热学复习题 答案
研究生考试热力学基础复习题及答案参考

第9章 热力学基础一、选择题1. 对于准静态过程和可逆过程, 有以下说法.其中正确的是 [ ] (A) 准静态过程一定是可逆过程 (B) 可逆过程一定是准静态过程 (C) 二者都是理想化的过程(D) 二者实质上是热力学中的同一个概念2. 对于物体的热力学过程, 下列说法中正确的是[ ] (A) 内能的改变只决定于初、末两个状态, 与所经历的过程无关 (B) 摩尔热容量的大小与所经历的过程无关(C) 在物体内, 若单位体积内所含热量越多, 则其温度越高(D) 以上说法都不对3. 有关热量, 下列说法中正确的是 [ ] (A) 热是一种物质(B) 热能是物质系统的状态参量(C) 热量是表征物质系统固有属性的物理量 (D) 热传递是改变物质系统内能的一种形式4. 关于功的下列各说法中, 错误的是 [ ] (A) 功是能量变化的一种量度(B) 功是描写系统与外界相互作用的物理量(C) 气体从一个状态到另一个状态, 经历的过程不同, 则对外作的功也不一样 (D) 系统具有的能量等于系统对外作的功5. 理想气体状态方程在不同的过程中有不同的微分表达式, 式表示[ ] (A) 等温过程 (B) 等压过程(C) 等体过程 (D) 绝热过程6. 理想气体状态方程在不同的过程中可以有不同的微分表达式, 式表示[ ] (A) 等温过程 (B) 等压过程 (C) 等体过程 (D) 绝热过程7. 理想气体状态方程在不同的过程中可以有不同的微分表达式, 式0d d =+V p p V 表示 [ ] (A) 等温过程 (B) 等压过程 (C) 等体过程 (D) 绝热过程8. 理想气体状态方程在不同的过程中可以有不同的微分表达式, 则式表示[ ] (A) 等温过程 (B) 等压过程 (C) 等体过程 (D) 任意过程9. 热力学第一定律表明:[ ] (A) 系统对外作的功不可能大于系统从外界吸收的热量 (B) 系统内能的增量等于系统从外界吸收的热量(C) 不可能存在这样的循环过程, 在此过程中, 外界对系统所作的功 不等于系统传给外界的热量 (D) 热机的效率不可能等于110. 对于微小变化的过程, 热力学第一定律为d Q = d E +d A .在以下过程中, 这三者同时为正的过程是[ ] (A) 等温膨胀 (B) 等容膨胀 (C) 等压膨胀 (D) 绝热膨胀11. 对理想气体的等压压缩过程,下列表述正确的是[ ] (A) d A >0, d E >0, d Q >0 (B) d A <0, d E <0, d Q <0 (C) d A <0, d E >0, d Q <0 (D) d A = 0, d E = 0, d Q = 012. 功的计算式适用于[ ] (A) 理想气体 (B) 等压过程 (C) 准静态过程 (D) 任何过程13. 一定量的理想气体从状态),(V p 出发, 到达另一状态)2,(Vp . 一次是等温压缩到2V , 外界作功A ;另一次为绝热压缩到2V, 外界作功W .比较这两个功值的大小是 [ ] (A) A >W (B) A = W (C) A <W (D) 条件不够,不能比较14. 1mol 理想气体从初态(T 1、p 1、V 1 )等温压缩到体积V 2, 外界对气体所作的功为 [ ] (A) 121lnV V RT (B) 211ln V VRT (C) )(121V V p - (D) 1122V p V p -15. 如果∆W 表示气体等温压缩至给定体积所作的功, ∆Q 表示在此过程中气体吸收的热量, ∆A 表示气体绝热膨胀回到它原有体积所作的功, 则整个过程中气体内能的变化为 [ ] (A) ∆W +∆Q -∆A (B) ∆Q -∆W -∆A (C) ∆A -∆W -∆Q (D) ∆Q +∆A -∆W16. 理想气体内能增量的表示式T C E V ∆=∆ν适用于[ ] (A) 等体过程 (B) 等压过程 (C) 绝热过程 (D) 任何过程17. 刚性双原子分子气体的定压比热与定体比热之比在高温时为[ ] (A) 1.0 (B) 1.2 (C) 1.3 (D) 1.418. 公式R C C V p +=在什么条件下成立?[ ] (A) 气体的质量为1 kg (B) 气体的压强不太高 (C) 气体的温度不太低 (D) 理想气体19. 同一种气体的定压摩尔热容大于定体摩尔热容, 其原因是 [ ] (A) 膨胀系数不同 (B) 温度不同(C) 气体膨胀需要作功 (D) 分子引力不同20. 摩尔数相同的两种理想气体, 一种是单原子分子气体, 另一种是双原子分子气体, 从同一状态开始经等体升压到原来压强的两倍.在此过程中, 两气体 [ ] (A) 从外界吸热和内能的增量均相同 (B) 从外界吸热和内能的增量均不相同 (C) 从外界吸热相同, 内能的增量不相同 (D) 从外界吸热不同, 内能的增量相同21. 两气缸装有同样的理想气体, 初态相同.经等体过程后, 其中一缸气体的压强变为原来的两倍, 另一缸气体的温度也变为原来的两倍.在此过程中, 两气体从外界吸热 [ ] (A) 相同 (B) 不相同, 前一种情况吸热多 (C) 不相同, 后一种情况吸热较多 (D) 吸热多少无法判断22. 摩尔数相同的理想气体H 2和He, 从同一初态开始经等压膨胀到体积增大一倍时 [ ] (A) H 2对外作的功大于He 对外作的功 (B) H 2对外作的功小于He 对外作的功 (C) H 2的吸热大于He 的吸热 (D) H 2的吸热小于He 的吸热23. 摩尔数相同的两种理想气体, 一种是单原子分子, 另一种是双原子分子, 从同一状态开始经等压膨胀到原体积的两倍.在此过程中, 两气体 [ ] (A) 对外作功和从外界吸热均相同 (B) 对外作功和从外界吸热均不相同 (C) 对外作功相同, 从外界吸热不同 (D) 对外作功不同, 从外界吸热相同24. 摩尔数相同但分子自由度不同的两种理想气体从同一初态开始作等温膨胀, 若膨胀后体积相同, 则两气体在此过程中 [ ] (A) 对外作功相同, 吸热不同 (B) 对外作功不同, 吸热相同 (C) 对外作功和吸热均相同 (D) 对外作功和吸热均不相同25. 两气缸装有同样的理想气体, 初始状态相同.等温膨胀后, 其中一气缸的体积膨胀为原来的两倍, 另一气缸内气体的压强减小到原来的一半.在其变化过程中, 两气体对外作功[ ] (A) 相同 (B) 不相同, 前一种情况作功较大 (C) 不相同, 后一种情况作功较大 (D) 作功大小无法判断26. 理想气体由初状态( p 1、V 1、T 1)绝热膨胀到末状态( p 2、V 2、T 2),对外作的功为 [ ] (A))(12T T C MV -μ(B))(12T T C Mp -μ(C) )(12T T C MV --μ(D) )(12T T C Mp --μ27. 在273K 和一个1atm 下的单原子分子理想气体占有体积22.4升.将此气体绝热压缩至体积为16.8升, 需要作多少功?[ ] (A) 330 J (B) 680 J (C) 719 J (D) 223 J28. 一定量的理想气体分别经历了等压、等体和绝热过程后其内能均由E 1变化到E 2 .在上述三过程中, 气体的[ ] (A) 温度变化相同, 吸热相同 (B) 温度变化相同, 吸热不同 (C) 温度变化不同, 吸热相同 (D) 温度变化不同, 吸热也不同29. 如果使系统从初态变到位于同一绝热线上的另一终态则 [ ] (A) 系统的总内能不变(B) 联结这两态有许多绝热路径 (C) 联结这两态只可能有一个绝热路径 (D) 由于没有热量的传递, 所以没有作功30. 一定量的理想气体, 从同一状态出发, 经绝热压缩和等温压缩达到相同体积时, 绝热压缩比等温压缩的终态压强[ ] (A) 较高 (B) 较低 (C) 相等 (D) 无法比较31. 一定质量的理想气体从某一状态经过压缩后, 体积减小为原来的一半, 这个过程可以是绝热、等温或等压过程.如果要使外界所作的机械功为最大, 这个过程应是 [ ] (A) 绝热过程 (B) 等温过程(C) 等压过程 (D) 绝热过程或等温过程均可32. 视为理想气体的0.04 kg 的氦气(原子量为4), 温度由290K 升为300K .若在升温过程中对外膨胀作功831 J, 则此过程是[ ] (A) 等体过程 (B) 等压过程(C) 绝热过程 (D) 等体过程和等压过程均可能33. 一定质量的理想气体经历了下列哪一个变化过程后, 它的内能是增大的? [ ] (A) 等温压缩 (B) 等体降压 (C) 等压压缩 (D) 等压膨胀34. 一定量的理想气体从初态),(T V 开始, 先绝热膨胀到体积为2V , 然后经等容过程使温度恢复到T , 最后经等温压缩到体积V .在这个循环中, 气体必然[ ] (A) 内能增加 (B) 内能减少 (C) 向外界放热 (D) 对外界作功35. 提高实际热机的效率, 下面几种设想中不可行的是 [ ] (A) 采用摩尔热容量较大的气体作工作物质 (B) 提高高温热源的温度 (C) 使循环尽量接近卡诺循环(D) 力求减少热损失、摩擦等不可逆因素36. 在下面节约与开拓能源的几个设想中, 理论上可行的是[ ] (A) 在现有循环热机中进行技术改进, 使热机的循环效率达100% (B) 利用海面与海面下的海水温差进行热机循环作功 (C) 从一个热源吸热, 不断作等温膨胀, 对外作功 (D) 从一个热源吸热, 不断作绝热膨胀, 对外作功37. 关于热运动规律,下列说法中唯一正确的是 [ ] (A) 任何热机的效率均可表示为吸Q A =η (B) 任何可逆热机的效率均可表示为高低T T -=1η (C) 一条等温线与一条绝热线可以相交两次(D) 两条绝热线与一条等温线可以构成一个循环38. 卡诺循环的特点是[ ] (A) 卡诺循环由两个等压过程和两个绝热过程组成 (B) 完成一次卡诺循环必须有高温和低温两个热源 (C) 卡诺循环的效率只与高温和低温热源的温度有关 (D) 完成一次卡诺循环系统对外界作的净功一定大于039. 在功与热的转变过程中, 下面说法中正确的是 [ ] (A) 可逆卡诺机的效率最高, 但恒小于1(B) 可逆卡诺机的效率最高, 可达到1(C) 功可以全部变为热量, 而热量不能全部变为功 (D) 绝热过程对外作功, 系统的内能必增加40. 两个恒温热源的温度分别为T 和t , 如果T >t , 则在这两个热源之间进行的卡诺循环热机的效率为 [ ] (A)t T T - (B) t t T - (C) T t T - (D) TtT +41. 对于热传递, 下列叙述中正确的是 [ ] (A) 热量不能从低温物体向高温物体传递 (B) 热量从高温物体向低温物体传递是不可逆的(C) 热传递的不可逆性不同于热功转换的不可逆性(D) 理想气体等温膨胀时本身内能不变, 所以该过程也不会传热42. 根据热力学第二定律可知, 下列说法中唯一正确的是 [ ] (A) 功可以全部转换为热, 但热不能全部转换为功(B) 热量可以从高温物体传到低温物体, 但不能从低温物体传到高温物体 (C) 不可逆过程就是不能沿相反方向进行的过程 (D) 一切自发过程都是不可逆过程43. 根据热力学第二定律判断, 下列哪种说法是正确的[ ] (A) 热量能从高温物体传到低温物体, 但不能从低温物体传到高温物体 (B) 功可以全部变为热, 但热不能全部变为功 (C) 气体能够自由膨胀, 但不能自由压缩(D) 有规则运动的能量能够变为无规则运动的能量, 但无规则运动的能量不能变为有规则运动的能量44. 热力学第二定律表明:[ ] (A) 不可能从单一热源吸收热量使之全部变为有用功 (B) 在一个可逆过程中, 工作物质净吸热等于对外作的功 (C) 摩擦生热的过程是不可逆的(D) 热量不可能从温度低的物体传到温度高的物体45. “理想气体和单一热源接触作等温膨胀时, 吸收的热量全部用来对外作功.”对此说法, 有以下几种评论, 哪一种是正确的?[ ] (A) 不违反热力学第一定律, 但违反热力学第二定律 (B) 不违反热力学第二定律, 但违反热力学第一定律 (C) 不违反热力学第一定律, 也不违反热力学第二定律 (D) 违反热力学第一定律, 也违反热力学第二定律46. 有人设计了一台卡诺热机(可逆的).每循环一次可从400K 的高温热源吸收1800J 的热量, 向300K 的低温热源放热800J, 同时对外作功1000J .这样的设计是 [ ] (A) 可以的, 符合热力学第一定律 (B) 可以的, 符合热力学第二定律(C) 不行的, 卡诺循环所作的功不能大于向低温热源放出的热量 (D) 不行的, 这个热机的效率超过了理论值47. 1mol 的单原子分子理想气体从状态A 变为状态B, 如果变化过程不知道, 但A 、B 两态的压强、温度、体积都知道, 则可求出[ ] (A) 气体所作的功 (B) 气体内能的变化(C) 气体传给外界的热量 (D) 气体的质量48. 如果卡诺热机的循环曲线所包围的面积从图中的abcda 增大为da c b a '',那么循环abcda 与da c b a ''所作的功和热机效率变化情况是:[ ] (A) 净功增大,效率提高(B) 净功增大,效率降低 (C) 净功和效率都不变 (D) 净功增大,效率不变49. 用两种方法: 使高温热源的温度T 1升高△T ;使低温热源的温度T 2降低同样的△T 值;分别可使卡诺循环的效率升高1η∆和 2η∆,两者相比:[ ] (A) 1η∆>2η∆ (B) 2η∆>1η∆(C) 1η∆=2η∆ (D) 无法确定哪个大50. 下面所列四图分别表示某人设想的理想气体的四个循环过程,请选出其中一个在理论上可能实现的循环过程的图的符号. [ ]51. 在T9-1-51图中,I c II 为理想气体绝热过程,I a II 和I b II 是任意过程.此两任意过程中气体作功与吸收热量的情况是:[ ] (A) I a II 过程放热,作负功;I b II 过程放热,作负功(B) I a II 过程吸热,作负功;I b II 过程放热,作负功 (C) I a II 过程吸热,作正功;I b II 过程吸热,作负功(D) I a II 过程放热,作正功;I b II 过程吸热,作正功52. 给定理想气体,从标准状态(p 0,V 0,T 0)开始作绝热膨胀,体积增大到3倍.膨胀后温度T 、压强p 与标准状态时T 0、p 0之关系为(γ 为比热比) [ ] (A) 01)31(T T -=γ, 0)31(p p γ= (B) 0)31(T T γ=,01)31(p p -=γ (C) 0)31(T T γ-=,01)31(p p -=γ (D) 01)31(T T -=γ,0)31(p p γ-=53. 甲说:“由热力学第一定律可证明任何热机的效率不可能等于1.”乙说:“热力学第二定律可表述为效率等于 100%的热机不可能制造成功.”丙说:“由热力学第一定律可证明任何卡诺循环的效率都等于)1(12T T -.”丁说:“由热力学第一定律可证明理想气体卡诺热机(可逆的)循环的效率等于)1(12T T -.”对以上说法,有如下几种评论,哪种是正确的? [ ] (A) 甲、乙、丙、丁全对 (B) 甲、乙、丙、丁全错(C) 甲、乙、丁对,丙错 (D) 乙、丁对,甲、丙错54. 某理想气体分别进行了如T9-1-54图所示的两个卡诺循环:(D)(C)(A)(B)T9-1-51图I(abcda )和II(a'b'c'd'a'),且两个循环曲线所围面积相等.设循环I 的效率为η,每次循环在高温热源处吸的热量为Q ,循环II 的效率为η',每次循环在高温热源处吸的热量为Q ',则[ ] (A) Q Q '<'<,ηη (B) Q Q '>'<,ηη(C) Q Q '<'>,ηη (D) Q Q '>'>,ηη55. 两个完全相同的气缸内盛有同种气体,设其初始状态相同.今使它们分别作绝热压缩至相同的体积,其中气缸1内的压缩过程是非准静态过程,而气缸2内的压缩过程则是准静态过程.比较这两种情况的温度变化:[ ] (A) 气缸1和气缸2内气体的温度变化相同 (B) 气缸1内的气体较气缸2内的气体的温度变化大(C) 气缸1内的气体较气缸2内的气体的温度变化小 (D) 气缸1和气缸2内的气体的温度无变化二、填空题1. 不等量的氢气和氦气从相同的初态作等压膨胀, 体积变为原来的两倍.在这过程中, 氢气和氦气对外作的功之比为 .2. 1mol 的单原子分子理想气体, 在1atm 的恒定压力下从273K 加热到373K, 气体的内能改变了 .3. 各为1摩尔的氢气和氦气, 从同一状态(p ,V )开始作等温膨胀.若氢气膨胀后体积变为2V , 氦气膨胀后压强变为2p, 则氢气和氦气从外界吸收的热量之比为 . 4. 两个相同的容器, 一个装氢气, 一个装氦气(均视为刚性分子理想气体),开始时它们的压强和温度都相等.现将6J 热量传给氦气, 使之温度升高.若使氢气也升高同样的温度, 则应向氢气传递的热量为 .5. 1摩尔的单原子分子理想气体, 在1个大气压的恒定压力作用下从273K 加热到373K, 此过程中气体作的功为 .6. 273K 和一个1atm 下的单原子分子理想气体占有体积22.4升.此气体等温压缩至体积为16.8升的过程中需作的功为 .7. 一定量气体作卡诺循环, 在一个循环中, 从热源吸热1000 J, 对外作功300 J . 若冷凝器的温度为7︒C, 则热源的温度为 .8. 理想气体卡诺循环过程的两条绝热线下的面积大小(图中阴影部分)分别为1S 和2S ,则二者的大小关系是 .9. 一卡诺机(可逆的),低温热源的温度为C 27,热机效率为40%,其高温热源温度为 K .今欲将该热机效率提高到50%,若低温热源保持不变,则高温热源的温度应增加 K .T9-2-8图10. 一个作可逆卡诺循环的热机,其效率为η,它的逆过程的致冷系数212T T T w -=,则η与w 的关系为 .11. 1mol 理想气体(设V P C C =γ为已知)的循环过程如T -V 图所示,其中CA 为绝热过程,A 点状态参量(11,V T ),和B 点的状态参量(21,V T )为已知.则C 点的状态参量为:=C V , =C T , =C p .12. 一定量的理想气体,从A 状态),2(11V p 经历如T9-2-12图所示的直线过程变到B 状态),(11V p ,则AB 过程中系统作功___________, 内能改变△E =_________________.13. 质量为M 、温度为0T 的氦气装在绝热的容积为V 的封闭容器中,容器一速率v 作匀速直线运动.当容器突然停止后,定向运动的动能全部转化为分子热运动的动能,平衡后氦气的温度增大量为 .14. 有ν摩尔理想气体,作如T9-2-14图所示的循环过程abca ,其中acb 为半圆弧,b -a 为等压过程,a c p p 2=,在此循环过程中气体净吸热量为Q νC p )(a b T T -(填入:> , <或=).15. 一定量的理想气体经历acb 过程时吸热550 J .则经历acbea 过程时,吸热为 .16. 一定量理想气体,从同一状态开始使其体积由V 1膨胀到2V 1,分别经历以下三种过程: 等压过程; 等温过程;● 绝热过程.其中:__________过程气体对外作功最多;____________过程气体内能增加最多;__________过程气体吸收的热量最多.17. 一定量的理想气体,从状态a 出发,分别经历等压、等温、绝热三种过程由体积V 1膨胀到体积V 2,试在T9-2-17图中示意地画出这三种过程的p -V 图曲线.在上述三种过程中:(1) 气体的内能增加的是__________过程;T 12TT9-2-11图2p 11T9-2-12图p pT9-2-14图533m 10-T9-2-15图12(2) 气体的内能减少的是__________过程.18. 如T9-2-18图所示,已知图中两部分的面积分别为S 1和S 2. 如果气体的膨胀过程为a →1→b ,则气体对外做功W =________; 如果气体进行a →1→b →2→a 的循环过程,则它对外做功W =_______________.19. 如T9-2-19图所示,一定量的理想气体经历c b a →→过程,在此过程中气体从外界吸收热量Q ,系统内能变化E ∆.则Q 和E ∆ >0或<0或= 0的情况是:Q _________, ∆E __________.20. 将热量Q 传给一定量的理想气体,(1) 若气体的体积不变,则其热量转化为 ; (2) 若气体的温度不变,则其热量转化为 ;(3) 若气体的压强不变,则其热量转化为 . 21. 一能量为1012 eV 的宇宙射线粒子,射入一氖管中,氖管内充有 0.1 mol 的氖气,若宇宙射线粒子的能量全部被氖气分子所吸收,则氖气温度升高了_________________K .(1 eV =1.60×10-19J ,普适气体常量R =8.31 J/(mol ⋅K))22. 有一卡诺热机,用29kg 空气作为工作物质,工作在27℃的高温热源与-73℃的低温热源之间,此热机的效率η=______________.若在等温膨胀的过程中气缸体积增大到2.718倍,则此热机每一循环所作的功为_________________.(空气的摩尔质量为29×10-3 kg ⋅mol -1,普适气体常量R =8.3111K mol J --⋅⋅)23. 一气体分子的质量可以根据该气体的定体比热来计算.氩气的定体比热c V =0.314 k J ·kg -1·K -1,则氩原子的质量m =_____ _____.T9-2-18图T9-2-19图三、计算题1. 1 mol 刚性双原子分子的理想气体,开始时处于Pa 1001.151⨯=p 、331m 10-=V 的状态,然后经图示直线过程I 变到Pa 1004.452⨯=p 、332m 102-⨯=V 的状态.后又经过方程为C pV=21(常量)的过程II 变到压强Pa 1001.1513⨯==p p 的状态.求:(1) 在过程I 中气体吸的热量; (2) 整个过程气体吸的热量.2. 1 mol 的理想气体,完成了由两个等容过程和两个等压 过程构成的循环过程(如T9-3-2图),已知状态1的温度为1T , 状态3的温度为3T ,且状态2和4在同一等温线上.试求 气体在这一循环过程中作的功.3. 一卡诺热机(可逆的),当高温热源的温度为C 127 、低温热源温度为C 27 时,其每次循环对外作净功8000J .今维持低温热源的温度不变,提高高温热源的温度,使其每次循环对外作净功10000J .若两个卡诺循环都工作在相同的两条绝热线之间,试求:(1) 第二个循环热机的效率; (2) 第二个循环的高温热源的温度.4. 某种单原子分子的理想气体作卡诺循环,已知循环效率%20=η,试问气体在绝热膨胀时,气体体积增大到原来的几倍?5. 1mol 双原子分子理想气体作如T9-3-5图所示的可逆循环过程,其中1-2为直线,2-3为绝热线,3-1为等温线.已知13128,2V V T T ==,试求:(1) 各过程的功,内能增量和传递的热量;(用1T 和已知常数表示) (2) 此循环的效率η.(注:循环效率1A =η,A 为每一循环过程气体对外所作的功,1Q 为每一循环过程气体吸收的热量)1p VT9-3-1图T9-3-2图123T9-3-5图6. 如T9-3-6图所示,一金属圆筒中盛有1 mol 刚性双原子分子的理想气体,用可动活塞封住,圆筒浸在冰水混合物中.迅速推动活塞,使气体从标准状态(活塞位置I)压缩到体积为原来一半的状态(活塞位置II),然后维持活塞不动,待气体温度下降至0℃,再让活塞缓慢上升到位置I ,完成一次循环. (1) 试在p -V 图上画出相应的理想循环曲线;(2) 若作100 次循环放出的总热量全部用来熔解冰,则有多少冰被熔化? (已知冰的熔解热 3.35×105 J·kg -1,普适气体常量 R= 8.31J·mol -1·K -1)7. 比热容比 1.40的理想气体,进行如T9-3-7图所示的abca 循环,状态a 的温度为300 K . (1) 求状态b 、c 的温度;(2) 计算各过程中气体所吸收的热量、气体所作的功和气体内能的增量;(3) 求循环效率.8. 一台冰箱工作时,其冷冻室中的温度为-10℃,室温为15℃.若按理想卡诺致冷循环计算,则此致冷机每消耗的功,可以从冷冻室中吸出多少热量?9. 一可逆卡诺热机低温热源的温度为7.0℃,效率为40%;若要将其效率提高50%,则高温热源温度需提高几度?10. 绝热容器中有一定量的气体,初始压强和体积分别为和.用一根通有电流的电阻丝对它加热(设电阻不随温度改变).在加热的电流和时间都相同的条件下,第一次保持体积不变,压强变为;第二次保持压强不变,而体积变为.不计电阻丝的热容量,求该气体的比热容比.11. 空气中的声速的表达式为,其中ρ是气体密度,是体弹性模量,满足关系式.就下列两种情况计算其声速: (1) 假定声波传播时空气的压缩和膨胀过程是一个等温过程(即等温声速模型,亦称为牛顿模型);(2) 假定声波传播时空气的压缩和膨胀过程是一个绝热过程(即绝热声速模型); 比较这两个结果你得出什么结论?(设空气中只有氮气)12. 某热机循环从高温热源获得热量Q H ,并把热量Q L 排给低温热源.设高、低温热源的温度分别为T H =2000K 和T L =300K ,试确定在下列条件下热机是可逆、不可逆或不可能存在的.(1) Q H =1000J ,A =900J ;(2) Q H =2000J ,Q L =300J ;(3) A =1500J ,Q L =500J .13. 研究动力循环和制冷循环是热力学的重要应用之一.内燃机以气缸内燃烧的气体为工质.对于四冲程火花塞点燃式汽油发动机来说,它的理想循环是定体加热循环,称为奥托循环(Otto cycle ).而对于四冲程压=λ=γJ 1020p 0V 0V 1p 0p 1V u κρ=κVp Vκ∆∆=-IT9-3-6图 I IT9-3-7图2)(m 3V 6Pa)10(2⨯p a 2b c O 4134燃式柴油机来说,它的理想循环是定压加热循环,称为狄塞耳循环(Diesel cycle ).如T9-3-13图所示,往复式内燃机的奥托循环经历了以下四个冲程:(1)吸气冲程(0→1):当活塞由上止点T 向下止点B 运时,进气阀打开,在大气压力下吸入汽油蒸气和空气的混合气体.(2)压缩冲程:进气阀关闭,活塞向左运行,混合气体被绝热压缩(1→2);活塞移动T 点时,混合气体被电火花点燃迅速燃烧,可以认为是定体加热过程(2→3),吸收热量.(3)动力冲程:燃烧气体绝热膨胀,推动活塞对外作功(3→4);然后,气体在定体条件下降压(4→1),放出热量.(4)排气冲程:活塞向左运行,残余气体从排气阀排出.假定内燃机中的工质是理想气体并保持定量,试求上述奥托循环1→2→3→4→1的效率.14. 绝热壁包围的气缸被一绝热的活塞分成A ,B 两室,活塞在气缸内可无摩擦自由滑动,每室内部有1摩尔的理想气体,定容热容量.开始时,气体都处在平衡态.现在对A 室加热,直到A 中压强变为2为止.(1) 加热结束后,B 室中气体的温度和体积? (2) 求加热之后,A 、B 室中气体的体积和温度; (3) 在这过程中A 室中的气体作了多少功? (4) 加热器传给A 室的热量多少?15. 如T9-3-15图所示,器壁与活塞均绝热的容器中间被一隔板等分为两部分,其中右边贮有1摩尔处于标准状态的氦气(可视为理想气体),左边为真空.现先把隔板拉开,待气体平衡后,再缓慢向右推动活塞,把气体压缩到原来的体积.求氦气的温度改变量.16. 如T9-3-15图所示,一固定绝热隔板将某种理想气体分成A 、B 两部分,B 的外侧是可动活塞.开始时A 、B 两部分的温度T 、体积V 、压强p 均相同,并与大气压强相平衡.现对A 、B 两部分气体缓慢地加热,当对A 和B 给予相等的热量Q 以后,A 室中气体的温度升高度数与B 室中气体的温度升高度数之比为7:5.(1) 求该气体的定体摩尔热容C V 和定压摩尔热容C p ; (2) B 室中气体吸收的热量有百分之几用于对外作功?17. 有两个全同的物体,其内能为为常数),初始时两物体的温度分别为.现以两物体分别为高、低温热源驱动一卡诺热机运行,最后两物体达到一共同温度.求(1);(2)求卡诺热机所作的功.18. 温度为25℃、压强为1atm 的1mol 刚性双原子分子理想气体,经等温过程体积膨胀至原来的3倍.(普适气体常量R =8.31 ,ln 3=1.0986)(1) 计算这个过程中气体对外所作的功;(2) 假若气体经绝热过程体积膨胀为原来的3倍,那么气体对外作的功又是多少?19. 图T9-3-19为一循环过程的T -V 曲线.该循环的工质为的理想气体,其中和均已知且为常量.已知a 点的温度为,体积为V 1,b 点的体积为V 2,ca 为绝热过程.求:1Q 2Q ηR c V 25=),,(000T V p 0p (u CT C =21T T 、f T f T 1--⋅⋅K mol J 1mol μV C γ1TT9-3-15图He空真T9-3-17图AB。
(完整word版)热力学第一定律复习题(13,10)

第二章 热力学第一定律:系统与环境间由于温差而交换的能量。
是物质分子无序运动的结果。
是过程量。
:除热以外的、在系统与环境间交换的所有其它形式的能量。
是物质分子有序运动的、恒压条件下,△H =Q p 。
系统状态变化时,计算系统与环境间交换的能量) 恒压反应热与恒容反应热的关系:Q p =Q V +∑νB (g)RT,21;()()p r p m r m r m m C H T H T dT ∆∆=∆+1. 当理想气体冲入一真空绝热容器后,其温度将(a) 升高(b) 降低(c) 不变(d) 难以确定(答案) c (△U=Q+W, ∵p外=0 , ∴W=0 ,又∵绝热,∴Q=0,所以△U=0)因为是真空故不做功,又因为是绝热故无热交换,故△U=0。
温度不变。
2. 当热力学第一定律写成d U = δQ–p d V时,它适用于(a). 理想气体的可逆过程(b). 封闭体系的任一过程(c). 封闭体系只做体积功过程(d). 封闭体系的定压过程(答案) c (W=W体+W非,当W非=0时,W体= -pdV)3.对热力学可逆过程,下列说法中正确的是(a) 过程进行的速度无限慢 (b) 没有功的损失(c) 系统和环境可同时复原 (d) 不需环境做功(答案) c可逆过程:体系经过某一过程从状态(1)变到状态(2)之后,如果能够使体系和环境都恢复到原来的状态而未留下任何永久性的变化,则该过程称为热力学可逆过程。
否则为不可逆过程特征:①状态变化时推动力与阻力相差无限小,体系与环境始终无限接近于平衡态;②过程中的任何一个中间态都可以从正、逆两个方向到达;③体系变化一个循环后,体系和环境均恢复原态,变化过程中无任何耗散效应;④等温可逆过程中,体系对环境作最大功,环境对体系作最小功。
⑤在可逆过程中,由于状态变化时推动力与阻力相差无限小,所以完成过程所需的时间为无限长。
4.对于封闭体系来说,当过程的始态与终态确定后,下列各项中哪一个无确定值(a) Q (b) Q + W(c) W (当Q = 0时) (d) Q (当W = 0时)(答案) a (△U=Q+W)5.对于孤立体系中发生的实际过程,下列关系中不正确的是(a) W = 0 (b) Q = 0(c) ΔU= 0 (d) ΔH = 0(答案) d (孤立体系?△U=Q+W)6.对于内能是体系状态的单值函数概念,错误理解是(a) 体系处于一定的状态,具有一定的内能(b) 对应于某一状态,内能只能有一数值不能有两个以上的数值(c) 状态发生变化,内能也一定跟着变化 (d) 对应于一个内能值,可以有多个状态(答案) c (理想气体等温过程,△U ,即内能不变; 绝热可逆过程△S=0)7.凡是在孤立体系中进行的变化,其ΔU 和ΔH 的值一定是 (a) ΔU > 0 , ΔH > 0 (b) ΔU = 0 , ΔH = 0(c) ΔU < 0 , ΔH < 0 (d) ΔU = 0 , ΔH 大于、小于或等于零不确定(答案) d8. 封闭体系从A 态变为B 态,可以沿两条等温途径:甲)可逆途径;乙)不可逆途径,则下列关系式⑴ ΔU 可逆> ΔU 不可逆 ⑵ ⎢W 可逆⎢ > ⎢W 不可逆 ⎢⑶ ⎢Q 可逆⎢< ⎢Q 不可逆⎢ ⑷ ( Q 可逆 - W 可逆) > ( Q 不可逆 - W 不可逆) 正确的是(a) (1),(2) (b) (2),(3) (c) (3),(4) (d) (1),(4)(答案) b (④等温可逆过程中,体系对环境作最大功,环境对体系作最小功。
热力学第二定律复习题及解答

第三章 热力学第二定律一、思考题1. 自发过程一定是不可逆的,所以不可逆过程一定是自发的。
这说法对吗?答: 前半句是对的,后半句却错了。
因为不可逆过程不一定是自发的,如不可逆压缩过程。
2. 空调、冰箱不是可以把热从低温热源吸出、放给高温热源吗,这是否与第二定律矛盾呢?答: 不矛盾。
Claususe 说的是“不可能把热从低温物体传到高温物体,而不引起其他变化”。
而冷冻机系列,环境作了电功,却得到了热。
热变为功是个不可逆过程,所以环境发生了变化。
3. 能否说系统达平衡时熵值最大,Gibbs 自由能最小?答:不能一概而论,这样说要有前提,即:绝热系统或隔离系统达平衡时,熵值最大。
等温、等压、不作非膨胀功,系统达平衡时,Gibbs 自由能最小。
4. 某系统从始态出发,经一个绝热不可逆过程到达终态。
为了计算熵值,能否设计一个绝热可逆过程来计算?答:不可能。
若从同一始态出发,绝热可逆和绝热不可逆两个过程的终态绝不会相同。
反之,若有相同的终态,两个过程绝不会有相同的始态,所以只有设计除绝热以外的其他可逆过程,才能有相同的始、终态。
5. 对处于绝热瓶中的气体进行不可逆压缩,过程的熵变一定大于零,这种说法对吗? 答: 说法正确。
根据Claususe 不等式TQS d d ≥,绝热钢瓶发生不可逆压缩过程,则0d >S 。
6. 相变过程的熵变可以用公式H ST∆∆=来计算,这种说法对吗?答:说法不正确,只有在等温等压的可逆相变且非体积功等于零的条件,相变过程的熵变可以用公式THS ∆=∆来计算。
7. 是否,m p C 恒大于 ,m V C ?答:对气体和绝大部分物质是如此。
但有例外,4摄氏度时的水,它的,m p C 等于,m V C 。
8. 将压力为101.3 kPa ,温度为268.2 K 的过冷液体苯,凝固成同温、同压的固体苯。
已知苯的凝固点温度为278.7 K ,如何设计可逆过程?答:可以将苯等压可逆变温到苯的凝固点278.7 K :9. 下列过程中,Q ,W ,ΔU ,ΔH ,ΔS ,ΔG 和ΔA 的数值哪些为零?哪些的绝对值相等?(1)理想气体真空膨胀; (2)实际气体绝热可逆膨胀; (3)水在冰点结成冰;(4)理想气体等温可逆膨胀;(5)H 2(g )和O 2(g )在绝热钢瓶中生成水;(6)等温等压且不做非膨胀功的条件下,下列化学反应达到平衡:H 2(g )+ Cl 2(g )(g )答: (1)0Q WU H ==∆=∆=(2)0, R Q S U W =∆=∆= (3)e 0, , P G H Q A W ∆=∆=∆= (4)e 0, =, U H Q W G A ∆=∆=-∆=∆ (5)e = 0V U Q W ∆==(6)0=W,H U Q ∆=∆=,0=∆=∆G A10. 298 K 时,一个箱子的一边是1 mol N 2 (100 kPa),另一边是2 mol N 2 (200 kPa ),中间用隔板分开。
(完整版)大学物理热学习题附答案

一、选择题1.一定量的理想气体贮于某一容器中,温度为T ,气体分子的质量为m 。
根据理想气体的分子模型和统计假设,分子速度在x 方向的分量平方的平均值 (A) m kT x 32=v (B) m kT x 3312=v (C) m kT x /32=v (D) m kT x /2=v2.一定量的理想气体贮于某一容器中,温度为T ,气体分子的质量为m 。
根据理想气体分子模型和统计假设,分子速度在x 方向的分量的平均值 (A) m kT π8=x v (B) m kT π831=x v (C) m kT π38=x v (D) =x v 03.温度、压强相同的氦气和氧气,它们分子的平均动能ε和平均平动动能w 有如下关系:(A) ε和w都相等 (B) ε相等,w 不相等 (C) w 相等,ε不相等 (D) ε和w 都不相等4.在标准状态下,若氧气(视为刚性双原子分子的理想气体)和氦气的体积比V 1 / V 2=1 / 2 ,则其内能之比E 1 / E 2为:(A) 3 / 10 (B) 1 / 2 (C) 5 / 6 (D) 5 / 35.水蒸气分解成同温度的氢气和氧气,内能增加了百分之几(不计振动自由度和化学能)?(A) 66.7% (B) 50% (C) 25% (D) 06.两瓶不同种类的理想气体,它们的温度和压强都相同,但体积不同,则单位体积内的气体分子数n ,单位体积内的气体分子的总平动动能(E K /V ),单位体积内的气体质量ρ,分别有如下关系:(A) n 不同,(E K /V )不同,ρ不同 (B) n 不同,(E K /V )不同,ρ相同(C) n 相同,(E K /V )相同,ρ不同 (D) n 相同,(E K /V )相同,ρ相同7.一瓶氦气和一瓶氮气密度相同,分子平均平动动能相同,而且它们都处于平衡状态,则它们(A) 温度相同、压强相同 (B) 温度、压强都不相同(C) 温度相同,但氦气的压强大于氮气的压强(D) 温度相同,但氦气的压强小于氮气的压强8.关于温度的意义,有下列几种说法:(1) 气体的温度是分子平均平动动能的量度;(2) 气体的温度是大量气体分子热运动的集体表现,具有统计意义;(3) 温度的高低反映物质内部分子运动剧烈程度的不同;(4) 从微观上看,气体的温度表示每个气体分子的冷热程度。
大学物理复习题(热学)

E
0
V
(10)、设有下列过程 10)、设有下列过程 )、 (1)用活塞缓慢地压缩绝热容器中的理想气体。(设无摩擦) 用活塞缓慢地压缩绝热容器中的理想气体。(设无摩擦) 。(设无摩擦 用缓慢地旋转的叶片使绝热容器中的水温上升。 (2)用缓慢地旋转的叶片使绝热容器中的水温上升。 冰溶解为水。 (3)冰溶解为水。 一个不受空气阻力及其摩擦力作用的单摆的摆动。 (4)一个不受空气阻力及其摩擦力作用的单摆的摆动。 其中是可逆过程的是: 其中是可逆过程的是: )(1)、(2)、(3)、(4 (A)(1)、(2)、(3)、(4) )(1)、(2)、(3 (B)(1)、(2)、(3) )(1)、(3)、(4 (C)(1)、(3)、(4) )(1)、(4 (D)(1)、(4) (D)
12、如图,一定量的理想气体,由平衡态A 12、如图,一定量的理想气体,由平衡态A变到平衡 的理想气体 ),则无论经过什么过程 则无论经过什么过程, 状态B 状态B(PA=PB),则无论经过什么过程,系统必然 对外做正功;( ;(B (A)对外做正功;(B)内能增加 从外界吸热;( ;(D 向外界放热。 (C)从外界吸热;(D)向外界放热。 [B]
[ C ]
(C)
N N H2 < O2 N N
f(v)
O2 H2
v
7、理想气体绝热地向真空自由膨胀,体 积增大为原来的两倍,则始、末两态 理想气体绝热地向真空自由膨胀, 积增大为原来的两倍,则始、 的温度T 和始、末两态气体分子的平均自由程λ 的温度T1与T2和始、末两态气体分子的平均自由程λ1 、λ2的关系为
30m/s的速度区间内 的速度区间内, 6、温度为T时,在方均根速度为 v2+30m/s的速度区间内, 温度为T 则有: H2和O2两种气体分子数占总分子数的百分比相比较 ,则有:
大学物理热学练习题及答案

大学物理热学练习题及答案第一题:一个物体的质量是1 kg,温度从20°C升高到30°C,如果物体的比热容是4200 J/(kg·°C),求物体吸收的热量。
解答:根据热量公式Q = mcΔθ,其中 Q 表示吸收的热量,m 表示物体的质量,c 表示比热容,Δθ 表示温度变化。
代入数据得:Q = 1 kg × 4200 J/(kg·°C) × (30°C - 20°C)= 1 kg × 4200 J/(kg·°C) × 10°C= 42,000 J所以物体吸收的热量为42,000 J。
第二题:一块金属材料的质量是0.5 kg,它的比热容是400 J/(kg·°C),经过加热后,材料的温度升高了60°C。
求该金属材料所吸收的热量。
解答:根据热量公式Q = mcΔθ,其中 Q 表示吸收的热量,m 表示物体的质量,c 表示比热容,Δθ 表示温度变化。
代入数据得:Q = 0.5 kg × 400 J/(kg·°C) × 60°C= 12,000 J所以金属材料吸收的热量为12,000 J。
第三题:一个热容为300 J/(kg·°C)的物体,吸收了500 J的热量后,温度升高了多少摄氏度?解答:根据热量公式Q = mcΔθ,其中 Q 表示吸收的热量,m 表示物体的质量,c 表示比热容,Δθ 表示温度变化。
将已知数据代入公式:500 J = m × 300 J/(kg·°C) × Δθ解方程得:Δθ = 500 J / (m × 300 J/(kg·°C))= 500 J / (m/(kg·°C)) × (kg·°C/300 J)= (500/300) °C≈ 1.67°C所以温度升高了约1.67°C。
《热学》期末复习用 各章习题+参考答案

(
29 × 10 3
)
485������
(4) 空气分子的碰撞频率为
√2������ ������
√2
6 02 × 10 × 22 4 × 10
3 3
×
(3
7 × 10−10)
× 485
(5) 空气分子的平均自由程为
7 9 × 109
������
485 7 9 × 109
6 1 × 10 8������
(������ + ������ )������������ ������ ������������ + ������ ������������
(4)
联立方程(1)(2)(3)(4)解得
������ + ������
������
2
������ ������ ������ (������ ������ + ������ ������ ) (������ + ������ )
������ (������ + ∆������) ������
������
������
(������ + ∆������) ������
������
ln
������������ ������
ln ������
������ + ∆������
ln
Hale Waihona Puke 133 101000ln
2
2
+
20 400
269
因此经过 69 × 60 40 后才能使容器内的压强由 0.101MPa 降为 133Pa.
1-7 (秦允豪 1.3.6) 一抽气机转速������ 400������ ∙ ������������������ ,抽气机每分钟能抽出气体20������.设 容器的容积������ 2 0������,问经过多长时间后才能使容器内的压强由 0.101MPa 降为 133Pa.设抽 气过程中温度始终不变.
大学物理热学习题附答案

大学物理热学习题附答案一、选择题1.一定量的理想气体贮于某一容器中,温度为T,气体分子的质量为m。
根据理想气体的分子模型和统计假设,分子速度在x 方向的分量平方的平均值(A)m kT x32=v(B)m kT x3312=v(C)m kT x/32=v(D)m kT x/2=v2.一定量的理想气体贮于某一容器中,温度为T,气体分子的质量为m。
根据理想气体分子模型和统计假设,分子速度在x方向的分量的平均值(A)m kTπ8=x v(B)m kTπ831=x v(C)m kTπ38=x v(D) =x v0[]3.4014:温度、压强相同的氦气和氧气,它们分子的平均动能ε和平均平动动能w有如下关系:(A)ε和w都相等(B)ε相等,而w不相等(C)w相等,而ε不相等(D)ε和w都不相等4.4022:在标准状态下,若氧气(视为刚性双原子分子的理想气体)和氦气的体积比V1/V2=1/2,则其内能之比E1/E2为:(A)3/10(B)1/2(C)5/6(D)5/35.4023:水蒸气分解成同温度的氢气和氧气,内能增加了百分之几(不计振动自由度和化学能)?(A)66.7%(B)50%(C)25%(D)06.4058:两瓶不同种类的理想气体,它们的温度和压强都相同,但体积不同,则单位体积内的气体分子数n,单位体积内的气体分子的总平动动能(E K/V),单位体积内的气体质量ρ,分别有如下关系:(A)n不同,(E K/V)不同,ρ不同(B)n不同,(E K/V)不同,ρ相同(C)n相同,(E K/V)相同,ρ不同(D)n相同,(E K/V)相同,ρ相同7.4013:一瓶氦气和一瓶氮气密度相同,分子平均平动动能相同,而且它们都处于平衡状态,则它们(A)温度相同、压强相同(B)温度、压强都不相同(C)温度相同,但氦气的压强大于氮气的压强(D)温度相同,但氦气的压强小于氮气的压强8.4012:关于温度的意义,有下列几种说法:(1)气体的温度是分子平均平动动能的量度;(2)气体的温度是大量气体分子热运动的集体表现,具有统计意义;(3)温度的高低反映物质内部分子运动剧烈程度的不同;(4)从微观上看,气体的温度表示每个气体分子的冷热程度。
热学练习题及答案

热学练习题一、选择题1.一定量的理想气体,在温度不变的条件下,当容积增加大时,分子的平均碰撞次数Z和平均自由程λ的变化情况是()A .Z减小,λ不变; B. Z减小,λ增大;C .Z增大,λ减小;D .Z不变λ增大2.若理想气体的体积为V,压强为P,温度为T,一个分子的质量为m ,则该理想气体分子数为:()A. PV/mB. PV/(KT)C. PV/(RT)D. PV/(mT)3.对于理想气体系统来说,在下列过程中,哪个过程系统所吸收的热量,内能的增量和对外作的功三者均为负值?()A.等容降压过程。
B.等温膨胀过程。
C. 绝热膨胀过程。
D.等压压缩过程。
4.气缸中有一定量的氦气(视为理想气体),经过绝热压缩,体积变为原来的一半,问气体分子的平均速率变为原来的几倍?()A. 522 B. 512 C. 322 D. 3125.两种不同的理想气体,若它们的最可几速率相等,则它们的()A 平均速率相等,方均根速率相等。
B平均速率相等,方均根速率不相等。
C平均速率不相等,方均根速率相等。
D平均速率不相等,方均根速率不相等。
6.一定量的理想气体,在容积不变的条件下,当温度降低时,分子的平均碰撞次数Z 和平均自由程λ的变化情况是( ) A Z 减小,但λ不变。
B Z 不变,但λ减小。
C Z 和λ都减小。
D Z 和λ都不变。
7.1mol 刚性双原子分子理想气体,当温度为T 时,其内能为( )A 23RTB 23KTC 25RTD 25KT (式中R 为摩尔气体常量,K 为玻耳兹曼常量)8.一物质系统从外界吸收一定的热量,则( )A 系统的内能一定增加。
B 系统的内能一定减少。
C 系统的内能一定保持不变。
D 系统内能可能增加,也可能减少或保持不变。
9.某理想气体分别进行了如图所示的两个卡诺循环:Ⅰ (abcda)和Ⅱ(a ′b ′c ′d ′a ′),且两条循环曲线所围面积相等。
设循环Ⅰ的效率为η,每次循环在高温热源处吸收的热量为Q ,循环Ⅱ的效率为η′,每次循环在高温热源处吸收的热量为Q ′,则( )A η<η′,Q < Q ′B η<η′,Q > Q ′C η>η′,Q < Q ′D η>η′,Q > Q ′10.气缸有一定量的氮气(视为刚性分子理想气体),经过绝热压缩,使其压强变为原来的2倍,问气体分子的平均速率变为原来的几倍?( )A 522B 512C 722D 71211.定量的理想气体经历如图所示的循环过程,A →B 和C →D 是等压过程,B →C 和D →A 是绝热过程。
热学专业课复习

2019级电子信息工程学院物理学(师范)专业核心课程热学期末复习题解析1.定体温度计的测温泡浸在水的三相点槽内时,其中气体的压强为:pa 3106.7⨯。
(1)用温度计测量300K 得温度时,气体的压强是多少? (2)当气体的压强为:Pa 3109.1⨯,待测温度是多少? 解:(1)K p pp T tr16.273)(⨯=,pa p tr 3107.6⨯=,当K T 300=时带入解得: pa p 32.7358=;(2)当pa p 3101.9⨯=时,带入公式得:K T 371=。
2. 图示的两条曲线分别表示在相同温度下氧气和氢气分子的速率分布曲线。
请问哪一条曲线表示氧气分子的速率分布曲线? 解:M RTmkTv p 22==,22H O M M >a 为氧气。
3.麦克斯韦速度分布函数是)(x f ,则s m v /100>的气体分子的平均速率v 为(⎰∞=100)(dv v f vv )。
4.半径为r 密度为ρ的小球在黏度系数为η,密度为σ的液体中自由下沉,求稳定后小球的速度是(g r v )(922σρη-=)。
解析:稳定后受力平衡则:.)(92,346623g r v mg g r vr mg gV vr σρηπσπηρπη-=⇒=+⇒=+排液体 5. 如果理想气体按照C pV =3(C 为正数常量)的规律从1V 膨胀到2V ,则做功为()11(22221V V C A -=)。
解析:).11(2222132121V V C A dV V C pdV A V V V V -=−−−→−==⎰⎰解出方程得:OEA B6. 某理想气体状态变化时,内能随体积的变化关系如图中AB 直线所示.A →B 表示的过程是(等压)过程。
解析:ννpVi U RT pV RT i U ⨯=⇒==2,2,从图中得出:aV U =,故为等压。
7. 有23molH (可视为理想气体),由423K 298K 加热到则此过程中U ∆为(7790.625J )。
化工热力学复习题(附答案)

化工热力学复习题一、选择题1. T 温度下的纯物质,当压力低于该温度下的饱和蒸汽压时,则气体的状态为( C )A. 饱和蒸汽 超临界流体 过热蒸汽2. 纯物质的第二virial 系数B ( A )A 仅是T 的函数B 是T 和P 的函数C 是T 和V 的函数D 是任何两强度性质的函数3. 设Z 为x ,y 的连续函数,,根据欧拉连锁式,有( B ) A. 1x y z Z Z x x y y ⎛⎫⎛⎫∂∂∂⎛⎫=- ⎪ ⎪ ⎪∂∂∂⎝⎭⎝⎭⎝⎭ B. 1y xZ Z x y x y Z ⎛⎫∂∂∂⎛⎫⎛⎫=- ⎪ ⎪ ⎪∂∂∂⎝⎭⎝⎭⎝⎭ C. 1y x Z Z x y x y Z ⎛⎫∂∂∂⎛⎫⎛⎫= ⎪ ⎪ ⎪∂∂∂⎝⎭⎝⎭⎝⎭D. 1y Z xZ y y x x Z ∂∂∂⎛⎫⎛⎫⎛⎫=- ⎪ ⎪ ⎪∂∂∂⎝⎭⎝⎭⎝⎭ 4. 关于偏离函数M R ,理想性质M *,下列公式正确的是( C )A. *R M M M =+B. *2R M M M =-C. *R M M M =-D. *R M M M =+5. 下面的说法中不正确的是 ( B )(A )纯物质无偏摩尔量 。
(B )任何偏摩尔性质都是T ,P 的函数。
(C )偏摩尔性质是强度性质。
(D )强度性质无偏摩尔量 。
6. 关于逸度的下列说法中不正确的是 ( D )(A )逸度可称为“校正压力” 。
(B )逸度可称为“有效压力” 。
(C )逸度表达了真实气体对理想气体的偏差 。
(D )逸度可代替压力,使真实气体的状态方程变为fv=nRT 。
(E )逸度就是物质从系统中逃逸趋势的量度。
7. 二元溶液,T, P 一定时,Gibbs —Duhem 方程的正确形式是 ( C ).a. X 1dlnγ1/dX 1+ X 2d lnγ2/dX 2 = 0b. X 1dlnγ1/dX 2+ X 2 dlnγ2/dX 1 = 0c. X 1dlnγ1/dX 1+ X 2dlnγ2/dX 1 = 0d. X 1dlnγ1/dX 1– X 2 dlnγ2/dX 1 = 08. 关于化学势的下列说法中不正确的是( A )A. 系统的偏摩尔量就是化学势B. 化学势是系统的强度性质C. 系统中的任一物质都有化学势D. 化学势大小决定物质迁移的方向9.关于活度和活度系数的下列说法中不正确的是 ( E )(A )活度是相对逸度,校正浓度,有效浓度;(B) 理想溶液活度等于其浓度。
热学习题课

径不变,则此时平均自由程为 B
(A) . 20 (C) . 0 / 2
(B) . 0 (D) 0/ 2.
解题总结:找出公式中的影响因子,确定不变量和变量。再根 据变量关系判断。
常见问题3:混合状态的平衡态分析
25
例6:在一密闭容器中,储有A、B、C三种理想气体,处于平
总结:找出平衡态中左右两边对等量,判别清楚运动方向,再
根据热力学第一定律进行判断。
常见问题4:PVT图像分析相关物理过程
31
例9.右图为一理想气体几种状态变化过程的p-V图,其中MT 为等温线,MQ为绝热线,在AM、BM、CM三种准静态过程 中: (1) 温度降低的是__________过程;
V
35
例11.一定量的理想气体分别由初态a经①过程ab和由初态a′经 ②过程a′cb到达相同的终态b,如p-T图所示,则两个过程中 气体从外界吸收的热量 Q1,Q2的关系为:
(A) Q1<0,Q1> Q2. (B) Q1>0,Q1> Q2. (C) Q1<0,Q1< Q2. (D) Q1>0,Q1< Q2.
大学物理
1
热学复习与习题解答
相关概念辨析
2
分子平均平动动能:单分子的平动维度上的平均动能,3kT/2 分子平均转动动能:单分子转动维度上的平均动能,(i-3)kT/2 分子平均动能:单分子在所有维度上的平均动能,ikT/2 分子气体的内能:分子组成的集体的内能之和,viRT/2
3
衡状态.A种气体的分子数密度为n1,它产生的压强为P1,B种
气体的分子数密度为2n1,C种气体的分子数密度为3 n1,则混
热学复习习题

北京邮电大学物理系
1.关于温度的意义,有下列几种说法: (1)气体的温度是分子平均平动动能的量度 (2)气体的温度是大量气体分子热运动的 集体表现,具有统计意义。 (3)温度的高低反应物质内部分子运动剧烈 程度的不同。 (4)从微观上看,气体的温度表示每个分子 的冷热程度
答案: (1)、(2)、(3)
量,视为常量,n 为气体摩尔数)计算理想气体内能 增量时,此式 (A) 只适用于准静态的等体过程. (B) 只适用于一切等体过程. (C) 只适用于一切准静态过程. (D) 适用于一切始末态为平衡态的过程. 答:[ D ]
18
16. 如图所示,绝热过程AB、CD,等温过程DEA, 和任意过 程BEC,组成一循环过程.若图中ECD所包围的面积为70 J, EAB所包围的面积为30 J,DEA过程中系统放热100J,则 40J (1)整个循环过程(ABCDEA)系统对外做功为___________. 140J (2) BEC过程中系统从外界吸热为___________ .
(C) 两种气体分子的平均速率相等.
(D) 两种气体的内能相等.
14
11.若气体分子的平均平动动能等于1.06 1019 J,则该气
5.12 103 体的温度T=______ K. k
1.38 1023 J K 1
一个
3 kT 2
12.根据能量按自由度均分原理,设气体分子为刚
答:[ A ]
20
18.
如图所示,设某热力学系统经历一个由 c→d→e的过程,其中ab 是一条绝热曲线,a、c在该曲线上.由热力学定律可知该系统在过 程中 (A)不断向外界放出热量. (B)不断从外界吸收热量. (C) 有的阶段吸热,有的阶段放热,整个过程中吸的热量等于放出的 热量. (D) 有的阶段吸热,有的阶段放热,整个过程中吸的热量大于放出的 热量. (E) 有的阶段吸热,有的阶段放热,整个过程中吸的热量小于放出的 p 热量. a
热学复习题 答案
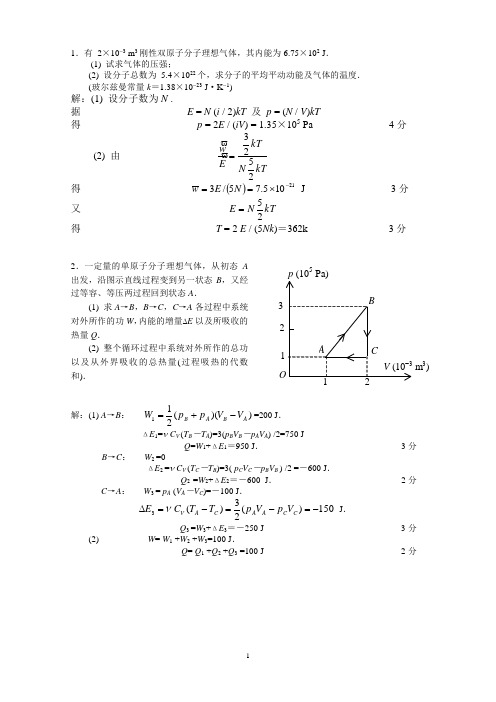
1.有 2×10-3 m 3刚性双原子分子理想气体,其内能为6.75×102 J .(1) 试求气体的压强;(2) 设分子总数为 5.4×1022个,求分子的平均平动动能及气体的温度.(玻尔兹曼常量k =1.38×10-23 J ·K -1)解:(1) 设分子数为N .据 E = N (i / 2)kT 及 p = (N / V )kT得 p = 2E / (iV ) = 1.35×105 Pa 4分(2) 由 kT N kT E w 2523=ϖϖ 得 ()21105.75/3-⨯==N E w J 3分又 kT N E 25= 得 T = 2 E / (5Nk )=362k 3分2.一定量的单原子分子理想气体,从初态A出发,沿图示直线过程变到另一状态B ,又经过等容、等压两过程回到状态A . (1) 求A →B ,B →C ,C →A 各过程中系统对外所作的功W ,内能的增量∆E 以及所吸收的热量Q .(2) 整个循环过程中系统对外所作的总功以及从外界吸收的总热量(过程吸热的代数和).解:(1) A →B : ))((211A B A B V V p p W -+==200 J . ΔE 1=ν C V (T B -T A )=3(p B V B -p A V A ) /2=750 JQ =W 1+ΔE 1=950 J . 3分B →C : W 2 =0ΔE 2 =ν C V (T C -T B )=3( p C V C -p B V B ) /2 =-600 J .Q 2 =W 2+ΔE 2=-600 J . 2分C →A : W 3 = p A (V A -V C )=-100 J .150)(23)(3-=-=-=∆C C A A C A V V p V p T T C E ν J . Q 3 =W 3+ΔE 3=-250 J 3分(2) W = W 1 +W 2 +W 3=100 J .Q = Q 1 +Q 2 +Q 3 =100 J 2分1 2 3 1 2 O V (10-3 m 3) 5 AB C3.1 mol 双原子分子理想气体从状态A (p 1,V 1)沿p -V 图所示直线变化到状态B (p 2,V 2),试求:(1) 气体的内能增量.(2) 气体对外界所作的功.(3) 气体吸收的热量.(4) 此过程的摩尔热容.(摩尔热容C =T Q ∆∆/,其中Q ∆表示1 mol 物质在过程中升高温度T ∆时所吸收的热量.) 解:(1) )(25)(112212V p V p T T C E V -=-=∆ 2分 (2) ))((211221V V p p W -+=, W 为梯形面积,根据相似三角形有p 1V 2= p 2V 1,则)(211122V p V p W -=. 3分 (3) Q =ΔE +W =3( p 2V 2-p 1V 1 ). 2分(4) 以上计算对于A →B 过程中任一微小状态变化均成立,故过程中ΔQ =3Δ(pV ). 由状态方程得 Δ(pV ) =R ΔT ,故 ΔQ =3R ΔT ,摩尔热容 C =ΔQ /ΔT =3R . 3分4.一定量的刚性双原子分子理想气体,开始时处于压强为 p 0 = 1.0×105 Pa ,体积为V 0 =4×10-3 m 3,温度为T 0 = 300 K 的初态,后经等压膨胀过程温度上升到T 1 = 450 K ,再经绝热过程温度降回到T 2 = 300 K ,求气体在整个过程中对外作的功. 解:等压过程末态的体积 1001T T V V = 等压过程气体对外作功)1()(01000101-=-=T T V p V V p W =200 J 3分 根据热力学第一定律,绝热过程气体对外作的功为W 2 =-△E =-νC V (T 2-T 1)这里 000RT V p =ν,R C V 25=, 则 500)(25120002==--=T T T V p W J 4分 气体在整个过程中对外作的功为 W = W 1+W 2 =700 J . 1分5.1 mol 理想气体在T 1 = 400 K 的高温热源与T 2 = 300 K 的低温热源间作卡诺循环(可逆的),在400 K 的等温线上起始体积为V 1 = 0.001 m 3,终止体积为V 2 = 0.005 m 3,试求此气体在每一循环中(1) 从高温热源吸收的热量Q 1(2) 气体所作的净功W(3) 气体传给低温热源的热量Q 2解:(1) 312111035.5)/ln(⨯==V V RT Q J 3分 B A O V p 1p p V 1V 2(2) 25.0112=-=T T η. 311034.1⨯==Q W η J 4分(3) 3121001.4⨯=-=W Q Q J 3分6.1 mol 单原子分子理想气体的循环过程如T -V图所示,其中c 点的温度为T c =600 K .试求:(1) ab 、bc 、c a 各个过程系统吸收的热量;(2) 经一循环系统所作的净功;(3) 循环的效率.(注:循环效率η=W /Q 1,W 为循环过程系统对外作的净功,Q 1为循环过程系统从外界吸收的热量ln2=0.693) 解:单原子分子的自由度i =3.从图可知,ab 是等压过程,V a /T a = V b /T b ,T a =T c =600 KT b = (V b /V a )T a =300 K 2分(1) )()12()(c b c b p ab T T R i T T C Q -+=-= =-6.23×103 J (放热))(2)(b c b c V bc T T R i T T C Q -=-= =3.74×103 J (吸热) Q ca =RT c ln(V a /V c ) =3.46×103 J (吸热) 4分(2) W =( Q bc +Q ca )-|Q ab |=0.97×103 J 2分(3) Q 1=Q bc +Q ca , η=W / Q 1=13.4% 2分7.一定量的某种理想气体进行如图所示的循环过程.已知气体在状态A 的温度为T A =300 K ,求 (1) 气体在状态B 、C 的温度;(2) 各过程中气体对外所作的功; (3) 经过整个循环过程,气体从外界吸收的总热量(各过程吸热的代数和). 解:由图,p A =300 Pa ,p B = p C =100 Pa ;V A =V C =1 m 3,V B =3 m 3.(1) C →A 为等体过程,据方程p A /T A = p C /T C 得T C = T A p C / p A =100 K . 2分B →C 为等压过程,据方程V B /T B =V C /T C 得T B =T C V B /V C =300 K . 2分(2) 各过程中气体所作的功分别为A →B : ))((211C B B A V V p p W -+==400 J . B →C : W 2 = p B (V C -V B ) = -200 J .C →A : W 3 =0 3分(3) 整个循环过程中气体所作总功为W = W 1 +W 2 +W 3 =200 J .因为循环过程气体内能增量为ΔE =0,因此该循环中气体总吸热Q =W +ΔE =200 J . 3分V (10-3m 3)O 1 2 a b c A B C p (Pa)O V (m 3)1002003008.如图所示,有一定量的理想气体,从初状态a (p 1,V 1)开始,经过一个等体过程达到压强为p 1/4的b 态,再经过一个等压过程达到状态c ,最后经等温过程而完成一个循环.求该循环过程中系统对外作的功W 和所吸的热量Q . 解:设c 状态的体积为V 2,则由于a ,c 两状态的温度相同,p 1V 1=p 1V 2 /4故 V 2 = 4 V 12分循环过程 ΔE = 0 , Q =W .而在a →b 等体过程中功 W 1= 0.在b →c 等压过程中功W 2 =p 1(V 2-V 1) /4 = p 1(4V 1-V 1)/4=3 p 1V 1/4 2分在c →a 等温过程中功W 3 =p 1 V 1 ln (V 2/V 1) = -p 1V 1ln 4 2分 ∴ W =W 1 +W 2 +W 3 =[(3/4)-ln4] p 1V 1 1分Q =W=[(3/4)-ln4] p 1V 1 3分9.气缸内贮有36 g 水蒸汽(视为刚性分子理想气体),经abcda 循环过程如图所示.其中a -b 、c -d 为等体过程,b -c 为等温过程,d -a为等压过程.试求:(1) d -a 过程中水蒸气作的功W da(2) a -b 过程中水蒸气内能的增量∆E ab(3) 循环过程水蒸汽作的净功W (4) 循环效率η (注:循环效率η=W /Q 1,W 为循环过程水蒸汽对外作的净功,Q 1为循环过程水蒸汽吸收的热量,1 atm= 1.013×105 Pa)解:水蒸汽的质量M =36×10-3 kg水蒸汽的摩尔质量M mol =18×10-3 kg ,i = 6(1) W da = p a (V a -V d )=-5.065×103 J 2分(2) ΔE ab =(M /M mol )(i /2)R (T b -T a )=(i /2)V a (p b - p a )=3.039×104 J 2分(3) 914)/(==RM M V p T mol a b b K W bc = (M /M mol )RT b ln(V c /V b ) =1.05×104 J净功 W =W bc +W da =5.47×103 J 3分(4) Q 1=Q ab +Q bc =ΔE ab +W bc =4.09×104 Jη=W / Q 1=13% 3分p p 1 p 1/4V 1a c b p (atm ) V (L) O a b c d25 50 2 610.比热容比=γ 1.40的理想气体,进行如图所示的ABCA 循环,状态A 的温度为300 K .(1) 求状态B 、C 的温度; (2) 计算各过程中气体所吸收的热量、气体所作的功和气体内能的增量.(普适气体常量 11K m ol J 31.8--⋅⋅=R ) 解:(1) C →A 等体过程有 p A /T A = p C /T C∴ 75)(==Ac A C p p T T K 1分B →C 等压过程有 V B /V B =V C / T C∴ 225)(==CBC B V VT T K1分 (2) 气体的摩尔数为 321.0mol ===AA A RT Vp M M ν1分 由 γ=1.40 可知气体为双原子分子气体,故 R C V 25=,R C p 27=1分 C →A 等体吸热过程 W CA =0Q CA =ΔE CA = v C V (T A -T C ) =1500 J2分 B →C 等压压缩过程 W BC =P B (V C -V B ) =-400 JΔE BC = v C V (T C -T B ) =-1000 JQ BC =ΔE BC + W BC =-1400 J2分 A →B 膨胀过程 1000J )26()100400(21=-+=AB W JΔE AB = v C V (T B -T A ) =-500 JQ AB =ΔE AB + W AB =500 J2分V (m 3) 246A B C O。
热学复习题答案

热学复习题1.气体分子的速率分布函数)f, 是系统中速率v附近单位速率区间的分(v子数占总分子数的百分比. ( R )2. 微观上,气体的温度表示每个分子的冷热程度. ( F)3. 气体的温度是分子平均平动动能的量度. ( R )一.选择题(每小题3分,共30分)1.一定量某理想气体所经历的循环过程是:从初态(V0 ,T0)开始,先经绝热膨胀使其体积增大1倍,再经等容升温回复到初态温度T0, 最后经等温过程使其体积回复为V0 , 则气体在此循环过程中( A )(A)对外作的净功为负值. (B) 对外作的净功为正值.(C) 内能增加了. (D) 从外界净吸收的热量为正值.2.如图所示,一定量的理想气体从体积V1膨胀到体积V2分别经历的过程是:A→B等压过程; A→C等温过程; A→D绝热过程. 其中对外作功最少的过程为:( C )(A)是A→B.(B)是A→C.(C) 是A→D.(D) 既是A→B,也是A→ C ,两者一样多.3.两容器内分别盛有氢气和氦气,若它们的温度和质量分别相等,则:( A )(A)两种气体分子的平均平动动能相等.(B) 两种气体分子的平均动能相等. (C) 两种气体分子的平均速率相等. (D) 两种气体的内能相等.4若理想气体的体积为V ,压强为p ,温度为T ,一个分子的质量为m ,k 为玻耳兹曼常量,R 为摩尔气体常量,则该理想气体的分子数为:( D )(A) pV/m . (B) pV /(mT ). (C) pV /(RT ) . (D) pV / (kT ).5. 下图所列各图表示的速率分布曲线,哪一图中的两条曲线能是同一温度下氮气和氦气的分子速率分布曲线 ( B )6.已知一定量的某种理想气体,在温度为T 1与T 2时分子最可几速率分别为v p1和v p2,分子速率分布函数的最大值分别为f (v p1)和f (v p2), 若T 1>T 2 , 则( B )(A) v p1>v p2 , f (v p1)>f (v p2) . (B) v p1>v p2 , f (v p1)<f (v p2) . (C)v p1<v p2 , f (v p1)>f (v p2 ) . (D) v p1<v p2 , f (v p1)<f (v p2) .7. 若室内生起炉子后温度从15℃升高到27℃,而室内气压不变,则此时室内的气体分子数减少了 ( B )(A) 500. (B) 400. (C) 900. (D) 2100.8. 已知氢气与氧气的温度相同,请判断下列说法正确的是 ( D )(A)(C)(B)(D)(A)氧分子的质量比氢分子大,所以氧气的压强一定大于氢气的压强. (B)氧分子的质量比氢分子大,所以氧气的密度一定大于氢气的密度. (C)氧分子的质量比氢分子大,所以氢分子的速率一定比氧分子的速率大.(D)氧分子的质量比氢分子大,所以氢分子的方均根速率一定比氧分子的方均根速率大.9.设1 mol 理想气体,从同一初始平衡态出发,进行可逆的等压过程或等体过程.在温熵图中,对于相同的温度 ( B ) (A) 等压过程曲线的斜率大于等体过程曲线的斜率. (B) 等压过程曲线的斜率小于等体过程曲线的斜率. (C) 两种过程曲线的斜率相等. (D) 两种过程曲线的斜率孰大孰小取决于温度的值.10. 在密闭容器中,若将理想气体分子的平均速度提高为原来的两倍,则( D )(A)温度和压强都提高为原来的2倍;(B) 温度变为原来的2倍,而压强变为原来的4倍; (C) 温度变为原来的4倍,而压强变为原来的2倍;(D) 温度和压强都提高为原来的4倍.11. 在一定的温度下,理想气体分子速率分布函数()v f 是一定的。
1.热学习题解答

第二篇 热 学 第一章 温度一、选择题1.在一密闭容器中,储有A 、B 、C 三种理想气体,处于平衡状态,A 种气体的分子数密度为n 1,它产生的压强为p 1,B 种气体的分子数密度为2n 1,C 种气体分子数密度为3n 1,则混合气体的压强p 为 (A )3p 1 (B )4p 1 (C )5p 1 (D )6p 12.若理想气体的体积为V ,压强为p ,温度为T ,一个分子的质量为m ,k 为玻尔兹曼常数,R 为摩尔气体常数,则该理想气体的分子数为:(A )m pV (B )kT pV (C )RT pV (D )mT pV二、填空题1.定体气体温度计的测温气泡放入水的三相点管的槽内时,气体的压强为Pa 31065.6⨯ 。
用此温度计测量的温度时,气体的压强是 ,当气体压强是Pa 3102.2⨯时,待测温度是 k, 0C 。
三、计算题1.一氢气球在200C 充气后,压强为,半径为。
到夜晚时,温度降为100C ,气球半径缩为,其中氢气压强减为 atm 。
求已经漏掉了多少氢气第二章 气体分子动理论一、选择题1. 两个相同的容器,一个盛氢气,一个盛氦气(均视为刚性分子理想气体),开始时它们的压强和温度都相等。
现将6 J 热量传给氦气,使之升高到一定温度。
若使氦气也升高同样的温度,则应向氦气传递热量:(A) 6 J (B) 10 J (C) 12 (D) 5 J 2. 在标准状态下, 若氧气(视为刚性双原子分子的理想气体)和氦气的体积比2121=V V ,则其内能之比21/E E 为:(A) 1/2 (B) 5/3 (C) 5/6 (D) 3/10 3. 在容积V = 4×103-m 3的容器中,装有压强p = 5×102P a 的理想气体,则容器中气分子的平均平动动能总和为:(A) 2 J (B) 3 J (C) 5 J (D) 9 J4. 若在某个过程中,一定量的理想气体的内能E 随压强 p 的变化关系为一直线(其延长线过E ~ p 图的原点),则该过程为(A) 等温过程 (B) 等压过程(C) 等容过程 (D) 绝热过程5. 若)(v f 为气体分子速率分布函数,N 为分子总数,m 为分子质量,则)(21221v Nf mv v v ⎰d v 的物理意义是:(A) 速率为v 2的各分子的总平均动能与速率为v 1的各分子的总平均动能之差。
热学练习题含答案

一、单项选择题1. 一个容器内贮有1摩尔氢气和1摩尔氦气,若两种气体各自对器壁产生的压强分别为P1 和P2,则两者的大小关系是:(A)限耍(B)p<p2.(C)p1= p2.(D)不确定的. 答案:C2双原子理想气体,作等压膨胀,若气体膨胀过程从热源吸收热量700J,则该过程气体对外做功为:a、200Jb、350Jc、300Jd、250J 答案:A3. 下列方程中,哪一个不是绝热过程方程;a、TV S=常量;b、P I T T=常量;c、P y V=常量;d、PV y =常量答案:C4.设单原子理想气体由平衡态A,经一平衡过程变化到状态B,如果变化过程不知道,但A, B两状态的P, V, T都已知,那么就可以求出:a、气体膨胀所做的功;b、气体传递的热量;c、气体内能的变化;d、气体的总质量。
答案:C5.某理想气体状态变化时,内能与温度成正比,则气体的状态变化过程是:a、一定是等压过程;b、一定是等容过程;c、一定是绝热过程;d、以上过程都有可能发生。
答案:D6.两瓶不同种类的气体,分子平均平动动能相等,但气体密度不同,则:a、温度和压强都相同;b、温度相同,内能也一定相同;c、温度相同,但压强不同;d、温度和压强都相不同。
答案:C7.室温下的双原子分子理想气体,在等压膨胀的情况下,系统对外所作的功与从外界吸收的热量之比为A/Q为:a、 1/3b、2/7c、2/5d、 1/4 答案:B8.对于理想气体系统来说,下列过程中,哪个过程系统所吸收的热量、内能的增量和对外做的功三者皆为负值:a、等压压缩过程;b、等容降压;c、等温膨胀;d、绝热膨胀。
答案:A9.摩尔数相同的氧气和氦气(视为理想气体),分别从同一初始状态开始作等温膨胀,终态体积相同,则此两种气体在这一膨胀过程中:a、吸热相同,但对外做功不同;b、吸热不同,但对外做功相同;c、对外做功和吸热均不相同d、对外做功和吸热都相同答案:D 10.根据热力学第二定律可知:a 、 功可以全部转换为热,但热不能全部转换为功;b 、 热量可以从高温物体传到低温物体,但不能从低温物体传道高温物体;c 、 不可逆过程就是不能向相反方向进行的过程;d 、 一切自发过程都是不可逆的。
热学期末考试复习补充题答案

∴
第 11 页 共 11 页
RT 798.9m / s ; M
p 3.82 10 6 ( s 1 ) ; kT
2d 2 nv 2d 2 v
(3)
v Z
1 2d n
2
2.09 10 4 (m) ;
(4)当温度保持不变,压强降为原来的一半时,分子的平均碰撞频率
Z2 p 1 2 , Z1 p1 2
(2)由分布函数的归一化条件 得
vF
0
4A 2 v dv 1 N
A
3N 3 4v F
第 9 页 共 11 页
(3) v
2
0
v 2 f (v )dv 1 2
vF
0
5 4Av F 3v 2 4A 4 F v dv N 5N 5 2 3v F 3 1 2 F ,其中 F mv F 2 5 5
第 10 页 共 11 页
N kT nkT V 2 理想气体压强公式为 p n k 3 3 由(1) 、 (2)两式可得 k kT 2 1 3 2 再由 k mv kT 可得 2 2
可得
p
v2
3kT m
或者
v2
3kT 3RT m
10. 热力学第一定律
V1 V2 T1 T2
T2 2T1
2
S 2 S1
1
2 C dT dQ p T T 1
7 R 2 7 ln 2 S 2 S1 R 2016 J / K 2 cp
2-3 为等容过程
p2 p2 T2 T3
T3 2T2 dQ C dT S3 S2 V T 2 T 2
高一物理热学基础练习题及答案

高一物理热学基础练习题及答案1.选择题:1) 以下哪个物理量与热平衡无关?A. 热容B. 热温度C. 热量D. 内能答案:A. 热容2) 单位质量物质升高1摄氏度所需的热量称为:A. 热容B. 热比热容C. 内能D. 热传导答案:B. 热比热容3) 热平衡是指两个物体:A. 温度相等B. 热量相等C. 热容相等D. 内能相等答案:A. 温度相等4) 以下哪个选项是正确的?A. 温度是物体的固有属性B. 温度是热量的度量C. 温度只能用温度计来测量D. 温度是物体内能的度量答案:D. 温度是物体内能的度量5) 热量是一个:A. 宏观物理量B. 微观物理量C. 化学物理量D. 学院物理量答案:A. 宏观物理量2.填空题:1) 定容状态下若物体的体积变小,则温度___。
答案:升高2) 0摄氏度与摄氏度的冷热程度相同。
答案:相同3) 理想气体在等压过程中热容与()相等。
答案:等压热容4) 热量可以用___来度量。
答案:焦耳5) 热平衡是指两个物体之间没有___流动。
答案:热量3.计算题:1) 质量为0.5kg的物体热容为400J/kg·°C,现有一物体温度由20°C 升高到40°C,需要吸收多少热量?答案:ΔQ = mcΔθΔQ = 0.5kg × 400J/kg·°C × (40°C - 20°C)ΔQ = 400J2) 一瓶装满水的热水袋的质量为0.8kg,其初始温度为80°C,现要将其温度升高到100°C,需要吸收多少热量?(水的比热容为4200J/kg·°C)答案:ΔQ = mcΔθΔQ = 0.8kg × 4200J/kg·°C × (100°C - 80°C)ΔQ = 6720J3) 一个物体的质量为2kg,它的比热容为1000J/kg·°C,将其温度由20°C升高到60°C,需要吸收多少热量?(不考虑相变)答案:ΔQ = mcΔθΔQ = 2kg × 1000J/kg·°C × (60°C - 20°C)ΔQ = 80000J总结:本篇文章涵盖了高一物理热学基础练习题及答案,分为选择题、填空题和计算题三个部分。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.有 2×10-3 m 3刚性双原子分子理想气体,其内能为6.75×102 J .(1) 试求气体的压强;(2) 设分子总数为 5.4×1022个,求分子的平均平动动能及气体的温度.(玻尔兹曼常量k =1.38×10-23 J ·K -1)解:(1) 设分子数为N .据 E = N (i / 2)kT 及 p = (N / V )kT得 p = 2E / (iV ) = 1.35×105 Pa 4分(2) 由 kT N kT E w 2523= 得 ()21105.75/3-⨯==N E w J 3分又 kT N E 25= 得 T = 2 E / (5Nk )=362k 3分2.一定量的单原子分子理想气体,从初态A出发,沿图示直线过程变到另一状态B ,又经过等容、等压两过程回到状态A .(1) 求A →B ,B →C ,C →A 各过程中系统对外所作的功W ,内能的增量∆E 以及所吸收的热量Q .(2) 整个循环过程中系统对外所作的总功以及从外界吸收的总热量(过程吸热的代数和).解:(1) A →B : ))((211A B A B V V p p W -+==200 J . ΔE 1=ν C V (T B -T A )=3(p B V B -p A V A ) /2=750 JQ =W 1+ΔE 1=950 J . 3分B →C : W 2 =0ΔE 2 =ν C V (T C -T B )=3( p C V C -p B V B ) /2 =-600 J .Q 2 =W 2+ΔE 2=-600 J . 2分C →A : W 3 = p A (V A -V C )=-100 J .150)(23)(3-=-=-=∆C C A A C A V V p V p T T C E ν J . Q 3 =W 3+ΔE 3=-250 J 3分(2) W = W 1 +W 2 +W 3=100 J .Q = Q 1 +Q 2 +Q 3 =100 J 2分3) 53.1 mol 双原子分子理想气体从状态A (p 1,V 1)沿p -V 图所示直线变化到状态B (p 2,V 2),试求:(1) 气体的内能增量.(2) 气体对外界所作的功.(3) 气体吸收的热量.(4) 此过程的摩尔热容.(摩尔热容C =T Q ∆∆/,其中Q ∆表示1 mol 物质在过程中升高温度T ∆时所吸收的热量.) 解:(1) )(25)(112212V p V p T T C E V -=-=∆ 2分 (2) ))((211221V V p p W -+=, W 为梯形面积,根据相似三角形有p 1V 2= p 2V 1,则)(211122V p V p W -=. 3分 (3) Q =ΔE +W =3( p 2V 2-p 1V 1 ). 2分(4) 以上计算对于A →B 过程中任一微小状态变化均成立,故过程中ΔQ =3Δ(pV ). 由状态方程得 Δ(pV ) =R ΔT ,故 ΔQ =3R ΔT ,摩尔热容 C =ΔQ /ΔT =3R . 3分4.一定量的刚性双原子分子理想气体,开始时处于压强为 p 0 = 1.0×105 Pa ,体积为V 0 =4×10-3 m 3,温度为T 0 = 300 K 的初态,后经等压膨胀过程温度上升到T 1 = 450 K ,再经绝热过程温度降回到T 2 = 300 K ,求气体在整个过程中对外作的功. 解:等压过程末态的体积 1001T T V V = 等压过程气体对外作功)1()(01000101-=-=T T V p V V p W =200 J 3分 根据热力学第一定律,绝热过程气体对外作的功为W 2 =-△E =-νC V (T 2-T 1)这里 000RT V p =ν,R C V 25=, 则 500)(25120002==--=T T T V p W J 4分 气体在整个过程中对外作的功为 W = W 1+W 2 =700 J . 1分5.1 mol 理想气体在T 1 = 400 K 的高温热源与T 2 = 300 K 的低温热源间作卡诺循环(可逆的),在400 K 的等温线上起始体积为V 1 = 0.001 m 3,终止体积为V 2 = 0.005 m 3,试求此气体在每一循环中(1) 从高温热源吸收的热量Q 1(2) 气体所作的净功W(3) 气体传给低温热源的热量Q 2解:(1) 312111035.5)/ln(⨯==V V RT Q J 3分 p 1p p 12(2) 25.0112=-=T T η. 311034.1⨯==Q W η J 4分(3) 3121001.4⨯=-=W Q Q J 3分6.1 mol 单原子分子理想气体的循环过程如T -V图所示,其中c 点的温度为T c =600 K .试求:(1) ab 、bc 、c a 各个过程系统吸收的热量; (2) 经一循环系统所作的净功;(3) 循环的效率. (注:循环效率η=W /Q 1,W 为循环过程系统对外作的净功,Q 1为循环过程系统从外界吸收的热量ln2=0.693) 解:单原子分子的自由度i =3.从图可知,ab 是等压过程,V a /T a = V b /T b ,T a =T c =600 KT b = (V b /V a )T a =300 K 2分(1) )()12()(c b c b p ab T T R i T T C Q -+=-= =-6.23×103 J (放热))(2)(b c b c V bc T T R i T T C Q -=-= =3.74×103 J (吸热) Q ca =RT c ln(V a /V c ) =3.46×103 J (吸热) 4分(2) W =( Q bc +Q ca )-|Q ab |=0.97×103 J 2分(3) Q 1=Q bc +Q ca , η=W / Q 1=13.4% 2分7.一定量的某种理想气体进行如图所示的循环过程.已知气体在状态A 的温度为T A =300 K ,求(1) 气体在状态B 、C 的温度; (2) 各过程中气体对外所作的功; (3) 经过整个循环过程,气体从外界吸收的总热量(各过程吸热的代数和). 解:由图,p A =300 Pa ,p B = p C =100 Pa ;V A =V C =1 m 3,V B =3 m 3.(1) C →A 为等体过程,据方程p A /T A = p C /T CT C = T A p C / p A =100 K . 2分B →C 为等压过程,据方程V B /T B =V C /T C 得T B =T C V B /V C =300 K . 2分(2) 各过程中气体所作的功分别为A →B : ))((211C B B A V V p p W -+==400 J . B →C : W 2 = p B (V C -V B ) = -200 J .C →A : W 3 =0 3分(3) 整个循环过程中气体所作总功为W = W 1 +W 2 +W 3 =200 J .因为循环过程气体内能增量为ΔE =0,因此该循环中气体总吸热Q =W +ΔE =200 J . 3分-3m 3)p (Pa)V (m 3)1002003008.如图所示,有一定量的理想气体,从初状态a (p 1,V 1)开始,经过一个等体过程达到压强为p 1/4的b 态,再经过一个等压过程达到状态c ,最后经等温过程而完成一个循环.求该循环过程中系统对外作的功W 和所吸的热量Q .解:设c 状态的体积为V 2,则由于a ,c 两状态的温度相同,p 1V 1=p 1V 2 /4故 V 2 = 4 V 12分循环过程 ΔE = 0 , Q =W .而在a →b 等体过程中功 W 1= 0.在b →c 等压过程中功W 2 =p 1(V 2-V 1) /4 = p 1(4V 1-V 1)/4=3 p 1V 1/4 2分在c →a 等温过程中功W 3 =p 1 V 1 ln (V 2/V 1) = -p 1V 1ln 4 2分 ∴ W =W 1 +W 2 +W 3 =[(3/4)-ln4] p 1V 1 1分Q =W=[(3/4)-ln4] p 1V 1 3分9.气缸内贮有36 g 水蒸汽(视为刚性分子理想气体),经abcda 循环过程如图所示.其中a -b 、c -d 为等体过程,b -c 为等温过程,d -a为等压过程.试求: (1) d -a 过程中水蒸气作的功W da(2) a -b 过程中水蒸气内能的增量∆E ab(3) 循环过程水蒸汽作的净功W (4) 循环效率η (注:循环效率η=W /Q 1,W 为循环过程水蒸汽对外作的净功,Q 1为循环过程水蒸汽吸收的热量,1 atm= 1.013×105 Pa)解:水蒸汽的质量M =36×10-3 kg水蒸汽的摩尔质量M mol =18×10-3 kg ,i = 6(1) W da = p a (V a -V d )=-5.065×103 J 2分(2) ΔE ab =(M /M mol )(i /2)R (T b -T a )=(i /2)V a (p b - p a )=3.039×104 J 2分(3) 914)/(==RM M V p T mol a b b K W bc = (M /M mol )RT b ln(V c /V b ) =1.05×104 J净功 W =W bc +W da =5.47×103 J 3分(4) Q 1=Q ab +Q bc =ΔE ab +W bc =4.09×104 Jη=W / Q 1=13% 3分p p 11 p (atm ) V (L)10.比热容比=γ 1.40的理想气体,进行如图所示的ABCA 循环,状态A 的温度为300 K .(1) 求状态B 、C 的温度; (2) 计算各过程中气体所吸收的热量、气体所作的功和气体内能的增量. (普适气体常量 11K mol J 31.8--⋅⋅=R ) 解:(1) C →A 等体过程有 p A /T A = p C /T C∴ 75)(==Ac A C p p T T K 1分B →C 等压过程有 V B /V B =V C / T C∴ 225)(==CBC B V V T T K1分 (2) 气体的摩尔数为 321.0mol ===AA A RT Vp M M ν1分 由 γ=1.40 可知气体为双原子分子气体,故 R C V 25=,R C p 27=1分 C →A 等体吸热过程 W CA =0Q CA =ΔE CA = v C V (T A -T C ) =1500 J2分 B →C 等压压缩过程 W BC =P B (V C -V B ) =-400 JΔE BC = v C V (T C -T B ) =-1000 JQ BC =ΔE BC + W BC =-1400 J2分 A →B 膨胀过程 1000J )26()100400(21=-+=AB W JΔE AB = v C V (T B -T A ) =-500 JQ AB =ΔE AB + W AB =500 J2分3) O。
