胺
有机化学课件-16胺

NH2 (CH3CO)2O
NHCOCH3 HNO3
H2SO4
NHCOCH3 △ (1)H3O+ (2)OH-
NH2
NO2
NO2
五、磺酰化:
即磺酰氯的胺解,常用的磺酰氯是对甲苯磺酰氯(TSCl),又 称为Hinsberg(兴斯堡)试剂;
RNH2
通式为: R2NH
R3N
O p-CH3C6H4-S Cl
O CH3 C
Cl
CH3CONHR CH3CONR2
HCl-H2O
R3N
R3N
CH3CONHR 油相 CH3CONR2 水相 (R3NH+Cl-)
油相
NaOH
△
油相
RNH2
H2O
R2NH
水相 NaOH 油相 (R3N)
H2O
(2)保护氨基避免副反应,对于芳香胺,可使亲电反应活性降低, 避免多取代;
例:
NH2
2-甲基-4-氨基戊烷
CH3CH2CHCH3
N(CH2CH3)2
2-二乙氨基丁烷
(三)季铵盐及季铵碱: 类似无机物NH4X或NH4OH的命名
(CH3)4N+Cl- C6H5CH2N+(C2H5)3Cl- (CH3)2N+(C2H5)2OH-
氯化四甲基铵 氯化三乙基苄基铵 氢氧化二甲基二乙基铵
注意:氨、胺及铵在命名时用法不同;
R'' R NH+X-
R NH + HX R' R''
R N + HX
R'
R'
R'
R'' R N + R'''X
第13章 胺

(CH3)3N bp: 2.87º C
C2H5NHCH3 36-37º C
CH3CH2CH2NH2 47.8º C
大多数芳胺具有毒性,苯胺可以导致再生障碍 性贫血,通过吸入,食入或透过皮肤吸收而致中 毒,食入0.25 mL就严重中毒。 β– 萘胺与联苯胺是能够引起恶性肿瘤的物质。
四、胺的化学性质 1. 胺的碱性与成盐
N R R R
N H H
学习胺的化学,要注意N上的孤对电子,胺的许多性 质都与它有关。
1. 胺的碱性与成盐
R—NH2 + H—OH R—NH3 + OH
[R+NH3][-OH] Kb = RNH2
pKb = - logKb
(1)产生碱性的原因: N上的孤对电子 (2)判别碱性的方法: pKb的值;或其共轭酸的
H R N H H O O H H H O H H H
R1 R N H R2 O H H
1° 胺 3° 胺 胺在水溶液中碱性的强弱,是其电子效应、空间效 应以及溶剂化效应的综合体现。
1. 胺的碱性与成盐
一些胺(氨)在水溶液中的pKb值
NH3 pKb 4.76
3.27
3.38 4.21
C6H5NH2
苯磺酰氯
对甲苯磺酰氯 (TsCl)
该反应用于伯、仲、叔胺的分离与鉴定。
磺酰化反应:
兴斯堡反应的反应式如下:
RNH2 + SO2Cl SO2NHR NaOH H+ SO2NR Na+
伯胺
R2NH + SO2Cl NaOH H2O SO2NR2
仲胺
R3N + SO2Cl NaOH H2O R3N +
+ NaOH H
胺的知识点总结

胺的知识点总结一、胺的性质1.1 胺的结构胺的结构通常由一个或多个氨基(-NH2)官能团以及与之相连的碳链组成。
根据氨基与碳链的连接方式不同,胺可以分为原始胺(氨基直接连接到一个碳原子上)、第一级胺(氨基连接到一个烷基基团上)、二级胺(两个烷基基团连接到氨基上)和三级胺(三个烷基基团连接到氨基上)。
1.2 胺的物理性质胺的物理性质包括外观、溶解性、沸点和熔点等。
一般来说,低分子量的胺呈无色或淡黄色液体,高分子量的胺呈固体状态。
胺通常具有挥发性和刺激性气味,易溶于水和有机溶剂。
1.3 胺的化学性质胺具有碱性,能与酸反应生成盐类。
它还具有亲核性,可以发生亲核取代、亲核加成等反应。
此外,胺还可发生取代反应、氧化反应和还原反应。
二、胺的分类根据氨基的连接方式和数量不同,胺可以分为原始胺、第一级胺、二级胺和三级胺。
根据碳链的不同,又可分为脂肪胺和芳香胺。
根据胺分子中氨基所取代的碳原子数不同,可分为氨基甲烷、氨基乙烷、氨基丙烷等不同种类。
三、胺的合成3.1 胺的直接合成胺的直接合成方法包括氨和烃或卤代烃的取代反应、氨和醛、酮的纳尔逊反应等。
3.2 胺的间接合成胺的间接合成方法包括亲核取代反应、亲电取代反应、亲核加成反应、氢解反应等。
3.3 胺的生物合成在生物体内,胺的合成通常是通过氨基酸的脱氨作用来完成的。
四、胺的应用由于胺具有碱性、亲核性等特点,因此在许多领域有广泛的应用。
4.1 化工领域胺可以用于合成染料、药物、橡胶、塑料等化合物。
4.2 农业领域胺类化合物被广泛应用于杀虫剂、除草剂等农药的合成。
4.3 医药领域许多药物中含有胺基团,胺也是很多生物活性分子的基本组成部分,如氨基酸、肽类化合物等。
4.4 日用化学品领域如洗涤剂、护肤品、香精等都包含胺类化合物。
4.5 其他领域胺还在颜料、涂料、感光材料、粘合剂等领域有着重要的应用。
五、结语胺作为一类重要的化合物,在化工、医药、农业等领域都有着重要的应用。
了解胺的性质、分类、合成方法和应用领域,对于进一步深入研究胺的化学性质和应用具有重要意义。
第15章 胺

手性
R1
..
N R2 R3
..
N R3
R2
CH3 +N
C6H5 R1 C2H5 CH2CH=CH2
CH3 N+ C6H5 CH2CH=CH2 C2H5
室温下,相互转化
三、物理性质
对映体
1. 常温下状态:甲胺、二甲胺、三甲胺、乙胺为气体;中级胺为液体;高级胺为 固体。 2. 气味:气体胺和具有挥发性液体胺具有类似氨的气味;三甲胺、六氢吡啶有 鱼 类腐败气味;芳香胺气味较淡,但其毒性较大,某些芳胺可致癌。 3. 沸点:伯、仲胺有N-H键,分子间形成氢键(但比O-H键所形成的氢键弱). 所以分子量相近的醇、胺、烃的沸点顺序为:醇>1°胺>2°胺>3°胺>烷烃。 4. 溶解度:由于胺与水形成氢键,较低相对分子质量的胺都易溶于水。 5. 分子极性:胺具有中等极性,脂肪胺与芳香胺偶极矩大小相近,方向相反。
CH3
NH2
2-甲基-4-氨基戊烷
C6H3C5H2C4H2C3 H-C2 H-C1H3 CH3 N(CH3)2
3-甲基-2-(N,N-二甲氨基)己烷
(3)季铵盐、季铵碱:按“铵”衍生物
(CH3)4N+Br-
[(CH3)3NC2H5]+Cl-
[CH3NH2C2H5]+OH-
溴化四甲铵
氯化三甲基乙基铵
氢氧化甲乙铵
R2NH
CH3COOH
在有机合成中用于保护氨基(实例见P393)。
八. 磺酰化反应(Hingsberg,兴斯堡反应)
伯胺、仲胺在碱性溶液中能与磺酰化试剂反应,生成相应的磺酰胺。
SO2Cl
SO2Cl
磺酰化试剂: ,
【有机化学】胺 Amine

非对映体
HCl
有机胺(+)
有机胺(-)
四. 胺的酸性 氨,伯胺和仲胺分子中的N-H 键可以电离,因此它们都有很弱的
酸性。其酸性相当于甲苯分子中甲基上的氢。氨和胺的共轭碱 RNH2-, RNH- 和R2N- 则是很强的碱。
胺,酰胺和酰亚胺中的N-H的酸性有什么差别?为什么?
CH3 H3C CH
NH + n-C4H9Li THF
(2) 当叔胺-N-氧化物上的一个烃基上有两种β-氢时, 产物为混合物,但一般以霍夫曼(Hofmann)烯烃为主。
五. 芳胺的亲电取代反应
1. 卤化
NH2
(CH3CO)2O
NHCOCH3 Br2, CH3CO2H
NHCOCH3 Br
CH3
Br2, H2O
NH2
Br
Br
CH3
CH3
1) HCl, H2O
CH3
SO2NR NaOH, H2O RR'NH
R'
对甲苯磺酰基把伯胺中氮原子上的一个价占据了, 只留下一个可供
取代的氢,烃化和水解后可以得到仲胺。
RC
N 1) (CH3)3COH, H+ 2) H2O
O RCNHC(CH3)3 NaOH, H2O (CH3)3CNH2
氮原子上三个价都占据了,只留下亲核的孤电子对,烃化后水解,
+RNH3 + OH
一. 脂肪胺的碱性:
1. 产生碱性的原因:N 上的孤对电子 2. 判别碱性的方法:形成胺正离子的稳定性 3. 影响碱性强弱的因素: 电子效应:烷基是推电子的,推论: 气相中 3º胺 > 2º胺> 1º胺 > 氨 溶剂化效应: 形成铵盐的溶剂化作用越大,其稳定性越好,胺的碱
简述胺的化学性质。

引言概述:胺是一类常见的有机化合物,具有重要的化学性质。
本文将从胺的结构、性质以及应用等方面进行详细探讨,希望能为读者提供全面的了解。
正文内容:一、胺的结构1.胺的一般结构特点2.长链胺和短链胺的结构区别3.脂肪胺与芳香胺的结构差异二、胺的物理性质1.胺的气味特征及相关反应2.胺的溶解性和蒸汽压3.胺的密度和沸点随碳链长度的变化三、胺的化学性质1.胺的碱性及其与酸的反应2.胺的酸性及其与碱的反应3.胺的氧化性反应4.胺的亲电性反应5.胺的求电子性反应四、胺的应用1.胺作为重要溶剂的应用2.胺作为表面活性剂的应用3.胺作为螯合剂的应用4.胺作为催化剂的应用5.胺作为医药及农药中的应用五、胺的特殊性质1.胺的亲核取代反应2.胺的氢键作用3.胺的配位性质4.胺的键能及其影响因素5.胺的空间构型和活性总结:胺作为一类重要的有机化合物,具有丰富的化学性质。
本文从胺的结构、物理性质、化学性质及其应用等方面进行了详细的阐述。
通过对胺的研究,我们可以更深入地了解胺在化学领域的作用以及其在其他领域的应用前景。
希望本文对读者对胺的化学性质有所帮助。
引言概述:胺是一类具有氨基基团(NH2)的有机化合物,它们是氨分子上一个或多个氢原子被有机基取代而形成的化合物。
胺分子的化学性质包括它们的酸碱性、氧化性、还原性以及它们在化学反应中的活性。
正文内容:一、胺的酸碱性1.胺是碱性物质,氨分子能够接受质子形成胺的盐酸盐。
2.胺可以与酸反应胺盐,这是因为氨基团上的孤对电子能够与酸中的质子形成离子键。
二、胺的氧化性1.一些胺具有氧化性,可以被氧化剂氧化成氧化胺。
2.例如,苯胺可以被过氧化氢氧化成苯酚。
三、胺的还原性1.胺具有还原性,它们可以将其他物质还原成较低的氧化态。
2.例如,亚硝胺可以还原成胺,同时氮氧键被还原成氮氢键。
四、胺的化学反应活性1.胺具有亲电性,可以发生亲电取代反应。
2.胺与酰氯、醛和酮等电子不足的化合物反应,酰胺、亚胺和烯胺等化合物。
胺的化学性质
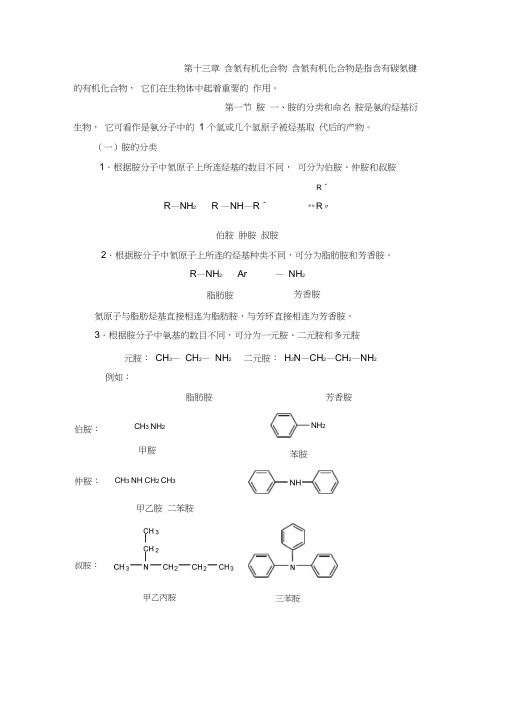
伯胺:CH3 NH2甲胺仲胺:CH3 NH CH2 CH3第十三章含氮有机化合物含氮有机化合物是指含有碳氮键的有机化合物,它们在生物体中起着重要的作用。
第一节胺一、胺的分类和命名胺是氨的烃基衍生物,它可看作是氨分子中的1 个氢或几个氢原子被烃基取代后的产物。
(一)胺的分类1.根据胺分子中氮原子上所连烃基的数目不同,可分为伯胺、仲胺和叔胺R′R—NH2 R —NH—R′R N R″伯胺肿胺叔胺2.根据胺分子中氮原子上所连的烃基种类不同,可分为脂肪胺和芳香胺。
R—NH2 Ar —NH2脂肪胺氮原子与脂肪烃基直接相连为脂肪胺,与芳环直接相连为芳香胺。
3.根据胺分子中氨基的数目不同,可分为一元胺、二元胺和多元胺芳香胺元胺:CH3—CH2—NH2二元胺:H2N—CH2—CH2—NH2例如:脂肪胺芳香胺NH2苯胺叔胺:甲乙胺二苯胺甲乙丙胺三苯胺请注意:伯胺、仲胺、叔胺与伯醇、仲醇、叔醇的区别,胺是根据氮原子上 所连烃基数目来分为伯胺、 仲胺、 叔胺,而醇则是根据羟基所连的烃基来分为伯 醇、仲醇、叔醇。
例如:(二)胺的命名1.简单的胺以胺为母体,按烃基的名称称为某胺。
例如:2.仲胺和叔胺的氮原子上连的烃基相同时,用二或三标明烃基的数目,写在烃基名称前;烃基不同时,从简单到复杂依次写出烃基的名称。
例如:甲乙丙胺3.芳香仲胺和叔胺的氮原子上连有烃基时,以芳香胺为母体,在烃基前标上“ N-”,以区别连接在芳环上的烃基。
例如:4.多元胺可参照多元醇命名,二元胺称为某二胺。
例如:H 2N —CH 2—CH 2—NH 2 H 2N —CH 2—CH 2—CH 2—CH 2—NH 25.对于结构复杂的胺,则以烃为母体,氨基用为取代基命名。
例如:CH 3CH 3 C NH 232CH 3伯胺CH 33CH3 C OH3CH 3叔醇CH 3 NH 2CH 3 CH 2 CH 2NH 2甲胺丙胺CH 3)2NHCH 3CH 2)3N二甲胺 三乙胺CH 3 NH CH 2 CH 3( C 6H 5) 3N三苯胺CH 3 CH 2CH 3 N CH 2 CH 2 CH 3甲乙胺CH 3CH 2CH 3N , N-二甲基苯胺N- 甲基 -N- 乙基苯胺乙二胺1 ,4- 丁二胺NHCH 3N-甲基苯胺N ( CH 3)2CH 3 CH 3CH 3CHCHCHCH 3H 2NCOOHNH 22,4- 二甲基 -3-氨基戊烷对胺基苯甲酸学生思考:胺和醇的结构与命名的异同点。
第十章 胺

但与湿的氧化银作用可转变为氢氧化四烃基铵(季铵碱)。
2(CH3)4N+Br-+Ag2O H2O (CH3)4N+OH-+2AgBr
⑶酰基化反应
氨、伯胺或仲胺与酰基化试剂(如乙酸酐、 乙酰氯)作用, 酰基取代氨基上的氢原子, 生成N-烷基酰胺或N,N-二烷基酰胺
叫做胺的酰基化反应。
O
R C Cl
or + R'NH2
根据N上所连 烃基的数目 R3N
3°胺 (叔胺)
R'''
R N R'' X
R4N + 4°胺 (季铵)
R' R''' R N R'' OH R'
季铵盐 季铵碱
根据N上所连 烃基的种类
脂肪胺
CH3NH2
芳香胺
NH2
芳脂胺
CH2NH2
根据分子中 氨基的数目
一元胺 多元胺
CH3CH2NH2 乙胺
(脂 肪 胺 , 一 元 胺 )
重氮化反应
芳香族仲胺与亚硝酸作用生成N-亚硝基胺。
+ (CH3)2NH NaNO2 + HCl
(CH3)2N N O + H2O + NaCl
N-亚硝基二甲胺
NHCH3 + NaNO2 + HCl
⑵烷基化反应
卤代烷与氨作用生成伯胺,该反应为卤代烷 的氨解。
生成的伯胺可以继续与卤代烷反应生成仲胺、 叔胺以及季铵盐。
NH3
C2H5I C2H5I
C2H5NH2
乙胺
(C2H5)3N
C2H5I C2H5I
(C2H5)2NH
胺

三、磺酰化 *
伯胺或仲胺与磺酰化剂作用,生成相应的芳磺酰胺 伯胺或仲胺与磺酰化剂作用,生成相应的芳磺酰胺: 芳磺酰胺
溶于碱
N-烷基 苯磺酰胺 烷基-苯磺酰胺 烷基
不溶于碱,固 不溶于碱 固 体析出
叔胺不发生磺酰化反 不溶于碱,蒸馏分 应 ,不溶于碱 蒸馏分 不溶于碱 离
N,N-二烷基 对甲基苯磺酰胺 二烷基-对甲基苯磺酰胺 二烷基 分离、鉴别伯、仲、叔胺。 分离、鉴别伯、 叔胺。
如发生在这 也一样
CH 3
NH 2
(2)若取代基是吸电子基团 碱性降低,如: 碱性降低, )若取代基是吸电子基团—碱性降低
例如: 例如:比较下列化合物碱性大小 供电子基团
NH-CH3
NO2
吸电子基团
NH-COCH3
O
NH2
>
>
>
O
NH
二、酰化反应 (1) 伯胺、仲胺与酰基化试剂 酰氯 酸酐 发生酰基化 伯胺、仲胺与酰基化试剂(酰氯 酸酐)发生酰基化 酰氯,酸酐 反应,生成 烷基(代 酰胺 生成N-烷基 酰胺: 反应 生成 烷基 代)酰胺
相应于氢氧化铵和铵盐的四烃基取代物,分别称为 相应于氢氧化铵和铵盐的四烃基取代物, 季铵碱和季铵盐: 季铵碱和季铵盐:
胺的习惯命名法: 胺的习惯命名法: 习惯命名法 (1) 在“胺”之前加烃基来命名 之前加烃基来命名; (2) 对仲胺和叔胺 当烃基相同时 在前面标出数目 对仲胺和叔胺,当烃基相同时 在前面标出数目; 当烃基相同时,在前面标出数目 (3) 当烃基不同 按次序规则“较优”的基团放在后面 当烃基不同,按次序规则 较优”的基团放在后面 按次序规则“ 后面:
四、 与亚硝酸的反应 由于亚硝酸不稳定,一般用亚硝酸钠与盐酸(或硫 由于亚硝酸不稳定,一般用亚硝酸钠与盐酸( 代替亚硝酸: 酸)代替亚硝酸 伯胺与亚硝酸反应 生成脂肪族重氮盐, (1)脂肪族伯胺与亚硝酸反应 )脂肪族伯胺与亚硝酸反应——生成脂肪族重氮盐, 生成脂肪族重氮盐 易分解: 易分解: 作为氨基的定量测定
【有机化学】胺

分子结构中含有碳氮键(C-N)的一类化合物。 广泛分布于自然界中,与日常生活及生命过程密 切相关,在生命科学中占有及其重要的地位 。
1
含氮有机物
硝基化合物 腈
肟 酰胺
胺 Amines 重氮和偶氮化合物 Diazonium Salts & Azo compounds
2
第一节 胺
一、胺的结构、分类和命名 NH3分子中的氢原子被烃基所取代的衍生物。
17
3.与苯磺酰氯反应(兴斯堡反应 Hinsberg )
苯磺酰氯如同酰氯一样能与伯胺、仲胺反应,生 成难溶于水的苯磺酰胺。 苯磺酰氯可用来鉴别伯、仲、叔三种胺。
伯胺所生成的苯磺酰胺
因氮原子上还连一个活 泼的氢原子,它在碱性溶 液中能生成可溶性的盐
叔胺因分子中氮原子 上不连氢原子,所以 与苯磺酰氯不反应
1.5
423.0
3.0
2
329.0
9.0
3
357.0
5.0
5
304.0
3.0
8
286.0
197.0
15
239.0
1842.0
24
286.0
2820.0
24
贮存蔬菜中亚硝酸盐含量的变化(mg/Kg)
贮存时间
亚硝酸盐含量
新鲜
0.00
2天
0.42
4天
1.10
6 天(开始腐烂) 6.70
8 天(完全腐烂) 146.0
H+
R NH2 + HNO2
R OH + H2O + N2
用于伯胺的定量分析 产物复杂,无制备意义
低温条件下,芳香伯胺在强酸性溶液中与亚硝酸 反应,生成芳香重氮盐,该反应称为重氮化反应
有机化学基础知识点整理胺的分类与性质

有机化学基础知识点整理胺的分类与性质胺是一类含有氨基(-NH2)基团的有机化合物,在有机化学中有着重要的地位。
本文将对胺的分类和性质进行整理,以帮助读者更好地理解和应用有机化学中的胺类化合物。
一、胺的分类胺可以分为三类:一级胺、二级胺和三级胺。
分类根据胺分子中氨基的数量来进行区分。
1. 一级胺:一级胺分子中含有一个氨基(-NH2)基团。
例如,乙胺(CH3CH2NH2)就是一级胺的例子。
2. 二级胺:二级胺分子中含有两个氨基(-NH2)基团。
例如,二甲胺(CH3NHCH3)就是一个典型的二级胺。
3. 三级胺:三级胺分子中含有三个氨基(-NH2)基团。
例如,三乙胺((CH3CH2)3N)就是一种常见的三级胺。
二、胺的性质1. 碱性:胺是碱性物质,因为它们可以接受质子(H+),生成相应的盐(如胺盐)。
这是由于胺分子中的氨基具有碱性,并且能够与酸反应形成盐类。
2. 水溶性:较短的一级和二级胺在水中具有较好的溶解性。
但是,随着分子量的增加,水溶性会降低。
3. 气味:一些低分子量的一级和二级胺具有刺激性的氨臭味。
例如,甲胺(CH3NH2)的气味类似于氨水。
4. 反应性:胺具有与其他化合物发生多种反应的特性,如取代反应、酰化反应、胺化反应等。
这些反应使得胺在有机合成中具有广泛的应用。
三、应用举例1. 生物学应用:胺在生物学中有重要的应用,例如作为生物碱、神经递质和抗组胺药物等。
2. 有机合成:胺在有机合成中广泛应用,可用于合成氨基酸、药物、染料等有机化合物。
3. 金属提取剂:一些胺类化合物在金属提取过程中具有重要的作用。
总结:通过对有机化学基础知识点整理的胺的分类与性质的讨论,我们了解到胺是有机化学中的重要化合物,具有碱性、水溶性和多种反应性。
其在生物学、有机合成和金属提取等领域都有广泛应用。
对于有机化学学习者来说,掌握胺的分类和性质是理解和应用胺类化合物的基础。
“氨”、“铵”、“胺”有什么区别(图)

“氨”、“铵”、“胺”有什么区别(图)
1.读音不同、字形不同
“氨”读音;“铵”读音;“胺”读音。
2.概念不同
氨是氮和氢的一种化合物,分子式为NH3,分子结构呈三角锥形,电子式为,其中氮原子有一对孤对电子,结构式为。
铵是从氨衍生所得的带一个单位正电荷的离子,化学式为NH4+,电子式为,其中氮氢原子间形成了一条配位键,结构式为。
但四个N-H键的键长、键能、键角完全相同,离子的空间构型为正四面体型。
胺是氨的氢原子被烃基代替后的有机化合物。
氨分子中的一个、两个或三个氢原子被烃基取代而生成的化合物,分别称为第一胺、第二胺和第三胺。
它们的通式为:RNH2——伯胺、R2NH——仲胺、R3N——叔胺。
3.性质不同
氨是一种无色、有臭味的气体,易溶于水。
氨能够单独存在。
铵相当于正一价金属阳离子,凡是含NH4+的盐叫铵盐。
NH4+不能单独存在,只能在铵盐或氨水中与阴离子共存。
胺类广泛存在于生物界,具有极重要的生理作用。
因此,绝大多数药物都含有胺的官能团——氨基。
蛋白质、核酸、许多激素、抗生素和生物碱,都含有氨基,是胺的复杂衍生物。
第十章 胺

R2NH
2°胺 (仲胺) 3°胺 (叔胺)
R ''' R N R' R '' X
季铵盐
根据N上所连 烃基的数目 R3N
R4N + 4°胺 (季铵)
R''' R N R' R'' OH
季铵碱
脂肪胺
CH3NH2
根据N上所连 烃基的种类
ห้องสมุดไป่ตู้
芳香胺
NH2
芳脂胺
CH2NH2
一元胺
根据分子中 氨基的数目
多元胺
C H C H N H 3 2 2 乙胺
N
NHSO 4
苯重氮氨基苯
苯重氮硫酸盐
(留氮反应) ※ 2.偶联反应
定义: 在低温弱酸、弱碱或中性溶液中, 芳香重氮盐 与芳胺或酚作用生成有色的偶氮化合物的反应。 例:
N C l 2
+-
+
H O A c N ( C H ) 3 3 N a O A c
NN
ANNB 偶氮化合物: A:重氮盐(亲电试剂)称重氮组分
叔胺>仲胺>伯胺>氨
但空间效应
烷基数目的增加,占据了氮原子外围更多的空间, 使质子难于与氮原子接近。使胺的碱性降低。 伯胺>仲胺>叔胺
两种效应综合作用的结果:
仲胺>伯胺>叔胺
※脂肪族胺碱性都比氨强。
(CH3)2NH > CH3NH2 > (CH3)3N > NH3 > 芳香胺 ?
:
※※其碱性按大小顺序排列如下:
(CH3)2NH > CH3NH2 > (CH3)3N > NH3 >芳香胺
胺

编辑本段释义
胺:[àn][ㄢˋ] 郑码:QWZM,U:80FA,GBK:B0B7 五笔:EPV 笔画数:10,部首:月,笔顺编号:3511445531 参考词汇: amic amine 氨分子中的氢被烃基取代而生成的化合物。
编辑本段分类
按照氢被取代的数目,依次分为一级胺(伯胺)RNH2、二级胺(仲胺)R2NH、三级胺(叔胺)R3N、四级铵盐(季铵盐)R4N+X-,例如甲胺CH3NH2、苯胺C6H5NH2、乙二胺H2NCH2CH2NH2、二异丙胺[(CH3)2CH]2NH、三乙醇胺(HOCH2CH2)3N、溴化四丁基铵(CH3CH2CH2CH2)4N+Br-。
编辑本段性质
胺具有碱性,在气相条件下氨比任何一种甲胺的碱性都弱得多,但在溶液中其碱性与三甲胺[1]相近,
胺
一甲胺和二甲胺的碱性较三甲胺约强10倍。
低级的胺是气体或易挥发的液体,气味与氨相似,有的有鱼腥味(鱼的腥味其实就主要来自三甲胺);高级的胺为固体;芳香胺多为高沸点的液体或低熔点的固体,具有特殊的气味。
胺的沸点比相对分子质量相似的非极性化合物高,比醇或羧酸的沸点低;叔胺的沸点比相对分子质量相近的伯胺和仲胺低。
胺是极性化合物。
低级胺易溶于水,胺可溶于醇、醚、苯等有机溶剂。
胺与酸作用易成盐。
在许多有机反应中,常把胺作为亲核试剂使用。
其反应活性通常随碱性的强弱而异,取代基的大小对反应活性的影响较大,位阻较大的胺反应活性降低,例如二异丙基乙基胺已完全不能与卤代烷发生作用。
此外,芳香胺的重氮化反应也是重要的有机反应之一。
胺的物理性质

季铵碱是一个强碱,其碱性与KOH相当,具有碱的一般通性, 如:能吸收空中的CO2,易潮解,易溶于水等。
季铵盐与季铵碱
季铵碱也不稳定,加热时也易分解,当烷基中无-H时,则分
解成叔胺和醇。
(CH3)4NOH
(CH3)3N + CH3OH
当烷基中有-H时,加热则分解成叔胺和烯烃。
(CH3)3NCH 2CH3 OH
CH2CN
乙腈
3-丁烯腈
丁二腈
苯乙腈(苄基腈)
腈(Nitrile)
2、腈的制备
(1)卤代烃取代法 RX + NaCN 乙醇 RCN + NaX
(2)酰胺脱水法
RCONH 2 P2O5 RCN + H2O
(3)乙炔加成法 CH CH + HCN
CH2 CHCN
(4)丙烯氨氧化法 CH2
CH3CH2CHCH3 OH N(CH3)3
CH3CH2CH CH2 + CH3CH CHCH3
主要产物
次要产物
但是,当烃基上带有吸电子基时,则主要方向是消除酸性较强 的-H。
CH3CH2N(CH3)2
OH
CH2CH2Br
CH2 CH2 + CH2 CHBr 次要产物 主要产物
霍夫曼消除反应
醇、烯、卤代烃等混合物
N2 + R + X
但脂肪重氮盐不稳定,即使低温下也会分解,放出N2气,生成 碳正离子,进而生成混合物,无制备意义,但能定量放出N2气, 因此,可用于定量分析和定性鉴别。
与亚硝酸反应
芳香伯胺生成的重氮盐在低温(<5℃)时能稳定存在,反应活性 较高,广泛应用于有机合成中。
第十七章 胺.ppt

(3)当氮与三个不同基团相连时,有一对对映体。
R3
R3
N R2
R1
N
R2 R1
E = 25.104kJ/mol
CH3
+
C6H5 N C2H5
CH2CH=CH2
已拆分出一对对映体。
17.1.2 胺的命名 1.普通命名法:一元胺的命名以胺字表示官能团,再加上与氮原 子相连的名称和数目。
CH3NH2
CH3(CH2)9NH3+Cl-
水层 NaCl
17.3.4 手性胺的拆分 胺的外消旋体与一个旋光酸生成两个非对映体的盐,根据它们
的溶解度不同,可以用分布结晶的方法分离。 17.3.5 胺的酸性
胺的酸性很弱。
R2NH
R2N- + H+
氨和二乙胺的pKa分别为34和36,其酸性强度相当于甲苯分子中 甲基上的氢。但氨和胺的共轭碱NH2-、RNH-和R2N-则是很强的碱。
O N
O
NH2 + H+
O N
O
NH3
它不稳定,平衡偏向左边,使硝基苯胺的碱性降低。 在邻硝基苯氨分子中,硝基除了通过苯环与氨基共轭外,由于
与氨基靠近,硝基强烈的吸电子诱导效应,使碱性进一步降低。 而间硝基苯胺,硝基只通过诱导效应使胺的碱性降低。
NH2
NH2
NH2
NH2 NO2
pKa
4.58
NO2 2.47
O
N+ O
NO2
NO2
(1)
(2)
(2)比(1)的碱性强4万倍
具体分析时,既要考虑N上取代基的影 响,也要考虑苯环上取代基的影响。
分析: 对硝基苯胺分子,硝基、苯环和氨基形成共轭体系:
胺的名词解释是

胺的名词解释是胺是一类有机化合物,由于它们内部含有氮原子的一个或多个原子,所以其名称中都带有“氨”字样。
胺和氨类似,是一种碱性物质,它可以与酸反应生成盐类。
胺在化学及生物领域中有着广泛的应用,可以说是一个非常重要的化合物。
胺可以根据它们所含氮原子的化合价和状态分为三个主要类别:一价胺,二价胺和三价胺。
一价胺是一类具有一种氮原子的胺化合物。
最简单的一级胺是甲胺和乙胺,它们分别由一个氨基团和一个甲基或乙基团组成。
一级胺可以通过在氨基团上添加更多的碳原子来形成更复杂的分子结构。
一级胺在有机合成、杀虫剂、药物和涂料等领域有着广泛的应用。
二价胺是一类具有两个氮原子的胺化合物。
一种重要的二级胺是乙二胺,它由两个氨基团连接而成。
乙二胺常被用作溶剂和化学品中的中间体,还可以用于合成聚酰胺和染料等材料。
三价胺是一类具有三个氮原子的胺化合物。
一个典型的三级胺是三甲胺,它由三个甲基团和一个氨基团组成。
三级胺通常用作催化剂和表面活性剂。
它还可以用于生物医学领域,例如用于合成医药中间体和制备生物染料。
除了它们在化学和生物领域中的应用,胺还具有其他各种各样的用途。
例如,胺可以用作溶剂和去污剂,以帮助去除油漆、橡胶和脱胶剂的残留物。
此外,胺化合物还可以用于防锈剂、塑料添加剂和化妆品等产品的生产。
胺的特性和用途不仅仅局限于化学和生物领域。
近年来,人们对胺化合物的研究也扩展到环境科学和可持续发展领域。
胺作为含氮有机化合物的一种,它在大气中的存在与空气污染和温室气体排放有关。
因此,了解胺在大气中的循环和转化过程对于环境保护和气候变化研究具有重要意义。
总之,胺是一类重要的有机化合物,由于其在化学、生物、医学和环境等领域的广泛应用,它在科学研究和工业生产中起着不可或缺的作用。
了解胺的性质和用途对于深入理解有机化学和相关领域的发展具有重要意义。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH2CH3 CH3CH2-N-CH2CH3 OH CH2CH3
+
Tetraethylammonium bromide
Tetraethylammonium hydroxide
溴化四乙铵
氢氧化四乙铵
罗氏化学 出品
17.2 胺的结构
sp3
N H H
N H3C
105.9
o
H 杂化, (1) 氨和胺中的 是不等性的 sp3杂化,未共用电子 ) 氨和胺中的N是不等性的
N
CH3 CH2CH3
CH2NH2
H2NCH2CH2NH2
乙二胺
H2N(CH2)6NH2
甲(基)乙(基)环丙胺 基 乙 基 环丙胺
苯甲胺 苄胺
NH2 (CH3)2NCHCH2CH3 CH3
环己胺
二甲(基 仲丁 仲丁(基 胺 二甲 基)仲丁 基)胺
1,6-己二胺 己二胺
罗氏化学 出品
对于芳香族仲胺或叔胺, 则在取代基前面冠以“N”字, 以表示这个基团是连在氮上,而不是连在芳香环上
罗氏化学 出品Leabharlann Methamphetamine
IUPAC Name (2S)-N-methyl-1-phenyl-propan-2-amine
CAS Number
537-46-2
Chemical Formula
C10H15N
罗氏化学 出品
17.1
胺的分类
根据氮上取代基的数目,胺可分为一级 伯 , 根据氮上取代基的数目,胺可分为一级(伯),二 胺和四级(季 铵盐 铵盐。 级(仲),三级 叔)胺和四级 季)铵盐。 仲 ,三级(叔 胺和四级 RNH2
胺的分类
按氮原子连烃基数目,胺分为伯 、 按氮原子连烃基数目,胺分为伯(1º)、仲(2º)、叔(3º)胺。 、 胺 按分子中氨基的数目,胺分为一元胺、二元胺和三元胺。 按分子中氨基的数目,胺分为一元胺、二元胺和三元胺。 一元胺 NH3 氨 RNH2 伯胺(1 伯胺 º胺) 氨基: 氨基:-NH2
R R'
CH3CH2CHCH2CH2CH2CH3 NHCH2CH3 CH3CH2CHCHNHCH3 H3C CH3
3-(N-乙氨基 庚烷 乙氨基)庚烷 乙氨基
NH2 CH2CH2CHCH3
O NH
3-甲基 甲基-2-(N-甲氨基 戊烷 甲氨基)戊烷 甲基 甲氨基
1-苯基 氨基丁烷 苯基-3-氨基 苯基 氨基丁烷
NH
仲胺(2 仲胺 º胺) 亚氨基: 亚氨基:-NH-
R R' N R'' 叔胺(3 叔胺 º胺)
四个相同或不同烃基与氮原子相连的化合物称为季胺化合物 四个相同或不同烃基与氮原子相连的化合物称为季胺化 季胺 其中R 称为季胺盐 季胺盐, 称为季胺碱 季胺碱。 其中 4N+X-称为季胺盐,R4N+OH-称为季胺碱。
CHOHCHCH3 NHCH3
N CH3
H OOCCH
L-麻黄碱(1R,2S)
CH3 H NHCH3 H OH ph
阿托品
D-(-)-麻黄素 麻黄素
CH2OH
罗氏化学 出品
H3C
N COOCH3 O O C
可卡因
CH3 CCNHCH3 OH
麻黄碱
CH3 CH2CHNHCH3
H C OH
N-甲基苯异丙胺
碘化四异丙铵
罗氏化学 出品
3. 胺盐和四级铵化合物的命名: 胺盐和四级铵化合物的命名:
CH3NH2 HCl methylamine hydrochloride
甲胺盐酸盐
CH2CH3 CH3CH2-N-CH2CH3 Br CH2CH3
+
CH3CH2NH2 HOAc ethylamine acetate
即把氨基作取代基,以烃或其它官能团作为母体。 即把氨基作取代基,以烃或其它官能团作为母体。
CH3 CH3 CH CH2 CH NH2 CH2 CH3
2-甲基 氨基己烷 甲基-4-氨基己烷 甲基
CH3 CH CH CH3
CH3 NH2
2-甲基 氨基丁烷 甲基-3-氨基丁烷 甲基
罗氏化学 出品
烃或其它官能团为母体,氨基作取代基。 复杂胺 烃或其它官能团为母体,氨基作取代基。
一级(伯)胺 一级 伯 胺
R2NH
二级(仲)胺 二级 仲 胺
R3N
三级(叔)胺 三级 叔 胺
R4N+X四级(季)铵盐 四级 季 铵盐
R4N+OH四级铵碱
根据烃基的不同,胺可分为脂肪胺和芳香胺。 根据烃基的不同,胺可分为脂肪胺和芳香胺。 CH3CH2NHCH3CH2CH3 脂肪胺 ArNH2 芳香胺
罗氏化学 出品
氯化苯铵 氯化苯铵
(CH3)3N+CH2C6H5Br-
硫酸二乙铵 硫酸二乙铵
(CH3)3N+CH2CH3OH-
溴化三甲苄铵 溴化三甲苄铵
[(CH3)2CH]4N+ICH3
氢氧化三甲乙铵 氢氧化三甲乙铵
CH2CH2OH N CH3 OH CH3
+ -
氢氧化(2-羟乙基 氢氧化 羟乙基) 羟乙基 三甲铵(俗名胆碱 三甲铵 俗名胆碱) 俗名胆碱
CH3 CH3NH2 methylamine aniline NH2 N CH2CH3
cyclopropylethylmethylamine
甲胺
苯胺
甲基乙基环丙胺
罗氏化学 出品
2. IUPAC命名法: 命名法: 命名法
CH3 CH3NH2 methylamine H3C N C2H5 N-ethyl-N,4-dimethylbenzenamine
罗氏化学 出品
1923年,当K.K.陈和 .F.施密特在北京协和医院 年 当 . .陈和C. . 进行一系列中草药研究时,发现中药“麻黄” 进行一系列中草药研究时,发现中药“麻黄”具有明显的 心血管作用,而且确认其有效成分是麻黄素。 心血管作用,而且确认其有效成分是麻黄素。 后来他们才知道,早在1887年,这一物质就被日本科 后来他们才知道,早在 年 学家Yamanashi分离并合成。 分离并合成。 学家 分离并合成 苯丙胺,或叫2一苯基一异丙胺首先于 一苯基一异丙胺首先于1887年投入生, 年投入生, 苯丙胺,或叫 一苯基一异丙胺首先于 年投入生 而后又于1919年合成甲基苯丙胺。 年合成甲基苯丙胺。 而后又于 年合成甲基苯丙胺 直到1927年,苯丙胺类的精神药理学作用才首次被描 直到 年 年发现其兴奋作用, 述,1933年发现其兴奋作用,1935年有人用来治疗发作性 年发现其兴奋作用 年有人用来治疗发作性 睡病,后又用来治鼻充血和哮喘,巴金森氏病等。 睡病,后又用来治鼻充血和哮喘,巴金森氏病等。 上市后跑长途的卡车司机用它来保持清醒, 上市后跑长途的卡车司机用它来保持清醒,也用于精 神不振者提神,还作为一种“觉醒剂”治疗忧郁症等。 神不振者提神,还作为一种“觉醒剂”治疗忧郁症等。 第二次世界大战中,日军, 德军用甲基苯丙胺注射, 第二次世界大战中,日军 德军用甲基苯丙胺注射, 为的就是提高士气,增加作战效率。 为的就是提高士气,增加作战效率。 战后苯丙胺便出现在日本市场上,无论学生、工人, 战后苯丙胺便出现在日本市场上,无论学生、工人, 甚至文化界人士、作家均广泛使用它且至今仍未平息。 甚至文化界人士、作家均广泛使用它且至今仍未平息。
罗氏化学 出品
CF3 NH2
CF3 2,5-bis(trifluoromethyl)benzenamine
2,5-双(三氟甲基 苯胺 双 三氟甲基 三氟甲基)苯胺
罗氏化学 出品
胺的命名
简单胺: 简单胺:用“胺”作官能团, 作官能团, 把它所含烃基的名称和数目写在前面, 把它所含烃基的名称和数目写在前面, 按简单到复杂先后列出,后面加上“ 按简单到复杂先后列出,后面加上“胺”字
第 17 章
胺
罗氏化学 出品
17.1 胺的分类 17.2 胺的结构 17.3 胺的物理性质 胺的反应
本 章 提 纲
17.4 胺的成盐反应 四级铵盐的应用 17.5 四级铵碱和霍夫曼消除反应 17.6 胺的酰化、兴斯堡反应 胺的酰化、 17.7 胺的氧化和科普消除 17.8 胺与亚硝酸的反应出品 重氮甲烷 罗氏化学 17.9
HO HO
CH2NHCH3
肾上腺素
罗氏化学 出品
罗氏化学 出品
“冰毒”即脱氧麻黄碱methamphetamine,为甲基苯丙胺的 一种,属某丙胺系列的效力强大的兴奋剂。因其形状呈白色 透明结晶体,与普通冰块相似,故又被称之为“冰”ice,亦 称为“艾斯”。 “冰毒”为1919年首先由一名日本化学家研制合成, 1947年开始应用于临床,通过口服或静脉注射,作为中 枢神经兴奋药或用于治疗麻醉药过量、精神抑郁症及发作性 睡眠等,亦被用作遏止食欲药以治疗肥胖症。 由于"冰毒"可消除疲劳,使人精力旺盛,故在第二次世 界大战期间,在日本曾被广泛用于疲惫的士兵和弹药厂的工 人提神。大战结束后,"冰"已成为日本最为流行的毒品。
H3C NHCH3 N CH3 H3C N CH2CH3
N-甲基苯胺 甲基苯胺
N,N-二甲基苯胺 二甲基苯胺
N-甲基 乙基 苯胺 甲基-N-乙基 甲基 乙基-苯胺
罗氏化学 出品
当氮原子同时连有芳基和脂肪基时,氮上脂肪基用N 当氮原子同时连有芳基和脂肪基时,氮上脂肪基用N定位 命名时必须在芳胺名称前面加字母“ 。 命名时必须在芳胺名称前面加字母“N”。
H 112.9oH
对占据一个sp 杂化轨道。 对占据一个 3杂化轨道。 上连接基团的不同, (2) 随着 上连接基团的不同,键角大小会有改变。 ) 随着N上连接基团的不同 键角大小会有改变。
罗氏化学 出品
都是脂肪族烃基时, 脂肪胺。 当R、R’和R’’都是脂肪族烃基时,为脂肪胺。 、 和 都是脂肪族烃基时 当其中一个是芳基时, 芳香族胺。 当其中一个是芳基时,为芳香族胺。 脂肪胺: 脂肪胺: (CH3)3C—NH2 叔丁基胺(伯胺) 叔丁基胺(伯胺) 伯胺
