1-4方程式默写
初中数学方程式默写版(全)

初中数学方程式默写版(全)本文档为初中数学方程式的默写版,旨在帮助学生们复和巩固数学方程的相关知识。
以下是方程的默写内容:1.一元一次方程定义:只含有一个未知数的一次方程。
示例:2x + 3 = 72.一元一次方程的解法移项法:将含有未知数的___到方程的一边,常数项移到另一边。
示例:4x + 2 = 14,解为:x = 33.一元一次方程的应用示例:已知一个饭店费用公式为5元/人加上固定费用30元,求6人就餐的总费用。
方程为:总费用 = (饭店费用/人) ×人数 + 固定费用解为:总费用 = (5 × 6) + 30 = 60元4.一元二次方程定义:含有一个未知数的二次方程。
示例:2x^2 + 3x + 1 = 05.一元二次方程的解法因式分解法:将方程进行因式分解并令每个因式等于零,求解得到未知数的值。
示例:x^2 + 5x + 6 = 0,因式分解为(x + 2)(x + 3) = 0,解为:x = -2 或 x = -36.一元二次方程的判别式判别式:Δ = b^2 - 4ac,其中a、b、c分别为方程中各项的系数。
若Δ。
0,则方程有两个不相等的实数根。
若Δ = 0,则方程有一个实数根。
若Δ < 0,则方程无实数根。
7.一元二次方程的应用飞机起落:飞机起飞时,起飞距离y与起飞速度v的关系符合一元二次方程y = ax^2 + bx + c。
根据需要,可求解出a、b、c的值,从而确定飞机起飞的最小速度和起飞距离。
以上是初中数学方程式的默写内容。
希望这份文档能帮助你更好地理解和记忆数学方程的相关知识。
如有任何疑问,请随时向我提问。
初中化学上下册默写化学方程式资料

化学《上册》必须过关的化学方程式1.实验室制取二氧化碳(必须熟记)________________________________________________2.二氧化碳使石灰水变浑浊(必须熟记)____________________________________________3.二氧化碳与水反应______________________________________________________________4.碳酸不稳定分解________________________________________________________________5.一氧化碳燃烧__________________________________________________________________6.一氧化碳还原氧化铜____________________________________________________________7.一氧化碳还原氧化铁____________________________________________________________8.甲烷燃烧______________________________________________________________________9.酒精燃烧_____________________________________________________________________10.实验室制取氢气_______________________________________________________________11.生石灰(氧化钙)与水反应_____________________________________________________12.氢气燃烧_____________________________________________________________________13.镁条与稀盐酸反应_____________________________________________________________14.红磷(或白磷)燃烧___________________________________________________________15.木炭还原氧化铜_______________________________________________________________16.木炭还原氧化铁_______________________________________________________________17.木炭还原四氧化三铁___________________________________________________________18.木炭还原二氧化碳_____________________________________________________________19.木炭燃烧(氧气充足)_________________________________________________________20.木炭不完全燃烧(氧气不充足)_________________________________________________21.实验室制氧气(三个化学方程式必须熟记)(1)分解过氧化氢______________________________________________________________ (2)加热氯酸钾________________________________________________________________ (3)加热高锰酸钾______________________________________________________________22.电解水______________________________________________________________________23.氢气还原氧化铜______________________________________________________________24.氢气还氧化铁________________________________________________________________25.铁与硫酸铜反应______________________________________________________________26.镁条燃烧____________________________________________________________________27.硫燃烧______________________________________________________________________28.铁丝燃烧____________________________________________________________________初中化学<下册>必须熟记的化学方程式1.金属单质+ 酸---盐+ 氢气(1)锌和稀硫酸: _______________________ (2)铁和稀硫酸: __________________________ (3)镁和稀硫酸: _______________________ (4)铝和稀硫酸:___________________________(5)锌和稀盐酸:________________________ (6)铁和稀盐酸: __________________________ (7)镁和稀盐酸: _______________________ (8)铝和稀盐酸: __________________________2.金属单质+ 盐(溶液) -----另一种金属+ 另一种盐(1)铁和硫酸铜溶液反应:_____________________________________(2)铜和硝酸银溶液反应:_____________________________________3.金属(碱性)氧化物+ 酸------盐+ 水(1)氧化铁和稀盐酸反应:_____________________________________(2)氧化铁和稀硫酸反应:_____________________________________(3)氧化铜和稀盐酸反应:_____________________________________(4)氧化铜和稀硫酸反应: ____________________________________4.非金属(酸性)氧化物+ 碱------盐+ 水(1)烧碱暴露在空气中变质(与空气中的CO反应): __________________________________ 2(2)苛性钠(烧碱、火碱)吸收二氧化硫气体: _______________________________________(3)苛性钠(烧碱、火碱)吸收三氧化硫气体: _______________________________________(4)熟石灰(消石灰)在空气中变质(与空气中的CO反应):___________________________ 25.酸+ 碱-----盐+ 水(1)盐酸和烧碱反应:____________________________________________(2)盐酸和氢氧化铝反应(治疗胃酸过多):_________________________________________(3)盐酸和氢氧化镁反应(治疗胃酸过多):_________________________________________(4)硫酸和烧碱反应:____________________________________________其他:(1)二氧化碳与水反应:______________________________(2)生石灰与水反应:________________________________化学《上册》必须过关的化学方程式答案1.实验室制取二氧化碳CaCO+2HCl=CaCl+HO+CO↑23222.二氧化碳使石灰水变浑浊CO+Ca(OH)=CaCO↓+HO22323.二氧化碳与水反应CO+HO=HCO 32224.碳酸不稳定分解HCO= HO +CO↑2223点燃= 2CO5.一氧化碳燃烧2CO+O22高温CO+CuO = Cu+CO6.一氧化碳还原氧化铜2高温= 2Fe+3CO7.一氧化碳还原氧化铁3CO+FeO223点燃O = CO+2H+2O8.甲烷燃烧:CH2224点燃O HOH+3O+3H = 2CO9.酒精燃烧C25222↑=ZnSO+H10.实验室制取氢气Zn+HSO2424 CaO + HO = Ca(OH)11.生石灰(氧化钙)与水反应22点燃O12.氢气燃烧2H + O = 2H222+ H↑13.镁条与稀盐酸反应Mg + 2HCl = MgCl22点燃4P + 5O =2PO14.红磷(或白磷)燃烧522高温15.木炭还原氧化铜2CuO+C = 2Cu+CO↑2高温O + 3C = 4Fe + 3CO↑16.木炭还原氧化铁2Fe322高温17.木炭还原四氧化三铁FeO↑+ 2C = 3Fe + 2CO432高温+ C = 2CO 木炭还原二氧化碳CO18.2点燃= CO19.木炭燃烧(氧气充足)C + O22点燃= 2CO 20.木炭不完全燃烧(氧气不充足)2C + O2 21.实验室制氧气(三个化学方程式必须熟记)MnO2= 2HOO + O↑)分解过氧化氢(12H2222 MnO2= 2KCl + 3O2KClO2()加热氯酸钾↑32△△MnO = K(3)加热高锰酸钾2KMnO + O↑+ MnO22442通电↑↑电解水22.2HO = 2H + O 222高温O 氢气还原氧化铜23.CuO + H = Cu + H22高温O Fe24.氢气还氧化铁+ 3HO = 2Fe + 3H2232 25. = Cu +FeSO铁与硫酸铜反应Fe + CuSO44点燃= 2MgO 2Mg + O镁条燃烧26.2点燃27.S + O = SO硫燃烧22点燃O3Fe +2O铁丝燃烧28. = Fe432.答案必须熟记的化学方程式下册>初中化学<1.金属单质+ 酸---盐+氢气(1)锌和稀硫酸: Zn + HSO = ZnSO + H↑(2)铁和稀硫酸: Fe + HSO = FeSO + H↑22422444(3)镁和稀硫酸: Mg +HSO=MgSO +H↑(4)铝和稀硫酸: 2Al +3HSO = Al(SO) +3H↑2242432442(5)锌和稀盐酸: Zn + 2HCl = ZnCl + H↑(6)铁和稀盐酸: Fe + 2HCl = FeCl + H↑2222(7)镁和稀盐酸: Mg + 2HCl = MgCl + H↑(8)铝和稀盐酸: 2Al + 6HCl = 2AlCl + 3H↑22232.金属单质+ 盐(溶液) -----另一种金属+ 另一种盐(1)铁和硫酸铜溶液反应:Fe + CuSO = FeSO + Cu 44(2)铜和硝酸银溶液反应:Cu + 2AgNO=Cu(NO) +2Ag2333.金属(碱性)氧化物+ 酸------盐+ 水(1)氧化铁和稀盐酸反应:FeO + 6HCl =2FeCl+ 3HO 223 3(2)氧化铁和稀硫酸反应:FeO+3HSO =Fe(SO)+ 3HO 22432234(3)氧化铜和稀盐酸反应:CuO + 2HCl = CuCl + HO 22(4)氧化铜和稀硫酸反应: CuO + HSO = CuSO + HO24424.非金属(酸性)氧化物+ 碱------盐+ 水(1)烧碱暴露在空气中变质(与空气中的CO反应): 2NaOH + CO = NaCO + HO 22322(2)苛性钠(烧碱、火碱)吸收二氧化硫气体: 2NaOH + SO = NaSO + HO 2223(3)苛性钠(烧碱、火碱)吸收三氧化硫气体: 2NaOH + SO = NaSO + HO2243(4)熟石灰(消石灰)在空气中变质(与空气中的CO反应):Ca(OH) + CO = CaCO↓+ HO 22322其他:(1)二氧化碳与水反应:CO + HO = HCO 3222(2)生石灰与水反应:CaO + HO = Ca(OH) 22。
沪教版九年级上册1-4章化学方程式

1—4章化学方程式一.化合反应1.镁带燃烧: 2Mg + O 2 ==== 2MgO2.铁丝燃烧: 3Fe + 2O 2 ==== Fe 3O 43.氢气燃烧: 2H 2 + O 2 === 2H 2O4.碳的燃烧:2C + O 2 ==== 2CO (不完全燃烧);C + O 2 === CO 2(完全燃烧)5.硫的燃烧:S + O 2 === SO 26.磷的燃烧:4P + 5O 2 === 2P 2O 57.浓盐酸与浓氨水相靠近:NH 3 + HCl == NH 4Cl8、二氧化碳与水反应: CO 2+ H 2O == H 2CO 39、一氧化碳的燃烧:2CO + O 2 == 2CO 2二.分解反应10.碳酸氢铵(碳铵)受热分解:NH 4HCO 3 NH 3↑+ CO 2↑+ H 2O 11.加热高锰酸钾制氧气: 2KMnO 4 K 2MnO 4 + MnO 2 + O 2↑ 12.二氧化锰催化双氧水制氧气:2H 2O 2 2H 2O + O 2↑ 13.电解水:2H 2O 2H 2↑+ O 2↑14.碳酸分解:H 2CO 3 == CO 2↑+ H 2O15、加热氯酸钾制取氧气:2KClO 32KCl + 3O 2↑ 三.其它反应16、硫酸铜溶液与氢氧化钠溶液反应:CuSO 4 + 2NaOH== Cu(OH)2↓+Na 2SO 417、二氧化碳与澄清石灰水反应:CO 2 + Ca(OH)2 == CaCO 3↓+ H 2O ;18、实验室制取二氧化碳:CaCO 3 + 2HCl == CaCl 2 + CO 2↑+ H 2O ; 点燃 点燃点燃 点燃 点燃 点燃 △ ===△ === 通电 === 点燃 MnO 2=== MnO 2 === △ 点燃。
九年级化学1-4章方程式整理

化学方程式整理1.加热高锰酸钾制氧气:2KMnO 4K 2MnO 4+MnO 2+O 2↑2.二氧化锰催化双氧水制氧气:2H 2O 22H 2O +O 2↑3.氯酸钾制氧气:2KClO 32KCl +3O 2↑4.实验室制二氧化碳:CaCO 3+2HCl ==CaCl 2+CO 2↑+H 2O5.澄清石灰水检验二氧化碳:CO 2+Ca(OH)2==CaCO 3↓+H 2O 6.电解水:2H 2O 2H 2↑+O 2↑7.氢气燃烧或爆炸:2H 2+O 2===2H 2O8.镁条燃烧:2Mg +O 2====2MgO 9.磷的燃烧:4P +5O 2===2P 2O 510.铁丝燃烧:3Fe +2O 2====Fe 3O 411.硫的燃烧:S +O 2===SO 212.碳的燃烧:2C +O 2====2CO (不完全燃烧);C +O 2===CO 2(完全燃烧)13.铜丝加热:2Cu +O 2===2CuO ;14.一氧化碳的燃烧:2CO +O 2===2CO 215.甲烷(天然气)的燃烧:CH 4+2O 2==CO 2+2H 2O16.二氧化碳与水反应:CO 2+H 2O ==H 2CO 317.碳酸受热分解:H 2CO 3CO 2↑+H 2O18.碳酸氢铵(碳铵)受热分解:NH 4HCO 3NH 3↑+CO 2↑+H 2O 19.碳酸钙高温煅烧分解:CaCO 3==CaO +CO 2↑20.氢氧化钠和硫酸铜反应:CuSO 4+2NaOH ==Cu(OH)2↓+Na 2SO 421.绿色植物光合作用:6CO 2+6H 2O ===C 6H 12O 6+6O 2点燃点燃点燃高温点燃点燃叶绿素△===MnO 2===通电===MnO 2===Δ点燃点燃△点燃△===△===点燃光照。
最新化学方程式默写(完整)

1.镁在空气中燃烧:_______________________________现象:发出耀眼白光,产生大量的热,生成白色粉末。
2.铁在氧气中燃烧:_______________________________现象:火星四射,产生大量的热,生成黑色固体。
3.铜在空气中受热:_______________________________现象:红色固体变黑。
4.氢气中空气中燃烧:_______________________________现象:发出淡蓝色火焰。
5.红磷在空气中燃烧:_______________________________现象:发出浓厚的白烟。
6.硫粉在空气中燃烧:_______________________________现象:发出明亮的蓝紫色火焰,生成有刺激性气味的气体。
7.碳在氧气中充分燃烧:______________________________现象:发出白光。
8.一氧化碳在氧气中燃烧:____________________________现象:发出蓝色火焰。
9.甲烷在空气中燃烧:_______________________________10.加热高锰酸钾:_______________________________11.高锰酸钾制氧:_______________________________反应类型:固固加热型12.过氧化氢分解反应:_______________________________反应类型:固液常温型气密性检查:橡皮管用止水夹夹住,往漏斗中加水,水柱不变,气密性良好。
13.水在直流电的作用下分解:__________________________注意事项:V正:V负=1:2(正氧负氢)m正:m负=8:1 14.生石灰溶于水:_______________________________现象:大量水汽产生,放出热量。
15.二氧化碳可溶于水:_______________________________现象:滴加紫色石蕊,试剂由紫变红。
化学1-4单元化学反应表达式
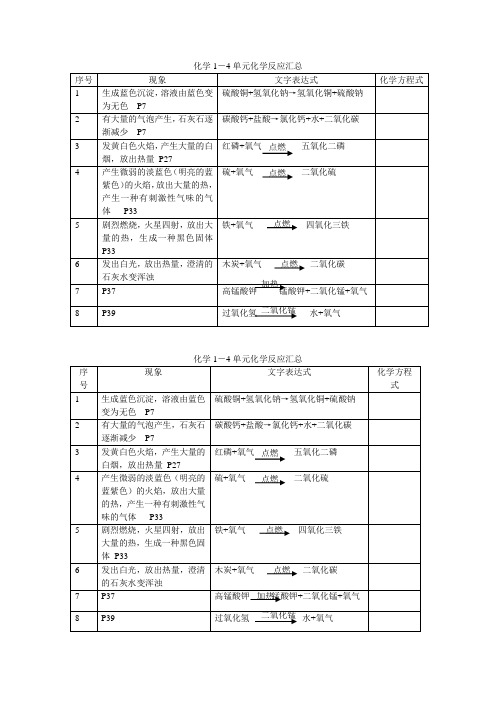
2
有大量的气泡产生,石灰石逐渐减少P7
点燃
碳酸钙+盐酸→氯化钙+水+二氧化碳
3
发黄白色火焰,产生大量的白烟,放出热量P27
点燃
红磷+氧气五氧化二磷
4
产生微弱的淡蓝色(明亮的蓝紫色)的火焰,放出大量的热,产生一种有刺激性气味的气体P33
点燃
硫+氧气二氧化硫
5
剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体P33
15
发耀眼的白光,放出热量,生成一种白色粉末状的固体p94
镁+氧气氧化镁
化学1-4单元化学反应汇总
序号
现象
文字表达式
化学方程式
9
P39
点燃
氯酸钾氯化钾+氧气
10
安静的燃烧,产生淡蓝色的火焰,放出热量,烧杯内壁有小水珠生成P79
通电
氢气+氧气水
11
正负极均有气泡产生,负极气体体积约为正极的两倍P80
水氢气+氧气
通电
氢气+氧气水
11
正负极均有气泡产生,负极气体体积约为正极的两倍P80
水氢气+氧气
12
有大量的气泡产生,溶液由无色变为浅绿色。
铁+硫酸→硫酸亚铁+氢气
13
溶液由蓝色变为浅绿色,铁钉表面附着一层红色物质P93
铁+硫酸铜→铜+硫酸亚铁
14
有大量的气泡产生,碳酸钠粉末逐渐减少P94
点燃
碳酸钠+盐酸→二氧化碳+水+氯化钠
点燃
硫+氧气二氧化硫
九年级化学1-4单元文字表达式归纳

写出下列化学反应的文字表达式,并在相应的物质下方写出该物质的化学式。
(1)磷在空气中燃烧
文字表达式:
化学方程式:
(2)硫在氧气中燃烧
文字表达式:
化学方程式:
(3)木炭在空气中燃烧
文字表达式:
化学方程式:
(4)铁丝在氧气中燃烧
文字表达式:
化学方程式:
(5)镁在空气中燃烧
文字表达式:
化学方程式:
(6)氢气在氧气中燃烧
文字表达式:
化学方程式:
(7)高锰酸钾受热分解制取氧气
文字表达式:
化学方程式:
(8)氯酸钾和二氧化锰混合加入制取氧气
文字表达式:
化学方程式:
(9)过氧化氢溶液与二氧化锰混合制取氧气
文字表达式:
化学方程式:
(10)电解水
文字表达式:
化学方程式:写出下列化学反应的文字表达式,并在相应的物质下方写出该物质的化学式。
(1)磷在空气中燃烧文字表达式:化学方程式:(2)硫在氧气中燃烧文字表达式:化学方程式:(3)木炭在空气中燃烧文字表达式:化学方程式:(4)铁丝在氧气中燃烧文字表达式:化学方程式:(5)镁在空气中燃烧文字表达式:化学方程式:(6)氢气在氧气中燃烧文字表达式:化学方程式:(7)高锰酸钾受热分解制取氧气文字表达式:化学方程式:(8)氯酸钾和二氧化锰混合加入制取氧气文字表达式:化学方程式:(9)过氧化氢溶液与二氧化锰混合制取氧气文字表达式:化学方程式:(10)电解水文字表达式:化学方程式:。
初中化学《上下册》默写化学方程式

化学《上册》必须过关的化学方程式1.实验室制取二氧化碳(必须熟记)________________________________________________2.二氧化碳使石灰水变浑浊(必须熟记)____________________________________________3.二氧化碳与水反应______________________________________________________________4.碳酸不稳定分解________________________________________________________________5.一氧化碳燃烧__________________________________________________________________6.一氧化碳还原氧化铜____________________________________________________________7.一氧化碳还原氧化铁____________________________________________________________8.甲烷燃烧______________________________________________________________________9.酒精燃烧_____________________________________________________________________10.实验室制取氢气_______________________________________________________________11.生石灰(氧化钙)与水反应_____________________________________________________12.氢气燃烧_____________________________________________________________________13.镁条与稀盐酸反应_____________________________________________________________14.红磷(或白磷)燃烧___________________________________________________________15.木炭还原氧化铜_______________________________________________________________16.木炭还原氧化铁_______________________________________________________________17.木炭还原四氧化三铁___________________________________________________________18.木炭还原二氧化碳_____________________________________________________________19.木炭燃烧(氧气充足)_________________________________________________________20.木炭不完全燃烧(氧气不充足)_________________________________________________21.实验室制氧气(三个化学方程式必须熟记)(1)分解过氧化氢______________________________________________________________ (2)加热氯酸钾________________________________________________________________ (3)加热高锰酸钾______________________________________________________________22.电解水______________________________________________________________________23.氢气还原氧化铜______________________________________________________________24.氢气还氧化铁________________________________________________________________25.铁与硫酸铜反应______________________________________________________________26.镁条燃烧____________________________________________________________________27.硫燃烧______________________________________________________________________28.铁丝燃烧____________________________________________________________________初中化学<下册>必须熟记的化学方程式1.金属单质+ 酸--- 盐+ 氢气(1)锌和稀硫酸: _______________________ (2)铁和稀硫酸: __________________________ (3)镁和稀硫酸: _______________________ (4)铝和稀硫酸:___________________________ (5)锌和稀盐酸:________________________ (6)铁和稀盐酸: __________________________ (7)镁和稀盐酸: _______________________ (8)铝和稀盐酸: __________________________ 2.金属单质+ 盐(溶液) ----- 另一种金属+ 另一种盐(1)铁和硫酸铜溶液反应:_____________________________________(2)铜和硝酸银溶液反应:_____________________________________3.金属(碱性)氧化物+ 酸------ 盐+ 水(1)氧化铁和稀盐酸反应:_____________________________________(2)氧化铁和稀硫酸反应:_____________________________________(3)氧化铜和稀盐酸反应:_____________________________________(4)氧化铜和稀硫酸反应: ____________________________________4.非金属(酸性)氧化物+ 碱------ 盐+ 水(1)烧碱暴露在空气中变质(与空气中的CO2反应): __________________________________(2)苛性钠(烧碱、火碱)吸收二氧化硫气体: _______________________________________(3)苛性钠(烧碱、火碱)吸收三氧化硫气体: _______________________________________(4)熟石灰(消石灰)在空气中变质(与空气中的CO2反应):___________________________5.酸+ 碱----- 盐+ 水(1)盐酸和烧碱反应:____________________________________________(2)盐酸和氢氧化铝反应(治疗胃酸过多):_________________________________________(3)盐酸和氢氧化镁反应(治疗胃酸过多):_________________________________________(4)硫酸和烧碱反应:____________________________________________其他:(1)二氧化碳与水反应:______________________________(2)生石灰与水反应:________________________________化学《上册》必须过关的化学方程式答案1.实验室制取二氧化碳CaCO 3+2HCl=CaCl 2+H 2O+CO 2↑2.二氧化碳使石灰水变浑浊CO 2+Ca(OH)2=CaCO 3↓+H 2O 3.二氧化碳与水反应CO 2+H 2O=H 2CO 34.碳酸不稳定分解H 2CO 3= H 2O +CO 2↑5.一氧化碳燃烧2CO+O 2 = 2CO 26.一氧化碳还原氧化铜CO+CuO = Cu+CO 27.一氧化碳还原氧化铁3CO+Fe 2O 3 = 2Fe+3CO 28.甲烷燃烧:CH 4+2O 2 = CO 2+2H 2O9.酒精燃烧C 2H 5OH+3O 2 = 2CO 2+3H 2O10.实验室制取氢气Zn+H 2SO 4 =ZnSO 4+H 2↑11.生石灰(氧化钙)与水反应CaO + H 2O = Ca(OH)212.氢气燃烧2H 2 + O 2 = 2H 2O13.镁条与稀盐酸反应Mg + 2HCl = MgCl 2 + H 2↑14.红磷(或白磷)燃烧4P + 5O 2 = 2P 2O 515.木炭还原氧化铜2CuO+C = 2Cu+CO 2↑16.木炭还原氧化铁2Fe 2O 3 + 3C = 4Fe + 3CO 2↑17.木炭还原四氧化三铁Fe 3O 4 + 2C = 3Fe + 2CO 2↑18.木炭还原二氧化碳CO 2 + C = 2CO19.木炭燃烧(氧气充足) C + O 2 = CO 220.木炭不完全燃烧(氧气不充足)2C + O 2 = 2CO21.实验室制氧气(三个化学方程式必须熟记)(1)分解过氧化氢2H 2O 2 = 2H 2O + O 2↑(2)加热氯酸钾2KClO 3 = 2KCl + 3O 2↑(3)加热高锰酸钾2KMnO 4 = K 2MnO 4 + MnO 2 + O 2↑22.电解水2H 2O = 2H 2↑+ O 2↑23.氢气还原氧化铜CuO + H 2 = Cu + H 2O 24.氢气还氧化铁Fe 2O 3 + 3H 2 = 2Fe + 3H 2O 25.铁与硫酸铜反应Fe + CuSO 4 = Cu + FeSO 426.镁条燃烧2Mg + O 2 = 2MgO27.硫燃烧S + O 2 = SO 228.铁丝燃烧3Fe +2O 2 = Fe 3O 4点燃高温高温点燃点燃点燃点燃高温高温高温点燃点燃MnO2MnO 2△△通电高温点燃点燃点燃高温高温初中化学<下册>必须熟记的化学方程式答案1.金属单质+ 酸--- 盐+ 氢气(1)锌和稀硫酸: Zn + H2SO4 = ZnSO4 + H2↑(2)铁和稀硫酸: Fe + H2SO4 = FeSO4 + H2↑(3)镁和稀硫酸: Mg +H2SO4=MgSO4 +H2↑(4)铝和稀硫酸: 2Al +3H2SO4 = Al2(SO4)3 +3H2↑(5)锌和稀盐酸: Zn + 2HCl = ZnCl2 + H2↑(6)铁和稀盐酸: Fe + 2HCl = FeCl2 + H2↑(7)镁和稀盐酸: Mg + 2HCl = MgCl2 + H2↑(8)铝和稀盐酸: 2Al + 6HCl = 2AlCl3 + 3H2↑2.金属单质+ 盐(溶液) ----- 另一种金属+ 另一种盐(1)铁和硫酸铜溶液反应:Fe + CuSO4 = FeSO4 + Cu(2)铜和硝酸银溶液反应:Cu + 2AgNO3=Cu(NO3)2 +2Ag3.金属(碱性)氧化物+ 酸------ 盐+ 水(1)氧化铁和稀盐酸反应:Fe2O3 + 6HCl =2FeCl 3 + 3H2O(2)氧化铁和稀硫酸反应:Fe2O3+3H2SO4 = Fe2(SO4)3+ 3H2O(3)氧化铜和稀盐酸反应:CuO + 2HCl = CuCl2 + H2O(4)氧化铜和稀硫酸反应: CuO + H2SO4 = CuSO4 + H2O4.非金属(酸性)氧化物+ 碱------ 盐+ 水(1)烧碱暴露在空气中变质(与空气中的CO2反应): 2NaOH + CO2 = Na2CO3 + H2O(2)苛性钠(烧碱、火碱)吸收二氧化硫气体: 2NaOH + SO2 = Na2SO3 + H2O(3)苛性钠(烧碱、火碱)吸收三氧化硫气体: 2NaOH + SO3 = Na2SO4 + H2O(4)熟石灰(消石灰)在空气中变质(与空气中的CO2反应):Ca(OH)2 + CO2 = CaCO3↓+ H2O 其他:(1)二氧化碳与水反应:CO2 + H2O = H2CO3(2)生石灰与水反应:CaO + H2O = Ca(OH)2。
化学方程式默写

化学方程式默写(一)1.Cl2与水反应的离子方程式2.Cl2与NaOH反应的离子方程式3.工业制漂白粉的化学方程式4.实验室制Cl2的离子方程式5.酸性KMnO4与浓盐酸反应的离子方程式6.次氯酸见光分解的化学方程式7.漂白粉在空气中失效的化学方程式8.Cl2与FeCl2反应的离子方程式9.Cl2与KI反应的离子方程式10.Cl2与SO2反应的离子方程式11.KClO3与浓盐酸反应的离子方程式12.足量铁丝在Cl2中燃烧的化学方程式13.SiO2与HF反应的化学方程式14.SiO2与NaOH反应的离子方程式15.SiO2高温下与Na2CO3反应的化学方程式16.Na2SiO3与盐酸反应的离子方程式17.少量CO2与NaOH反应的离子方程式18.过量CO2与NaOH反应的离子方程式19.Na2SiO3溶液中通入足量CO2的离子方程式20.高纯硅的制备流程方程式(原料为SiO2、C、Cl2、H2):、、。
21.小苏打溶液中加入过量的澄清石灰水的离子方程式:。
化学方程式默写(二)1.SO2与CaO反应方程式2.少量SO2与NaOH反应的离子方程式3.少量SO2与澄清石灰水反应的离子方程式4.SO2与H2S反应的化学方程式5.SO2与FeCl3反应的离子方程式6.SO2与新制氯水反应的离子方程式7.SO2与酸性KMnO4反应的离子方程式8.SO2与碘水反应的离子方程式9.工业上用浓氨水处理硫酸工业尾气的化学方程式:、。
10.SO2的催化氧化方程式11.铜与浓硫酸反应的化学方程式12.碳与浓硫酸反应的化学方程式13.铜与双氧水、稀硫酸反应的离子方程式14.少量铁粉在加热条件下与浓硫酸反应的化学方程式:15.NaHSO4与Ba(OH)2反应后溶液呈中性的离子方程式:16.电解精炼铜阳极阴极17.钥匙镀锌阳极阴极化学方程式默写(三)1.N2与O2放电时的化学方程式2.NO与O2反应的化学方程式3.NO2溶于水的离子方程式4.Cu与浓HNO3反应的离子方程式5.Cu与稀HNO3反应的离子方程式6.少量铁粉与稀HNO3反应的离子方程式7.Fe2+与稀HNO3反应的离子方程式8.实验室制NH3的化学方程式9.NH3的工业制法10.NH3·H2O的电离方程式11.氨水受热分解方程式12.工业制硝酸的反应方程式:、、。
人教版必修一化学方程式默写归纳及练习

化学必修1化学方程式默写表一、钠及其化合物1.钠与氧气:常温:点燃:2.钠与水反应:____________________________离子方程式:____________________________3.钠与硫酸反应:4.氧化钠与水反应:___________________________5.过氧化钠与二氧化碳反应:6.过氧化钠与水反应:_离子方程式:_______________________7.NaOH溶液中通入少量CO2:离子方程式:__________________NaOH溶液中通入过量CO2:离子方程式:_____________________8.①向碳酸钠溶液滴入少量稀盐酸:向稀盐酸滴入少量碳酸钠溶液:②除去碳酸氢钠溶液中混有的碳酸钠:③碳酸钠与氢氧化钙:④碳酸氢钠与盐酸:⑤少量碳酸氢钠溶液滴入氢氧化钙溶液中:少量氢氧化钙溶液滴入碳酸氢钠溶液中:⑥除去碳酸钠溶液中的碳酸氢钠:⑦除去碳酸钠固体中的碳酸氢钠:⑧鉴别碳酸钠和碳酸氢钠溶液:二、铝及其化合物1.铝与氧气的反应:2.铝与氧化铁反应(铝热反应):3.铝和稀盐酸:_______________________________ 离子方程式:_________________________4.铝和NaOH溶液:______________________________离子方程式:_________________________5.氧化铝和稀硫酸:_____________________________离子方程式:_________________________6.氧化铝和NaOH溶液:__________________________离子方程式:_________________________7.氢氧化铝和盐酸:_____________________________离子方程式:_________________________8.氢氧化铝和NaOH溶液:________________________离子方程式:_________________________9.氢氧化铝受热分解:_____________________________10.硫酸铝与氨水反应:_____________________________离子方程式:______________________11.AlCl3溶液中加入少量NaOH溶液:AlCl3溶液中加入过量NaOH溶液:12.往偏铝酸钠溶液中通入少量CO2:往偏铝酸钠溶液中通入足量CO2:13.电解氧化铝:三、铁及其化合物1.铁与氧气反应:铁与硫反应:2.铁与盐酸反应:离子方程式:___________________________铁与CuSO4溶液:离子方程式:___________________________3.铁和水蒸气:_______________________________________________4.氧化亚铁与盐酸反应:离子方程式:_____________________5.氧化铁与盐酸反应:_____________________离子方程式:_____________________6.CO还原氧化铁:__________________________________________7.氯化铁与氢氧化钠溶液:____________________________离子方程式:_____________________8.硫酸亚铁与氢氧化钠溶液:__________________________离子方程式:_____________________9.氢氧化铁加热分解:__________________________________________10.氢氧化亚铁被氧化成氢氧化铁:__________________________________________11.除去FeCl2中的FeCl3:____________________________离子方程式:_______________________12.FeCl2和Cl2反应:________________________________离子方程式:________________________13.FeCl3和Cu反应:________________________________离子方程式:________________________14.氯化铁与硫氰化钾溶液反应:________________________________四、硅及其化合物1.硅与氧气加热:硅与氟气:________________________2.硅单质与氢氟酸反应:3.硅与氢氧化钠溶液反应:____4.二氧化硅与氢氟酸反应:_______________________________________5.二氧化硅与氧化钙高温反应:__________________________________6.二氧化硅与氢氧化钠溶液反应:_____________________________________________7.二氧化硅与碳反应:____________________________________8.硅酸钠与盐酸反应:______________________________离子方程式:_________________________9.往硅酸钠溶液中通入二氧化碳:_____________________________10.二氧化硅与纯碱反应:_________________________________11.二氧化硅与石灰石反应:_________________________________12.加热硅酸:五、氯及其化合物1.实验室制氯气:______________________________________离子方程式:______________________2.钠在氯气中燃烧:____________________________________铁在氯气中燃烧:____________________________________铜在氯气中燃烧:___________________________________氢气在氯气中燃烧:___________________________3.氯气和水反应:______________________________离子方程式:_____________________________4.次氯酸光照分解:__________________________________5.氯水中通入二氧化硫:___离子方程式:_________________________6.氯气与氢氧化钠溶液:________________________________离子方程式:_______________________7.工业生产漂白粉:__________________________________________________8.漂白粉漂白原理:________________________________________________________9.向漂白粉溶液中加入稀盐酸:10.氯气通入溴化钾溶液:离子方程式:_____________________氯气通入碘化钾溶液:离子方程式:_____________________溴水和碘化钾溶液反应:离子方程式:_____________________11.氯化钠和硝酸银溶液:离子方程式:_____________________溴化钠和硝酸银溶液:离子方程式:_____________________碘化钠和硝酸银溶液:离子方程式:_____________________六、硫及其化合物1.硫在空气中燃烧:___________________________________硫与氢气加热:________2.二氧化硫与水:______________________________________二氧化硫与氧化钙:__________________________________少量SO2与氢氧化钠:______________________________离子方程式:_______________________ 过量SO2与氢氧化钠:______________________________离子方程式:_______________________3.SO2通入过量的澄清石灰水:过量的SO2通入澄清石灰水:4.二氧化硫与硫化氢:_____5.SO2的催化氧化:____________________________________6.亚硫酸钠和硫酸反应:____________________________________________________7.Na2SO3与氧气反应:__________________________________8.三氧化硫和水反应:____________________________________9.三氧化硫与氧化钙:___________________________10.三氧化硫与氢氧化钙:___________________________11.铜与浓硫酸反应:________________________________________________________12.碳与浓硫酸反应:______________________________________________________七、氮及其化合物1.氮气和氧气反应:____________________________2.工业合成氨:____________________________________3.一氧化氮与氧气反应: ____________________4.NO2溶于水:____________________________________5.氨气溶于水:___________________________氨水显弱碱性(电离方程式):____________________6.浓氨水受热分解___________________________7.氨气和氯化氢:____________________________________8.氨的催化氧化_________________________________________9.氯化铵受热分解:____________________________________10.碳酸氢铵受热分解:___________________________________11.硝酸铵和NaOH:__________________________________离子方程式:_________________________12.实验室制氨气:_______________________________________13.浓硝酸与铜反应:_________________________________离子方程式:_________________________14.稀硝酸与铜反应:________________________________离子方程式:________________________15.硝酸见光分解:_____________________________________________16.NH4+的检验离子方程式:___________________________17.NO2、O2混合气通入水中无剩余气体:18.NO、O2混合通入水中无剩余气体:化学必修1化学方程式归纳表一、钠及其化合物1.钠与氧气:常温:4Na+O2=2Na2O点燃:2Na + O2 Na2O22.钠与水反应:_2Na + 2H2O = 2NaOH + H2↑_离子方程式:2Na + 2H2O = 2Na++2OH- + H2↑3.钠与硫酸反应:2Na +H2SO4= Na2SO4+H2↑4.氧化钠与水反应:Na2O+H2O=2NaOH5.过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 = 2Na2CO3 +O2↑6.过氧化钠与水反应:2Na2O2+2H2O =4NaOH+O2↑离子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑7.NaOH溶液中通入少量CO2:2NaOH+CO2=Na2CO3+H2O离子方程式:2OH-+CO2=CO32-+H2ONaOH溶液中通入过量CO2:NaOH+CO2= NaHCO3离子方程式:_ OH-+CO2= HCO3-_____8.①向碳酸钠溶液滴入少量稀盐酸: Na2CO3 + HCl = NaHCO3 + NaCl向稀盐酸滴入少量碳酸钠溶液: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑②除去碳酸氢钠溶液中混有的碳酸钠:Na2CO3 + H2O +CO2=2NaHCO3③碳酸钠与氢氧化钙:Na2CO3 +Ca(OH)2=CaCO3↓ + 2NaOH④碳酸氢钠与盐酸:NaHCO3+HCl=NaCl+H2O+CO2↑⑤少量碳酸氢钠溶液滴入氢氧化钙溶液中:NaHCO3+Ca(OH)2=CaCO3↓ +NaOH+ H2O少量氢氧化钙溶液滴入碳酸氢钠溶液中: 2NaHCO3+Ca(OH)2=CaCO3↓ +Na2CO3 + 2H2O⑥除去碳酸钠溶液中的碳酸氢钠:NaHCO3 + NaOH Na2CO3 + H2O⑦除去碳酸钠固体中的碳酸氢钠:2NaHCO3 Na2CO3 + H2O +CO2↑⑧鉴别碳酸钠和碳酸氢钠溶液:Na2CO3 +CaCl2=CaCO3↓ + 2NaCl二、铝及其化合物1.铝与氧气的反应:4Al + 3O2 2Al2O32.铝与氧化铁反应(铝热反应):2Al + Fe2O3高温2Fe + Al2O33.铝和稀盐酸:2Al + 6HCl = 2AlCl3 + 3H2↑离子方程式:2Al + 6H+ = 2Al3+ + 3H2↑4.铝和NaOH溶液:2Al+2NaOH+2H2O=2NaAlO2+3H2↑离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑5.氧化铝和稀硫酸:Al2O3+3H2SO4=Al2(SO4)3+3H2O_离子方程式:Al2O3+6H+=2Al3++3H2O6.氧化铝和NaOH溶液:Al2O3 + 2NaOH = 2NaAlO2 +H2O 离子方程式:Al2O3 + 2OH-=2AlO2-+H2O7.氢氧化铝和盐酸:Al(OH)3+3HCl = AlCl3+3H2O离子方程式:Al(OH)3+3H+ = Al3++3H2O8.氢氧化铝和NaOH溶液:Al(OH)3 +NaOH = NaAlO2+2H2O离子方程式:Al(OH)3 +OH-= AlO2-+2H2O9.氢氧化铝受热分解:_2Al(OH)3Al2O3+3H2O_10.硫酸铝与氨水反应:Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4离子方程式:_ Al3++3NH3·H2O=Al(OH)3↓+3NH4+_______11.AlCl3溶液中加入少量NaOH溶液:AlCl3+3NaOH=A l(O H)3↓+3NaClAlCl3溶液中加入过量NaOH溶液:AlCl3+ 4NaOH =NaAlO2+ 3NaCl+2H2O 12.往偏铝酸钠溶液中通入少量CO2:2NaAlO2+3H2O+CO2=2A l(O H)3↓+Na2CO3往偏铝酸钠溶液中通入足量CO2:NaAlO2+2H2O+CO2=A l(O H)3↓+NaHCO313.电解氧化铝:2Al2O34Al+3O2↑三、铁及其化合物1.铁与氧气反应:3Fe +2O2Fe3O4铁与硫反应:Fe + S FeS2.铁与盐酸反应:Fe + 2HCl = FeCl2 + H2↑离子方程式:Fe + 2H+ = Fe2+ + H2↑_铁与CuSO4溶液:Fe+CuSO4=FeSO4+Cu离子方程式:Fe+Cu2+=Fe2++Cu_3.铁和水蒸气:_3Fe + 4H2O(g) 高温Fe3O4 + 4H2_4.氧化亚铁与盐酸反应:FeO+2HCl=FeCl2+H2O离子方程式:FeO+2H+=Fe2++H2O _5.氧化铁与盐酸反应:_Fe2O3+6HCl=2FeCl3+3H2O离子方程式:Fe2O3+6H+=2Fe3++3H2O_6.CO还原氧化铁:_ Fe2O3 + 3CO 高温2Fe + 3CO2_7.氯化铁与氢氧化钠溶液:FeCl3+3NaOH = Fe(OH)3↓+3NaCl_离子方程式:Fe3++3OH-= Fe(OH)3↓8.硫酸亚铁与氢氧化钠溶液:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4离子方程式:Fe2++2OH-= Fe(OH)2↓9.氢氧化铁加热分解:__2Fe(OH)3Fe2O3+3H2O_____10.氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3_11.除去FeCl2中的FeCl3:2FeCl3 + Fe = 3FeCl2_离子方程式:2Fe3+ + Fe = 3Fe2+_12.FeCl2和Cl2反应:_2FeCl2 + Cl2 = 2FeCl3_离子方程式:_2Fe2+ + Cl2 = 2Fe3++2Cl-13.FeCl3和Cu反应:2FeCl3+Cu=2FeCl2+CuCl2_离子方程式:2Fe3++Cu=2Fe2++Cu2+14.氯化铁与硫氰化钾溶液反应:_Fe3+ + 3SCN-= Fe(SCN)3___四、硅及其化合物1.硅与氧气加热:Si+O2SiO2硅与氟气:_Si+2F2=SiF4__2.硅单质与氢氟酸反应:Si+4HF=SiF4+2H23.硅与氢氧化钠溶液反应:Si+2NaOH+H2O=Na2SiO3+2H2↑4.二氧化硅与氢氟酸反应:_4HF+SiO2=SiF4↑+2H2O _5.二氧化硅与氧化钙高温反应:SiO2+CaO 高温CaSiO3__6.二氧化硅与氢氧化钠溶液反应:SiO2 + 2NaOH = Na2SiO3 + H2O__7.二氧化硅与碳反应:_ SiO2 + 2C 高温Si + 2CO↑_8.硅酸钠与盐酸反应:_ Na2SiO3+2HCl=H2SiO3↓+2NaCl__离子方程式: SiO32-+2H+=H2SiO3↓9.往硅酸钠溶液中通入二氧化碳:_Na2SiO3+CO2+H2O == H2SiO3↓+ Na2CO3_10.二氧化硅与纯碱反应:SiO2+Na2CO3高温Na2SiO3+CO2↑_11.二氧化硅与石灰石反应:_ SiO2+CaCO3高温CaSiO3+CO2↑_12.加热硅酸:H2SiO3SiO2+H2O五、氯及其化合物1.实验室制氯气:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O_离子方程式:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O2.钠在氯气中燃烧:_2Na+Cl2 2NaCl_铁在氯气中燃烧:2Fe+3Cl2 2FeCl3_铜在氯气中燃烧:Cu + Cl2 CuCl2氢气在氯气中燃烧:H2 + Cl2 2HCl _3.氯气和水反应:Cl2 + H2O = HCl + HClO离子方程式:Cl2 + H2O = H++Cl- + HClO4.次氯酸光照分解:_2HClO 2HCl + O2↑_5.氯水中通入二氧化硫:Cl2+SO2+2H2O=H2SO4+2HCl离子方程式:Cl2+SO2+2H2O=4H++SO42-+2Cl-6.氯气与氢氧化钠溶液:Cl2+2NaOH=NaCl+NaClO+H2O离子方程式:Cl2+2OH-=Cl-+ClO-+H2O7.工业生产漂白粉:_2Ca(OH)2 + 2Cl2=Ca(ClO)2 + CaCl2 + 2H2O _8.漂白粉漂白原理:_Ca(ClO)2 + CO2 + H2O =CaCO3↓ + 2HClO _9.向漂白粉溶液中加入稀盐酸:Ca(ClO)2 + 2HCl=CaCl2 +2HClO10.氯气通入溴化钾溶液:Cl2 + 2KBr = Br2 + 2KCl离子方程式:Cl2 + 2Br- = Br2 + 2Cl-氯气通入碘化钾溶液:Cl2 + 2KI = I2 + 2KCl离子方程式:_Cl2 + 2I- = I2 + 2Cl-溴水和碘化钾溶液反应:Br2 +2KI = I2+2KBr离子方程式:Br2 +2I- = I2+2Br-11.氯化钠和硝酸银溶液:AgNO3+ NaCl =AgCl↓+ NaNO3离子方程式:Ag++Cl-=AgC l↓溴化钠和硝酸银溶液:AgNO3+ NaBr=AgBr↓+ NaNO3离子方程式:Ag++Br-=AgBr↓_ 碘化钠和硝酸银溶液:AgNO3+ NaI =AgI↓+ NaNO3离子方程式:Ag++I-=AgI↓_ 六、硫及其化合物1.硫在空气中燃烧:_S+O2SO2__硫与氢气加热:S+H2H2S2.二氧化硫与水:_ SO2+H2O H2SO3_二氧化硫与氧化钙:_ SO2+CaO=CaSO3_少量SO2与氢氧化钠:_2NaOH+SO2=Na2SO3+H2O _离子方程式:_2OH-+SO2=SO32-+H2O_过量SO2与氢氧化钠:_ NaOH+SO2=NaHSO3_离子方程式:_ OH-+SO2= HSO3-_3.SO2通入过量的澄清石灰水: Ca(OH)2+SO2=CaSO3↓+H2O过量的SO2通入澄清石灰水:Ca(OH)2+2SO2=Ca(HSO3)24.二氧化硫与硫化氢:SO2 + 2H2S=3S↓+2H2O5.SO2的催化氧化:6.亚硫酸钠和硫酸反应:_Na2SO3+H2SO4=Na2SO4 +SO2↑+H2O__7.Na2SO3与氧气反应:_2Na2SO3+O2=2Na2SO4_8.三氧化硫和水反应:_ SO3+H2O=H2SO4_9.三氧化硫与氧化钙:__ SO3+CaO= CaSO4_10.三氧化硫与氢氧化钙:_Ca(OH)2+SO3=CaSO4↓+H2O _11.铜与浓硫酸反应:_ Cu + 2H2SO4 (浓)CuSO4 + 2H2O+SO2 ↑_12.碳与浓硫酸反应:_ C + 2H2SO4(浓) 2H2O+CO2↑+2SO2↑_七、氮及其化合物1.氮气和氧气反应:_N2 + O2 2NO_2.工业合成氨:_ N2 + 3H2催化剂高温高压2NH3_3.一氧化氮与氧气反应:2NO + O2= 2NO2_4.NO2溶于水:_3NO2 + H2O = 2HNO3 + NO_5.氨气溶于水: NH3 + H2O NH3·H2O氨水显弱碱性(电离方程式):NH3·H2O NH4+ + OH-6.浓氨水受热分解_ NH3·H2O △NH3↑+H2O __7.氨气和氯化氢:_ HCl + NH3 = NH4Cl _8.氨的催化氧化_4NH3 +5O2 4NO + 6H2O_9.氯化铵受热分解:_ NH4Cl NH3+HCl_10.碳酸氢铵受热分解:_ NH4HCO3NH3↑+ H2O↑ + CO2↑_11.硝酸铵和NaOH:NH4NO3 + NaOH NaNO3 + NH3↑+H2O_离子方程式:NH4++ OH-NH3↑+H2O12.实验室制氨气:_2NH4Cl + Ca(OH)2CaCl2 + 2NH3↑+2H2O13.浓硝酸与铜反应:4HNO3(浓)+Cu Cu(NO3)2+2NO2↑+2H2O离子方程式:4H++2NO3-+Cu Cu2++2NO2↑+2H2O14.稀硝酸与铜反应:8HNO3(稀)+3Cu 3Cu(NO3)2+2NO↑+4H2O离子方程式:8H++2NO3-+3Cu 3Cu2++2NO↑+4H2O15.硝酸见光分解:_4HNO3=4NO2↑+O2↑+2H2O(见光或受热分解)_16.NH4+的检验离子方程式:NH4++ OH-NH3↑+H2O17.NO2、O2混合气通入水中无剩余气体:4NO2 + O2 + 2H2O = 4HNO318.NO、O2混合通入水中无剩余气体:4NO+ 3O2 + 2H2O = 4HNO3放电。
初三化学方程式汇总默写版

初三化学方程式之【四大基本反应类型】一、化合反应:由二种或二种以上的物质生成一种物质的反应(多变一)1、二氧化碳和水反应:、二氧化硫和水反应3、三氧化硫和水反应、氧化钙和水反应5、氧化钠和水反应、碳在高温下和二氧化碳反应7、碳在空气中燃烧、一氧化碳燃烧9、硫燃烧、磷燃烧11、铁在氧气中燃烧、铝在氧气中燃烧13、镁在空气中燃烧、铜在空气中加热二、分解反应:由一种物质生成二种或二种以上的物质的反应。
(一变多)1、高锰酸钾加热分解2、双氧水和二氧化锰混合3、氯酸钾和二氧化锰加热分解4、水通电分解氧化汞受热分解6、碳酸分解7、氢氧化铜受热分解:8、石灰石高温分解9、水通电分解10、碳酸氢铵受热分解三、置换反应:一种单质和一种化合物生成另一种单质和另一种化合物的反应。
(一)金属和酸反应,可制氢气1、锌和稀硫酸反应2、锌和稀盐酸反应3、铁和稀硫酸反应(注意:)4、铁和稀盐酸反应(注意:)5、铝和稀硫酸反应6、铝和稀盐酸反应7、镁和稀硫酸反应8、镁和稀盐酸反应你能把上面这四种和酸反应的金属和酸反应时的激烈程度按由大到小排列一下吗:你做出这样的排列的理由是:()(二)金属氧化物和氢气或碳反应,可治炼金属1、氢气还原氧化铜2、氢气还原氧化铁:5、氢气还原氧化铜、碳高温还原氧化铜 7、碳还原氧化铁、碳还原氧化亚铁注意:一氧化碳还原氧化铜这个反应不是置换反应,因为,一氧化碳不是单质,它不满足置换反应的定义。
Co+CuO=Cu+Co2 (不是置换反应(三)金属与某些盐溶液反应,可治炼金属(1)铁和硫酸铜反应(2)铝和硫酸铜反应(3)铜和硝酸汞反应(4)铜和硝酸银反应注意:金属与某些盐溶液能否发生置换反应的条件是:金属活动性顺序表中,排在前面的金属能把排在后面的金属从他的盐溶液中置换出来。
Mg+Al2(SO4 3= (可以反应 Fe+AlCl3= (不反应四、复分解反应:两种化合物相互交换成分生成两种新的化合物的反应。
(通式:)(一)酸+某些金属氧化物 === 盐+水(1)盐酸与氧化铁反应(2)硫酸与氧化铁反应(3)硫酸与氧化铜反应(4)盐酸与氧化铜反应(二)酸+碱 === 盐+水(中和反应)1、氢氧化钠和稀盐酸反应2、氢氧化铜和盐酸反应3、氢氧化铜和硫酸反应4、氢氧化钠和硫酸反应5、氢氧化钡和硫酸反应(三)盐+酸 === 新盐+新酸(生成物中有气体、沉淀或水)1、大理石(石灰石)和稀盐酸反应2、碳酸钠和稀盐酸反应3、硝酸银和盐酸反应4、氯化钡和稀硫酸反应(四)盐+碱 === 新盐+新碱(反应物均溶于水,生成物中有沉淀)1、硫酸铜和氢氧化钠反应2、氯化铁和氢氧化钠反应3、碳酸钠和氢氧化钙反应4、硫酸铜和氢氧化钡反应5、硫酸镁和氢氧化钡反应6、氯化铵和氢氧化钙反应(五)盐+盐两种新盐(反应物均溶于水,生成物中有沉淀)1、氯化钾和硝酸银反应2、氯化钠和硝酸银反应3、硫酸钠和氯化钡反应4、碳酸钠与氯化钡反应五、不属基本反应类型的反应(一)某些非金属氧化物与碱的反应1、二氧化碳与澄清石灰水反应2、二氧化碳与氢氧化钠反应3、二氧化硫与氢氧化钠反应(二)一氧化碳与某些金属氧化物的反应1、一氧化碳还原氧化铜2、一氧化碳还原氧化铁3、一氧化碳还原氧化亚铁4、一氧化碳还原四氧化三铁(三)甲烷、酒精等有机物的燃烧1、甲烷(天然气、沼气、瓦斯气)燃烧2、酒精(乙醇)燃烧化学方程式的运用写出下列化学方程式(一)化合反应:由二种或二种以上的物质生成一种物质的反应。
1到5章化学方程式汇总与默写doc

1-5章化学方程式整理1. 镁在空气中燃烧:2Mg + O2点燃2MgO2. 铁在氧气中燃烧:3Fe + 2O2点燃Fe3O43. 铜在空气中受热:2Cu + O2加热2CuO4. 铝在空气中燃烧:4Al + 3O2点燃2Al2O35. 氢气中空气中燃烧:2H2 + O2点燃2H2O6. 红磷在空气中燃烧:4P + 5O2点燃2P2O57. 硫粉在空气中燃烧:S + O2点燃SO28. 碳在氧气中充分燃烧: C + O2点燃CO29. 碳在氧气中不充分燃烧:2C + O2点燃2CO10. 一氧化碳在氧气中燃烧:2CO+ O2点燃2CO211. 甲烷在空气中燃烧:CH4+2O2点燃CO2+2H2O12. 水通电分解:2H2O 通电2H2↑+ O2 ↑13. 加热碱式碳酸铜:Cu2(OH)2CO3加热2CuO + H2O + CO2↑14. 加热高锰酸钾:2KMnO4加热K2MnO4+MnO2 + O2↑15. 碳酸不稳定而分解:H2CO3==H2O + CO2↑16. 高温煅烧石灰石:CaCO3高温CaO + CO2↑17. 二氧化碳溶解于水:CO2 + H2O=== H2CO318. 生石灰溶于水:CaO + H2O === Ca(OH)219. 一氧化碳还原氧化铁:3CO+ Fe2O3高温2Fe + 3CO220. 一氧化碳还原四氧化三铁:4CO+ Fe3O4高温3Fe + 4CO221. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑22. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑23. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑24. 铝和稀硫酸2Al+3H2SO4 =Al2(SO4)3 +3H2↑25. 锌和稀盐酸Zn + 2HCl=== ZnCl2 + H2↑26. 铁和稀盐酸Fe + 2HCl=== FeCl2 + H2↑27. 镁和稀盐酸Mg+ 2HCl=== MgCl2 + H2↑28. 铝和稀盐酸2Al +6HCl== 2AlCl3 + 3H2↑29. 铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu30. 氢氧化钠溶液与硫酸铜溶液反应:2NaOH+ CuSO4 ===Na2SO4 + Cu(OH)2↓31.实验室检验二氧化碳:CO2 +Ca(OH)2=== CaCO3↓+ H2O1-5章化学方程式默写1.实验室用紫黑色固体制氧气:2.实验室用黑色固体和无色透明液体制氧:3.实验室常用来制取氢气:4.实验室制取二氧化碳:5.工业制二氧化碳:6.实验室检验二氧化碳:7. 铁在氧气中燃烧:8. 镁在空气中燃烧:9. 铜在空气中受热:10. 铝在空气中燃烧:11. 氢气中空气中燃烧:12. 红磷在空气中燃烧:13. 硫粉在空气中燃烧:14. 碳在氧气中充分燃烧:15. 碳在氧气中不充分燃烧:16. 一氧化碳在氧气中燃烧:17. 甲烷在空气中燃烧:18.铁和盐酸反应:19.铝和硫酸反应:20.镁和硫酸:21. 湿法冶金:22.水通电分解:23. 加热碱式碳酸铜:24. 碳酸不稳定而分解:25. 二氧化碳溶解于水:26. 生石灰作干燥剂的原理:27. 工业用赤铁矿炼铁原理:28. 工业用磁铁矿炼铁原理:29. 氢氧化钠溶液与硫酸铜溶液反应:30.工业炼铁中焦炭作用:31.完成下列转化:。
九年级1-4章化学方程式 常见化学式

1-4章化学方程式1. 镁在空气中燃烧:2Mg + O2 点燃 2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹照明弹2. 铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O4剧烈燃烧、火星四射、生成黑色固体、放热3. 铜在空气中受热:2Cu + O2 加热2CuO红色金属变为黑色固体4. 铝在空气中缓慢氧化:4Al + 3O2 2Al2O3 银白金属变为白色固体5. 氢气中空气中燃烧:2H2 + O2 点燃 2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料、最理想的燃料(资源丰富,热值高,无污染.6. 红磷在空气中燃烧:4P + 5O2 点燃 2P2O5 剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量烟幕弹发令枪子弹7. 硫粉在空气中燃烧: S + O2 点燃 SO2 剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰,.氧气中蓝紫色火焰8. 碳在氧气充分时燃烧:C + O2 点燃 CO2 剧烈燃烧、白光、放热、使石灰水变浑浊9. 碳在氧气不充分时燃烧:2C + O2点燃2CO 产生能量少,污染大;煤炉中常见反应、生成物是空气污染物之一、煤气中毒原因10. 一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO2 CO还原金属氧化物实验中,尾气处理的反应11. 甲烷在空气中燃烧:CH4 + 2O2点燃 CO2 + 2H2O 明亮的蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧12. 酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O清洁能源、绿色能源叶绿素13. 光合作用: 6 H2O +6 CO2光照C6H12O6+6O2酶14.呼吸作用:C6H12O6+6O2 6H2O +6 CO215. 水在直流电的作用下分解:2H2O 通电 2H2↑+ O2 ↑ 初中唯一的一个条件为“通电”的反应。
沪科版九年级化学第1到5 章化学方程式默写含答案

第1—5 章化学方程式默写1.镁在空气中燃烧:2. 铁在氧气中燃烧:3. 铜在空气中受热:4. 氢气中空气中燃烧:5. 红磷在空气中燃烧:6. 硫粉在空气中燃烧:7. 碳在氧气中完全燃烧:8. 碳在氧气中不完全燃烧:9. 一氧化碳在氧气中燃烧:10. 甲烷完全燃烧:11. 钠在氯气中燃烧:12. 氯化氢与氨气的反应:13. 二氧化碳溶解于水:14. 水在直流电的作用下分解:15. 加热碳酸氢铵: ____________16. 加热碱式碳酸铜:17. 加热高锰酸钾:18. 氯酸钾制氧气:_____19. 双氧水和二氧化锰制氧气:20. 碳酸不稳定而分解:21. 检验二氧化碳:22. 大理石与稀盐酸:_____ ____23. 铝在空气中形成致密的氧化膜24. 锌与稀盐酸反应25. 锌与稀硫酸反应26. 镁与稀盐酸反应27. 镁与稀硫酸反应28. 铝与稀盐酸反应29. 铝与稀硫酸反应30. 铁与稀盐酸反应31. 铁与稀硫酸反应32. 曾青得铁则化为铜33. “百炼成钢”的主要反应34. 高炉炼铁焦炭作用、35. CO 还原赤铁矿反应36. CO 还原磁铁矿反应37. H2还原氧化铜38. H2还原氧化铁39. 木炭还原氧化铜40. 木炭还原氧化铁41. 氢氧化钠溶液与硫酸铜溶液反应42. 铜生锈的反应第1—5 章化学方程式1. 镁在空气中燃烧: 2 Mg + O2点燃 2 MgO(白色)2. 铁在氧气中燃烧: 3 Fe + 2O2点燃Fe3O4(黑色)3. 铜在空气中受热: 2 Cu + O2∆ 2 CuO(黑色)4. 氢气中空气中燃烧: 2 H2 + O2点燃2 H2O5. 红磷在空气中燃烧:4 P + 5 O2点燃2 P2O5(白色)(白烟)6. 硫粉在空气中燃烧:S + O2点燃SO2(刺激性气味)7. 碳在氧气中完全燃烧:C + O2点燃CO28. 碳在氧气中不完全燃烧: 2 C + O2点燃2 CO(毒)9. 一氧化碳在氧气中燃烧:2 CO + O2点燃2 CO210. 甲烷完全燃烧:CH4 + 2 O2点燃CO2 + 2 H2O11. 钠在氯气中燃烧: 2 Na + Cl2点燃2 NaCl(了解)12. 氯化氢与氨气的反应:HCl + NH3 = NH4Cl(了解)(白烟)13. 二氧化碳溶解于水:CO2 + H2O = H2CO314. 水在直流电的作用下分解:2 H2O通电2 H2↑+ O2↑15. 加热碳酸氢铵:NH4HCO3∆ NH3↑ + H2O + CO2↑16. 加热碱式碳酸铜:Cu2(OH)2CO3∆ 2 CuO + H2O + CO2↑17. 加热高锰酸钾:(紫黑)2 KMnO4∆ K2MnO4 + MnO2 + O2↑2 KCl +3 O2↑18. 氯酸钾制氧气: 2 KClO3 MnO2△19. 双氧水和二氧化锰制氧气:2 H2O2MnO2 2 H2O + O2↑20. 碳酸不稳定分解:H2CO3∆ H2O + CO2↑21. 检验二氧化碳:Ca(OH)2 + CO2 = CaCO3↓+ H2O22. 大理石与稀盐酸:CaCO3 + 2 HCl = CaCl2 + H2O + CO2↑23. 铝在空气中形成致密的氧化膜 4 Al + 3 O2 = 2 Al2O324. 锌与稀盐酸反应Zn + 2 HCl = ZnCl2 + H2↑(实验室制H2)25. 锌与稀硫酸反应Zn + H2SO4 = ZnSO4 + H2↑(实验室制H2)26. 镁与稀盐酸反应Mg + 2 HCl = MgCl2 + H2↑27. 镁与稀硫酸反应Mg + H2SO4 = MgSO4 + H2↑28. 铝与稀盐酸反应 2 Al + 6 HCl = 2 AlCl3 + 3 H2↑29. 铝与稀硫酸反应 2 Al + 3 H2SO4= Al2(SO4)3 +3 H2↑30. 铁与稀盐酸反应Fe + 2 HCl = FeCl2 + H2↑31. 铁与稀硫酸反应Fe + H2SO4 = FeSO4 + H2↑32. 曾青得铁则化为铜Fe + CuSO4 = FeSO4 + Cu33. “百炼成钢”的主要反应C + O2点燃CO2(炼钢的原理)34. 高炉炼铁焦炭作用C+O2点燃CO2CO2+ C高温2 CO35. CO 还原赤铁矿反应 3 CO + Fe2O3高温2 Fe + 3 CO236. CO 还原磁铁矿反应 4 CO + Fe3O4高温3 Fe + 4 CO237. H2还原氧化铜H2 + CuO△2O38. H2还原氧化铁 3 H2 + Fe2O3△2 Fe + 3 H2O39. 木炭还原氧化铜 C + 2 CuO高温2 Cu + CO2↑40. 木炭还原氧化铁 3 C + 2 Fe2O3高温4 Fe + 3 CO2↑41. 氢氧化钠溶液与硫酸铜溶液2 NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4 42. 铜生锈的反应2 Cu + O2 + H2O + CO2 = Cu2(OH)2CO3(了解)第7 章化学方程式默写1.氧化铁与稀盐酸(盐酸除铁锈)2. 氧化铁与稀硫酸(硫酸除铁锈)3. 氧化铜与稀盐酸4.氧化铜与稀硫酸5.氢氧化钠与稀盐酸6.氢氧化钠与稀硫酸7.氢氧化钙与稀盐酸8.氢氧化铝与稀盐酸(治疗胃酸过多)9.石灰石与稀盐酸(实验室制取CO2)10.碳酸钠与稀硫酸11.氯化钡和稀硫酸12.硝酸银和稀盐酸13.氧化钙和水(生石灰变熟石灰)14.氢氧化钙和二氧化碳(检验CO2)15.氢氧化钠和二氧化碳(吸收/除去CO2)16.氢氧化钙和二氧化硫(石灰浆吸收SO2)17.硫酸铜和氢氧化钠18.硫酸铜和氢氧化钙(配制农药波尔多液)19.碳酸钠和氢氧化钙(工业制烧碱)20.氯化铁和氢氧化钠21.铜和硝酸银22.铝和硝酸铜23.氯化钡和碳酸钠24.氢氧化钡和碳酸钠25.氯化钠和硝酸银26.氯化钡和硫酸钠27.碳酸氢钠和稀盐酸(治疗胃酸过多)28.加热碳酸氢铵(小苏打做发酵粉)29.煅烧石灰石30.氨水与稀硫酸31.氯化铵和氢氧化钠32.硫酸铵与氢氧化钙33.电解饱和氯化钠溶液34.侯氏制碱35.碱式碳酸铜与稀盐酸反应第7 章化学方程式1. 氧化铁与稀盐酸(盐酸除铁锈)Fe2O3+6HCl=2FeCl3+3H2O2. 氧化铁与稀硫酸(硫酸除铁锈)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O3. 氧化铜与稀盐酸 CuO+2HCl=CuCl2+H2O4.氧化铜与稀硫酸 CuO+H2SO4=CuSO4+H2O5.氢氧化钠与稀盐酸 NaOH+HCl=NaCl+H2O6.氢氧化钠与稀硫酸 2NaOH+H2SO4=Na2SO4+2H2O7.氢氧化钙与稀盐酸 Ca(OH)2+2HCl=CaCl2+2H2O8.氢氧化铝与稀盐酸(治疗胃酸过多)Al(OH)3+3HCl=AlCl3+3H2O9.石灰石与稀盐酸(实验室制取CO2)CaCO3+2HCl=CaCl2+H2O+CO2↑10.碳酸钠与稀硫酸 Na2CO3+H2SO4=Na2SO4+H2O+CO2↑11.氯化钡和稀硫酸 BaCl2+H2SO4=BaSO4↓+2HCl12.硝酸银和稀盐酸 AgNO3+HCl=AgCl↓+HNO313.氧化钙和水(生石灰变熟石灰)CaO+H2O=Ca(OH)214.氢氧化钙和二氧化碳(检验CO2)Ca(OH)2+CO2=CaCO3↓+H2O15.氢氧化钠和二氧化碳(吸收/除去CO2)2NaOH+CO2=Na2CO3+H2O16.氢氧化钙和二氧化硫(石灰浆吸收SO2)Ca(OH)2+SO2=CaSO3↓+H2O18.硫酸铜和氢氧化钙(配制农药波尔多液)CuSO4+Ca(OH)2=CaSO4+Cu(OH)2↓19.碳酸钠和氢氧化钙(工业制烧碱)Na2CO3+Ca(OH)2=CaCO3↓+2NaOH20.氯化铁和氢氧化钠 FeCl3+3NaOH=Fe(OH)3↓+3NaCl22.铝和硝酸铜 2Al+3Cu(NO3)2=2Al(NO3)3+3Cu23.氯化钡和碳酸钠 aCl2+Na=CO3=BaCO3↓+2NaCl24.氢氧化钡和碳酸钠 Ba(OH)2+Na2CO3=BaCO3↓+2NaOH25.氯化钠和硝酸银 AgNO3+NaCl=AgCl↓+NaNO326.氯化钡和硫酸钠 BaCl2+Na2SO4=BaSO4↓+2NaCl27.碳酸氢钠和稀盐酸(治疗胃酸过多)NaHCO3+HCl=NaCl+H2O+CO2↑28.加热碳酸氢铵(小苏打做发酵粉)2NaHCO3△2CO3+H2O+CO2↑29.煅烧石灰石 CaCO3高温CaO+CO2↑30.氨水与稀硫酸 2NH3∙H2O+H2SO4=(NH4)2SO4+2H2O31.氯化铵和氢氧化钠 NH4Cl+NaOH=NaCl+NH3↑+H2O32.硫酸铵与氢氧化钙(NH4)2SO4+Ca(OH)2=CaSO4+2NH3↑+2H2O33.电解饱和氯化钠溶液2NaCl+2H2O通电2NaOH+Cl2↑+H2↑34.侯氏制碱 NaCl+H2O+NH3+CO2=NaHCO3↓+NH4Cl2NaHCO3△2CO3+H2O+CO2↑35. 碱式碳酸铜与稀盐酸反应Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑(Cu2(OH)2CO3可以拆成Cu(OH)2∙CuCO3的形式)。
初三语文方程式汇总默写版

初三语文方程式汇总默写版
初三语文学科中,有一些重要的方程式是需要同学们熟记并默写的。
掌握这些方程式可以帮助我们更好地理解和记忆语文知识。
下面是初三语文方程式的汇总默写版。
1. 修辞手法方程式
- 比喻:A像B一样
- 拟人:物体具有人的特点
- 夸张:夸大事物的特征或效果
- 对仗:内容相对称,表现在音、义或个别形式的对应上
- 排比:重复使用同样的句式结构
- 设问:说话者没有明确表达意见,而是通过提问的方式进行叙述
- 倍数群:以倍数形式进行叠加,具有增强或放大的效果
- 修饰语的重复:通过重复修饰同一个对象,强化修饰的效果
2. 文言文修辞手法方程式
- 借指:用一个特定的对象代替另一个对象
- 假设:假设一种情况,并以此作为叙述的基础
- 略释:附加释义来解释某个词的意义,便于读者理解句子的含义
- 借古讽今:通过引用古人或古代事件,批判当时的现象或表达作者的观点
- 内引法:用一个词或一段话来引申或解释与之相联的词或句- 外引法:借用其他事物对原文进行诠释或比喻
- 用反语:通过违背常理的方式来表达某种意思
- 比兴:通过比喻或夸张来描绘某个人或事物
3. 阅读与写作规范方程式
- 阅读:先读全文,再细读每一段落,最后理解作者的意图
- 写作:结构清晰,逻辑连贯,要点突出,运用恰当的修辞手法
以上是初三语文方程式汇总的默写版。
通过不断练习,熟练掌握这些方程式,相信同学们在语文学科中会取得更好的成绩。
希望大家好好学习,加油!。
选修4 化学反应原理1--4各章知识点详细总结

选修4 化学反应原理1—4章知识点总结第一章化学反应与能量一、反应热焓变1、定义:化学反应过程中放出或吸收的热量叫做化学反应的反应热.在恒温、恒压的条件下,化学反应过程中所吸收或释放的热量称为反应的焓变。
2、符号:△H3、单位:kJ·mol-14、规定:吸热反应:△H > 0 或者值为“+”,放热反应:△H < 0 或者值为“-”常见的放热反应和吸热反应放热反应吸热反应燃料的燃烧C+CO2, H2+CuO酸碱中和反应C+H2O金属与酸Ba(OH)2.8H2O+NH4Cl大多数化合反应CaCO3高温分解大多数分解反应小结:1、化学键断裂,吸收能量;化学键生成,放出能量2、反应物总能量大于生成物总能量,放热反应,体系能量降低,△H为“-”或小于0反应物总能量小于生成物总能量,吸热反应,体系能量升高,△H为“+”或大于03、反应热数值上等于生成物分子形成时所释放的总能量与反应物分子断裂时所吸收的总能量之差二、热化学方程式1.概念:表示化学反应中放出或吸收的热量的化学方程式.2.意义:既能表示化学反应中的物质变化,又能表示化学反应中的能量变化.[总结]书写热化学方程式注意事项:(1)反应物和生成物要标明其聚集状态,用g、l、s分别代表气态、液态、固态。
(2)方程式右端用△H 标明恒压条件下反应放出或吸收的热量,放热为负,吸热为正。
(3)热化学方程式中各物质前的化学计量数不表示分子个数,只表示物质的量,因此可以是整数或分数。
(4)对于相同物质的反应,当化学计量数不同时,其△H 也不同,即△H 的值与计量数成正比,当化学反应逆向进行时,数值不变,符号相反。
三、盖斯定律:不管化学反应是一步完成或分几步完成,其反应热是相同的。
化学反应的焓变(ΔH)只与反应体系的始态和终态有关,而与反应的途径无关。
总结规律:若多步化学反应相加可得到新的化学反应,则新反应的反应热即为上述多步反应的反应热之和。
有机方程式默写单

有机化学方程式默写单1、甲烷及烷烃(易燃烧、易取代、可裂解)45、卤代烃(易水解、能消去)1 溴乙烷水解成醇2 溴乙烷消去成烯3 R—X水解4 一氯乙烷的水解5 1,2—二溴乙烷的水解6 苄基溴的水解反应7 溴苯水解反应(较难进行)8 R-CH2CH2X的消去反应9的消去反应10 3—甲基—3—溴己烷的消去反应11的消去反应12 1,2—二溴乙烷发生消去反应成双键或者三键13 CH3—CH2—CHCl2的消去反应(成三键)6、乙醇及醇类(易氧化、易取代、能消去)1 乙醇和钠的置换反应2 乙醇和镁的置换反应3 乙醇的燃烧反应4 乙醇的催化氧化5 正丙醇催化氧化6 异丙醇催化氧化7 乙醇直接被氧化成乙酸8 乙醇分子间脱水成醚9 乙醇与浓氢卤酸的取代10 乙醇与酸的酯化反应11 乙醇的消去反应12 R—CH2OH的催化氧化13 的催化氧化14的消去反应15 乙二醇与钠反应16 丙三醇与硝酸反应7、苯酚及酚类(易氧化、易取代、能加成)1 苯酚的弱电离2 苯酚与金属钠的反应3 苯酚与氢氧化钠的反应4 苯酚与碳酸钠的反应5 向苯酚钠溶液中通入少量CO2气体向苯酚钠溶液中通入过量量CO2气体6 向苯酚钠溶液加入盐酸7 苯酚与浓溴水的取代反应8 苯酚与浓硝酸的硝化反应9 酚类的显色反应10 苯酚与乙酸酯化反应11 苯酚与氢气的加成反应12 苯酚与甲醛的缩聚反应8917 乙二酸在浓硫酸作用下脱水10、“形形色色”的酯化反应(1)一元羧酸与一元醇的酯化反应:RCOOH+HOR′RCOOR′+H2O甲酸与甲醇(2)多元醇与一元羧酸的酯化反应(乙二醇和乙酸)1:1反应1:2反应(3)多元羧酸与一元醇的酯化反应(乙二酸和乙醇)1:1反应1:2反应(4)多元羧酸与多元醇的酯化反应(乙二酸和乙二醇)1:1成链状1:1成环状成聚酯(5)两分子乳酸酯化成链状两分子乳酸酯化成环状一分子乳酸酯化1112、基本营养物质——糖类(1)(2)(2)1314。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.镁在氧气中燃烧:现象:燃烧、放出大量的热、同时放出
2.铁在氧气中燃烧:现象:剧烈燃烧、火星四射、生成黑色的固体
3.铜在氧气中受热:
4.铝在空气中燃烧:
5.氢气在氧气中燃烧:现象:淡蓝色的火焰
6.红磷在空气中燃烧:现象:生成白烟
7.硫粉在氧气中燃烧:现象:空气中是的火焰;纯氧中是的火焰;同时都生成有刺激性气味的气体。
8.碳在氧气中充分燃烧:
9.汞(水银)在氧气中燃烧:
1双氧水催化制氧气:现象:溶液里冒出大量的气泡2.水在直流电的作用下分解:
3
4.
5..加热氧化汞:
6
现象:
7碳酸钠和盐酸反应:
8煅烧石灰石
姓名时间:5min
1.镁在氧气中燃烧:现象:燃烧、放出大量的热、同时放出
2.铁在氧气中燃烧:现象:剧烈燃烧、火星四射、生成黑色的固体
3.铜在氧气中受热:
4.铝在空气中燃烧:
5.氢气在氧气中燃烧:现象:淡蓝色的火焰
6.红磷在空气中燃烧:现象:生成白烟
7.硫粉在氧气中燃烧:现象:空气中是的火焰;纯氧中是的火焰;同时都生成有刺激性气味的气体。
8.碳在氧气中充分燃烧:
9.汞(水银)在氧气中燃烧:
姓名时间:5min
1双氧水催化制氧气:
2.水在直流电的作用下分解:
3加热氯酸钾(有少量的二氧化锰):
4加热高锰酸钾:
5铁和硫酸铜溶液:
现象:铁表面色物质生成,色溶液变为色
6硫酸铜和氢氧化钠反应
写出以下物质化学式:
氢氧化铝硝酸铵碳酸钠赤铁矿(主要成分氧化铁)
姓名时间:5min
1碳酸钠和盐酸反应:
2 实验室制备CO2原理:
3工业制备二氧化碳原理
4碳还原氧化铜,现象:色粉末变为色,生成的气体能使澄清石灰水
5一氧化碳还原氧化铜
6向装有CO2集气瓶中加水,再滴加紫色石蕊试剂,则紫色石蕊变为色,原理
写出以下物质化学式:
氧化锌氢氧化钙硝酸银硫酸亚铁
姓名时间:5min
1氢气还原氧化铜:
2 一氧化碳还原氧化铁:
3一氧化碳还原四氧化三铁:
4 煤炉的中层反应:
5澄清石灰水变浑浊原理:
6工业制备二氧化碳:
写出以下物质化学式:
硫酸钡盐酸氢氧化镁氧化亚铁。
