2019学年高一化学人教版必修1课件 第4章 第2节 第
2019-2020学年人教版必修1第4章第2节富集在海水中的元素——氯作业

阶段重点突破练(七)题组一氯气的性质1.下列关于氯气的说法正确的是()A.Cl2具有很强的氧化性,在化学反应中只能作氧化剂B.氯元素在自然界中既以化合态存在,也以游离态存在C.实验室制备Cl2可用排饱和食盐水法收集D.1.12 L Cl2含有1.7N A个质子(N A为阿伏加德罗常数的值)答案 C解析Cl2中的氯元素处于中间价态,所以在化学反应中既可以作氧化剂也可以作还原剂(如Cl2与H2O反应),A项错误;氯元素主要以Cl-的形式存在于海水中,自然界中只有化合态的氯,没有游离态的氯,B项错误;D项没有说明在标准状况下,错误。
【考点】氯气的性质【题点】氯气的性质及应用2.氯气是一种重要的工业原料。
工业上利用反应3Cl2+2NH3===N2+6HCl检查氯气管道是否漏气。
下列说法错误的是()A.若管道漏气遇氨就会产生白烟B.该反应利用了Cl2的强氧化性C.该反应属于复分解反应D.生成1 mol N2有6 mol电子转移答案 C解析本题通过一个陌生的化学反应方程式,考查氨气和氯气的性质及氧化还原知识。
当NH3过量时会与HCl反应生成NH4Cl白烟,故A对;反应中氮和氯两元素的化合价发生了变化,因而属于氧化还原反应,故C错;氯气中的氯元素化合价从0价变为-1价,化合价降低,氯气为氧化剂,NH3中的氮由-3价升高至0价(失去3个电子),为还原剂,生成1 mol N2需2 mol氮原子,失去6 mol电子,故D对。
【考点】氯气的性质【题点】氯气的性质及应用3.如图所示,A处通入干燥的Cl2,关闭B阀时,C处湿的红色布条看不到明显现象,打开B阀后,C处红色布条逐渐褪色,则D瓶中装的是()A.浓H2SO4B.NaOH溶液C.浓盐酸D.饱和NaCl溶液答案 B解析由题意说明D处的液体能吸收Cl2,A、C、D选项中的溶液都不能吸收Cl2,故B项正确。
【考点】氯气的性质【题点】氯气的性质实验4.下列有关化学反应过程或实验现象的叙述中,正确的是()A.氯气的水溶液可以导电,说明氯气是电解质B.漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的C.氯气可以使湿润的有色布条褪色,但实际起漂白作用的物质是次氯酸而不是氯气D.氯水中加入有色布条,布条褪色,说明溶液中有Cl2存在答案 C解析电解质必须是化合物,Cl2是单质,既不是电解质,也不是非电解质,A不正确;漂白粉是利用强氧化性杀菌消毒,而明矾是利用Al3+和水反应生成Al(OH)3胶体吸附杂质,B不正确;D项只能说明存在HClO,D不正确。
4.3.2 共价键(课件)高一化学(人教版2019必修第一册)

键。 共用电子对偏向吸引电子能力强原
原子,两个原子均不显电性
子,成键的原子成正电性或负电性
。
。
判断
由同种非金属元素原子形成
由不同种非金属元素原子形成
实例 Cl2:
+
HCl:
+
01 对应训练
【典例1】关于共价键的说法正确的是 ( B ) A.金属原子在化学反应中只能失去电子,因而不能形成共价键 B.由共价键形成的分子可以是单质分子,也可以是化合物分子 C.共价键只能在不同原子之间形成 D.稀有气体分子中只存在共价键
01 共价键
活动一、Cl2、HCl 的形成过程 任务一、阅读教材P114页1、2自然段,思考从微观角度如何理解 Cl2分子的形成过程?
①氯原子的最外层有7个电子,要达到 稳定的8电子结构,需获得1个电子;
②2个氯原子各提供1个电子→2个氯原 子间形成共用电子对→2个氯原子均达 到8电子稳定结构→形成稳定的氯气分 子。
有一部分熔点比离子化合物要高,如二氧化硅比氯化钠高。
02 共价化合物
活动一、共价化合物的概念及结构 任务一、阅读教材P114页最后两个自然段,回答什么是共价化合物? 共价化合物的导电性有何特点?
①定义:原子间以共用电子对形成的化合物称为共价化合物。如H2O、CO2、 H2SO4等。
②导电性:熔融状态时不导电(即熔融无法破坏共价键),溶于水后可能导 电(如HCl、H2SO4等酸),可能不导电(如乙醇)。杨s
形象表示:
电子式表示HCl的形成过程:
01 对应训练
【典例】如果用“·”表示最外层的电子,原子形成NaCl和HCI的的过程 可表示如下,有关说法正确的是( D )
A.H易失电子显+1价而形成稳定结构 B.NaCl固体中主要存在NaCl分子 C.HCl的水溶液中主要存在HCl分子 D.H与Cl共用一对电子形成HCl
高一化学人教版2019必修第一册 4.2元素周期律 (知识点)
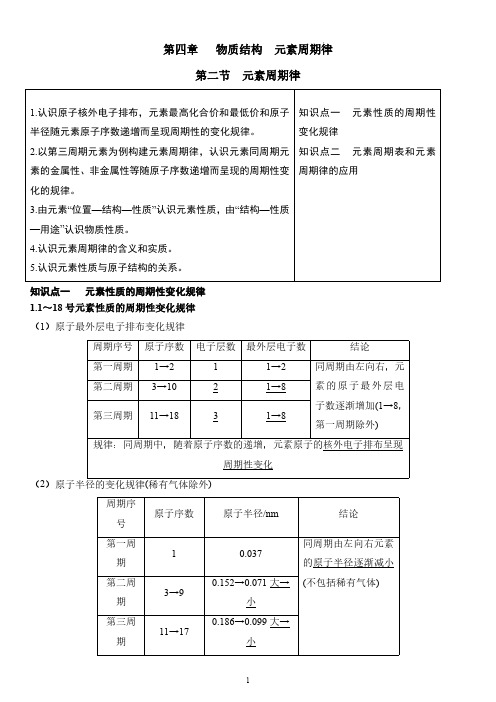
第四章物质结构元素周期律第二节元素周期律1.认识原子核外电子排布,元素最高化合价和最低价和原子半径随元素原子序数递增而呈现周期性的变化规律。
2.以第三周期元素为例构建元素周期律,认识元素同周期元素的金属性、非金属性等随原子序数递增而呈现的周期性变化的规律。
3.由元素“位置—结构—性质”认识元素性质,由“结构—性质—用途”认识物质性质。
4.认识元素周期律的含义和实质。
5.认识元素性质与原子结构的关系。
知识点一元素性质的周期性变化规律知识点二元素周期表和元素周期律的应用知识点一元素性质的周期性变化规律1.1~18号元素性质的周期性变化规律(1)原子最外层电子排布变化规律(2周期序号原子序数原子半径/nm结论第一周期10.037同周期由左向右元素的原子半径逐渐减小(不包括稀有气体)第二周期3→90.152→0.071大→小第三周期11→170.186→0.099大→小规律:同周期中,随着原子序数的递增,元素的原子半径呈现周期性变化3.元素的主要化合价周期序号原子序数主要化合价结论第一周期1→2+1→0①同周期由左向右,元素的最高正价逐渐升高(+1→+7,O和F无最高正价);②元素的最低负价由第ⅣA族的-4价逐渐升高至第ⅦA族的-1价;③最高正价+|最低负价|=8第二周期3→9最高价+1→+5(不含O、F)最低价-4→-1第三周期11→17最高价+1→+7最低价-4→-1规律:同周期中,随着原子序数的递增,元素的主要化合价呈现周期性变化4.实验探究:金属性的递变规律(1)Na、Mg元素金属性强弱比较原理金属与水反应置换出H2的难易程度操作现象镁条表面附着少量气泡剧烈反应,溶液变成浅红色化学反应-Mg+2H2OMg(OH)2+H2↑结论结合Na与水的反应的现象,Na与水反应置换H2比Mg 容易,则金属性:Na>Mg(2)Mg、Al元素金属性强弱比较原理金属的最高价氧化物对应水化物的碱性强弱物质Al(OH)3Mg(OH)2操作现象A 中沉淀溶解B 中沉淀溶解C 中沉淀溶解D 中沉淀不溶解A 、B 、C 、D 试管中的离子方程式A :Al(OH)3+3H +===Al 3++3H 2O B :Al(OH)3+OH -===AlO -2+2H 2OC :Mg(OH)2+2H +===Mg 2++2H 2OD :不反应结论Al(OH)3是两性氢氧化物,其碱性弱于Mg(OH)2(中强碱),更弱于NaOH(强碱),则金属性:Na>Mg>Al5.非金属性的递变规律6.元素周期律(1)内容:元素的性质随着原子序数的递增而呈周期性的变化。
人教版高中化学必修一课件高一化学《第四章第四节氨硝酸硫酸(第3课时)》.pptx

2019/11/17
18
二、硫酸和硝酸的氧化性
浓硝酸、浓硫酸、浓盐酸性质对比
有 有 无 稳定 易挥发 无 无
有有 有有
浓有 稳定 难挥发 有 有 有 不稳定 易挥发 无 无
2019/11/17
2019/11/17
10
二、硫酸和硝酸的氧化性
△ C+4HNO3(浓)===CO2↑+4NO2↑+2H2O
当硝酸与金属或非金属(如碳、硫等)及 某些有机物反应时,反应物反应条件不 同,硝酸被还原得到的产物也不同.硝酸 中的+5价的氮得电子,被还原成较低得 氮的化合物。如: +4+3+2+10-3 NO2HNO2NON2ON2NH3
保存:
密封于棕色瓶中,并放在阴暗处!
2019/11/17
7
二、硫酸和硝酸的氧化性
浓硝酸与铜的反应:
现象:1、产生红棕色气体;2、溶液由无色变为
绿色;3、铜在不断的溶解。
固+液→气
浓HNO3
2019/11/17
NaOH溶液
8
二、硫酸和硝酸的氧化性
3、硝酸具有强氧化性:
还C原u+剂4H氧N化O3剂(浓)=Cu(NO3)2+2NO2↑+2H2O
空白演示
在此输入您的封面副标题
新课标人教版高中化学课件系列
必修化学1 第四章非金属及其化合物 第四节氨硝酸硫酸 第3课时
2019/11/17
2
二、硫酸和硝酸的氧化性
二、硝酸
(一)硝酸的物理性质:
第4章 第2节 第2课时氯气的制法 --人教版高中化学必修一课件(共37张PPT)

清石灰水,石灰水变浑浊,由此判断水溶液中含有( )
பைடு நூலகம்
A.Cl-、SO24-
B.Cl-、NO- 3
C.Cl-、CO23-
D.Cl-、OH-
解析:选 C 根据题给现象,生成的白色沉淀部分溶于稀
硝酸,且产生使石灰水变浑浊的气体,则原溶液中存在 CO23-和
Cl-。
4.有一包白色固体,它可能是 KCl、K2CO3、KNO3 中的一 种或几种,进行下列实验:
第四章 非金属及其化合物
第二节 富集在海水中的 元素——氯
第二课时 氯气的制法 氯离子(Cl-)的检验
1.了解实验室制取 Cl2 的原理和实验装置。 2.掌握 Cl-的检验方法。
[晨背重点语句]
2.氯气制备的流程
发生装置 ⇒ 净化装置 ⇒ 收集装置 1.实验室制备 Cl2 的反
应原理
⇒ 尾气吸收装置
2.氯气的工业制法 工业上用电解饱和食盐水的方法制取 Cl2,反应的化学方程 式为 2NaCl+2H2O=电==解==2NaOH+H2↑+Cl2↑。 [特别提醒] 实验室制取 Cl2 用的是浓盐酸而不是稀盐 酸,因为 MnO2 与稀盐酸不反应。
1.某实验室的尾气中含有较多的氯气,有毒,要吸收这些尾
12 _沉__淀__不_溶__解_____ 14 _无__明_显__变__化____
2.请写出上述实验中有关的化学方程式 ② 15 _N_a_C__l+__A__g_N_O__3=__=_=_A_g_C__l↓__+__N__a_N_O__3 ____; ③ 16 _N__a_2C__O_3_+__2_A_g_N__O_3_=_=_=_A__g_2C__O_3_↓__+__2_N_a_N__O_3__, 17 _A__g_2C__O_3_+__2_H_N__O_3_=_=_=_C__O_2_↑__+__H_2_O_+ __2_A__g_N_O__3_; ④ 18 __C_l_2_+__H_2_O______H__C_l_+__H_C__lO_, 19 ___H_C__l+__A__g_N_O__3=_=_=__A_g_C_l_↓__+__H__N_O__3 __。
氢键 课件-高一化学人教版(2019)必修第一册

Br2
50 0
CCl4
-50 -100
50 100 150 200 250
Cl2
相对分 子质量
-50 -100
100 200 300 400 500
相对分 子质量
-150
-150 CF4
-200 F2
-200
-250 卤素单质的熔沸点与 -250 四卤化碳的熔沸点与 相对分子质量的关系 相对分子质量的关系
(1)存在: 分子 分子间作用力 分子
(2)强弱:比化学键弱
(较弱) 分子间作用力
O HH
化学键 (较强)
1.为什么NaCl在熔化状态或水溶液中具有导电性,而液态氯化氢却不 具有导电性?
前者熔化或溶于水破坏了离子键,形成可自由移动的阴阳离子 后者原子间以共价键结合,分子间存在分子间作用力
2.干冰受热汽化转化为二氧化碳气体,而二氧化碳气体在加热条件下
1、结合下列数据分析下列间题:
O原子的电负性强
①为什么H2O分子间能形成氢键,而CH4分子间难形成氢键?
②为什么NH3分子间能形成氢键,而HCI分子间难形成氢键? N原子的半径小
氢键的形成条件
⑴有X-H共价键,X原子电负性强,原子半径 小,主要是F、O、N。 ⑵ X—H…Y中的Y必须电负性强、原子半径 小、具有孤对电子。X、Y可以相同,也可 以不同。
氢键的本质: 强极性键(X-H)上的氢与电负性很大的、含孤电子 对并带有部分负电荷的原子Y之间的静电作用力。
3、氢键的特点: 有方向性,有饱和性
• 方向性(X-H…Y尽可能在同一条直线上) • 饱和性(一个X-H只能和一个Y原子结合)
典例剖析
例1、下列物质中,分子间不能形成氢键的是( )
4.1.2 元素周期表 核素、同位素(课件)高一化学(人教版2019必修第一册)

目录
CONTENTS
01 元素周期表
0 核素 同位素 2
学习目标
1.通过阅读教材、讨论交流,了解核素、同位素的含义,认 识同位素在生产、生活中的应用,初步学会利用各概念之间的关 系解答有关问题。
2.通过对元素周期表发现史资料的收集整理、交流汇报, 了解元素周期表的形成过程,并能运用归纳、概括等方法对信息 进行加工,体验科学探究的过程,进一步学习科学探究的方法。
任务二、讨论交流:阅读教材P94页内容,思考现行元素周期表的编 排原则是什么?
①原子序数:按照元素在周期表中的顺序给元素编号;原子序数=核电荷数= 质子数=核外电子数。 ②元素周期表中元素的排列方式:将电子层数相同的元素按照原子序数递增的 顺序由左向右排成横行,再把不同横行中最外层电子数相同的元素,按电子层 数递增的顺序由上向下排成纵列。
元素的种类
2 8 8 18 18 32 32
01 元素周期表
活动二、探究元素周期表的结构 任务一、观察元素周期表,结合教材P95页“思考与讨论”,思考周期序 数与原子核外电子排布有何关系?完成表格内容。
周期序数 1 2 3 4 5 6 7
起止元素 H~He Li~Ne Na~Ar K~Kr Rb~Xe Cs~Rn Fr~Og
A. 、 、H+和H2是氢元素的四种不同粒子 B. 和 、石墨和金刚石均为同素异形体 C. 和 是不同的核素 D.12C和14C互为同位素,物理性质不同,但化学性质几乎完全相 同 【解析】A项中的四种微粒是氢元素的四种不同粒子, 和 是质子数均为
1,中子数不等的不同的氢原子,它们是不同的核素,12C和14C由于其质子数 均为6,而中子数分别为6和8,故它们互为同位素,同理, 和 也互为 同位素,其物理性质不同,但化学性质几乎完全相同;金刚石与石墨是由碳 元素组成的不同的单质,它们互为同素异形体。
1.1.2 分散系及其分类-高一化学课件(人教版2019必修第一册)

分散系及其分类
胶体
溶液 、胶体、浊液
分散系及其分类
胶体
交叉分类法 分散质
•气
•液
•固
分散剂
•气 •液 •固
按照分散质或分散剂的聚集 状态气、液、固来分,有9 种类型。
分散系及其分类 胶体
分散剂是液体,Fe(OH)3胶体
分散剂是气体,云、雾 分散剂是固体,有色玻璃
分散系及其分类
Fe(OH)3胶体的制备
FeCl3 + 3H2O △ Fe(OH)3(胶体)+3HCl
分散系及其分类 Fe(OH)3胶体的制备
➢ 把盛有CuSO4溶液和Fe(OH)3胶体的烧杯置于暗处,分别用红色激光笔照射烧杯中 的液体,在与光束垂直的方向进行观察,并记录现象。
有一条“光亮”的通路
分散系及其分类
胶体的性质
⑴ 丁达尔效应:
➢ 取两个100 mL小烧杯,分别加入40 mL蒸馏水和40 mL CuSO4溶液。将烧杯中的蒸 馏水加热至沸腾,向沸水中逐滴加入5~ 6滴FeCl3饱和溶液。继续煮沸至液体呈红 褐色,停止加热。观察制得的Fe(OH)3胶体。
条件
1.沸水(蒸馏水) 2.逐滴加入,不能搅拌 3.饱和FeCl3溶液 4.继续煮沸至红褐色
当一束光线照射胶体时,从侧面观察,可看见在胶体里形成一条 光亮的通路的现象。它是由于胶体粒子对光线散射形成的。
利用丁达尔效应来区分胶体和溶液是一种的常用物理方法。
分散系及其分类 胶体的性质
分散系及其分类
胶体的性质
✓ 布朗运动:胶体粒子不停地、作无秩序的运动,是胶体能稳定存在的一个原因
✓ 电泳:在电场的作用下,胶体微粒在分散剂里做定向移动的现象。 原因:胶体粒子带有电荷、例氢氧化铁胶粒只吸附阳离子而带正电荷
第四章+第一节原子结构与元素周期表第1、2课时课件高一上学期化学人教版(2019)必修第一册

课堂小结
2019人教版
第四章 物质结构 元素周期律
第一节 原子结构与元素周期律 第二课时 元素周期表
学习目标
课程标准
核心素养
1.知道元素周期表编排原则 1.微观探析:能从元素和原子水平
和结构。 上认识物质的组成和结构。
2.认识元素周期表的特点, 2.证据推理:具有证据意识,能
并应用表解决一些化学问 基于证据对物质组成、结构及其变
A原子的M层比B原子的M层少3个电子,B原子的L层电子数恰为A原子L层电子数的 2倍,说明A、B为第二、第三周期元素;L层最多排8个电子,B原子的L层电子数恰 为A原子L层电子数的2倍,说明B原子的L层有8个电子,A原子的L层有4个电子,故 A是碳原子;A原子的M层比B原子的M层少3个电子,故B为铝原子。
2019人教版
第四章 物质结构 元素周期律
第一节 原子结构与元素周期律 第一课时 原子结构
学习目标
课程标准
核心素养
1.认识原子的结构。
1.微观探析:能从元素和原子水平
2.了解原子核外的电子排 上认识物质的组成和结构。
布。
2.证据推理:具有证据意识,能
3.会画 1-18 号原子的结构示 基于证据对物质组成、结构及其变
【典例1】A元素的原子最外层电子数是a,次外层电子数是b;B元素的
原子M层电子数是(a-b),L层电子数是(a+b),则A、B两元素形成化合物
的化学式最可能表示为 ( )
A.B3A2
B.BA2
C.A3B2
D.AB2
【解析】选B。因为B的L层电子数为(a+b)且有M层,所以a+b=8,又因A 原子最外层电子数为a,次外层电子数为b,且满足a+b=8,所以A原子有 两个电子层,且K层为2个电子,L层为6个电子,所以a=6,b=2。进而推 知B的各电子层上的电子数分别为2、8、4。即A为O,B为Si。A、B两 元素形成化合物的化学式最可能为SiO2。
高一化学人教版(2019)必修第一册:第四章 第三节 第二课时 离子化合物和共价化合物

专属客服
VIP专属客服,第一时间解决你的问题。专属客服QQ版全部权益:1.海量精选书免费读2.热门好书抢先看3.独家精品资源4.VIP专属身份标识5.全站去广告6.名人书友圈7.三端同步
物质熔化、溶解时破坏化学键类型的判断 (1)离子化合物的溶解或熔化过程 离子化合物溶于水或熔化后均电离成自由移动的阴、阳离子,离子键被 破坏。 (2)共价化合物的溶解过程 ①有些共价化合物溶于水后,能与水反应,其分子内共价键被破坏,如 CO2 和 SO2 等。年VIP月VIP
连续包月VIP
享受100次共享文档下载特权,一次发放,全年 赠送的共享文档下载特权自VIP生效起每月发放一次,每次发放的特
内有效
权有效期为1个月,发放数量由您购买的VIP类型决定。
赠送每月15次共享文档下载特权,自VIP生效起 每月发放一次,持续有效不清零。自动续费,前 往我的账号-我的设置随时取消。
解析
君不见,黄河之水天上来,奔流到海不复回。 君不见,高堂明镜悲白发,朝如青丝暮成雪。 人生得意须尽欢,莫使金樽空对月。 天生我材必有用,千金散尽还复来。 烹羊宰牛且为乐,会须一饮三百杯。 岑夫子,丹丘生,将进酒,杯莫停。 与君歌一曲,请君为我倾耳听。 钟鼓馔玉不足贵,但愿长醉不复醒。 古来圣贤皆寂寞,惟有饮者留其名。 陈王昔时宴平乐,斗酒十千恣欢谑。 主人何为言少钱,径须沽取对君酌。 五花马,千金裘,呼儿将出换美酒,与尔同销万古愁
第二课时 离子化合物和共价化合物
1.下列叙述中正确的是( ) A.化学键只存在于分子之间 B.化学键只存在于离子之间 C.化学键是相邻的原子或离子间强烈的相互作用 D.化学键是相邻的分子之间强烈的相互作用
答案 C
答案
解析 化学键是相邻的原子或离子间强烈的相互作用,可以是阴、阳离 子之间的离子键,也可以是原子间通过共用电子对形成的共价键。分子之间 形成的是分子间作用力,不属于化学键,C 正确。
【课件】第一章 第二节 第1课时 电解质及其电离+课件高一化学人教版(2019)必修第一册

自我测试
4.现有中学化学中常见的十种物质: ①固体氢氧化钡 ②石墨棒 ③纯醋酸 ④液态氯化氢 ⑤硫酸氢钾固体 ⑥熔融氯化钠 ⑦蔗糖 ⑧碳酸钠粉末 ⑨氯化钠溶液 ⑩二氧化碳 请用序号填空: (1)上述状态下可导电的是_②__⑥__⑨__,属于电解质的是__①__③__④__⑤__⑥__⑧__。 (2)属于酸的是_③__④__,属于碱的是__①__,属于盐的是_⑤__⑥__⑧__。 (3)写出④⑤⑧在水溶液中的电离方程式: ④_H_C__l=_=_=__H_+_+__C__l-__; ⑤_K_H__S_O_4_=_=_=_K_+_+__H__+_+__S_O_24_-__; ⑧_N_a_2_C_O_3_=_=_=_2_N__a_+_+__C_O_23_-__。
的是
A.CuSO4、NaCl均为电解质,灯泡会亮起来
固体氯化钠中无自由移动的离子,不
√B.在NaCl(s)中导加电入适量水,灯泡会亮起来
C.CuSO4的电离方程式:CuSO4=通=电=Cu2++SO42−
电离不需通电
D.将NaCl(s)改为NaCl溶液,在CuSO4溶液中加入少量NaOH固体,灯泡明显变暗
如HCO3−、SO42−、OH-等,但HSO4−在水溶液中拆开,在熔融状态下不拆 开。
自我测试
1.下列叙述正确的是 A.凡能电离出H+的化合物均属于酸 阳离子全部是H+ B.NaCl溶于水,在通电条件下才能发生电离 不需通电
C.石墨能导电,所以它是电解质 单质,既不是电解质也不是非电解
√D.熔融的MgCl2能导电,所以MgCl2是质电解质
⑨熔融氯化钠
一、电解质
归纳 总结
高一化学人教版2019必修第一册 4.1原子结构与元素 周期表(知识点)

第四章物质结构元素周期律第一节原子结构与元素周期表1.认识原子的构成,了解原子核外电子排布规律,能画出1~20号元素的原子结构示意图。
2.能从原子结构的角度理解元素周期表的编排原则,能进行元素在周期表中的位置与原子结构之间的相互推导。
3.了解元素周期表的发展历程及现行元素周期表的结构。
4.知道元素、核素、同位素、A Z X的含义,并能比较它们的不同。
5.知道碱金属元素、卤族元素的结构和性质,能从原子结构角度解释同主族元素性质的递变规律。
6.能设计实验方案,探究同主族元素性质的递变性7.巩固原子的构成,加深对核素、同位素概念的理解,熟练掌握核电荷数、质子数、中子数、质量数之间的关系。
8.熟练掌握元素周期表的结构,能用原子结构理论解释同族元素性质的相似性和递变性。
知识点一原子的构成知识点二原子核外电子排布知识点三元素周期表的编排原则与结构知识点一原子的构成1.构成原子的微粒及其性质2.质量数(1)概念:将原子核内所有质子和中子的相对质量取近似整数值相加,所得的数值叫做质量数,常用A 表示。
(2)构成原子的粒子间的两个关系①质量数(A)=质子数(Z)+中子数(N)。
②质子数=核电荷数=核外电子数。
3.元素(1)概念:具有相同质子数(核电荷数)的一类原子的总称。
(2)决定元素种类的是质子数。
4.核素(1)概念:具有一定数目质子和一定数目中子的一种原子。
表示方法:A Z X。
(2)实例原子符号(A Z X)原子名称氢元素的原子核质子数(Z)中子数(N)11H氕1021H或D氘1131H或T氚125.同位素(1)概念:质子数相同而中子数不同的同一元素的不同原子互称为同位素(即同一元素的不同核素互称为同位素)。
“同位”是指核素的质子数相同,在元素周期表中占有相同的位置。
例如:氢元素有11H、21H、31H三种核素;碳元素有126C、136C、146C等核素;氧元素有168O、178O和188O三种核素;铀元素有23492U、23592U、23892U等核素。
4.2 元素周期律(共2课时课件)(人教版2019高一化学必修第一册))

03 元素的主要化合价变化规律
元素化合价的变化规律:
正价:+1→+5,负价:-4 →-1
正价:+1→+7,负价:-4 →-1
同周期由左向右元素的最高正价逐渐升高(+1→+7,O和F无最高正价);元素的最低负价由ⅣA族的-4价逐渐升高至ⅦA族的-1价
绘制1—18号元素随着原子序数的递增,元素的最高正价、最低负价变化折线图。
短周期主族元素中,原子半径最大的是哪种元素?
Na
H
稀有气体除外
原子核对核外电子吸引力
(电子层数相同)
质子数
原子半径
弱
强
小
大
小
大电子层数Leabharlann 核电荷数核外电子数
同电子层结构:序大径小
1、比较 Na 与 Cl、Na 与 F 的原子半径大小?
r(Na)>r(Cl)
r(Na)>r(F)
2、比较 Na+ 与 Cl−、Na+ 与 F− 的半径大小?
BD
4.下列各组微粒半径大小比较中,不正确的是( )A. r(K)>r(Na)>r(Li) B. r(Mg2+)>r(Na+)>r(F-)C. r( Na+)>r(Mg2+)>r(Al3+) D. r(Cl-)>r(F-)>r(F)
r(Na+)<r(Cl−)
r(Na+)<r(F−)
3、比较 Na 与 Na+、Cl 与 Cl− 的半径大小?
r(Na)>r(Na+)
r(Cl)<r(Cl−)
2.比较Na与Mg、Al的原子半径大小
1.比较O和S的半径大小
离子键++课件+-2024学年高一上学期化学人教版(2019)必修第一册

日积月累,水到渠成!
孝、诚、勤、忍,常怀感恩!
思考 哪些微粒能形成离子键?
活泼的金属元素(IA,IIA)和 活泼的非金属 元素(VIA,VIIA)之间的化合物。
活泼的金属元素和酸根离子形成的盐
强碱
AlCl3特殊,不是离子化合物
铵根离子和酸根离子(或活泼非金属元素)形成的盐
型离子化合物的是( D )
A.6与8 B.11与13 C. 11与16 D.12与17
日积月累,水到渠成!
孝、诚、勤、忍,常怀感恩!
5、X、Y、Z均为短周期元素,它们在周期表中
的相对位置如图所示,已知X、Y、Z三种元素的
质子数之和为31,试回答:
(1)X原子的电子式为
X
C
(2)Y的最高价氧化物的电子
(同种非金属元素)
极性键
H﹣Cl(结构式)
极性 共价键特点:共用电子对偏向氯原子,偏离氢原子,
(不同种非金属元素)氯原子带部分负电荷,氢原子带部分正电荷。
日积月累,水到渠成!
孝、诚、勤、忍,常怀感恩! 日积月累,水到渠成!
孝、诚、勤、忍,常怀感恩!
学与问 用电子式表示下列分子的形成过程
氧
+
水
硫化氢
氨 二氧化碳
日积月累,水到渠成!
孝、诚、勤、忍,常怀感恩!
二、共价键
定义:原子之间通过共用电子对所形成的相互作用, 叫做共价键。
成键微粒:原子
相互作用:共用电子对
成键元素:同种或不同种非金属元素
思考
不一定
含有共价键的化合物一定是共价化合物?
日积月累,水到渠成!
﹕﹕
孝、诚、勤、忍,常怀感恩!
1.2.1电解质与非电解质+课件+2024-2025学年高一上学期化学人教版(2019)必修第一册+

第一章 物质及其变化
第二节 离子反应
课时1 电解质与非电解质
教学目标与重难点
【教学目标】 1、使学生了解电离、 电解质的含义; 2、能准确判断出电解 质非电解质。
【重点】 1、电解质的概念。 2、电解质和非电解质的判断。
【难点】 1、电解质的概念。 2、电解质和非电解质的判断
灯泡不亮 灯泡不亮
不导电
蒸馏水
灯泡 不亮
NaCl溶液
KNO3溶液
熔融的 NaCl固体
灯泡亮 灯泡亮 灯泡亮
导电
实验结论:干燥的NaCl固体、KNO3固体都不导电,蒸馏水也不 导电。但是,NaCl溶液、KNO3溶液却能够导电
【注意】严格地说,蒸馏水也能导电,只是导电能力非常弱,看不 到灯泡发光(此处默认它不导电)。
;
(3) 能够导电的是 ①④⑤⑦⑧⑫⑬ 。
4、熔融的 MgCl2 能导电,所以 MgCl2 是电解质。 ( √ ) 5、熔融NaCl 能导电,是因为通电时NaCl 发生了电离。 ( ×) 6、NaCl 固体不导电,因为NaCl 固体中无带电微粒。 ( × ) 7、AgCl难溶于水,所以AgCl是非电解质。( × )
8、NaCl和HCl都是电解质,所以它们熔融状态下都能导电。 ( × ) 9、氯化氢溶于水能导电,但液态氯化氢不能导电。( √ ) 10、能导电的物质一定是电解质。 ( ×)
导电性
导电原因的探究 (1)Cu等金属、石墨等能导电?导电的原因是什么?
由于有自由移动的电子 (2)NaCl固体不导电,但NaCl溶液、熔融NaCl能导电的原因?
由于有自由移动 的带电离子!
导电性 注意: ①有离子不一定能导电,还需要看是否能自由移动(状态)。
第2节 第3课时 氢氧化铝、铝盐(课件)高一化学(人教版2019必修第一册)

氢
酸性:Al(OH)3 + 3HCl = AlCl3 + 3H2O
氧 化
化学性质
碱性:Al(OH)3 + NaOH = NaAlO2 + 2H2O
铝
不稳定性: 2Al(OH)3
3Al2O3+3H2O
制备
Al3+ + 3NH3·H2O =Al(OH)3↓+ 3NH4+ AlO2- + CO2 + 2H2O = Al(OH)3↓ + HCO3-
Al(OH)3+3HCl=AlCl3+3H2O Al(OH)3+NaOH=NaAlO2+2H2O
探究课堂
铝盐的化学性质
铝盐与碱的反应
和氢氧化钠
Al3+ + 3OH- = Al(OH)3↓
氢氧化铝可继续和氢氧化钠反应: Al(OH)3 + OH- = AlO2- + 2H2O
和氨水
Al3+ + 3NH3·H2O =Al(OH)3↓+ 3NH4+
探究课堂
【例1】下列条件下最终能得到氢氧化铝的是( C )
A. 将铝粉溶于冷水中 B. 氧化铝与水混合加热 C. 过量的氧化铝溶液加到一定量的氢氧化钠溶液中 D. 过量的氢氧化钠溶液加到一定量的氧化铝溶液中
课堂小结
白色胶状不溶于水的固体,有较强的吸附性
物理性质
用途
氢氧化铝胶体有较强吸附性,可用于净水 氢氧化铝碱性不强,可以用作胃酸中和剂
十二水硫酸铝钾是一种无机物,又称 明矾,化学式为KAl(SO4)2·12H2O,是一 种含有结晶水的硫酸钾和硫酸铝的复盐。
