第七章 氧化还原反应
合集下载
无机化学第7章氧化还原反应

实验结果与讨论
实验结果
通过实验观察和测量,可以记录到电 流计和电压计的变化情况,从而得出 氧化还原反应过程中电子转移的结论 。
结果讨论
根据实验结果,分析氧化还原反应的 特点和规律,探讨影响氧化还原反应 的因素,以及在实际生产中的应用。
THANKS FOR WATCHING
感谢您的观看
子被氧化。
电子从还原剂转移到氧化剂
02
电子从还原剂转移到氧化剂是氧化还原反应的本质,也是判断
氧化剂和还原剂的依据。
反应趋向于降低电位
03
在自发反应中,反应总是趋向于降低电位,即趋向于更稳定的
电子状态。
氧化还原反应的速率
1 2
反应速率与反应物浓度成正比
在一定条件下,反应速率与反应物浓度呈正比关 系,即反应物浓度越大,反应速率越快。
特点
氧化还原反应是电子转移的过程 ,通常伴随着元素氧化数的变化 ,并伴随着能量的变化。
氧化数与氧化态
氧化数
表示元素在化合物中的氧化态,通常用罗马数字表示。例如,在H₂O中,H的 氧化数为+1,O的氧化数为-2。
氧化态
表示元素在某个特定反应中的氧化状态,通常用希腊字母表示。例如,在反应 H₂O + O₂ → H₂O₂中,H的氧化态为+1,O的氧化态为-1。
在达到平衡后,如果增加某一反应物的浓度,平衡会向减少该物质浓度的方向移动。
压力变化对平衡的影响取决于反应前后气体分子数的变化
如果反应前后气体分子数发生变化,压力变化会对平衡产生影响;反之则不会。
04 氧化还原反应的应用
在化学工业中的应用
氧化还原反应在化学工业中有着广泛的应用,如合成 有机物、制备无机物和金属冶炼等。
大学分析化学第七章氧化还原滴定

Fe3++e-
Fe2
E' Fe(III)/Fe(II)
0.68V
化学计量点 后
化学计量点 前
E
Eθ' Ce(IV)/Ce(III)
0.059Vlg
cCe(IV) cCe(III)
E
Eθ' Fe(III)/Fe(II)
0.059Vlg
cFe(III) cFe(II1)7
化学计量点
E sp n 1 E n 1 1 ' n n 2 2 E 2 ' ( 适 用 于 两 个 电 对 都 是 对 称 电 对 ) E sp11.4V 4 1 1 10.6V 81.06V
试剂存在,则从Eθ′的定义式可见,副反应系数必然改变。 副反应系数改变又必然引起Eθ′和E改变。
Eθ Fe3+/Fe2+
0.77V
2Fe3++2I-=2Fe2++I2
Eθ I2/I-
0.54V
10
(四)沉淀的生成
对于某一电对,如果加入一种可以与氧化型或还原 型生成沉淀的试剂时,将会改变氧化型或还原型的浓度, 从而改变电极电位.
n
c red red ox
E
E 0.059V lg ox red 0.059V lg cox
ox / red
ox / red
n
red ox
n
cred
E
E ' 0.059V lg cox
ox / red
ox / red
n
cred
6
E
E 0.059V lg ox red 0.059V lg cox
对上述滴定选用何种指示剂?
(分析化学课件)第七章氧化还原滴定法

津 科 技
2MnO4- + 5C2O42- + 16H+ = 2Mn2+ + 10CO2↑+ 8H2O
大
学
②标准溶液标定时的注意“三度一点”
a.速度:该反应室温下反应速度极慢,利
用反应本身所产生的Mn2+起自身
催化作用加快反应进行。
b.温度:常将溶液加热到75~85℃。温度
高于90℃会使发生下述反应:
α为Fe的副反应系数
天 当电对的氧化态和还原态的分析浓度均 津 为1mol·L-1时,可得到:
科 技 大 学
EӨ′称为条件电势。
注意:
附录表16中列出部分氧化还原电对在不
同介质中的条件电势,均为实验测得值。
当缺乏相同条件下的条件电势时,可采用
天 条件相近的条件电势数据。
津
条件电极电势与标准电极电势差异很大。
津
科 若考虑副反应影响,则以K’代替K:
技 大 学
天 津 科 技 大 学
7.1.4 化学计量点时反应进行的程度
由化学计量点时氧化态与还原态浓度的 比值表示。
可以根据平衡常数求得。
天 津 科 技 大 学
例7.3 计算1mol/L HCl介质中,Fe3+与Sn2+ 反应的平衡常数及化学计量点时反应进行的 程度。已知 E F '3 /e F 2 e 0 .6V ,8 E S '4 n /S2 n 0 .1V 4
(3)间接碘法:利用I-的还原性。
①基本反应:
2I- - 2e → I2 I2 + 2S2O32-= S4O62-+2I-
(中性或弱酸性条件)连四硫酸根
天 津
P
H,S22IO234H2HO 2 SI2H22SH2O O 3
大学无机化学-第七章-氧化还原反应-电化学基础-课件

② 分别写出氧化剂被还原和还原剂被氧化的半反应 ③ 分别配平两个半反应方程式,等号两边的各
种元素的原子总数各自相等且电荷数相等 ④ 确定两半反应方程式得、失电子数目的最小公倍
数。将两个半反应方程式中各项分别乘以相应的 系数,使得、失电子数目相同。然后,将两者合 并,就得到了配平的氧化还原反应的离子方程式。 有时根据需要可将其改为分子方程式。
3Cl2 (g) + 6OH- = 5Cl- + ClO3- + 3H2O 3Cl2 (g) + 6NaOH = 5NaCl + NaClO3 + 3H2O
无机化学
§7.1 氧化还原反应的基本概念
例 4 配平方程式
Cr(OH)3 (s) + Br2 (l) + KOH
K2CrO4 + KBr
Cr(OH)3 (s) + Br2 (l)
电极组成:Pt , Cl2(p) | Cl- (a)
电极反应: Cl2 + 2e
2Cl-
无机化学
§7.2 电化学电池
3. 金属-金属难溶盐-阴离子电极
将金属表面涂有其金属难溶盐的固体,然后浸 入与该盐具有相同阴离子的溶液中构成的电极
电极组成:Ag ,AgCl(s)| Cl- (a) 电极反应:AgCl + e Ag + Cl电极组成:Hg ,Hg2Cl2(s)| Cl- (a) 电极反应:Hg2Cl2+2e 2Hg +2Cl-
无机化学
§7.1 氧化还原反应的基本概念
2-2 半反应法(离子—电子法) 配平原则 (1)反应过程中氧化剂得到的电子数等于还
原剂失去的电子数 (2)反应前后各元素的原子总数相等
种元素的原子总数各自相等且电荷数相等 ④ 确定两半反应方程式得、失电子数目的最小公倍
数。将两个半反应方程式中各项分别乘以相应的 系数,使得、失电子数目相同。然后,将两者合 并,就得到了配平的氧化还原反应的离子方程式。 有时根据需要可将其改为分子方程式。
3Cl2 (g) + 6OH- = 5Cl- + ClO3- + 3H2O 3Cl2 (g) + 6NaOH = 5NaCl + NaClO3 + 3H2O
无机化学
§7.1 氧化还原反应的基本概念
例 4 配平方程式
Cr(OH)3 (s) + Br2 (l) + KOH
K2CrO4 + KBr
Cr(OH)3 (s) + Br2 (l)
电极组成:Pt , Cl2(p) | Cl- (a)
电极反应: Cl2 + 2e
2Cl-
无机化学
§7.2 电化学电池
3. 金属-金属难溶盐-阴离子电极
将金属表面涂有其金属难溶盐的固体,然后浸 入与该盐具有相同阴离子的溶液中构成的电极
电极组成:Ag ,AgCl(s)| Cl- (a) 电极反应:AgCl + e Ag + Cl电极组成:Hg ,Hg2Cl2(s)| Cl- (a) 电极反应:Hg2Cl2+2e 2Hg +2Cl-
无机化学
§7.1 氧化还原反应的基本概念
2-2 半反应法(离子—电子法) 配平原则 (1)反应过程中氧化剂得到的电子数等于还
原剂失去的电子数 (2)反应前后各元素的原子总数相等
第7章 氧化还原反应

rH m 2537kJ mol
1
rGm 2879kJ mol 1
Mg(s) + 1/2O2(g) = MgO(s) 氧化反应(加氧的过程) CuO(s)+ H2(g)= Cu(s)+ H2O(g) 还原反应(去氧的过程) Mg(s) + Cl2(g)= MgCl2(s)
自身氧化还原反应(氧化值的升高和降低都 发生在同一个物质中不同元素上) 据氧化值的 变化情况
如:2KCl+5O3-2 = 2KCl-1 +3O20
歧化反应(氧化值的升高和降低都发生在同 一个物质中同元素上) 如:4KCl+5O3-2 = 3KCl+7O4 +KCl-1
D 所谓歧化反应,就是________
无加氧的过程和去氧的过义:失电子的过程,即氧化数升高的过程叫氧化; 得电子得过程即氧化数降低得过程叫还原。
P(s)+3/2Cl2(g)= PCl3(l)
H2(g) + Cl2(g) = 2HCl(g) 物质中元素氧化值(氧化数)的发生变化的 反应称为氧化还原反应
已知电池(-)Ag|AgCl|Cl-(1mol.L-1)||I-(1mol.L-1)|I2|Pt(+),
2Ag + I2+2Cl- = 2AgCl + 2I该电池电极反应是_______________________________________ , I2+2e = 2I正极反应_____________________________ ,
2Fe+2 =2Fe+3 + 2e
氧化反应 还原反应 氧化还原反应中 得失电子数相等
+
无机化学第七章+氧化还原反应

电池符号:(-) Al |Al3+ (aq) ‖ Zn2+ (aq) | Zn (+)
三、电对的电极电势、电池的电动势及其测量
M
-
Mn
“金属-金属离子电极”
当金属 M 与其盐 Mn+ 溶液接触时,有两种 过程可能发生:
Ms Mn(aq) ne 溶解
Mn (aq) ne Ms
中各元素氧化数的代数和等于该离子所带电荷数。
氧化数与化合价的区别与联系:二者有时相等,有时不等。
例题 7-1: 确定下列化合物中S原子的氧化数:
(a) H2SO4;(b) Na2S2O3;(c) K2S2O8;(d) SO32 ;
(e)
S4O
2 6
。
Solution
设题给化合物中 S原子的氧化数依次为 x1, x2, x3, x4和x5, 根据上述有关规则可得:
10 HClO3 + 3 P4 + 18 H2O = 10 HCl + 12 H3PO4
这里介绍一种配平 H+、OH- 和H2O 的方法供参考:
酸性介质: 多 n个O,加 2n个H+,另一边 加 n个 H2O
碱性介质: 多 n个 O,加 n个 H2O,另一边 加 2n个 OH–
中性介质: 左边多 n个 O,加 n个 H2O,右边加 2n个 OH – 右边多 n个 O,加 2n个 H+,左边加 n个 H2O
双电层之间的电势差就是M-M+电极的电极电势,即
金属高出溶液的电势差,用符号 M n /M 表示。
标准电极电势: Mn/M
是指标准电极的电势. 凡是符合标准态条件的 电极都是标准电极:
• 所有的气体分压均为1×105Pa • 溶液中所有物质的活度均为1mol·L-1 • 所有纯液体和固体均为纯净物质
三、电对的电极电势、电池的电动势及其测量
M
-
Mn
“金属-金属离子电极”
当金属 M 与其盐 Mn+ 溶液接触时,有两种 过程可能发生:
Ms Mn(aq) ne 溶解
Mn (aq) ne Ms
中各元素氧化数的代数和等于该离子所带电荷数。
氧化数与化合价的区别与联系:二者有时相等,有时不等。
例题 7-1: 确定下列化合物中S原子的氧化数:
(a) H2SO4;(b) Na2S2O3;(c) K2S2O8;(d) SO32 ;
(e)
S4O
2 6
。
Solution
设题给化合物中 S原子的氧化数依次为 x1, x2, x3, x4和x5, 根据上述有关规则可得:
10 HClO3 + 3 P4 + 18 H2O = 10 HCl + 12 H3PO4
这里介绍一种配平 H+、OH- 和H2O 的方法供参考:
酸性介质: 多 n个O,加 2n个H+,另一边 加 n个 H2O
碱性介质: 多 n个 O,加 n个 H2O,另一边 加 2n个 OH–
中性介质: 左边多 n个 O,加 n个 H2O,右边加 2n个 OH – 右边多 n个 O,加 2n个 H+,左边加 n个 H2O
双电层之间的电势差就是M-M+电极的电极电势,即
金属高出溶液的电势差,用符号 M n /M 表示。
标准电极电势: Mn/M
是指标准电极的电势. 凡是符合标准态条件的 电极都是标准电极:
• 所有的气体分压均为1×105Pa • 溶液中所有物质的活度均为1mol·L-1 • 所有纯液体和固体均为纯净物质
09无机第七章氧化还原反应与电极电势

以电极电势较大电对中的氧化型 物质为氧化剂,以电极电势较小 电对中的还原型物质为还原剂时, 氧化还原反应自发进行。
(一)定义 还原剂:组成元素的氧化值升高的物质。
氧化剂:组成元素的氧化值降低的物质。
还原剂氧化产物 氧化剂还原产物
(二)判断氧化剂、还原剂的原则
3
氧化剂 KMnO4 还原剂 H2S
+1 +4 -2
还原剂
Na2SO3作 氧化剂
三、氧化还原电对
(一)半反应 Cu2++Zn=Cu+Zn2+
还原反应 Cu2++2e- =Cu
正极 MnO4-+8H++5e- Mn2++4H2O
(-)pt,Cl2(P)Cl-(c1) H+(c2),Mn2+(c3),MnO4-(c4)pt(+)
第三节 电极电势 一、电极电势的产生
(一)产生
12
溶解 M(s)沉积MZ+(aq)+ze-
(二)影响电极电势的因素
(a)M 活泼, c(MZ+) 小,V溶>V沉,
(一)标准氢电极 某一电极的电极电势就是在指定温度下此电 极与标准氢电极所组成的原电池的电动势 1、组成 H+/H2 2、电极反应 2H+(aq)+2e- H2(g) 3、电极符号 H+(c)H2(P) ,pt 4、E(H+/H2)= 0.0000V (二)标准电极电势的测量
E(Ox/Red)的定义:某一电 极在标准状态下的电极电势
2MnO4-+10Cl-+16H+= 2Mn2++5Cl2 ↑ +8H2O (1)写出离子方程式(写离) (2)分为两个半反应(分)同一元素不同价态 (3)配平两个半反应(配半)先物质后电荷
(一)定义 还原剂:组成元素的氧化值升高的物质。
氧化剂:组成元素的氧化值降低的物质。
还原剂氧化产物 氧化剂还原产物
(二)判断氧化剂、还原剂的原则
3
氧化剂 KMnO4 还原剂 H2S
+1 +4 -2
还原剂
Na2SO3作 氧化剂
三、氧化还原电对
(一)半反应 Cu2++Zn=Cu+Zn2+
还原反应 Cu2++2e- =Cu
正极 MnO4-+8H++5e- Mn2++4H2O
(-)pt,Cl2(P)Cl-(c1) H+(c2),Mn2+(c3),MnO4-(c4)pt(+)
第三节 电极电势 一、电极电势的产生
(一)产生
12
溶解 M(s)沉积MZ+(aq)+ze-
(二)影响电极电势的因素
(a)M 活泼, c(MZ+) 小,V溶>V沉,
(一)标准氢电极 某一电极的电极电势就是在指定温度下此电 极与标准氢电极所组成的原电池的电动势 1、组成 H+/H2 2、电极反应 2H+(aq)+2e- H2(g) 3、电极符号 H+(c)H2(P) ,pt 4、E(H+/H2)= 0.0000V (二)标准电极电势的测量
E(Ox/Red)的定义:某一电 极在标准状态下的电极电势
2MnO4-+10Cl-+16H+= 2Mn2++5Cl2 ↑ +8H2O (1)写出离子方程式(写离) (2)分为两个半反应(分)同一元素不同价态 (3)配平两个半反应(配半)先物质后电荷
第七章氧化还原反应和氧化还原滴定(2013秋)分解

反应
Zn + Cu2+ = Cu + Zn2+ 由于Zn片与Cu2+直接接触,电子直接转移给Cu2+,这是电 子的流动是无序的,反应中放出的化学能转化为热能而得不到 电流。
图3-1 Cu-Zn原电池 符号 (-)Zn│ZnSO4‖CuSO4│Cu (+)
若在一只盛有 ZnSO4 溶液的烧杯中,插入 Zn 片,在一只盛 有CuSO4溶液的烧杯中,插入 Cu片,用盐桥(装满饱和KCl溶 液和琼脂凝成的胶冻状物质的 U形管,离子可以在管内自由移 动)连接两只烧杯中的溶液,用导线连接Zn片和Cu片,并在导 线中连一电流计。当电路闭合时,就可以看到电流计指针发生 偏转,证明有电子从Zn片流向Cu片。通过这样一个装置,就把 系统降低的能量转化成电能。这种装置叫做原电池。
④合并半反应,两式各乘以适当的系数,使得失电子总数相 等,然后将两式相加,消去电子合并为一个离子反应式。 2×) MnO4- + 8H+ + 5e- = Mn2+ + 4H2O +) 5×) SO32- + H2O –2e- = SO42- + 2H+
整理后为 2MnO4- + 5SO32- + 6H+ = 2Mn2+ + 5SO42- + 3H2O
若氧化还原反应是在水溶液中进行的,可以只写参加反 应的离子。 MnO4- + 5Fe2+ + 8H+ = Mn2+ + 5Fe3+ + 4H2O 这样的反应方程式叫做离子方程式。
3、氧化还原电对:
任何一氧化还原反应都可以分为氧化反应和还原反应两部分。 如:Cu2+ + Zn = Zn2+ + Cu 还原反应:Cu2+ + 2e - = Cu 氧化反应:Zn - 2e- = Zn2+ 称作氧化还原反应的半反应。每一个半反应均表示某一元 素的两种氧化数物质之间的转化,常将高氧化数物质称为氧化 态(或氧化型)物质,低氧化数物质称的概念是为了说明氧化还原反应,氧化剂,还原剂等问 题而人为地提出的。 氧化数是假设将化合物中成键电子都归电负性较大的原子, 从而求得原子所带的形式电荷数,此形式电荷数即为原子在化合 物中的氧化数。 简单的说:氧化数是化合物中某元素所带形式电荷的数值。 (3)确定元素氧化数的规则: 1)单质的氧化数为零。 2)在化合物中各元素氧化数的代数和等于零。在多原子离子 中,各元素氧化数的代数和等于离子所带的电荷数。 3)氢在化合物中的氧化数一般为+1,但在活泼金属的氢化物 (如NaH、CaH2)中,氢的氧化数为-1。 4)氧在化合物中的氧化数一般为-2;但在过氧化物(如H2O2 、 BaO2 )中,氧的氧化数为- 1 ;在超氧化物( KO2 )中,氧的 氧化数为-1/2;在氟化氧(OF2)中,氧的氧化数为+2。
第七章氧化还原反应和电极电势案例
Mn2++ BiO3-+H+→ MnO4- + Bi3+ (2)拆成两个半反应 还原半反应:BiO - →Bi3+ 3 氧化半反应:Mn2+→ MnO4-
(3)配平两个半反应
A. 原子配平——配平反应式两边的原子个数
BiO3-+6H+=Bi3++3H2O BiO3- → Bi3+ Mn2+ → MnO4- Mn2++4H2O=MnO4-+8H+
[例]计算K2Cr2O7中Cr和Fe3O4中Fe的氧 化值。 [解] K2Cr2O7
2(+1)+ 2x+ 7(-2) = 0
x=+6 Fe3O4
3x+ 4(-2)= 0
8 x=+ 3
二、氧化剂和还原剂
Zn + 2HCl = ZnCl2 + H2
Zn→Zn2+, 失去电子 氧化值0→+2升高,被氧化 还原剂: 氧化值升高的物质
测得298.15K E=0.3419V -E E E= + - = 0.3419 E(Cu2+/Cu)= 0.3419(V) 测E(Zn2+/Zn)
(-)ZnZn2+(1molL-1)||H+(1molL-1)H2(100kPa),pt (+)
298.15K E=0.7618V 氢正极 锌负极 -E 2+ E E= + - =0.7618 = 0-E Zn /Zn E(Zn2+/Zn)=-0.7618(V)
酸性介质 反应物 碱性(中 性) 反应物 少1个O加1个H2O,生成2个H+ 多1个O加2个H+,生成1个H2O 多1个O加1个H2O,生成2个OH-
无机化学课件第7章 氧化还原反应

3Fe2(SO4)3 + Cr2(SO4)3 + 7H2O + K2SO4
第一节
第一章
2、离子-电子法
现以 KMnO Na SO +H SO MnSO +K SO +H O反
4
2
3
2
4
4
2
4
2
应为例,用离子- 电子法配平其方程。
⑴ 以离子反应式表示氧化还原反应:
rGm ≤ W′
如果反应是热力学可逆,上式取等号;如果反应是自 发进行的,取小于号。即系统对环境所做的最大功的 绝对值不会超过| rGm | , 只能小于等于| rGm | 。
第二节
第一章
在298.15 K和标准状态下进行的化学反应:
Zn(s)+Cu2+ ===Zn2+ +Cu(s)
K2Cr2O7 + FeSO4 + H2SO4 → Fe2(SO4)3 + Cr2(SO4)3 找出氧化剂和还原剂反应前后氧化数的变化:
2×(3-6)= -6
+6
+2
+3
+3
K2Cr2O7 + FeSO4 + H2SO4 → Fe2(SO4)3 + Cr2(SO4)3
3-2=1
第二节
第一章
锌-铜原电池
原电池是由两个半电池组成,每个半电池又称作一个电极, 电极包括传导电子的金属及组成半电池的溶液。
第二节
第一章
2、电极反应 负极: Zn Zn2+ (aq)+2e (氧化反应) 正极: Cu2+ (aq)+2e Cu (还原反应)
第一节
第一章
2、离子-电子法
现以 KMnO Na SO +H SO MnSO +K SO +H O反
4
2
3
2
4
4
2
4
2
应为例,用离子- 电子法配平其方程。
⑴ 以离子反应式表示氧化还原反应:
rGm ≤ W′
如果反应是热力学可逆,上式取等号;如果反应是自 发进行的,取小于号。即系统对环境所做的最大功的 绝对值不会超过| rGm | , 只能小于等于| rGm | 。
第二节
第一章
在298.15 K和标准状态下进行的化学反应:
Zn(s)+Cu2+ ===Zn2+ +Cu(s)
K2Cr2O7 + FeSO4 + H2SO4 → Fe2(SO4)3 + Cr2(SO4)3 找出氧化剂和还原剂反应前后氧化数的变化:
2×(3-6)= -6
+6
+2
+3
+3
K2Cr2O7 + FeSO4 + H2SO4 → Fe2(SO4)3 + Cr2(SO4)3
3-2=1
第二节
第一章
锌-铜原电池
原电池是由两个半电池组成,每个半电池又称作一个电极, 电极包括传导电子的金属及组成半电池的溶液。
第二节
第一章
2、电极反应 负极: Zn Zn2+ (aq)+2e (氧化反应) 正极: Cu2+ (aq)+2e Cu (还原反应)
第七章 氧化还原反应

14
答案 :用氧化数法配平下列反应方程式 1. 4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3+3H2O 2. 6H2O2+ Cr2(SO3)3 = H2Cr2O7 + 3H2SO4+2H2O 3.2KMnO4 = K2MnO4+ MnO2 + O2 4.2KMnO4+5Na2C2O4+16HCl= 2MnCl2+10CO2+2KCl+10NaCl+8H2O 用离子一电子法配平下列反应式 1.Cr2O72-+3H2S+8H+ = 2Cr3+ + 3S +7H2O 2.2MnO4- + 3SO32- = 2MnO2+3 SO42-+2OH(酸性介质) (碱性介质)
3.电对 电对 氧化型物质 + ne-
高氧化态
还原型物质
低氧化态
(一定条件下 可相互转化)
Cu2+ + 2e- Cu 称为氧化-还原电对 Zn2+ + 2e- Zn 也可表示为:Cu2+/Cu , Zn2+/Zn
SO32―-2e―→ SO42―
④使氧化剂得电子总数和还原剂失电子总数相等,然 后相加。 2MnO4― + 16 H+ + 10e-→ 2 Mn2+ + 8H2O 5SO32― + 5 H2O -10e―→ 5SO42― + 10 8H+
+
2MnO4― +5SO32― + 6 H+ → 2 Mn2+ + 5SO42― +3 H2O 2KMnO4 +5K2SO3 +3 H2SO4→ 2MnSO4 + 6K2SO4 + 3 H2O
答案 :用氧化数法配平下列反应方程式 1. 4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3+3H2O 2. 6H2O2+ Cr2(SO3)3 = H2Cr2O7 + 3H2SO4+2H2O 3.2KMnO4 = K2MnO4+ MnO2 + O2 4.2KMnO4+5Na2C2O4+16HCl= 2MnCl2+10CO2+2KCl+10NaCl+8H2O 用离子一电子法配平下列反应式 1.Cr2O72-+3H2S+8H+ = 2Cr3+ + 3S +7H2O 2.2MnO4- + 3SO32- = 2MnO2+3 SO42-+2OH(酸性介质) (碱性介质)
3.电对 电对 氧化型物质 + ne-
高氧化态
还原型物质
低氧化态
(一定条件下 可相互转化)
Cu2+ + 2e- Cu 称为氧化-还原电对 Zn2+ + 2e- Zn 也可表示为:Cu2+/Cu , Zn2+/Zn
SO32―-2e―→ SO42―
④使氧化剂得电子总数和还原剂失电子总数相等,然 后相加。 2MnO4― + 16 H+ + 10e-→ 2 Mn2+ + 8H2O 5SO32― + 5 H2O -10e―→ 5SO42― + 10 8H+
+
2MnO4― +5SO32― + 6 H+ → 2 Mn2+ + 5SO42― +3 H2O 2KMnO4 +5K2SO3 +3 H2SO4→ 2MnSO4 + 6K2SO4 + 3 H2O
无机化学(大连理工)第七章。ppt教材

配平步骤:
①用离子式写出主要反应物和产物(气体、纯 液体、固体和弱电解质则写分子式)。
②分别写出氧化剂被还原和还原剂被氧化的半 反应。
③分别配平两个半反应方程式,等号两边的各 种元素的原子总数各自相等且电荷数相等。
④确定两半反应方程式得、失电子数目的最 小公倍数。将两个半反应方程式中各项分别乘以 相应的系数,使得、失电子数目相同。然后,将 两者合并,就得到了配平的氧化还原反应的离子 方程式。有时根据需要可将其改为分子方程式。
• 1) 2Mg(s)+O2(g) = 2MgO(s) 与氧结合
• 2) Mg→Mg2+ + 2e
电子转移
• 3) 2P(s)+2Cl2(g) = 2PCl3(l) 电子偏移
氧化还原反应—— 有电子得失或电子转移的反
Cu应2+。(aq) + Zn(s) Zn2+ (aq) + Cu(s) 得失电子
H2(g)+ Cl2(g) 2HCl(g)
例1:配平反应方程式
KMnO4 (aq) + K2SO3(aq) 酸性溶液中 MnSO4 (aq) + K2SO4 (aq)
①
MnO
4
+
SO
2 3
SO
2 4
+
Mn 2+
②
MnO
4
+ 8H +
+ 5e
=
Mn 2+
+
4H 2O
①
SO
2 3
+
H2O
=
SO
2 4
+
2H +
+
无机化学第7章氧化还原反应

2020/8/4
第七章 氧化还原反应(环境2015)
3/33
§7.1 氧化还原反应的基本概念
一. 氧化数(值) 二. 氧化还原反应方程式的配平
2020/8/4
第七章 氧化还原反应(环境2015)
4/33
一.氧化值 (oxidation number)
1.氧化还原概念的发展
1) 2Mg(s)+O2(g) = 2MgO(s) 2) Mg→Mg2+ + 2e
氧化数与化合价的区别2
1.氧化数只指原子而不指原子团,而化合价 既可指示原子又指原子团。 (例:OH-)
2.化合价只能是整数,不能是分数,而氧化 数可以用分数。 (例:Fe3O4 )
3.氧化数纯粹是为了说明氧化态而引入的人 为规定的概念,它可以是正数、负数或分数。 氧化数实质上是一种形式电荷数,表示元素 原子平均的、表观的氧化状态。
还原型1+氧化型2
氧化型1+还原型2
2020/8/4
第七章 氧化还原反应(环境2015)
6/33
2.氧化还原电对(redox couple)
对氧化还原反应 Cu2+ + Zn = Zn2+ + Cu O1 R1 O2 R2
Cu2+ /Cu , Zn2+ /Zn 称为氧化还原电对,
氧化值小
氧化态和还原态为共轭关系-电子得失:Βιβλιοθήκη 连四硫酸根 离子S2
O
2 3
S4
O
2 6
Fe3O4
I的氧化值为 7
S的氧化值为 2 S的氧化值为 2.5 Fe的氧化值为 8
3
2020/8/4
第七章 氧化还原反应(环境2015)
第七章、氧化还原反应

[H+]=1.0mol/L时,反应正向进行,而酸度降低反应方 向相反。(自学例7-5,注意用条件电位计算与标准电 位计算时公式的区别。)
2.H+ 与氧化型或还原型结合成难离解化合物的 影响 有些电对的电极电位,从表面上来看似乎与H+浓 度无关。例如
Fe(CN)63-+e-=Fe(CN)64E0=0.356V 从其半电池反应来看,虽然没有H+参加反应、但 实际上,当溶液的pH值小于4时,其电极电位却迅速 增大,这是由于HFe(CN)63-是一种较弱的酸。
氧化还原反应的条件平衡常数K'值的大小由氧化 剂和还原剂两电对的条件电位之差决定的。一般讲 E1o'、E2o'之差越大,K'值也越大,反应进行得越完全。 如E1o'和E2o'相差不大,则反应进行较不完全。那么K' 值达到多大时,反应才能进行完全呢?现在以氧化剂 Ox1滴定还原剂Red2的反应 aOx1+bRed2=aRed1+bOx2
'
当反应达到平衡时, φ1、φ2相等。
a b CRe d1 COx2 n(1 ' 2 ' ) lg K ' lg a b ( 7 15 COx1 CRe d 2 0.059
)
式中, n为两电对转移电子数的最小公倍数。
n1=n/a, n2=n/b
θ′、φ θ′为氧化剂、还原剂电对的条件电位, φ1 2
力为1.013×105Pa。
任一氧化还原反应: Ox + ne = Red 氧化态 + ne = 还原态 能斯特公式:
0.0592 a(氧化态)(高价态) lg n a(还原态(低价态) )
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3
无机化学
第七章 氧化还原反应
杨 勤
确定氧化数的规则
1、单质中元素的氧化数为0 2、中性分子中,所有原子氧化数代数和等于0 3、离子内所有原子氧化数代数和等于离子的电荷数 4、在大多数化合物中氢原子氧化数为+1,但在金属氢 化物中为-1 5、在化合物中氧的氧化数为-2,过氧化物中为-1,氧 氟化物中为+2或+1(如OF2和O2F2) 6、在共价化合物中,将属于两原子的共用电子对指定 给两原子中电负性更大的原子以后,在两原子上 形成的电荷数就是它们的氧化数。
5
无机化学
第七章 氧化还原反应
杨 勤
元素的原子(离子)氧化数升高的反应叫氧化反应
元素的原子(离子)氧化数降低的反应叫还原反应
使别的元素氧化而本身被还原的物质叫做氧化剂 使别的元素还原而本身被氧化的物质叫做还原剂
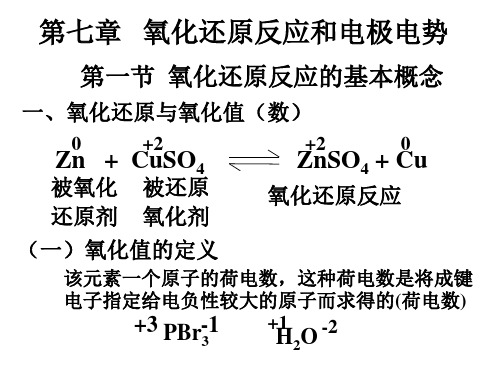
CuSO4 + Zn = ZnSO4 + Cu
Zn:
Cu:
氧化数升高,被氧化,是还原剂
第七章 氧化还原反应
杨 勤
(2)分别写出氧化剂被还原和还原剂被 氧化的 两个半反应
Cr2O72-
Cr3+
2I-
I2
(3)分别配平两个半反应方程式,使每 个半反应方程式等号两边的各种元素的 原子总数各自相等且电荷数相等:
+6e- Cr2O72-
+
14H+
= =
2 Cr3+
+ 7H2O
2I-
I2
+2e-
第七章 氧化还原反应
杨 勤
标准电动势EөMF
298.15K下的标准电动势以
E өMF (298.15K)表示
E MF表示了在标准状态下还原剂的还原能力和氧化
ө
剂的氧化能力的相对大小
可以用电动势来推断反应进行的方向的程度
无机化学
第七章 氧化还原反应
杨 勤
四、 原电池的最大功与Gibbs函数
Eθ (H+/H2)=0.00V
33
无机化学
第七章 氧化还原反应
杨 勤
(2)甘汞电极(SCE)
参比电极(必须比较稳定) 甘汞电极(Hg2Cl2与KCl组成) 电极反应: Hg2Cl2(s) + 2e = 2Hg (l) + 2Cl-(aq) E = 0.2415 V (饱和甘汞电极) Eө = 0.268 V (标准甘汞电极)
无机化学 第七章 氧化还原反应 杨 勤
§7.3 电极电势
32
无机化学
第七章 氧化还原反应
杨 勤
一、标准氢电极 常用电极
1. 标准氢电极(SHE)(25℃)
被吸附的氢与溶液中的氢 离子建立了如下的平衡:
2H+ + 2e
(1molL-1)
H2 (g)
(100kPa)
规定: 标准氢电极的标准电极电势
17
FeS2 + HNO3 Fe2(SO4)3 + NO2
无机化学
第七章 氧化还原反应
杨 勤
P + NaOH + H2O NaH2PO2 + PH3
(1) P + OH- H2PO2- + PH3 (2) P H2PO2P PH3 (3) P + 2OH- = H2PO2- + e 3 P + 3H2O + 3e = PH3 + 3OH1 (4) 4P + 3OH- + 3H2O = 3H2PO2- + PH3 (5) 4P + 3NaOH + 3H2O = 3NaH2PO2 + PH3
无机化学
第七章 氧化还原反应
杨 勤
(5)核对(检查方程式两边电荷的代数和及原 子数目是否相等) (6)写成分子反应方程式:
K2Cr2O7 + 6KI + 14HCl
= 2CrCl3
+ 3I 2 + 8KCl +7H 2O
无机化学
第七章 氧化还原反应
杨 勤
练习
配平: (1) (2)
Zn + HgO
第七章 氧化还原反应 电化学基础
主要内容
配平氧化还原方程式 原电池电动势 原电池符号 标准电极电势
能斯特方程
氧化还原反应的方向和程度
2
无机化学
第七章 氧化还原反应
杨 勤
§7.1 氧化还原反应的基本概念
一、 氧化值(oxidation states)
氧化态: 元素的原子在化合物中的氧化状态简 称氧 化态,以数字表示这种氧化态称氧化值 氧化值即原子的形式电荷
氧化数降低,被还原,是氧化剂
6
无机化学
第七章 氧化还原反应
杨 勤
二、* 氧化还原方程式配平
练习一:HClO3 + P4 HCl + H3PO4 练习二: HNO3 + CuS Cu(NO3)2 + H2SO4 + NO 练习三: KMnO4 + K2SO3 + H2SO4(稀) MnSO4 + K2SO4 练习四: As2S3 + HNO3 H3AsO4 + H2SO4 + NO
19
无机化学
第七章 氧化还原反应
杨 勤
§7.2 电化学电池
一、 原电池(primary cell)的构造 1. 原电池概念
2e
Zn
+
2+ Cu
=
2 Zn+
+
Cu
原电池:设计一定的装置,换个方式进行上述反应, 让电子转移变成电子的定向移动
20
无机化学
第七章 氧化还原反应
杨 勤
电池反应
Cu – Zn原电池反应为:
25
无机化学
第七章 氧化还原反应
杨 勤
1. SnCl2(c1) + HgCl2(c) = Hg + SnCl4(c2)
(–) Pt SnCl2(c1), SnCl4(c2)|| HgCl2 (c) ,Hg(l) Pt (+) 2. 2Fe2+(0.010mol.L-1) + Cl2(pө) =2 Fe3+(0.10mol.L-1) + 2Cl-(2.0mol.L-1) (–) Pt Fe2+(0.010mol.L-1), Fe3+(0.10mol.L-1) || Cl-(2.0mol.L-1) Cl2(pө) Pt (+)
在等温等压的过程中,体系的自由能减小值(-ΔG)等 于对外所做的最大有用功。 在等温等压电化学反应中,有用功为电功(ZFEMF) 即: -ΔrGm = Wf (非膨胀功) ΔrGm =W电= -EQ = -ZFEMF F: 法拉第常数(96485 c.mol-1) Z: 电池反应所涉及的电荷数 E: 电池电动势 ΔrGөm= -ZFEөMF=-ZF(Eө+-Eө-)
负极(negative electrode) :原电池内发生氧化反 应的电极 正极(positive electrode) :原电池内发生还原反应 的电极
23
无机化学
第七章 氧化还原反应
杨 勤
电极:氧化还原电对 ( Ox/Red )
oxidation-reduction couple:同一元素的氧化态和 还原态物质
4
无机化学
第七章 氧化还原反应
杨 勤
MnO4- , Fe3O4 , K2Cr2O7 , Na2S2O3, Na2S4O6 , K2S2O8 , CH4 , CH3Cl , CH2Cl2 , CHCl3 CCl4 C2H4O 由此可知:氧化数是按一定规则指定的形式电 荷数,它可以是负数,也可以是正数,还可以 是分数。
锌电极(负极):氧化反应 Zn
Zn2+ +2e
Cu (+
=
2 Zn+
铜电极(正极):还原反应 Cu2+ +2e
电Hale Waihona Puke 反应:Zn +2+ Cu
+
Cu
22
无机化学
第七章 氧化还原反应
杨 勤
半电池:氧化或还原部分 半电池反应或电极反应:在两个半电池中所发生 的氧化还原反应 电池反应:氧化和还原的总反应
化学上规定:
7
无机化学
第七章 氧化还原反应
杨 勤
10HClO3 +3 P4 +18H2O
= 10HCl + 12H3PO4
14HNO3 + 3CuS = 3Cu(NO3)2 + 3H2SO4 +8 NO + 4H2O 2 KMnO4 +5 K2SO3 +3 H2SO4(稀)= 2MnSO4 + 6 K2SO4+3H2O 3As2S3 + 28HNO3 +4H2O = 6 H3AsO4 +9 H2SO4 + 28 NO
18
无机化学
第七章 氧化还原反应
杨 勤
H2O2+Cr2(SO4)3+KOH K2CrO4+K2SO4+H2O
(1) H2O2 + Cr3+ H2O + CrO42(2) H2O2 OH2Cr3+ 2CrO42(3) H2O2+2e = 2 OH3 2Cr3+ +16OH- = 2CrO42- +8H2O+6e 1 (4) 3H2O2+ 2Cr3+ + 10OH- =2 CrO42- +8H2O (5) 3H2O2+ Cr2(SO4)3 +10KOH =2K2CrO4+3K2SO4+8H2O
