阳离子脂质体复合物与脂质!鱼精蛋白
阳离子脂质体递送STAT3 siRNA抑制黑色素肿瘤细胞探究

阳离子脂质体递送STAT3 siRNA抑制黑色素肿瘤细胞探究邹瑞;彭正松【摘要】利用阳离子脂质体作为载体,用其搭载鱼精蛋白与STAT3 siRNA复合物,通过一系列实验证实该复合体系可显著抑制STAT3基因在黑色素瘤细胞B16中的表达,促进肿瘤细胞的凋亡.首先对载体材料进行了一系列表征测定,检测了不同复合比例下载体和siRNA复合物的粒径和电位.利用载体和siRNA的复合物对B16细胞进行转染并测定转染效率,随后对复合材料的毒性进行了检测.此外还进行了细胞凋亡、平板克隆、荧光定量PCR以及Western Blot等一系列实验来进一步确定载体复合物的有效性.实验结果表明,阳离子脂质体搭载复合了鱼精蛋白的STAT3siRNA表现出了良好的靶向治疗性及优秀的递送效率,且复合体系稳定性良好,毒性低.【期刊名称】《西昌学院学报(自然科学版)》【年(卷),期】2019(033)001【总页数】6页(P28-33)【关键词】阳离子脂质体;鱼精蛋白;siRNA;STAT3【作者】邹瑞;彭正松【作者单位】西华师范大学生命科学学院,四川南充 637009;西华师范大学生命科学学院,四川南充 637009;西昌学院农业科学学院,四川西昌 615000【正文语种】中文【中图分类】R739.51998年,华盛顿卡耐基研究院的Fire A 等首次在秀丽隐杆线虫(C.elegans)发现了一个双链RNA能够沉默蠕形秀丽隐杆线虫基因表达,并证明上述现象属于转录后水平的基因沉默[1],这一现象正式被称为 RNA 干扰(RNAi)。
从 1999年人们发现RNAi 现象[2]的存在到 2001年,RNAi 技术正式应用于哺乳动物细胞基因功能的研究中[3],短短几年内,RNAi技术得到了飞速发展。
毫无疑问,若RNAi技术能有效应用于临床,这将是基因治疗领域的一大突破。
RNAi 能够抵抗转基因或外源性病毒的侵犯。
在体外设计与靶基因mRNA 同源互补的双链RNA后,将这段双链RNA 导入目的细胞,其能够通过同源互补,从而靶向性地降解该mRNA,达到靶基因沉默的效果。
mrna 阳离子 脂质体

mrna 阳离子脂质体mRNA阳离子脂质体是一种重要的基因递送系统,被广泛应用于基因治疗和疫苗开发领域。
本文将介绍mRNA阳离子脂质体的定义、结构、工作原理以及在基因治疗和疫苗开发中的应用。
一、定义mRNA阳离子脂质体是一种由阳离子脂质包裹的mRNA分子的纳米粒子。
阳离子脂质由正电荷的脂质组成,能够与负电荷的mRNA结合形成稳定的复合物。
二、结构mRNA阳离子脂质体通常由四个组分构成:mRNA负载部分、阳离子脂质、PEG修饰剂和靶向配体。
1. mRNA负载部分:mRNA负载部分是mRNA阳离子脂质体的核心组成部分,负责携带目标基因信息。
mRNA负载部分由独特的序列决定,可以编码特定的蛋白质。
2. 阳离子脂质:阳离子脂质是mRNA阳离子脂质体的外层包裹物,由正电荷的脂质分子构成。
阳离子脂质能够与mRNA负载部分中的负电荷相互作用,形成稳定的纳米粒子。
3. PEG修饰剂:PEG修饰剂是一种带有聚乙二醇基团的化合物,用于提高mRNA阳离子脂质体的稳定性和生物相容性。
PEG修饰剂可以降低mRNA阳离子脂质体与免疫系统的相互作用,延长其在体内的循4. 靶向配体:靶向配体是一种结合在mRNA阳离子脂质体表面的分子,能够与特定的细胞受体结合,实现靶向递送。
靶向配体可以提高mRNA阳离子脂质体对特定细胞的选择性。
三、工作原理mRNA阳离子脂质体通过一系列的步骤实现基因递送。
首先,阳离子脂质与mRNA负载部分相互作用,形成稳定的复合物。
然后,mRNA 阳离子脂质体通过靶向配体与特定的细胞受体结合,实现靶向递送。
一旦进入细胞内,mRNA负载部分被释放,并被细胞的核糖体翻译为蛋白质。
四、应用mRNA阳离子脂质体在基因治疗和疫苗开发中具有广泛的应用前景。
1. 基因治疗:mRNA阳离子脂质体可以用于治疗遗传性疾病和癌症等疾病。
通过携带特定的修饰mRNA,mRNA阳离子脂质体能够在细胞内编码所需的蛋白质,实现疾病的基因矫正。
mRNA_疫苗的研究及应用进展

生物技术进展 2023 年 第 13 卷 第 4 期 492 ~ 498Current Biotechnology ISSN 2095‑2341进展评述ReviewsmRNA 疫苗的研究及应用进展蔚丹1 , 马云龙1 , 万方1 * , 武建强2 *1.内蒙古农业大学生命科学学院,呼和浩特 010010;2.内蒙古医科大学基础医学院,呼和浩特 010107摘要:与传统疫苗相比,mRNA 疫苗具有高效、安全、低成本等优点,但它的应用一直受到体内传递不稳定、翻译效率较低等技术问题的限制。
新型冠状病毒的流行及其疫苗的研发加速了mRNA 疫苗的研发和批准,特别是在mRNA 结构修饰及脂质纳米颗粒构建等方面有了突破性进展,如使用优化后核苷、帽子结构的mRNA 疫苗稳定性大大提高,替换低使用频率的密码子可提高其翻译效率等。
目前常用的mRNA 递送系统有脂质纳米颗粒、聚合物载体、类病毒载体等。
综述了mRNA 疫苗的发展历程、作用机制、修饰技术突破和递送系统方面的研究及应用进展,以期促进mRNA 疫苗的深入研究及应用。
关键词:mRNA 疫苗;作用机制;递送系统DOI :10.19586/j.20952341.2023.0015中图分类号:Q812, R373 文献标志码:AAdvances on Research and Application of mRNA VaccinesYU Dan 1 , MA Yunlong 1 , WAN Fang 1 * , WU Jianqiang 2 *1.Faculty of Life Science , Inner Mongolia Agricultural University , Huhehot 010010, China ;2.College of Basic Medicine , Inner Mongolia Medical University , Huhehot 010107, ChinaAbstract :Compared with traditional vaccines , mRNA vaccines have the advantages of high efficiency , safety and low cost , but its application has been limited by technical problems such as unstable in vivo delivery and low translation efficiency. The prevalence of SARS -CoV -2 virus and their vaccine development have accelerated the development and approval of mRNA vaccines ,especially breakthroughs in mRNA structural modification and construction of lipid nanoparticles , for example , the stability of mRNA vaccines using optimized nucleoside and cap structures is greatly improved , and the replacement of codons with low fre⁃quency of use can improve their translation efficiency. The commonly used mRNA delivery systems are lipid nanoparticles , poly⁃mer vectors , virus -like vectors , etc. The research and application progress of development history , mechanism of action , techno⁃logical breakthroughs in modification , and delivery systems of mRNA vaccines were reviewed in order to promote the in -depth re⁃search and application of mRNA vaccines.Key words :mRNA vaccine ; mechanism of action ; delivery systemmRNA 疫苗是一种通过体外转录技术合成后选择合适的递送系统将mRNA 运输进入机体,依靠细胞自身的翻译系统将mRNA 翻译成目标蛋白,从而达到临床治疗目的的先进疗法[1]。
NGX6基因联合顺铂治疗肺癌的体内外研究_张敬

NGX6基因联合顺铂治疗肺癌的体内外研究张敬1,王哲2,史晓宇1,孟玮1,马峰1,王金3,赵永明3(1.河北北方学院附属第一医院肿瘤内科,河北张家口075000;2.河北北方学院附属第一医院泌尿外科,河北张家口075000;3.河北北方学院药学系,河北张家口075000)资助项目:张家口市2013年度科学技术研究与发展计划(1321099D )作者简介:张敬,女,硕士,主治医师,研究方向:肺癌治疗的基础与临床研究,E-mail :zhangjingbfxy@163.com 。
[摘要]目的探讨NGX6基因联合顺铂对肺癌A549细胞和NCI-H1975细胞的体外抑制作用及其体内抗肿瘤效果。
方法以脂质体鱼精蛋白为载体,构建载NGX6基因的阳离子脂质体-DNA 复合物。
将A549细胞和NCI-H1975细胞均分为NGX6组(载NGX6基因的LPD ,NGX6浓度为30μg /mL )、顺铂组、NGX6+顺铂组,以PBS 为阴性对照。
采用MTT 检测各组对A549细胞和NCI-H1975细胞的生长抑制作用;克隆形成实验计算克隆形成率和抑制率;构建肺癌移植肿瘤模型,将裸鼠分为同细胞处理相同的4组,每组10只,统计各组裸鼠肿瘤体积和生存期,观察各组裸鼠肿瘤组织细胞凋亡情况。
结果对肿瘤细胞的增殖抑制能力显著强于NGX6组和顺铂(P <0.01)。
克隆形成实验结果表明,NGX6+顺铂组的肿瘤细胞克隆数小于NGX6组和顺铂组(P <0.01)。
体内抗肿瘤实验结果表明,NGX6+顺铂组对荷瘤裸鼠的肿瘤生长抑制率显著高于NGX6组和顺铂组(P <0.01)。
NGX6+顺铂组,NGX6组,顺铂组和生理盐水组荷瘤裸鼠的中位生存期分别为43、31、29、15d 。
结论NGX6基因联合顺铂能够有效抑制肺癌细胞的增殖和肿瘤的生长。
表明基因干预联合细胞毒性药物化疗能为肿瘤的治疗提供了一种新的治疗手段。
[关键词]NGX6基因;肺癌;顺铂;A549细胞;NCI-H1975细胞;体内;体外[中图分类号]R734.2[文献标识码]A [文章编号]1005-1678(2015)05-0033-04NGX6gene combined with cisplatin in treatment oflung cancer in vitro and in vivoZHANG Jing 1,WANG Zhe 2,SHI Xiao-yu 1,MENG Wei 1,MA Feng 1,WANG Jin 3,ZHAO Yong-ming 3(1.Department of Oncology ,The First Attached Hospital of Hebei Northern University ,Zhangjiakou 075000,China ;2.Department of Urology ,The First Attached Hospital of Hebei Northern University ,Zhangjiakou 075000,China ;3.Department of Pharmacy ,Hebei North University ,Zhangjiakou 075000,China )[Abstract ]Objective To evaluate the effect of NGX6combined with cisplatin on the inhibition rate of A549cells and NCI-H1975cells and antitumor effects in vivo.Methods The NGX6was loaded in the LPD ,and prepare Liposome protamine DNA complexes.A549cells and NCI-H1975cells were seperately divided into NGX6group (30μg /mL NGX6concentration ),cisplatin group ,NGX6+cisplatin group ,PBS as negative control group.The effect of cytotoxicity of four group on A549cells and NCI-H1975cell were evaluated by MTT assay.the clone forming rate and the inhibition rate were determined by Cell colony count.lung transplantation tumor model were successfully established ,then nude mice were divided into four groups as abeve ,each group of 10,tumor size and survival period were determined tumor cell apoptosis were observed.Results The cell viability of A549cells and NCI-H1975cells of (NGX6+cisplatin )were lower than that of NGX6group ,cisplatin group and saline group ,respectively (P <0.01).The cloning efficiency of A549cells and NCI-H1975cells of (NGX6+cisplatin )were lower than that of NGX6group ,cisplatin group and saline group ,respectively (P <0.01).The tumor inhibitory rate was in vivo for (NGX6+cisplatin )was higher than other group (P <0.01).The median survival of nude mice in (NGX6+cisplatin ),NGX6,cisplatin and saline group were 43,31,29and 15days.Conclusion NGX6combination with cisplatin can inhibit the cell proliferate of lung cancer cells and inhibit the tumor growth and the combination of NGX6and cisplatin may be a potentially effective treatment for lung cancer.[Keywords ]NGX6;lung cancer ;cisplatin ;A549cells ;NCI-H1975cells ;in vitro ;in vivo肺癌是当前威胁人类的头号肿瘤疾病。
常用阳离子脂质

常用阳离子脂质自20世纪70年代DNA重组技术诞生,以重组DNA技术为核心的现代生物技术产业蓬勃发展,已有十多个基因工程药物上市。
以基因工程药物为主的各种基因工程产品和细胞工程产品陆续商品化。
在基因治疗中,基因载体是外源基因得以进入受体细胞的关键,其中,阳离子脂质体目前被认为是靶向性好,副作用小,稳定性好和转染效率较高的理想载体。
阳离子脂质体通常由一种阳离子脂质和一种中性辅助脂质在适当的条件下复合而成,阳离子脂质体转染效率与阳离子脂质的组成密切相关。
1、常用阳离子脂质缩写名化学名DOTMA 氯化三甲基-2, 3-二油烯氧基丙基铵DOTAP 溴化三甲基-2, 3-二油酰氧基丙基铵DOSPA 三氟乙酸二甲基-2, 3 -二油烯氧基丙基-2-(2-精胺甲酰氨基)乙基铵DTAB 溴化三甲基十二烷基铵TTAB 溴化三甲基十四烷基铵CTAB 溴化三甲基十六烷基铵DDAB 溴化二甲基双十八烷基铵DORI 溴化二甲基-2-羟乙基-2,3-二油酰氧基丙基铵DORIE 溴化二甲基-2-羟乙基-2,3-二油烯氧基丙基铵DORIE-HP 溴化二甲基-3-羟丙基-2,3-二油烯氧基丙基铵DORIE-HB 溴化二甲基-4-羟丁基-2,3-二油烯氧基丙基铵DORIE-HPc 溴化二甲基-5-羟戊基-2,3-二油烯氧基丙基铵DPRIE 溴化二甲基-2-羟乙基-2,3-双十六烷氧基丙基铵DSRIE 溴化二甲基-2-羟乙基-2,3-双十八烷氧基丙基铵DMRIE 溴化二甲基-2-羟乙基-2,3-双十四烷氧基丙基铵DOGS N-(2-精胺甲酰基)-N’, N’ -双十八烷基甘氨酰胺DOSC 1,2-二油酰-3-琥珀酰-sn-甘油胆碱酯DC-Chol 3β-[N-(N’,N’-二甲基胺乙基)胺基甲酰基]胆固醇LPLL 脂质多聚-L-赖氨酸SA 硬脂胺2、常用辅助脂质辅助脂质主要有磷脂酰乙醇胺(PE)、磷脂酰胆碱(PC)、胆固醇(Chol)等。
盐对疫苗的阳离子脂质体的物理化学性质及蛋白质免疫原性的影响

盐对疫苗的阳离子脂质体的物理化学性质及蛋白质免疫原性的影响摘要最近,我们已经研制了一种由一个阳离子脂质和一个抗原多肽组成的简单而有效的治疗癌症的疫苗。
在这篇报告中,我们扩大了这种基于蛋白质组成的疫苗的效用。
首先,我们用不同剂量的DOTAP脂质体制备了人乳头瘤病毒(HPV)16 E7蛋白(E7)。
结果表明,这些组成未能抑制已形成了的肿瘤。
然而,当在DOTAP(100 nmol)/ E7(20μɡ)配方中加入氯化钠(30μM)时,抗肿瘤活性在免疫的小鼠体内产生。
相关地,在DOTAP / E7蛋白配方中,氯化钠的加入使粒径从350纳米增加到550纳米,同时降低了蛋白质负载力(从95%到90%),并且增加了zeta电位(从29 mV到 38 mV)。
接下来,在不同剂量的DOTAP脂质体中制备了一个模型蛋白质抗原卵清蛋白(OVA)。
同样的,结果表明,在含有 30μɡ氯化钠的200nmol DOTAP中制备的20 g OVA有最好的包括IgG1和IgG2a 在内的OVA特性抗体反应, 说明在这个组成中同时产生了Th1与Th2免疫反应。
总之,我们已经扩大了基于疫苗的阳离子DOTAP脂质体制备的蛋白质的应用,并且也明确了少量的盐可以改变疫苗配方的理化性质、提高基于疫苗的DOTAP /蛋白的活性。
由盐份产生的免疫反应的提高很可能是由于阳离子脂质体和抗原蛋白质之间产生的相互静电力的干扰,同时可以促使抗原从载体释放、并激活抗原载体细胞。
1.简介近代疫苗发展方向已由包含整个有机体的疫苗转向为了求得一个成功的免疫反应仅包含必需组成的更安全的副族疫苗。
新一代疫苗体系基于蛋白、多肽或DNA而成,被认为是比基于减弱或杀死生物体的疫苗更安全的疫苗体系。
为了产生强烈的T 或B-细胞介导的免疫反应,副族疫苗必须有效地将抗原传递给抗原呈递细胞(APC),同时激活APC【9,3,23】。
最近我们已经发现一个由单一的DOTAP阳离子脂质组成的阳离子脂质体,它能将一个细胞毒T淋巴细胞(CTL)决定肽E7转运到树突状细胞(DC),并且使鼠类宿主对含有人乳头病毒(HPV)DNA 的TC-1肿瘤细胞的生长产生免疫【4】。
核定位信号肽优化非病毒载体的相关研究

核定位信号肽优化非病毒载体的相关研究崔晶晶【摘要】非病毒基因载体是一多组分系统,其介导的基因治疗要进行有效的细胞转染,则需要各组分共同作用以突破三道屏障即细胞膜、内涵体-溶酶体系统、核膜,核膜是一主要屏障.核定位信号肽(NLS)是一段富含精氨酸、赖氨酸等碱性氨基酸在基因转移领域重点研究的一类短肽,主要存在于真核细胞核蛋白及病毒蛋白,具有引导其所在序列趋向定位于核区的功能.近年来,国内外学者对借助NLS突破核膜屏障提高非病毒基因载体的转染效率进行了积极的探索.【期刊名称】《医学综述》【年(卷),期】2016(022)014【总页数】4页(P2713-2716)【关键词】核定位信号;基因治疗;连接方式【作者】崔晶晶【作者单位】武汉大学人民医院超声科,武汉430060【正文语种】中文【中图分类】R331构建高效低毒并可稳定转染的靶向基因转导体系是基因治疗领域的关键技术,非病毒基因载体以低毒安全、携带容量大、经济等突出优点受到广泛关注。
然而,转染效率低是限制非病毒基因载体系统发展的主要瓶颈。
如何进一步优化非病毒基因载体系统是基因转染领域亟待解决的关键问题。
绝大部分外源性基因需要被转运至细胞核,其携带的遗传信息才能进行有效的翻译及表达,而在此之前需要突破细胞膜、内涵体-溶酶体系统、核膜三重屏障[1]。
目前,针对细胞膜、内吞体逃逸的各种非病毒转运载体的研究已相对成熟,包括利用超声靶向破碎微泡技术、显微注射、基因枪等进行转染的物理方法、利用聚乙烯亚氨等进行转染的阳性多聚物介导法及阳性脂质体介导法等。
近年来,越来越多的国内外学者意识到设计一个好的基因转导系统必须考虑到质粒DNA的核转导,而通常质粒DNA在细胞核中的积聚效率较低,尤其是处于分裂间期的细胞[2]。
早在1980年就有学者报道了核膜可以阻碍外源性基因表达。
Meinema等[3]研究表明,小分子(18~28 bp)低聚核苷酸可自由扩散通过核膜上的核孔复合物(nuclear pore complexs,NPC)进入细胞核,而大分子(200~300 bp)的核苷酸则需要借助载体通过特定的活化机制才能通过NPC进入细胞核。
鱼精蛋白-siRNA不同形貌复合体的制备、 结构及药效学分析

鱼精蛋白-siRNA不同形貌复合体的制备、结构及药效学分析史迈;江芮;崔新霞;张欣;申世刚;丁良;潘学峰【摘要】利用涡旋混匀及室温孵育的方法制备了不同形貌的鱼精蛋白-siRNA复合体,并利用聚丙烯酰胺凝胶电泳结合银染、原子力显微镜和透射电子显微镜等手段进行了结构表征.结果表明,鱼精蛋白可以和不同的siRNA分子以不同的质量比形成球形和纤维状鱼精蛋白-siRNA复合物.在此基础上,利用Mg2+等金属离子探针,确认鱼精蛋白与siRNA的磷酸-戊糖骨架之间通过静电力发生作用.利用原子力和透射电子显微镜表征了鱼精蛋白-siRNA复合体的形貌和结构特征;利用激光纳米粒度仪测量了该复合体的粒径;并进一步比较了黑色素瘤细胞对不同形貌复合体的吞噬及药效学特征.【期刊名称】《高等学校化学学报》【年(卷),期】2019(040)006【总页数】8页(P1164-1171)【关键词】鱼精蛋白;siRNA;黑色素瘤;药物递送【作者】史迈;江芮;崔新霞;张欣;申世刚;丁良;潘学峰【作者单位】河北大学化学与环境科学学院,保定071002;河北大学医学院,保定071000;河北大学化学与环境科学学院,保定071002;河北大学医学院,保定071000;河北大学化学与环境科学学院,保定071002;河北大学医学院,保定071000;河北大学化学与环境科学学院,保定071002;河北大学医学院,保定071000;北京理工大学生命学院,北京100081【正文语种】中文【中图分类】O629.74自1998年在秀丽新小杆线虫中发现RNA干扰(RNAi)现象以来, RNAi技术已经得到了普遍应用[1,2]. RNAi技术的工作机制之一是籍细胞内源性Dicer酶加工双链RNA前体产生小干扰RNA(siRNA), 之后与AGO蛋白结合形成siRNA-沉默复合体(RISC), 致使靶mRNA特异性降解, 从而实现靶基因沉默[3,4]. 在实际应用中, siRNA既可由细胞产生, 又可以由外部供给. 比如, 可以供给靶细胞人工合成的长双链RNA, 这些长双链RNA进入细胞后被Dicer酶识别并加工为具有效能的siRNA. 在人为递送外源性siRNA过程中, 发现体外递送的siRNA普遍存在稳定性差及与靶细胞识别的特异性问题[5]. 为此, 研究者们尝试利用天然物质与siRNA形成复合体以提高siRNA的稳定性. 其中, 鱼精蛋白得到了较多的尝试[6,7]. 鱼精蛋白是一类富含精氨酸残基的阳离子多肽, 能与DNA的磷酸-戊糖骨架结合, 形成“环状”(Toroid)鱼精蛋白-DNA复合体. 哺乳类鱼精蛋白P1氨基末端含有半胱氨酸残基, 可在上述过程中形成二硫键; 而昆虫、鸟类、硬骨鱼、爬行动物和大多数有袋动物的鱼精蛋白则缺乏或不含半胱氨酸残基, 因此, 与DNA结合时不具有形成二硫键的能力[8,9]. 迄今, 鱼精蛋白的临床安全性已经得到确认, 不仅抗原性弱, 而且具有优良的生物相容性[10,11]. 此外, 鱼精蛋白含有核定位信号(NLS), 可以被有效运送到细胞核中, 有助于提高外源性物质进入细胞核的效率[12,13].酪氨酸酶[14]是黑色素合成中的关键酶[15], 黑色素的异常表达可见于一系列的生理和病理过程, 如雀斑、黄褐斑及老年斑等色素沉着性皮肤病等. 诸多证据表明, 酪氨酸酶在人黑色素瘤细胞A375呈高表达[16].基于此, 本文选定A375黑色素瘤细胞作为表征不同形貌鱼精蛋白-siRNA纳米复合体制剂的药效学模型. 首先根据人的酪氨酸酶设计了具有特异性的siRNA[17], 通过聚丙烯酰胺凝胶电泳与银染[18]方法观察了鱼精蛋白与siRNA形成复合体的剂量效应; 利用Mg2+等离子探针分析了鱼精蛋白与siRNA分子的作用方式[19~21]; 利用原子力显微镜和透射电子显微镜观察了鱼精蛋白-siRNA复合体的结构形貌[22,23], 在此基础上进一步比较了不同形貌的鱼精蛋白-siRNA复合体被人黑色素瘤细胞A375胞吞及入胞后所表现出的药效差异.1 实验部分1.1 试剂与仪器siRNA-1(正义链siRNA: 5′-AAUCCUAACUUACUCAGCCCAGCAUCA-3′, 反义链siRNA:3′dTdT-UUAGGAUUGAAUGAGUCGGGUCGUAGU-5′), siRNA-2(正义链siRNA:5′-AAUUGUAACCUAAUACAAAGUGUAGCC-3′, 反义链siRNA: 3′-dTdT-UUAACAUUGGAUUAUGUUUCACAUCGG-5′)和lipoHigh脂质体购于生工生物工程(上海)股份有限公司; 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)和鱼精蛋白(Protamine from salmon, 分析纯)购于美国Sigma公司; 氢氧化钠(分析纯)购于天津市科密欧化学试剂有限公司; 过硫酸铵、甲醛、冰乙酸、硝酸银和乙二胺四乙酸二钠(分析纯)购于天津市大茂化学试剂厂; 溴酚蓝(分析纯)购于天津市光复科技发展有限公司; 蔗糖(分析纯)购于天津市北方天医化学试剂厂; 6×上样缓冲液(含质量分数0.25%的溴酚蓝、质量分数40%的蔗糖及体积分数3%, pH=8.0, 0.5 mol/L的Na2EDTA·2H2O溶液); 4-羟乙基哌嗪乙磺酸(HEPES, 分析纯)购于南京旋光科技有限公司; 氯化钠和氯化钾(分析纯)购于国药集团化学试剂有限公司; 氯化锰、氯化钙和氯化镁(分析纯)购于天津光复科技发展有限公司; 四甲基乙二胺(TEMED, 分析纯)购于天津市光复精细化工研究所; 质量分数30%的丙烯酰胺(聚丙烯酰胺与N,N′-亚甲双丙烯酰胺质量比为29∶1)和β-巯基乙醇(分析纯)购于北京博奥拓达科技有限公司; 10×Tris-硼酸缓冲液(TBE)和二甲基亚砜(DMSO, 分析纯)购于北京索莱宝科技有限公司; 3-氨丙基三乙氧基硅烷(APTES, 分析纯)购于上海邦成化工有限公司.DW-86L388J型超低温冰箱(青岛海尔股份有限公司); SW-CJ-2FD型超级工作台(苏州安泰空气技术有限公司); BG-gdsAUTO520型凝胶成像分析系统、 BG-ver MINI型垂直电泳槽和BG-power600h型电泳仪电源(北京百晶生物技术有限公司); IS-RDV1型摇床(美国精骐有限公司); 摩尔基因型1810S超纯水机(重庆摩尔水处理设备有限公司); Tecnai G2 F20 S-TWIN型透射电子显微镜(TEM, 美国FEI公司); Agilent 5500 AFM-SPM型原子力-扫描探针显微镜(AFM, 美国Agilent公司); Delsa Nano C 纳米粒度仪(美国Beckman Coulter 公司); 311型CO2恒温细胞培养箱(美国Thermo Scientific公司); FV1000型激光共聚焦显微镜(日本Olympus公司); EL×800型全自动酶标仪(美国BioTek公司).1.2 实验过程1.2.1 鱼精蛋白-siRNA复合体的制备取5.0 μL用20 mmol/L HEPES缓冲液(pH=7.4)稀释的不同浓度的鱼精蛋白液, 逐滴加入到5.0 μL 8.6675 μg/mL siRNA-1溶液中[24] , 在保持鱼精蛋白与siRNA-1的质量比分别为15∶1, 20∶1, 25∶1, 30∶1, 35∶1和40∶1的前提下, 用HEPES缓冲液定容至50.0 μL, 涡旋混匀5 min, 室温下孵育30 min, 使之形成鱼精蛋白-siRNA-1复合体. 按照上述过程制备质量比分别为15∶1, 20∶1, 25∶1, 30∶1, 35∶1和40∶1的鱼精蛋白-siRNA-2复合体. 对制备的鱼精蛋白-siRNA复合体用质量分数20%的聚丙烯酰胺凝胶电泳解析分子量大小.Table 1 Preparation of protamine-siRNA-1 complexwith a mass ratio of 20∶1V(Total)/μLV(siRNA)/μLV(Protamine)/μLV(HEPES)/μL50.02.52.545.050.05.05.040.050.07.57.535.050.010.010.030.050.012.512.525.050.015.015.020. 0实验中, 质量比为20∶1的鱼精蛋白-siRNA-1复合体的制备基本步骤同上. 具体组方按表1进行, 在保持反应体系总体积不变的前提下, 依次增加鱼精蛋白和siRNA-1的体积.1.2.2 聚丙烯酰胺凝胶电泳及银染聚丙烯酰胺凝胶电泳的凝胶制备、电泳、银染及成像参照文献[18,25]方法.1.2.3 鱼精蛋白与siRNA的作用方式探究向质量比为20∶1的鱼精蛋白-siRNA-1复合体混合液中分别加入NaCl, KCl, CaCl2, MnCl2和MgCl2, 使每种盐的最终浓度分别为0, 2.5, 5, 10, 15, 25和50 mmol/L, 进行聚丙烯酰胺凝胶电泳(PAGE)及银染成像. 向质量比20∶1鱼精蛋白-siRNA-1复合体混合液中加入MgCl2使Mg2+浓度分别为0, 2.5, 5, 10, 15, 25和50 mmol/L, 涡旋混匀5 min, 室温下孵育30 min后, 进行聚丙烯酰胺凝胶电泳并银染成像.1.2.4 鱼精蛋白-siRNA复合体的结构表征取约10 μL质量比20∶1和40∶1的鱼精蛋白-siRNA-1复合体样品滴在铜网上, 真空冷冻干燥约30 min, 用5 μL含质量分数 2%的磷钨酸进行染色(染色时间约3 min), 从铜网侧边吸走多余染色液, 经真空冷冻干燥后, 用TEM进行观察.参照文献[26]方法制备AFM样品, 用原子力-扫描探针显微镜进行观察.1.2.5 鱼精蛋白-siRNA复合体粒度的测定利用激光纳米粒度仪测定质量比为15∶1, 20∶1, 25∶1, 30∶1, 35∶1和40∶1的鱼精蛋白-siRNA-1复合体的粒径大小, 将样品适当稀释, 过滤, 置于比色皿中测试, 每个样品平行测定3次.1.2.6 鱼精蛋白-siRNA复合体对A375细胞增殖的影响按照1.2.1节步骤制备鱼精蛋白-siRNA-1复合体(siRNA1用cy3荧光标记, 浓度为0.347 μg/μL), 根据两者质量比不同得到球状和纤维状复合体, 分别加入黑色素瘤细胞A375的培养液,置于细胞培养箱中8 h后, 在激光共聚焦显微镜下(波长为550 nm)观察细胞.取对数生长期的黑色素瘤细胞A375, 按5000 Cell/孔接种于96孔培养板内. 根据lipo脂质体转染实验所需siRNA浓度, 实验组每孔加入不同形貌复合体(siRNA为5 pmol), 分为lipoHigh脂质体组(培养液加入lipoHigh脂质体)、 siRNA组(培养液加入lipoHigh脂质体和siRNA1)、磷脂微囊组(培养液加入磷脂微囊)、球状复合体组(培养液加入磷脂微囊和球状复合体)、纤维状复合体组(培养液加入磷脂微囊和纤维状复合体)及空白对照组. 分别转染8 h后更换培养液, 于24和48 h终止培养, 每孔加入5 mg/mL MTT溶液20 μL, 继续培养4 h, 弃去孔中培养液, 每孔加入150 μL DMSO, 振荡10 min, 用酶标仪检测各孔光密度(OD)值, 检测波长为490 nm. 根据下式计算细胞增殖率(RGR, %):RGR=ODexperiment/ODcontrol×100%(1)2 结果与讨论2.1 鱼精蛋白-siRNA复合体的制备Fig.1 PAGE analysis on the formations of protamine-siRNA complexesProtamine-siRNA-1 complexes in (A) or protamine-siRNA-2 complexes in (B) were formed by protamine and siRNA by mass ratios of 15∶1, 20∶1, 25∶1, 30∶1, 35∶1, 40∶1, respectively. Lane 1: siRNA-1(A) or siRNA-2(B); lanes 2—7: protamine-siRNA complexes formed by mass ratios of protamine to siRNA-1(A) or siRNA-2(B) by 15∶1, 20∶1, 25∶ 1, 30∶ 1, 35∶ 1, 40∶ 1, respectively. Protamine-siRNA-1 complexes formed by a mass ratio of protamine to siRNA-1 by 20∶1(C). Lane 1: siRNA-1, lanes 2—7: protamine-siRNA-1 complexes formed by simultaneously increasing the protamine and siRNA-1 by 2.5, 5.0, 7.5, 10.0, 12.5, 15.0 μL, respectively.首先, 将鱼精蛋白与含有不同碱基序列的siRNA-1和siRNA-2分别以质量比为15∶1, 20∶1, 25∶1, 30∶1, 35∶1和40∶1混合, 并于室温下孵育, 形成的鱼精蛋白-siRNA复合体分别用20%聚丙烯酰胺凝胶电泳解析和银染呈带, 结果如图1(A)和(B)所示. 可见, 随着鱼精蛋白/siRNA质量比的增加, siRNA的条带逐渐变浅. 当鱼精蛋白与siRNA-1或siRNA-2的质量比为20∶1时, siRNA条带近乎完全消失, 表明siRNA已经与鱼精蛋白作用完全, 并形成了分子质量非均一的鱼精蛋白-siRNA复合体. 当鱼精蛋白和siRNA-1以20∶1的质量比同时增加反应体系中各自分子个数时, 所得鱼精蛋白-siRNA-1复合体的数量增多, 且分子量均增大[图1(C)], 表明较高分子量的鱼精蛋白-siRNA-1复合体形成与反应体系中鱼精蛋白分子和siRNA-1分子的数量呈正相关.鉴于siRNA-1和siRNA-2之间并无碱基序列相似性, 因此鱼精蛋白与siRNA分子的结合不表现序列特异性. 基于此, 后续实验选取siRNA-1与鱼精蛋白形成的复合体, 对两者之间的作用方式、结合位点以及复合体形态进行了研究.2.2 鱼精蛋白与siRNA的作用方式研究表明, Na+, K+, Ca2+, Mn2+和Mg2+等阳离子均参与RNA的折叠[27]. 其中, Na+和K+能通过长程静电力与RNA分子中磷酸-戊糖骨架上的磷酸基作用, Ca2+, Mn2+和Mg2+既可与RNA分子发生长程静电作用, 又可以通过电荷转移和极化等非静电作用方式与RNA在短距离内发生强烈相互作用, 形成稳定复合体. 以Mg2+与DNA作用为例, Mg2+能与DNA分子中磷酸-戊糖骨架上的磷酸基形成“十元环”结构[27]. 为了获悉鱼精蛋白与siRNA形成复合体所依赖的作用方式和相互作用位点, 分别利用Na+, K+, Ca2+, Mn2+和Mg2+等阳离子作为探针, 采取与鱼精蛋白-siRNA复合体共混等方式, 分析了这些离子与鱼精蛋白竞争siRNA的能力.Fig.2 PAGE analysis on the effects of different metal ions on the stabilitiesof protamine-siRNA complexesProtamine-siRNA complexes reacted with different concentrations of NaCl(A), KCl(B), CaCl2(C), MnCl2(D) andMgCl2(E) and formed in the presence of different concentrations of Mg2+ (0, 2.5, 5, 10, 15, 25 and 50 mmol/L)(F). Lane 1: siRNA, lanes 2—8: protamine-siRNA complexes reacted with different metal ions with a final concentration of 0, 2.5, 5, 10, 15, 25 and 50 mmol/L, respectively.随着加入的金属阳离子浓度的增加, 鱼精蛋白-siRNA复合体中的鱼精蛋白被阳离子逐渐替换, 形成siRNA-阳离子复合物. 图2(A)和(B)表明, 较低浓度的Na+和K+基本不影响复合体的稳定性; 但当Na+和K+浓度分别为15和25 mmol/L时, 开始出现游离siRNA[图2(A)lane 6和图2(B)lane 7]. 此结果表明, Na+与siRNA结合的能力大于K+与siRNA的结合力. 一价金属阳离子与相同类型siRNA结合的差异, 表明二者的结合并不只依赖简单的静电长程作用. 进一步比较了二价金属阳离子Ca2+和Mn2+(离子半径Ca2+>Mn2+)对鱼精蛋白-siRNA复合体中鱼精蛋白的竞争能力. 图2(C)和(D)表明, Ca2+和Mn2+均对鱼精蛋白-siRNA复合体中鱼精蛋白和siRNA的相互作用产生影响, 表现为 Ca2+<Mn2+. 与一价金属阳离子Na+和K+相比, Ca2+和Mn2+在浓度为10 mmol/L时开始与鱼精蛋白发生明显的作用, 当体系中Ca2+和Mn2+浓度为10~15 mmol/L时, 2种阳离子各自与鱼精蛋白的竞争作用差别不明显, 但均表现为Ca2+<Mn2+. 当反应体系中Ca2+的浓度增加至25和50 mmol/L时, 鱼精蛋白-siRNA复合体的分子量进一步降低[图2(C) lanes 7和8]; 在同等条件下, Mn2+却不再对鱼精蛋白-siRNA复合体的分子量产生明显影响[图2(D) lanes 7和8]. 上述结果表明, 二价阳离子Ca2+和Mn2+对鱼精蛋白与siRNA之间相互作用也不仅是通过静电力实现的.为了进一步理解Ca2+和Mn2+作用的差异, 考察了Mg2+对鱼精蛋白-siRNA复合体稳定性的影响. Mg2+离子半径小、电荷密度高, 可与DNA分子中磷酸-戊糖骨架上的磷酸基团形成“十元环”结构(Mg2+-DNA复合体) [27]. 鉴于RNA和DNA拥有相似的磷酸-戊糖骨架, 且磷酸基团在DNA和RNA磷酸-戊糖骨架中的理化性质相同, 考察了Mg2+对鱼精蛋白-siRNA复合体稳定性的影响.由图2(E)可知, 当反应体系中含有5 mmol/L Mg2+时, 鱼精蛋白与siRNA(质量比20∶1)形成复合体的反应明显受到Mg2+的影响, 出现了Mg2+-siRNA复合体和较低分子量的鱼精蛋白-siRNA复合体[图2(E)lane 4]. 随着反应体系中Mg2+浓度的增加, 出现了大量的Mg2+-siRNA复合体[图2(E)lanes 5~8], 表明Mg2+能抑制鱼精蛋白与siRNA的结合. 为了进一步确定Mg2+抑制鱼精蛋白与siRNA结合的反应类型, 尝试向鱼精蛋白-siRNA复合体中加入不同浓度的Mg2+[图2(F)]. 结果表明, 5 mmol/L的Mg2+可以“夺取”鱼精蛋白-siRNA复合体中的siRNA, 形成Mg2+-siRNA复合物[图2(F) lane 4]; 当体系中Mg2+浓度小于25 mmol/L 时, 鱼精蛋白-siRNA复合体和Mg2+-siRNA复合体分布基本达到平衡[图2(F) lanes 5~7]; 但继续增大Mg2+浓度至50 mmol/L时, 终产物以Mg2+-siRNA复合体为主[图2(F) lane 8]. 这表明Mg2+、鱼精蛋白与siRNA的作用体现浓度依赖竞争. 对比图2可见, 二价阳离子Mg2+, Mn2+和Ca2+与鱼精蛋白-siRNA复合体中的鱼精蛋白“争夺” siRNA的能力依次减弱. 基于Mg2+与DNA分子可形成稳定“十元环”结构, 推测Mn2+, Ca2+若与 siRNA形成类似Mg2+-siRNA 的“十元环”结构, 其能力均弱于Mg2+.2.3 鱼精蛋白-siRNA复合体的形貌TEM结果(图3)表明, 当鱼精蛋白与siRNA质量比分别为20∶1和40∶1时, 形成了不同形貌(球形和纤维形)的复合体.Fig.3 TEM images of protamine-siRNA complexes formed by protamine and siRNA with the mass ratios of 20∶1(A) and 40∶1(B)Fig.4 AFM visualizations of protamine-siRNA complexes with the massratios of protamine to siRNA 20∶1(A, toroid) and 40∶1(B, filamentous) and protamine proteins(white dots) in the filamentous protamine-siRNA complexes(C)AFM结果(图4)表明, 鱼精蛋白与siRNA形成的“颗粒状”复合体为鱼精蛋白通过静电作用将siRNA分子压缩形成的环状结构[8]. 鲑鱼精蛋白具有保守的精氨酸结构域, 在HEPES缓冲液中精氨酸解离带正电荷, siRNA磷酸骨架上的磷酸基团则带有负电荷, 两者通过静电力把siRNA单体“压缩”成环[图4(A)]. 此外, 当鱼精蛋白与siRNA的质量比进一步增加, 则形成纤维状复合体[图4(B)和(C)]. 不同形态的鱼精蛋白-siRNA复合物中鱼精蛋白与siRNA相互作用的示意图见Scheme 1. Scheme 1 Schematic illustrations for the interactions between protamine and siRNA in protamine-siRNA complexes of different morphologies Fig.5 PAGE analysis on the formation of disulfide bonds in the protamine-siRNA complexesLane 1: siRNA, lanes 2—7: protamine-siRNA complexes of filament morphologies treated using β-mercaptoethanol with a final concentration of 0, 5, 10, 15, 20 and 40 mmol/L, respectively.有些鱼精蛋白中含半胱氨酸残基, 易形成二硫键, 本文使用的鲑鱼精蛋白在理论上不含半胱氨酸. 但是, 为了进一步确认所得鱼精蛋白-siRNA纤维复合体不是通过鱼精蛋白形成二硫键而形成, 对纤维状复合体中是否含有二硫键进行了分析. 分别用0, 5, 10, 15, 20和40 mmol/L的β-巯基乙醇对复合体进行还原处理. 电泳结果如图5所示, 可见纤维状鱼精蛋白-siRNA复合体不因巯基乙醇的处理而发生电泳行为的改变.2.4 鱼精蛋白-siRNA复合体的粒径分析利用纳米粒度仪测试了制备的不同鱼精蛋白-siRNA复合体的粒径, 结果列于表2. 可见, 随着反应体系中鱼精蛋白量的增加, 形成的复合体的粒径也增大, 表明鱼精蛋白与siRNA可依据反应体系中二者分子量不同形成不同类型的复合体.Table 2 Particle sizes of the protamine-siRNA complexesMass ratio of protamine to siRNA d(90)/nmMass ratio of protamine-siRNAd(90)/nm15∶1217.5±6.730∶1325.8±7.620∶1220.0±7.235∶1384.2±6 .225∶1275.5±5.040∶1405.0±4.32.5 鱼精蛋白-siRNA复合体对A375细胞增殖的影响由激光共聚焦显微照片(图6)可见, 颗粒状和纤维状鱼精蛋白-siRNA复合体均能进入黑色素瘤细胞A375内, 且主要分布于细胞质中. 随机选取不同视野进行观察并计算转染效率(荧光细胞数占总细胞数的比例). 经计算得出球状鱼精蛋白-siRNA复合体转染效率约为69%, 纤维状鱼精蛋白-siRNA复合体转染效率约为72%, 后者略高于前者.Fig.6 Phagocytosis of A375 melanoma cells on toroid(A) and fibrous(B) protamine-siRNA complexes under confocal fluorescence microscopy Fig.7 Effects of protamine-siRNA complexes on the proliferation of A375 cellsa. Control; b. lipoHigh; c. phospholipid vesicles; d. siRNA; e. spherical complexes; f. filamentous complexes.通过MTT实验评价了2种形貌的鱼精蛋白-siRNA复合体对黑色素瘤细胞A375增殖的影响, 结果表明, siRNA组、球状复合体组和纤维状复合体组对黑色素瘤细胞A375的增殖均有明显影响, 且随着细胞培养时间的延长, 细胞增殖率降低, 存在显著性差异(见图7). 结果表明, 将2种形貌的鱼精蛋白-siRNA复合体递送入细胞的效率与之后所表现出的药效学作用与Lipo脂质体递送siRNA的效果相当, 而且纤维状鱼精蛋白-siRNA复合体对黑色素瘤细胞A375的增殖抑制效果较球状鱼精蛋白-siRNA复合体更好.3 结论鱼精蛋白和siRNA之间相互作用可分别形成螺旋环(Toroid)颗粒状和纤维状鱼精蛋白-siRNA复合体. 其中, 发生在鱼精蛋白碱性氨基酸侧基和siRNA磷酸-戊糖骨架之间的静电作用是鱼精蛋白和siRNA相互作用的主要作用方式. 不论是形成颗粒状鱼精蛋白-siRNA复合体, 还是形成纤维状鱼精蛋白-siRNA复合体均不依赖siRNA碱基排列顺序. siRNA与鱼精蛋白形成复合体有助于siRNA向黑色素瘤A375细胞递送, 而颗粒状复合体与纤维状复合体在细胞递送效率上并未见显著性差异. 但在入胞后所能发挥的药效学效果上具有明显差异, 表现为纤维状鱼精蛋白-siRNA复合体比颗粒状鱼精蛋白-siRNA复合体具有更高的抑制人黑色素瘤A375增殖能力. 不同形貌的鱼精蛋白-siRNA复合体在药物递送环节中的差异尚需深入研究.参考文献【相关文献】[1] Fire A., Xu S., Montgomery M. K., Kostas S. A., Drive S. E., Mello C. C., Nature, 1998, 391(6669), 806—811[2] Pan X. F., Molecular Biology of Genetic Diseases, Chemical Industry Press, Beijing, 2014, 436—447(潘学峰. 基因疾病的分子生物学, 北京: 化学工业出版社, 2014, 436—447)[3] Peedicayil J., Indian J. Med. Res., 2006, 123(1), 17—24[4] Jiang N., Pan X. F., Biotechnology Bulletin, 2015, 31(4), 105—119(姜楠, 潘学峰. 生物技术通报, 2015, 31(4), 105—119)[5] Tatiparti K., Sau S., Kashaw S. K., Iyer A. K., Nanomaterials, 2017, 7(4), 77—94[6] Rengaswamy V., Zimmer D., Süss R., Rössler J., J. Control Release, 2016, 235, 319—327[7] Hao H. W., Zhen Y. S., Wang Z. C., Chen F. L., Xie X., Cell Biol. Int., 2013, 37, 860—864[8] Hutchison J. M., Rau D. C., DeRouchey J. E., Biophys. J., 2017, 113(9), 1925—1933[9] Warrant R. W., Kim S. H., Nature, 1978, 271(5641), 130—135[10] Balhorn R., Genome. Biol., 2007, 8(9), 227—235[11] He H. N., Ye J. X., Liu E. G., Liang Q. L., Liu Q., Yang V. C., J. Control Release, 2014, 193,63—73[12] Rui P. M., Ostermeier G. C., Krawetz S. A. , J. Biol. Chem., 2004, 279(50), 51862—51868[13] Cornetta K., Anderson W. F., J. Virol. Methods, 1989, 23(2), 187—194[14] Pillaiyar T., Manickam M., Namasivayam V., J. Enzym. Inhib. Med. Ch., 2017, 32(1), 403—425[15] Hudjashov G., Villems R., Kivisild T., PloS One, 2013, 8(9), e74307[16] Wang J. H., Pei Y. Y., Xu H. D., Li L. J., Wang Y. Q., Liu G. L., Qu Y., Zhang N., Biomed Rep., 2016, 5(1), 87—92[17] Elbashir S. M., Harborth J., Weber K., Tuschl T., Methods, 2002, 26(2), 199—213[18] Minakshi P., Ranjan K., Kumar P., Prasad G., Adv. Anim. Vet. Sci., 2013, 1(4S), 20—23[19] Petrov A. S., Bowman J. C., Harvey S. C., Williams L. D., RNA, 2011, 17(2), 291—298[20] Misra V. K., Draper D. E., P. Natl. Acad. Sci. USA, 2001, 98(22), 12456—12461[21] Iii R. J. T., Draper D. E., Nucleic Acids Res., 2017, 45(8), 4733—4742[22] Koo H., Park I., Lee Y., Kim H. G., Jung J. H., Lee J. H., Kim Y., Kim J. H., Park J. W., J. Am. Chem. Soc., 2016, 138(36), 11664—11671[23] Schön P., Methods, 2016, 103, 25—33[24] Tusup M., Pascolo S., Methods in Molecular Biology, 2017, 1499, 155—163[25] Rio D. C., Jr A. M., Hannon G. J., Nilsen T. W., Cold Spring Harbor Protocols, 2010, 2010(6), pdb.prot5443[26] Gilmore J., Deguchi K., Takeyasu K., Microscopy and Imaging Science: Practical Approaches to Applied Research and Education, Formatex Research Center, Badajoz, 2017, 300—306[27] Bowman J. C., Lenz T. K., Hud N. V., Williams L. D., Curr. Opin. Struct. Biol., 2012, 22(3), 262—272。
阳离子脂质体-siRNA复合物对K562细胞凋亡诱导的作用机制
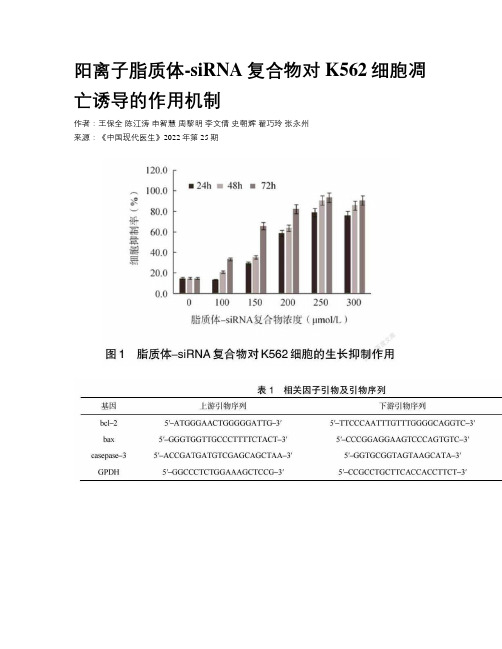
阳离子脂质体-siRNA复合物对K562细胞凋亡诱导的作用机制作者:王保全陈江涛申智慧周黎明李文倩史朝辉翟巧玲张永州来源:《中国现代医生》2022年第25期[摘要] 目的制备新型阳离子脂质体–siRNA复合物,并探讨其对K562细胞凋亡的诱导作用及作用机制。
方法通过逆向蒸发技术制备阳离子脂质体复合物,以K562细胞为模型,使用不同浓度的脂质体–siRNA复合物转染K562细胞,MTT法测定脂质体–siRNA复合物对K562细胞生长的影响,流式细胞术检测脂质体–siRNA复合物对K562细胞周期的影响,反转录聚合酶链反应(reverse transcription polymerase chain reaction,RT–PCR)和蛋白质印迹法检测脂质体–siRNA复合物对K562细胞相关mRNA及蛋白表达的影响。
结果与对照组相比,脂质体–siRNA复合物轉染K562细胞增殖受到明显抑制,流式细胞术检测结果显示,阻滞于G1期细胞明显增多(P<0.05),而S期和G2/M期细胞显著减少(P<0.05),RT–PCR和蛋白质印迹法结果显示,随着脂质体–siRNA复合物浓度的增加,K562细胞中bcl–2蛋白及mRNA表达水平均显著降低(P<0.05),bax、caspase–3蛋白及mRNA表达水平均显著升高(P<0.05)。
结论新型脂质体–siRNA复合物转染率高,且沉默效果显著,可下调bcl–2基因,上调bax、caspase–3基因,进而促进K562细胞凋亡,有望成为慢性粒细胞白血病基因治疗的高效药物传递系统。
[关键词] 脂质体–siRNA复合物;K562细胞;慢性粒细胞白血病;凋亡诱导[中图分类号] R91 [文献标识码] A [文章编号] 1673-9701(2022)25-0031-05[Abstract] Objective To prepare a novel cationic liposome–siRNA complex, and to explore the apoptotic induction of K562 cells induced by liposome–siRNA complex and its mechanism. Methods Cationic liposome complex was prepared by reverse evaporation. K562 cells were used as a model and transfected with different concentrations of liposome–siRNA complex, MTT assay was used to detect the effect of liposome–siRNA complex on K562 cell proliferation. Flow cytometry was used to detect the effect of liposome–siRNA complex on K562 cell cycle. The mRNA and protein expression of bcl–2, bax and caspase–3 in K562 cells were detected by reverse transcription polymerase chain reaction (RT–PCR) and Western blotting. Results Compared with control group, the proliferation of K562 cells transfected with liposome–siRNA complex was significantly inhibited, and the flow cytometry results showed that K562 cells in G1 phase were significantly inceased (P<0.05),while cells in S phase and G2/M phase were significantly decreased (P<0.05). RT–PCR and Western blotting results showed that the expression levels of bcl–2 protein and mRNA were significantly decreased (P<0.05), the expression levels of bax、caspase–3 protein and mRNA were significantly increased (P<0.05), with the increase of the concentration of liposome–siRNA complex. Conclusion The novel liposome–siRNA complex has high transfection rate and significant silencing effect, and can down–regulate bcl–2 gene, up–regulate bax and caspase–3 genes, and promote K562 cell apoptosis, which is expected to become an efficient drug delivery system for gene therapy of chronic melogenous leukemia.[Key words] Liposome–siRNA complex; K562 cell; Chronic myelogenous leukemia; Apoptosis inductionRNA干扰(RNA interference,RNAi)是指细胞在发展进程中高度保守的、由双链RNA (double– stranded RNA,dsRNA)诱发的、同源信使RNA(messenger RNA,mRNA)高效特异性降解的现象[1]。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
阳离子脂质体 ! 鱼精蛋白 " # $ 复合物与脂质 ! % ! " # $ 复合物体外细胞转染率比较
孙 逊& 田 聆’ 聂
( 宇 & 张志荣 & 路
娇 & 魏于全 ’
+ & , , & . + & , , & .
四川大学 华西药学院 靶向药物与新型给药系统实验室 * 成都 & ) 四川大学 华西医院 人类疾病生物治疗教育部重点实验室 * 成都 ’ ) 摘要
基 因 治 疗 为 一 些 长 期 困 扰 人 类 的 重 大 疾 病* 如 恶性肿瘤 G 遗传病 G 感染性疾病的有效预防和治疗带 来了希望 J 伴随着基因治疗而出现的基因载体研究 *
% 国 家 高 技 术 研 究 发 展 计 划 ) B + C 计 划 .资 助 项 目 ) ’ , , C & D , & & . 22’ / E F8 9 9 ( 通讯作者 J 5 1; 4 8 C 0 C C 8 4 5 @ 4 = ; : 7 1
生 物 医 学 工 程 学 杂 志
第, .卷
$ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ $ 脂质与细胞融合后 ! 重组基因导入细胞 ! 脂质体即被 磷脂可被细胞生物膜利用 " 目前 ! 已有不少基 降解 ! 因治疗的脂质体制剂进入临床试验 " 脂 质# 聚 阳离 子 # 是近年来 * ! $ %& 复合物 ’ ( ) $ 在 阳 离 子 脂 质 体# 发展起来 $ %& 复 合 物 的 基 础 上 ! " 与 阳 离 子 脂 质 体# 因而 $ %& 复合物相比 ! ( ) $ 能更有效地缩合 $ %&! 其可能提高对细胞的转染率 " 这方面的研究国外报
2 材料与方法
2 3 4 仪器与试剂 # < 3 = . *质 粒 @ @ # 5 67 1 8 9 : ;’ > ? ( A 5 B C D : E 9 FA G D H 分析试 剂盒 美 国 公 司 鱼 精 蛋 白 硫 ’ * 0 I 9 8 J G K A K B I D G 酸 盐@ 二甲基双十八烷基溴化铵 ’ 二 油酰 磷 * @ $ $ &L 脂酰乙醇胺’ 质粒扩增试剂 * ’ 0 $ 6) M N A I F9公 司 * 盒’ 美 国 OA 胎牛血清’ 杭州四季青生物 0 9 I D G公 司 * 制 品 公 司* 0 Q R . S @ 7 ) PJ $ PM P 培养基’ T A ? : B公 司* 0 "W L U &蛋白分析试剂盒’ ) A D V : D公 司 * M P# 日本电子* 激光粒度测定 Q S S 0 N X 透射电子显 微 镜 ’ 仪 P9 英 [ S ’ 国 P9 * 0 8 K D V G; D E 9 Y A Z D V%9 G B; N 8 K D V G 日本岛津* 倒置显微镜 0 # = S S S荧 光 分 光 光 度 计 ’ 7 1 日 本* 美 国 伯 乐* ’ ! 0 = = S酶 标 仪 ’ 0 68 A F5 \ Y PB ] D 8 水平凝胶电泳仪 ’ 美国法玛西 Q S S凝胶成相系统 ^ N X 亚* " 2 3 2 质粒 _ ‘ a 的扩增和纯化 质粒 5 包含 3 = .> 67 1 8 9 : ;是 < ?真核表达载体 ! 其报告基 因依赖 M 有报告基因 8 ! # Q ^ 9 : ; 1 b cd ( e杂 交 启动子启动 "采用 f 菌株 $ 扩增质粒 ! 采 3 g h i j c= b 用M 分离纯化质粒 ! 并 G ] B 1 V D D OA 9 I D GT A I 9试剂盒 ! 用紫外分光光度法和凝胶电泳法对质粒的纯度和含 量进行了测定 ! 纯度符合要求 " 2 3 k 阳离子脂质体 l _ ‘ a 复合物的制备 取一 定 量 的 $ 用适量的氯仿溶 ! 6) M和 $ $ &L 解! 经 旋 转 蒸 发 和 真 空 干 燥 后 得 到 脂 质 薄 膜0 用Q S nQ 缓冲 液 水 合脂 膜 后 得到 m( cD ’ p . * FFB 8 5 D Y 5 co 的空 白 阳 离 子 脂 质 体 ! 再分别挤压通过 , S S和 Q S S 的 聚 碳 酸 脂 膜 得 到 大 小 均 一 的 空 白 阳 离 子 脂 ! G F 质体 " 将适量的 $ %& 与空白阳离子脂质体等体积混 万方数据 合! 室温孵育 , SFA G后 即 得 到 阳 离 子 脂 质 体 # $ %&
nQ 在, ’ Q SFFB m( *稀释后加入样品池 ! = | 下重复 8 测定 <次 "
道不多 ! 国内尚未见报道 " 经典的 ( ) $ 传递系统使 用的聚阳离子是多聚赖氨酸 0 本文以 1 $ & 已批准可 供 临 床 使 用 的 鱼 精 蛋 白 为 聚 阳 离 子 成 分! 研究了 并对 ( ( ) $ 的构建方法 ! ) $ 和阳离 子 脂 质 体 # $ %& 复合物对体外细胞的转染率进行了比较 "
+ , -. /
复合物 " 2 3 q 凝胶阻滞实验 将阳 离子 脂质体 与质粒 $ %& 按 不 同 重 量 比 形 用Q 成的阳离子脂质体 # r 的琼脂糖凝 $ %& 复合物 !
的又一种新型非病毒载体
胶 进 行 电 泳! 每孔上样量为 S p =s S I$ %&" 电 泳 . 用 溴化乙锭 ’ 染色 ! 紫 外灯下 观察 ! 以确 * FA G后 ! M L 定阳离子脂质体与质粒 $ %& 的配比关系 " 2 3 t u v _ 的制备 将一定比例的空白阳离子脂质体和鱼精蛋白的 溶 液混合 后 ! 加入 等体积 的 $ cD 5 D Y %&! $ %& 的终 浓 度为 < 轻微振荡后 室温孵育 即 Ss ^ ! ! , SFA ! I F8 G 得到 ( " ) $ 粒径和 x 2 3 w 形态 @ y z {电位 阳 离 子 脂 质 体# ) $样品适当 $ %& 复 合 物 或 ( 稀释后 ! 滴加在覆盖碳膜的铜网上 ! 用, r 磷钨酸负 染! 在透射电镜下观察微粒的形态和大小 " 阳离子脂 质体 # $ %& 复 合 物 和 ( ) $的粒径及表面 电 荷 用 激 光 粒度仪测定 " 取, 的样品用 ,F8 缓冲液 Ss 8 cD 5 D Y
采用薄膜 / 挤压法 制 备 空 白 阳 离 子 脂 质 体 后 * 再分别制得阳离子脂质体/ 聚阳离子/ 0 12 复 合 物 和 脂 质 /
用凝胶阻滞实验* 确定阳离子脂质体与质粒 0 / / * . B 0 12 复 合 物 ) 3 4 5 4 6 5 7 8 9 : ; < 4 7 = 0 12 8 4 5 7 5 7 8 9 5 8 > ? > @ 3 A 0 12 的 配 比B 用透射电镜观察阳离子脂质体 / 复合物和 的形态 用激光粒度仪测定它们 的 粒 径 和 电 位 用酶标 * B 0 12 3 A 0 C > < ; 仪测定它们对张氏 ) 肝细胞G . D E ; = F H> 5 I’肝 癌 细 胞 的 转 染 率 J 结 果 表 明 阳 离 子 脂 质 体 / 0 12 复 合 物 和 3 A 0的 形 态均近似于球体 * 但3 肝 细 胞 和 H> . 3 A 0对 张 氏 ) D E ; = F A 0 的粒径明显 较 小 B 5 I’肝 癌 细 胞 的 转 染 率 均 高 于 阳 离 子 脂质体 / 0 12 复合物 J3 A 0 是基因治疗的临床应用中一种更具前景的载体系统 J 关键词 阳离子脂质体 / 0 12 复合物 脂质 / 鱼精蛋白 / 0 12 复合物 转染率
g h Ni h N
j
K T M N[ T N k # T Qm h n o M N kn o T L U N k [ hp T M U qQ T m h r h M N
*| * & , , & *w . ’ ) u y v { ! y } x ’ { z(z y ) t $ u y v & w x t z * + ’ + x y z { st u v w x y z {,~
! K L M N O P Q R S T U NV P P T R T Q N R WX U YZ M L T O U NU P X M S T U N T R[ T Z U O U YQ " # $ ! ! X U YZ \ Q ] Q O M N ^[ T Z T ^ _ L U S M YT N Q " # $X U YZ \ Q ] Q O ‘ ab c d e f
j 引
言
一直是突破其临床有效治疗的关键之一 J 目前 * 广泛 使用的基因载体主要分为病毒载体系统和非病毒载 体系统 J 非病毒载体系统因其具有使用方便 G 安全性 其 中* 阳 离 子 脂 质 体/ 0 12 复 合 物 是 目 前 研 究 得 最
& H 为广泛的非病毒载体系统 G 其优点在于 E 制备工艺 J
高G 可大规模生产和无免疫原性等优点而备受关注 *
简 便* 可 运 载 不 同 大 小 的 基 因 片 段* 可运载质粒
万方数据
还 可 运 载 染 色 体 或 细 胞 核* 其内容量大大超 0 12* 过 其它载 体 B 可 抵 御 核 酸 酶 的 作 用* 延 缓 基 因 降 解B
Q [ ,
l
