高中溶解性表
部分酸、碱和盐的溶解性表(室温)

部分酸、碱和盐的溶解性表(室温)
性,“---”表示那种物质不存在或遇到水就分解了。
碱的溶解性
说明:能溶解的碱共有五种,分别是氢氧化钾(KOH)、氢氧化钠(NaOH)、氢氧化钡[Ba(OH)2]、氢氧化钙[Ca(OH)2微溶]、氨水(NH3·H2O又叫一水合氨)。
除此之外的碱都不溶解,像氢氧化铜[Cu(OH)2]是蓝色沉淀,氢氧化铁[Fe(OH)3]是红褐色沉淀,其他的碱都是白色沉淀。
盐的溶解性
说明:
第一句:钾盐、钠盐、铵盐、硝酸盐都易溶于水;
第二句:硫酸盐中除了硫酸钡(BaSO4)难溶,硫酸银(Ag2SO4)和硫酸钙(CaSO4)微溶以外,其他的硫酸盐都易溶于水;第三句:盐酸盐中除了氯化银(AgCl)难溶以外,其他的盐酸盐都易溶于水;
第四句:碳酸盐中除了第一句中的碳酸钾(K2CO3)、碳酸钠(Na2CO3)、碳酸铵[(NH4)2CO3]、碳酸氢铵(NH4HCO3)易溶于水外,还有碳酸镁(MgCO3)微溶,其他的碳酸盐都难溶于水。
那么多溶解性口诀,记住这一个就够了!

那么多溶解性⼝诀,记住这⼀个就够了! 溶解性表是初⾼中化学学习中⼀个重要⼯具,然⽽离⼦种类繁多,记住好难。
为了帮助⼩伙伴们记住常见的溶解性规律,很多化学爱好者编制了很多轻松好记的溶解性⼝诀。
其实这么多溶解性⼝诀,⼩伙伴们记住⼀个就够了,轻松搞定离⼦⽅程式神马的考点。
1、溶解性表注:“难”:难溶于⽔(溶解度⼩于0.01g,⼏乎可以看成不溶,但实际溶解了极少量,绝对不溶于⽔的物质⼏乎没有);“微”:微溶于⽔(溶解度0.01g~1g);“溶”:该物质可溶于⽔(溶解度⼤于1g);“挥”:易挥发或易分解;“—”:该物质不存在或遇⽔发⽣⽔解。
2、常见沉淀⽩⾊:BaSO4BaCO3CaCO3AgCl Ag2CO3Mg(OH)2Fe(OH)2Al(OH)3CuCO3ZnCO3MnCO3Zn(OH)2蓝⾊:Cu(OH)2浅黄⾊:AgBr红褐⾊:Fe(OH)3 3、初中需掌握的溶解性⼝诀酸易溶于⽔,初中酸全溶。
碱中溶五位,钾、钠、氨(⽔)、钡都可溶,(氢氧化钾KOH、氢氧化钠NaOH、氨⽔NH3·H2O、氢氧化钡Ba(OH)2)微溶只需记住钙。
(氢氧化钙Ca(OH)2微溶)可溶盐,钾钠铵、硝酸盐,全盘端。
盐酸盐(Cl-),银靠边。
(盐酸盐⾥除氯化银AgCl外都溶。
)硫酸盐(SO42-),除钡餐。
(硫酸盐中不溶的是硫酸钡BaSO4。
)碳酸盐,可溶的只有钾钠铵;(只有相应的碳酸钾、碳酸钠和碳酸铵可溶)其余不溶于⽔,均能“溶于”酸。
4、⾼中需掌握的溶解性⼝诀钾、钠、铵、硝酸溶,(钾盐、钠盐、铵盐和硝酸盐都溶于⽔。
)盐酸除银亚汞,(盐酸盐⾥除氯化银AgCl和氯化亚汞Hg2Cl2外都溶。
)再说硫酸盐,不溶有钡、铅,(硫酸盐中不溶的是硫酸钡BaSO4和硫酸铅PbSO4。
)其余⼏类盐,(碳酸盐、亚硫酸盐、磷酸盐、硅酸盐和硫化物)只溶钾、钠、铵,(只有相应的钾盐、钠盐和铵盐可溶)最后说碱类,钾、钠、铵和钡。
(氢氧化钾KOH、氢氧化钠NaOH、氢氧化钡Ba(OH)2和氨⽔NH3·H2O可溶)另有⼏种微溶物,可单独记住。
物质溶解性表

红褐色:Fe(OH)3[1] 4沉淀鉴别编辑Cu(OH)2蓝色沉淀Fe(OH)3红褐色沉淀AgBr淡黄色沉淀AgI ,Ag3PO4黄色沉淀AgCl白色沉淀CuO黑色沉淀Cu2O 红色沉淀Fe2O3红棕色沉淀FeO 黑色沉淀FeS2黄色沉淀PbS 黑色沉淀FeCO3灰色沉淀Ag2CO3白色沉淀(制作过程中Ag2CO3易分解成褐色Ag2O,混合物常常为黄色)Cu2(OH)2CO3暗绿色沉淀BaCO3白色沉淀(且有CO2生成)CaCO3白色沉淀(且有CO2生成)BaSO4白色沉淀不溶的碳酸盐白色沉淀(且有CO2生成)不溶的碱、金属氧化物白色沉淀(且有CO2生成)Fe(OH)2为白色絮状沉淀(在空气中很快变成灰绿色,再变成Fe(OH)3红褐色沉淀)5相关口诀编辑钾钠铵盐硝酸盐均可溶盐酸盐银不溶硫酸盐钡不溶白色沉淀: CaCO3. BaCO3 . BaSO4. AgCL. Mg(OH)2蓝色沉淀: Cu(OH)2红褐色沉淀: Fe(OH)3不建议死记硬背,只需记住每个阴离子里哪个不溶即可,钾钠铵硝都溶溶解性口诀一钾钠铵盐溶水快,①硫酸盐除去钡银铅钙。
②氯化物不溶氯化银,硝酸盐溶液都透明。
③氢氧根多溶一个钡④口诀中未有皆下沉。
⑤注:①钾钠铵盐都溶于水;②硫酸盐中只有硫酸钡、硫酸铅不溶(硫酸钙硫酸银微溶也是沉淀);③硝酸盐都溶于水;④碱性物质中除了钾离子钠离子铵离子锂离子还有钡离子也可溶⑤口诀中没有涉及的盐类都不溶于水;溶解性口诀二钾、钠、铵盐、硝酸盐;氯化物除银、亚汞;硫酸盐除钡和铅;碳酸、磷酸盐,只溶钾、钠、铵。
说明,以上四句歌谣概括了8类相加在水中溶解与不溶的情况。
溶解性口诀三钾钠铵硝皆可溶、盐酸盐不溶银亚汞;硫酸盐不溶钡和铅、碳磷酸盐多不溶。
多数酸溶碱少溶、只有钾钠铵钡溶溶解性口诀四钾、钠、硝酸溶,(钾盐、钠盐和硝酸盐都溶于水。
)盐酸除银(亚)汞,(盐酸盐里除氯化银和氯化亚汞外都溶。
)再说硫酸盐,不容有钡、铅,(硫酸盐中不溶的是硫酸钡和硫酸铅。
高中课本后面附录里的溶解性表

高中课本后面附录里的溶解性表都列出来了例如:常见物质的溶解性歌诀(一):钾、钠、硝酸溶,(钾盐、钠盐和硝酸盐都溶于水。
)盐酸除银(亚)汞,(盐酸盐里除氯化银和氯化亚汞外都溶。
)再说硫酸盐,不容有钡、铅,(硫酸盐中不溶的是硫酸钡和硫酸铅。
)其余几类盐,(碳酸盐、亚硫酸盐、磷酸盐、硅酸盐和硫化物)只溶钾、钠、铵,(只有相应的钾盐、钠盐和铵盐可溶)最后说碱类,钾、钠、铵和钡。
(氢氧化钾、氢氧化钠、氢氧化钡和氨水可溶)物质溶解性口诀(二):钾钠铵盐硝酸盐,完全溶解不困难,氯化亚汞氯化银,硫酸钡和硫酸铅。
生成沉淀记心间,氢硫酸盐和碱类,碳酸磷酸硝酸盐,可溶只有钾钠铵。
溶解性的口诀(三):钾钠铵硝溶得全,没有不溶水的盐。
氯化物,要记住,只有银是不溶物。
硫酸盐,溶得多,只有钡在水中搁。
碳磷酸盐很简单,溶于水的钾钠铵。
补充:盐的溶解性钾钠铵硝皆可溶、盐酸盐不溶银亚汞;硫酸盐不溶钡和铅、碳磷酸盐多不溶。
氢硫溶四位,钾钠和镁钡。
多数酸溶碱少溶、只有钾钠铵钡溶。
意思是在盐中,注意不是复盐中,阳离子是钾离子钠离子铵根离子,或者阴离子是硝酸根离子的盐在水中都是可溶的,而阴离子是氯离子的的盐中只有氯化银、氯化亚汞是不溶的,阴离子是硫酸根的盐中,硫酸钡、硫酸铅不溶,碳酸盐、磷酸盐基本上都是不溶的,除了阳离子是钾离子、钠离子、铵根离子的盐,而氢硫酸根,要可溶阳离子必须是钾钠钡镁中的其中一种。
而酸,大多数都是可溶的(高中课堂介绍的酸应该都是溶的),碱,只有氢氧化钾,氢氧化钠,氢氧化铵(也就是氨水),氢氧化钡可溶。
(2012•峨边县二模)水煤气的主要成分是CO和H2(少量CO2和水蒸气),某同学通过下列实验,验证水煤气的主要成分,请根据下图所示装置,回答有关问题.(1)A装置中反应的化学方程式是CO2+2NaOH ═Na2CO3+H2O;(2)B装置内盛放的物质是澄清的石灰水,其作用是检验水煤气中的CO2是否已除尽;(3)C装置内盛放的物质是浓硫酸;(4)D装置内的现象是黑色粉末变成红色;(5)若E装置与F装置位置颠倒,其后果是不能证明水煤气中H2的存在.考点:常见气体的检验与除杂方法;书写化学方程式、文字表达式、电离方程式.专题:压轴实验题.分析:(1)根据A中氢氧化钠溶液只可与水煤气中的二氧化碳反应,写出化学反应式;(2)B装置内的物质应该是检验二氧化碳是否被除尽;(3)C装置中应盛放吸收水分的物质;(4)一氧化碳在加热的条件下还原氧化铜,使黑色粉末变成红色;(5)E装置的作用是检验是否有水分,即看有无H2存在.解答:解:(1)A中氢氧化钠溶液只可与水煤气中的二氧化碳反应,生成碳酸钠和水.(2)B装置的作用应该是检验二氧化碳是否被除尽,所以应盛放石灰水;(3)然后再把剩余的水分除去,所以C装置中要盛放吸收水分性很强的浓硫酸;(4)剩余的CO和H2可以还原D装置中的黑色氧化铜,生成红色的铜,所以D装置的现象是黑色粉末变成红色.(5)E装置的作用是检验是否有水分,即看有无H2存在;F装置中的澄清石灰水用于检验二氧化碳的存在,如果二者颠倒,F装置中的水分进入E装置,也会使E中的无水硫酸铜变色,就不能证明水煤气中H2的存在.故答案为:(1)CO2+2NaOH═Na2CO3+H2O;(2)澄清的石灰水;检验水煤气中的CO2是否已除尽;(3)浓硫酸;(4)黑色粉末变成红色;(5)不能证明水煤气中H2的存在.。
高中化学溶解性表

高中化学溶解性表work Information Technology Company.2020YEAR
高中化学溶解性表
溶:该物质易溶于水。
不:该物质不溶于水。
难:难溶于水(溶解度小于0.01g,几乎可以看成不溶,但实际溶解了极少量,绝对不溶于水的物质几乎没有)
微:微溶于水
挥:易挥发或易分解
沉淀鉴别
淀;Cu2O 红色沉淀;Fe2O3红棕色沉淀;FeO 黑色沉淀
FeS2黄色沉淀;PbS 黑色沉淀;FeCO3灰色沉淀;
Ag2CO3白色沉淀(制作过程中Ag2CO3易分解成褐色Ag2O,混合物常常为黄色);Cu2(OH)2CO3暗绿色沉淀;BaCO3白色沉淀(且有CO2生成);CaCO3白色沉淀(且有CO2生成);BaSO4白色沉淀;不溶的碳酸盐白色沉淀(且有CO2生成);不溶的碱、金属氧化物白色沉淀(且有CO2生成);Fe(OH)2为白色絮状沉淀(在空气中很快变成灰绿色,再变成Fe(OH)3红褐色沉淀)
溶解性口诀:
钾、钠、硝酸溶,(钾盐、钠盐和硝酸盐都溶于水。
)
盐酸除银(亚)汞,(盐酸盐里除氯化银和氯化亚汞外都溶。
)
硫酸盐除钡、铅,(硫酸盐中不溶的是硫酸钡和硫酸铅。
)
其余几类盐,(碳酸盐、亚硫酸盐、磷酸盐、硅酸盐和硫化物);只溶钾、钠、铵,(只有相应的钾盐、钠盐和铵盐可溶)
碱类中,钾、钠、铵、钡溶。
(氢氧化钾、氢氧化钠、氢氧化钡和氨水可溶)
另有几种微溶物,可单独记住(见上表)。
高中化学常见气体性质归纳

常见气体性质归纳1. 常见气体溶解性:极易溶于水的气体:NH3(1∶700)、HCl(1∶500)易溶于水的气体:HF、HCl、HBr、HI、HCHO、SO2能溶或可溶于水的气体:CO2(1∶1)、Cl2(1∶2)、H2S(1∶2.6)微溶于水的气体:C2H2难溶或不溶于水的气体:O2、H2、CO、NO、CH4、CH3Cl、C2H4、C2H6能与水反应的气体:F2、NO22. 有颜色的气体单质:F2(淡黄绿色)、Cl2(黄绿色)、溴蒸气(红棕色) O3(淡蓝色)有颜色的气体化合物:NO2(红棕色)3. 有刺激性气味的气体:F2、Cl2、Br2(g)、HF、HCl、HBr、HI、NH3SO2、NO2、HCHO有臭鸡蛋气味的气体:H2S稍有甜味的气体:C2H44. 能用排水法收集的气体:H2、O2、CO、NO、CH4、CH3Cl、C2H4、C2H6C2H2可用排某些饱和溶液的方法收集的气体:CO2(排饱和NaHCO3溶液)SO2(排饱和NaHSO3溶液)、H2S(排饱和NaHS溶液)Cl2(排饱和NaCl溶液)5. 不能用排气法收集的气体:CO、C2H4、NO、C2H6、N26. 易溶于水能做喷泉实验的气体:NH3、HF、HCl、HBr、HI7. 有毒的气体:F2、Cl2、Br2(g)、HF、CO、NO、NO28. 易液化的气体:Cl2、NH3、SO29. 在空气中易形成白雾的气体:HF、HCl、HBr、HI 、NH310. 能在空气中燃烧的气体:H2、CO、CH4、C2H4、C2H6、C2H2、H2S在空气中点燃火焰呈淡蓝色的气体:H2、CO、CH4、H2S只能在纯氧中燃烧的气体:NH311. 在常温下不能共存的气体:SO2和H2S、H2S和Cl2、NH3和HClF2和H2、NO和O2、HI和Cl2或F212. 有漂白作用的气体:Cl2(有水时)、SO213. 能使澄清石灰水变浑浊的气体:HF、SO2、CO214. 与水可发生反应的气体:F2、Cl2、Br2(g)、SO2、CO2、NO2、NH315. 在空气中易被氧化变色的气体:NO16. 具有强化性的气体:F2、Cl2、Br2(g)、NO2、O2、O3具有强或较强还原性的气体:H2、CO、HI 、HBr、HCl、NH3、NO、H2S 既有氧化性又有还原性的气体:SO2、N217. 能使无水硫酸铜变蓝的气体:H2O(g)18. 水溶液易腐蚀玻璃的气体:HF19. 能使紫色石蕊试液变红的气体:HF、HCl、HBr、HI、NO2、SO2、CO2Br2(g)、H2S能使湿润的红色石蕊试纸变蓝的气体:NH3能使紫色石蕊试液先变红后褪色的气体:Cl220. 能使酸性高锰酸钾溶液褪色的气体:C2H4、C2H2、HBr、 HI、SO2、H2S21.能使溴水褪色的气体:SO2、H2S、 HI、C2H4、C2H222.能使湿润的淀粉碘化钾试纸变蓝的气体:Cl2、NO2、Br2(g)、O323.能使湿润的醋酸铅或硝酸铅试纸变黑的气体:H2S24.在制备过程中发生氧化还原反应的气体:Cl2、O2、H2、NO、NO225.能用浓硫酸制取的气体:HF、HCl、CO、C2H4、SO226. 不能用浓硫酸干燥的气体:HBr、 HI、H2S、NH327.不能用碱石灰干燥的气体:SO2、H2S、Cl2、HF、HCl、HBr、HI、NO2CO228.制备时不需要加热的气体: SO2、H2S、CO2、NO、NO229.能用启普发生器制取的气体:H2S、CO2、H230.遇硝酸银溶液可产生沉淀的气体:Cl2、Br2(g)、H2S、HCl、HBr、HI NH331.由于化学性质稳定通常用做保护气的气体:N2、Ar另可用还原性气体H2做金属焊接的保护气32. 导致酸雨的主要气体:SO2、NO2导致光化学烟雾的主要气体:NO2等氮氧化物和烃类导致臭氧层空洞的主要气体:氟氯烃和 NO2等氮氧化物导致温室效应的主要气体:CO2和CH4等烃33. 用做制冷剂或冷冻剂的气体:NH3、CO2、N234. 用做大棚植物气肥的气体:CO235. 制得的气体通常是混合气的气体:NO2和N2O436. 被称做地球生命保护伞的气体:O337. 燃烧用做金属焊接或切割的气体:H2、C2H238. 一种气体在另一种气体中燃烧产生苍白色火焰的气体:H2和Cl239. 用于生产碳酸型饮料的气体:CO240. 用于自来水消毒的气体:Cl2。
酸碱盐溶解性表和口诀(精华版)
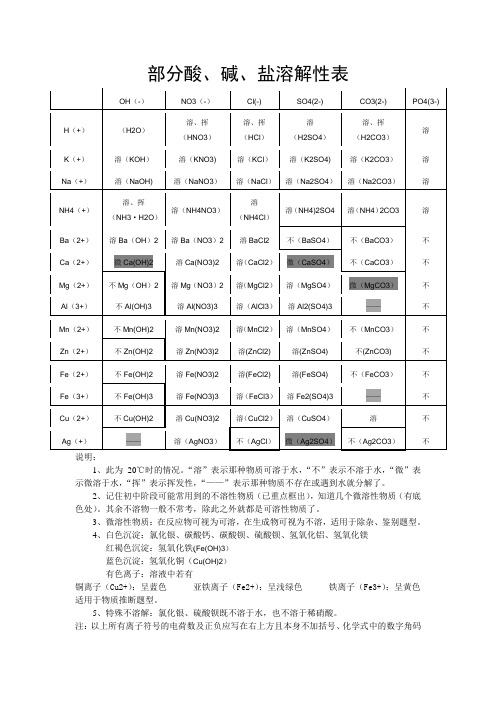
说明:
1、此为20℃时的情况。
“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“——”表示那种物质不存在或遇到水就分解了。
2、记住初中阶段可能常用到的不溶性物质(已重点框出),知道几个微溶性物质(有底色处)。
其余不溶物一般不常考,除此之外就都是可溶性物质了。
3、微溶性物质:在反应物可视为可溶,在生成物可视为不溶,适用于除杂、鉴别题型。
4、白色沉淀:氯化银、碳酸钙、碳酸钡、硫酸钡、氢氧化铝、氢氧化镁
红褐色沉淀:氢氧化铁(Fe(OH)3)
蓝色沉淀:氢氧化铜(Cu(OH)2)
有色离子:溶液中若有
铜离子(Cu2+):呈蓝色亚铁离子(Fe2+):呈浅绿色铁离子(Fe3+):呈黄色适用于物质推断题型。
5、特殊不溶解:氯化银、硫酸钡既不溶于水,也不溶于稀硝酸。
注:以上所有离子符号的电荷数及正负应写在右上方且本身不加括号、化学式中的数字角码
应写在右下方,这里是为了方便打字,请谅解。
部分酸碱盐溶解性背诵口诀
①钾钠铵盐硝酸盐,
完全溶解不困难。
②硫酸盐中钡不溶,
盐酸盐中只银难,
硫酸钡和氯化银,
两种沉淀记心间。
③碳酸盐溶钾钠铵,
碳酸铝铁银碱无。
④硫酸钙银盐微溶,
微溶还有碳酸镁。
⑤碱有钾钠铵钡溶,
氢氧化钙是微溶,
其他全都不能溶。
⑥常见诸酸皆可溶,
记住挥酸盐硝碳。
注:口诀仅供参考,本身并不完全准确,但是能促进记忆。
高中化学溶解性表73129
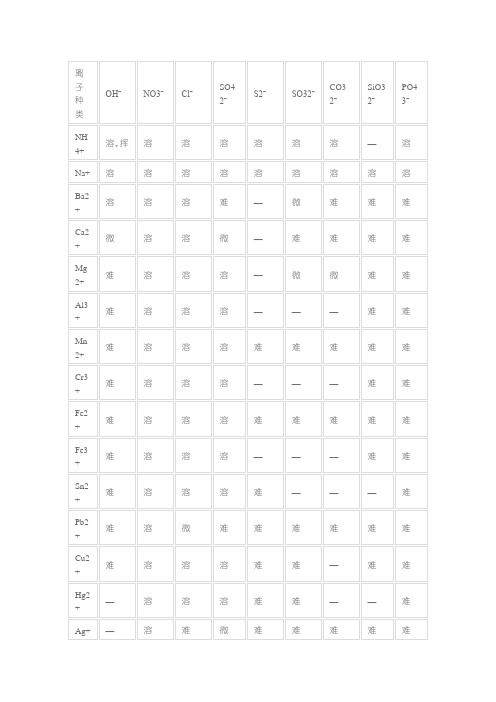
适合高中使用的口诀:
碳酸只溶钾钠铵;(碳酸盐里钾钠铵盐易溶)
氢氧多溶了钡的碱。
(氢氧根比碳酸根多溶解一个钡离子)
硫酸不溶钡和铅;(硫酸盐里钡和铅不溶)
三价碳酸天地间。
(三价的阳离子和碳酸根离子都生成气体和沉淀,即上天和入地)
还是氢氧人水性好,
水底忍渴好几年。
(氢氧根和银离子会生成氧化银沉淀是为水底,忍渴指还生成了水)
氯化不溶唯有银;(氯化物中只有银盐不溶)
硝酸大度溶万金。
(硝酸盐都易溶)
溶解性口诀八
钾钠铵盐均可溶;硝盐入水无影踪。
难溶硫酸铅和钡;还有氯化银亚汞。
至于磷酸碳酸盐;绝大多数均难溶。
酸碱盐的溶解性表口诀高中

酸碱盐的溶解性表口诀高中酸碱盐的溶解性表口诀是学习酸碱盐的基础,在高中物理化学中有着重要的作用。
一般来说,酸碱盐的溶解性会与溶质的性质,溶解介质的性质,溶液的倍量有关。
那么,我们需要记住酸碱盐的溶解性表口诀,以便能够正确地判断某一酸碱盐是否能够溶于某一介质中,更加深入地学习酸碱盐的方面。
在高中物理化学中,酸碱盐的溶解性表口诀是学习酸碱盐的一个重要知识点,可以记住以下口诀:溶于水的有HCl、NaOH、KNO3、NaHCO3,而溶于醇的有HNO3、H2SO4、C2H5OH、NaClO。
下面我们来看看酸碱盐的溶解性表口诀的一些具体内容:一、 HCl、NaOH、KNO3、NaHCO3都能溶于水,其中HCl是一种强酸,NaOH是一种强碱,而KNO3和NaHCO3则都是碱性无机盐。
二、 HNO3、H2SO4、C2H5OH、NaClO都能溶于醇,其中HNO3是一种强酸,H2SO4是一种强碱,而C2H5OH和NaClO则都是碱性无机盐。
三、汞是一种重要的金属,也能够溶于稀硫酸,这是一种强酸,它的溶解度受温度的影响,随着温度的升高,汞的溶解度也会增加。
四、铝能够溶于硫酸铝,硫酸铝是一种弱酸,属于酸性无机盐,它的溶解度也受温度的影响,随着温度的升高,铝的溶解度也会增加。
五、碳酸钠可以溶于水,也可以溶于乙醇,碳酸钠是一种弱碱,属于碱性无机盐,它的溶解度受温度的影响,随着温度的升高,碳酸钠的溶解度也会增加。
六、氯化氢(HCl)可以溶于水,也可以溶于乙醇,它属于强酸,它的溶解度受温度的影响,随着温度的升高,氯化氢的溶解度也会增加。
七、氢氧化钙(Ca(OH)2)可以溶于水,也可以溶于乙醇,它属于强碱,它的溶解度受温度的影响,随着温度的升高,氢氧化钙的溶解度也会增加。
以上就是高中物理化学中酸碱盐的溶解性表口诀的一些具体内容,希望大家能够记住,以便在学习酸碱盐的方面更加深入地理解。
从口诀中我们可以得知,溶解在酸碱盐中是非常重要的,它的溶解性受到溶质的性质,溶解介质的性质,溶液的倍量以及温度等因素的影响。
部分物质化学式、溶解性表
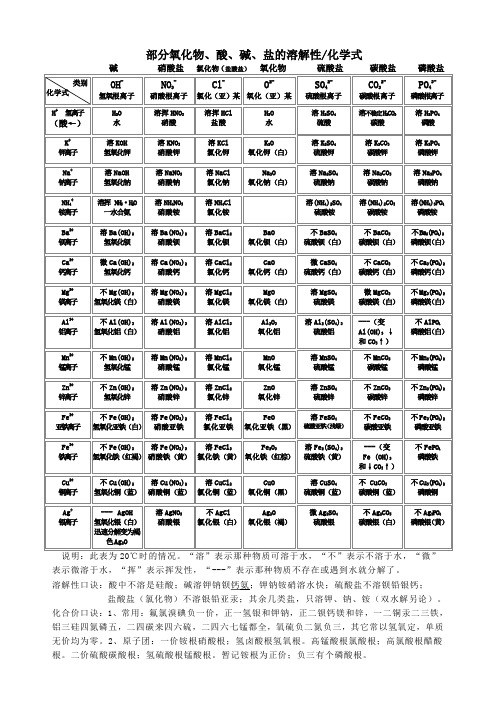
部分氧化物、酸、碱、盐的溶解性/化学式
表示微溶于水,“挥”表示挥发性,“---”表示那种物质不存在或遇到水就分解了。
溶解性口诀:酸中不溶是硅酸;碱溶钾钠钡钙氨;钾钠铵硝溶水快;硫酸盐不溶钡铅银钙;
盐酸盐(氯化物)不溶银铅亚汞;其余几类盐,只溶钾、钠、铵(双水解另论)。
化合价口诀:1、常用:氟氯溴碘负一价,正一氢银和钾钠,正二钡钙镁和锌,一二铜汞二三铁,铝三硅四氮磷五,二四碳来四六硫,二四六七锰都全,氧硫负二氮负三,其它常以氢氧定,单质无价均为零。
2、原子团:一价铵根硝酸根;氢卤酸根氢氧根。
高锰酸根氯酸根;高氯酸根醋酸根。
二价硫酸碳酸根;氢硫酸根锰酸根。
暂记铵根为正价;负三有个磷酸根。
高中化学溶解性表3篇

高中化学溶解性表
第一篇:酸碱溶解性表
酸碱溶解性是指物质在酸性或碱性环境下的溶解性质,具体来说就是指物质在酸性或碱性溶液中的溶解度以及其在酸性或碱性溶液中的稳定性。
而这些性质则对于了解物质性质及其在反应中的应用具有非常重要的意义。
下面是一些经典的酸碱溶解性表:
一、酸溶解性表
1. 金属:
金属名称溶解性
钠(Na)EDT
钙(Ca)EDT
铝(Al)不溶
铁(Fe)水或酸中不溶,盐酸中溶
2. 非金属:
非金属名称溶解性
硼(B)弱酸水中可以溶解
碳(C)水不溶,但在酸中会产生气体
氮(N)不溶
氧(O)非常容易溶解
氟(F)非常容易溶解
氯(Cl)不容易溶解
溴(Br)不容易溶解
碘(I)不容易溶解
二、碱溶解性表
1. 金属:
金属名称溶解性
钠(Na)碱中显著溶解
钙(Ca)碱中极易溶解
铝(Al)碱中不稳定
铁(Fe)碱中容易溶解
2. 非金属:
非金属名称溶解性
硼(B)弱碱中可以溶解
碳(C)不溶
氮(N)不溶
氧(O)不溶
氟(F)不容易溶解
氯(Cl)不容易溶解
溴(Br)不容易溶解
碘(I)不容易溶解
以上内容可以为我们更好地理解物质的性质及其在实际应用中的应用提供参考。
高中化学溶解性表73129

高中化学溶解性表
73129
work Information Technology Company.2020YEAR
适合高中使用的口诀:
碳酸只溶钾钠铵;(碳酸盐里钾钠铵盐易溶)
氢氧多溶了钡的碱。
(氢氧根比碳酸根多溶解一个钡离子)
硫酸不溶钡和铅;(硫酸盐里钡和铅不溶)
三价碳酸天地间。
(三价的阳离子和碳酸根离子都生成气体和沉淀,即上天和入地)
还是氢氧人水性好,
水底忍渴好几年。
(氢氧根和银离子会生成氧化银沉淀是为水底,忍渴指还生成了水)
氯化不溶唯有银;(氯化物中只有银盐不溶)
硝酸大度溶万金。
(硝酸盐都易溶)
溶解性口诀八
钾钠铵盐均可溶;硝盐入水无影踪。
难溶硫酸铅和钡;还有氯化银亚汞。
至于磷酸碳酸盐;绝大多数均难溶。
高中化学酸碱和盐的溶解性表大全

溶
溶
微
微
不
不
不
不
Mg2﹢
不
溶
溶
溶
溶
微
微
不
不
Al3﹢
不
溶
溶
溶
一
一
一
不
不
Mn2﹢
不
溶
溶
溶
不
不
不
不
不
Zn2﹢
不
溶
溶
溶
不
不
不
不
不
Cr3﹢
不
溶
溶
溶
一
一
一
不
不
Fe2﹢
不
溶
溶
溶
不
不
不
不
不
Fe3﹢
不
溶
溶
溶
一
一
一
不
不
Sn2﹢
不
溶
溶
溶
不
一
一
一
不
Pb2﹢
不
溶
微
不
不
不
不
不
不
Bi3﹢
不
溶
一
溶
不
不
不
一
不
Cu2﹢
不
溶
溶
溶
不
不
不
高中化学酸碱和盐的溶解性表大全
高中化学酸、碱和盐的溶解性表(室温)
阴离子
阳离子
OH﹣
NO?﹣
Cl﹣
SO42﹣
S2﹣
SO32﹣
CO32﹣
SiO32﹣
PO43﹣
H﹢
溶、挥
溶、挥
溶
溶、挥
溶、挥
高中化学盐溶解性表及元素周期表
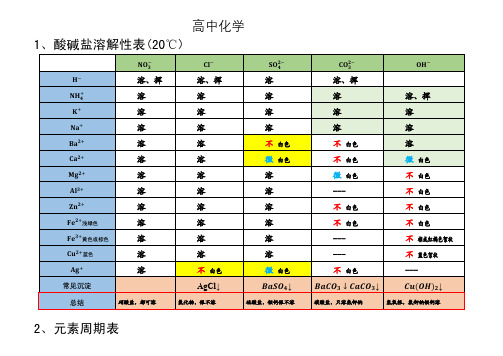
高中化学盐溶解性表及元素周期表
1、酸碱盐溶解性表(20℃)
−
−
−
−
−
−
溶、挥
溶、挥
溶
溶、挥
+
溶
溶
溶
溶
溶、挥
+
溶
溶
溶
溶
溶
+
溶
溶
溶
溶
溶
+
溶
溶
不
白色
不
白色
溶
&色
不
白色
微
白色
+
溶
溶
溶
微
白色
不
白色
+
溶
溶
溶
---
不
白色
+
溶
溶
溶
不
白色
不
白色
+ 浅绿色
溶
溶
溶
不
白色
不
白色
+ 黄色或棕色
溶
溶
溶
---
不
棕或红褐色絮状
+ 蓝色
溶
溶
溶
---
不
蓝色絮状
溶
不
不
---
+
AgCl↓
常见沉淀
总结
白色
硝酸盐,都可溶
2、元素周期表
氯化物,银不溶
微
白色
↓
高中生物:第三章常见物质溶解性表(20℃)素材人教版选修4

附:常见物质溶解性表〔20℃〕
阴 阳离子 离 子
H+
OH -
NO
- 3
Cl -
SO
2- 4
溶、挥 溶、挥 溶
S 2-
SO
2- 3
CO
2- 3
SiO
2- 3
溶、挥 溶、挥 溶、挥 微
PO
3- 4
溶
NH
+ 4
溶、挥 溶
溶
溶
溶
溶
溶
溶
溶
K+
溶
溶
溶
溶
溶
溶
溶
溶
溶
Na+
溶
溶
溶
溶
溶
溶
溶
溶
溶
Ba2+
溶
溶
溶
不
溶
不
不
不
溶
溶
不
不
不
不
不
Hg+
-
溶
不
微
不
不
不
-
不
Hg2+
-
溶
溶
溶
不
不
不
-
不
Ag+
-
溶
不
微
不
不
不
不
不
说明:“溶〞表示那种物质可溶于水,“不〞表示不溶于水,“微〞表示微溶于水,“挥〞表
专业.
. 示挥发性,“—〞表示那种物质不存在或遇到水就分解了。
专业.
不
Ca2+
微
溶
溶
微
微
不
不
不
不
Mg2+
不
溶
溶
溶
溶
微
不
不
不
高中生物:第三章常见物质溶解性表(20℃)素材人教版选修4
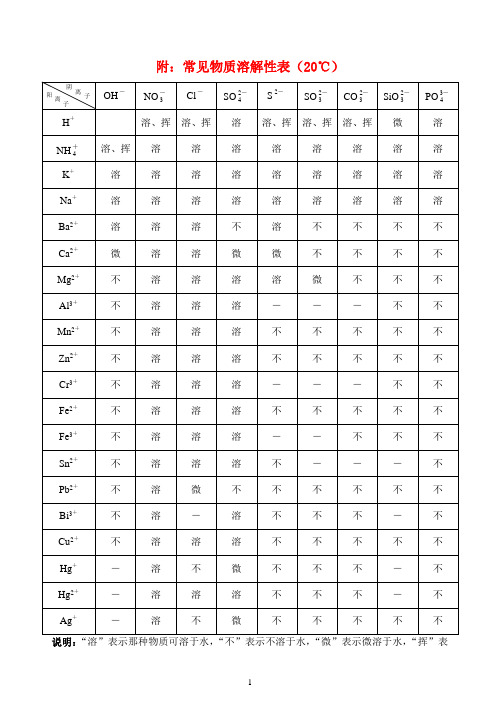
附:常见物质溶解性表(20℃)
OH - NO -3
Cl -
SO -
24
S -2
SO -
23 CO -23 SiO -
23 PO -
34
H +
溶、挥 溶、挥 溶 溶、挥 溶、挥 溶、挥 微 溶 NH +4 溶、挥 溶 溶 溶 溶 溶 溶 溶 溶 K
+
溶 溶 溶 溶 溶 溶 溶 溶 溶 Na
+
溶 溶 溶 溶 溶 溶 溶 溶 溶 Ba 2+
溶 溶 溶 不 溶 不 不 不 不 Ca 2
+
微 溶 溶 微 微 不 不 不 不 Mg 2+
不 溶 溶 溶 溶 微 不 不 不 Al 3
+
不 溶 溶 溶 - - - 不 不 Mn 2+
不 溶 溶 溶 不 不 不 不 不 Zn 2+
不 溶 溶 溶 不 不 不 不 不 Cr 3+
不 溶 溶 溶 - - - 不 不 Fe 2+
不 溶 溶 溶 不 不 不 不 不 Fe 3
+
不 溶 溶 溶 - - 不 不 不 Sn 2+
不 溶 溶 溶 不 - - - 不 Pb 2+
不 溶 微 不 不 不 不 不 不 Bi 3
+
不 溶 - 溶 不 不 不 - 不 Cu 2+
不 溶 溶 溶 不 不 不 不 不 Hg
+
- 溶 不 微 不 不 不 - 不 Hg 2+
- 溶 溶 溶 不 不 不 - 不 Ag
+
-
溶
不
微
不
不
不
不
不
说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表
阴
离
子
阳
离
子
示挥发性,“—”表示那种物质不存在或遇到水就分解了。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CO32−C2O42−F−Cl−Br−I−S2−
NH4+水水水水水水水
H+弱、揮水弱、揮溶、揮溶、揮水水
Na+水水水水水水水
K+水水水水水水水
Mg2+略溶水HCl水水水反應[1]
Ca2+HCl HCl不溶水水水反應[1]
Sr2+HCl HCl HCl水水水微溶[2]
Ba2+HCl HCl略溶水水水反應[1]
Cr3+-HCl水水水水水解 HCl Mn2+HCl HCl HCl水水水HCl
Fe2+HCl HCl略溶 HCl水水水HCl
Fe3+解HCl略溶 HCl水水水HCl
Co2+HCl HCl HCl水水水HNO3
Ni2+HCl HCl HCl水水水HNO3
Cu+不溶-氧還[4]微溶HCl不溶微溶,HCl Cu2+HCl[8]HCl略溶 HCl水水略溶HNO3
Zn2+HCl HCl HCl水水水HCl
Cd2+HCl HCl略溶 HCl水水水HNO3
Al3+解HCl水水水水水解 HCl Ga3+不溶略溶酸,氧還水水水不溶
Tl+水水微溶微溶微溶微溶難溶
C4+--微溶微溶微溶難溶微溶
Sn2+-HCl水水解,HCl水解 HCl水濃HCl
Sn4+-水水水解,HCl水解 HCl水解 HCl濃HCl
Pb2+HNO3HNO3略溶 HNO3沸水不溶略溶 HNO3HNO3
As3+--解[17]水解,HCl水解 HCl水HNO3
Sb3+-HCl略溶,HCl水解,HCl水解 HCl水解 HCl濃HCl
Bi3+HCl HCl HCl水解,HCl水解 HCl HCl HNO3
CH3+不溶不溶略溶略溶弱、揮弱、揮不溶
水該物質溶於
水
略溶
該物質略溶
於水
微溶
該物質微溶
於水
HCl
該物質可
溶於鹽酸
Ag+HNO3HNO3水不溶不溶不溶HNO3
HNO3該物質可溶
於硝酸王水
該物質可
溶於王水
不溶
該物質不溶
於水、鹽酸
、硝酸和王
水
氧還
該物質的
陰陽離子
在水中會
發生氧化
還原反應
而不存在
解該物質的
陰陽離子
在水中會
發生徹底
雙水解反
弱
該物質溶於
水但為弱電
解質
揮
該物質溶於
水且有揮發
性
-
該物質溶
解度資訊
不詳
SO42−
SO32−S2O32−AsO43−AsO33−PO43−BO2−SiO32−水
水水水水水水水水
水水水水水水水水
水水水水水水水水
水水水水水水水水
水水HCl HCl HCl HCl HCl 微溶
HCl 水HCl HCl HCl 略溶HCl 不溶
HCl 水HCl HCl HCl 略溶HCl 不溶
HCl HCl HCl HCl HCl HCl HCl 水
--HCl -HCl HCl HCl 水
HCl 水HCl HCl HCl HCl HCl 水
HCl 水HCl HCl HCl HCl HCl 水
解-HCl HCl HCl HCl HCl 水
HCl 水HCl HCl HCl HCl HCl 水
HCl 水HCl HCl HCl HCl HCl 水[5]
水------水
HCl -HCl HCl HCl HCl HCl 水
HCl 水HCl HCl HCl HCl HCl 水
HCl 水HCl HCl HCl HCl HCl 水
HCl 水HCl -HCl HCl HCl 水
不溶水--不溶--水
水---略溶----------水
HCl 水HCl HCl HCl HCl --
-水HCl -HCl --HNO3
HNO3HNO3HNO3HNO3HNO3HNO3HNO3-
-------HCl
----HCl --略溶
--HCl HCl HCl HCl HCl 弱、揮弱、揮---弱、揮--
HNO3HNO3HNO3HNO3HNO3HNO3HNO3溶解性全表略溶
C4H4O62−CrO42−CN −[Fe(CN)6]4−[Fe(CN)6]3−SCN −CH3COO −NO2−水
水水水水水水水水
水水水水水水水水
水水水水水水水水
水水水水水水水水
水水水水水水水HCl
水水水水水水水HCl
略溶水水水水水水HCl
HCl 略溶 HCl 水水水水水水
HCl HCl --水水-略溶 HCl
略溶 HCl HCl HCl 不溶水水水HCl
氧還不溶不溶不溶水水-水
水-不溶水水水水水
HCl HNO3不溶不溶水水水HCl
HCl HNO3不溶不溶水水水-
-不溶--不溶解-水
水HCl 不溶不溶HNO3水水HCl
水HCl 不溶不溶水水水HCl
HCl HCl 不溶不溶HCl 水水水
----水水--
水-----水-
-水-------微溶-----HCl
HCl --不溶-水-水
--不溶-水水-HNO3
HNO3HNO3不溶不溶HNO3水水-
-------HCl
-------HCl
HCl ----水-水-混溶---弱、揮略溶
不溶略溶熱水HNO3
HNO3不溶不溶不溶性全表
NO3−O2−OH −H −ClO4−MnO4−N3−水解水不穩定水略溶幾乎不溶水弱弱不溶水水水水水水解水水水水水水解水水水水HCl HCl 解水水水水略溶 HCl 略溶 HCl 解水水水水HCl 略溶 HCl 解水水水水HCl HCl 解水微溶水水HCl HCl 解水水-水HCl HCl 解水氧還[3]HNO3水HCl HCl 解水水HNO3水HCl HCl 解水水HNO3水HCl HCl 解水水HNO3水HCl HCl 解水水HNO3水HCl 不溶不溶[6][7]水水HNO3水HCl HCl -水水HNO3水HCl HCl 解水水HNO3水HCl HCl -水水HNO3水HCl HCl 解水水不溶水-不溶-水水不溶水-水[15]-水水--略溶、弱水微溶--解[16]-HCl HCl -水水--HCl,略溶不溶-水水略溶水HNO3HNO3-水水水-HCl -水水水--HCl HCl 不溶水水-略溶,HNO3H NO3HCl 次氯酸
水水-解弱、揮混溶微溶水-微溶不溶水解[11]HNO3水HNO3不溶[9][10]。
