4 1酶
生化第4章学习酶

5、80年代初发现了具有催化功能的RNA——核酶(ribozyme),这一
V、异构酶:催化 各种异构体之间的互变。
A
B
常见的有消旋和变旋、醛酮异构、顺反异构和变位酶类。
异构酶按照异构化的类型不同,分为 6 个亚类。命名时分别在底 物名称的后面加上异构酶(isomerase)、消旋酶(racemase)、 变位酶(mutase)、表异构酶(epimerase)、顺反异构酶(cistrans-isomerase)等。
几何异构 专一性
相对专一性:可作用于一类或一些结构很相似的底物。
O 酯酶:R—C—O—R′ + H2O
RCOO- +R O′H + H+
CH2OH
α-葡萄糖 苷酶
5 OH
OH
O 1O R +H2O
OH
绝对专一性:只能作用于某一底物。
第一章 酶学通论
1、酶的催化性质 2、酶的化学本质 3、酶的分类命名 4、酶的专一性 5、酶的活力与分离纯化
概述-酶的发现及研究历史
人们对酶的认识起源于生产与生活实践。 夏禹时代,人们掌握了酿酒技术。 公元前12世纪周朝,人们酿酒,制作饴糖和酱。 春秋战国时期已知用麴(曲)治疗消化不良的疾病。
2.1 酶的化学组成
化
①经酸碱水解终产物是aa
学
②能被蛋白酶水解而失活
本
③酶可变性失活
质 是
④酶是两性电解质
KPC酶研究进展

SUMMARY
如果临床菌株对第三、第四代头孢菌素"R",
厄他培南≥2μg/ml〔19-21mm>
*亚胺培南、美罗培南2-4μg/ml 〔16-
21mm>
应进行改良 Hodge 试验
对碳氢酶烯类抗生素敏感而Hodge 试验 〔+的菌 株,CLSI建议:报告MIC值,但不报告"S"
放映结束 感谢各位的批评指导!
肠杆菌属
注解
源于肺炎克雷伯菌的暴发流行 源于产酸克雷伯菌的散在发生
大肠埃希菌
沙门菌属 弗劳地枸橼酸杆菌
散在发生
沙雷菌属
铜绿假单胞菌– 哥伦比亚 &波多黎各
两株肺炎克雷伯菌的RAPD分析
对上海地区分离的肺炎克 雷伯菌〔A1500和XX地 区分离的肺炎克雷伯菌 〔K1做随机扩增的多态性 DNA〔 RAPD分析,证明 两株菌株不是同一克隆型
KPC酶的检测
实验室检测产KPC菌株
问题: 1> 一些菌株表现为低水平的碳氢酶烯类抗
生素耐药,甚至敏感
2> 有些自动化系统尚不能发现低水平耐药
产KPC菌株对亚胺培南的敏感性
No. of Isolates
60 40 20 0
≤1
S*
Im ipe ne mI
R
2
4
8
16
32
>32
12%的检测MIC菌(m株g/m对l) 亚胺培南敏感
KPC, SME, 肠杆菌科
IMI, NMC, (铜绿中报道较少) GES
Class B
IMP, VIM, 铜绿假单胞菌
(金属-b-内酰胺酶) GIM, SPM 肠杆菌科细菌
白细胞介素4诱导蛋白1(IL4I1)在免疫调节中的作用研究进展

细胞与分子免疫学杂志(Chin J Cell M ol Im m U n〇l)2021, 37( 1)79•综述.文章编号:1007-8738(2021 )01"0079>05白细胞介素4诱导蛋白1(IL4I1)在免疫调节中的作用研究进展刘文倩,董成亚,刘向荣*(首都医科大学附属北京天坛医院,国家神经系统疾病临床医学研究中心,北京100070)[摘要]白细胞介素4诱导蛋白1(11411)是一种分泌型氨基酸氧化酶,由抗原提呈细胞产生,可将苯丙氨酸氧化为苯丙酮酸。
IW I1通过抑制T细胞增殖、分化并限制B细胞增殖,发挥免疫抑制作用;参与机体感染防御;作为肿瘤不良预后相关基因,参 与肿瘤免疫逃逸;在自身免疫性脱髓鞘疾病中,调节小胶质细胞极化表型,促进髓鞘再生,但具体作用机制尚不明确。
我们总 结了 1W I1在机体中的免疫调节作用及机制,以期为感染、肿瘤和自身免疫性疾病的治疗提供新思路。
[关键词]白细胞介素4诱导蛋白1(I L4I1);免疫调节;肿瘤免疫逃逸;自身免疫性疾病;髓鞘再生;综述[中图分类号]R392. 9, R392.l l,R593. 2, G353.ll [文献标志码]AThe role of IL4I1 in immunoregulation :An updateLIU Wenqian,D O N G Chengya,LIU Xiangrong*National Center of Clinical Medicine for Neurological Diseases, Beijing Tiantan Hospital, Capital Medical University, Beijing 100070, China* Corresponding author, E-m ail:Ixrpumc@[Abstract]Interleukin^ induced 1protein (IL4I1), a secreted amino acid oxidase produced by antigen presenting cells, oxidizes phenylalanine to phenylpyruvate. It has been found that IL4I1 exerts an immunosuppressive function by inhibiting the proliferation and differentiation of T cells as well as limiting the proliferation of B cells. IL4I1 is involved in host defense against infection. As a gene related to poor prognosis in cancers, IL4I1 participates in tumor immune escape. IL411promotes remyelination via regulation of the different phenotypes of microglia in the autoimmune demyelinating diseases, but the detailed mechanism still remains unknown. W e summarize the role and mechanism of IL4I1 in the immune regulation to provide new ideas for the treatment of infections, cancers and autoimmune diseases.[Key words] interleukin^ induced gene 1(IL4I1) ;immune regulation;tumor immune escape;autoimmune disease;remyelination;review白细胞介素4诱导蛋白1(interleukin~4induced 1 protein,II4I1)是一种L型氨基酸氧化酶,因其可以 在细胞因子白细胞介素4(interleukin4,IL4)诱导下 表达而命名。
面粉中常用的酶制剂的作用机理及应用方法

(3)真菌α-淀粉酶作用淀粉产生的糊精,又对改良面包外皮色泽已有良好的效果。
3、细菌α-淀粉酶
细菌α-淀粉酶一般是耐热的枯草杆菌α-淀粉酶在作用机理上与真菌α-淀粉酶有一定的差别。同样以可溶性淀粉作底物时,真菌α-淀粉酶的水解终产物主要是麦芽糖和麦芽三糖;而细菌α-淀粉酶的终产物主要是短链糊精。两者的性质差异也很大。其最适pH值为5.0最适温度为80℃~90℃。
因此,优良的面包制造,必须添加适量的α-淀粉酶。
在面包生产中添加α-淀粉酶,使面包变得柔软,增强伸展性和保持气体的能力,容积增大,出炉后制成触感较好的面包,此外,由于α-淀粉酶作用淀粉所生成的糊精,对改良面包外皮色泽已有较好的效果。
2、真菌α-淀粉酶
真菌α-淀粉酶简称FAA,来源于米曲霉,作为传统酶制造,是第一个应用于面包制作的微生物酶,它取代了麦芽是由于麦芽中的淀粉酶含量不稳定,而且含有蛋白水解酶,真菌α-淀粉酶具有更稳定的活性而不含蛋白质酶活性,所以此酶应用十分广泛。
由于其较高的耐热性,在烘培是仍有酶活性,从而产生过多的可溶性糊精,结果使得最终制品发粘而不是和在面包中大量使用。但与真菌α-淀粉酶相比,它能产生很好的抗老化效果。而对面包的弹性和口感都优于真菌α-淀粉酶,因而小规模的使用及如何解决其耐高温而造成最终产品发粘的问题是十分重要的。
α-淀粉酶具有仿腐抗老的能力,其机理是此酶将淀粉分解生成地分子量糊精火地分子量的分支淀粉,能干涉支链淀粉的重结晶。产生的糊精会干涉面包中膨胀淀粉粒与蛋白质网络结构的相互作用,而且支链淀粉和支链淀粉中裂开的键有助于支链淀粉-脂肪复合物的形成。
面筋蛋白由麦谷蛋白和麦醇蛋白组成,面筋蛋白中的半胱氨酸是面筋的空间结构和面团形成的关键。蛋白质分子间的作用取决于二硫键-S-S-的数目和大小。二硫键可在分子内形成(麦醇蛋白),也可以在分子间形成(麦谷蛋白)
高三生物一轮总复习 第2单元 细胞代谢 专题4 酶1

付兑市石事阳光实验学校专题4 酶考点十二酶的本质及作用高考试题1.(课标理综Ⅱ,T6,6分,★★☆)关于酶的叙述,错误的是( )A.同一种酶可存在于分化程度不同的活细胞中B.低温能降低酶活性的原因是其破坏了酶的空间结构C.酶通过降低化学反的活化能来提高化学反速度D.酶既可以作为催化剂,也可以作为另一个反的底物点睛:本题主要考查了酶的相关知识,涉及酶的结构、分布、功能和作用机理。
意在考查考生对与酶的相关知识的识记能力和理解能力。
解析:同一种酶可存在于分化程度不同的活细胞中,无论细胞分化到何种程度,某些基本的代谢是细胞所共有的,如细胞呼吸、转录、翻译,这些生命活动过程中的酶就是分化程度不同的细胞中所共有的酶,如呼吸酶、RNA聚合酶,故A项正确。
酶的作用条件比较温和,在最适温度和pH下,酶的活性最强,低温使酶的活性降低,但不会破坏酶的空间结构,使酶失活,故B项错误。
酶在生化反中起着催化作用,其作用机理降低了化学反的活化能,提高了化学反速率,故C项正确。
绝大多数酶的化学本质是蛋白质,酶在一些化学反中可作为催化剂,而在另一些化学反中,则可作为底物被相关的蛋白酶水解,如唾液淀粉酶可催化淀粉水解,又可以被胃蛋白酶水解,故D项正确。
答案:B2.(理综,T2,6分,★★☆)细胞代谢受酶的调节和控制。
下列叙述正确的是( )A.激素都是通过影响靶细胞内酶活性来调节细胞代谢B.代谢的终产物可反馈调节相关酶活性,进而调节代谢速率C.同一个体各种体细胞酶的种类相同、数量不同,代谢不同D.对于一个细胞来说,酶的种类和数量不会发生变化点睛:本题考查了酶的本质及作用,意在考查考生对酶的本质的识记能力和对酶作用机理的理解能力。
解析:激素通过影响基因的表达来调节细胞代谢,A错误;代谢终产物通过反馈调节,使酶的活性升高或降低来影响酶的活性,使代谢速率维持在一水平上,B 正确;同一个体由于分化形成了各种体细胞,分化过程中形成的酶的种类不同,数量也不同,故代谢过程也不同,C错误;对于一个细胞来说,有分化、衰老、凋亡过程,在不同过程中酶的种类和数量也会发生变化,D错误。
酶
(3)过氧化物酶
(4)加氧酶(双加氧酶和单加氧酶)
O2 +
OH OH
OH C=O C=O OH
(顺,顺-已二烯二酸)
RH + O2 + 还原型辅助因子 ROH + H2O + 氧化型辅助因子 (又称羟化酶)
2、转移酶 Transferase
• 转移酶催化基团转移反应,即将一个底物分子 的基团或原子转移到另一个底物的分子上。
HOOCCH=CHCOOH H2O
HOOCCH2CHCOOH OH
5、异构酶 Isomerase
• 异构酶催化各种同分异构体的相互转化, 即底物分子内基团或原子的重排过程。
• 例如,6-磷酸葡萄糖异构酶催化的反应
CH2OH O OH OH OH OH OH OH CH2OH O CH2OH OH
A
酶蛋白决定反应的特异性和高效性 辅助因子决定反应的种类与性质
辅助因子分类
(按其与酶蛋白结合的紧密程度)
辅酶 (coenzyme): 与酶蛋白结合疏松,可用透析或超滤的 方法除去。 辅基 (prosthetic group): 与酶蛋白结合紧密,不能用透析或超 滤的方法除去。 金属离子
辅酶/辅基的作用特点
• 活性中心:
• 必需基团:活性中心的必需基团,活性中心以外的必 需基团 • 活性中心: 底物结合部位+ 催化部位 • 活性中心是酶与底物结合并表现催化作用的空间区域, 大多由肽链上相距甚远的氨基酸残基提供必需基团, 经肽链折叠环绕,使之在三维空间中相互接近,构成 特定的空间构象,起催化中心作用。在结合酶中辅酶 和辅基也参与活性中心的组成。
微生物酶分类

1 微生物酶的分类、作用机理及来源1.1淀粉酶。
淀粉酶是能够分解淀粉糖苷键的一类酶的总称,包括α-淀粉酶、β-淀粉酶、糖化酶和异淀粉酶。
α-淀粉酶又称淀粉1,4-糊精酶,能够切开淀粉链内部的α-1,4-糖苷键,将淀粉水解为麦芽糖、含有6个葡萄糖单位的寡糖和带有支链的寡糖。
生产此酶的微生物主要有枯草杆菌、黑曲霉、米曲霉和根霉。
β-淀粉酶又称淀粉1,4-麦芽糖苷酶,能够从淀粉分子非还原性末端切开1,4-糖苷键,生成麦芽糖。
此酶作用于淀粉的产物是麦芽糖与极限糊精。
此酶主要由曲霉、根霉和内孢霉产生。
糖化酶又称淀粉α-1,4-葡萄糖苷酶,此酶作用于淀粉分子的非还原性末端,以葡萄糖为单位,依次作用于淀粉分子中的α-1,4-糖苷键,生成葡萄糖。
此酶作用于支链淀粉后的产物有葡萄糖和带有α-1,6-糖苷键的寡糖;作用于直链淀粉后的产物几乎全部是葡萄糖。
此酶产生菌主要是黑曲霉(左美曲霉、泡盛曲霉)、根霉(雪白根酶、德氏根霉)、拟内孢霉、红曲霉。
异淀粉酶又称淀粉α-1,6-葡萄糖苷酶、分枝酶,此酶作用于枝链淀粉分子分枝点处的α-1,6-糖苷键,将枝链淀粉的整个侧链切下变成直链淀粉。
此酶产生菌主要是嫌气杆菌、芽孢杆菌及某些假单孢杆菌等细菌。
1.2蛋白酶。
蛋白酶系催化分解蛋白质肽键的一群酶的总称,它作用于蛋白质,将其分解为蛋白胨、多肽及游离氨基酸。
此酶种类繁多,广泛存在于所有生物体内,按其来源可分为植物蛋白酶、动物蛋白酶、微生物蛋白酶(又可分为细菌蛋白酶、放线菌蛋白酶、霉菌蛋白酶等);按其作用形式可分为肽链内切酶、肽链外切酶;按所产蛋白酶性能分为酸性蛋白酶、霉菌蛋白酶酶、中性蛋白酶、碱性蛋白酶。
酸性蛋白酶(最适pH=2~5)产生菌主要是黑曲霉、米曲霉、根霉、微小毛霉、似青霉、青霉、血红色螺孔菌等的某些种;中性蛋白酶(最适pH=7~8)产生菌主要是枯草杆菌、巨大芽孢杆菌、腊状芽孢杆菌、米曲霉、栖土曲霉、灰色链霉菌、微白色链霉菌、耐热性解蛋白质杆菌等;碱性蛋白酶(最适pH=9~11)主要产生菌为枯草杆菌、腊状芽孢杆菌、米曲霉、栖土曲霉、灰色链霉菌、镰刀菌等。
1-4酶分类和命名.

例如, 谷丙转氨酶催化的氨基转移反应。
CH3CHCOOH HOOCCH2CH2CCOOH
NH2
O
CH3CCOOH HOOCCH2CH2CHCOOH
O
NH2
水解酶
水解酶催化底物的加水分解反应。 AB+H2O=AOH+BH 系统名:底物名称+水解作用的化学键位置+水解酶 推荐名: 底物名称+酶 主要包括淀粉酶、蛋白酶、核酸酶及脂酶等。 例如,脂肪酶(Lipase)催化的脂的水解反应:
天冬氨酸合成酶
L-天冬氨酸+氨+ ATP = L-天门冬酰胺+ AMP + PPi
二、核酸类酶的分类与命名
(一)对R酶的分类原则
① 根据酶作用的底物是其本身RNA还是其他分子, 分为内催化R酶和分子间R酶;
② 每一大类中,根据酶的催化类型不同,又分为若 干亚类,如剪切酶、剪接酶和多功能酶。
③ 在每个亚类中,根据酶的结构特点和催化特性不 同,分为若干小类;
异构酶
催化分子内部基团或构相的转化的酶,即底物分子 内基团或原子的重排过程。A=B
按异构化类型不同,可分为6个亚类:异构酶、消 旋酶、变位酶、表异构酶、顺反异构酶等。
命名:底物名称后面加上具体异构酶型。
例如,6-磷酸葡萄糖异构酶催化的反应。
CH2OH O OH
OH OH
OH
CH2OH
CH2OHO OHFra bibliotek 分子间催化的R酶
是催化其他分子进行反应的核酸类酶 根据作用的底物分子的不同,可分为若干亚类: 1)作用于其他RNA分子的R酶;
RNA剪切酶(能催化其他RNA进行剪切反应) 多功能 R 酶(能催化其他RNA进行多种反应) 2)作用于DNA的R酶; 3)作用于多糖的R酶; 4)作用于氨基酸酯的R酶。
酶工程4-1--3 酶的提取与分离提纯 酶的提取与分离提纯

用于提取在稀碱溶液中溶解度大 且稳定性较好的酶
用于提取那些与脂质结合牢固或 含有较多非极性基团的酶
有机溶剂提取 可与水混溶的有机溶剂
主要影响因素
扩散的影响:
酶分子的扩散速度与温度、溶液黏度、扩散面积、扩散距离以及两相 界面的浓度差有密切关系。提高温度、降低溶液黏度、增加扩散面积、缩 短扩散距离, 增大浓度差等都有利于提高酶分子扩散速度, 从而增大提取效 果。 含酶原料的颗粒体积越小,则扩散面积越大,有利于提高扩散速度;适当的搅 拌可以使提取液中的酶分子迅速离开原料颗粒表面,从而增大两相界面的浓 度差,有利于提高扩散速率;适当延长提取时间,可以使更多的酶溶解出来,直 至达到平衡。
2. 酸溶液提取
3. 碱溶液提取 4. 有机溶剂提取
表4-2 酶的主要提取方法
提取方法 盐溶液提取 使用的溶剂或溶液 0.02~0.5mol/L的盐溶液 提取对象 用于提取在低浓度盐溶液中溶解 度较大的酶 用于提取在稀酸溶液中溶解度大, 且稳定性较好的酶
酸溶液提取
碱溶液提取
pH值为2~6的水溶液
pH值为8~12的水溶液
指溶液中加入的饱和硫酸铵的体积与混合溶液总体积之比值。
饱和度=
溶液中饱和硫酸铵的体积
溶液的总体积
3) 调整盐浓度的方式
a.
饱和溶液法(添加饱和硫酸铵溶液)
适用于:蛋白质溶液体积不太大,而达到的盐浓度又 不太高时。
配制饱和硫酸铵溶液
在水中加入过量的固体硫酸铵, 加热至50~60℃, 保 温数分钟 , 趁热滤去过量未溶解的硫酸铵 , 滤液在0℃ 或 25℃平衡1~2 天, 有固体析出, 此溶液即为饱和硫酸铵溶 液, 其饱和度为1。
利用酶与其他杂质在有机溶剂中的溶解度不同, 通过添加 一定量的某种有机溶剂, 使酶或杂质沉淀析出, 从而使酶 与杂质分离 在酶液中加入某些物质, 使它与酶形成复合物而沉淀下来, 从而使酶与杂质分离
二氢黄酮醇还原酶基因概述

8 DFR 基因的转录调控
迄今发现的花青素合成调节因子主要包括 Myb 转录因子,Myc 家族的 bHLH 转录因子和 WD40 蛋白。其中 Myb 转录因子含有保 守的 DNA 结合结构域, 每个 Myb 结构域约含 51~52 个氨基酸 残基,包含一系列高度保守的残基和间隔序列,并含有特异的 DNA 序列识别区和启动子结合区。如玉米的 C1 P1 和 P基因; bHLH 家族蛋白都有一个螺旋-环-螺旋结构区域和 4 个保守功 能区域 bHLH 转录因子可以结合到特异的 DNA 序列上。某些 bHLH 转录因子在花青素途径调控中需要与 Myb 类转录因子共同 作用,如金鱼草 Delila 基因。WD40 重复蛋白是一种螺旋蛋白, 核心区域由 40 个氨基酸残基组成,可以促进蛋白与蛋白之间的 相互作用。它发挥作用时必须与 Myb 转录因子,bHLH 转录因子 形成蛋白复合体,如拟南芥的 TTG1 编码WD40 蛋白基因。
7 DFR 结构基因的启动子
植物基因启动子是重要的顺式作用元件 ,位于结构基因 5'端上游 区,指导全酶与模板的正确结合。活化 RNA 聚合酶,决定转录的方向 和效率,直接影响基因的表达。
六倍体小麦有 3 种 DFR 基因 TaDFR-A TaDFR-B TaDFR-C 分别 位于染色体 3A,3B 和 3D上,都有 3 个内含子。在 3 种DFR 基因启 动子序列中存在 Myb 类转录因子P的结合位点,它和 G-box 的核心元 件共同调控 DFR 基因的表达,这一结构可能调控小麦 DFR 基因的组织 特异性表达,在 TaDFR-B 中有 3 个这种元件。而 TaDFR-A 和TaDFR -C 只有2个,因此 TaDFR-B 的表达量要比其他2种 DFR 基因在小麦 的子叶 根和种皮等器官中的表达量高。
4-1(3) 酶、生命的直接能源物质
第4章生命的物质变化和能量转换
第1节生物体内的化学反应
第三课时酶、生命活动的直接能源物质——ATP
一、设计意图
本节课在之前学习的基础上对酶的特性进行归纳总结,并介绍了A TP分子的结构特点及其与ADP相互转变的特性,A TP在细胞生命活动中的作用等内容,为光合作用、呼吸作用等内容的学习打下良好的基础,具有承前启后的作用。
这些内容对于学生而言比较抽象。
在教学中课充分运用教材插图的图解,帮助学生感性理解A TP的结构,及其与ADP之间的相互转化,将抽象知识具体感性化。
引导学生通过对图片及其箭头的提示,了解一些生物体内的物质变化过程。
二、教学目标
知识与技能
理解A TP是生物题各种生命活动的直接能源物质。
过程与方法
归纳酶的作用特点以及应用价值。
情感、态度和价值观
关注酶在生产和生活中的应用实例,认识生命科学的价值,激发学科学的热情。
三、重点和难点
重点:
酶的作用和特性、A TP的化学组成特点及在能量代谢中作用
难点:
A TP与ADP的相互转变与生物供能之间的关系。
四、教学准备
制作PP课件
(久隆徐群翊)。
生物化学第四章酶

⽣物化学第四章酶第四章酶酶是⼀类具有⾼效率、⾼度专⼀性、活性可调节的⾼分⼦⽣物催化剂。
1957巴斯德提出酒精发酵是酵母细胞活动的结果。
1 分⼦Glc→2分⼦⼄醇+2分⼦CO2 从Glc开始,经过12种酶催化,12步反应,⽣成⼄醇。
1897 Buchner兄弟证明发酵与细胞的活动⽆关,不含细胞的酵母汁也能进⾏⼄醇发酵。
1913 Michaelis和Menten提出⽶⽒学说—酶促动⼒学原理。
1926 Sumner⾸次从⼑⾖中提出脲酶结晶,并证明具有蛋⽩质性质。
1969 化学合成核糖核酸酶。
1967-1970 从E.coli中发现第I、第II类限制性核酸内切酶。
1986 Cech发现四膜⾍细胞⼤核期间26S rRNA前体具有⾃我剪接功能。
ribozyme ,deoxyribozymeE.coRI5’——GAA TTC——3’3’——CTTAAG——5’限制作⽤修饰作⽤5’——GAATTC——3’5’——GAATTC——3’3’——CTTAAG——5’ 3’——CTTAAG——5’第⼀节酶学概论⼀、酶的⽣物学意义⼤肠杆菌⽣命周期20分钟,⽣物体内化学反应变得容易和迅速进⾏的根本原因是体内普通存在⽣物催化剂—酶。
没有酶,⽣长、发育、运动等等⽣命活动就⽆法继续。
限制性核酸内切酶(限制-修饰)⼆、酶的概念及其作⽤特点1、酶是⼀种⽣物催化剂酶是⼀类具有⾼效率、⾼度专⼀性、活性可调节的⾼分⼦⽣物催化剂。
⽣物催化剂:酶(enzyme),核(糖)酶(ribozyme),脱氧核(糖)酶(deoxyribozyme)2、酶催化反应的特点(1)、催化效率⾼酶催化反应速度是相应的⽆催化反应的108-1020倍,并且⾄少⾼出⾮酶催化反应速度⼏个数量级。
(2)、专⼀性⾼酶对反应的底物和产物都有极⾼的专⼀性,⼏乎没有副反应发⽣。
(3)、反应条件温和(4)、活性可调节根据据⽣物体的需要,许多酶的活性可受多种调节机制的灵活调节,包括:别构调节、酶的共价修饰、酶的合成、活化与降解等。
5种酶测定方法

丙二醛含量(MDA)原理丙二醛(MDA是由于植物官衰老或在逆境条件下受伤害,其组织或器官膜脂质发生过氧化反应而产生的。
它的含量与植物衰老及逆境伤害有密切关系。
测定植物体内丙二醛含量,通常利用硫代巴比妥酸(TBA)在酸性条件下加热与组织中的丙二醛产生显色反应,生成红棕色的三甲川(3、5、5—三甲基恶唑2、4 —二酮),三甲川最大的吸收波长在532nm但是测定植物组织中MDA时受多种物质的干扰,其中最主要的是可溶性糖,糖与硫代巴比妥酸显色反应产物的最大吸收波长在450nm处,在532nm处也有吸收。
植物遭受干旱、高温、低温等逆境胁迫时可溶性糖增加,因此测定植物组织中丙二醛与硫代巴比妥酸反应产物含量时一定要排除可溶性糖的干扰。
此外在532nm波长处尚有非特异的背景吸收的影响也要加以排除。
低浓度的铁离子能显著增加硫代巴比妥酸与蔗糖或丙二醛显色反应物在532、450nm处的吸光度值,所以在蔗糖、丙二醛与硫代巴比妥酸显色反应中需要有一定的铁离子,通常植物组织中铁离子的含量为100 —300卩g • g —1Dw根据植物样品量和提取液的体积,加入Fe3+的终浓度为0.5nmol • L—1。
在532nm 600nm和450nm波长处测定吸光度值,即可计算出丙二醛含量。
三、材料、仪器设备及试1. 材料:植物叶片。
2. 仪器设备:离心机,分光光度计;电子分析天平;恒温水浴;研钵;试管;移液管(1ml、5ml)、试管架;移液管架;洗耳球;剪刀。
3. 试剂:10%三氯乙酸:50gTCA用水定容至500ml0.6 %硫代巴比妥酸(TBA)溶液:0.6gTBA溶于100ml水中(加少量1mol/L NaOH溶解)采用赵世杰(1994)方法,略有改动。
称取新鲜材料0.2 g,加入8 ml 10%TCA(三氯乙酸)溶液(分三次加入,注意冲洗研钵),在预冷研钵上充分研磨,4000 rpm离心10 min。
取上清液2 ml(对照加2 ml蒸馏水),加入2 ml 0.6%TBA硫代巴比妥酸)(用10%勺TCA溶液配制)溶液,加塞,摇匀。
酶的结构与功能
3. 同工酶
一. 酶的结构
同工酶的作用: 对于适应不同的组织、器官的不同生理需要非常 重要;是代谢调节的一种重要方式。
同工酶物理性质差异: 1. Aa组成和顺序不同 2. 催化特性不同 3. 电泳行为不同 4. 组织、器官中分布不同 5. 生理功能不同
2. 变构酶
变构酶的特点:
二. 酶的结构与功能
已知的变构酶都是寡聚酶。
变构酶分子上除了活性中心外,还有调节中 心。这两个中心处在酶蛋白的不同部位,有 的在不同的亚基上,有的在同一亚基上。
变构酶的 v-[S] 的关系不符合米氏方程,所 以其曲线不是双曲线型。
2. 变构酶
Vmax 100%
二. 酶的结构与功能
这些基团在一级结构上可能相距很远,甚至可 能不在一条肽链上,但在蛋白质空间结构上彼 此靠近,形成具有一定空间结构的区域。
对于结合酶,辅因子常常是活性中心的组成部分。
1. 酶的活性中心
二. 酶的结构与功能
1. 酶的活性中心
二. 酶的结构与功能
The structure of a glycogen phosphorylase monomer
5. 酶的活性部位并不是和底物的几何图形正好吻 合,而是在酶与底物结合的过程中,底物分子或 酶分子或它们两者的构象同时发生一定变化后才 相互契合,这时催化基团的位置也正好处于所催 化底物的敏感化学键部位。
1. 酶的活性中心 (2)有关酶活性中心的几个术语
二. 酶的结构与功能
结合部位:底物在此与酶分子结合。一个酶的结 合部位又可以分为各种亚位点,分别与底物的不 同部位结合。
1. 活性中心在酶分子总体积中只占相当小的部分 (约1%2%),相当于23个氨基酸残基。
4-α-糖基转移酶

4-α-糖基转移酶
4-α-糖基转移酶(4-alpha-glucanotransferase)是一种酶,属于糖基转移酶家族,可以催化淀粉内糖基的转移反应。
4-α-糖基转移酶的主要特征和功能包括:1. 可以催化淀粉分子内糖基的转移,使淀粉发生重组。
2. 在淀粉加工中,4-α-糖基转移酶可以裂解淀粉分子,降低淀粉的黏度。
3. 在大米加工中,4-α-糖基转移酶可以改变淀粉结构,增强米饭的弹性。
4. 4-α-糖基转移酶可以合成抗性淀粉,这种淀粉不易被消化吸收,具有益生元的功能。
5. 通过基因工程,可以生产转基因杂交4-α-糖基转移酶,提高酶的产量和稳定性。
6. 4-α-糖基转移酶广泛应用于食品工业,在淀粉糖的提取、修改和加工过程中发挥重要作用。
综上,4-α-糖基转移酶通过催化淀粉内部糖基的转移,可以改变淀粉的性质,在食品加工中有重要应用价值。
4-1酶的特异性

实验四 影响酶活性的因素
一、实验目的
观察淀粉在水解过程中遇碘后溶液颜色的变 化。观察不同底物、温度、pH、激活剂与抑 制剂对唾液淀粉酶活性的影响。
二、原理 影响酶活性的因素包括:底物类型、酶浓度、底物
2
2
沸水浴煮沸2~3min
记录观察结果
2. 淀粉酶的专一性实验
取2只试管,按下表操作。
试管编号 试剂处理稀释的唾液/mL1211
0.3%NaCl的 0.5%淀粉溶液/mL
3
-
2% 蔗糖溶液/mL
—
3
摇匀,置37℃水浴保温10min
Benedict试剂/mL
2
2
沸水浴煮沸2~3min
记录观察结果
五、注意事项
根据反应时间调整酶的稀释倍数。
实验四-1 酶的特异性
一、实验目的
了解酶的特异性并掌握检查酶的特异性的方法和原 理。
二、原理
酶的特异性是指一种酶只能对一种或一类化合物 (此类化合物通常具有相同的化学键)起作用,而 不能对别的化合物起作用。如淀粉酶只能催化淀粉 水解,对蔗糖的水解无催化作用。
本实验以唾液淀粉酶(含淀粉酶和少量麦芽糖 酶)对淀粉的作用为例,说明酶的特异性。淀粉和 蔗糖都没有还原性,但淀粉水解产物为葡萄糖,蔗 糖水解产物为果糖和葡萄糖,均为还原性糖,能与 Benedict试剂反应,生成砖红色的氧化亚铜沉淀。
浓度、产物浓度、抑制剂、激活剂、pH值、温度等
淀粉在淀粉酶的作用下被降解成单糖,这种降解过 程是逐步进行的,降解的中间产物遇碘曾现不同的 颜色:
酶的EC编号

酶的EC编号EC1:氧化还原酶EC2:转移酶EC3:水解酶EC4:裂合酶EC5:异构酶EC6:连接酶EC1:氧化还原酶EC1.1:作用在给体的CH-OH上EC1.1.1:以NAD+或NADP+为受体EC1.1.1.1:醇脱氢酶EC1.2:作用在给体的醛基或氧桥上EC1.2.1:以NAD+或NADP+为受体EC1.2.1.1:(已删除,以EC1.1.1.284和EC4.4.1.22 代替)EC1.3:作用在给体的CH-CH上EC1.3.1:以NAD+或NADP+为受体EC1.3.1.1:二氢尿嘧啶脱氢酶(NAD+)EC1.4:作用在给体的CH-NH2上EC1.4.1:以NAD+或NADP+为受体EC1.4.1.1:丙氨酸脱氢酶EC1.5:作用在给体的CH-NH上EC1.5.1:以NAD+或NADP+为受体EC1.5.1.1:吡咯啉-2-羧酸还原酶EC1.6:作用在NADH或NADPH上EC1.6.1:以NAD+或NADP+为受体EC1.6.1.1:NAD(P)+转氢酶(B)EC1.6.1.2:NAD(P)+转氢酶(AB)EC1.7:以其他含氮化合物为给体EC1.7.1:以NAD+或NADP+为受体EC1.7.1.1:硝酸还原酶(NADH+)EC1.8:作用在给体的硫族上EC1.8.1:以NAD+或NADP+为受体EC1.8.1.1:半胱胺脱氢酶(已删除。
)EC1.9:作用在给体的血红素上EC1.9.3:以氧为受体EC1.9.3.1:细胞色素C氧化酶EC1.10:以联苯酚及其相关化合物为给体EC1.10.1:以NAD+或NADP+为受体EC1.10.1.1:顺-苊-1,2-二醇脱氢酶EC1.11:以过氧化物为给体EC1.11.1:过氧化物酶类EC1.11.1.1:NADH过氧化物酶§NADH peroxidase EC1.12:以氢为给体EC1.12.1:以NAD+或NADP+为受体EC1.12.1.1:氢化酶(已转移至EC1.18.99.1)EC1.13:加氧酶EC1.13.11:加双氧酶EC1.13.11.1:儿茶酚-1,2-加双氧酶EC1.14:EC1.14.11:EC1.14.11.1:γ-丁基甜菜碱加双氧酶EC1.14.13:EC1.14.13.39:一氧化氮合酶EC1.15:以超氧化物为给体EC1.15.1:EC1.15.1.1:超氧化物歧化酶EC1.15.1.2:超氧化物还原酶EC1.16:氧化金属离子EC1.16.1:以NAD+或NADP+为受体EC1.16.1.1:汞(II)还原酶EC1.17:作用在给体的CH-CH2上EC1.17.1:以NAD+或NADP+为受体EC1.17.1.1:CDP-4-氢-6-脱氧葡萄糖还原酶EC1.18:以铁-硫蛋白为给体EC1.18.1:以NAD+或NADP+为受体EC1.18.1.1:红氧还蛋白—NAD+还原酶EC1.19:以黄素氧还蛋白为给体EC1.19.6:以氮分子为受体EC1.19.6.1:固氮酶(黄素氧还蛋白)EC1.20:作用于给体的磷或砷上EC1.20.1:以NAD+或NADP+为受体EC1.20.1.1:膦酸脱氢酶EC1.21:作用在X-H和Y-H上形成X-YEC1.21.3:以氧为受体EC1.21.3.1:异青霉素-N合酶EC1.97:其他氧化还原酶EC1.97.1:EC1.97.1.1:氯酸还原酶EC2:转移酶EC2.1:转移一个碳EC2.1.1:甲基转移酶EC2.1.1.1:烟酰胺-N-甲基转移酶EC2.1.1.2:胍乙酸-N-甲基转移酶EC2.1.1.3:噻亭—高半胱氨酸-S-甲基转移酶EC2.1.1.4:乙酰血清素-O-甲基转移酶EC2.1.1.5:甜菜碱—高半胱氨酸-S-甲基转移酶EC2.1.1.6:邻苯二酚-O-甲基转移酶EC2.1.1.7:烟酸-N-甲基转移酶EC2.1.1.8:组胺-N-甲基转移酶EC2.1.1.9:硫醇-S-甲基转移酶EC2.1.1.10:高半胱氨酸-S-甲基转移酶EC2.1.1.11:镁原卟啉IX甲基转移酶EC2.1.1.12:甲硫氨酸-S-甲基转移酶EC2.1.1.13:甲硫氨酸合酶EC2.1.1.14:5-甲基四氢蝶酰三谷氨酸—高半胱氨酸-S-甲基转移酶EC2.1.1.15:脂肪酸-O-甲基转移酶EC2.1.1.16:亚甲基-脂肪酰基磷脂合酶EC2.1.1.17:磷脂酰乙醇胺-N-甲基转移酶EC2.1.1.18:多糖-O-甲基转移酶EC2.1.1.19:三甲基锍—四氢叶酸-N-甲基转移酶EC2.1.1.20:甘氨酸-N-甲基转移酶EC2.2:转移醛基或酮基EC2.3:酰基转移酶EC2.4:糖基转移酶EC2.5:转移除了甲基的烷基和芳基EC2.6:转移含氮基团EC2.7:转移含磷基团EC2.8:转移含硫基团EC2.9:转移含硒基团EC3:水解酶EC3.1:作用在酯键上EC3.1.1:羧酸酯水解酶EC3.1.1.1:羧酸酯酶EC3.1.1.2:芳基酯酶EC3.1.1.3:三酰甘油脂肪酶EC3.1.1.4:磷脂酶A2EC3.1.1.5:溶血磷脂酶EC3.1.1.6:乙酰酯酶EC3.1.1.7:乙酰胆碱酯酶EC3.1.1.8:胆碱酯酶EC3.1.1.9:苯甲酰胆碱酯酶(已删除。
淀粉代谢关键酶

淀粉代谢关键酶与淀粉水解有关的主要酶系(1)a—淀粉酶也称液化型淀粉酶、糊精化酶、淀粉一1,4一糊精酶其作用是将淀粉迅速水解为糊精及少量糖,失掉原来的黏稠度。
酿造食醋使用的a—淀粉酶主要来源于枯草杆菌及曲霉菌、根霉菌中。
一般新工艺制醋时,都使用细菌a—淀粉酶制剂。
(2)(3淀粉酶又称淀粉,1,4一麦芽糖苷酶。
由于过去对淀粉酶作用认识不全面,将能糖化淀粉的酶统称为卩淀粉酶。
因此现在除液化型淀粉酶外,对其他淀粉酶仍有着统称作卩淀粉酶的习惯。
卩淀粉酶存在于小麦麸皮或甘薯中。
近年来发现某些微生物也能分泌卩淀粉酶。
(3)葡萄糖淀粉酶也称糖化型淀粉酶、外切淀粉酶。
葡萄糖淀粉酶水解淀粉时是从非还原性末端起,一个一个顺序切开a一1,4糖苷键而生成葡萄糖,它也能切割支链淀粉的1,6糖苷链,但速度相当慢。
糖化酶是一种极为重要的淀粉糖化剂,大量存在于黑曲霉中。
麦芽糖酶也是属于糖化型淀粉酶的一种,它能将麦芽糖水解成2个葡萄糖。
高等植物的种子发芽及能发酵麦芽糖的酵母都含有此酶。
霉菌中根霉及部分黑曲霉虽然可能不含有此酶,但对麦芽糖有很强的分解能力,这主要是糖化型淀粉酶的作用结果。
酵母菌不能直接利用麦芽糖,必须分泌麦芽糖酶将麦芽糖分解成葡萄糖后才能利用,乙醇酵母是产麦芽糖酶最多的酵母,所以发酵麦芽糖能力强,在发酵过程中如何迅速地将麦芽糖变成葡萄糖,是提高发酵率的重要手段。
(4)转移葡萄糖苷酶主要存在于黑曲霉系中。
(5)异淀粉酶也称脱支酶。
异淀粉酶内切支链淀粉的ot—1,6葡萄糖苷键,产物为直链淀粉。
此外,曲霉菌还含有丰富的果胶酶、纤维素酶、单宁酶、酸性蛋白酶等,这些酶对植物原料的细胞组织有一定分解作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
共价催化作用
主要通过一个底物或底物的一部分与酶形成 共价键,催化基团的转移反应。 共价键,催化基团的转移反应。 A-X+E== +X-E + == ==A+ X-E+B== + == ==B-X+E +
底物靠近和定向效应
靠近:底物(也包括辅助因子) 靠近:底物(也包括辅助因子)的敏感键 逐渐靠近活性部位的催化基团, 逐渐靠近活性部位的催化基团,为的是定 向于催化基团以便容易形成过渡态。 向于催化基团以便容易形成过渡态。 定向: 定向:活性部位还将底物定向以便使底物 相对于催化基团处于最好的取向 取向( 相对于催化基团处于最好的取向(orbital steering),增强酶催化作用。 ) 增强酶催化作用。
5. 酶的组成
• 单纯酶 酶蛋白 • 结合酶 辅因子 (cofacter) 辅酶( 辅酶(coenzyme) ) 辅基( 辅基(prosthetic group) ) 金属离子
全酶(holoenzyme) 全酶(holoenzyme)= 酶蛋白 + 辅因子 (holoenzyme
酶的辅因子
定义:酶的对热稳定的非蛋白小分子物质 非蛋白小分子物质或 定义:酶的对热稳定的非蛋白小分子物质或金属离子 根据辅因子与酶蛋白结合的松紧程度,可分: 根据辅因子与酶蛋白结合的松紧程度,可分: 辅因子与酶蛋白结合的松紧程度 辅酶( 辅酶(Coenzyme) ) NAD+(CoⅠ)、NADP+(CoⅡ)、TPP、CoA、FH4 Ⅰ、 Ⅱ、 、 、 辅基( 辅基(Prosthetic group) ) FMN、FAD、铁卟啉、生物素 、 、铁卟啉、
二、影响酶促反应速度的因素
酶浓度 底物浓度 pH值 pH值 温度 激活剂 抑制剂
1. 酶浓度的影响
如果: 如果: ①底物浓度足够大 ②反应体系中不含其它 抑制剂或激活剂 那么: 那么: ν=k[E] = (ν∝[E]) ∝
主要包括淀粉酶、蛋白酶、核酸酶及脂酶等 主要包括淀粉酶、蛋白酶、核酸酶及脂酶等 淀粉酶 例如,脂肪酶(Lipase)催化的脂的水解反应 例如,脂肪酶 催化的脂的水解反应
R C O O C H 2C H 3 H 2O RC O O H C H 3C H 2O H
4.裂解酶 4.裂解酶 Lyase
主要包括醛缩酶、水化酶及脱氨酶等 主要包括醛缩酶、水化酶及脱氨酶等。 醛缩酶 延胡索酸水合酶催化的反应。 延胡索酸水合酶催化的反应。
+
CH3CCOOH NADH O
H
+
2.转移酶 2.转移酶 Transferase
谷丙转氨酶催化的氨基转移反应。 谷丙转氨酶催化的氨基转移反应。
CH3CHCOOH HOOCCH2CH2CCOOH NH2 CH3CCOOH O O HOOCCH2CH2CHCOOH NH2
3.水解酶 3.水解酶 Hydrolase
在每一大类酶中,又可根据不同的原则, 在每一大类酶中,又可根据不同的原则,分 为几个亚类 每个亚类再分为几个亚亚类 亚亚类。 为几个亚类 ,每个亚类再分为几个亚亚类。然后 再把原于这一亚亚类的酶按顺序排好
§4-2 酶的结构与功能
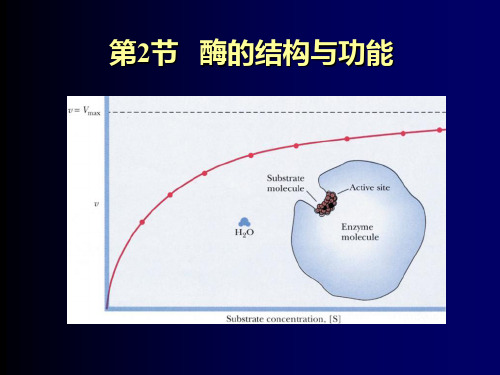
一、酶的活性中心(Active center) 酶的活性中心( )
概念:酶分子中直接和底物结合,并与催化 概念:酶分子中直接和底物结合,并与催化 中直接和底物结合 作用直接有关的基团 的基团, 作用直接有关的基团,构象比较集中且构成 特定空间的区域。 特定空间的区域。
底物张力与变形
§4-4 酶促反应动力学
酶促反应动力学是研究酶促反应速度, 酶促反应动力学是研究酶促反应速度, 反应速度 以及影响酶促反应速度的各种因素 影响酶促反应速度的各种因素。 以及影响酶促反应速度的各种因素。
底物:Substrate,S 底物: , 产物: 产物:Product,P , 酶:Enzyme,E , 抑制剂: 抑制剂:Inhibitor,I , 激活剂: 激活剂:Activitor,A ,
酶的高效性) 二、中间复合物学说 (酶的高效性 酶的高效性
设一反应: ←→ ←→P 设一反应: S←→ E+S←→[ES]←→ ←→[ ]←→E+P ←→
(1) (2)
中间复合物学说的证据: 中间复合物学说的证据:光谱法
过氧化物酶和其底物过氧化氢 H2O2 + AH2 → A + 2H2O
过氧化物酶 645,583,548,498nm
活性部位的特征
存在于酶分子的表面,呈裂缝状,占每个酶分子 存在于酶分子的表面, 裂缝状, 表面 体积的很小一部分 是一个错综复杂的三维结构 空间区域) 三维结构( 是一个错综复杂的三维结构(空间区域) 决定了酶的专一性和催化反应的性质 专一性和催化反应的 决定了酶的专一性和催化反应的性质 构象因底物的诱导可改变
如胃蛋白酶(pepsin),唾液淀粉酶(salivary amylase) ,唾液淀粉酶 如胃蛋白酶
国际系统命名法
底物名称:底物名称:底物名称 底物名称:底物名称:底物名称……+反应性质 + 如果底物之一为水时,可以略去不写)。 +“酶”(如果底物之一为水时,可以略去不写)。 例如:谷丙转氨酶(习惯名称) 例如:谷丙转氨酶(习惯名称) 反应: 反应:
2.酶的命名 2.酶的命名
习惯命名法: 898年 在底物上加ase 习惯命名法:1898年Dudaux在底物上加 在底物上加
根据底物:淀粉酶(amylase),蛋白酶 根据底物:淀粉酶 底物 ,蛋白酶(proteinase) 根据催化的反应性质:如脱氢酶(dehydrogenase) 根据催化的反应性质:如脱氢酶 催化的反应性质 底物+反应性质 底物 反应性质 如乳酸脱氢酶(lactate ~) ,苹果酸脱氢酶 苹果酸脱氢酶(malic ~) 如乳酸脱氢酶 以酶的来源或酶的其它特征
必需基团:酶分子中,与酶的活性密切相关的基团 必需基团:酶分子中,
酶活性中心有两个功能部位: 酶活性中心有两个功能部位: 结合部位:决定酶的专一性 结合部位:决定酶的专一性 催化部位:决定酶催化反应的性质 催化部位:决定酶催化反应的性质
构成酶活性中心的Βιβλιοθήκη 团: 的咪唑基 的咪唑基、 的 构成酶活性中心的基团:His的咪唑基、Ser的OH、Cys的-SH、Glu的γ-COOH 的 、 的 、
酶的专一性) 三、诱导契合学说(酶的专一性 诱导契合学说 酶的专一性
☀
在诱导契合学说中, 在诱导契合学说中,诱 导是双向的, 导是双向的,但主要是 底物对酶的诱导。 底物对酶的诱导。
四、使酶具有高效催化效率的因素
酸碱催化 共价催化 底物靠近和定向效应 底物张力与变形
酸碱催化
广义的酸碱催化 在酸碱催化中, 在酸碱催化中,一个反应的加速是通过催化 一个质子转移完成的 对酶来说 酶大都是蛋白质, 酶大都是蛋白质,活性部位的氨基酸可以 提供一个相当于强酸或强碱溶液的生物环境
一、酶促反应速度的测定—测定初速度 酶促反应速度的测定 测定初速度 测定酶促反应速度方法
底物的消耗量; (1)单位时间内底物的消耗量; )单位时间内底物的消耗量 产物的生成量。 (2)单位时间内产物的生成量。 )单位时间内产物的生成量
以“ν”(Velocity)表示 ( ) 单位是:浓度/单位时间 单位时间( 秒等) 单位是:浓度 单位时间(分、秒等)
HOOCCH=CHCOOH H2O
HOOCCH2CHCOOH OH
5.异构酶 5.异构酶 Isomerase
6-磷酸葡萄糖异构酶催化的反应
CH2OH O OH OH OH OH OH OH CH2OH O CH2OH OH
6.合成酶 6.合成酶 Synthetase
也称作连接酶 A + B + ATP + H-O-H =A-B + ADP +Pi 例如, 例如,丙酮酸羧化酶催化的反应 丙酮酸 + CO2 → 草酰乙酸
相对专一性
立体异构专一性
4. 发展简史
(1)酶是蛋白质: (1)酶是蛋白质: 酶是蛋白质 1926年,Summer由刀豆制出脲酶结晶确立酶是 1926年,Summer由刀豆制出脲酶结晶确立酶是 蛋白质。 蛋白质。 (2)核酶的发现 核酶的发现: (2)核酶的发现: 1981~1982年 R.Cech实验发现有催 1981~1982年,Thomas R.Cech实验发现有催 化活性的天然RNA RNA—Ribozyme 化活性的天然RNA Ribozyme (3)抗体酶(abzyme): (3)抗体酶(abzyme): 抗体酶 1986年 Lerrur和 Schaltz运 1986年,Richard Lerrur和Peter Schaltz运 用单克隆抗体技术制备了具有酶活性的抗体。 用单克隆抗体技术制备了具有酶活性的抗体。
六大类酶的记忆诀窍: 氧转水, 六大类酶的记忆诀窍:O2 + H2 ←→ H2O 氧转水,裂亦合
1.氧化1.氧化-还原酶 Oxidoreductase 氧化
乳酸(Lactate)脱氢酶催化乳酸的脱氢反应。 脱氢酶催化乳酸的脱氢反应。 如,乳酸 脱氢酶催化乳酸的脱氢反应
CH3CHCOOH NAD OH
金属离子【Fe2+(3+)、Mn2+、Mg2+、Zn 2 +、
Cu+(2+)、K+、Na+、Co2+】
在酶催化中的作用 o 传递电子 o 在酶与底物之间起连接作用 o 维持酶分子的活性构象 o 中和阴离子
6.酶的分类 6.酶的分类
酶的六大类: 酶的六大类: 1. 氧化还原酶类( 氧化还原酶类(oxido-reductases) 2. 转移酶类( 转移酶类(transferases) 3. 水解酶类( 水解酶类(hydrolases) 4. 裂合酶类( 裂合酶类(lyases) 5. 异构酶类( 异构酶类(isomerases) 6. 合成酶类(ligases) 合成酶类(
