铁及其化合物练习2011.9.22
铁及其化合物练习题

铁及其化合物基础训练1. 下列离子组能在溶液中大量共存的是( )(A) Mg 2+ 、Fe 3+ 、SO 42- 、 I – (B) Fe 2+ 、 H + 、 Cl – 、 NO 3-(C) Na + 、 Fe 3+ 、 HCO 3- 、 Cl – (D) Mg 2+ 、Fe 3+ 、SO 42- 、C2. 某溶液中有NH Mg Fe Al 4223++++、、和四种离子, 若向其中加入过量的氢氧化钠溶液,微热并搅拌, 再加入过量盐酸; 溶液中大量减少的阳离子是A .NH 4+B .Mg 2+C .Fe 2+D .Al 3+3. 下列离子方程式中正确的是A .三氯化铁溶液中加入铁粉 Fe Fe 2Fe 32+++=B .氯化镁溶液中加入硝酸银溶液 Ag Cl AgCl +-+=↓C . 过量氯气通入溴化亚铁溶液中 2Fe 2Br 2Cl 2Fe Br 4Cl 2232+-+-++=++D .氢氧化铜溶于稀硫酸中()Cu OH 2H Cu 2H O 222+=+++ 4. 2FeCl Cu 2FeCl CuCl 322+=+, 判断: Fe Fe Cu 322+++、、氧化性强弱的顺序是A .Fe Fe Cu 322+++>>B .Fe Cu Fe 223+++>>C .Cu Fe Fe 223+++>>D .Fe Cu Fe 322+++>>5. 制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl 3+Cu =2FeCl 2+CuCl 2。
向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能...出现的是A. 烧杯中有铜无铁B. 烧杯中有铁无铜C. 烧杯中铁、铜都有D. 烧杯中铁、铜都无6、.下列各组的两种溶液中,分别加入足量氨水,观察到的现象相同的是A .FeCl 3 AlCl 3B .NaCl BaCl 2C .MgCl 2 CuCl 2D .FeCl 2 FeCl 37、. 四种黑色粉末CuO 、FeO 、MnO 2、C(石墨粉)只需加入一种试剂即可将它们区别开来, 这种试剂是A .NaOH 溶液B .稀H 2SO 4C .浓盐酸D .蒸馏水(2)能说明物质B的后一现象的化学方程式是__________________________910、在相同体积的KI、FeCl2、FeBr2的溶液里, 分别通入足量的氯气并且发生完全充分反应, 若它们耗用Cl2的质量相同, 则KI、FeCl2、FeBr2三种溶液的物质的量浓度比A.6∶3∶2 B.1∶3∶3 C.3∶3∶1 D.1∶2∶311、为除去MgCl2酸性溶液中的FeCl3,可以加入下列物质中的A. MgOB. 氨水C. Mg(OH)2D. 铁粉12、下列各组物质反应后,滴入KSCN溶液一定显红色的是A 、生了锈的铁块放入稀H2SO4中B、FeCl3、CuCl2的混合溶液中加入过量的铁粉C、FeO放入稀HNO3中D、Fe放入HNO3溶液中13143Fe(OH)3的质量可能是A.10.7克B.21.4克C.40克D.23.9能力提高1、只用一种试剂可区别()()Na SO MgCl FeCl Al SO NH SO、、、、五种溶液, 这种2422243424试剂是A.Ba(OH)2B.H2S C.NaOH D.AgNO32、下列图象是表示铁跟一定量硝酸反应时, 铁和硝酸铁之间物质的量(mol)的关系, 其中正确的是3.把a g铁铝合金粉末溶于足量盐酸中,加入过量NaOH溶液,过滤出沉淀,经洗涤、干燥、灼烧,得到红色粉末的质量仍为a gA.70% B.52.4% C.47.6% D.30%4.、根据图中的实验现象及转化关系判断A、B、C、D、E、F、G各是什么物质写出①、②反应的离子方程式;③④反应的化学方程式。
高中化学《铁及其化合物》练习题(含解析)

高中化学《铁及其化合物》练习题学校:___________姓名:___________班级:_________________一、单选题1.珊瑚是由无数珊瑚虫分泌出的石灰质长期积淀而形成的。
红珊瑚之所以是红色,最有可能的是含有 ( )A .NO 2B .Fe 3O 4C .Fe 2O 3D .Al 2O 32.下列关于物质用途的叙述中不正确的是( )A .Na 2O 2可用作呼吸面具中的供氧剂B .硅胶多孔,吸水能力强,可做食品干燥剂C .Al(OH) 3可作治疗胃酸过多的一种药剂D .四氧化三铁俗称铁红,可用于作油漆、红色涂料3.化学与生产、生活、环境密切相关,下列有关说法错误的是( )A .氧化铁可用于红色油漆和涂料B .明矾可用于自来水的杀菌消毒C .N95活性炭口罩可用于防霾,其原理是吸附原理D .氨气易液化,汽化时会吸收大量热,可做制冷剂4.下列试剂的保存方法错误..的是( ) A .实验室少量的钠保存在煤油中B .浓硝酸保存在无色细口玻璃瓶中C .存放FeSO 4溶液时加入少量铁粉D .NaOH 溶液保存在橡皮塞的试剂瓶中5.将m g 铁和氧化铁的混合物加入100mL 浓度为11mol L -⋅盐酸中,恰好完全反应,放出标准状况下的气体0.448L 。
滴加KSCN 溶液,溶液不变色。
则下列判断正确的是( )A .原混合物中()23Fe O :(Fe)3:1n n =B .无法计算原混合物的质量C .收集产生的气体刚好能与20.224L Cl 完全反应D .向溶液中通入20.025mol Cl ,可以将2Fe +完全转化为3Fe +6.1.12克铁粉加入25mL 2mol/L 的氯化铁溶液中,正确的是( )A .溶液中[Fe 2+]<[Fe 3+]B .溶液中[Fe 2+]>[Fe 3+]C .部分Fe 3+被氧化D .在反应后的溶液中加入KSCN 溶液,会出现血红色沉淀7.下列有关溶液组成的描述合理的是()+、Cl-、I-A.无色溶液中可能大量存在Fe3+、NH4-、Cl-B.酸性溶液中可能大量存在Na+、ClO-、SO24-C.弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3-、SCN-D.FeCl3溶液中可能大量存在Mg2+、Al3+、MnO48.N A代表阿伏加德罗常数的值。
(完整版)高中化学铁及其化合物专题练习

铁及其化合物一、选择题(本题包括10小题,每小题5分,共50分)1.下列反应,其产物的颜色按红色、红褐色、淡黄色、蓝色顺序排列的是()①金属钠在纯氧中燃烧②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间③FeCl3溶液中滴入KSCN溶液④无水硫酸铜放入医用酒精中A.②③①④B.③②①④C.③①②④D.①②③④2.已知下述三个实验中均有化学反应发生。
下列判断正确的是()A.实验①中铁钉只做还原剂B.实验②中Fe2+既显氧化性又显还原性C.实验③中发生的是置换反应D.上述实验证明氧化性:Fe3+>Fe2+〉Cu2+3.在含有FeCl3和BaCl2的酸性溶液中,通入足量的SO2后有白色沉淀生成,过滤后,向溶液中滴加KSCN 溶液,无明显现象,下列叙述不.正确的是()A.白色沉淀是BaSO4和BaSO3B.溶液的酸性增强C.白色沉淀是BaSO4D.FeCl3全部被还原为FeCl24.某溶液中有Fe3+、Mg2+、Fe2+和Al3+四种阳离子,若向其中加入过量的氢氧化钠溶液,搅拌后,再加入过量的盐酸,溶液中大量减少的阳离子是()A.Fe3+B.Mg2+C.Fe2+D.Al3+5.下列离子方程式书写正确的是()A.FeO固体放入稀硝酸溶液中:FeO+2H+===Fe2++H2OB.过量的铁粉与稀硝酸溶液反应:Fe+4H++NO错误!===Fe3++NO↑+2H2OC.向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+===Fe2++2H2OD.向Fe(OH)3中加入氢碘酸:2Fe(OH)3+6H++2I-===2Fe2++I2+6H2O6.某学生设计了如图所示的方法,鉴定盐A的组成成分。
由此分析,下列结论中正确的是( )A.A中一定有Fe3+B.C中一定有Fe3+C.B为AgI沉淀D.A一定为FeBr2溶液7.高铁酸钠(Na2FeO4)是一种新型、高效、多功能的水处理剂。
湿法制备的主要反应方程式为2Fe(OH)3+3ClO -+4OH-===2FeO2-,4+3Cl-+5H2O。
(完整word)铁及其化合物练习题(精)

铁及其化合物练习题【考题再现】1.下列有关纯铁的描述正确的是()A.熔点比生铁的低B.与相同浓度的盐酸反应生成氢气的速率比生铁的快C.在潮湿空气中比生铁容易被腐蚀 D.在冷的浓硫酸中可钝化2.已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。
下列反应在水溶液中不可能...发生的是A、3Cl2+6FeI2=2FeCL3+4FeI3 B、Cl2+FeI2=FeCl2+I2C、Co2O3+6HCl=2CoCl2+Cl2↑+3H2OD、2Fe3++2I-=2Fe2++I23。
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。
高铁电池的总反应为:3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述不正确...的是A、放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2B、充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2OC、放电时每转移3mol电子,正极有1mol K2FeO4被氧化D、放电时正极附近溶液的碱性增强4.硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。
实验室通过下列实验由废铁屑制备FeSO4·7H2O晶体:①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2~3遍;②向洗涤过的废铁屑加入过量的稀硫酸,控制温度50~80℃之间至铁屑耗尽;③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;④待结晶完毕后,滤出晶体,用少量冰水2~3次,再用滤纸将晶体吸干;⑤将制得的FeSO4·7H2O晶体放在一个小广囗瓶中,密闭保存。
请回答下列问题:(1)实验步骤①的目的是__________________,加热的作用是____________________。
铁及其化合物习题(有答案,有分析)

铁及其化合物习题(有答案,有分析)1.下列各组物质中,X是主体物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的一组是( )【答案】2.把一铁片插入下列溶液中,过一段时间取出,发现铁片的质量减小,且没有气体产生,此溶液是( ) A.FeSO4B.Fe2(SO4)3C.H2SO4D.CuSO4【解析】Fe与Fe3+发生反应,形成Fe2+进入溶液,故Fe片质量减轻且无气体放出,Fe与H2SO4反应放出H2,Fe与CuSO4溶液反应,会有Cu析出附着在Fe片上使之质量增重,Fe 与FeSO4溶液不发生化学反应,故A、C、D均不符合题意。
【答案】 B3.向一定量的FeO、Fe、Fe3O4的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,放出224 mL(标准状况)的气体,在所得溶液中加入KSCN溶液无血红色出现。
若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是( ) A.11.2 g B.5.6 gC.2.8 g D.无法计算【解析】依题意,恰好反应后溶液中只存在FeCl2,根据元素守恒法,可建立关系n(Fe)=n(Fe2+)=12n(Cl-)=12n(HCl)=12×0.1 L×1 mol/L=0.05 mol,m(Fe)=2.8 g。
【答案】 C4.在硫酸铁溶液中加入a g铜,完全溶解后,再加入b g铁,充分反应后得到c g残余固体,且a>c,则下列说法正确的是 ( ) A.残余固体全部是铜B.残余固体可能为铁和铜的混合物C.残余固体是铁,溶液中一定不含Cu2+D.最后得到的溶液中可能含Fe3+【解析】残留固体中一定含有Cu,由于a>c,说明溶液中一定含有Cu2+,故c g残余固体中不可能含Fe,溶液中也一定不含Fe3+。
【答案】 A5.将一定量的Fe和Fe2O3的混合物投入到250 mL 2 mol·L-1的硝酸溶液中,反应完全后,无固体剩余,生成1.12 L NO气体(标准状况),再向反应后的溶液中加入1 mol·L-1的NaOH 溶液,要使铁元素全部沉淀下来,所加NaOH溶液的体积最少为( ) A.450 mL B.500 mLC.400 mL D.无法确定【解析】要使铁元素全部沉淀下来,所加NaOH溶液的体积最小,很重要的一点就是加入NaOH溶液后,无论是生成Fe(OH)2还是Fe(OH)3沉淀,剩余溶液始终为NaNO3溶液,注意Na +与NO-3的量的比例关系为1∶1,也就是说NaOH的物质的量与NO-3的物质的量相等时,使铁元素全部沉淀下来,所加NaOH溶液的体积最小。
铁及其化合物练习题

铁及其化合物练习题一.正误判断(正确的打“√”,错误的打“×”)。
(1)铁具有导电、导热、延展性及被磁体吸引的特性( )(2)Fe 分别与氯气和盐酸反应所得氯化物相同( )(3)用铁制容器可以运输浓硝酸和浓硫酸( )(4)氧化铁能与酸反应,所以可用于制作红色染料( )(5)Fe 2O 3不可与水反应得到Fe(OH)3,所以不能通过化合反应制取Fe(OH)3( )(6)Fe 与稀HNO 3、稀H 2SO 4反应均有气泡产生,说明Fe 与两种酸均发生置换反应( )(7)Fe 在足量Cl 2中燃烧生成FeCl 3,在少量Cl 2中燃烧生成FeCl 2( )(8)根据Cl 2、S 与铁的反应可以判断氯元素和硫元素的非金属性强弱( )二.将下列物质的颜色和用途或性质用短线连接起来。
①Fe 2O 3 a .红褐色A .具有较强的还原性 ②Fe(OH)2 b .红棕色B .易被氧化成灰绿色最终变成红褐色 ③Fe(OH)3 c .白色C .红色油漆、涂料 ④Fe 2+ d .棕黄色D .受热分解成红棕色粉末⑤Fe 3+e .浅绿色 E .具有较强的氧化性 三.选择题:1.能使铁溶解,但不能生成沉淀的溶液是 ( )A .稀H 2SO 4B .FeCl 3溶液C .CuSO 4溶液D .FeSO 4溶液2.为了除去FeSO 4溶液中的Fe 2(SO 4)3和 CuSO 4杂质,可选用的试剂为( )A .NaOHB .氯水C .CuD .Fe3.下列操作中,溶液的颜色不发生变化的是 ( )A .碳酸氢钠溶液中滴加稀盐酸B .硫酸铁溶液中滴加硫氰化钾溶液C .碘水中滴加淀粉碘化钾溶液D .氯化铁溶液中加入铁粉4.鉴别Fe 2+和Fe 3+可用下列试剂中的 ( ) ①NaOH 溶液 ②稀H 2SO 4 ③KSCN 溶液 ④铜片 ⑤KI 淀粉溶液A .①②③B .①③④⑤C .③④⑤D .②③④5.将铁的某种化合物溶于盐酸,滴加KSCN 溶液不发生颜色变化,再加入适量氯水,溶液立即呈红色.则此铁的化合物是 ( )A .Fe 2O 3B .FeCl 3C .Fe 2(SO 4)3D .FeO6.下列离子在溶液中能大量共存的是 ( )A .Fe NH SCN Cl 34++--、、、B .--++2432S O NO H Ba 、、、C .Fe Fe Na NO 233+++-、、、D .Fe NH Cl OH 24++--、、、7.证明某溶液只含有Fe2+而不含有Fe3+的实验方法是()A.先滴加氯水,再滴加KSCN溶液后显红色B.先滴加KSCN溶液,不显红色,再滴加氯水后显红色C.滴加NaOH溶液,先产生白色沉淀,后变灰绿,最后呈红褐色D.只需滴加KSCN溶液8.在含有1molFeSO4的溶液中投入一小块金属钠,反应完全后,滤出沉淀并洗涤之,然后在空气中灼烧沉淀得到的固体物质是()A.Fe B.FeO C.Fe(OH)3D.Fe2O39.将Fe、Cu、Fe2+、Fe3+和Cu2+盛于同一容器中充分反应,如Fe有剩余,则容器中只能有()A.Cu、Fe3+B.Fe2+、Fe3+C.Cu、Cu2+、Fe D.Cu、Fe2+、Fe10.制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3+Cu2FeCl2+CuCl2。
铁及其化合物(习题及答案)

【参考答案】
1. B 2. C 3. A 4. C 5. B 6. A 7. D 8. 产生白色沉淀,在空气中迅速变成灰绿色,最后变为红褐色
FeCl2 + 2NaOH Fe(OH)2↓+ 2NaCl 4Fe(OH)2 + O2 + 2H2O 4Fe(OH)3 9. 不合理 向另一支装有该未知溶液的试管中先滴加 KSCN 溶液,无现 象,再通入氯气,溶液变为红色,证明该未知溶液含有 Fe2+。 10. (1)Fe Cl2 H2 (2)Fe + 2HCl Fe2+ + H2↑ (3)2Fe2+ + Cl2 2Fe3+ + 2Cl
①剩余金属只有 Fe
②剩余金属一定有 Cu
③反应后的溶液中一定有 FeCl2
④反应后的溶液中可能有 FeCl3
A.①③ B.②④ C.②③
D.只有③
5. 在含有 Fe3+、Fe2+、Cu2+的溶液中加入铁粉,充分反应后,
固体残渣用盐酸处理有气体放出,则与铁粉反应后的溶液中
离子最多的是( )
A.Fe3+
B.Fe2+
C.Cu2+
D.H+
6. 为了使 FeCl2 氧化成 FeCl3 且不引杂,应向溶液中加入( )
A.氯水
B.HNO3
C.KMnO4 D.Na2O2
7. 能与 Fe3+反应,且能够证明 Fe3+具有氧化性的物质是( )
①KSCN ②Fe ③FeCl2 ④Cu
A.④⑤ B.②③
C.①③
⑤NaOH D.②④
产生的是( )
A.CuCl2 溶液
铁及其重要化合物练习题

一、选择题1.某同学欲探究铁及其化合物的性质,下列实验方案可行的是()A.将铁粉加入热的浓硫酸中:探究铁的活泼性B.将热的NaOH溶液滴入FeCl3溶液中:制备Fe(OH)3胶体C.在蒸发皿中加热蒸干FeSO4溶液:制备FeSO4·6H2O晶体D.将铜粉加入FeCl3溶液中:验证Fe3+的氧化性强于Cu2+2.下列检验试剂选用正确的是()A.用氯水、KSCN溶液检验FeCl3中是否有FeCl2B.用酸性KMnO4溶液检验FeCl3中是否有FeCl2C.用NaOH溶液检验MgCl2中是否有FeCl2D.用硝酸检验某黄色固体是纯铜还是黄铜3.铁及其化合物是中学化学中的一类重要物质,下列关于铁元素的叙述中正确的是() A.保存FeCl2溶液常常加一些铁粉,其目的是抑制Fe2+水解B.25℃,pH=0的溶液中,Al3+、NH+4、NO-3、Fe2+可以大量共存C.制备AlCl3、FeCl3均可采用将溶液直接蒸干的方法D.硫酸亚铁溶液中加入过氧化氢溶液:2Fe2++H2O2+2H+===2Fe3++2H2O4.将一定量的铁粉加入一定浓度的稀硝酸中,金属恰好完全溶解,反应后溶液中存在:c(Fe2+)∶c(Fe3+)=3∶2,则参加反应的Fe和HNO3的物质的量之比为()A.1∶1 B.5∶16C.2∶3 D.3∶25.下列各组物质中,X是主体物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的一组是()选项 A B C DX FeCl2溶液FeCl3溶液Fe CaCl2溶液Y FeCl3CuCl2Al FeCl3Z Cl2Fe NaOH溶液NaOH溶液6.A、B、C为3种单质(其中A为固体,B、C为气体),将D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色,B、C反应的产物易溶于水得到无色溶液E。
它们之间的转化关系如图,下列推断正确的是()A.物质B是H2B.物质C是Cl2C.物质D是FeCl2D.物质F是FeCl27.采用硫酸铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取绿矾(FeSO4·7H2O),某学习小组设计了如下流程:下列说法错误的是()A.酸浸时选用足量硫酸,试剂X为铁粉B.滤渣a主要含SiO2,滤渣b主要含Al(OH)3C.从滤液B得到绿矾产品的过程中,必须控制条件防止其氧化和分解D.试剂X若为过量NaOH溶液,得到的沉淀用硫酸溶解,再结晶分离也可得绿矾8.在Fe2(SO4)3溶液中,加入a g铜,完全溶解后,再加b g铁,充分反应后得到c g残余固体,已知a>c,则下列说法正确的是()A.残余固体是铜和铁B.最后得到的溶液中一定含有Cu2+C.将残余固体加入到稀H2SO4中,有气泡产生D.最后得到的溶液中可能含有Fe3+L-1盐酸恰好将之完全溶解,所得溶液还能9.有一块铁的“氧化物”样品,用140 mL 5.0 mol·吸收0.025 mol Cl2,恰好使其中的Fe2+全部转变为Fe3+,则该样品可能的化学式为() A.Fe2O3B.Fe3O4C.Fe4O5D.Fe5O710.A、B、C三种物质中均含有同一种元素M,它们之间有如图所示的转化关系。
铁及其化合物能力训练

铁及其化合物能力训练(一)选择题:1.下列物质发生反应时其离子方程式正确的是( )A.铁与三氯化铁溶液反应Fe+2Fe3+ 3Fe2+B.足量的氯气通入溴化亚铁溶液中2Fe2++4Br-+3Cl2 2Fe3++2Br2+6Cl-C.Fe(OH)3跟盐酸反应Fe(OH)3+3H+ Fe3++3H2OD.FeS跟稀硝酸反应FeS+2H+=Fe2++H2S↑知识点:离子方程式的书写规则及Fe的一些重要反应能力点:再现能力、推理能力2.5.6g铁粉加入到含0.3 mol硝酸铁的溶液中,充分反应后则( )A.铁完全被氧化B.铁部分被氧化C.铁离子完全被还原实用文档D.不发生氧化—还原反应知识点:铁与HNO3反应时为+3能力点:推理计算能力3.下列试剂能用来分离Fe3+与Al3+的是( )A.NH3·H2OB.NaOHC.(NH4)2CO3D.HCl知识点:Fe3+与OH-反应与Al3+不同。
能力点:再现能力、推理能力。
4.金属X分别与浓H2SO4和Cl2反应时,呈相同的价态,与浓H2SO4反应的产物是X 2(SO4)3.已知14gX与26.6g氯气恰好完全反应,则X的相对原子质量为( )A.27B.56C.52D.64知识点:Fe在遇到强氧化剂时显+3价能力点:计算推断能力,再现能力5.下列各组离子在溶液中能大量共存的是( )A.Fe3+、S2-、HCO-3、K+B.Fe2+、H+、NO-3、SO-24C.Fe3+、Mg2+、NO-3、Cl-D.Fe2+、Cu2+、Cl-、NO-3实用文档知识点:离子共存的条件能力点:再现能力、发散思维能力6.有100毫升0.1 mol/L 的FeCl3溶液与50mol 0.1mol/L的AgNO3溶液混合后,混合液各离子浓度由大到小的顺序是( )]A.[Cl-]>[Fe3+]>[Ag+]>[NO-3]>[Ag+]B.[Cl-]>[Fe3+]>[NO-3]>[Cl-]>[Ag+]C.[Fe3+]>[NO-3]>[Fe3+]>[Cl-]>[Ag+]D.[NO-3知识点:离子浓度的计算能力点:推理能力、发散思维能力7.炼铁高炉中排出的炉渣的主要成分是( )A.CaOB.FeSiO3C.CaSiO3D.Fe3O4知识点:炼铁的炉渣成分能力点:分析比较能力、辨认能力8.在炼钢结束时,常在钢水中加一些硅铁、锰铁,其目的是( )A.除氧化B.还原氧化铁C.除硫磷D.除去过量的氧化亚铁知识点:炼钢过程中加入一些原料的作用实用文档9.下列生产工业①制生石灰②制水泥③制普通玻璃④炼铁⑤炼钢⑥制漂白粉⑦硬水软化,其生产原料中直接使用石灰石的是( )A.只有①③⑦B.只有②④⑤C.只有①④⑥D.只有①②③④知识点:一些工业生产中的原料及用途能力点:再现能力、推断能力10.下列有关炼铁和炼钢的说法中,错误的是( )A.炼铁是铁矿石被还原的过程B.炼钢是生铁被氧化的过程C.炼铁高炉中加入石灰石的目的是除去脉石D.炼钢转炉中加入的生石灰是造渣剂.知识点:炼钢和炼铁的原理和目的能力点:再现能力、推断能力11.将10g铁碳合金放入氧气中高温灼烧,反应后的气体通入过量石灰水中得沉淀1.4g。
铁及其化合物练习题

铁及其化合物练习题一、选择题1. 铁在氧气中燃烧生成的化合物是:A. FeOB. Fe2O3C. Fe3O4D. FeS2. 以下哪个化合物是铁的氧化物?A. FeCl3B. Fe2(SO4)3C. Fe(NO3)3D. FeCO33. 铁与稀硫酸反应生成的化合物是:A. FeSO4B. FeCl2C. Fe(NO3)2D. FeCO34. 铁在高温下与水蒸气反应生成的化合物是:A. Fe3O4B. Fe2O3C. FeOD. Fe(OH)35. 铁在潮湿的空气中形成的锈是:A. Fe2O3B. Fe3O4C. Fe(OH)2D. FeS二、填空题6. 铁在氧气中燃烧的化学方程式为:________________________。
7. 铁与稀盐酸反应生成氯化亚铁和氢气的化学方程式为:________________________。
8. 铁与硝酸反应的化学方程式为:__________________________。
9. 铁在高温下与水蒸气反应生成四氧化三铁和氢气的化学方程式为:________________________。
10. 铁锈的主要成分是氧化铁,其化学式为:________________________。
三、简答题11. 简述铁在潮湿的空气中生锈的过程。
12. 描述铁与硫酸铜溶液反应的现象和化学方程式。
13. 说明铁在高温下与水蒸气反应生成四氧化三铁的工业应用。
四、计算题14. 已知铁与稀硫酸反应生成硫酸亚铁和氢气,若反应中消耗了5.6g 铁,求生成的氢气的质量。
15. 假设铁与稀硝酸反应生成硝酸铁、NO和水,若反应中消耗了0.5mol铁,求生成的NO的摩尔数。
五、实验设计题16. 设计一个实验来验证铁的氧化物的颜色,并说明实验步骤和预期结果。
17. 描述如何通过实验来测定铁的氧化物中铁元素的价态。
六、综合应用题18. 某工厂需要大量生产四氧化三铁,设计一个经济有效的生产方案,并说明其可行性。
高考化学《铁及其化合物的综合》专项训练及详细答案
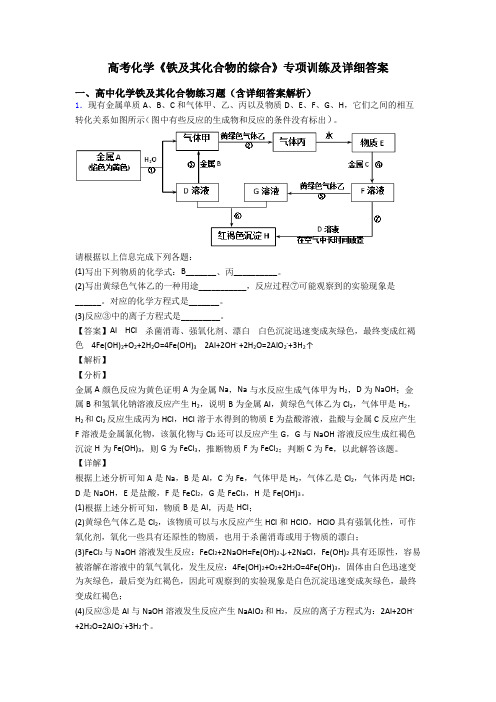
高考化学《铁及其化合物的综合》专项训练及详细答案一、高中化学铁及其化合物练习题(含详细答案解析)1.现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。
请根据以上信息完成下列各题:(1)写出下列物质的化学式:B_______、丙__________。
(2)写出黄绿色气体乙的一种用途___________,反应过程⑦可能观察到的实验现象是______。
对应的化学方程式是_______。
(3)反应③中的离子方程式是_________。
【答案】Al HCl 杀菌消毒、强氧化剂、漂白白色沉淀迅速变成灰绿色,最终变成红褐色 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Al+2OH- +2H2O=2AlO2-+3H2↑【解析】【分析】金属A颜色反应为黄色证明A为金属Na,Na与水反应生成气体甲为H2,D为NaOH;金属B和氢氧化钠溶液反应产生H2,说明B为金属Al,黄绿色气体乙为Cl2,气体甲是H2,H2和Cl2反应生成丙为HCl,HCl溶于水得到的物质E为盐酸溶液,盐酸与金属C反应产生F溶液是金属氯化物,该氯化物与Cl2还可以反应产生G,G与NaOH溶液反应生成红褐色沉淀H为Fe(OH)3,则G为FeCl3,推断物质F为FeCl2;判断C为Fe,以此解答该题。
【详解】根据上述分析可知A是Na,B是Al,C为Fe,气体甲是H2,气体乙是Cl2,气体丙是HCl;D是NaOH,E是盐酸,F是FeCl2,G是FeCl3,H是Fe(OH)3。
(1)根据上述分析可知,物质B是Al,丙是HCl;(2)黄绿色气体乙是Cl2,该物质可以与水反应产生HCl和HClO,HClO具有强氧化性,可作氧化剂,氧化一些具有还原性的物质,也用于杀菌消毒或用于物质的漂白;(3)FeCl2与NaOH溶液发生反应:FeCl2+2NaOH=Fe(OH)2↓+2NaCl,Fe(OH)2具有还原性,容易被溶解在溶液中的氧气氧化,发生反应:4Fe(OH)2+O2+2H2O=4Fe(OH)3,固体由白色迅速变为灰绿色,最后变为红褐色,因此可观察到的实验现象是白色沉淀迅速变成灰绿色,最终变成红褐色;(4)反应③是Al与NaOH溶液发生反应产生NaAlO2和H2,反应的离子方程式为:2Al+2OH- +2H2O=2AlO2-+3H2↑。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
铁及其化合物 练习1.A ~I 分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G 为主族元素的固态氧化物,A 、B 、C 、D 、E 、F 六种物质中均含同一种元素。
请填写下列空白:⑴A 、B 、C 、D 、E 、F 六种物质中所含同一种元素在周期表中位置 。
⑵写出C 、G 物质的化学式:C G ⑶写出①、④、⑥反应的化学方程式。
反应①: 反应④: 反应⑥:2.在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物。
该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉。
这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以俗称“引火铁”。
请分别用下图中示意的两套仪器装置。
制取上述铁的氧化物和“引火铁”。
实验中必须使用普通铁粉和6摩/升盐酸,其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。
填写下列空白:⑴实验进行时试管A 中应加入的试剂是 ;烧瓶B 的作用是 ;烧瓶C 的作用是 ;在试管D 中收集得到的是 。
⑵实验时,U 型管G 中应加入的试剂是 ;长颈漏斗H 中应加入 ⑶两套装置中,在实验时需要加热的仪器是(填该仪器对应的字母) ; ⑷烧瓶Ⅰ中发生的反应有时要加入少量硫酸铜溶液,其目的是 ; ⑸试管E 中发生反应的化学方程式是 ; ⑹为了安全,在E 管中的反应发生前,在F 出口处必须 ;E 管中的反应开始后,在F 出口处应 。
3.(2011延庆一模)28.(10分)硫酸亚铁晶体(FeSO 4·7H 2O )在医药上作补血剂。
某课外小组测定该补血剂中铁元素的含量。
实验步骤如下:请回答下列问题:(1)证明步骤①滤液中含有Fe 2+的方法是 。
(2)写出②中的离子反应方程式: 。
(3)步骤③中反应的离子方程式: 。
(4)步骤④中一系列处理的操作步骤:过滤、 、灼烧、冷却 、称量。
(5)该小组有些同学认为用KMnO 4溶液滴定也能进行铁元素含量的测定。
(5Fe 2++MnO 4—+8H +→5Fe 3++Mn 2++4H 2O )实验前,首先要精确配制一定物质的量浓度的KMnO 4溶液250mL ,配制时需要的仪器除药匙、天平(附砝码)、玻棒、烧杯、胶头滴管外,还需 。
②滴定到终点时的颜色为 色。
(6)正常人每天应补充16.8mg 左右的铁。
其中绝大部分来自于食物。
如果全部通过服用含FeSO 4·7H 2O 的片剂。
来补充铁,则正常人每天服需用含 mg FeSO 4·7H 2O 片剂。
4.高铁酸钾(K 2FeO 4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。
其生产工艺如下:已知:① 2KOH + Cl 2 → KCl + KClO + H 2O (条件:温度较低)② 6KOH + 3Cl 2 → 5KCl + KClO 3 + 3H 2O (条件:温度较高)③ 2Fe(NO 3)3 + 2KClO + 10KOH → 2K 2FeO 4 + 6KNO 3 + 3KCl + 5H 2O 回答下列问题:(1)该生产工艺应在 (填“温度较高”或“温度较低”)的情况下进行; (2)写出工业上制取Cl 2的化学方程式 ; (3)K 2FeO 4具有强氧化性的原因 ; (4)配制KOH 溶液时,是在每100 mL 水中溶解61.6 g KOH 固体(该溶液的密度为1.47 g/mL ),它的物质的量浓度为 ;(5)在“反应液I”中加KOH 固体的目的是 : A .与“反应液I”中过量的Cl 2继续反应,生成更多的KClO B .KOH 固体溶解时会放出较多的热量,有利于提高反应速率 C .为下一步反应提供反应物 D .使副产物KClO 3转化为 KClO(6)从“反应液II”中分离出K 2FeO 4后,会有副产品 (写化学式),它们都是重要的化工产品,具体说出其中一种物质的用途 。
5.(10分)工业上利用含锰废水(主要含MnSO 4、H 2SO 4、和铁、铝、铜等金属的硫酸盐)制取碳酸锰(MnCO 3)。
步骤如下: Ⅰ.氧化:向废水中加入氧化剂;Ⅱ.中和:控制温度在40~50 ℃,加入氨水,过滤;Ⅲ.除重金属:向滤液中加入BaS 溶液,除去Cu 2+ 等重金属,过滤,得MnSO 4溶液; Ⅳ.制固体MnSO 4:从MnSO 4溶液得其固体;Ⅴ.制MnCO 3:用水溶解MnSO 4固体,加入NH 4HCO 3溶液,得MnCO 3沉淀粗品; Ⅵ.洗涤:用水洗涤MnCO 3粗品至无SO 42-,获得高纯MnCO 3。
回答下列问题:(1)Ⅰ中,下列氧化剂均能把Fe 2+氧化为Fe 3+,最佳的试剂是 。
a .浓HNO 3 b .MnO 2 c .K 2Cr 2O 7(2)Ⅱ中,氨水除中和酸外,同时沉淀Fe 3+、Al 3+ 等,沉淀Al 3+的离子方程式是: 。
(3)Ⅳ中,溶液需浓缩、结晶、 (填一种分离操作的名称),得MnSO 4固体。
(4)Ⅴ中生成MnCO 3沉淀的离子方程式是:。
(5)由MnCO 3 可制得重要的催化剂MnO 2,MnCO 3 → MnO 2 + CO 。
现加热分解 460.0 kg 的MnCO 3,得到332.0 kg 产品,若产品中杂质只有MnO ,则该产品中MnO 2的质量是 kg 。
(摩尔质量/g·-1mol :MnCO 3 115 MnO 2 87 MnO 71)6.(16分)某废金属屑中主要成分为Cu 、Fe 、Al ,还含有少量的铜锈[C u 2(O H )2C O 3]、少量的铁锈和少量的氧化铝,用上述废金属屑制取胆矾(CuSO 4·5H 2O )、无水AlCl 3和铁红的过程如下图所示:已知: ① Al 3+、A l (O H )3、AlO 2-有如下转化关系:② 碳酸不能溶解A l (O H )3。
请回答:(1)在废金属屑粉末中加入试剂A ,生成气体1的反应的离子方程式是 。
(2)溶液2中含有的金属阳离子是 ;气体2的成分是 。
(3)溶液2转化为固体3的反应的离子方程式是 。
(4)固体2制取CuSO 4溶液有多种方法。
① 在固体2中加入浓H 2SO 4,并加热,使固体2全部溶解得CuSO 4溶液,反应的化学方程式是 。
② 在固体2中加入稀H 2SO 4 后,通入O 2并加热,使固体2全部溶解得CuSO 4溶液,反应的离子方程式是 。
(5)溶液1转化为溶液4过程中,不在溶液1中直接加入试剂C ,理由是 。
(6)直接加热AlCl 3·6H 2O 不能得到无水AlCl 3。
SOCl 2为无色液体,极易与水反应生成HCl 和一种具有漂白性的气体。
AlCl 3·6H 2O 与SOCl 2混合加热制取无水AlCl 3 ,反应的化学方程式是 。
CO 2废金属屑粉末气体1过量试剂A试剂B试剂C SOCl 2固体1溶液1气体2固体2溶液2 固体4溶液3过量试剂A CuSO 4溶液气体1过量试剂A 固体3溶液4灼烧铁 红胆 矾AlCl 3·6H 2O无水AlCl 3空气 Al 3+OH - H + AlO 2-OH - H +A l (O H )3铁及其化合物练习答案1.⑴第4周期、第Ⅷ族⑵FeCl2Al2O3⑶8Al+3Fe3O44Al2O3+9Fe2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 4F e(OH)2+O2+2H2O=4Fe(OH)32.⑴普通铁粉(或铁粉),作为水蒸气发生器(或用来产生水蒸气);防止水倒吸(或用作安全瓶);氢气⑵固体NaOH(或碱石灰、CaO等碱性固体干燥剂);6 mol·L-1HCl(注:G中如填写酸性干燥剂或液体干燥剂,则此空不给分。
)⑶A、B、E⑷加快氢气产生的速度⑸⑹检验氢气的纯度点燃氢气3.(10分)(1)(1分)取1ml滤液于试管中,滴加几滴酸性KMnO4溶液,如果溶液紫色退去,则说明有Fe2+。
(合理答案均给分)(2)(2分)2Fe2++H2O2+2H + ===2Fe3+ +2H2O(3)(2分)Fe3++3NH3.H2O = Fe(OH)3↓+3 NH4+(4)(1分)洗涤(5)(2分)250ml容量瓶溶液变成紫红色(6)(2分)83.44.(1)温度较低(2分)(2)2NaCl + 2H2O 2NaOH + H2↑+ Cl2↑(2分)(3)Fe元素的化合价显+6价,易得电子(2分)(4)10 mol/L(2分)(5)AC(2分)(6)KNO3KCl,KNO3可用于化肥,炸药等(合理就给分)(2分)5.(10分)(每空2分)(1) b(2) Al3+ + 3NH3·H2O = Al(OH)3↓ + 3NH4+(3)过滤(4)Mn2+ + 2 HCO3- = MnCO3↓ + H2O + CO2↑(5)261.0 6.(16分)(1)(2分)2Al+2OH-+2H2O = 2 AlO2-+3H2↑(2)(2分)Fe2+ (2分)CO2和H2(3)(2分)4Fe2++8OH-+O2+2H2O = 4Fe(OH)3↓(4)(2分)① Cu+2H2SO4(浓)CuSO4+ SO2↑+2H2O(2分)② 2Cu+4H++O22Cu2++2H2O(5)(2分)若在溶液1中直接加入盐酸,会使溶液4中混有试剂A中的阳离子(如Na+等),而不是纯净的AlCl3溶液(6)(2分)AlCl3·6H2O+6SOCl2 AlCl3+12HCl↑+6SO2↑△△Fe3O4 + 4H23Fe + 4H2O高温△。
