溶瘤腺病毒靶向杀灭葡萄膜黑色素瘤的实验研究
溶瘤腺病毒靶向治疗肿瘤干细胞的研究进展

溶瘤腺病毒靶向治疗肿瘤干细胞的研究进展
王芳
【期刊名称】《医学综述》
【年(卷),期】2013(19)13
【摘要】肿瘤干细胞(或肿瘤起始细胞)由于具有很强的肿瘤起始能力和浸润转移能力而成为许多肿瘤中难治性的细胞群体.有研究表明肿瘤干细胞对化疗、放疗抵抗,因此与肿瘤的复发有关.针对肿瘤干细胞治疗策略将会影响肿瘤治疗的成败,已有研究表明溶瘤腺病毒可通过感染的方式杀伤肿瘤干细胞,因此可以克服肿瘤干细胞对药物耐受、对放化疗抵抗的机制;另外,通过基因工程的方法在溶瘤腺病毒的构建过程中增加一些外源性抗肿瘤基因,还可促进溶瘤病毒的特异性和抗肿瘤活性.该文总结溶瘤腺病毒靶向针对肿瘤干细胞的研究进展,以期为今后的临床治疗和应用提供理论基础.
【总页数】4页(P2345-2348)
【作者】王芳
【作者单位】兰州大学第二医院泌尿外科研究所,兰州,730000;兰州大学基础医学院,兰州,730000
【正文语种】中文
【中图分类】R730.5;R730.2
【相关文献】
1.溶瘤腺病毒靶向治疗恶性肿瘤研究进展 [J], 赵文超;金鑫;郑明华;牛天力;郑骏年
2.survivin 启动子调控肿瘤干细胞标记 CD133基因 siRNA增殖型溶瘤腺病毒的构建及对肝癌细胞生长的抑制作用 [J], 牛坚;王月;刘斌;王人颢;朱志军;申海莲
3.恶性胶质瘤肿瘤干细胞靶向治疗的研究进展 [J], 武志;刘建雄
4.双调控肿瘤特异性溶瘤腺病毒对卵巢癌靶向治疗的研究 [J], 赵婷;石琴
5.人溶瘤腺病毒的研究进展 [J], 申祖杰;王艳杰;康燕燕;林楠;高剑文
因版权原因,仅展示原文概要,查看原文内容请购买。
溶瘤病毒在肿瘤治疗中的研究进展

溶瘤病毒在肿瘤治疗中的研究进展黄慧雅;陆荫英;谢震【摘要】随着生物工程技术的进步,近年来经过基因修饰/改造的溶瘤病毒在肿瘤治疗领域取得很大进展,成为肿瘤免疫治疗研究的热点方向.从非基因编辑型到基因编辑型,溶瘤病毒包含众多种类和结构,疗效及安全性得到极大提升.溶瘤病毒不仅可以直接裂解肿瘤细胞,还可以在肿瘤微环境中表达外源效应基因,诱发并增强机体对肿瘤的免疫杀伤作用,使其成为肿瘤联合治疗的理想搭配,在多种肿瘤联合免疫治疗中取得显著疗效.同时,随着现代合成生物学技术的飞速发展,使我们对溶瘤病毒精准、严谨的改造成为可能,这为理解溶瘤病毒干预肿瘤微环境的机制,增强肿瘤的免疫杀伤效能,开发更加安全、特效的溶瘤病毒类抗肿瘤药物提供了新的思路和技术途径.【期刊名称】《传染病信息》【年(卷),期】2019(032)001【总页数】7页(P30-36)【关键词】溶瘤病毒;肿瘤微环境;联合免疫治疗;合成生物学【作者】黄慧雅;陆荫英;谢震【作者单位】100084 北京,清华大学自动化系清华国家信息科学与技术实验室合成与系统生物学中心生物信息学与生物信息学教育部重点实验室;100039 北京,中国人民解放军总医院第五医学中心肝脏肿瘤诊疗与研究中心;100084 北京,清华大学自动化系清华国家信息科学与技术实验室合成与系统生物学中心生物信息学与生物信息学教育部重点实验室【正文语种】中文【中图分类】R373.9;R730.5溶瘤病毒是指能通过不同的调控机制在肿瘤细胞内复制进而裂解肿瘤细胞,但不影响正常细胞生长状况的一类病毒。
其在肿瘤细胞裂解的过程中会释放肿瘤特异性抗原,进而激活机体特异性免疫反应。
所以溶瘤病毒可以通过直接裂解和免疫作用两种方式杀伤肿瘤细胞。
溶瘤病毒在临床上的应用最早可以追溯到19世纪末,一名患有白血病的42岁女子在一次疑似感染流感病毒后肿瘤忽然痊愈。
1912年意大利医生报道了一个晚期的宫颈癌患者在注射狂犬病疫苗后病情明显缓解的案例。
质子照射法治疗葡萄膜黑色素瘤的临床效果剖析
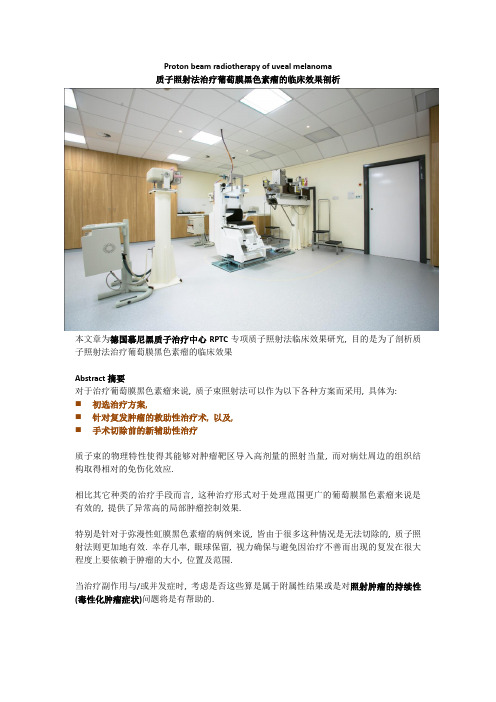
Proton beam radiotherapy of uveal melanoma质子照射法治疗葡萄膜黑色素瘤的临床效果剖析本文章为德国慕尼黑质子治疗中心RPTC专项质子照射法临床效果研究, 目的是为了剖析质子照射法治疗葡萄膜黑色素瘤的临床效果Abstract摘要对于治疗葡萄膜黑色素瘤来说, 质子束照射法可以作为以下各种方案而采用, 具体为:⏹初选治疗方案,⏹针对复发肿瘤的救助性治疗术, 以及,⏹手术切除前的新辅助性治疗质子束的物理特性使得其能够对肿瘤靶区导入高剂量的照射当量, 而对病灶周边的组织结构取得相对的免伤化效应.相比其它种类的治疗手段而言, 这种治疗形式对于处理范围更广的葡萄膜黑色素瘤来说是有效的, 提供了异常高的局部肿瘤控制效果.特别是针对于弥漫性虹膜黑色素瘤的病例来说, 皆由于很多这种情况是无法切除的, 质子照射法则更加地有效. 幸存几率, 眼球保留, 视力确保与避免因治疗不善而出现的复发在很大程度上要依赖于肿瘤的大小, 位置及范围.当治疗副作用与/或并发症时, 考虑是否这些算是属于附属性结果或是对照射肿瘤的持续性(毒性化肿瘤症状)问题将是有帮助的.上图为钽标记物植入效果本图像显示了钽标记物缝合于巩膜的效果. 自肿瘤边缘的距离, 异组织边缘及相互的距离皆被测量出.A.治疗左眼内乳头旁脉络膜黑色素瘤的质子治疗规划. 肿瘤基底尺寸为7.5mm x 6.6mm毫米, 厚度达到了0.9mm. 3项钽标记物被植入患者眼内, 采用视盘为第4”标记物”B.叠加于基底照片的质子束图标, 注意束波槽口, 设计来避免对视神经的间接损伤C.3D图像显示了肿瘤, 神经, 标记物与束波D.通过眼球的垂直切片显示出对视神经的最小照射a)脉络膜黑色素瘤质子照射法的眼部效果, 局部肿瘤控制b)根据肿瘤高度所达到的20/200视力维护或更好的结果c)根据后肿瘤延长而取得的20/40视力维护效果d)根据肿瘤高度所达到的眼球保留效果。
黑色素瘤pd1临床实验

黑色素瘤pd1临床实验黑色素瘤PD-1临床实验近年来,肿瘤治疗领域取得了突破性进展,其中包括了免疫治疗的出现。
而在黑色素瘤治疗领域,PD-1抑制剂被广泛应用并且取得了显著的疗效。
本文将对黑色素瘤PD-1临床实验进行讨论,探究其在黑色素瘤治疗中的应用和疗效。
一、PD-1抑制剂:国际间的共识与进展PD-1是免疫检查点受体的一种,受癌细胞分泌的PD-L1配体的作用,使T细胞失去活性,通常表现为免疫逃逸。
因此,通过抑制PD-1和PD-L1结合,可以恢复T细胞的免疫活性,对黑色素瘤等恶性肿瘤起到治疗作用。
目前,多个PD-1抑制剂已经获得国际认可和广泛使用,如nivolumab、pembrolizumab等。
临床实验结果显示,PD-1抑制剂在治疗黑色素瘤中具有较好的疗效和耐受性。
二、黑色素瘤PD-1临床实验研究的疗效1. 单用PD-1抑制剂治疗黑色素瘤临床实验研究显示,单用PD-1抑制剂治疗晚期黑色素瘤的患者,可以获得显著的生存期延长和肿瘤缩小。
其中,pembrolizumab治疗黑色素瘤的KEYNOTE-006研究,证实了该药物在治疗黑色素瘤中的疗效。
2. PD-1抑制剂联合其他治疗手段为了提高黑色素瘤PD-1抑制剂治疗的疗效,目前研究者也尝试将其与其他治疗手段联合应用。
例如,PD-1抑制剂与BRAF抑制剂的联合治疗,通过同时刺激免疫系统和抑制肿瘤细胞的增殖,取得了较好的临床效果。
三、黑色素瘤PD-1临床实验中的安全性尽管PD-1抑制剂在黑色素瘤治疗中显示出良好的疗效,但其不良反应也不可忽视。
临床实验研究发现,PD-1抑制剂可引起皮疹、疲劳、呕吐等不良反应,少数患者可能出现严重的免疫相关性不良反应,如肺炎、甲状腺功能异常等。
因此,在应用PD-1抑制剂治疗黑色素瘤时,医生需要密切监测患者的不良反应并及时处理。
结论黑色素瘤PD-1临床实验的研究表明,PD-1抑制剂在治疗晚期黑色素瘤中具有显著的疗效和耐受性。
然而,随着研究的深入,我们还需进一步探索PD-1抑制剂联合其他治疗手段的潜力,并关注其安全性。
葡萄膜黑色素瘤分子机制及靶向治疗新进展

・综述Leabharlann 葡萄膜黑色素瘤分子机制及靶 向治疗新进展
王祯 莲 周晓鹰
【 摘要】 葡 萄 膜 黑 色 素瘤 是 成 人 眼 内 最 常见 的肿 瘤 。 半 数 以上 的原 发 性 葡 萄膜 黑 色 素 瘤会 发 生 转
移。 但 目前 对 于 转移 性 葡 萄 膜 黑 色 素瘤 还 没 有 有 效 的治 疗 方 法 。 研 究 葡 萄 膜 黑 色 素瘤 转 移 、 生长 、 增殖 、
葡 萄膜 黑 色 素瘤 是 国外 最 常见 、 国 内发 病 率 第 二 的 眼 内
生存率 . 我 们 必 须更 多地 了解 肿 瘤 细胞 转 移 的 机 制 。对 葡 萄
膜 黑 色 素 瘤 中新 发 现 的 基 因和 分 子 改 变 的 深 入 理 解 对 预 测
s u mma r i z e s r e c e n t l y d i s c o v e r e d mo l e c u l a r f e a t u r e s o f u v e a l me l a n o ma a n d t h e r a p i e s b e i n g e x p l o r e d t o c a p i t a l i z e o n t h i s k n o wl e d g e .
存 活相 关 的基 因 突变 可 以更 好 地 了 解其 发 病 机 理 及 转移 机制 , 并基 于此 开 展 有 效 的 治疗 。本 综 述 对 葡
萄 膜 黑 色 素 瘤 的分 子 机 制 、 相应 的治 疗 策 略 及研 究 前 景 进 行 了 总结 。
【 关键 词】 葡萄膜黑色素瘤 ; 基因表达谱 ; B A P 1 ; S F 3 B1 ; 靶向治疗
溶瘤病毒在葡萄膜黑色素瘤治疗上的应用、治疗效果的标记物及其检

专利名称:溶瘤病毒在葡萄膜黑色素瘤治疗上的应用、治疗效果的标记物及其检测试剂
专利类型:发明专利
发明人:刘福生,刘思思,张俊文
申请号:CN202010784288.1
申请日:20200806
公开号:CN111850126A
公开日:
20201030
专利内容由知识产权出版社提供
摘要:本发明公开了一种用于治疗、预防和/或减缓葡萄膜黑色素瘤的制剂,该制剂包括能够表达胞嘧啶脱氨酶基因的溶瘤性1型单纯疱疹病毒以及5‑氟胞嘧啶,二者联用能够显著地减少葡萄膜黑色素瘤体积并改善受试者生存期。
本发明还公开了一种用于评价葡萄膜黑色素瘤通过前述制剂治疗效果的标记物,该标记物选自能够表征上皮间质转化程度的标记物,主要包括IL‑6、DPD、TWIST1、ZEB1、CD44和CDH1。
申请人:北京市神经外科研究所
地址:100070 北京市丰台区南四环西路119号
国籍:CN
代理机构:北京五洲洋和知识产权代理事务所(普通合伙)
更多信息请下载全文后查看。
转移性葡萄膜黑色素瘤预后生物标志物的筛选

转移性葡萄膜黑色素瘤预后生物标志物的筛选摘要:背景:转移性葡萄膜黑色素瘤是一种具有高度恶性和复杂性的恶性肿瘤,其预后差异显著。
因此,筛选转移性葡萄膜黑色素瘤的预后生物标志物是一个重要的课题,有助于指导患者治疗和预后评估。
目的:本研究旨在筛选转移性葡萄膜黑色素瘤的预后生物标志物。
方法:我们通过文献检索、实验验证和生物信息学分析等方法,研究了一系列潜在的预后生物标志物。
结果:我们发现,某些基因表达水平的改变,特别是某些微小RNA分子的表达水平的显著改变,可以预示转移性葡萄膜黑色素瘤的预后。
此外,一些血液中的血清标志物也可以预测黑色素瘤的转移和预后。
结论:本研究筛选出了一些潜在的生物标志物,对于转移性葡萄膜黑色素瘤的诊断和治疗具有重要的意义。
关键词:转移性葡萄膜黑色素瘤;预后生物标志物;微小RNA;血清标志物;筛选引言转移性葡萄膜黑色素瘤是一种具有恶性和复杂性的恶性肿瘤,它可以在任何器官发生转移。
由于其发病率低、发病隐匿、治疗难度大,且预后较差,已经成为临床上一个较为棘手的难题。
因此,寻找预测转移性葡萄膜黑色素瘤转移和预后的生物标志物具有重要的临床意义。
方法我们对相关文献进行了检索,筛选了一系列有潜在价值的生物标志物。
根据文献报道和实验验证,我们发现某些基因表达水平的改变,特别是某些微小RNA分子的表达水平的显著改变,可以预示转移性葡萄膜黑色素瘤的预后。
此外,一些血液中的血清标志物也可以预测黑色素瘤的转移和预后。
结果我们筛选出了一些可能的生物标志物,通过生物信息学分析和实验验证,我们发现这些标志物可以预示转移性葡萄膜黑色素瘤的预后。
其中一些标志物包括miR-101、miR-146b、miR-214、miR-221和miR-222等微小RNA分子,以及一些血清标志物,如sCD146、MIA、VEGF和YKL-40等。
结论筛选出的一些潜在的生物标志物对于诊断和治疗转移性葡萄膜黑色素瘤具有重要的意义。
进一步的研究需要验证这些标志物的临床应用价值,以指导患者的治疗和预后评估另外,除了生物标志物的研究外,目前也有不少的临床研究探讨了转移性葡萄膜黑色素瘤的治疗方法。
miR-138-5p靶向TCF4调节眼葡萄膜黑色素瘤细胞的恶性生物学行为

kinaseB(PI3K/AKT)pathwayandtransientreceptorpotentialcationchannelprotein6(TRPC6)intheprocessof angiotensinⅡ (AngⅡ)inducedglomerularpodocyteinjury.Methods Mouseglomerularpodocyteswerecul turedinvitroandtreatedwithAngⅡ,Losartan,PI3K/AKTpathwayinhibitor(LY294002),TRPC6channelbloc ker(SKF96365).ThecellsweredividedintoblankcontrolgroupandAngⅡ group,AngⅡ + Losartangroup, Losartangroup,AngⅡ + LY294002group,LY294002group,AngⅡ + SKF96365group,SKF96365group. TheqRTPCRwasusedtodetectthechangesofTRPC6mRNAineachgroup.Westernblotwasusedtodetectthe changesofAKT,phosphorylatedproteinkinaseB(pAKT),andTRPC6proteinexpressionineachgroup.The apoptosisofpodocyteswasdetectedbyHoechst33258staining.Results Comparedwiththeblankcontrolgroup, theAKTphosphorylationleveloftheAngⅡ groupdecreased,theexpressionofTRPC6increased,andtheapopto sisofpodocytesincreased(P<005).ComparedwiththeAngⅡ group,theAKTphosphorylationlevelofthe AngⅡ +SKF96365groupincreased,theexpressionofTRPC6decreased,andtheapoptosisofpodocytesde creased(P<005);theAKTphosphorylationleveloftheAngⅡ +LY294002groupdecreased,andtheapoptosis ofpodocytesincreased(P<005);theAKTphosphorylationleveloftheAngⅡ +Losartangroupincreased,the expressionofTRPC6decreased,andtheapoptosisofpodocytesdecreased(P<005).Conclusion AngⅡ may inducepodocyteinjurybyactivatingtheTRPC6channelandtherebyinhibitingtheactivationofPI3K/AKTpath way. Keywords angiotensinⅡ;podocytes;phosphatidylinositol3kinase/proteinkinaseB;transientreceptorpoten tialcationchannelprotein6
溶瘤病毒的抗肿瘤作用机制和临床进展

溶瘤病毒的抗肿瘤作用机制和临床进展溶瘤病毒(OV)的发展是建立在早在一个世纪前的观察基础上的,当时自然获得性病毒感染后,癌症会自然消退。
最初,人们希望利用含有病毒的体液来进行治疗,但随后的研究表明,天然的病毒嗜性在临床转化中造成了严重的限制。
有了这一认识,基因工程的出现促进了病毒的优化,它们对不同的癌症有了明确的选择性。
几乎所有种类的病毒,包括单纯疱疹病毒、腺病毒、痘苗病毒、麻疹病毒、细小病毒、脊髓灰质炎病毒、马拉巴病毒、呼肠孤病毒、柯萨奇病毒、水泡性口炎病毒和新城疫病毒,都在这种背景下进行了设计,并在临床上对不同类型的肿瘤进行了测试。
通常需要对病毒复制的一些关键基因进行突变,在赋予病毒肿瘤选择性的同时,大大削弱了对宿主细胞的杀伤能力。
这种溶瘤活性增强了治疗优势,并诱导肿瘤细胞死亡后的免疫原性,使CD8+T细胞向肿瘤微环境的浸润增加。
溶瘤病毒的这一重要特征可使免疫“冷”肿瘤升温,其与其它免疫疗法相结合呈现出诱人的前景。
溶瘤病毒发展史实际上,用活的嗜瘤病毒治疗癌症有着悠久的历史。
自19世纪中期以来就有病例报告表明癌症患者的自然微生物感染有时可以暂时减轻肿瘤负担,这引起了研究人员的好奇,随后便诞生了溶瘤病毒的概念及相关研究。
从1949年开始,人们使用不同类型的野生型非减毒病毒进行了许多临床试验。
此后不久,OV领域的趋势演变为开发对人类致病性较小的基因修饰病毒,如减毒活疫苗。
在过去的20-30年中,这一转变一直延续到使用转基因病毒进行癌症治疗的时代,包括利用病毒基因敲除和/或治疗性转基因敲入。
进入21世纪,在许多临床试验得到积极结果之后,OV领域获得了相当大的关注。
到目前为止,已经在全球批准了四项OV药物。
第一种OV是一种被称为Rigvir的小核糖核酸病毒,在拉脱维亚被批准用于治疗黑色素瘤,但未得到广泛应用。
其次,2005年中国批准了一种名为H101的工程腺病毒,用于治疗头颈癌。
第三,2015年,美国和欧洲批准了另一种名为Talimogene Laherparepvec(T-VEC)的工程单纯疱疹病毒(HSV-1)OV,用于治疗不可切除的转移性黑色素瘤。
IL-24的靶向溶瘤腺病毒在肿瘤治疗中的研究的开题报告

携带mda-7/IL-24的靶向溶瘤腺病毒在肿瘤治疗中
的研究的开题报告
题目:携带mda-7/IL-24的靶向溶瘤腺病毒在肿瘤治疗中的研究
摘要:肿瘤治疗常常会出现一些副作用,如对正常细胞的损伤和化疗抗药性等问题,而目前的治疗方法也很难攻克这些问题。
溶瘤疗法是一种新兴的治疗肿瘤的方法,其利用病毒的导向和杀伤能力,使癌细胞死亡,并且可以诱导抗肿瘤免疫应答,具有较好的治疗效果。
本研究旨在构建携带mda-7/IL-24的靶向溶瘤腺病毒并评估其在肿瘤治疗中的疗效和安全性。
研究方法:本研究将通过基因工程技术,将mda-7/IL-24基因植入溶瘤腺病毒中,制备携带mda-7/IL-24的靶向溶瘤腺病毒。
通过体外实验,评估溶瘤病毒对癌细胞的杀伤作用和携带mda-7/IL-24的靶向溶瘤病毒对癌细胞的生长抑制作用。
然后,进行体内实验,并将携带mda-7/IL-24的溶瘤腺病毒直接注射到小鼠的肿瘤中,评估其对肿瘤的治疗效果。
预期结果:本研究预期将成功构建携带mda-7/IL-24的靶向溶瘤腺病毒,并证实其在体外和体内对癌细胞的杀伤作用和生长抑制作用。
此外,还将评估其在肿瘤治疗中的安全性和效果,并探讨其作用机制。
意义:该研究所构建的携带mda-7/IL-24的靶向溶瘤腺病毒有望作为一种新的肿瘤治疗方法,改善传统治疗方法所存在的问题,提高肿瘤治疗的疗效,并减少对正常细胞的损伤,具有广阔的临床应用前景。
葡萄膜黑色素瘤患者经过I125短程放疗法后虹膜和前房角新生血管形成

葡萄膜黑色素瘤患者经过I125短程放疗法后虹膜和前房角新生血管形成Detorakis E.T.;Engstrom Jr. R.E.;Wallace R.;Straatsma B.R.;王海燕【期刊名称】《世界核心医学期刊文摘:眼科学分册》【年(卷),期】2005(000)007【摘要】Purpose: Iris neovascularization (INV) and anterior chamber angle neovascularization after radiotherapy for uveal melanoma may lead to neovascular glaucoma and enucleation. However, neovascularization of the anterior ocular segment may respond favorably to treatment with panretinal photocoagulation. The purpose of this study was to evaluate the frequency, interval to development, and predisposing factors of anterior ocular segment neovascularization following iodine 125 (I125)- brachytherapy for uveal melanoma. Design: Retrospective, interventional, consecutive case series. Participants: Sixty- five patients (65 eyes), consecutively treated with I125 brachytherapy for uveal melanoma from 1995 through 2000 and followed up after radiation therapy for 24 months or more. Methods: Clinical findings and ultrasonography characteristics as well as treatment parameters were analyzed. Main Outcome Measures: The frequency of INV was determined and the interval to development of INV as well as the predisposing factors were analyzed statistically. Results: In 15 of 65 eyes (23% ), INV was detected after I125 brachytherapy at a mean± standard deviation of 26.66± 11.63 months (median, 24 months; range, 9-48 months). Risk factors displaying the stronger correlation with INV were greater maximal tumor height (P< 0.01), greater tumor vascularity (P< 0.01), and disinsertion of horizontal rectus muscles (P=0.01). Conclusions: After I125 brachytherapy for choroidal melanoma, INV developed in 23% of eyes and was correlated with larger tumor size, greater tumor vascularity, and disinsertion of a horizontal rectus muscle.【总页数】2页(P60-61)【作者】Detorakis E.T.;Engstrom Jr. R.E.;Wallace R.;Straatsma B.R.;王海燕【作者单位】Department of Ophthalmology Univ. Hospital of Alexandroupolis Alexandroupolis Thrace Greece【正文语种】中文【中图分类】R739.7【相关文献】1.频域眼前节光学相干断层扫描仪(AS-OCT)对激光周边虹膜切开术后患者前房角结构定量检测 [J], 朱丹;马晓昀;刘林;邹俊2.晶状体手术对增生型糖尿病视网膜病变患者玻璃体切割术后虹膜新生血管形成的影响 [J], 李明武;黎晓新;姜燕荣;鲍永珍3.Ⅱ型糖尿病患者虹膜新生血管形成的危险因素分析 [J], 韩龙辉;李志红;牟国营4.短程兰索拉唑、克拉霉素和阿莫西林三联疗法根除幽门螺杆菌在东南亚患者中的疗效——5日一日三次疗法和7日一日两次疗法 [J],5.焦点解决短程疗法对脑卒中后抑郁患者情绪的影响研究 [J], 余思思;李云;蔡敏克因版权原因,仅展示原文概要,查看原文内容请购买。
葡萄膜恶性黑色素瘤治疗新进展

葡萄膜恶性黑色素瘤治疗新进展唐飞;甘露;何为民【摘要】葡萄膜恶性黑色素瘤(uveal melanoma,UM)是成人最常见的原发性眼内恶性肿瘤.虽然目前治疗手段多种多样,眼球摘除术仍是本病的传统治疗,但手术摘除眼球并不能完全控制肿瘤的远处转移.对于伴全身转移的患者,据30a来的统计,生存率仍很低.近年来许多研究致力于靶向治疗、免疫治疗、放射治疗,并取得了可喜的效果,本文对相关研究进行综述.【期刊名称】《国际眼科杂志》【年(卷),期】2017(017)002【总页数】5页(P254-258)【关键词】葡萄膜恶性黑色素瘤;靶向治疗;免疫治疗;放射治疗【作者】唐飞;甘露;何为民【作者单位】611731,中国四川省成都市,四川大学华西医院上锦南府医院眼科;610041,中国四川省成都市,中航工业成都363医院眼科;610041,中国四川省成都市,四川大学华西医院眼科【正文语种】中文引用:唐飞,甘露,何为民.葡萄膜恶性黑色素瘤治疗新进展.国际眼科杂志2017;17(2):254-258葡萄膜恶性黑色素瘤(uveal melanoma,UM)是成人常见的原发性眼内恶性肿瘤,如能在肿瘤转移前诊断并局部治疗,5a生存率大于90%[1]。
不幸的是,大约有50%患者诊断时已伴全身转移,最常见转移至肝脏,其次为肺,再次为骨骼[2],导致这部分患者的中位生存时间在2~15mo[3]。
传统的治疗手段包括眼球摘除、肿瘤局部切除、激光光凝。
眼球摘除造成视力剥夺并影响外观;肿瘤局部切除复生率和转移率相对较高;激光光凝的有效性欠佳,临床较少使用。
目前新型的治疗手段有靶向治疗、免疫治疗、放射治疗。
靶向治疗是指以标准化的生物标记物来识别是否存在某种疾病特定的控制肿瘤生长的基因或基因谱,以此确定针对特异性靶点的治疗方法。
UM已发现的主要靶向位点有:BAP1、GNAQ/GNA11、IGF-1、VEGF 、C-kit 基因等[4]。
1.1 BAP1 BAP1(basic assembler program 1)是一个肿瘤抑制基因,编码一种组蛋白H2A泛素水解酶,调节细胞分化、细胞周期阻滞和DNA修复[5-6]。
靶向SF3B1突变型葡萄膜黑色素瘤的药物筛选

葡萄膜黑色素瘤(UM )起源于眼部葡萄膜的黑色素细胞。
目前,放射疗法和手术切除是治疗原发性葡萄膜黑色素瘤的有效手段。
但是,超过一半的患者会发展成为转移性葡萄膜黑色素瘤,对于转移性的葡萄膜黑色素瘤患者,化疗和免疫疗法效果并不理想,患者的中位生存期只有6~12月[1,2]。
SF3B1基因编码小核糖核蛋白snRNP 的一个重要亚基,参与mRNA 剪接的早期阶段。
SF3B1突变蛋白识别异常的分支位点,导致异常的可变剪接模式[3,4]。
SF3B1基因在葡萄膜黑色素瘤中的突变率高达20%[5],并且与中等程度的恶性转移相关[6,7]。
SF3B1突变相关的异常剪接模式提示剪切体有可能成为肿瘤治疗的靶标[8],与正常细胞相比,携带SF3B1突变的肿瘤细胞有可能对剪接体抑制剂更为敏感[9-12]。
已有研究发现靶向SF3B1的剪切体抑制剂E7107和H3B-8800对携带剪切因子突变的髓系血液病有更强的的抑制作用[11,13]。
但是,E7107的一期临床试验因存在视觉毒性而中止[13-15]。
目前还没有安全有效的药物靶向SF3B1基因发生突变的肿瘤,包括葡萄膜黑色素瘤。
本研究通过CRISPR-Cas9构建SF3B1突变等位基因敲除的葡萄膜黑色素瘤细胞Mel202SF3B1mut-KO#1Screening of drugs that selectively inhibit uveal melanoma cells with SF3B1mutationsLUO Xin 1,REN Chonglu 2,LIU Xiaolian 3,ZHANG Guiming 3,HUANG Sisi 3,YU Le 3,LI Yilei 11Department of Pharmacy,Nanfang Hospital,Southern Medical University,Guangzhou 510515,China;2College of Medical Information Engineering,Guangdong Pharmaceutical University,Guangzhou 510006,China;3School of Pharmaceutical Sciences,Southern Medical University,Guangzhou 510515,China摘要:目的构建SF3B1突变等位基因敲除的人葡萄膜黑色素瘤细胞模型,筛选靶向抑制SF3B1突变型葡萄膜黑色素瘤的药物。
葡萄膜黑色素瘤的药物治疗研究现状

葡萄膜黑色素瘤的药物治疗研究现状郑磊;温佳敏;张国明【期刊名称】《眼科新进展》【年(卷),期】2018(038)002【摘要】葡萄膜黑色素瘤(uveal melanoma,UM)是成人眼内最常见的恶性肿瘤,虽然近30a来涌现出许多局部治疗方法,但患者的生存率一直无明显改善,主要原因是缺乏UM的治疗药物,尤其是抑制转移的药物.国外学者针对UM的药物治疗已经开展了大量的临床试验,我国目前仍然采用传统的眼球摘除术治疗UM,缺乏相应的临床药物研究.本文对国内外开展的UM临床药物试验展开综述,以期为眼科医师或肿瘤科医师提供治疗UM的新思路.%Uveal melanoma (UM) is the most common primary intraocular malignancy in adults.Despite the availability of local treatment modalities,the survival rates of patients with UM have not improved in 30 years.And the main reason is lack of therapeutic drugs for UM,especially agents that inhibit tumor metastasis.Foreign researchers have carried out extensive clinical trials on the agents,but traditional ocular enucleation has been performed for the treatment of UM without any clinical drug tests in China.This paper will give a review on these clinical trials abroad,hoping to provide insight in the treatment of UM for domestic ophthalmologists and oncologist.【总页数】5页(P188-192)【作者】郑磊;温佳敏;张国明【作者单位】518040广东省深圳市,深圳市眼科医院,深圳眼科学重点实验室,深圳大学眼视光学院;510060广东省广州市,眼科学国家重点实验室,中山大学中山眼科中心;518040广东省深圳市,深圳市眼科医院,深圳眼科学重点实验室,深圳大学眼视光学院【正文语种】中文【中图分类】R773【相关文献】1.突发性聋的分型及药物治疗研究现状 [J], 文艺;吕萍;石敏;胡一勇;张雪迎;冯勃2.基于进食策略的帕金森病非药物治疗的研究现状 [J], 李琴;万雪莉;宋彩萍;江玲;马蓉;宋晶3.药物治疗幽门螺旋杆菌及其多药耐药性的研究现状及发展趋势 [J], 薛宇;朱艳丽;张晨晨;高家福;谭雨薇4.慢性失眠临床诊断与药物治疗研究现状 [J], 李雁鹏;赵正卿;王雯雯;庄建华;赵忠新5.基于交感神经系统的高血压非药物治疗研究现状和进展 [J], 叶鹏;谭兴;冷岳奇;王杨凯;王伟忠因版权原因,仅展示原文概要,查看原文内容请购买。
靶向敲除JARID2基因对葡萄膜黑色素瘤细胞生长与转移的影响

靶向敲除JARID2基因对葡萄膜黑色素瘤细胞生长与转移的影响刘博;邱纯;李鹏;毕建军;吴晴;钮蓓蓓【期刊名称】《上海交通大学学报(医学版)》【年(卷),期】2015(035)005【摘要】目的探讨JARID2基因在葡萄膜黑色素瘤细胞生长和转移中的作用.方法采用real-time PCR检测葡萄膜黑色素瘤细胞系OM431和SP6.5中JARID2 mRNA的表达.利用shRNA敲除OM431和SP6.5的JARID2基因,构建稳定转染细胞系shSP6.5和shOM431,Western blotting检测JARID2蛋白表达变化,观察靶向敲除JARID2基因对葡萄膜黑色素瘤细胞生长、转移及体外克隆形成的影响.结果 OM431和SP6.5细胞中JARID2 mRNA呈过表达.Western blotting检测结果显示:与OM431和SP6.5细胞比较,shOM431和shSP6.5细胞中JARID2蛋白表达显著减少.靶向敲除JARID2基因的葡萄膜黑色素瘤细胞的生长受到抑制,细胞转移数量减少,体外克隆形成率降低.结论 JARID2基因在葡萄膜黑色素瘤细胞的生长、转移和克隆形成能力中起着重要的作用.【总页数】5页(P642-646)【作者】刘博;邱纯;李鹏;毕建军;吴晴;钮蓓蓓【作者单位】上海交通大学医学院附属新华医院科研中心,上海200092;上海交通大学医学院附属第九人民医院眼科实验室,上海200011;上海交通大学医学院附属第九人民医院眼科实验室,上海200011;上海交通大学医学院附属第九人民医院眼科实验室,上海200011;上海交通大学医学院附属第九人民医院眼科实验室,上海200011;上海交通大学医学院附属第九人民医院眼科实验室,上海200011;上海交通大学医学院附属新华医院科研中心,上海200092【正文语种】中文【中图分类】R73-3【相关文献】1.miR-137基因转染对人眼葡萄膜黑色素瘤细胞侵袭能力的影响及机制 [J], 陈俊杰;郑娜芬;叶梓莹;林俊汕;区瑞章;曾宇婷2.MiR-127-3p靶向MAPK4对葡萄膜黑色素瘤细胞增殖、凋亡、迁移和侵袭的影响 [J], 魏丽; 连红梅; 刘鹏; 刘兴华; 吴书一; 刘萌萌3.MiR-127-3p靶向MAPK4对葡萄膜黑色素瘤细胞增殖、凋亡、迁移和侵袭的影响 [J], 魏丽; 连红梅; 刘鹏; 刘兴华; 吴书一; 刘萌萌4.miR-204-5p靶向JARID2调控葡萄膜黑色素瘤细胞增殖侵袭迁移的机制 [J], 马宇; 周利晓; 刘意; 武卫5.抑制整合素α9基因的表达对黑色素瘤细胞B16F1的生长和肺转移的影响 [J], 孙思文;王海明;康世钧;罗荣城因版权原因,仅展示原文概要,查看原文内容请购买。
重视对葡萄膜黑色素瘤侵袭转移机制的研究

重视对葡萄膜黑色素瘤侵袭转移机制的研究李彬;张旭【期刊名称】《中华实验眼科杂志》【年(卷),期】2012(030)009【摘要】葡萄膜黑色素瘤(UM)是成人眼内最常见的恶性肿瘤.肿瘤组织浸润侵袭性强,易经血行途径发生转移,转移后临床预后较差.UM转移存在多种途径,目前认为与染色体异常、基因表达异常、细胞因子及信号转导通路调控异常等有关.通过对UM临床病理学特征及其侵袭转移机制进行研究,寻求检测UM早期转移的标志物及可能的治疗靶点,进行有效地监测和干预,对于提高患者生存率以及UM的防治水平具有重要意义.%Uveal melanoma(UM) is the most common primary intraocular malignant tumor in adults,which is tend to metastasize.The mortality of the patients with the metastatic tumor is very high.The mechanism of the UMmetastasis is associated with genesmutation,cytokine,protein expression abnormality and regulation abnormality of signal transduction pathways.Some research about the mechanism of the UM metastasis is carring out to find the early metastatic marker and potential therapeutic target point,so that the tumor can be detected early and prevented.It will be very important for us to increase the survival rate and improve the life quality of UM patients.【总页数】5页(P769-773)【作者】李彬;张旭【作者单位】100730北京,首都医科大学附属北京同仁医院北京同仁眼科中心北京市眼科研究所北京市眼科学与视觉科学重点实验室;100730北京,首都医科大学附属北京同仁医院北京同仁眼科中心北京市眼科研究所北京市眼科学与视觉科学重点实验室【正文语种】中文【相关文献】1.骨桥蛋白在不同侵袭转移潜能葡萄膜黑色素瘤中的表达及意义 [J], 张旭;顼晓琳;李彬;高飞;张志豹;李亮2.骨桥蛋白在不同侵袭转移潜能葡萄膜黑色素瘤中的表达及意义 [J], 张旭;顼晓琳;李彬;高飞;张志豹;李亮3.重视对葡萄膜黑色素瘤侵袭转移机制的研究 [J], 李彬;张旭4.miRNA-19对葡萄膜黑色素瘤细胞增殖、凋亡、迁移和侵袭的影响及其机制研究 [J], 李珂;项奕5.马钱子碱诱导人葡萄膜黑色素瘤细胞凋亡影响及作用机制研究 [J], 史雪丽;陈婷;苏胜;张丽娟因版权原因,仅展示原文概要,查看原文内容请购买。
葡萄膜黑色素瘤的诊断与治疗进展

葡萄膜黑色素瘤的诊断与治疗进展
彭秀军
【期刊名称】《国外医学:眼科学分册》
【年(卷),期】1991(015)005
【摘要】葡萄膜黑色素瘤是一种发病率较高的眼部恶性肿瘤,其病因目前尚未十分了解。
近年由于诊疗方法的进步,本病治愈率及存活串已有很大提高。
超声波检查、荧光血管造影和放射性同位素诊断技术已逐步广泛地应用于临床。
患眼摘除术已不是唯一的治疗手段。
放射疗法和光化学疗法等对肿瘤有较好的治疗作用。
综合治疗有更多的优点。
至于器官保留治疗法的效果还需进一步的临床研究。
【总页数】6页(P299-304)
【作者】彭秀军
【作者单位】无
【正文语种】中文
【中图分类】R739.705
【相关文献】
1.GNAQ/GNA11突变在葡萄膜黑色素瘤中的研究进展 [J], 郑磊
2.GNAQ/GNA 11突变在葡萄膜黑色素瘤中的研究进展 [J], 郑磊(综述); 张国明(审校)
3.非编码RNA对葡萄膜黑色素瘤发生机制影响研究新进展 [J], 李冠瑜; 孙丰源
4.葡萄膜黑色素瘤的放疗方法及其并发症的临床研究进展 [J], 蒋梦婷; 王海青
5.葡萄膜黑色素瘤分子预后指标的研究进展 [J], 张瑞恒;李洋;魏文斌
因版权原因,仅展示原文概要,查看原文内容请购买。
MicroRNA在葡萄膜恶性黑色素瘤中的研究进展

MicroRNA在葡萄膜恶性黑色素瘤中的研究进展李云燕;邵毅;高桂平【期刊名称】《眼科新进展》【年(卷),期】2016(36)5【摘要】恶性黑色素瘤恶性程度高,易经血流转移,是成年人中最多见的一种恶性眼内肿瘤,其发生发展涉及到多步骤的分子生物学机制,包括原癌基因和抑癌基因的遗传和表观遗传学改变.因此研究参与此过程的分子机制能为肿瘤的有效治疗提供有益的见解.微小核糖核酸(microRNA,miRNA)是一类长约22个核苷酸的非编码单链小分子RNA,在各种生理病理过程中发挥了重要作用,最新的研究发现,异常表达的microRNA参与了葡萄膜恶性黑色素瘤众多的病理过程.本文综述了microRNA 的发现、形成及作用机制,葡萄膜恶性黑色素瘤中microRNA的异常表达及其可能机制,microRNA与葡萄膜恶性黑色素瘤的发生与增殖、侵袭和转移以及microRNA在葡萄膜恶性黑色素瘤中的临床应用价值.【总页数】4页(P485-488)【作者】李云燕;邵毅;高桂平【作者单位】330006江西省南昌市,南昌大学第一附属医院眼科;330006江西省南昌市,南昌大学第一附属医院眼科;330006江西省南昌市,南昌大学第一附属医院眼科【正文语种】中文【相关文献】1.端粒酶在葡萄膜恶性黑色素瘤中的表达及意义 [J], 程浩;夏阳;刘敏;吴中耀2.葡萄膜恶性黑色素瘤肿瘤标志物研究进展 [J], 史雪辉;魏文斌3.葡萄膜恶性黑色素瘤中血管内皮生长因子水平与肿瘤转移的关系 [J], 白惠玲;刘勤;文瑾;吴小玲4.GNAQ/GNA11突变在葡萄膜黑色素瘤中的研究进展 [J], 郑磊5.GNAQ/GNA 11突变在葡萄膜黑色素瘤中的研究进展 [J], 郑磊(综述); 张国明(审校)因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中国科学: 生命科学2014年 第44卷 第2期: 151 ~ 157 SCIENTIA SINICA Vitae 引用格式: 刘博, 陈泓宇, 王静宜, 等. 溶瘤腺病毒靶向杀灭葡萄膜黑色素瘤. 中国科学: 生命科学, 2014, 44: 151–157 Liu B, Chen H Y, Wang J Y, et al. Viral therapy using the oncolytic adenovirus H101 to treat uveal melanoma. SCIENTIA SINICA Vitae, 2014, 44:151–157, doi: 10.1360/052013-354《中国科学》杂志社SCIENCE CHINA PRESS中国知名大学及研究院所专栏 上海交通大学医学院专题论 文溶瘤腺病毒靶向杀灭葡萄膜黑色素瘤的实验研究刘博, 陈泓宇, 王静宜, 黄蓉双, 陈颖, 姚玉亭, 宋欣, 徐晓芳, 贾仁兵, 张赫, 葛盛芳*, 范先群*上海交通大学医学院附属第九人民医院眼科, 上海 200011 * 联系人, E-mail: geshengfang@; fanxq@收稿日期: 2013-10-30; 接受日期: 2013-12-02国家自然科学基金(批准号: 81172323, 31200632, 81372469)、上海市科委基础研究重点项目(批准号: 13JC1406202, 12ZR1417300)、上海市浦江人才计划项目(批准号: 13PJ1405700)和国家大学生创新性实验计划项目资助 doi: 10.1360/052013-354摘要 葡萄膜黑色素瘤是成人最严重的原发性恶性肿瘤之一. 传统的治疗方法, 包括手术、放射治疗和化学治疗效果都不是很理想. 溶瘤腺病毒H101, 能够特异性地在p53突变的肿瘤细胞中复制并杀伤肿瘤细胞, 同时对正常细胞影响较少, 且已由中国国家食品药品监督管理总局批准上市. 为了研究H101对葡萄膜黑色素瘤的治疗效果, 通过体外感染葡萄膜黑色素瘤细胞, 发现H101能够显著抑制葡萄膜黑色素瘤细胞的增殖并促进细胞凋亡, 抑制细胞周期, 而对正常的ARPE-19细胞没有影响. 在体内实验中, 建立了SP6.5细胞的荷瘤小鼠模型, 在H101治疗后抑制了肿瘤的生长, 延长了动物寿命. 上述结果表明, 溶瘤腺病毒H101治疗葡萄膜黑色素瘤是一种可行的方法.关键词葡萄膜黑色素瘤 溶瘤腺病毒 H101葡萄膜黑色素瘤(uveal melanoma, UM)是成人最常见的原发性恶性肿瘤之一, 每10万人中就有0.7人发病[1]. UM 起源于眼色素层的色素细胞与神经细胞. 虽然治疗葡萄膜黑色素瘤的手段有所进步, 但全身治疗的高抗性与高转移性导致死亡率仍然居高不下[2,3]. 严重的是, 近50%的葡萄膜黑色素瘤患者为转移性肿瘤[4,5]. 为改善预后, 目前亟需一种新的治疗葡萄膜黑色素瘤的手段.近年来开展了许多基于基因治疗的肿瘤治疗临床试验. 肿瘤抑制性基因治疗、抗血管生成的基因治疗、自杀性基因治疗、修饰性基因治疗和溶瘤腺病毒基因治疗都是常用的治疗肿瘤的手段. 一些靶向基因治疗已经用来治疗皮肤黑色素瘤[6]. 然而, 溶瘤腺病毒治疗UM 的研究报道较少[7~10].随着对病毒认识的加深与分子生物学、基因工程手段的进步, 生产一种相对安全的抗肿瘤的病毒成为了可能. 溶瘤腺病毒正是近年来研究出的用于肿瘤基因治疗的病毒之一[11]. 溶瘤腺病毒H101是人工改造的人5型腺病毒, 该病毒剔除了E3区和E1B 区内55 kD 的片段. 2005年11月由中国国家食品药品监督管理总局批准上市, 目前已有治疗恶性肿瘤的临床报道[12]. E1B 区内55 kD 蛋白的剔除使得H101仅在肿瘤细胞中复制, 而在正常细胞中无法复制. 在缺少的E3区78.3~85.8 μm 基因片段中, 包含了腺病毒致死蛋白和病毒复制增强子, 这种改造降低了腺病毒的毒性, 保证了体内外的安全性. 本课题组前期刘博等: 溶瘤腺病毒靶向杀灭葡萄膜黑色素瘤152工作已研究溶瘤腺病毒H101与达卡巴嗪、长春新碱等化疗药物的联合治疗效果[13,14].本研究尝试探索溶瘤腺病毒H101治疗葡萄膜黑色素瘤的效果, 检测细胞的增殖, 凋亡情况. 在体内实验中观察H101对荷瘤小鼠(Mus musculus )肿瘤的治疗效果.1 材料与方法1.1 细胞系与细胞培养人葡萄膜黑色素瘤细胞株SP6.5, VUP, OCM1和OM431由John F. Marshall 教授(Tumor Biology Laboratory, Cancer Research UK Clinical Center, John Vane Science Centre, 伦敦, 英国)惠赠[15]. 人视网膜色素上皮细胞株ARPE-19由上海交通大学附属瑞金医院眼科惠赠. 人葡萄膜黑色素瘤细胞株SP6.5, VUP, OCM1和OM431采用含10%FBS(fetal bovine serum)的DMEM(Dulbecco’s modified Eagle’s medium)培养基培养, 人视网膜色素上皮细胞株ARPE-19采用含有10%FBS 的DMEM/F12(Dulbecco’s modified Eagle’s medium: nutrient mixture F-12)培养基培养, 置于5%CO 2细胞培养箱中37℃培养.1.2 病毒感染重组人5型腺病毒注射液(H101)购于上海三维生物技术有限公司, 并依据公司推荐条件保藏. H101删除了E1B 区编码55 kD 蛋白的序列和E3区78.3~85.8 μm 的基因片段.细胞接种于6孔或12孔板, 37℃培养过夜. 第2天, 换成无血清培养液, 实验组加入H101(MOI (multiplicity of infection)=10, 50, 100, 200), 对照组加入磷酸缓冲液(phosphate buffer solution, PBS). 2 h 后, 加入等量的20%血清培养液使得血清终浓度恢复到10%.1.3 细胞增殖在处理后的1~4天用CCK-8法(Dojindo, 日本)检测细胞相对存活率, 方法同本课题组前期研究[16].1.4 细胞周期与凋亡检测在感染H101的48 h 后收集细胞, 用70%的冰乙醇固定, 4℃过夜. 第2天, 用预冷的PBS 清洗细胞2次, 室温碘化丙啶(propidium iodide, PI)染色15 min. 流式细胞仪检测细胞周期.参照操作说明用Annexin V FITC 凋亡检测试剂盒(BD Bioscience, 美国)和流式细胞仪(Becton Dick- inson, 美国)检测细胞凋亡.1.5 蛋白印迹收集细胞并用预冷的PBS 清洗2次. 加入RIPA(radio immunoprecipitation assay)蛋白裂解液, 离心去除沉淀后用BCA 试剂盒(Pierce Biotechnology, 美国)测定蛋白浓度. 蛋白样品由12% SDS-PAGE (sodium dodecyl sulfate polyacrylamide gel electro- phoresis)胶分离, 使用Bio-Rad 蛋白转印系统(Bio- Rad Laboratories, 美国)转印到PVDF(polyvinylidene fluoride)膜上. PVDF 膜用含有5%脱脂奶粉的TBS (Tris-buffered saline)封闭1 h, 之后一抗孵育过夜. 蛋白条带由Odyssey 红外成像系统(LI-COR, 美国)分析.1.6 PCR参照操作手册使用Applied Biosystems 7500 RT-PCR machine (Applied Biosystems, 美国)与SYBR Premix Ex Taq(TaKaRa, 日本)检测hexon 基因在细胞中的表达情况. hexon [17]上游引物: 5′-TAACCAGTC- ACAGTCGCAAG-3′; 下游引物: 5′-GTCAAAGTAC- GTGGAAGCCAT-3′. GAPDH [10]上游引物: 5′-GGAT- TTGGTGGTATTGGG-3′; 下游引物: 5′-GGAAGAT- GGTGATGGGATT-3′.反应结束后用分析软件以∆∆C t relative quantit- ation 法分析结果, 以GADPH 作为内参. 设定SP6.5+ H101组为100%, 计算其他组较SP6.5+H101组的hexon 基因相对表达率.使用Ex Taq Mix(TaKaRa, 日本)在GeneAmp PCR System 7900(Applied Biosystems, 美国)进行RT-PCR 反应, 引物和检测对象同上, 反应条件为94℃ 5 min; 94℃ 30 s, 62℃ 30 s, 72℃ 30 s, 30个循环; 72℃ 10 min. 反应产物琼脂糖凝胶(浓度为1%)电泳检测, 凝胶成像系统分析.1.7 H101体内抗肿瘤实验皮下注射1×107个SP6.5细胞到裸鼠右侧腹下, 制作荷瘤小鼠模型. 为研究溶瘤腺病毒H101的抗瘤效果, 荷瘤小鼠被随机分配到两组, 每组8只. 对小中国科学: 生命科学 2014年 第44卷 第2期153鼠身上的肿瘤分别注射H101和PBS. 首次注射后每2天注射1次, 共注射10次. 从注射当天开始, 每2天用游标卡尺测量肿瘤的长径(A)和短径(B), 皮下肿瘤体积(tumour volume, TV)的计算公式为TV=0.5 ×A×B 2, 根据测量结果计算出肿瘤体积, 并持续观察裸鼠生存状态.1.8 数据统计分析所有细胞有关实验都至少重复3次, 数值以x ±SD 表示, 利用SPSS 19.0软件进行数据统计分析.两组之间差异采用Student’s t -test 双尾检验, 当P <0.05时认为两组间差异显著.2 结果2.1 葡萄膜黑色素瘤对H101的不同敏感度 为了研究UM 细胞对溶瘤腺病毒H101的敏感度, 分别加入MOI 为10, 50, 100和200的病毒感染细胞. 在感染的72 h 后检测细胞存活率(图1), 发现OCM-1和OM431细胞对溶瘤腺病毒相对不敏感, 而SP6.5和VUP 相对敏感. H101的毒性在SP6.5和VUP 细胞中要高于OCM-1和OM431细胞. 在MOI=100或200时, 病毒对UM 细胞的杀伤几乎没有差异. 为了更好地研究H101治疗肿瘤的分子机制, 选择对病毒相对图1 葡萄膜黑色素瘤细胞对溶瘤腺病毒H101的敏感度以MOI 分别为10, 50, 100和200处理细胞, 72 h 后CCK-8法检测细胞存活率. 数据代表3次独立实验的结果. SP6.5和VUP 细胞与OCM-1和OM431细胞相比, *: P <0.05敏感的SP6.5和VUP 细胞在MOI=50条件下进行后续研究.2.2 H101仅在葡萄膜黑色素瘤细胞中复制而对正常细胞无影响以人正常视网膜色素上皮细胞APRE-19研究H101是否能在正常细胞中复制. 用RT-PCR 和Western blot 检测病毒基因hexon 在细胞中表达情况(图2). 病毒基因hexon 在UM 细胞中高表达而在ARPE-19细胞中几乎没有表达. 上述结果表明, H101特异性感染肿瘤细胞而对正常细胞没有影响.2.3 细胞周期阻滞为了研究UM 细胞凋亡的机制, 用PI 染色的方法检测了SP6.5和VUP 细胞的周期变化. 48 h 时, H101感染过的细胞有明显的S 期阻滞的现象. S 期占据了将近1/2的周期分布, 同时G1期细胞数量减少. 上述结果表明, S 期可能是病毒复制期, 因为这也是细胞的DNA 复制期.2.4 H101促进葡萄膜黑色素瘤细胞凋亡用Annexin V-FITC 凋亡检测试剂盒和流式细胞仪检测UM 细胞凋亡情况(图3). 72 h 时, H101感染的细胞凋亡细胞数约为对照组的3倍. 在SP6.5细胞中, 凋亡率由5.48%提高到17.02%, 在VUP 细胞中, 凋亡率由4.07%提高到13.79%. 这表明H101显著引起UM 细胞的凋亡.2.5 H101在体内的抗肿瘤效果为了将本研究的发现应用于体内, 制备了SP6.5细胞的荷瘤小鼠. 实验组注射H101, 对照组注射PBS(图4). 与对照组相比, H101治疗组的小鼠肿瘤体积明显较小. H101能够显著地抑制肿瘤的生长. 治疗3周后, H101组肿瘤体积约为PBS 组的1/2. 这说明H101可以在体内抑制肿瘤的生长.3 讨论传统的治疗UM 的方法主要有手术、放射治疗、化学治疗等, 但这些疗法都有一定的局限性, 并且不是特别的有效[3,14,18]. 溶瘤病毒治疗癌症已有百余年的历史, 1912年, DePace [19]首次报道了他的开创性工作, 他们发现在接种减毒狂犬病疫苗后, 宫颈癌瘤体刘博等: 溶瘤腺病毒靶向杀灭葡萄膜黑色素瘤154出现消退. 一个世纪以来, 对溶瘤病毒的研究不断深入, 且有了长足进步, 带有治疗性基因的溶瘤病毒已经能够治疗包括人黑色素瘤、脑瘤等多种肿瘤, 且获得了很好的疗效[20~25].溶瘤腺病毒能够特异性感染并杀伤肿瘤细胞而不感染正常细胞. 过去, 由于技术原因难以获得足够的病毒滴度用于临床治疗. 随着分子生物学与基因工程手段的进步, 病毒的基因组已经能被改造, 能够剔除病毒致病区同时插入增强溶瘤能力的基因[19]. 2005年, 溶瘤腺病毒注射液(H101)由中国国家食品药品监督管理总局批准在中国上市, 成为世界上首个正式进入临床应用的溶瘤病毒制剂[20]. 在临床试验中, 对头颈部鳞状细胞癌、神经胶质瘤和卵巢癌等肿瘤均有较好的疗效和较高的安全性[26]. H101是人重组5型腺病毒, 其删除了E1B 区55 kD 片段使其只能在p53突变的肿瘤细胞中复制[25]. 前期研究证实本课题组使用的UM 细胞均为p53突变型[9]. 本研究发现, 在MOI=50时, H101对UM 具有治疗效果. 对于p53突变的SP6.5和VUP 细胞有显著的杀伤作用, 而对正常细胞ARPE-19几乎没有影响(图2). RT- PCR 和Western blot 的结果也表明, 同ARPER-19细胞相比, H101对SP6.5和VUP 细胞具有明显抑制生长的作用. 由此可见, H101治疗肿瘤在体外是相对安全的.溶瘤腺病毒的复制依赖细胞周期, 并且更倾向于在S 期. 因此, 宿主细胞的S 阻滞更有利于病毒的图2 H101感染后细胞的相对生存率与病毒复制情况A: 在MOI=50时细胞的相对存活率; B: 病毒感染72 h 后RT-PCR 病毒晚期基因hexon 表达情况; C: 72 h 后RT-PCR 检测hexon 基因表达情况; D: 72 h 后Western blot 检测和hexon 蛋白表达情况. SP6.5 vs. SP6.5-H101, VUP vs. SP6.5-H101, ARPE-19 vs. SP6.5-H101, ARPE-19-H101 vs.SP6.5-H101, *: P <0.05; **: P <0.01中国科学: 生命科学 2014年 第44卷 第2期155图3 H101感染SP6.5和VUP 细胞后导致细胞周期阻滞与凋亡A: 流式细胞仪检测SP6.5和VUP 细胞发生细胞周期阻滞, PI 染色. 两株细胞都有明显的S 期阻滞现象; B: 用Annexin V FITC 凋亡检测试剂盒检测SP6.5和VUP 细胞的凋亡情况. 在H101感染后凋亡明显增加. *: P <0.05; **: P <0.01; ***: P <0.001图4 H101在荷瘤小鼠体内抗肿瘤的效果皮下肿瘤由注射SP6.5细胞至裸鼠体内产生肿瘤(8只). 数据以x±SD 表示. ***: P <0.001复制. 在p53突变的细胞中, 一些依赖p53途径的细胞周期调节因子, 如视网膜母细胞瘤蛋白(retinoblas- toma protein)和有丝分裂阻滞缺失样蛋白2(mitotic arrest deficient-like 2)的变化导致了细胞周期阻滞[27]. 这可能解释了H101感染后细胞S 期阻滞的现象. 而凋亡的增加可能是由于病毒在UM 细胞中复制增加而导致的.基于体外实验的结果, 为了探索H101在体内的效果, 制备了SP6.5细胞荷瘤小鼠, 并按期注射H101. 体内实验表明, 在持续大剂量注射H101病毒注射液情况下, H101治疗组的异体瘤的生长速度明显低于对照组.综上所述, 溶瘤腺病毒H101在体外能够特异性杀伤肿瘤细胞, 引起细胞凋亡, 阻滞细胞周期, 在体内治疗中能够抑制肿瘤生长. 溶瘤腺病毒H101是一种治疗葡萄膜黑色素瘤的潜在有效的方法, 但在如何降低使用剂量, 提高病毒感染效率方面仍需进一步研究.刘博等: 溶瘤腺病毒靶向杀灭葡萄膜黑色素瘤参考文献1Hentrich H, Kaiser R, Gottsberger G. Floral biology and reproductive isolation by floral scent in three sympatric aroid species in French Guiana. Plant Biol, 2010, 12: 587–5962Singh A D, Turell M E, Topham A K. Uveal melanoma: trends in incidence, treatment, and survival. Ophthalmology, 2011, 118: 1881–18853Triozzi P L, Eng C, Singh A D. Targeted therapy for uveal melanoma. Cancer Treat Rev, 2008, 34: 247–2584Bedikian A Y. Metastatic uveal melanoma therapy: current options. Int Ophthalmol Clin, 2006, 46: 151–1665Kujala E, Mäkitie T, Kivelä T. Very long-term prognosis of patients with malignant uveal melanoma. Invest Ophthalmol Vis Sci, 2003, 44: 4651–46596Shields C L, Shields J A. Ocular melanoma: relatively rare but requiring respect. Clin Dermatol, 2009, 27: 122–1337Alizadeh H, Howard K, Mellon J, et al. Reduction of liver metastasis of intraocular melanoma by interferon-beta gene transfer. Invest Ophthalmol Vis Sci, 2003, 44: 3042–30518Andrawiss M, Maron A, Beltran W, et al. Adenovirus-mediated gene transfer in canine eyes: a preclinical study for gene therapy of human uveal melanoma. J Gene Med, 2001, 3: 228–2399Huang X, Jia R, Zhao X, et al. Recombinant oncolytic adenovirus H101 combined with siBCL2: cytotoxic effect on uveal melanoma cell lines. Brit J Ophthalmol, 2012, 96: 1331–133810Zhou Y, Song X, Jia R, et al. Radiation-inducible human tumor necrosis factor-related apoptosis-inducing ligand (TRAIL) gene therapy: a novel treatment for radioresistant uveal melanoma. Pigment Cell Melanoma Res, 2010, 23: 661–67411Song X, Zhou Y, Jia R, et al. Inhibition of retinoblastoma in vitro and in vivo with conditionally replicating oncolytic adenovirus H101.Invest Ophthalmol Vis Sci, 2010, 51: 2626–263512Yu W, Fang H. Clinical trials with oncolytic adenovirus in China. Curr Cancer Drug Targets, 2007, 7: 141–14813Cun B, Song X, Jia R, et al. Combination of oncolytic adenovirus and dacarbazine attenuates antitumor ability against uveal melanoma cells via cell cycle block. Cancer Biol Ther, 2012, 13: 77–8414Song X, Wang H, Jia R, et al. Combined treatment with an oncolytic adenovirus and antitumor activity of vincristine against retinoblastoma cells. Int J Mol Sci, 2012, 13: 10736–1074915Jia R, Jiao Z, Xu X, et al. Functional significance of B7-H1 expressed by human uveal melanoma cells. Mol Med Rep, 2011, 4: 163–167 16Zhang H, Wang H, Zhang J, et al. Enhanced therapeutic efficacy by simultaneously targeting two genetic defects in tumors. Mol Ther, 2009, 17: 57–6417Huang X, Wang L, Zhang H, et al. Therapeutic efficacy by targeting correction of Notch1-induced aberrants in uveal tumors. PLoS One, 2012, 7: e4430118Thomas M A, Spencer J F, Toth K, et al. Immunosuppression enhances oncolytic adenovirus replication and antitumor efficacy in the Syrian hamster model. Mol Ther, 2008, 16: 1665–167319DePace N. Sulla scomparsa di un enorme cancro vegetante del collo dell’utero senza cura chirurgia. Article in Italian. Ginecologia, 1912, 9: 82–8920Martuza R L, Malick A, Markert J M, et al. Experimental therapy of human glioma by means of a genetically engineered virus mutant.Science, 1991, 252: 854–85621Eager R M, Nemunaitis J. Clinical development directions in oncolytic viral therapy. Cancer Gene Ther, 2011, 18: 305–31722Hammill A M, Conner J, Cripe T P. Oncolytic virotherapy reaches adolescence. Pediatr Blood Cancer, 2010, 55: 1253–126323Breitbach C J, Reid T, Burke J, et al. Navigating the clinical development landscape for oncolytic viruses and other cancer therapeutics: no shortcuts on the road to approval. Cytokine Growth Factor Rev, 2010, 21: 85–8924Vasey P A, Shulman L N, Campos S, et al. Phase I trial of intraperitoneal injection of the E1B-55-kd-gene-deleted adenovirus ONYX-015 (dl1520) given on days 1 through 5 every 3 weeks in patients with recurrent/refractory epithelial ovarian cancer. J Clin Oncol, 2002, 20: 1562–156925Chiocca E A, Abbed K M, Tatter S, et al. A phase I open-label, dose-escalation, multi-institutional trial of injection with an E1B-Attenuated adenovirus, ONYX-015, into the peritumoral region of recurrent malignant gliomas, in the adjuvant setting. Mol Ther, 2004, 10: 958–96626Patel M R, Kratzke R A. Oncolytic virus therapy for cancer: the first wave of translational clinical trials. Transl Res, 2013, 161: 355–364 27Cherubini G, Petouchoff T, Grossi M, et al. E1B55K-deleted adenovirus (ONYX-015) overrides G1/S and G2/M checkpoints and causes mitotic catastrophe and endoreduplication in p53-proficient normal cells. Cell Cycle, 2006, 5: 2244–2252156中国科学: 生命科学 2014年第44卷第2期Viral Therapy Using the Oncolytic Adenovirus H101 to Treat Uveal Melanoma LIU Bo, CHEN HongYu, WANG JingYi, HUANG RongShuang, CHEN Ying, YAO YuTing, SONG Xin, XU XiaoFang, JIA RenBing, ZHANG He, GE ShengFang & FAN XianQunDepartment of Ophthalmology, Ninth People’s Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai 200011, China Uveal melanoma is the most serious primary intraocular malignancy in adults. Traditional approaches to treating uveal melanoma, including surgery, radiotherapy and chemotherapy, are insufficient. The oncolytic adenovirus H101 specifically replicates in and kills p53-mutant tumour cells while sparing normal cells and has been approved for use by the China Food and Drug Administration. To investigate the effect of treating uveal melanoma with H101, we infected specific uveal melanoma cell lines in vitro and observed significant cell growth inhibition, apoptosis and cell cycle arrest; the treatment was innocuous in the ARPE-19 normal cell line. In vivo, an intratumoural injection of H101 inhibited tumour growth and prolonged animal survival in the SP6.5 tumour xenograft mouse model. These results indicated that viral therapy using the oncolytic adenovirus H101 is feasible and promising for the treatment of uveal melanoma.uveal melanoma, oncolytic adenovirus, H101doi: 10.1360/052013-354157。
