贮存期注射用单磷酸阿糖腺苷质量稳定性考察
稳定性品种项目表
相对密度
酸碱度
微生物
--
6
聚山梨酯80
性状
颜色
水分
酸碱度
乙二醇与二甘醇、环氧乙烷与二氧六环、脂肪酸组成、内毒素
7
单、双硬脂酸甘油酯
性状
酸值
游离甘油
微生物
皂化值、碘值、水分、含量、脂肪酸组成
8
混合脂肪酸甘油酯
性状
酸值
熔点
微生物
--
9
八角茴香油
性状
含量
旋光度
凝点
微生物
10
精制玉米油
性状
相对密度
酸值
脂肪酸组成
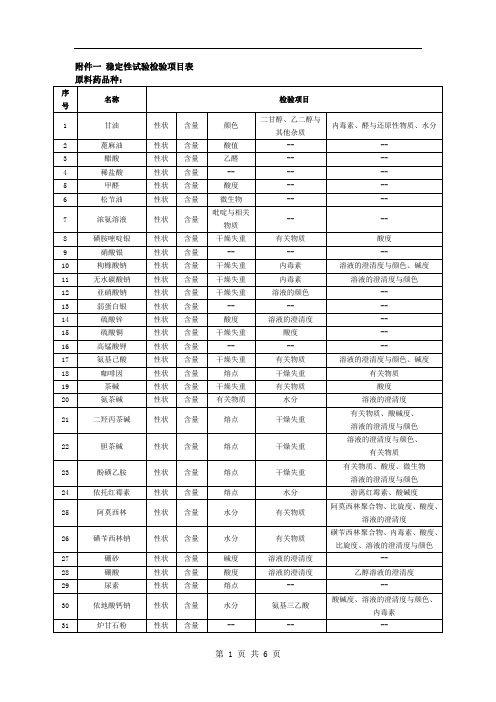
附件一 稳定性试验检验项目表
原料药品种:
序号
名称
检验项目
1
甘油
性状
含量
颜色
二甘醇、乙二醇与其他杂质
内毒素、醛与还原性物质、水分
2
蓖麻油
性状
含量
酸值
--
--
3
醋酸
性状
含量
乙醛
--
--
4
稀盐酸
性状
含量
--
--
--
5
甲醛
性状
含量
酸度
--
--
6
松节油
性状
含量
微生物
--
--
7
浓氨溶液
性状
含量
吡啶与相关物质
--
性状
比旋度
溶液的颜色
内毒素
--
19
乙二胺
性状
含量
液体的颜色
--
--
20
磷酸
性状
含量
溶液的澄清度与颜色
正交实验法优选注射用单磷酸阿糖腺苷的配伍条件

·1221·
样品溶液按中国药典 2010 年版二部微粒检测法中 的光阻法进行不溶性微粒测定 , 每个样品重复测 定5次取平均值。 2.6 样 品 溶 液 pH 稳 定 性 测 定 按照中国药典 2010年版(一部)附录VII G pH测定法检查“2.3”项
中国现代应用药学 2015 年 10 月第 32 卷第 10 期
2.8 2.8.1
。
有关注射用单磷酸阿糖腺苷与溶媒配伍后稳 定性研究目前主要集中于温度、放置时间对稳定 性的影响
[3-4]
,而忽视了溶媒种类、溶媒体积、光
照条件对稳定性的影响。此外,当多因素共同作 用时,其稳定性是否会产生新的变化,也未见相 关报道。本实验采用正交试验,选择温度、光照、 放置时间、溶媒、溶媒用量 5 个影响因素,以单
ABSTRACT: OBJECTIVE To investigate multiple factors on the compatibility stability of Vidarabine Monophosphate for Injection mixed with different solvents. METHODS L18(35) of orthogonal design was used with five factors: temperature, illumination, storage time, solvent and amount of solvent. With the content of vidarabine monophosphate, pH value changes of the compatibility solution and the insoluble particles as indexes, the content of vidarabine monophosphate in the mixture was determined by HPLC, the change of pH value before and after compatibility determined by pHs-2C type precision acidity meter, the insoluble particles were observed by GWJ-4 type particle analyzer. RESULTS There were no significant changes in appearance and character of the mixture in the inspection time. The temperature and time showed significant effects on the contents of vidarabine monophosphate in the mixture, and illumination could influence the number of insoluble particles. The solvent and amount of solvent had no significant influence on all indexes. CONCLUSION The optimal compatibility conditions as follows: temperature of 25 ℃, under the incandescent lights, compatibility time of 4 h, and 100 mL 0.9% sodium chloride injections as the solvent. KEY WORDS: Vidarabine Monophosphate for Injection; compatibility conditions; compatible stability
血管用药注射液持续稳定性考察方案用

血管用药注射液持续稳定性考察方案用摘要血管用药注射液是治疗心脑血管疾病的常用药物,对于药物的持续稳定性和注射方案的合理性是研究的重点。
本文将探讨血管用药注射液持续稳定性考察方案用的相关内容,旨在为相关研究提供参考。
引言血管用药注射液是治疗心脑血管疾病的常用药物,经常出现药物的降解和注射过程中的波动影响,导致药物的质量不稳定。
针对这个问题,研究人员不断地探索药物的持续稳定性,并且设计合理的注射方案,以确保药物在使用过程中的有效性和安全性。
本文将探讨血管用药注射液持续稳定性考察方案用的相关内容。
一、血管用药注射液持续稳定性的研究现状目前,有关血管用药注射液持续稳定性的研究已经取得了不小的进展。
研究人员主要从以下几个方面进行探讨:1. 药物降解药物降解是药物稳定性的关键因素。
许多药物经过注射后容易出现降解现象,导致药物的效力下降。
为了探讨血管用药注射液的持续稳定性,研究人员对药物降解过程进行了研究。
针对药物降解过程,研究人员探索采用控制温度、pH值和氧气含量等手段进行控制,以克服药物降解的问题。
2. 药物波动药物波动主要是由于药物的分布不均匀或者药物的分解过程导致的。
在药物注射液制备和贮存过程中,药物的浓度会发生变化,这就会导致药物在使用时的波动而影响疗效。
研究人员为了克服药物波动的问题,探索采用合适的浓度、贮存方式和注射方案等手段进行控制,保证药物的持续稳定性。
3. 药物贮存药物贮存是药物长期使用过程中必须考虑的因素。
药物的有效性和安全性直接关系到药物在使用过程中的贮存方式。
在现有技术条件下,研究人员主要探讨如何通过控制药物的存储温度、湿度、光照强度和空气质量等因素来保证药物的质量,同时也提出了探索新型抗氧剂来延长药物的贮存期,以克服药物长期储存容易发生质量变化的问题。
二、血管用药注射液持续稳定性考察方案的确定选择合适的考察方案对于研究血管用药注射液持续稳定性的问题非常关键。
下面介绍一些目前常用的考察方案。
兽用化学药物稳定性研究技术指导原则

兽用化学药物稳定性研究技术指导原则一、概述兽用化学药物的稳定性是指原料药及制剂保持其物理、化学、生物学和微生物学的性质,通过对原料药和制剂在不同条件(如温度、湿度、光照等)下稳定性的研究,掌握兽药质量随时间变化的规律,为兽药的生产、包装、运输、贮存条件和有效期的确定提供依据,以确保临床用药的安全性和临床疗效。
稳定性研究是兽药质量控制研究的主要内容之一,与兽药质量研究和质量标准的建立紧密相关。
稳定性研究具有阶段性特点,贯穿兽药研究与开发全的过程,一般始于兽药的临床前研究,在兽药临床研究期间和上市后还应继续进行稳定性研究。
本文为一般性原则,具体的试验设计和评价应遵循具体问题具体分析的原则。
二、稳定性研究的设计要求稳定性研究的设计应根据不同的研究目的,结合原料药的理化性质、剂型的特点和具体的处方及工艺条件进行。
稳定性研究包括影响因素试验、加速试验和长期试验。
原料药需进行影响因素试验、加速试验和长期试验;制剂需进行影响因素试验中的光照试验、加速试验和长期试验。
(一)样品的批次和规模影响因素试验采用1批样品进行,加速试验和长期试验均采用3批样品进行。
稳定性研究应采用一定规模生产的样品,以能够代表规模生产条件下的产品质量。
原料药的合成工艺路线、方法、步骤应与最终生产规模一致;药物制剂的处方、制备工艺、设备也应与最终生产规模一致。
稳定性研究中,原料药的批量应达到中试规模的要求;质量应既代表临床前研究的质量,又能代表临床研究以及规模生产时的质量。
口服固体制剂如片剂、胶囊剂应不少于10000个制剂单位,预混剂、可溶性粉剂不少于200公斤。
大体积包装的制剂(如静脉输液等)批量至少应为各项试验所需总量的10倍。
特殊品种、特殊剂型所需数量,视具体情况而定。
制剂质量应能代表规模生产时的质量。
(二)包装及放置条件稳定性试验要求在一定的温度、湿度、光照条件下进行,应充分考虑到药物在贮存、运输及使用过程中可能遇到的环境因素。
原料药的加速试验和长期试验所用包装应采用模拟小包装,所用材料和封装条件应与大包装一致。
药厂稳定性考察计划方案
2015年度产品稳定性考察方案制定人制定日期审核人审核日期批准人批准日期颁发部门执行日期持续稳定性考察的目的是在有效期内监控已上市药品的质量,以发现药品与生产相关的稳定性问题(如杂质、含量溶出度特性的变化),并确定药品能够在标示的贮存条件下,符合质量标准的各项要求。
为确保患者能够安全,有效的用药和制定产品有效期及储存条件提供科学依据,特制定产品稳定性考察方案,对公司生产的所有品种进行稳定性考察试验。
1 稳定性考察的产品范围1.1持续稳定性考察主要针对市售包装药品;1.2当待包装产品在完成包装前,还需要长期贮存时,应当在相应的环境条件下,评估其对包装后产品稳定性的影响。
1.3贮存时间较长的中间产品也要进行考察。
1.4上市前研发阶段的产品进行全面的稳定性试验,以得到注册所需的所有数据。
2 稳定性考察的批次2.1对每种规格,每种内包装形式,每个生产批量的产品,每年度均应进行稳定性考察。
2.2某些情况下,持续稳定性考察中应当额外增加批次数,如重大变更或生产和包装有重大偏差的药品应列入稳定性考察,除非已经过验证和稳定性考察。
2.3重新加工、返工或回收的批次,应列入考察范围,除非已经过验证和稳定性考察。
3 稳定性考察方法3.1加速试验3.1.1按市售包装,在温度40±2℃、相对湿度75±5%的条件下放置6个月,在试验期间第1个月、2个月、3个月、6个月末取样一次,按稳定性主要考察项目检测。
3.1.2在上述条件下,如6个月内供试品经检测不符合制订的质量标准,则应在中间条件下即在温度30±2℃,相对湿度60±5%的情况下(可用NaNO2饱和溶液,25~40℃,相对湿度64~61.5%)进行加速试验,时间仍为6个月。
3.1.3对温度特别敏感的药物,预计只能在冰箱中(4~8℃)保存,这种药物的加速试验,可在温度25±2℃、相对湿度60±10%的条件下进行,时间为6个月。
XXXXXX注射液(批号:xxxxxxxx)持续稳定性考察总结报告

持续稳定性考察总结报告考察品种:XXXXX脸射液考察批号:XXXXXXXX考察周期:XXX对XX月XX日至XXX)# XX月XX日1. 留样考察批号:xxxxxxxx。
2. 留样包装:安甑装;5ml/支X 5支/盒。
3. 贮存条件:密封,避光,在阴凉处(不超过20C)保存。
4. 持续稳定性考察检验项目:性状、鉴别(1)、鉴别(2)、检查(pH值、装量、可见异物、不溶性微粒、无菌、热原)、含量测定(XXX素)。
5. 产品有效期:2年6. 持续稳定性考察时限:3年(即产品有效期后1年)。
7. 持续稳定性考察结果及检验数据:(进链接表)8. 稳定性考察结果分析:对以上1个批号产品在稳定性考察期间(0月、3月、6月、9月、12月、18月、24月、30月、36月)各个项目随着时间的变化趋势进行分析,分析情况如下:(暂以批号20100201为例)(1)性状:XXXXXXfe射液一个批号的持续稳定性考察均未发生变化;(2)鉴别①:XXXXX戏射液一个批号的持续稳定性考察均未发生变化;(3)鉴别②:XXXXX戏射液一个批号的持续稳定性考察均未发生变化;(4) pH值趋势图:(见图1)(5)装量:XXXXXXfe射液一个批号的持续稳定性考察均未发生变化;(6)可见异物:XXXXXXt射液一个批号的持续稳定性考察均未发生变化;(7)不溶性微粒:XXXXXXt射液一个批号的持续稳定性考察均未发生变化;(8)无菌:XXXXXXfe射液一个批号的持续稳定性考察均未发生变化;(9)热原:XXXXXXfe射液一个批号的持续稳定性考察均未发生变化;图1:(10)含测:XXX素趋势图:(见图2)图2:0.600.550.500.450.400.350.309. 结果评价:(一)、性状、鉴别①、鉴别②、检查(pH值、装量、可见异物、不溶性微粒、无菌、热原)的结果均未发生变化,质量稳定。
(二八pH值、含测XXX素的测试结果均有轻微波动,这与不同检测仪器、不同检测人员有一定关系,但检验偏差是符合规定的,并且测试结果均符合国家法定质量标准规定范围内。
注射用单磷酸阿糖腺苷国家标准

注射用单磷酸阿糖腺苷Zhusheyong Danlinsuan Atangxian’ganVidarabine Monophosphate for Injection本品为单磷酸阿糖腺苷的无菌冻干品。
按平均装量计算,含单磷酸阿糖腺苷(C10H14N5O7P·H2O)应为标示量的90.0%~110.0%。
【性状】本品为白色或类白色的疏松块状物或粉末;有引湿性。
【鉴别】(1)取本品适量(约相当于单磷酸阿糖腺苷20mg),加6mol/L盐酸溶液2ml 溶解后,加间苯三酚10mg,振摇,置水浴中加热,呈紫红色。
(2)取本品,加0.01mol/L盐酸溶液溶解并稀释制成每1ml中约含单磷酸阿糖腺苷10μg 的溶液,照紫外-可见分光光度法(中国药典2015年版四部通则ⅣA)测定,在258nm的波长处有最大吸收,在230nm的波长处有最小吸收。
(3)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(4)取本品适量(约相当于单磷酸阿糖腺苷0.1g),加无水碳酸钠1g,混匀,灼烧灰化,冷却后加水10ml振摇使溶解,滤过,滤液显磷酸盐的鉴别反应(中国药典2015年版四部通则Ⅲ)。
【检查】酸碱度取本品,加水溶解并稀释制成每1ml中含单磷酸阿糖腺苷4mg的溶液,依法测定(中国药典2015年版四部通则0631),pH值应为6.5~8.0。
溶液的澄清度与颜色取本品1瓶,加水溶解并稀释制成每1ml中含单磷酸阿糖腺苷50mg的溶液,依法检查(中国药典2015年版四部通则0901第一法和0902第一法),溶液应澄清无色;如显色,与黄色或黄绿色3号标准比色液比较,不得更深。
干燥失重取本品,以五氧化二磷为干燥剂,在40℃减压干燥至恒重,减失重量不得过5.0%(中国药典2015年版四部通则0831)。
有关物质取本品,精密称定,加0.01mol/L盐酸溶液溶解并定量稀释制成每1ml中约含0.15mg的溶液,作为供试品溶液;精密量取适量,用0.01mol/L盐酸溶液稀释制成每1ml 中约含0.3μg和0.15μg的溶液,分别作为对照溶液和灵敏度溶液;另取阿糖腺苷对照品、腺嘌呤对照品适量,精密称定,加0.01mol/L盐酸溶液溶解并定量稀释制成每1ml中约含阿糖腺苷与腺嘌呤各0.75μg的溶液,作为对照品溶液。
XXXXXX注射液(批号:xxxxxxxx)持续稳定性考察总结报告

持续稳定性考察总结报告考察品种:XXXXXX注射液考察批号:XXXXXXXX考察周期:XXXX年XX月XX日至XXXX年XX月XX日1.留样考察批号:xxxxxxxx。
2.留样包装:安瓿装;5ml/支×5支/盒。
3.贮存条件:密封,避光,在阴凉处(不超过20℃)保存。
4.持续稳定性考察检验项目:性状、鉴别(1)、鉴别(2)、检查(pH值、装量、可见异物、不溶性微粒、无菌、热原)、含量测定(XXX素)。
5.产品有效期:2年6.持续稳定性考察时限:3年(即产品有效期后1年)。
7.持续稳定性考察结果及检验数据:(进链接表)8.稳定性考察结果分析:对以上1个批号产品在稳定性考察期间(0月、3月、6月、9月、12月、18月、24月、30月、36月)各个项目随着时间的变化趋势进行分析,分析情况如下:(暂以批号20100201为例)(1)性状:XXXXXX注射液一个批号的持续稳定性考察均未发生变化;(2)鉴别①:XXXXXX注射液一个批号的持续稳定性考察均未发生变化;(3)鉴别②:XXXXXX注射液一个批号的持续稳定性考察均未发生变化;(4)pH值趋势图:(见图1)(5)装量:XXXXXX注射液一个批号的持续稳定性考察均未发生变化;(6)可见异物:XXXXXX注射液一个批号的持续稳定性考察均未发生变化;(7)不溶性微粒:XXXXXX注射液一个批号的持续稳定性考察均未发生变化;(8)无菌:XXXXXX注射液一个批号的持续稳定性考察均未发生变化;(9)热原:XXXXXX注射液一个批号的持续稳定性考察均未发生变化;图1:(10)含测:XXX素趋势图:(见图2)图2:9.结果评价:(一)、性状、鉴别①、鉴别②、检查(pH值、装量、可见异物、不溶性微粒、无菌、热原)的结果均未发生变化,质量稳定。
(二)、pH值、含测XXX素的测试结果均有轻微波动,这与不同检测仪器、不同检测人员有一定关系,但检验偏差是符合规定的,并且测试结果均符合国家法定质量标准规定范围内。
血管用药注射液持续稳定性考察方案用

血管用药注射液持续稳定性考察方案用篇1:血管用药注射液持续稳定性考察方案用******注射液持续稳定性考察方案方案编号:起草人起草日期审核人审核日期批准人批准日期实施日期目录1.产品概述42.考察计划43.样品包装与贮存要求43.1包装要求43.2贮存要求44.检查项目要求44.1考察检测项目44.2检测项目说明55.检测时间要求65.1样品测试时间要求65.2样品测试时限要求66.异常情况处理要求66.1贮存环境异常情况66.1.1设备或者设施故障66.1.2停电66.1.3当采取的应急措施对考察结果可能有影响时66.2产品质量异常情况66.2.1在有效期内出现样品检验不合格的情况时76.2.2在考察过程中,样品结果出现异常趋势时77.考察报告要求77.1考察报告内容要求77.2报告的时限要求78.记录管理要求79.支持性文件79.1《持续稳定性考察标准操作规程》79.2《中国药典》2010年版79.3《中国药典》2010年版第二增补本71.产品概述品名:******注射液剂型标准编号批准文号制剂规格包装规格药品有效期注射剂WS-10001-(HD-1138)-2002国药准字H520209595ml/支5支/盒200盒/件暂定24个月处方组成执行标准功能主治贮藏条件**、盐酸川芎嗪;辅料为甘油(供注射用)化学药品地方标准上升国家标准第十二册,标准编号:WS-10001-(HD-1138)-2002抗血小板聚集,冠状动脉扩张药。
用于闭塞性脑血管疾病,如脑供血不全,脑血栓形成,脑栓塞及其他缺血性心血管疾病,如冠心病的胸闷、心绞痛、心肌梗塞、缺血性中风、血栓闭塞性脉管炎等症避光,密封,在阴凉处保存2.考察计划药品名称制剂规格包装规格生产批量内包装材料考察批数样品数量(盒)/批******注射液每支5ml5支/盒200盒/件90万毫升安瓿90注:下列情况,应取样进行持续稳定性考察:1.新产品:包括新开发产品和仿制类新产品;2.变更关键辅料、内包装材料、生产工艺及主要设备等的第一批;3.其它可能引起药品内在质量变化的变更后生产的产品的第一批;4.在生产过程中出现可能影响产品内在质量偏差的该批产品;5.重新加工、返工或回收的该批产品。
XXXXXX注射液(批号:xxxxxxxx)持续稳定性考察总结报告

持续稳定性考察总结报告考察品种:XXXXX脸射液考察批号:XXXXXXXX考察周期:XXX对XX月XX日至XXX)# XX月XX日1. 留样考察批号:xxxxxxxx。
2. 留样包装:安甑装;5ml/支X 5支/盒。
3. 贮存条件:密封,避光,在阴凉处(不超过20C)保存。
4. 持续稳定性考察检验项目:性状、鉴别(1)、鉴别(2)、检查(pH值、装量、可见异物、不溶性微粒、无菌、热原)、含量测定(XXX素)。
5. 产品有效期:2年6. 持续稳定性考察时限:3年(即产品有效期后1年)。
7. 持续稳定性考察结果及检验数据:(进链接表)8. 稳定性考察结果分析:对以上1个批号产品在稳定性考察期间(0月、3月、6月、9月、12月、18月、24月、30月、36月)各个项目随着时间的变化趋势进行分析,分析情况如下:(暂以批号20100201为例)(1)性状:XXXXXXfe射液一个批号的持续稳定性考察均未发生变化;(2)鉴别①:XXXXX戏射液一个批号的持续稳定性考察均未发生变化;(3)鉴别②:XXXXX戏射液一个批号的持续稳定性考察均未发生变化;(4) pH值趋势图:(见图1)(5)装量:XXXXXXfe射液一个批号的持续稳定性考察均未发生变化;(6)可见异物:XXXXXXt射液一个批号的持续稳定性考察均未发生变化;(7)不溶性微粒:XXXXXXt射液一个批号的持续稳定性考察均未发生变化;(8)无菌:XXXXXXfe射液一个批号的持续稳定性考察均未发生变化;(9)热原:XXXXXXfe射液一个批号的持续稳定性考察均未发生变化;图1:(10)含测:XXX素趋势图:(见图2)图2:0.600.550.500.450.400.350.309. 结果评价:(一)、性状、鉴别①、鉴别②、检查(pH值、装量、可见异物、不溶性微粒、无菌、热原)的结果均未发生变化,质量稳定。
(二八pH值、含测XXX素的测试结果均有轻微波动,这与不同检测仪器、不同检测人员有一定关系,但检验偏差是符合规定的,并且测试结果均符合国家法定质量标准规定范围内。
不同处方注射用单磷酸阿糖腺苷稳定性考察

t h e s t a b i l i y t o f v i d a r a b i n e mo n o p h o s p h a t e or f i n j e c t i o n wi t h d i f e r e n t f o mu r l a s . T h e b e s t p r e s c i r p t i o n wa s : a d d e d e t h y l e n e d i a mi n e t e t r a a c e t i c a c i d d i — s o d i u m s a l t nd a p h o s p h a t e b u f f e r . Co n c l u s i o n : T h e p r e s c r i p t i o n o f s e l e c i t o n c a n e f e c t i v e l y s o l v e t h e s t a b i l i y t o f v i d a r a b i n e mo n o p h o s p h a t e or f i n j e c —
果: 不同处方样 品稳定性存 在较 大差异 , 同时加 入依 地酸二钠和磷酸盐缓冲对的处方稳定性最好。结论 : 筛选处方 能有效解决 注射 用单磷酸 阿糖腺苷 的稳定性 , 可用于指导生产 。 。 [ 关键词]单磷 酸阿糖 腺苷; 稳定性 ; 处方 筛选 [ 中图分类号]R 9 2 7 . 2 [ 文献标识码]A [ 文 章编 号] 1 0 0 8 — 1 8 7 9 ( 2 0 1 4 ) 0 7 - 0 1 2 7 - 0 2
我院注射用单磷酸阿糖腺苷用药分析

我院注射用单磷酸阿糖腺苷用药分析宋 瑞,卞光奇,陈晓东(泗县人民医院药剂科,安徽泗县234300)摘要:目的 调查我院2016年2月份出院患者注射用单磷酸阿糖腺苷的使用情况,促进临床合理用药。
方法 利用我院合理用药信息系统对该药的科室分布、出院诊断、患者年龄分布作统计分析。
结果 我院新生儿科患者使用最多;该药主要用于呼吸道感染疾病;临床使用较多的患者为小于3岁的儿童;本院不合理使用注射用单磷酸阿糖腺苷的最突出表现为超适应症用药。
结论 我院应针对单磷酸阿糖腺苷的临床用药加强监管,尤其要确保儿童合理、安全用药。
关键词:注射用单磷酸阿糖腺苷;用药分析;合理用药中图分类号:R969 4 文献标识码:B 文章编号:1006 3765(2021) 02 0188 02 注射用单磷酸阿糖腺苷作为一种抗脱氧核糖核酸(DNA)类病毒药物,其作用机制表现为能与病毒的DNA聚合酶结合,从而抑制合成病毒的脱氧核糖核酸。
主要适应症为治疗巨细胞病毒感染及疱疹病毒感染所致的脑炎、口炎等。
查阅相关说明书及文献资料发现,单磷酸阿糖腺苷只对疱疹病毒、巨细胞病毒和乙肝病毒有效,但其对疱疹性病毒的疗效与阿昔洛韦比较也不占优势,对于RNA病毒感染的有效性没有充分证据证明。
注射用单磷酸阿糖腺苷不良反应报告数量近年来增长趋势明显〔1〕,为规范我院药品的合理使用,降低患者用药风险,现对我院使用注射用单磷酸阿糖腺苷住院患者病历进行统计、分析与评价,并将结果进行汇总。
1 资料与方法1 1 资料来源 利用我院合理用药软件系统抽取2016年2月份所有使用注射用单磷酸阿糖腺苷的患者的出院归档病历,合计60份。
1 2 方法 通过对每份使用注射用单磷酸阿糖腺苷病历的住院号、使用科室、姓名、年龄、诊断、单次剂量和频次逐项进行登记,根据药品说明书及相关文献资料,点评注射用单磷酸阿糖腺苷的用药合理性。
2 结果2 1 使用科室情况 经统计,我院单磷酸阿糖腺苷用药情况,新生儿科患者应用最多(见表1)。
注射用单磷酸阿糖腺苷无菌检查方法适用性研究

注射用单磷酸阿糖腺苷无菌检查方法适用性研究佘凡;王自义;高翔;李秋菲【摘要】目的建立注射用单磷酸阿糖腺苷无菌检查方法标准.方法按照2015年版《中国药典》规定,采用薄膜过滤法,对14家企业生产的注射用单磷酸阿糖腺苷进行无菌方法适用性研究.结果确定了规格为0.1g注射用单磷酸阿糖腺苷的无菌检查方法.14家企业(共111批次)无菌检验方法均为:取样品60支,采用薄膜过滤法,用pH 7.0氯化钠-蛋白胨缓冲液冲洗,每次100 mL,共冲洗2次.结论通过对14家企业生产的注射用单磷酸阿糖腺苷的方法验证资料进行整理、归纳、分析、试验,最终确定严谨统一的无菌检查方法.%Objective To set up the standards for the sterility test of adenine arabinoside monophosphate for injection.Methods According to Chinese pharmacopoeia (2015),the sterility tests on adenine arabinoside monophosphate for injection from 14 producers were performed by membrane-filtration procedure.Results The sterility test on 0.1 g adenine arabinoside monophosphate for injection was confirmed.The sterility tests of all 14 producers (111 batches) were carried out as follows:60 samples were filtered by membranefiltration procedure,and washed twice by pH 7.0 sodium chloride peptone buffer,100 mL each time.Conclusions A strict and unified sterility test has been confirmedby reorganizing,concluding,analyzing and testing of the data on the adenine arabinoside monophosphate for injection from the 14 producers.【期刊名称】《安徽医药》【年(卷),期】2017(021)012【总页数】5页(P2164-2168)【关键词】注射用单磷酸阿糖腺苷;无菌检查法;方法适用性【作者】佘凡;王自义;高翔;李秋菲【作者单位】杨凌示范区药品检验监测评价中心,陕西杨凌712100;陕西省医疗器械质量监督研究院,陕西西安712046;陕西省食品药品监督检验研究院,陕西西安710065;陕西省食品药品监督检验研究院,陕西西安710065【正文语种】中文注射用单磷酸阿糖腺苷常用于治疗疱疹病毒感染所致的口炎、皮炎、脑炎,也用于治疗免疫抑制患者的带状疱疹和水痘感染,但对巨细胞病毒无效。
药品留样管理与持续稳定性考察制度

药品留样管理与持续稳定性考察制度药品生产质量管理规范第二百二十五条企业按规定保存的、用于药品质量追溯或调查的物料、产品样品为留样。
用于产品稳定性考察的样品不属于留样。
留样应当至少符合以下要求:(一)应当按照操作规程对留样进行管理(按文件执行)(二)留样应当能够代表被取样批次的物料或产品(代表性)(三)成品的留样:1.每批药品均应当有留样:如果一批药品分成数次进行包装,则每次包装至少应当保留一件最小市售包装的成品:(同批产品包装多少次就得留样多少次)2.留样的包装形式应当与药品市售包装形式相同,原料药的留样如无法采用市售包装形式的,可采用模拟包装:(成品的留样必须和卖出的产品包装相同)3每批药品的留样数量一般至少应当能够确保按照注册批准的质量标准完成两次全检(无菌检查和热原检查等除外)(中药饮品一般不需要注册就按药典标准或内控标准)4.如果不影响留样的包装完整性,保存期间内至少应当每年对留样进行一次目检观察,如有异常,应当进行彻底调查并采取相应的处理措施;5.留样观察应当有记录6.留样应当按照注册批准的贮存条件至少保存至药品有效期后一年:7如企业终止药品生产或关闭的,应当将留样转交受权单位保存,并告知当地药品监督管理部门,以便在必要时可随时取得留样。
(如果企业关闭或此药品不生产了,要告知药品监督管理局,)(四)物料的留样:1.制剂生产用每批原辅料和与药品直接接触的包装材料均应当有留样。
与药品直接接触的包装材料(如输液瓶),如成品已有留样,可不必单独留样;(很多企业是成品留样了,成品包含在里面的,包材就不留样了)2.物料的留样量应当至少满足鉴别的需要。
3.除稳定性较差的原辅料外,用于制剂生产的原辅料(不包括生产过程中使用的溶剂、气体或制药用水)和与药品直接接触的包装材料的留样应当至少保存至产品放行后2年。
如果物料的有效期较短,则留样时间可相应的缩短:(留样期限可以随着有效期变动,保留期限到有效期后面没什么意义)4.物料的留样应当按照规定的条件贮存,必要时还应当适当包装密封。
注射用单磷酸阿糖腺苷的冻干工艺研究
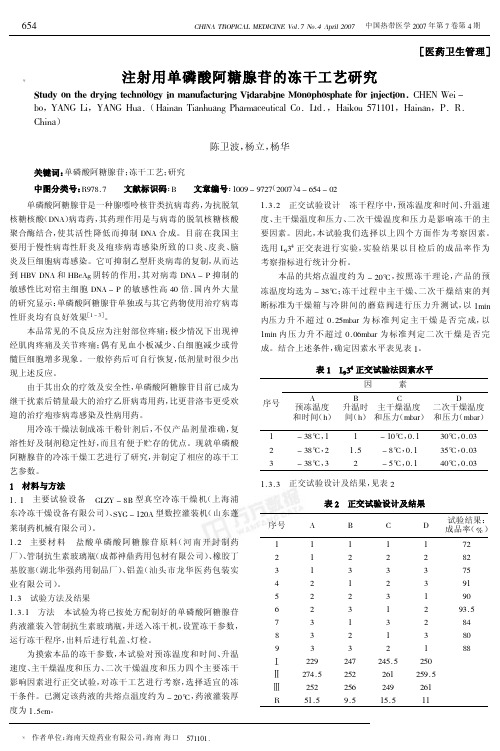
药液灌装入管制抗生素玻璃瓶, 并送入冻干机, 设置冻干参数, 运行冻干程序, 出料后进行轧盖、 灯检。 为摸索本品的冻干参数, 本试验对预冻温度和时间、 升温 速度、 主干燥温度和压力、 二次干燥温度和压力四个主要冻干 影响因素进行正交试验, 对冻干工艺进行考察, 选择适宜的冻 干条件。已测定该药液的共熔点温度约为 ( GAP , 药液灌装厚 度为 @E>98。
。因此, 在产品预冻
阶段必须保证产品冻牢, 主干燥阶段必须控制好隔板温度, 在 升华段制品温度不能超过其共熔点温度。 通过正交试验确定本品的冻干参数为预冻温度为 ( %)* 。
!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!
(上接第 65% 页)
此, 有关主管部门和医院管理者应拟合国家整体和谐的科学发 展观长效管理思路, 构建以 “患者为中心” 的管理理念, 树立为 患者减轻病患、 保障健康的服务宗旨。根据当前我国医疗卫生 的发展特点, 敢下猛药, 敢触及部门利益, 以寻求各种执行操作 制度的创新, 并针对国家医院管理年的建设热点, 不断完善医 疗机构的 “生存、 服务、 发展” 的思路, 并进一步拓展生存能力, 开发稳定的医疗服务集约群体, 扶持基层医疗服务水平, 构建 和谐祥和医患关系的平安医院和平安社会, 以更好地为患者服 务, 为自身的生存和发展铺基础。 参考文献:
[.]黄勃 7 单磷酸阿糖腺苷抗乙型肝炎病毒的疗效观察 [ 8] - 四川医学, (.#) : #,,,, #. ..,# 9 ..,%[#]邰 立 慧 7 单 磷 酸 阿 糖 腺 苷 治 疗 慢 性 乙 肝 的 近 期 疗 效 观 察 [ 8] (%) : - :;<=314> ?@A3B1C 8;<241C, #,,%, %. ##,[%]周莉, 于岩岩, 王勤环 7 单磷酸阿糖腺苷联合胸腺治疗慢性乙型肝 炎疗效观察 [ 8] (.) : - 临床肝胆病杂志, #,,%, .D %5 9 %6[’]李艳萍 - 冻干技术研究进展 [ 8] - 微生 物 学 免疫 学 进 展, .DD’, ## (’) : ’) 9 5.收稿日期: #,,6 ( .# ( .’
注射用单磷酸阿糖腺苷稳定性研究

注射用单磷酸阿糖腺苷稳定性研究
林军;池宏林;罗碧玫;黄湘兰;陈宁;翁丹华
【期刊名称】《中国药学杂志》
【年(卷),期】1991(26)4
【摘要】实验证明单磷酸阿糖腺苷的水解,主要是H^+的催化影响。
最稳定pH为9.3~10.5。
同时对其冻干制剂用经典恒温法、低温恒温恒湿法、室温留样观察及光照试验等考察产品质量,证实该品室温放置是稳定的。
并可与葡萄糖、氯化钠等输液配伍,但不能与含钙制剂配伍使用。
【总页数】3页(P210-212)
【关键词】单磷酸;阿糖腺苷;稳定性
【作者】林军;池宏林;罗碧玫;黄湘兰;陈宁;翁丹华
【作者单位】广东省药物研究所
【正文语种】中文
【中图分类】R927.11
【相关文献】
1.注射用单磷酸阿糖腺苷无菌检查方法适用性研究 [J], 佘凡;王自义;高翔;李秋菲
2.注射用单磷酸阿糖腺苷与阿昔洛韦注射液配伍稳定性考察 [J], 刘跃林
3.注射用单磷酸阿糖腺苷与小儿电解质补给注射液的配伍稳定性考察 [J], 于海洲;阮健
4.注射用单磷酸阿糖腺苷与盐酸利多卡因注射液配伍稳定性考察 [J], 陈丽娜;金描真;欧少英
因版权原因,仅展示原文概要,查看原文内容请购买。
注射用单磷酸阿糖腺苷与盐酸利多卡因注射液配伍稳定性考察

注射用单磷酸阿糖腺苷与盐酸利多卡因注射液配伍稳定性考察陈丽娜;金描真;欧少英
【期刊名称】《广东药学院学报》
【年(卷),期】2000(16)3
【摘要】考察了单磷酸阿糖腺苷与盐酸利多卡因配伍的稳定性,结果两药配伍后8h内溶液颜色,澄清度、pH含量均无明显变化,两药配伍稳定,可供临床用药参考。
【总页数】1页(P214)
【作者】陈丽娜;金描真;欧少英
【作者单位】深圳市宝安区人民医院,广东深圳;广东药学院
【正文语种】中文
【中图分类】R927.11
【相关文献】
1.注射用单磷酸阿糖腺苷与阿昔洛韦注射液的配伍研究 [J], 夏晓君;张迎春;荆俊丽;魏春雁
2.注射用右雷佐生与不同输液溶媒配伍的稳定性考察 [J], 张亚坤;刘剑;贡莹;陈玮;张志清
3.葡萄糖酸钙注射液与不同溶媒配伍的稳定性考察 [J], 张文佳;孙德清
4."即配即用"药物-哌拉西林钠他唑巴坦钠的配伍稳定性考察 [J], 邱博;杨浩天;安静;董占军
5.精氨酸谷氨酸注射液与脂肪乳氨基酸(17)葡萄糖(11%)注射液的配伍稳定性考察[J], 陈火树;刘佳萍;刘凤婷;徐骞
因版权原因,仅展示原文概要,查看原文内容请购买。
稳定性考察检验指南

稳定性考察检验指南已有原料药与制剂产品的稳固性试验(EPMP/QWP/122/02 rev 1)执行日期:2004.031.介绍1.1.目的:本指南是对《新原料药与制剂产品稳固性试验指南》(CPMP/ICH/2736/99corr)的扩展,它制定了已有原料药与有关制剂产品稳固性试验的要求。
本指南中,已有原料药是指欧洲共同市场通过制剂产品批准的原料药。
本指南适用于化学原料药及其制剂产品、草本药物、草本药物制剂及其有关草本药品,不适用于放射性制品、生物制品与通过生物技术生产的产品。
本指南旨在例举已有原料药及其制剂产品要紧稳固性资料的要求,但对实际情况中哟秋有特定的技术与具有特殊性的药品也给予了充分的灵活性。
如有足够的科学根据也可使用其它方法。
1.2.范围:本指南旨在阐述已有原料药与有关制剂产品注册申请时需提交的资料。
关于草本药物、草本制剂与草本药品,应参考《草本药品质量指南注意事项》稳固性章节(EMEA/CPMP2819/00)。
1.3.通则:稳固性试验的目的是为原料药或者制剂产品的质量因受温度、湿度、光线等不一致环境条件因素影响而发生的变化提供根据,并建立原料药的复检周期、制剂产品的货架寿命与建议贮存条件。
本指南对试验条件选择的说明,参见《新原料药与制剂产品稳固性试验指南注意事项》(CPMP/ICH/2736/99现行)。
2.指南:2.2.成品2.2.1.通则:制剂产品正式稳固性考察计划的制定应以对原料药与制剂剂型的作用与性质的熟悉为基础。
2.2.2.光稳固性试验应对初期生产的至少一批制剂产品进行光稳固性试验。
光稳固性试验的标准条件在《新原料药与药品光稳固性指南》(CPMP/ICH/279/95)中有描述。
2.2.3.考察批次的选择:在提交申请时,应提供相同配方与相同剂型的建议市场销售用包装批次产品的稳固性考察资料。
2种方法可供选择:a)关于传统剂型(如:即释固体制剂、溶液剂)与已知有效成份稳固的制剂产品,可提供至少2批中试产品的稳固性考察资料。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.1 实验所见,贮存时间对贮存样品的合格率有显著影响。该制剂的有效期与生产工艺、生产贮存环境、冻干条件的关系十分密切。有效期可定为2.5年。
3.2 pH值测定数据显示,该产品有可能同时产生酸性与碱性降解产物,pH值经贮存后均有下降(见表1),提示该产品降解产物多数显酸性。
作者单位:曾斓彬(广东省药物研究所 广州 510180)
贮存期注射用单磷酸阿糖腺苷质量稳定性考察
更新日期:2009-05-02 点击:
曾斓彬
摘要 对贮存留样的13批样品的性状、含量及pH进行了测定考察。经χ2检验法分析了贮存样品的测定数据。结果表明该制剂的生产工艺设计合理,实验测得该制剂有效期为2.5年。
关键词 单磷酸阿糖腺苷 稳定性
1.2 样品 均为留样样品,避光常态下贮存,中性多剂量玻璃容器盛载,内夹层包装为白色泡沫,外包装为透明无色塑料盒、纸盒包装。批号:930703、930812、930928、931015、931023、931029、931120、940306、940408、940511、940612、980813、940915共13批。
940915 - 102.26 101.57 7.74 7.36 0.38
2.1 含量测定 随机抽取各批留样样品3瓶,分别用0.01mol/L HCl溶解后配制成约20mg/ml的溶液,按分光光度法在258nm波长处测定吸收度。计算测定结果。
2.2 pH的测定 取本品0.2g,加新沸放冷的蒸馏水20ml,溶解后按pH值测定法测定。
930703 + 101.05 100.88 7.57 7.54 0.03
930812 + 94.36 94.25 7.75 6.99 0.76
930928 ++ 96.97 99.53 7.59 7.50 0.09
931051 - 99.60 100.33 7.51 7.38 0.13
2.3 统计分析[2]
χ2检验法分析贮存样品,结果见表2。
表2 χ2检验法分析
贮存期(年) 总批数 三项*合格数 仅性状项
不合格数
3<T<4 7 1 6
2<T<3 6 5 1
合计 13 6 7
*包括性状、含量、pH值
按四格表确切概率法计算得P=0.0292,按α=0.05,拒绝H0,接受H1,即贮存期样品的贮存时间(T)不同,样品合格率差异有显著性。3<T<4年,合格率为14.28SERVA公司产品标示含量:Ara-AMP 98%
1.3 0.01mol/L HCl溶液
2 实验方法与结果
样品为冻干剂,主要考察该制剂的性状、含量、pH值。结果见表1。
表1 留样样品的性状、含量、pH值测定结果
批号 性状
(变黄) 含量(%) pH
原测值 现测值 原测值 现测值 d
注射用单磷酸阿糖腺苷(Ara-AMP)为白色块状粉末冻干剂,在室温下放置稳定,制剂水解的主要因素是[H+][1]。为考察该制剂的质量稳定性,采用留样观察法考察了该产品的稳定性。
1 仪器与试药
1.1 仪器 UV-210A 可见-紫外分光光度计(日本岛津),PHS-3C型酸度计(上海雷磁仪器厂)
931023 + 100.07 101.58 7.69 7.48 0.21
931029 ++ 94.42 92.00 7.78 7.58 0.20
931120 +++ 98.54 94.58 7.64 7.67 -0.03
940306 - 108.36 105.18 8.02 7.52 0.50
940408 - 105.33 102.98 7.47 7.50 -0.03
940511 + 102.54 99.73 7.42 7.27 0.15
950612 - 106.00 104.10 7.68 7.50 0.18
940813 - 106.05 108.17 7.46 7.34 0.12
参考文献:
[1]林军,池宏林,罗碧玫,等.注射用单磷酸阿糖腺苷稳定性研究.中国药学杂志.1991,26(4):210~212
[2]杨树勤主编.卫生统计学.人民卫生出版社.1996:43~98
