2019-2020人教版高中化学必修第二册新学案检测:(四) 氮气及氮的氧化物
新人教版必修第二册高一化学练习卷:氮气与氮的氧化物【有答案】

氮气与氮的氧化物1.(双选)下列关于氮气的说法中错误的是(CD)A.氮气在通常情况下不燃烧,也不支持燃烧,不能供呼吸B.液氮可用于医学和高科技领域,制造低温环境C.高温或通电的条件下,氮气能与氧气化合生成二氧化氮D.高温高压催化剂条件下与氢气反应时,氮气作还原剂解析:A.氮气是一种无色无味的气体,是空气的主要成分之一,化学性质稳定,在通常情况下不燃烧,也不支持燃烧,不能供呼吸,故A正确;B.液氮气化吸热,所以可以制造低温环境,故B正确;C.高温或通电的条件下,氮气能与氧气化合生成一氧化氮,为高能固氮的过程,故C错误;D.高温高压催化剂条件下与氢气反应生成氨气,氮气中N的化合价从0降低到-3,作氧化剂,故D错误。
故选C、D。
2.(双选)下列说法中,正确的是(AB)A.在雷雨天,空气中的N2和O2化合生成NO属于自然固氮B.在化学反应中,氮气既可作氧化剂又可作还原剂C.利用氮气的不活泼性,在医学上液氮常用作冷冻剂D.标准状况下,22.4 L N2与足量的H2充分反应可转移电子6 mol解析:A.闪电时,氮气和氧气反应生成NO,属于自然固氮,故A正确;B.氮气中氮元素化合价可以降低生成氨气,也可以升高生成NO等,氮气既可作氧化剂又可作还原剂,故B正确;C.液氮挥发时会吸收大量的热,所以常用作冷冻剂,故C错误;D.氮气与氢气的反应为可逆反应,标准状况下,22.4 L N2与足量的H2充分反应转移的电子少于6 mol,故D 错误。
故选A、B。
3.将3 mol NO2气体依次通入下列三个分别装有足量①NaHCO3饱和溶液,②浓H2SO4,③Na2O2的装置后,用排水法把残留气体收集起来,则收集到的气体是(D)A.1 mol NOB.1 mol NO2和0.05 mol O2C.2 mol O2D.0.25 mol O2解析:由3NO2+H2O===2HNO3+NO可知有1 mol NO、2 mol HNO3生成,由HNO3+NaHCO3===NaNO3+H2O+CO2↑可知,2 mol HNO3与足量NaHCO3反应有2 mol CO2产生。
5.2.1氮气及氮氧化物教学设计2023-2024学年高一下学期化学人教版(2019)必修第二册

答案:氮气的化学反应包括与氢气反应生成氨气,与氧气反应生成一氧化氮等。氮氧化物的化学反应包括氧化还原反应、酸碱反应等。氮氧化物在催化反应中的应用包括选择性催化氧化、还原等反应。
7. 题目:请简要描述氮气及氮氧化物在工业生产中的应用。
答案:氮气在食品包装、医疗、电子工业等方面的应用,氮氧化物在汽车尾气控制、工业排放处理等方面的应用。
五、总结回顾(用时5分钟)
今天的学习,我们了解了氮气及氮氧化物的基本概念、重要性和应用。同时,我们也通过实践活动和小组讨论加深了对氮气及氮氧化物的理解。我希望大家能够掌握这些知识点,并在日常生活中灵活运用。最后,如果有任何疑问或不明白的地方,请随时向我提问。
六、教学资源拓展
1.拓展资源:
- 科普文章:氮气及氮氧化物的科普文章,介绍其在自然界、工业生产和环境保护中的作用和重要性。
2.拓展建议:
- 学生可以阅读科普文章,加深对氮气及氮氧化物的理解和认识。
- 观看实验视频,帮助学生更好地理解氮气及氮氧化物的制备过程。
- 分析实际案例,让学生了解氮气及氮氧化物在实际生活中的应用和解决方法。
- 阅读学术文章,了解氮气及氮氧化物在科学研究中的最新进展和应用。
- 学习环境保护资料,提高学生对氮气及氮氧化物对环境影响的认识,培养学生的环保意识。
二、新课讲授(用时10分钟)
1.理论介绍:首先,我们要了解氮气及氮氧化物的基本概念。氮气(N2)是地球大气中最丰富的气体,占据了大约78%的比例。它在工业生产和科学研究中具有重要应用,例如作为保护气体和焊接辅助气体。氮氧化物(NOx)是一类含有氮和氧的化合物,包括NO、NO2等,它们在汽车尾气排放和工业生产中产生,对环境和人体健康有一定影响。
5.2.1氮气与氮的氧化物教学设计2023-2024学年高一下学期化学人教版(2019)必修第二册
4.环境保护:氮的氧化物用于制造硝酸、氮肥等,促进植物生长,提高农作物产量。
教学反思
今天的课程结束后,我对氮气与氮的氧化物的教学进行了反思。首先,我意识到实验教学在化学教学中起到了至关重要的作用。通过实验,学生们能够直观地观察到氮气与氮的氧化物的性质和变化,加深了对知识的理解和记忆。例如,在氮气实验中,学生们通过观察集气瓶内水位的变化,直观地感受到了氮气的密度比水小的性质。而在氮的氧化物实验中,学生们通过观察湿润的蓝色石蕊试纸的颜色变化,加深了对二氧化氮的酸性性质的理解。
2.植物损害:氮的氧化物能对植物造成伤害,影响农作物产量和质量。
3.建筑物腐蚀:氮的氧化物中的二氧化氮能与水蒸气结合形成硝酸,对建筑物、桥梁等基础设施造成腐蚀。
题型三:实验操作及观察
【问题】请描述如何进行氮气与氮的氧化物的实验操作,并观察实验现象。
【答案】实验操作及观察如下:
1.氮气实验操作:
(1)准备实验器材:集气瓶、水槽、导管等。
互动探究:
设计小组讨论环节,让学生围绕氮气与氮的氧化物的性质和用途展开讨论,培养学生的合作精神和沟通能力。
鼓励学生提出自己的观点和疑问,引导学生深入思考,拓展思维。
技能训练:
设计实践活动或实验,让学生在实践中体验氮气与氮的氧化物知识的应用,提高实践能力。
在氮气与氮的氧化物新课呈现结束后,对知识点进行梳理和总结。
强调重点和难点,帮助学生形成完整的知识体系。
(四)巩固练习(预计用时:5分钟)
随堂练习:
随堂练习题,让学生在课堂上完成,检查学生对氮气与氮的氧化物知识的掌握情况。
鼓励学生相互讨论、互相帮助,共同解决氮气与氮的氧化物问题。
5.2.1氮气氮的氧化物教学设计2023-2024学年高一下学期化学人教版(2019)必修第二册

学校
授课教师
课时
授课班级
授课地点
教具
教学内容分析
本节课的主要教学内容为氮气、氮的氧化物的性质和制备。教学内容与学生已有知识的联系:学生已经学过原子结构、化学键的相关知识,对气体分子有一定的了解,这为学习氮气奠定了基础。本节课的内容与上一节课的化学反应原理有关联,为学生提供了更深入的气体知识。
知识点梳理
本节课的知识点主要包括以下几个方面:
1.氮气的制备方法:讲解工业制氮气和实验室制氮气的方法,包括液态氮的制备和氮气的提取。
2.氮气的化学性质:介绍氮气的化学性质稳定,不与其他物质发生反应,强调其在化学反应中的重要作用。
3.氮的氧化物的制备方法:讲解氮的氧化物的制备方法,包括NO、NO2等氮的氧化物的制备原理和实验操作。
(三)改进措施
1.教学管理:加强课堂管理,提高学生的注意力。可以考虑采用小组合作学习的方式,让学生在小组内进行讨论和互动,提高学生的参与度。
2.教学方法:多样化教学方法,增加课堂的趣味性。可以尝试使用多媒体教学手段,如视频、动画等,让学生更加直观地了解氮气、氮的氧化物的性质和制备过程。
3.教学评价:完善评价体系,加强对学生学习过程的评价。可以考虑增加课堂表现、实验操作等评价指标,全面评估学生的学习情况。
(2)简答题
1.请简述氮气的制备方法。
2.请简述氮的氧化物的制备方法。
反思改进措施
经过对本节课的教学实践进行反思,我认为在教学过程中存在以下几个问题:
(一)教学特色创新
1.实验教学:通过实验操作,让学生亲身体验化学反应,提高学生的实验技能和动手能力。
5.2.1氮气氮的氧化物教学设计2023-2024学年高一下学期化学人教版(2019)必修第二册

1.优化教学内容和方法,结合生活实例,使理论知识更具趣味性和实用性。
2.调整互动问题设计,提高学生的参与度和思考能力。
3.加强实验安全教育,提高学生的实验操作能力和安全意识。
4.增加课后辅导,针对学生薄弱环节进行有针对性的指导。
5.定期进行教学反思,了解学生的学习需求,调整教学策略。
(3)氮循环及其在自然界中的作用
学生可以通过学习氮循环过程,了解氮气、氮氧化物在生物、地质等领域的应用。例如,氮固定、氨氧化等过程在农业生产中的重要作用。
(4)化学实验:氮的氧化物的制备和性质实验
鼓励学生进行课后化学实验,如制备一氧化氮(NO)和二氧化氮(NO2),观察它们的性质,了解它们之间的相互转化。通过实验,加深对氮的氧化物性质的理解。
随堂练习:
随堂练习题,让学生在课堂上完成,检查学生对知识的掌握情况。鼓励学生相互讨论、互相帮助,共同解决问题。
错题订正:
针对学生在随堂练习中出现的错误,进行及时订正和讲解。引导学生分析错误原因,避免类似错误再次发生。
(五)拓展延伸(预计用时:3分钟)
知识拓展:
介绍与氮的氧化物相关的环保政策和前沿科技,拓宽学生的知识视野。引导学生关注学科前沿动态,培养学生的创新意识和探索精神。
4.科学态度与价值观:培养学生严谨求实的科学态度,认识到化学知识在实际生活中的应用价值,激发他们学习化学的兴趣。
5.跨学科综合能力:结合物理、生物等学科知识,了解氮循环及其在自然界中的作用,提高学生的跨学科综合能力。
学习者分析
1.学生已经掌握了相关知识:在学习本节课之前,学生已经了解了化学键的基本概念,掌握了氧化还原反应的基本原理,对气体的制备和性质也有一定的认识。此外,通过对空气成分的学习,学生对氮气的存在和重要性有了初步了解。
氮气和氮的氧化物-高一化学(人教版2019必修第二册)

合成氨是人类科学技术发展史上的一项重大成就。
在很大程度上解决了地球上因粮食不足而导致的饥饿问题。
哈伯也是第一位研究出化学武器的科学家,
在一战中为纳粹增加了很大的杀伤力。
化学史
合成化肥
天使
氨
合成硝酸
哈伯
(F.Haber,1868-1934)
合成炸药
魔鬼
4. 氮的制备和用途
(1) 制备
排水法
瓶口向上排空气法
特别提醒
(1)氮的氧化物都是大气污染物。
(2)空气中NO2是造成光化学烟雾的主要因素。
(3)空气中NO、NO2主要来源于煤和石油的燃烧、汽车尾气、硝酸工厂等。
(4)NO2:既有氧化性又有还原性,以氧化性为主。NO2能使湿润的淀粉-KI
试纸变蓝。
破解奇闻
在新疆与青海交界处有一山谷,人称魔鬼谷,
的实质是3NO2+H2O=2HNO3+NO,2NOư。
归纳小结:
1、关于NO、O2、H2O的混合计算,
记住总反应:4NO + 3O2 + 2H2O = 4HNO3
V(NO)
V(O2)
>4:3
余NO
=4:3 恰好完全反应
余O2
<4:3
2、关于NO2、O2、H2O的混合计算,
①NO→NO2: _____________________;
3NO2+H2O===2HNO3+NO
②NO2→NO: __________________________。
(工业制取硝酸)
【思考与讨论】
实验5-5对工业生产硝酸有什么启示?
O2
O2
新教材人教版必修第二册 5.2.1 氮气与氮的氧化物 学案(2)

第二节氮及其化合物第1课时氮气与氮的氧化物学习目标1.通过认识自然界中氮的循环及氮的固定,培养观察能力、归纳总结能力和合作互助意识。
2.通过探究氮的氧化物的性质,培养科学探究精神,提高分析解决问题的能力。
3.通过学习氮及其氧化物的用途,培养学生用辩证观点看化学与生产、生活的关系,增强环保意识。
重、难点含氮物质的性质及相互转化。
课堂探究【自主学习】认识重要的含氮物质。
任务一:请确定以下含氮物质在坐标系中的位置。
N2NO NO2HNO3NaNO3NH3NH4Cl NH3·H2O【合作学习】了解含氮物质间的转化。
任务二:1.认真观察实验,及时记录实验现象。
探究实验实验步骤现象Ⅰ将放电装置放置于透明的矿泉水瓶之中,通电Ⅱ①将装有8mLNO的注射器快速吸入20mL空气,封闭管口,观察现象;②再向注射器内吸入5mL水,振荡注射器,观察现象;③再次吸入10mL空气,充分振荡,观察现象;④然后测定溶液的pH11~12续表任务三:你还知道哪些与含氮物质转化有关的事实或现象吗?含氮物质之间的转化对人类的生产、生活都是有益的吗?【评测反响】目前,汽车尾气已成为许多大城市空气的主要污染源。
汽车尾气中含有CO和NO等多种污染物。
内置贵金属催化剂(1)治理汽车尾气中NO和CO的一种方法是在汽车的排气管上装一个催化转化装置(右图),使NO和CO反响,生成CO2和N2,写出反响的化学方程式。
(2)汽车尾气是形成硝酸型酸雨的主要原因之一,请写出有关反响的化学方程式。
核心素养专练1.以下气体不会造成空气污染的是( )3222.以下气体中,不能用排水法收集的是( ),不能用排空气法收集的是( )2223.不属于氮的固定的变化是( )A.根瘤菌把氮气转化为氨B.氮气和氢气在适宜条件下合成氨C.镁在氮气中燃烧D.工业上用氨和二氧化碳合成尿素4.在NO2被水吸收的反响中,复原产物和氧化产物的物质的量比为( )A.3∶1B.1∶3C.1∶2D.2∶15.同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO和NO2,②NO2和O2,③NO 和O2。
2020人教版高中化学必修第二册课时检测:(四) 氮气及氮的氧化物 Word版含解析

课时跟踪检测(四) 氮气及氮的氧化物A 级—学业水平考试达标练1.下列过程不属于固氮的是( )A .雷电时生成氮的氧化物B .工业上用氢气与氮气合成氨C .植物的根从土壤中吸收铵根离子和硝酸盐D .豆科植物的根瘤菌把空气中的氮气转化为硝酸盐解析:选C 固氮是指将游离态氮转化为氮的化合物。
雷电时N 2+O 2===2NO ,N 2转化为NO ,故A 属于固氮;氮气转化为氨,故B 属于固氮;没有发生化学反应,故C 不属于固氮;氮气转化为硝酸盐,故D 属于固氮。
2.如图所示,两个连通容器用活塞分开,左右两室各充入一定量NO 和O 2,且恰好使两容器内气体密度相同,打开活塞,使NO 与O 2充分反应,最终容器内混合气体密度比原来( )A .增大B .减小C .不变D .无法确定解析:选C 反应前后混合气体的质量和体积不变,所以密度不变。
3.下列关于氮的氧化物的说法中,正确的是( )A .氮的氧化物都是酸性氧化物B .氮的氧化物都既有氧化性,又有还原性C .NO 2与H 2O 反应生成HNO 3,所以NO 2是酸性氧化物D .NO 和NO 2均有毒解析:选D NO 、NO 2等不是酸性氧化物;N 2O 5中氮元素为最高价,只有氧化性;NO 2与H 2O 反应生成HNO 3时N 的价态发生了变化,故NO 2不是酸性氧化物。
4.下列关于N 2的说法错误的是( )A .通常情况下N 2性质很稳定,所以N 2可在电焊时作保护气B .反应N 2+O 2=====高温2NO 是汽车尾气造成污染的主要原因之一C .N 2的质量约占空气总质量的45D .在反应3Mg +N 2=====点燃Mg 3N 2中,N 2作氧化剂解析:选C N 2在空气中的体积含量约为45,C 项错误。
5.电闪雷鸣的雨天,空气中的N 2会发生一系列反应,生成氮的化合物。
雷雨时,一般不可能生成的氮的化合物是( )①NH 3 ②NO ③NO 2 ④N 2O 3 ⑤N 2O 5 ⑥HNO 3A .②④⑥B .②③⑤⑥C .①④⑤D .①③⑤解析:选C 放电时,空气中的N 2和O 2会化合生成NO ,NO 很容易与O 2反应生成NO 2,NO 2溶于水生成HNO 3和NO ,一般不能生成NH 3、N 2O 3和N 2O 5。
-高中化学必修第二册新学案、氮气及氮的氧化物

[解析] 反应为 4NO2+O2+2H2O===4HNO3,设原气体 体积为 8 L,则剩余气体为 1 L。
①若剩余的 1 L 气体为 O2。则 V(NO2)=45×7L,V(O2) =15×7+1L。二者体积比为 7∶3。
②若剩余的 1 L 气体为 NO,而上述反应后剩余 3 L NO2, 则 V(NO2)=3+45×5 L,V(O2)=15×5L。二者体积比为 7∶1。
新 新新知知知探探 探究 究究(((二一一③))) N氮 氮氮的 气气2+ 氧 与与化 氮氮O物 的的固固2定定=放==电==或=高==温==2NO;
新知探究(二) 氮的氧化物
高温、高压 新知探究(一) 氮气与氮的固定 ④N2+3H2 催化剂 2NH3;
②③
;属于人工固氮
⑤2NO+O2===2NO2。
(5)将盛满 NO 的试管打开塞子置于空气中,无色气体变为
红棕色 答案:(1)√ (2)√ (3)√ (4)√ (5)√
()
2.在 NO2 与水的反应中,水的作用是 A.是还原剂 B.既是氧化剂又是还原剂 C.是氧化剂 D.既不是氧化剂又不是还原剂 答案:D
()
3.为除去混入 NO 中的少量 NO2,应将气体通过 ( )
[演练新学考]
1.判断正误(正确的打“√”,错误的打“×”)。
(1)氮元素可形成五种价态的氧化物,其中+4 价的有 NO2
和 N2O4 两种
()
(2)NO 和 NO2 的颜色、气味、水溶性不同,但它们都是有
毒的气体
()
(3)实验室只能用排水法收集 NO,用向上排空气法收集 NO2
() (4)NO 具有较强的还原性,在空气中极易被氧化 ( )
新知探究(二) 氮的氧化物 新知探究(一) 氮气与氮的固定
氮和氮的氧化物—人教版高中化学必修第二册习题课件

氮和氮的氧化物—人教版高中化学必 修第二 册习题 课件
答案
氮和氮的氧化物—人教版高中化学必 修第二 册习题 课件
氮和氮的氧化物—人教版高中化学必 修第二 册习题 课件
(1)NO 使人中毒的原理与 CO 相似。 (2)NO 与空气中的 O2 反应,其颜色会发生变化,故可用此原理来检验 NO 的存在;同时也说明不能用排空气法收集 NO。
氮和氮的氧化物—人教版高中化学必 修第二 册习题 课件
①当通入氧气的体积为12V 时,则广口瓶①的气体体积为________; ②当广口瓶①中刚好充满液体时,所得液体的物质的量浓度为________ mol·L-1。
5氮.2和氮第的1课氧时化物氮—和人氮教的版氧高化中物化—学人必教修版第(二2册01习9)题高课中件化学必修第 二册习 题课件 (共25 张PPT)
答案
解析
5氮.2和氮第的1课氧时化物氮—和人氮教的版氧高化中物化—学人必教修版第(二2册01习9)题高课中件化学必修第 二册习 题课件 (共25 张PPT)
11.某活动小组利用如图装置进行 NO、NO2 的性质实验,按下列步骤 进行(装置气密性已检验完毕)。
Ⅰ.向广口瓶①中通入 NO 并测定 NO 的体积。 (1)通入 NO 前,向广口瓶①中加水的主要操作:______________。
氮和氮的氧化物—人教版高中化学必 修第二 册习题 课件
答案 D
答案
氮和氮的氧化物—人教版高中化学必 修第二 册习题 课件
2019-2020学年高中化学人教版(2019)必修第二册学案:第五章 第二节氮及其化合物 (第1课时) 氮与氮的氧
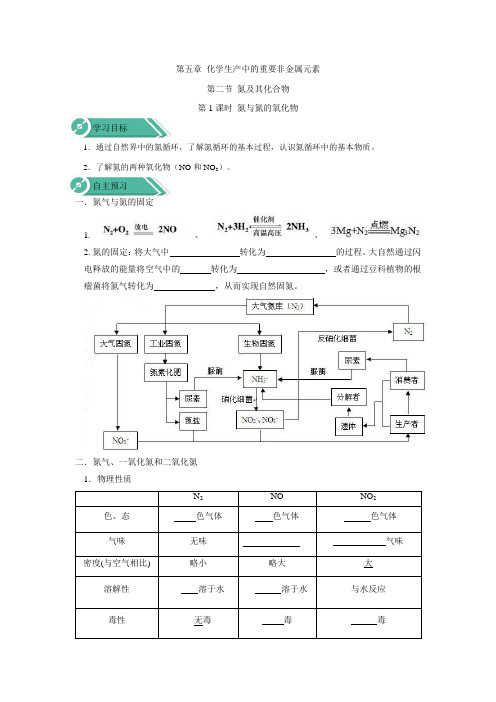
第五章化学生产中的重要非金属元素第二节氮及其化合物第1课时氮与氮的氧化物学习目标1.通过自然界中的氮循环,了解氮循环的基本过程,认识氮循环中的基本物质。
2.了解氮的两种氧化物(NO和NO2)。
自主预习一.氮气与氮的固定1.、、2.氮的固定:将大气中转化为的过程。
大自然通过闪电释放的能量将空气中的转化为,或者通过豆科植物的根瘤菌将氮气转化为,从而实现自然固氮。
二.氮气、一氧化氮和二氧化氮1.物理性质N2NO NO2色、态色气体色气体色气体气味无味气味密度(与空气相比) 略小略大大溶解性溶于水溶于水与水反应毒性无毒毒毒2.化学性质(1) 2NO +O 2===2NO 2 (2)3NO 2+H 2O===2HNO 3+NO 三.二氧化氮与水的反应【实验5-5】实验现象:____________ _____________。
实验结论:________ __________________________。
四.氮氧化物的计算类型1.相关反应原理:3NO 2+H 2O===2HNO 3+NO ① 2NO +O 2===2NO 2②由方程式①×2+②得:4NO 2+O 2+2H 2O===4HNO 3③ 由方程式①×2+②×3得:4NO +3O 2+2H 2O===4HNO 3④ 2.计算类型:①NO 2(或NO 2与NO 的混合气体)气体溶于水(反应①)利用气体体积差法进行计算。
V 剩=V (NO)原+13V (NO 2)。
②NO 2与O 2的混合气体溶于水(反应③)。
当V (NO 2) :V (O 2) ⎩⎪⎨⎪⎧=4:1,恰好完全反应>4:1,NO 2过量,剩余NO<4:1,O 2过量,剩余O 2③NO 与O 2的混合气体溶于水(反应④) 当V (NO) :V (O 2)⎩⎪⎨⎪⎧=4:3,恰好完全反应>4:3,剩余NO<4:3,剩余O 2课堂练习1.判断正误,正确的打“√”,错误的打“×” (1)空气中N 2的体积分数约为78%。
5.2.1氮及其氧化物2023-2024学年高一化学同步备课教学设计(人教版2019必修第二册)

鼓励学生阅读这些材料,以深入了解氮及其氧化物在环境、地球科学和生物地球化学领域的应用和重要性。
2.鼓励学生进行课后自主学习和探究:
-研究氮及其氧化物在农业生产中的应用,如氮肥的使用和影响。
-调查氮及其氧化物在工业生产中的排放和控制措施,如汽车尾气排放标准。
其他学生和教师对展示内容进行提问和点评,促进互动交流。
教师总结各组的亮点和不足,并提出进一步的建议和改进方向。
6.课堂小结(5分钟)
目标:回顾本节课的主要内容,强调氮及其氧化物的重要性和意义。
过程:
简要回顾本节课的学习内容,包括氮及其氧化物的基本概念、组成部分、案例分析等。
强调氮及其氧化物在现实生活或学习中的价值和作用,鼓励学生进一步探索和应用氮及其氧化物。
教学反思与总结
在这次教学氮及其氧化物过程中,我深刻反思了自己的教学方法和策略。首先,我意识到在讲解理论知识时,应该更加注重与实际生活的联系。通过举例说明氮及其氧化物在环境、工业和农业等方面的应用,可以激发学生的学习兴趣,帮助他们更好地理解和记忆。其次,实验教学是我这次教学中的一个亮点。通过让学生亲手操作,他们能够直观地观察到氮及其氧化物的性质和反应,从而加深对知识点的理解和记忆。
然而,在教学管理方面,我发现自己在课堂纪律的维持上还有待提高。部分学生在实验操作时过于活跃,影响了其他学生的学习。我应该更加严格地要求学生遵守课堂纪律,确保每个学生都能在一个良好的学习环境中成长。
对于教学效果的客观评价,我认为学生在知识、技能和情感态度方面都取得了显著的进步。他们不仅掌握了氮及其氧化物的性质和反应,还能够在实际问题中运用所学知识。同时,他们通过小组讨论和实验操作,培养了合作精神和解决问题的能力。然而,仍有部分学生在理解氧化还原反应和酸碱反应的应用上存在困难,我应该在未来的教学中更加关注这部分学生,提供更多的指导和帮助。
第04讲5.4氮气和氮氧化物-2024-2025学年高一化学必修第二册同步学案

第1课时 氮气和氮氧化物1.了解氮的固定和自然界中氮的循环。
2.了解氮气的主要化学性质。
3.认识氮氧化物的性质与转化。
一、氮气与氮的固定 1.氮元素的原子结构和性质(1)氮元素的原子结构氮元素位于元素周期表的第二周期第ⅤA 族,氮原子最外层有5个电子,既不容易得到3个电子,也不容易失去5个电子。
氮原子一般通过共用电子对与其他原子相互结合构成物质。
(2)氮元素在自然界中的存在①游离态:主要以氮气分子的形式存在于空气中,约占78%(体积分数)。
②化合态:存在于动植物体内的蛋白质中,土壤、海洋的硝酸盐和铵盐中。
2.氮气的性质(1)物理性质通常情况下,氮气是无色、无味的气体,密度比空气的稍小,难溶于水。
(2)化学性质氮分子内两个氮原子间以共价三键(N ≡N)结合,断开该化学键需要较多的能量,所以氮气的化学性质很稳定,通常情况下很难与其他物质发生化学反应,但在高温、放电等条件下,氮气也可以与镁、氧气、氢气等物质发生化合反应。
写出氮气与下列物质反应的化学方程式。
①金属镁:N 2+3Mg=====点燃Mg 3N 2,氮气表现氧化性; ②氢气:N 2+3H 2高温、高压催化剂2NH 3,氮气表现氧化性;③氧气:N 2+O 2=======放电或高温2NO ,氮气表现还原性。
(3)用途①氮气常用作保护气,如焊接金属、填充灯泡、保存食品等。
②氮气是合成氨、制硝酸的重要原料。
③液氮可用作制冷剂,应用于医学、科技等领域。
3.氮的固定(1)含义:将大气中游离态的氮转化为氮的化合物的过程。
(2)分类:①自然固氮:大自然通过闪电释放能量将氮气转化为含氮的化合物(高能固氮),或者通过豆科植物的根瘤菌将氮气转化为氨(生物固氮)。
②人工固氮:工业合成氨。
二、一氧化氮和二氧化氮1.一氧化氮、二氧化氮的物理性质氧化物颜色状态气味水溶性NO无色气态无味难溶NO2红棕色气态刺激性气味与水反应2.一氧化氮、二氧化氮的相互转化操作一:在一支50 mL的注射器里充入20 mL NO,观察颜色,然后吸入5 mL水,用乳胶管和弹簧夹封住管口,振荡注射器。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
课时跟踪检测(四) 氮气及氮的氧化物A 级—学业水平考试达标练1.下列过程不属于固氮的是( )A .雷电时生成氮的氧化物B .工业上用氢气与氮气合成氨C .植物的根从土壤中吸收铵根离子和硝酸盐D .豆科植物的根瘤菌把空气中的氮气转化为硝酸盐解析:选C 固氮是指将游离态氮转化为氮的化合物。
雷电时N 2+O 2===2NO ,N 2转化为NO ,故A 属于固氮;氮气转化为氨,故B 属于固氮;没有发生化学反应,故C 不属于固氮;氮气转化为硝酸盐,故D 属于固氮。
2.如图所示,两个连通容器用活塞分开,左右两室各充入一定量NO 和O 2,且恰好使两容器内气体密度相同,打开活塞,使NO 与O 2充分反应,最终容器内混合气体密度比原来( )A .增大B .减小C .不变D .无法确定解析:选C 反应前后混合气体的质量和体积不变,所以密度不变。
3.下列关于氮的氧化物的说法中,正确的是( )A .氮的氧化物都是酸性氧化物B .氮的氧化物都既有氧化性,又有还原性C .NO 2与H 2O 反应生成HNO 3,所以NO 2是酸性氧化物D .NO 和NO 2均有毒解析:选D NO 、NO 2等不是酸性氧化物;N 2O 5中氮元素为最高价,只有氧化性;NO 2与H 2O 反应生成HNO 3时N 的价态发生了变化,故NO 2不是酸性氧化物。
4.下列关于N 2的说法错误的是( )A .通常情况下N 2性质很稳定,所以N 2可在电焊时作保护气B .反应N 2+O 2=====高温2NO 是汽车尾气造成污染的主要原因之一C .N 2的质量约占空气总质量的45D .在反应3Mg +N 2=====点燃Mg 3N 2中,N 2作氧化剂解析:选C N 2在空气中的体积含量约为45,C 项错误。
5.电闪雷鸣的雨天,空气中的N 2会发生一系列反应,生成氮的化合物。
雷雨时,一般不可能生成的氮的化合物是( )①NH 3 ②NO ③NO 2 ④N 2O 3 ⑤N 2O 5 ⑥HNO 3A .②④⑥B .②③⑤⑥C .①④⑤D .①③⑤解析:选C 放电时,空气中的N 2和O 2会化合生成NO ,NO 很容易与O 2反应生成NO 2,NO 2溶于水生成HNO 3和NO ,一般不能生成NH 3、N 2O 3和N 2O 5。
6. 氮气是大气中含量最多的气体,下列有关氮气的说法正确的是( )①氮元素的非金属性较强,所以氮气是一种活泼的非金属单质②常温下,N 2既能与O 2反应,又能与H 2反应③通过灼热的镁粉除去N 2中的O 2④“雷雨发庄稼”是指雷雨时可增加土壤中氮肥的含量,此变化属于氮的固定⑤3 mol H 2与1 mol N 2混合反应生成NH 3,转移电子的数目小于6×6.02×1023A .①②③④⑤B .②③④⑤C .②④⑤D .④⑤解析:选D 氮元素是非金属性较强的元素,N 2的结构式为N ≡N ,两个氮原子通过三个共价键结合,键能大,难断裂,所以N 2是一种不活泼的非金属单质,故①错误。
N 2既能与O 2反应又能与H 2反应,但不是常温下:N 2+O 2=====放电2NO ,N 2+3H 2高温、高压催化剂2NH 3,故②错误。
N 2与O 2均能与灼热的镁粉发生反应:2Mg +O 2=====△2MgO ,N 2+3Mg=====△Mg 3N 2,所以不能通过灼热的镁粉除去N 2中的O 2,故③错误。
雷雨时,空气中的N 2能在放电的条件下转化为NO ,进而通过一系列反应转化为HNO 3,可增加土壤中氮肥的含量,此变化属于氮的固定,故④正确。
N 2与H 2合成NH 3属于可逆反应,1 mol N 2与3 mol H 2反应的过程中,由于N 2不可能完全转化,不可能生成2 mol NH 3,所以转移电子的物质的量小于6 mol ,故⑤正确。
7.四支试管中分别充满NO 、SO 2、NO 2、Cl 2中的一种,把它们分别倒置于盛有水的水槽中,放置一段时间后的现象如图所示。
其中原试管充满NO 2的是( )解析:选B 根据化学方程式3NO 2+H 2O===2HNO 3+NO 可知,剩余气体是反应前的13,故B 项正确。
8.实验室以空气和镁为原料制备Mg 3N 2的装置如图所示(夹持和加热装置略去):下列说法正确的是( )A .装置A 、B 中可依次加入浓硫酸、NaOH 溶液B .若去掉装置C ,对产品纯度无影响C .实验时应先加热C ,通入一段时间空气后再加热DD .E 中碱石灰的作用是吸收尾气解析:选C A 错,要制备氮化镁,需要除去空气中的氧气、CO 2和水蒸气,则装置A 、B 中可依次加入NaOH 溶液、浓硫酸。
B 错,若去掉装置C ,镁与氧气反应生成氧化镁,对产品纯度有影响。
C 对,实验时,应先加热C ,通入一段时间空气除去氧气,然后再加热D 。
D 错,装置E 中碱石灰的作用是吸收空气中的水蒸气和二氧化碳。
9.以下是氮循环的一部分:(1)通常状况下,NO 2的颜色是________。
(2)反应①的化学方程式是_________________________________________________。
(3)NO 2易溶于水,并和水发生化学反应。
该反应中,氧化剂是________。
(4)化合物A 的化学式是________。
(5)治理汽车尾气的一种方法是用催化剂使NO 与CO 发生反应:2NO +2CO=====催化剂2CO 2+N 2。
当生成2 mol N 2时,被还原的NO 为________ mol 。
解析:(1)NO 2的颜色是红棕色。
(2)反应①是N 2和O 2在放电条件下的反应,化学方程式是N 2+O 2=====放电2NO 。
(3)NO 2易溶于水,发生的反应是3NO 2+H 2O===2HNO 3+NO ,该反应中NO 2的氮元素化合价既有降低又有升高,NO 2既是氧化剂又是还原剂。
(4)由3NO 2+H 2O===2HNO 3+NO 知A 的化学式是HNO 3。
(5)从2NO +2CO=====催化剂2CO 2+N 2看出NO 和N 2的比为2∶1,则生成2 mol N 2时反应的NO 为4 mol 。
答案:(1)红棕色 (2)N 2+O 2=====放电2NO (3)NO 2(4)HNO 3 (5)410.氮氧化物进入大气后,不仅会形成硝酸型酸雨,还可能形成光化学烟雾,因此必须对含有氮氧化物的废气进行处理。
(1)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:NO 2+NO +2NaOH===2NaNO 2+H 2O ①,2NO 2+2NaOH===NaNO 2+NaNO 3+H 2O ②。
在反应①中,氧化剂是________,还原剂是________。
在反应②中,氧化剂和还原剂的物质的量之比为_______________________________。
(2)在一定条件下氨气亦可用来将氮氧化物转化为无污染的物质。
写出氨气和二氧化氮在一定条件下反应的化学方程式:_____________________________________________。
答案:(1)NO 2 NO 1∶1(2)8NH 3+6NO 2=====一定条件7N 2+12H 2OB 级—选考等级考试增分练1.氮元素在海洋中的循环是整个海洋生态系统的基础和关键。
海洋中无机氮的循环过程可用下图表示。
下列关于海洋氮循环的说法正确的是( )A .海洋中的氮循环起始于氮的氧化B .海洋中的氮循环属于固氮作用的是③C .海洋中的反硝化作用一定有氧气的参与D .向海洋中排放含NO -3的废水会影响海洋中NH +4的含量解析:选D A 项,海洋中的氮循环起始于氮的还原,错误;B 项,海洋中的氮循环属于固氮作用的是②,错误;C 项,反硝化作用是氮元素化合价降低的过程,反硝化细菌在氧气不足的条件下还原N ,不一定有氧气参与,错误;D 项,由氮的循环过程可知,NO -3增多,反硝化作用增强,会进一步影响海洋中NH +4的含量,正确。
2.如图所示,将相同条件下的m 体积NO 和n 体积O 2同时通入倒立于水槽中且盛满水的试管内,充分反应后,试管内残留m 2体积的气体,该气体与空气接触后立即变为红棕色。
则m 与n 的比值为( )A .3∶2B .2∶3C .8∶3D .3∶8解析:选C 该过程中涉及的反应有2NO +O 2===2NO 2、3NO 2+H 2O===2HNO 3+NO ,可将两个方程式“合并”为4NO +3O 2+2H 2O===4HNO 3。
剩余气体与空气接触立即变为红棕色,说明剩余气体为NO 。
则可知m 2体积的NO 气体与n 体积的O 2恰好完全反应。
4NO +3O 2+2H 2O===4HNO 34 3m 2n 4∶m 2=3∶n ,解得m ∶n =8∶3。
3.将充有m mL NO 和n mL NO 2气体的试管倒立于水槽中,然后通入m mL O 2,若已知m <n ,则充分反应后,试管中的气体在同温同压下的体积为( )A.4n -12mL B.n -m 3 mL C.3m +n 3 mL D .3(n -m )mL解析:选B NO 不与水反应,NO 2与水发生反应:3NO 2+H 2O ===2HNO 3+NO ,n mLNO 2参加反应可生成n 3mL NO ,所以试管中有NO ⎝⎛⎭⎫m +n 3mL ,通入m mL O 2会发生反应:4NO +3O 2 +2H 2O===4HNO 3。
若O 2剩余,则剩余O 2的体积为m mL -34⎝⎛⎭⎫m +n 3mL =m -n 4mL ,已知m <n ,故不合理;若NO 剩余,则剩余NO 的体积为⎝⎛⎭⎫m +n 3mL -43m mL =n -m 3mL ,合理,所以充分反应后,试管中的NO 气体在同温同压下的体积为n -m 3mL ,B 项正确。
4.汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )A .反应中NO 为氧化剂,N 2为氧化产物B .汽车尾气的主要污染成分包括CO 、NO 和N 2C .NO 和O 2必须在催化剂表面才能反应D .催化转化的总反应为2NO +O 2+4CO=====催化剂4CO 2+N 2解析:选D 反应过程中NO 、O 2为氧化剂,N 2为还原产物;汽车尾气中的N 2不是污染物;NO 和O 2的反应不需要催化剂;根据题中的图示,可将反应的过程分成如下两步写:2NO +O 2===2NO 2,2NO 2+4CO===N 2+4CO 2,将两步反应式合并可得总反应式为2NO +O 2+4CO=====催化剂4CO 2+N 2。
