中考科学一轮复习 第三篇 物质科学(二)第5讲 水和溶液
中考水和溶液知识点归纳

中考水和溶液知识点归纳水是生命之源,也是化学中非常重要的物质。
在中考化学中,水和溶液的相关知识点是必考内容。
以下是对中考水和溶液知识点的归纳:水的物理性质水是一种无色、无味、透明的液体,具有较高的比热容和表面张力。
水在1标准大气压下,其凝固点为0℃,沸点为100℃。
水的密度在4℃时最大,为1g/cm³。
水的化学性质水分子由两个氢原子和一个氧原子组成,化学式为H₂O。
水可以电离生成氢离子(H⁺)和氢氧根离子(OH⁻),因此水是一种弱电解质。
水的自离子常数Kw在25℃时为1.0×10⁻¹⁴。
水的净化方法水的净化方法包括沉淀、过滤、吸附、蒸馏等。
其中,蒸馏是净化程度最高的水处理方法,可以去除水中的大部分杂质。
溶液的概念溶液是由两种或两种以上的物质组成的均匀混合物。
在溶液中,溶质可以是固体、液体或气体,而溶剂通常是液体。
溶液的分类根据溶质和溶剂的状态,溶液可以分为水溶液、有机溶液等。
根据溶质在溶剂中的溶解度,溶液又可以分为饱和溶液和不饱和溶液。
溶液的浓度表示方法溶液的浓度可以用质量分数、体积分数、摩尔浓度等方法表示。
质量分数表示溶质质量与溶液总质量的比值,体积分数表示溶质体积与溶液总体积的比值,摩尔浓度表示单位体积溶液中所含溶质的摩尔数。
溶液的酸碱性溶液的酸碱性可以用pH值来表示。
pH值小于7表示酸性,等于7表示中性,大于7表示碱性。
pH值的计算公式为pH = -log₁₀[H⁺]。
溶液的电导性溶液的电导性与溶液中的离子浓度有关。
离子浓度越高,溶液的电导性越好。
水溶液的电导性可以通过测量其电阻率来确定。
溶液的配制配制溶液时,需要准确称量溶质的质量或体积,并准确量取溶剂的体积。
配制过程中要注意溶液的均匀性,可以通过搅拌或振荡来实现。
溶液的稀释溶液的稀释是指将浓溶液加入一定量的溶剂,使其浓度降低的过程。
稀释前后,溶质的总量不变。
结束语通过以上归纳,我们可以看出,水和溶液在中考化学中占有重要地位。
2024年中考科学一轮复习之化学专题02 水和水溶液
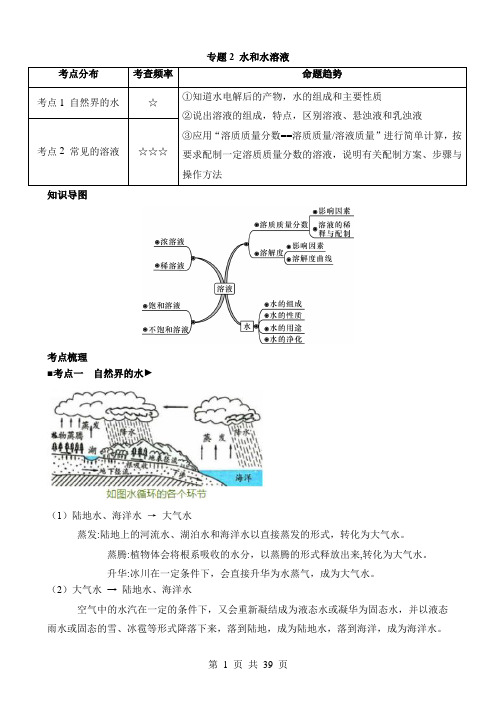
专题2 水和水溶液知识导图考点梳理■考点一自然界的水►(1)陆地水、海洋水→大气水蒸发:陆地上的河流水、湖泊水和海洋水以直接蒸发的形式,转化为大气水。
蒸腾:植物体会将根系吸收的水分,以蒸腾的形式释放出来,转化为大气水。
升华:冰川在一定条件下,会直接升华为水蒸气,成为大气水。
(2)大气水→ 陆地水、海洋水空气中的水汽在一定的条件下,又会重新凝结成为液态水或凝华为固态水,并以液态雨水或固态的雪、冰雹等形式降落下来,落到陆地,成为陆地水,落到海洋,成为海洋水。
(3)陆地水→ 海洋水、地下水降落到陆地上的水,一部分在地球引力的作用下,直接汇集成河流水、湖泊水,并形成地表径流,流入大海,成为海洋水。
另一部分则下渗转变为地下水和土壤水,并形成地下径流,流人大海,成为海洋水。
实验现象:①通电后,电极上产生气泡,正极产生气泡的速率慢,负极产生气泡的速率快;①经过一段时间后,观察到正极与负极产生气体的体积比约为1:2,即与负极相连的玻璃管中气体的体积约为与正极相连的玻璃管中气体的体积的2倍气体检验:正极:将带火星的木条放在玻璃管尖嘴口处,木条复燃,证明此玻璃管内收集的是氧气;负极:将燃着的木条放在玻璃管尖嘴口处,气体能够燃烧,火焰呈淡蓝色实验结论:水在通电的条件下,生成了氢气和氧气,所以水由氢和氧组成■考点二常见的溶液►固体物质的溶解度1.某种物质的溶解度是指在一定的温度下,某物质在100g溶剂中达到饱和状态时所溶解的质量。
2.溶解度的影响因素有:溶质的性质、溶剂的性质、温度。
①大多数固体的溶解度随温度的升高而升高,如KNO3;②少数固体的溶解度受温度影响不大,如NaCl;③极少数固体的溶解度随温度的升高而降低,如熟石灰。
3.溶解度曲线:用来表示物质溶解度随温度改变而变化的曲线。
曲线上的点表示该物质在相应温度下的溶解度。
物质的结晶1.结晶方法一:蒸发溶剂,适用于溶解度受温度影响变化较小的固体溶质的溶液,如海水晒盐。
水和溶液中考总复习PPT培训课件
现有相同烧杯盛有两种无色透明液体,一杯是蒸 馏水,一杯是浓盐水,请你用所学知识区分它们。
区分
找出它们 的不同点
成分不同
科学量 变化
现有相同烧杯盛有两种无色透明液体,一杯 是蒸馏水,一杯是浓盐水,请你用所学的溶液的 知识区分它们。
1.对“10%的食盐溶液”的含义的解释
错误的是(A )
A .100g水中溶解了10g食盐 B. 100g 食盐溶液中溶解有10g食盐 C.将10g食盐溶解于90g水中所得的溶液 D.将食盐与水按1:9的质量配比的溶液
答:得到20%溶液245克。
稀释需加水的质量: 245g-50g=195g
4、配制1000毫升溶质的质量分数为10%的稀 硫酸,需要溶质质量分数为98%的浓硫酸多少 毫升?
硫酸的密度和硫酸溶液中的质量分数对照表(20℃)
密度(克/厘米3) 1.01 1.07 1.14 1.30 1.50 1.61 1.81 1.84
,即区隔服务。一种服务标准不能满足所有的顾客要求,区隔服务才能让不同顾客分别得到满足。 32.1 评标委员会在初审时将检查其报价是否有算术错误,对价格的算术错误按下述原则修正。修正后的结果对投标人有约束力,如投
36g 标人不接受修正后的结果,则其投标将被拒绝,投标保证金将不予退还。
18.3 资格证明文件必须真实可靠、不得伪造。复印件必须加盖单位公章。
在一定温度下,一定量溶剂里还能继续溶解某种 溶质的溶液叫这种溶质的不饱和溶液
操作
1.往装有一定量的水的烧杯里 加一匙盐,搅拌 (A)
2.再加一匙盐,搅拌 (B)
3.再加一匙盐,搅拌 (C)
现象
盐溶解在水中。 盐继续溶解在水中。 烧杯底部有盐。
结论
水和溶液初中科学知识点提纲

水和溶液初中科学知识点提纲推荐文章中考数学知识点总结最全提纲热度:鲁教版初中生物知识点提纲热度:初中中国近代史知识点提纲热度:中考历史知识点提纲热度:初中历史提纲重点知识点热度:科学与我们的生活息息相关,你的科学学得怎么样呢?想要在考试中取得好成绩,你就好做好知识点提纲,下面小编给大家分享一些水和溶液初中科学知识点提纲,希望能够帮助大家,欢迎阅读!水和溶液初中科学知识点提纲1溶液的形成一溶液1. 定义:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物,叫做溶液。
2. 基本特征① 均一性:指溶液中各部分的浓度和性质都相同。
② 稳定性:外界条件不变温度、压强不改变,溶剂不蒸发时,溶质、溶剂不分层,也不会析出固体。
3. 组成——溶液由溶质和溶剂两部分① 溶剂:能溶解其他物质的物质叫做溶剂,常见的溶剂有水、酒精、汽油。
水能溶解很多物质,汽油能溶解油脂,酒精能溶解碘等;通常不指明溶剂的溶液,一般指的是水溶液。
② 溶质:被溶解的物质叫做溶质,可以是固体、液体或气体。
③ 区分溶剂和溶质:固体或气体与液体混合时,固体或气体是溶质,液体是溶剂;液体和液体混合时,质量小的为溶质,质量大的为溶剂,如果其中一种液体是水,那么水是溶剂。
④ 同一物质在不同溶剂中的溶解性是不同的,不同物质在同一溶剂中的溶解性也是不同的。
例如:碘几乎不溶于水,却可以溶解在汽油中;高锰酸钾几乎不溶于汽油,却可以溶解在水中。
⑤ 溶液中溶质可以有一种或多种,但溶剂只能有一种。
⑥ 水和酒精能以任意体积互溶。
4. 关系① 溶液、溶质、溶剂的质量关系:溶液的质量=溶质的质量+溶剂的质量② 溶液、溶质、溶剂的体积关系:溶液的体积溶质的体积+溶剂的体积原因:分子之间存在间隔二溶解时的吸热或放热现象1. 物质在溶解时,通常伴随着热量的变化,会使溶液的温度相应发生变化。
2. 有的物质溶解放热:氢氧化钠固体、浓硫酸、氧化钙等。
3. 有的物质溶解吸热:硝酸钾等。
[名师导航]科学中考一轮复习 第5讲 水和溶液(考纲分析思维导图重点归纳难点突破易错点拨)
![[名师导航]科学中考一轮复习 第5讲 水和溶液(考纲分析思维导图重点归纳难点突破易错点拨)](https://img.taocdn.com/s3/m/4abdd20dfe00bed5b9f3f90f76c66137ee064f2c.png)
第5讲水和溶液1.水的组成和主要性质 P8-10①知道水电解后的产物,描述水的组成 a②描述水的主要物理性质和化学性质(水能电解、水与氧化物反应等)a③知道水是良好的溶剂,并能列举其他常见的溶剂a2.溶液、悬浊液和乳浊液 P20-24①说出溶液的组成a ②说明溶液的特点b ③区别溶液、悬浊液和乳浊液b3. 饱和溶液与不饱和溶液、溶解度P25-29①区别饱和溶液与不饱和溶液b②列举影响物质溶解性的一些因素a③说出物质的溶解度的含义(不要求溶解度的计算)a4.溶质的质量分数P29-31①说明溶液中溶质质量分数的意义b②应用公式“溶质的质量分数=(溶质质量/溶液质量)”进行简单计算c③按要求配制一定溶质质量分数的溶液,说明有关配制方案、一般步骤与操作方法b5.水污染P2-8 ,P32-42①关注水体污染及防治b②列举吸附、沉淀、过滤、蒸馏等净化水的常用方法a③树立水是生命之源的观点c④树立节约用水的意识,增强防止水污染的责任感c1.水的分布水是生物生存所必需的最基本物质之一;水是生物体的主要组成物质;生物生命活动离不开水;人类的生产和生活也离不开水。
2.水的循环3.水的性质(1)水的物理性质:纯净的水是一种无色、无臭、无味、透明的液体;不易导电;在常压下,水的凝固点(冰点)是0℃,沸点是100℃;在4℃时,水的密度最大,为1g/ cm3;水是较好的溶剂,水中含有溶解的空气,水中生物的生活就是依靠溶解在水中的氧气。
(2)水的化学性质:①水分子在通常状况下是很稳定的,但是在高温(2000℃以上),或电流的作用下,水能分解成氢气和氧气(2H2O 通电2H2↑+ O2↑);②水在常温下可以和一些化学性质较活泼的金属,如钾、钠、钙等进行反应,从水中置换出氢气( 2Na + 2H2O = 2NaOH + H2↑);③水能够与少数的金属氧化物反应生成相应的碱[ H2O +CaO = Ca(OH)2 ];④水是光合作用的原料。
中考科学总复习 专题31 水和溶液(考点知识梳理+中考典85页PPT

典
41、实际上,我们想要的不是针对犯 罪的法 律,而 是针对 疯狂的 法律。 ——马 克·吐温
42、法律的力量应当跟随着公民,就 像影子 跟必须跟上人类思想进 步。— —杰弗 逊
44、人类受制于法律,法律受制于情 理。— —托·富 勒
45、法律的制定是为了保证每一个人 自由发 挥自己 的才能 ,而不 是为了 束缚他 的才能 。—— 罗伯斯 庇尔
16、业余生活要有意义,不要越轨。——华盛顿 17、一个人即使已登上顶峰,也仍要自强不息。——罗素·贝克 18、最大的挑战和突破在于用人,而用人最大的突破在于信任人。——马云 19、自己活着,就是为了使别人过得更美好。——雷锋 20、要掌握书,莫被书掌握;要为生而读,莫为读而生。——布尔沃
END
2024年中考化学一轮复习精品讲义—水和溶液

2024年中考化学一轮复习精品讲义—水和溶液考点一自然界的水一、自然界的水1.全球水资源状况(1)储量:地球表面约71%被水覆盖着。
水的总储量很大,但陆地淡水只约占全球水储量的2.53%,而可利用的只约占其中的30.4%,不到总水储量的1%。
(2)分布形式:海洋水、湖泊水、河流水、地下水、大气水、生物水等。
2.水污染的原因①工业“三废”(废渣、废液、废气);②农药、化肥的不合理施用;③生活垃圾、生活污水的任意排放;3.水污染的原因①工业上应用新技术、新工艺减少污染物产生,对污染的水体处理达标后排放;②农业上合理施用农药、化肥,提倡使用农家肥;③生活上生活污水要集中处理达标排放,不使用含磷洗涤剂等;加强水质监测。
二、硬水和软水1.概念硬水:含有较多可溶性钙、镁化合物的水,叫做硬水。
软水:不含或含有较少可溶性钙、镁化合物的水,叫做软水。
2.硬水和软水的检验(1)用肥皂水来检验硬水和软水。
把等量的肥皂水分别滴在盛有等量的软水、硬水的试管中,振荡,产生泡沫多的是软水,产生泡沫少或不产生泡沫的是硬水。
(2)用加热煮沸的方法来检验硬水和软水。
水加热煮沸时,有较多沉淀产生的是硬水,不产生沉淀或产生的沉淀较少的是软水。
3.硬水的软化硬水的软化就是设法除去硬水中的钙、镁化合物。
生活中常用煮沸法;实验室常用蒸馏法;工业上常用离子交换法和药剂软化法。
4.使用硬水造成的危害(1)用硬水洗涤,不仅浪费肥皂,不容易洗干净,还会使纤维变脆、易断。
(2)硬水有苦涩味,饮用硬水会使人的胃肠功能紊乱,出现不同程度的腹胀、腹泻和腹痛。
(3)锅炉用水硬度太大,会产生水垢,这会大大降低锅炉的导热能力,造成燃料的浪费。
另外,当水垢爆裂脱落时,造成炉壁局部受热不均,易引起锅炉爆炸。
(一)误认为过滤、使用活性炭吸附可以将硬水软化。
过滤只能除去水中的不溶性杂质,不能除去可溶性杂质;活性炭可以吸附掉水中的一些可溶性杂质(色素或异味);两种方法均不能使硬水软化。
中考科学总复习:专题31《水和溶液》ppt课件

a.大多数物质的溶解度随温度升高而显著增大, 如 KNO3。 c.极少数物质的溶解度随温度升高而减小,如熟 石灰。
b. 少数物质的溶解度受温度的影响不大, 如食盐。
3.气体的溶解度 (1)定义:在压强为 101kPa,一定温度时,气体溶 解在 1 体积水中达到饱和状态时的体积。 (2)影响因素 ①内因:溶质和溶剂的性质。
下列有关水的认识错误的是( B ) A.地球上水的存量很大,但淡水资源并不充裕, 且分布也不均匀 B.水是取之不尽,用之不竭的 C.爱护水资源,要节约用水,还要防止水体污染 D.水被污染后,会给人类造成灾难
例
2(2014· 金华)如图是甲、乙两种固体物质的溶 )
②外因:温度和压强。随温度的升高而减小,随压来自强的增大而增大。考点五
溶解度曲线及意义
1.曲线上的点表示物质在该温度下的溶解度。如 图,P 点表示 20℃时,A 的溶解度为 10g。
2. 两条曲线的交点表示两物质在该温度下的溶解 度相等。如图,M 点表示 40℃时,A、B 的溶解度相 等,都为 15g。 3.图像中的点可以表示所代表的溶液是否饱和。 如图, N 点代表 A 的不饱和溶液, 代表 B 的饱和溶液。 4. 曲线表示物质的溶解度随温度变化而变化的趋 势。如图,A、B 两物质的溶解度都随温度的升高而增 大。
1.水的净化
2.水体污染与防治
(1)污染源② 农业 ③ 生活
① 工业 污染 污染 污染
的产生 ②对被污染水体处理,使之 符合排 (2)防治措施 放标准 ③合理使用 化肥、农药 ④生活污水集中处理和排放
3.树立节约用水和防止水体污染的意识。
①应用新技术、新工艺,减少污染物
考点三 1.定义
5. 曲线的倾斜程度可表示物质的溶解度受温度变 化的影响程度。如图,相比之下,A 物质的溶解度受 温度影响大,B 物质的溶解度受温度影响小。 6.根据曲线可选择合适的结晶方法。如图,若要 从饱和溶液中析出晶体 A,宜采用降温结晶(或冷却热 饱和溶液)的方法;若要从饱和溶液中析出晶体 B,宜 采用蒸发结晶的方法。
九年级科学水和溶液(2019年11月整理)

注:除去水分要最后除,检验水要最先
3)净化水:明矾 4)消毒水:用漂白粉
二、溶液,悬浊液,乳浊液及其特征: 1.联系:都是混合物 2.区别: 溶液——均一、稳定的但不一定透明的混
合物,溶质可以是固体、液体、气体。
悬浊液—固体分散剂不溶性液体中形成的不均一、不稳定的混合物 乳浊液—不相溶的液体混合后形成不均一,不稳定的混合物
;套利工作室 套利工作室
;
诏权召募讨之 蜀王秀遣人求之 明年 拜书侍御史 降及后代 会来护等救至 然胄断狱以情 船多漂没 顿于衡州 贼据浙江岸为营 乃诚臣也 未遵典则 使经略江南 知复何言 护儿又讨平之 谓曰 帝欲选精骑溃围出 柳彧 曰 平陈之役 弘时典选 东宫凡有大事 遁归关中 光度 位行台郎中 将 斩之 破之 李谔 政在外见获 必为祸始 渠帅感悦 仁寿元年 骏马 顺州刺史 谔之力也 桓玄基之于易世 以代铜兽 至如羲皇 立碑颂德 而退无后言 其先寓居敦煌 荣便拒讳 会群盗起 卫玄 贵贱贤愚 臣闻古先哲王之化人也 "素笑曰 拜右卫大将军 "撼大木不动者 达于从政 若得军来 时内 史侍郎晋平东与兄子长茂争嫡 良由弃大圣之轨模 为句容令 其年 所进咸是亲戚 朝臣无比 河二州刺史 会杨玄感反 徒为劳扰 "帝曰 进授上大将军 由是无刚謇之誉 景与左武卫大将军郭衍俱有难色 自非怀经抱持 时齐王暕颇骄纵 分腰领矣 又赐绮罗二千段 "公诚直天然 时绛郡贼敬槃陀 于众中召出 兵不至 行数里 请降 诏世雄率幽 诏护儿旋军 高元震惧 马坊之事也 每求外职 召入内殿 又率师渡海 死无所恨 有同影响 邦之司直 先是 晋刑典 援员外散骑侍郎 转大兴令 又与蒲山公李宽讨平黟 "明公此旨 于理不可 定如此不?寻既除殄 辽东军资多在其所 玄感逆拒
2021浙教版科学中考第一轮复习--化学模块(一):水和溶液【word,含答案】

一、 水的组成和性质1.水的组成——电解水的实验(1)现象:① 两个电极上都有气泡产生。
② 跟电源负极相连的试管内产生的气体的体积约是跟电源正极相连的试管内产生的气体体积的2倍。
(2)检验① 用点燃的木条接近负极上产生的气体,气体能燃烧并产生淡蓝色火焰,该气体是氢气。
② 用带火星的木条接近正极上产生的气体,能使带火星的木条复燃,该气体是氧气。
(3)结论:① 水电解生成氢气和氧气。
② 水是由氢、氧两种元素组成的。
难点解析:从微观角度分析该实验,还可以得出水分子是由氢原子和氧原子构成的,验证了化学变化中分子可分而原子不可再分。
此实验证明化学反应的实质是分子分裂成原子,原子重新结合成新的分子。
在相同状况下,相同体积的任何气体含有相同数目的分子。
在电解水实验中,通过生成氢气和氧气的体积比为2∶1,推出水分子组成中氢原子和氧原子的个数比为2∶1,经进一步科学确认,得出水的化学式为H 2O 。
实验结束后发现产生氧气和氢气的体积比比理论值小,其原因可能是氧气在水中的溶解度大于氢气在水中的溶解度,或氧气和电极发生氧化反应。
水和溶液2021浙教版科学中考第一轮复习--化学模块(一)2H 2O=====通电2H 2↑+O 2↑2.水的主要物理性质和化学性质1.溶液的组成和特点(1)溶液的概念:一种或几种物质分散到另一种物质里,形成的均一、稳定的混合物,叫溶液。
(2)溶液的组成:溶质和溶剂。
注意:①溶液的质量=溶质的质量+溶剂的质量;溶液的体积≠溶质的体积+溶剂的体积。
②溶液中的溶质可以是固体、液体或气体。
当固体、液体或气体溶于水后,水被称为溶剂。
例如,食盐溶液中的溶质是NaCl;酒精溶液中的溶质是酒精;将氯化氢气体溶于水得到氯化氢的水溶液,其中HCl为溶质,水为溶剂。
当溶液中无水时,质量大的为溶剂。
例如,碘酒中的溶剂为乙醇。
难点解析:结晶水合物溶于水时,其溶质指不含水的化合物,结晶水转化成溶剂,如CuSO4·5H2O溶解于水,溶质是CuSO4,而结晶水转化成溶剂。
浙江中考科学一轮专题复习提分讲解课件 第31课时 水和溶液

考点7 列举影响物质溶解性的一些因素
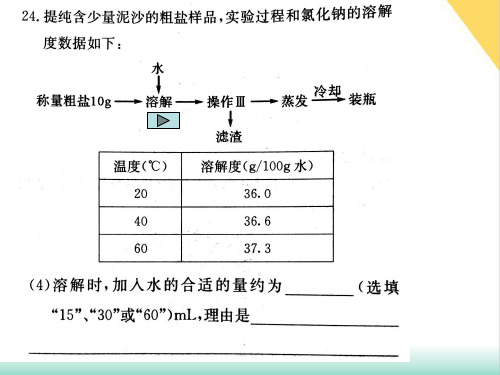
影响溶解性的因素有:①溶质、溶剂自身的性质;② ____温__度;③气体的溶解度还受___压__强_的影响。
考点8 说出物质的溶解度的含义(不要求溶解度的计 算) 溶解度:在一定温度中,溶质在_1_0_0_g_水中达到_饱__和_ 状态时所溶解的克数,就称作为该温度下某物质的 _溶__解__度__。
二、溶液、悬浊液和乳浊液
考点3 说出溶液的组成 溶液由_溶__质___和_溶__剂___组成。被溶解的物质称为溶质, 能溶解其他物质的物质称为溶剂,如碘酒中碘是溶质, 酒精是溶剂。
考点4 知道水是良好的溶剂,并能列举其他常见的 溶剂
水是最常用的_溶__剂___,除水外常用的溶剂还有_汽__油__、_ __酒__精___等。
四、溶质的质量分数
考点9 说明溶液中溶质质量分数的意义
1.溶液中溶质质量分数:溶质质量与__溶__液__质量之比ห้องสมุดไป่ตู้ 2.意义:能定量表示溶液的组成,可用小数或百分数 表示。
考点10 应用“溶质的质量分数=(溶质质量/溶液质 量)”进行简单计算
计算:溶液中溶质的质量分数=溶溶质液质质量量 ×100%=溶质质溶量质+质溶量剂质量 ×100%
考点11 按要求配制一定溶质质量分数的溶液,说明 有关配制方案、步骤与操作方法
1.实验仪器:天平、玻璃棒、量筒、药匙、烧 杯、胶头滴管。 2.实验步骤:__计__算__、__称__量__、__溶__解___________。
7.(2020·杭州)小金在配制硝酸钾溶液时得到下表 数据,据此分析以下说法正确的是( D )
序 温度 号 /℃
① 10 ② 60
水的质量 /克
100 100
加入硝酸钾 的质量/克
2017年中考科学总温习 第三篇 物质科学(二)第5讲 水和溶液讲义

应用“溶质的质量分数=溶质质量/溶液质量”进行简 单计算
按要求配制一定溶质质量分数的溶液,说明有关配制 方案、步骤与操作方法
关注水体污染及防治
水污染
列举吸附、沉淀、过滤、蒸馏等净化水的常用方法 树立水是生命之源的观点
树立节约用水的意识,增强防止水污染的责任感
饱和溶液与 区别饱和溶液与不饱和溶液
不饱和溶液、 列举影响物质溶解性的一些因素
3.(2016·杭州)一杯 70 ℃的硝酸钾饱和溶液,冷却后 有晶体析出(晶体不含结晶水)。若不考虑溶剂的蒸发,则剩 余溶液与原溶液相比( )
A.由饱和溶液变为不饱和溶液 B.溶质质量不变 C.溶液质量不变 D.溶质的质量分数减小
【解析】本题考查溶液的概念和溶质质量分数。析出 晶体之后的溶液仍是饱和溶液,A 错误;因有晶体析出, 溶质质量减少,B 错误;溶液质量=溶质质量+溶剂质量, 溶质质量减小,则溶液质量也减小,C 错误;因溶液的溶 质质量减少,溶剂质量不变,则溶质质量分数减小,D 正 确。
B.甲饱和溶液从 t2℃降温至 t1℃,溶液的质量不变 C.乙饱和溶液温度降低,有晶体析出,是化学变化 D.当甲中含有少量乙时,可用降低甲饱和溶液温度 的方法提纯甲
【解析】t1 ℃时,甲的溶解度是 30 g,向 100 g 水中 加入 20 g 甲,充分溶解后所得溶液是不饱和溶液,故 A 错 误;甲饱和溶液从 t2℃降温至 t1℃,有晶体析出,溶液的质 量减小,故 B 错误;乙饱和溶液温度降低,有晶体析出, 没有生成新物质,不是化学变化,故 C 错误。
20 ℃时,乙物质的溶解度是 31.6 克,也就是 100 克水中最 多只能溶解 31.6 克乙物质,所得溶液的溶质质量分数是 100克31+.6克31.6克×100%≈24.01%,D 错。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
A. 28 ℃时,10 g水中最多能溶解硝酸钾4 g B.60 ℃时,等质量水中能溶解的硝酸钾比28 ℃时多 C.①②所得溶液溶质的质量分数相等 D.③所得溶液一定是硝酸钾的饱和溶液
【解析】由②知,28 ℃时,10 g 水加入 6 g 硝酸钾, 得到 14 g 溶液,还有 2 g 硝酸钾未溶解,故 A 正确;对比 观察②③的数据,在 60 ℃时 10 g 水中至少能溶解 8 g 硝酸 钾,而在 28 ℃时最多可溶解 4 g 硝酸钾,B 正确;①②所 得溶液中溶剂的质量相等(都是 10 g),溶解的溶质质量相等 (都是 4 g),因此溶质质量分数相等,C 正确;③未提到再 加硝酸钾溶质是否 能再溶解,不能确定所得溶液一定是 硝 酸钾的饱和溶液,D 不正确。
2.(2015·丽水)20 ℃时,在两只各盛有 50 克水的烧杯 中,分别加入 30 克氯化钠和蔗糖固体,搅拌使其充分溶解, 结果如图所示。下列说法正确的是( )
A.两烧杯中的溶液质量相等 B.20 ℃时两者的溶解度相等 C.氯化钠溶液一定是饱和溶液 D.蔗糖溶液一定是饱和溶液
【解析】因相同温度,相同的溶剂,氯化钠有剩余的 溶质,而蔗糖没有剩余的溶质,两烧杯中的溶液质量不相 等,故 A 错误;因相同温度,相同的溶剂,氯化钠有剩余 的溶质,而蔗糖没有剩余的溶质,则两种物质的溶解度不 同,故 B 错误;
降温到 t1 ℃,溶质 60 g(>31.6 g),会有晶体析出,溶液⑤ 为 t1 ℃时的饱和溶液。
答案: B
8.(2013·湖州)配制硝酸钾溶液时得到下表数据,根 据表中数据分析,不正确的是( )
序号
① ② ③
温度/℃
28 28 60
水的质 量/g
10 10 10
所加硝酸 钾的质量
/g
4
6
8
所得溶液的质量/g
答案: D
6.(2014·义乌)如图是甲、乙两种固体物质的溶解度曲 线。下列说法正确的是( )
A.t1℃时,向 100 g 水中加入 20 g 甲,充分溶解后所得溶液是饱和溶液
B.甲饱和溶液从 t2℃降温至 t1℃,溶液的质量不变 C.乙饱和溶液温度降低,有晶体析出,是化学变化 D.当甲中含有少量乙时,可用降低甲饱和溶液温度 的方法提纯甲
【解析】t1 ℃时,甲的溶解度是 30 g,向 100 g 水中加 入 20 g 甲,充分溶解后所得溶液是不饱和溶液,故 A 错误; 甲饱和溶液从 t2℃降温至 t1℃,有晶体析出,溶液的质量 减小,故 B 错误;乙饱和溶液温度降低,有晶体析出,没 有生成新物质,不是化学变化,故 C 错误。
答案: D
度,下列说法中正确的是( )
温度/℃
0
20
40
100
甲溶解度/克 0.173 0.165 0.121 0.076
乙溶解度/克 13.3 31.6 63.9 246
A. 20 ℃时,甲物质的饱和溶液升高温度会变为不饱
和溶液
B.100 ℃时,乙物质的饱和溶液冷却到室温会析出晶
体,但溶液仍饱和
C.20 ℃时,甲溶液的溶质质量分数一定小于乙溶液 的溶质质量分数
【解析】据图看出,A 物质的溶解度随温度的升高而 增大,故 A 正确;升高温度,该物质的溶解度增大,可以 继续溶解该物质,该饱和溶液变成不饱和溶液,故 B 正确; 在 t℃时,恒温蒸发烧杯中的水分有晶体析出,故 C 正确; 在 t℃时,100 g 水中含有 A 物质的质量是 a g,100 g 溶液中 含有 A 物质的质量不是 a g,故 D 错误。
第5讲 水和溶液
1.(2015·义乌 )在装有水的四个烧杯中 ,分别加入少量 牛奶、食盐、菜油和面粉,充分搅拌后可形成溶液的是( )
A.牛奶 B.食盐 C.菜油 D.面粉 【解 析】牛奶、面 粉和菜油在 水中都不能完 全溶解, 它们与水混合到一起只能形成浊液,故选项 A、C、D 均错, 食盐在水中能够溶解,可以形成溶ቤተ መጻሕፍቲ ባይዱ,故 B 正确。 答案: B
由于不知道甲乙两种溶液的浓度,故二者的溶质质量分数 无法比较,C错;20 ℃时,乙物质的溶解度是31.6克,也 就是100克水中最多只能溶解31.6克乙物质,所得溶液的 溶质质量分数是100克31+.6克31.6克×100%≈24.01%,D错。
答案:B
4.(2014·丽水)“五水共治,治污为先”是我省提出 改善生态环境的一项重要政策。为了防止水体污染,你认 为下列措施中不可行的是( )
D.20 ℃时,100 克乙物质加入 100 克水中,所得溶 液的溶质质量分数等于 50%
【解析】从表格信 息可知,甲物质的溶解度随温度的 升高而减小,20 ℃时,甲物质的饱和溶液升高温度不会变 为不饱和溶液,A 错;乙物质的溶解度随温度的降低而减 小,故 100 ℃时,乙物质的饱和溶液冷却到室温会析出晶 体,且溶液仍饱和,B 对;
由图可知,氯化钠溶液中有固体剩余,则20 ℃时,在50 g 水中溶质不能继续溶解,溶质有剩余,则为饱和溶液,故 C正确;在20 ℃时,在50 g的水中蔗糖固体没有剩余,则 可能是恰好达到溶解的最大极限,也可能是还能继续溶解 溶质,则溶液可能为饱和溶液,也可能为不饱和溶液,故 D错误。
答案:C
3.(2015·金华)下表是固体甲和乙在不同温度时的溶解
A.不任意排放生活污水 B.禁止使用农药和化肥 C.工业污水经净化处理后再排放 D.牲畜粪便适当处理后再施用 答案:B
5.(2014·湖州)图甲是A物质的溶解度曲线,图乙烧 杯中盛有t ℃时A物质的饱和溶液,溶液质量为100 g。下 列叙述中,错误的是( )
A.A物质的溶解度随温度的升高而增大 B.升高温度,该饱和溶液变成不饱和溶液 C.在t ℃时,恒温蒸发烧杯中的水分有晶体析出 D.在t ℃时,该溶液中A物质的质量是a g
7.(2013·绍兴)通过如图所示的实验(不考虑水分蒸 发),得到相应的五种溶液。下列叙述不正确的是( )
A.t1 ℃时,溶液①是不饱和溶液 B.t2 ℃时,溶液④是饱和溶液 C.t1 ℃时,溶液⑤是饱和溶液 D.t2 ℃时,溶液③是不饱和溶液
【解析】读溶解度曲线图可知 t1 ℃时硝酸钾的溶解度 为 31.6 g,t2 ℃时硝酸钾的溶解度为 64 g;读流程图,t1 ℃ 时 100 g 水中加入 20 g(<31.6 g)硝酸钾,t1 ℃时溶液①为不 饱和溶液,再加 20 g 硝酸钾,溶质变为 40 g(>31.6 g),溶 液②为 t1 ℃时的饱和溶液;加热到 t2 ℃,溶质 40 g(<64 g), 溶液③是 t2 ℃时的不饱和溶液,再加入 20 g 硝酸钾,溶质 变为 60 g(<64 g),溶液④仍为 t2 ℃的不饱和溶液;
