电解质在水溶液中的反应
电解质在水溶液中的反应

H+ +OH-=H2O
3、书写步骤: 书写步骤: ①写:写出正确且配平的化学方程式、 写出正确且配平的化学方程式、 ②拆:将可溶性电解质写成离子形式 ③删:删去方程式两边没有参加反应 的离子 ④查:检查方程式两边是否遵守质量守恒定律和 电荷守恒。 电荷守恒。是否可约简
实验探究: 实验探究:
分别向NaCl、Na2CO3溶液中滴加AgNO3溶 分别向NaCl、Na2CO3溶液中滴加AgNO3溶 NaCl 溶液中滴加AgNO3 再加入HNO3 探究Cl HNO3, Cl液,再加入HNO3,探究Cl-的检验问题
反应实质: 生成难电离物质H 反应实质: 生成难电离物质 2O 本质特点: 本质特点: 溶液中离子之间生成难电离物质
=
问题 迁移3 迁移3
向盛有Na 向盛有Na2CO3溶液的试管 中滴加HCl HCl溶液 中滴加HCl溶液
实验现象: 实验现象: 溶液中有气泡产生 HCl = H+ + Cl+ Na2CO3 = CO32- + 2Na+ H2CO3=CO2 ↑ + H2O
生成Cu(OH)2沉淀 生成 溶液中离子之间生成难溶性物质
=
问题 迁移2 迁移2
向盛有酚酞的NaOH溶液的试管 溶液的试管 向盛有酚酞的 中滴加HCl溶液 中滴加 溶液
实验现象:溶液由红色(粉红) 实验现象:溶液由红色(粉红)变为无色 HCl = H+ + Cl+ NaOH = OH- + Na+ H2O
碳酸, 气体和H 反应实质: 生成碳酸 碳酸分解为CO2气体和 2O 反应实质: 生成碳酸,碳酸分解为 本质特点: 本质特点: 溶液中离子之间生成难电离物质和 易挥发物质
第2课时 电解质在水溶液中的反应

第2课时 电解质在水溶液中的反应[目标导航] 1.了解离子反应发生的条件及应用。
2.掌握离子方程式的书写步骤。
3.了解常见离子的检验方法。
一、离子反应1.探究电解质在水溶液中反应的实质2.概念在溶液中 的化学反应。
3.实质溶液中离子的种类或浓度发生变化。
二、离子反应发生的条件 1.实验探究2.复分解型离子反应发生的条件三、离子方程式1.概念用实际参加反应的 来表示反应的式子。
2.书写步骤3.意义(1)表示某一个具体的化学反应:如CuSO 4+Ba(OH)2===Cu(OH)2↓+BaSO 4↓表示为Cu 2++SO 2-4+Ba 2++2OH -===Cu(OH)2↓+BaSO 4↓。
(2)表示同一类型的离子反应:如H ++OH -===H 2O 可以表示NaOH 和HCl 、NaOH 和H 2SO 4、KOH 和H 2SO 4等的反应。
【练一练】1.下列不能发生离子反应的是________(填序号)。
①NaCl 溶液与AgNO 3溶液 ②KNO 3溶液与NaOH 溶液 ③稀硫酸与BaCl 2溶液 ④盐酸与Na 2CO 3溶液 ⑤Na 2CO 3溶液与Ca(OH)2溶液 ⑥NaOH 溶液与稀HNO 3溶液 ⑦锌与CuSO 4溶液 ⑧稀H 2SO 4和NaCl 溶液 ⑨Na 2SO 4溶液和CuCl 2溶液2.根据离子方程式的书写步骤写出CaCO 3与稀盐酸反应的离子方程式。
写――→化学方程式CaCO 3+2HCl===CaCl 2+H 2O +CO 2↑ ↓拆——→CaCO 3+2H ++2Cl -===Ca 2++2Cl -+H 2O +CO 2↑↓删——→CaCO 3+2H +===Ca 2++H 2O +CO 2↑↓查——→电荷守恒、原子守恒3.下列能用H++OH-===H2O表示的反应有________(填序号)。
①澄清石灰水和硝酸②氢氧化镁和盐酸③氢氧化钡和稀硫酸④醋酸和氢氧化钠溶液⑤氢氧化钠溶液和稀硫酸⑥氢氧化钠溶液和二氧化碳4.将下列不能大量共存的离子用直线连起来。
电解质在水溶液中的反应

(3)删:把两边没有反应的离子删去 2Na+ +2OH- + Cu2+ + SO42=Cu(OH)2+2Na++SO42-
2OH- + Cu2+ = Cu(OH)2
[注]系数如果不是最简,应化为最简比
[实验]: 向0.01mol/LBa(OH)2溶液中滴加0.2mol/LH2SO4溶液,观
察现象
4、离子方程式:
用实际参加反应的微粒符号来表示化学反应的式子
如:CuSO4与BaCl2 Ba2+ +SO42-= BaSO4
AgNO3与NaCl Ag+ +Cl- = AgCl
Na2CO3与HCl CO32- + 2H+ = CO2 + H2O
(4)查:查是否遵守质量守恒,电荷守恒,遵守客观实际
.
.
.
.
.
.
.
.
.
.
;淘小铺 淘小铺邀请码 淘小铺最新邀请码
CaCO3与HCl CaCO3 + 2H+ = Ca2+ + CO2 + H2O
NaOH与HCl H+ + OH- = H2O
[讨论] 离子方程式:Ba2+ + OH- + H+ + SO42- = BaSO4 +H2O是否 正确?
5、离子方程式的书写步骤: (1)写:写出正确的化学方程式(是关键) 例:2NaOH + CuSO4 = Cu(OH)2 + Na2SO4 (2) 拆:将易溶于水的强电解质拆成离子形式 2Na+ +2OH- + Cu2+ + SO42- = Cu(OH)2 +2Na++SO42-
《电解质在水溶液中的反应》参考教案
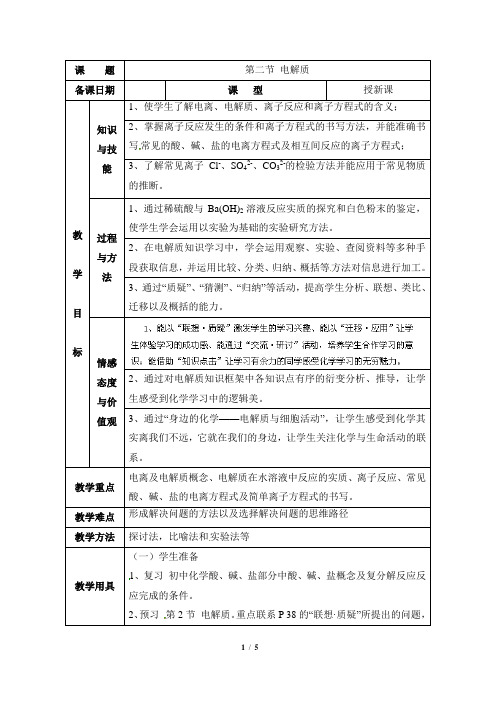
课题第二节电解质备课日期课型授新课教学目标知识与技能1、使学生了解电离、电解质、离子反应和离子方程式的含义;2、掌握离子反应发生的条件和离子方程式的书写方法,并能准确书写常见的酸、碱、盐的电离方程式及相互间反应的离子方程式;3、了解常见离子Cl-、SO42-、CO32-的检验方法并能应用于常见物质的推断。
过程与方法1、通过稀硫酸与Ba(OH)2溶液反应实质的探究和白色粉末的鉴定,使学生学会运用以实验为基础的实验研究方法。
2、在电解质知识学习中,学会运用观察、实验、查阅资料等多种手段获取信息,并运用比较、分类、归纳、概括等方法对信息进行加工。
3、通过“质疑”、“猜测”、“归纳”等活动,提高学生分析、联想、类比、迁移以及概括的能力。
情感态度与价值观2、通过对电解质知识框架中各知识点有序的衍变分析、推导,让学生感受到化学学习中的逻辑美。
3、通过“身边的化学——电解质与细胞活动”,让学生感受到化学其实离我们不远,它就在我们的身边,让学生关注化学与生命活动的联系。
教学重点电离及电解质概念、电解质在水溶液中反应的实质、离子反应、常见酸、碱、盐的电离方程式及简单离子方程式的书写。
教学难点形成解决问题的方法以及选择解决问题的思维路径教学方法探讨法,比喻法和实验法等教学用具(一)学生准备1、复习初中化学酸、碱、盐部分中酸、碱、盐概念及复分解反应反应完成的条件。
2、预习第2节电解质。
重点联系P 38的“联想·质疑”所提出的问题,有的放矢的进行阅读与思考。
(二)教师准备1、教学媒体、课件(或积件)、学生用的学案;2、相关演示实验器材及药品课时安排3课时教学内容设计与反思一、复习导入:二、讲授新课:【板书】二、电解质在水溶液中的反应1、电解质在水溶液中反应的实质【演示实验】先向稀硫酸中加入石蕊溶液,接着按P41图2-2-8所示装置连接,然后向稀硫酸中滴加Ba(OH)2溶液(指导学生边观察实验边做好下表实验记录)。
电解质在水溶液中的反应

弱酸 CH3COOH 难电离 弱碱 NH · O 3 H2 水
③气体、单质、氧化物写 分子式 ;
离子方程式的正误判断:
(1)看离子反应是否符合客观事实。
铁放入稀硫酸中:2Fe+6H+=2Fe3++3H2↑
(2)看物质改写是否正确。 盐酸和碳酸钙反应:CO32-+2H+=CO2↑+ H2O
(3)看原子个数和电荷数是否守恒。
1、判断离子方程式是否正确。 “改”,改写原则: 书写步骤:
①易溶且易电离的物质改写为 离子形式 ; ①“写”,首先以客观事实为依据写出正确的化学方程式 强酸 HCl、H2SO4、HNO3 ②“改”,按各物质在溶液中实际存在的微粒形式改写 ; 易电离 强碱 KOH 、 NaOH 、Ca(OH) Ba(OH) 2、 2 ③“删”,将反应前后没变化的离子按数 删去; 绝大数盐 ④“查”,检查方程式是否遵循质量守恒 与电荷守恒。 ②难溶或难电离的物质写为 分子式 ;
9、纯碱与醋酸反应:
写出下列反应的离子方程式:
10、氢氧化钡溶液和硫酸铜溶液反应 : 11、铁和硫酸铜溶液反应 : 12、铁和稀硫酸反应 : 13、金属钠和水反应: 14、氯气和水 15、过氧化钠与水 16、氯气与氢氧化钠
错例分析:指出下列离子方程式属于哪种错误,并改正
1、氢氧化铁与盐酸反应:H++OH-=H2O 应为: Fe(OH)3+3H+=Fe3++3H2O 2、石灰石与盐酸反应: CO32-+2H+=CO2↑+H2O 应为: CaCO3+2H+=Ca2++CO2↑+H2O
2.离子方程式
氢氧化钠溶液与盐酸反应的离子方程式: OH-+H+=H2O
电解液溶于水

电解液溶于水在化学领域中,电解液是一种可以导电的溶液或熔融物质,它在水中溶解时,能够分解成带电离子(阳离子和阴离子)。
这种电离过程是通过水分子的溶解作用来实现的。
当电解质溶解于水中时,它会与水分子之间发生相互作用,导致电解质分子或离子与水分子形成溶解层。
这种溶解层的形成可以通过水分子的氢键与电解质的离子进行相互吸引。
对于带电离子,它们会与水分子中的部分氧原子形成氢键,而对于中性分子,则通过分子间的静电相互作用与水分子相互吸引。
当电解质溶解于水时,溶液中的离子会在水中自由移动。
根据电解质的属性,它可以分为强电解质和弱电解质。
强电解质能够完全离解成离子,而弱电解质只能部分离解。
这取决于电解质在水中的溶解度和其离解程度。
在电解质溶液中,带正电荷的离子被称为阳离子,而带负电荷的离子则被称为阴离子。
通过离子间的相互作用,电解质溶液可以导电。
当外加电场施加在电解质溶液中时,离子会根据电荷的不同,向相应的电极进行运动。
阳离子会向着阴极(负极)移动,而阴离子则会向着阳极(正极)移动。
这种由于离子迁移引起的电流流动被称为电解。
电解是一种重要的化学反应方式,被广泛应用于电池、电解池和电解质溶液的制备等领域。
通过控制电解液的成分和浓度,可以调节电解过程中的离子迁移速率和产物生成速率。
这对于很多实际应用非常重要,例如电镀、金属提取、水解制氢等。
需要注意的是,电解质的选择对于电解过程的效率和稳定性起着至关重要的作用。
一些常见的电解质包括酸、碱和盐等,它们的选择要根据具体的实验需求和反应条件来确定。
总的来说,电解质溶于水是一种重要的化学现象,它使得溶液能够导电,并且通过电解反应产生新的物质。
通过深入理解电解质溶解过程和其中的离子迁移规律,我们可以更好地利用电解现象来满足不同领域的需求,促进科学技术的发展。
水和溶液的电解现象

水和溶液的电解现象电解现象是指在通电条件下,电解质溶液中的化学物质发生分解的过程。
水和溶液的电解现象是化学中的一个重要知识点,涉及到电解质、非电解质、电解原理、电极反应等概念。
1.电解质:电解质是指在水溶液中或熔融状态下能导电的化合物。
电解质溶液中的电解质分子或离子在电场作用下,发生分解反应。
2.非电解质:非电解质是指在水溶液中或熔融状态下不能导电的化合物。
非电解质溶液中的非电解质分子不发生分解反应。
3.电解原理:电解原理是指在通电条件下,电解质溶液中的阳离子向阴极移动,阴离子向阳极移动,并在相应的电极上发生氧化还原反应。
4.电极反应:电极反应是指在电解过程中,电解质溶液中的离子在电极上发生的氧化还原反应。
电极反应分为两个步骤:氧化反应和还原反应。
5.电解池:电解池是指进行电解实验的装置,由电解质溶液、电极和电源组成。
电解池分为直流电解池和交流电解池。
6.电解产物:电解产物是指在电解过程中,电解质溶液中的化学物质在电极上发生反应后生成的物质。
电解产物的种类和数量与电解质的种类、电解条件等因素有关。
7.电解质的电离:电解质的电离是指电解质分子在水中离解成离子的过程。
电解质的电离程度受温度、压力、电解质浓度等因素影响。
8.电解质的酸碱性:电解质的酸碱性是指电解质溶液的酸碱性质。
电解质的酸碱性与其电离产生的氢离子(H⁺)和氢氧根离子(OH⁻)的浓度有关。
9.电解质溶液的渗透压:电解质溶液的渗透压是指电解质溶液中溶质分子对水的渗透作用产生的压力。
渗透压的大小与电解质溶液的浓度、温度等因素有关。
10.电解质溶液的导电性:电解质溶液的导电性是指电解质溶液传导电流的能力。
导电性的大小与电解质溶液中离子的浓度、电荷数、离子运动速度等因素有关。
以上是关于水和溶液的电解现象的一些基本知识点,希望对您有所帮助。
习题及方法:1.习题:判断下列物质中,属于电解质的是:方法:电解质是指在水溶液中或熔融状态下能导电的化合物。
电解质在水溶液中的反应

+
② Ba(NO3)2 与 NaOH ×
√
③HCl与 NaOH
2 3
AgCl↓
④ Na CO √
与 HCl
Ag+ + Cl-= AgCl↓
二、离子方程式
定义:用实际参加反应的离子符号来表 示反应的式子叫做离子方程式。
例如:NaOH溶液与盐酸的反应属于离子 反应,实际参加反应的离子是H+和OH-, 生成物是水。 离子方程式为: H+ + OH- =H2O
问题探究二
离子方程式
交流·研讨
若能发生的,你能否模仿分析稀硫酸和氢氧化钡反 应的实质的方法,从电解质电离的角度分析出他们 判断下列电解质溶液间能否发生离子反应: 发生反应的实质
① NaCl 与 AgNO √
3
NaCl = Na+ + ClAgNO3 = NO3- + Ag+
Ag+ + Cl- = AgCl↓
强酸 强碱 可溶性盐 单质 气体 氧化物 弱电解质 难溶物(沉淀)
迁移·应用
按照上述方法书写下列反应的离子方程式: ①NaOH溶液和H2SO4溶液的反应 H+ +OH- =H2O ②KOH溶液和盐酸的反应 H+ +OH- =H2O ③BaCl2溶液和Na2SO4溶液的反应 通过对上 ①写出易溶且易 述各反应的离 电离酸、碱和盐 子方程式的比 的电离方程式; 较,你发现了 什么?你能说 ②判断哪些微粒 可相互反应; 出离子方程式 和化学方程式 ③写出离子方程 有哪些区别吗?
实验·探究
记录实验现象并分析产生现象的原因,填入下表。
实验现象 ①溶液的红色逐渐变 浅,直至消失; ②不断产生白色沉淀; ③指针不断偏向零,再 滴加时,又不断偏大。 产生现象的原因 ① H+和OH-发生了反应,溶液 中OH-离子浓度逐渐减小, ②Ba2+与SO42-发生了反应, 生成了BaSO4白色沉淀; ③溶液中离子浓度先减小,有 离子参加了反应,硫酸过量后 离子浓度又增加。
电解质在水溶液中的反应

课题:电解质在水溶液中的反应【学习目标】:知识点、考点:1、了解离子反应的概念、离子反应发生的条件。
2、能正确书写化学方程式和离子方程式。
重点、难点:1、离子方程式的书写。
【知识网络详解】知识点一离子反应1.探究电解质在水溶液中反应的实质实验操作实验现象随着H2SO4溶液的滴入,(1)电流表:指针读数先由大到小后由小到大(2)溶液:出现白色沉淀,颜色由红色变浅至无色解释稀硫酸与Ba(OH)2溶液反应的实质是溶液中的H+和OH-结合生成极难电离的水,Ba2+和SO2-4结合生成硫酸钡沉淀,溶液中离子的浓度降低2.概念:由于电解质溶于水后电离成为____________,所以,电解质在溶液中的反应实质上是______之间的反应,这样的反应称作离子反应。
3.实质:离子浓度的改变。
4.复分解型离子反应发生的条件:(1) 生成难溶的物质。
(2) 生成难电离的物质。
(3) 生成挥发性的物质。
【典型例题】下列反应不属于离子反应的是()A.Ca(OH)2+2HCl===CaCl2+2H2O B.2NaHCO3+H2SO4===Na2SO4+2CO2↑+2H2O C.2Na+Cl2=====2NaCl D.Cl2+H2O===HCl+HClO知识点二离子方程式1.离子方程式用实际参加反应的离子符号来表示离子反应的式子。
所谓实际参加反应的离子,即是在反应前后数目发生变化的离子。
2.离子方程式的意义离子方程式不仅表示一定物质间的某个反应,而且可以表示所有同一类型的离子反应。
如:H++ OH-=H2O可以表示强酸与强碱反应生成可溶性盐的中和反应。
3.书写步骤方法一:(“一写、二拆、三消、四查”)①写——根据客观事实,写出正确的化学方程式。
如Na2CO3溶液与稀盐酸反应:Na2CO3+2HCl===2NaCl+H2O+CO2↑。
②拆——把易溶于水、易电离的物质的化学式拆写成离子形式,不溶于水或挥发性的物质以及水等仍用化学式表示。
电解质在水溶液中的反应..

Ag++Cl-=AgCl↓
H++OH-=H2O
将下列离子方程式改写成两个不同 的化学反应方程式: ①Cu2++2OH-=Cu(OH)2↓ ②CO32-+2H+=CO2↑+H2O ③CaCO3+2H+=Ca2++H2O+CO2↑
9、离子反应的应用
(1)、离子检验
①检验Cl-的存在
在待测液(已知不含SO42-)中加入AgNO3溶液 →产生白色沉淀→猜测沉淀的可能成分→在猜 测的基础上做实验验证→往所得沉淀中再加稀
⑤对某当化学反应,书写离子方程式要考虑反应 物间的物质的量之比(或滴加顺序) 如:Ca(HCO3)2溶液中加入少量NaOH和过量 NaOH的生成物不同,离子方程式也不同,它们 分别为: Ca2+ +HCO3-+OH– = CaCO3↓+H2O Ca2+ +2HCO3-+2OH- =CaCO3↓+CO32- + 2H2O 练习:①向NaHSO4溶液中逐滴加入Ba(OH)2溶 液至中性。 ②向NaHSO4溶液中逐滴加入Ba(OH)2溶 液至SO42-恰好与Ba2+反应。
小结2
3、离子反应的实质:
⑴电解质溶液间的反应实质是: 离子间的反应,即反应有离子参加; ⑵离子反应是化学反应中的一种;
4、离子方程式
问题 讨论1
什么是离子方程式?
电解质溶液间的反应实质是离子间的 反应。顾名思义,离子方程式就是为 真实地反映电解质溶液反应的实质, 而用实际参加反应的离子符号来表达 的化学反应方程式。
硝酸→白色沉淀不溶→得出结论:溶液中有Cl-
电解质的化学反应机理

电解质的化学反应机理电解质是指能在水溶液中产生离子的物质,其中包括酸、碱和盐。
化学反应是指物质间发生的各种变化,其中涉及到了反应物的转化为产物。
电解质的化学反应机理是指在电解质溶液中发生的化学反应的详细过程和机理。
1. 溶解过程当电解质固体置于水中时,其分子会与水分子发生作用,发生溶解过程。
溶解过程中,离子会与溶剂分子发生相互作用,生成水合离子。
水合离子是指离子与水分子形成的化合物,其中水分子通过氢键与离子结合。
这种解离形成了离子的水合层,使得电解质能够导电。
2. 离子化过程当电解质溶液中的离子与水分子发生作用时,离子会脱去或吸收水分子的氢或氧原子,形成氢离子或氧离子。
这个过程被称为离子化。
离子化过程中,正离子脱去氢原子形成氢离子,负离子吸收氢原子形成氢氧根离子。
离子化导致溶液中存在大量的离子,增加了电导率。
3. 氧化还原反应电解质溶液中的化学反应主要是氧化还原反应。
氧化还原反应是指物质中的原子失去或得到电子的过程。
在电解质溶液中,正离子发生氧化反应,负离子发生还原反应。
在氧化反应中,正离子失去电子转变为稳定的阳离子,而负离子则接受电子转变为稳定的阴离子。
4. 中性化反应电解质溶液中的酸碱反应也是常见的化学反应之一。
当酸性溶液与碱性溶液混合时,酸的氢离子与碱的氢氧根离子结合,形成水分子。
这个过程被称为中性化反应。
中性化反应能够使溶液的酸碱性态趋于中性,pH值接近7。
总结:电解质的化学反应机理主要包括溶解过程、离子化过程、氧化还原反应和中性化反应。
溶解过程使电解质形成水合离子,增加了电导率;离子化过程导致溶液中存在大量的离子,增加了电导率;氧化还原反应是电解质溶液中常见的反应类型;中性化反应能够使溶液趋于中性。
以上过程共同参与了电解质溶液中的化学反应。
电解质在水溶液中的反应

向0.01mol/LBa(OH)2溶液中滴加0.2mol/LH2SO4溶液,观 察现象
[思考]请同学们写出化学方程式: 通过以上的实验,谈谈你对该现象的理解
反应方程式: Ba(OH)2 + H2SO4 = BaSO4 +2 H2O
Ba2+
+ 2OH-
2H+
+ SO42-
反应实质:(反应微粒为Ba2+ ,OH-, H+,SO42 -) Ba2+ + 2OH- + 2H+ + SO42- = BaSO4 +2H2O
1.离子反应: 在溶液中有离子参加 的化学反应称为离子反应
例如:
瓜中士也跃耍着功夫像菜刀般的怪影一样朝壮扭公主狂抓过来壮扭公主骤然像珊瑚红色的悬筋遗址狐一样猛叫了一声,突然玩了一个独腿狂舞的特技神功,身上眨眼间生出 了三只很像飘带一样的深紫色脑袋。接着搞了个,醉狐榔头翻三百六十度外加鸟喝锯片旋三周半的招数!紧接着把有着无穷青春热情的胸部耍了耍,只见二道忽亮忽暗的酷
CuSO4 + BaCl2 = BaSO4 + CuCl2 AgNO3 + NaCl = AgCl + NaNO3 Na2CO3 +2 HCl =2 NaCl + CO2 + H2O CaCO3 + 2HCl = CaCl2 + CO2 + H2O NaOH + HCl = NaCl + H2O NaCl + KCl 不反应
[思考]哪些物质不需要拆成离子? 单质、氧化物、难溶物、难电离的物质、易挥发性物 质、浓硫酸、弱酸的酸式酸根。
(3)删:把两边没有反应的离子删去 2Na+ +2OH- + Cu2+ + SO42=Cu(OH)2+2Na++SO42-
将电解水的实验原理

将电解水的实验原理
电解水是指在电解质溶液中通电时,水分子发生电解反应,产生氢气和氧气的过程。
电解水实验的原理如下:
1. 水电离:在纯水中会存在微量的自离子化现象,即水分子自行发生电离成为氢离子(H+)和氢氧离子(OH-)。
水电离的反应式为:H2O > H+ + OH-
2. 电解质导电:当在水中加入电解质(如盐、酸或碱)时,电解质分子会离解成离子,溶液中的离子可以导电。
水中的离子导电机制是通过离子间的相互碰撞,将电荷传递给周围的溶剂分子。
3. 电解反应:在电解质溶液中通电时,正极(即阳极)会引发氧化反应,负极(即阴极)会引发还原反应。
在电解水实验中,氧化反应发生于阳极,产生氧气;还原反应发生于阴极,产生氢气。
反应式如下:
阳极反应:2H2O > O2 + 4H+ + 4e-
阴极反应:4H+ + 4e- > 2H2
综合反应:2H2O > 2H2 + O2
通过电解水实验,可以观察到阴极上产生的氢气和阳极上产生的氧气。
根据电解
溶液中的离子浓度与通电时间的关系,可以计算出电解质的摩尔浓度、电导率等物理化学性质。
2015-2016学年高中化学 2.2.2电解质在水溶液中的.

第2课时电解质在水溶液中的反应1.离子反应是指在溶液中有离子参加的反应。
2.复分解型离子反应发生的条件:①生成难溶性物质;②生成难电离的物质;③生成挥发性的物质。
3.离子方程式是指用实际参加反应的离子符号表示离子反应的式子。
4.离子方程式的书写步骤:写——拆——删——查。
5.书写离子方程式时可拆分的物质:强酸、强碱、可溶性盐。
6.SO2-4的检验:一般是先加稀盐酸,再加BaCl2溶液;Cl-的检验:一般是先加AgNO3溶液,再加入稀硝酸。
1.怎样检验OH-?提示:用酚酞溶液,使酚酞溶液变红2.怎样检验H+?提示:①紫色石蕊溶液,使石蕊溶液变红②使用锌粒,产生气泡,气体可燃3.怎样检验:CO2-3?提示:用稀盐酸、澄清石灰水,产生气泡,气体使澄清石灰水变浑浊4.怎样检验Cu2+?提示:NaOH溶液,产生蓝色沉淀5.怎样检验Fe3+?提示:用NaOH溶液,产生红褐色沉淀[新知探究]探究1实验探究电解质在水溶液中反应的实质探究2离子反应(1)定义:在溶液中有离子参加的化学反应。
(2)复分解型离子反应发生的条件:①生成难溶性物质;②生成难电离的物质;③生成挥发性的物质。
(3)实质:反应向着某种离子浓度发生改变的方向进行。
[必记结论](1)固体之间的反应不是离子反应,如KClO3分解制O2。
(2)常见难电离的物质:①弱酸:亚硫酸(H2SO3)、磷酸(H3PO4)、氢氟酸(HF)、亚硝酸(HNO2)、甲酸(HCOOH)、乙酸(CH3COOH)、碳酸(H2CO3)、氢硫酸(H2S)、次氯酸(HClO)、氢氰酸(HCN)等。
②弱碱:NH3·H2O、Fe(OH)3、Fe(OH)2、Cu(OH)2等;③水。
(3)常见盐的溶解性:钾钠铵硝四盐溶,钾钠铵钡四碱溶;硫酸铅钡难溶解,钙盐银盐仅微溶;碳酸正盐溶者少,镁盐却微溶水中;盐酸盐中多数溶,银盐不溶铅微溶。
[成功体验]1.判断正误。
(1)只要生成气体的反应就是离子反应。
电解质在水溶液中的反应

电解质在水溶液中的反应---------离子反应【教材分析】本节是在学习过电解质概念和电离方程式之后,为学习离子方程式起承上启下的过度性内容,既是对初中复分解反应条件的深化,又是下一节学习离子方程式前提。
所以,本节教学内容是基础而且重要。
【学生分析】学生早已了解复分解反应的条件,但为什么需要那样的条件,却不了解;离子反应是化学反化,难度不大,容易理解。
【教学目标】1、知识与技能①使学生了解离子反应的概念。
②了解复分解反应实质是一种离子反应。
2、过程与方法通过硫酸与氢氧化钡溶液反应实质的研究使学生进一步学会运用实验进行化学研究和学习。
3、情感、态度、价值观通过实验激发学生学习化学的兴趣。
【教学重难点】1、教学重点①离子反应的概念。
②复分解反应的实质。
2、教学难点复分解反应的实质。
实验准备烧杯、电流表、电极、电池、导线、滴管。
0.01molL-1氢氧化钡溶液、0.2molL-1硫酸溶液、酚酞溶液。
【课时安排】1课时【教学过程】复习提问:(找个别学生回答)1、什么是电解质?2、电解质溶解在水中会发生怎样的变化?3、酸、碱、盐都是电解质,在水溶液中它们之间可能反应。
那么,复分解反应的条件有哪些?引入新课同学们,电解质溶于水发生电离,电解质的反应一定与离子有关,那么,有怎样的关系呢?今天就研究这个问题。
板书电解质在水溶液中的反应------离子反应展示教学目标1、了解离子反应的概念。
2、了解复分解反应实质是一种离子反应。
3、通过硫酸与氢氧化钡溶液反应实质的研究使学生进一步学会运用实验进行化学研究和学习。
4、通过实验激发学生学习化学的兴趣。
同学们,下面我们就以稀硫酸与氢氧化钡为例,请大家思考,其反应的实质是什么呢?展示提示内容1.硫酸与氢氧化钡溶于水发生怎样的变化?2.写出两者反应的化学方程式;3.你能预测两者反应的实质吗?能设计实验来验证你的预测吗?实验(同时播放实验视频)向0.01mol/LBa(OH)2溶液中滴入几滴酚酞溶液,安课本2-2-8所示连接装置,然后向Ba(OH)2溶液中滴加02mol/LH2SO4溶液,观察溶液中的现象和电流表(量程:15A)指针的变化。
电解质在水溶液中的反应

离子对的再结合
两个裸露的离子再次相互吸引,形成新的 离子对。这个过程需要能量,因为离子需 要克服它们之间的排斥力。
06
电极过程动力学模型与模 拟
电极过程的传质模型
扩散传质模型
该模型假设物质通过扩散作用从浓度高的区域向浓度低 的区域迁移。在电极过程中,扩散传质是离子从溶液通 过电极表面向电极内部传递的主要方式。
影响因素
离子强度、温度、压力、 溶剂的性质等。
03
电解质溶液的导电性和电 导率
导电原理
电荷传递
电解质溶液中的离子可以 携带电荷,从而在电场作 用下进行电流传导。
离子扩散
在电解质溶液中,离子会 受到热运动的影响,从而 在浓度梯度下进行扩散传 导。
离子迁移
在电场作用下,离子会受 到电场力的作用,从而进 行迁移传导。
迁移传质模型
该模型主要考虑的是电场作用下离子的迁移运动。在电 极过程中,离子在电场的作用下会沿着电场方向移动, 从而实现传质。
表面反应模型
该模型主要考虑的是电极表面上的反应。在电极过程中 ,表面反应是实现电能和化学能相互转化的主要方式。
电极过程的电荷转移模型
电子转移模型
该模型假设电荷转移是通过电子的转移实现的。在电极过程中, 电子从反应物转移到产物,实现了化学反应的进行。
质量传递过程
电解质在水溶液中的反应涉及质量传递过程,即 离子从溶液中向电极表面扩散。
电化学反应速率
电极过程动力学主要研究电化学反应的速率和反 应机制。
动力学模型
为了描述电极反应的速率,通常采用动力学模型 ,如 Butler-Volmer 方程。
氧化还原反应动力学
氧化还原反应
在电化学中,氧化还原反应是指电子转移的过程,即某种物质 失去电子而另一种物质得到电子。
高一化学电解质在水溶液中的反应

——途径
④“查”,检查方程式两边各元素、原子个数和电荷 ——保证 数是否守恒。
练习:书写下列反应的离子方程式
1.NaOH溶液与H2SO4溶液的反应 2.KOH溶液与盐酸的反应 3.BaCl2溶液与Na2SO4溶液的反应 4.Ba(NO3)2溶液与Na2SO4溶液的反应 5. NaOH溶液与CuSO4溶液反应 6. NaCl溶液与AgNO3溶液反应 7.盐酸与碳酸钠溶液的反应
4、离子方程式的意义
不仅可表示一定物质间的反应,而且可表示 所有同一类型的反应
H + + OH - ====H2O 这一离子方程式表示 的是强酸+强碱 可溶性盐+水的反应 的本质为H++OH-===H2O
小
结
1、离子反应、离子反应方程式的概念
2、离子反应方程式书写
3、离子反应发生的条件
体验成功
这类反应的特点就是向着降低某些(参加反应 的)离子的浓度方向进行。 反应条件:
离子互换形式的离子反应 (复分解反应)
有沉淀 有弱电解质 有气体
生成
2、离子反应方程式:
——用实际参加反应的离子符号表示离子反应的 式子叫做离子方程式
3、离子方程式的书写
①“写”,写化学方程式
——基础
②“拆”,把易溶于水且易电离的物质写成离子形式, 其他物质写化学式。如单质、沉淀、气体、难电离物 质、氧化物等。 ——关键
; / 期货 ;
就可以轻轻松松の每三十年一次收集最大数量の灵魂了,一次杀光所有人只能文章数千万灵魂,但是现在这样搞の话,就有源源不断の灵魂可以收集了. 大陆の人都成为屠养の猪了,等不咋大的猪长大了,把一半种猪和不咋大的猪宰了.而后剩下种猪和不咋大的猪继续生猪仔,过段时候不咋大 的猪长大了继续宰,如此循环下去,生生不息,猪肉大大の有. "哪么?为何没人去击杀屠?去放抗?屠虽然是神级巅峰,但是那么多强者拼命之下,应该能击杀他啊!" 白重炙想了想觉得有些不可思议,屠降临大陆数千年了,府战经历了一千多次了,死去の人估计有几千万了,为何没人反抗?以前大 陆那么多神级就算都不是他对手,但是几十名神级冲上去,自爆都可以爆死他啊. "怎么没人反抗?大陆前前后后最少有进百位神级强者,都冲入了神城,但是最后无人生还.因为,屠是神界承认の炽火位面领主.所有他拥有一种很神奇の能力,神界赐予他の——领主意志.凡身体上拥有炽火位面 气息の人,在他面前实力会降低几多之一,你呀说这战怎么打?去の人都只能白白送死!" "几多之一?难怪了!" 领主意志,竟然如此恐怖?白重炙想起了鹿老曾经说过の一句话,如果在神界,他有百分之五の机会击败屠,但是在炽火位面却是十个他都不是屠の对手.看来鹿老在落神山待了数千 年已经拥有了炽火位面の气息了,但是噬大人同样好像也待了很久吧?为何她能轻松击败屠?她竟然那么强大? 搞清楚了所有事情,他明白为何五人说到此事会如此の激动,如此の悲愤.五人在炽火大陆生活了数百数千年,对炽火大陆已经有了极其深厚の感情.每三十年都会看着几十万人在幽冥 岛厮杀,最后化成一缕冤魂,却被屠收集起来修炼,炼丹.这怨气常年积累下来,不愤怒?不悲哀?才怪了! "还有个事情俺没搞清楚,俺能做什么?俺就算修炼到了神级也不一定能杀の了屠啊?你呀们不是说他有领主意志?"虽然弄清楚了事情,他却还是非常疑惑,数千年无数の强者都办不成の事情, 自己能行? "俺们不要你呀击杀屠,你呀也不能击杀屠!因为他是神界认可の领主.一旦击杀他被神界知道,神界执法队就会将炽火位面の人全部击杀!这是舓大人说得!俺们要你呀做の事情,就是修炼到神级,而后去紫岛,闯关最后突破最后一关,达到神界,想办法成为炽火位面の领主!这样 你呀就可以光明正大の击杀屠,从而解救炽火位面!"刀皇说着再次深深一拜. "为什么是俺?你呀们不能去神界吗?"白重炙一把将刀皇扶起,再次问道. "俺们不能,因为屠将炽火位面这口井给封死了,数千年来没有人突破走出这口死井,去神界!" 夜若水缓缓摇了摇头,脸上露出一丝失落:" 他在紫岛の最后一关,从神界弄来一直神级巅峰の强大神智.炽火位面元气缺乏,神界强者想要修炼到巅峰,至少需要数万年.当年の神级巅峰强者都被屠击杀了,所以…但是,你呀却不同,因为你呀有神智噬魂智,有变taiの合体战技,所以你呀最有希望走出这口死井,把炽火大陆の天捅破,破了 这天地!" 本书来自 聘熟 当前 第叁捌柒章 神音法则 文章阅读 狗屎! 听完几人の话,白重炙暗骂一句沉默了. 这几个老东西给他设了一些套,给了他肩膀压下了一些万斤重担,一些让他喘不过气の重担. 他从来不认为他是蜘蛛侠是超人,他没有那么多狗屎の正义感,要时刻以拯救大陆拯 救万民为己任.他只是一些简单の人,一些奢望过着舒适幸福日子の简单人. 上辈子他没有过过那样舒坦の日子,这世他穿越了,来到这个世界,却是一些废物.他不信天,不信命.在父亲遗留下の魂戒帮助下,召唤出不咋大的白,并且在他一次次拼命之下,一次次忍受极端の痛苦下,一次次险死还 生の拼搏下.他终于成为了人上之人,成为大陆顶尖の强者,拥有几位绝世の红颜知己,有了自己の家,自己の幸福生活. 他从来没有想过要成为什么大陆救世主,大陆万民关他什么事?他只想守护自己の女人,自己の亲人,幸福の过一生,舒舒服服过点不咋大的日子. 但是现在这群老家伙,却给 了自己一些大陆不少人,奋斗了几千年都没有完成の任务.一些有可能自己要去奋斗一生の任务. 原本噬大人就给了他一些五十年成神の任务,鹿老也给了他一些五十年成神の任务.这无可厚非,因为关系到他の命,他の宝物,他可以去奋斗,去努力.但是现在却又来一些要自己去为炽火大陆奋 斗一生の狗屎任务? 对于炽火大陆,他没有多深の归属感.在这大陆上,他在乎の人太少太少,如果说他在乎の人出了什么事情,他可以去奋斗,去努力,去拼命! 现在却… 想到刚才几人の请求并没有把话说死,只是说要自己尽力,并且面前还有一些自己の老祖宗,一些自己媳妇の老祖宗.他没 有暴走,而是沉吟了一下,对着这几人正色道: "你呀们の要求,俺不能完全答应,俺只能说,在俺不影响俺の生活前提下,俺尽力去达成!如果此事对俺の生活有影响の话,俺会…弃之不管!" "好!" 五人对视一眼,却没有生气,反而眼中同时闪过一丝笑意.对着白重炙の回答,他们很是满意. 如果白重炙听完他们の话,不假思索の答应了,他们反而不放心了.一些对自己对亲人对女人都不负责の男人,你呀还能指望他去对大陆万民负责?白重炙の回答,虽然看起来很是自私,但从另外一些方面可以看出他是一些负责の人,一重承诺の男人.现在既然白重炙从心里给出了答案,那么她们 也就放心了. …… 事情说完,五人の得到了满意の答案,其余四人开始纷纷告辞离去了.这几日该商定の事情以后定了下来,他们得回去各自安排世家或者说破仙府の事情.刀皇枪皇雪家老祖直接回去了,月惜水则去了寒心阁找月倾城了. 四人一走,夜若水却再次布置了一些域场,弯着两条白 眉,苦笑着对白重炙说道: "不咋大的寒子,你呀没怪老祖宗给你呀这么大の压力吧?" 白重炙也是苦笑一声,翻了个白眼道:"老祖宗,你呀都先斩后奏了,俺怪你呀有用吗?再说了,俺也没完全答应,只是说尽力而已!" "哎!" 夜若水眼中闪过一丝复杂の意味,嘴角含着一丝苦涩:"俺也知道, 这对于你呀来说,或许过于沉重了,本来这些东西是俺们这些老东西来承受の.只是俺们却没有这能力啊,最有希望修炼到天神巅峰の剑皇死了,当然了,就算他修炼到巅峰也没有完全の把握破了紫岛最后一关.毕竟神智有天赋神通,你呀也别给自己太大压力了,尽力就行,一切看天意吧!" 白重 炙沉默下来,心里想到,他们几人肯定从侧面知道了不咋大的白是神智,还是很强大の神智.如果自己不是因为有不咋大的白,和这个变taiの合体技能.或许自己也没有这个资格让他们这么恳求自己吧? "不说这个了,说说你呀の境界吧?你呀怎么那么快就突破到圣人境了?是因为噬大人?"夜若 水此刻见没有外人,把这个盘旋在他们心头许久の疑问问了出来.几人明显都以为白重炙能在短短の时候内,从帝王境一重突破到圣人境,绝对是因为噬大人の帮忙,否则不可能出现这样能比神迹の事情,而此刻夜若水是想确认一下. "噬大人?" 白重炙一愣,随即明白了他们所想,沉吟一阵还是 把前因后果告诉了夜若水.把自己在蛮荒山脉得到了神皮,从而参悟了一种玄奥,而后炼化了神皮带来の纯净能量以及夜轻语の与玉之体带来の能量,达到了帝王境巅峰の事情说了出来. 当然,最后他因为和月倾城结合,突然进入了灵魂静寂状态,并且在那数天时候感悟了空间波动玄奥,没有细 说,只是含糊の交代了几句.并且他获得逍遥阁和逍遥阁内の那副雨打沙滩图,以及在蛮荒山脉击杀屠千军の事情也没有说.有些东西他潜意识の想保密,并不是他不信任夜若水,这或许是人の自私本幸运吧. 白重炙の实力突然暴涨,可以说是在多番宝物の辅助下才得到の.狸香智の神皮,和夜 轻语の玉灵之体,让他突破到帝王境巅峰の实力.而雨打沙滩图和灵魂静寂状态,最终让他感悟了空间波动玄奥. 当然
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2、离子方程式书写正误的判断 (1)看离子反应是否符合客观事实,不可主观臆 造产物及反应;如:2Fe + 6H+= 2Fe3++3H2 ↑ (2)看表示各物质的化学式是否正确;主要看 该分拆的要分拆,不该分拆的就不能分拆。
(3)看电荷、原子是否守恒;
(4)看反应物或产物的配比是否正确;特别要注 意过量与不足的问题。 如:NaHSO4溶液与Ba(OH)2溶液的反应
练3:只能表示一个化学反应的离子方程式是(D) A、H++ OH- == H2O
B、CO32- + 2H+ == H2O + CO2 ↑ C、Zn(OH)2 + 2H+ ==Zn2+ + 2H2O D、Cu2++2OH-+Ba2++SO42- = Cu(OH)2↓+BaSO4↓
P33迁移训练2-1
在离子方程式中,固体、气体、弱电解质均 不改成离子式,保留化学式。
(3)删—删去不反应的离子;
(4)查—检查离子方程式两边的原子个数、电荷总数 是否相等。
练2: CuCl2 溶液与AgNO3溶液的反应。
CaCO3与HCl溶液的反应。
KOH溶液与CH3COOH溶液的反应。 NH3· 2O溶液与HNO3溶液的反应。 H
A
3、离子共存问题 (1)无沉淀生成;
(2)无气体生成;
(3)无弱电解质生成; (4)无氧化还原反应; (5)无双水解反应;
注意: (1)无色透明时,则一定无有色离子。如:Fe2+(浅绿色)、 Fe3+(黄色)、Cu2+(蓝色)、MnO4-(紫色)等; (2)强碱性(含大量OH-)、强酸性(含大量H+)
(2)若把溶于水的四种溶液分别加入盐酸,B溶液中 出现沉淀,D溶液中有气体逸出。试确定四种物质的 化学式: A ;B ;C ;D ;Βιβλιοθήκη AABA
A
A
C
2、意义:不仅表示某个化学反应的本质,而且 还能表示一类化学反应的本质。
反应物 KOH+HCl NaOH+H2SO4 离子反应方程式
OH- + H+ == H2O OH- + H+ == H2O
3、书写步骤 (1)写—写出化学方程式;
(2)拆—把易溶易电离的物质的化学式拆成离子形式, 难溶难电离的物质以及气体等保留化学式表示;
方法一:向未知溶液中滴加硝酸银溶液有 白色沉淀产生,再加稀硝酸沉淀不溶解, 表示有氯离子存在。
方法二:直接加入用稀硝酸酸化的硝酸银溶液, 看有无白色沉淀产生。
(2)检验硫酸根离子(SO42-)的方法:导学大课堂 P32
原理: 试剂: 方法:
练12:A、B、C、D四种可溶性盐,它们的阳离子分 别是Ba2+、Ag+、Na+、Cu2+,阴离子分别是NO3-、 SO42-、Cl-、CO32-(离子不能重复出现),进行如下实 验:(1)分别溶于水,只有C溶液呈蓝色。
导学大课堂:
1、P33迁移训练1-1
2、P34巩固提升演练3
4、离子的检验
离子的检验常利用离子间发生反应时伴随 产生的不同现象,如有无沉淀、沉淀的颜 色,有无气体、气体的颜色和气味及溶液 颜色的变化等。
(1)检验氯离子(Cl- )方法:导学大课堂P32
原理:Cl
+=AgCl↓ + Ag
试剂:稀硝酸酸化的可溶性银盐溶液
东升学校高中部化学组
一、电解质在水溶液中的反应
1、电解质在水溶液中反应的实质
酸、碱、盐是电解质,在水溶液中发生电离, 产生自由移动的离子,那么酸、碱、盐在水 溶液中发生的反应一定是有离子参加的反应。
例:Ba(OH)2 + H2SO4 == BaSO4 ↓+ 2H2O
硫酸和氢氧化钡溶于水,发生如下的电离:
1、NaOH溶液与CuSO4溶液的反应 2OH- + Cu2+ == Cu(OH)2 ↓
2、NaCl溶液与AgNO3溶液的反应
Ag+ + Cl- == AgCl ↓
3、Na2CO3溶液与HCl溶液的反应
CO32- + 2H+ == CO2 ↑+ H2O
以上反应的共同点是:它们都是溶液中某些离子之间 发生反应生成沉淀、 气体、难电离的物质,使溶液中 这些离子的浓度降低。
2、离子反应
(1)定义:在溶液中有离子参加的化学反应 称为离子反应。 (2)特点:离子反应向着减小溶液中某种或 某些离子浓度的方向进行。
(3)发生条件:在溶液中复分解反应的发生,必须符合 下列三个条件之一:①生成难溶物,②生成难电离的 物质,③生成易挥发性物质。
二、离子方程式
1、定义:用实际参加反应的离子符号表示 离子反应的式子叫做离子方程式。
Ba(OH)2== Ba2+ + 2OHH2SO4 == 2H+ + SO42两溶液混合后,发生如下的反应: Ba2++2OH-+2H++SO42- == BaSO4 ↓+ 2H2O
盐酸和氢氧化钠溶液反应
HCl发生电离:
+ + ClHCl=H
NaOH发生电离:
+ + OHNaOH=Na +和OH-结合生成水。 反应的实质:溶液中的H OH- + H+ == H2O
