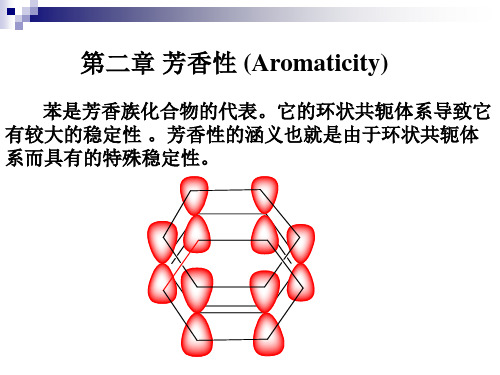
9 苯系芳香族化合物和芳香性
第二章 10芳香性
H 即 H H
H
环丙烯
H
环丙烯正离子
H
环丙烯正离子中的碳—碳键长都是0.140nm,因此它的电子 不是固定在其两个碳原子之间而是离域的,正电荷不是集中 于某一原于上,而是分布在由三个碳原于组成的共轭体系 中 三原子二电子π 体系。
环丙烯正离的正电荷离域
+
环丙烯正离子本身和它的某些取代的衍生物已被合成, 例如:
C6H5 C6H5 BF4ˉ C6H5 Cl Cl AlCl4ˉ
Cl
事实上,三丙基环丙烯正离于是最稳定的正碳离子之 一,甚至在水溶液中它还是稳定的。三叔丁基环丙烯正离 子也是很稳定的。此外,环丙烯酮也是稳定的化合物。
O
环丙烯酮
O-
环丙烯负离子的情况与相应的正离子就不同了
环丙烯负离子的四电子体系不符合Hückel规则,因而 它没有芳香性。
O O
卓酚酮是卓酮的羟基游衍生物。
或写作
OH O
O O H
2.6 八元环的π体系
虽然环辛四烯没有芳香性,但在环辛四烯分子中除去两个电子 的双正离子和增加两个电子的双负离子都是存在的,并都有一定程 度的芳香性。前者相当于六电子体系,后者相当于十电子体系,都 符合4n+2规则,前者n=1,后者n=2。它们的分子轨道和基态时 的电子排布如下图所示: 环辛四烯双负离子的存在需要有两个负电荷置于同一环上,这只 能用芳香性来解释。
2.3 四元环的π体系
环丁二烯π电子不符合4n+2规则,它没有芳香性。
按照Hückel规则,如果在环丁二烯分子中减去两个电 子,则将成为二电子体系,也就可以具有芳香性。同预测 的情况一致,下列化合物已被合成,并可代表具有芳香性 的二电子体系。
R R
有机化学基础知识点整理芳香族化合物与苯环

有机化学基础知识点整理芳香族化合物与苯环有机化学基础知识点整理:芳香族化合物与苯环有机化学是研究碳和有机化合物的化学性质和反应的学科,其中一类重要的化合物是芳香族化合物。
芳香族化合物一般都含有苯环结构,苯环是由6个碳原子组成的六元环,每个碳原子上都有一个氢原子。
本文将为大家介绍芳香族化合物的基本概念、结构、命名规则以及常见的反应类型。
一、芳香族化合物的基本概念与结构芳香族化合物是一类具有特殊的化学性质和结构特征的有机化合物。
它们通常具有以下特点:1. 具有苯环结构:芳香族化合物的分子中包含苯环,苯环由6个碳原子组成,相邻碳原子之间通过共轭键连接。
2. 具有共轭体系:苯环中的碳碳键都是共轭键,即相邻的碳原子上的π电子可以在整个苯环中传递。
3. 具有稳定的芳香性:苯环中的π电子云非常稳定,使得芳香族化合物具有稳定的共轭体系和高度的芳香性。
芳香族化合物的结构可以通过化学式来表示,如苯的化学式为C6H6。
在苯环上,通常只绘制一个氢原子,表示其他5个氢原子也位于苯环上。
二、芳香族化合物的命名规则芳香族化合物的命名主要依据结构和取代基的位置进行。
以下是常见的命名规则:1. 简单芳香族化合物的命名:根据苯环的取代基情况,在化合物的名称前加上取代基的名称或编号。
例子:- 甲苯(m-甲基苯):苯环上的一个氢原子被甲基(-CH3)取代。
2. 多取代芳香族化合物的命名:除了简单的取代基外,还需要用编号表示取代基的位置。
例子:- 邻二甲苯:苯环上的两个氢原子被两个甲基取代,而这两个甲基相邻。
3. 多个取代基的命名:依据取代基的位置,按照字母序列来命名。
例子:- 间-对二甲苯:苯环上的两个甲基分别位于相邻的两个碳原子和对位的两个碳原子。
三、芳香族化合物的常见反应类型芳香族化合物由于其特殊的稳定性和共轭体系,所以它们的反应类型与非芳香族化合物有所不同。
以下是一些常见的芳香族化合物反应类型:1. 取代反应:芳香族化合物的含有活泼的取代基时,可以与试剂发生取代反应。
有机化学基础知识点整理芳香性和芳香化合物的性质

有机化学基础知识点整理芳香性和芳香化合物的性质芳香性和芳香化合物的性质有机化学是化学领域中的一个重要分支,研究有机物的结构、性质和合成方法等。
芳香性和芳香化合物是有机化学中的重要概念和研究内容之一。
本文将对芳香性和芳香化合物的基础知识点进行整理。
一、芳香性的概念芳香性是指含有芳香环结构的化合物所特有的性质或现象。
它是由芳香环中的π电子云形成的高度共轭体系所决定的。
具备芳香环结构的化合物表现出一系列独特的性质,包括稳定性高、反应活性低、呈现特殊的气味等。
二、芳香性的规则和条件1. 符合Hückel规则Hückel规则是判断一个化合物是否具备芳香性的一个重要准则。
根据Hückel规则,一个环状分子具备芳香性必须满足:- 分子是平面的;- 分子中含有 4n+2 个π电子,其中 n 是非负整数。
2. 产生高度共轭体系芳香性是由共轭体系中的π电子云形成的,因此产生芳香性的分子通常具有大范围的共轭结构。
对于苯环来说,由于其电子云在整个环上共轭,因此苯是最简单的芳香化合物。
3. 具备极性芳香化合物中的芳香环带有电负性较大的原子团,如氧、氮等,因此具备一定的极性。
然而,芳香化合物整体上常表现出较弱的极性,主要由于π电子在环上的扩散。
三、芳香化合物的性质1. 化学稳定性芳香化合物的共轭结构使其更加稳定。
对于具有芳香性的化合物,由于能量更低,其化学稳定性也相对较高。
这也是为什么芳香化合物常用作药物、染料和香料等方面的原料。
2. 同位素标记由于芳香化合物的稳定性,可以通过同位素标记来追踪其在化学反应中的转化过程。
同位素标记技术在有机化学的研究和应用中扮演着重要的角色,有助于揭示化学反应的机理和动力学。
3. 气味和香味芳香化合物常常具有独特的气味和香味,广泛应用于香水、香料和食品添加剂等方面。
因为芳香化合物形成的芳香环结构能够与嗅觉受体结合,产生特殊的感官效应。
4. 光谱特性芳香化合物在红外光谱、紫外光谱和核磁共振光谱等光谱中表现出特殊的峰值和吸收特性,这对于准确鉴定和表征芳香化合物具有重要意义。
有机化学基础知识点整理芳香性与芳香族化合物的特性

有机化学基础知识点整理芳香性与芳香族化合物的特性芳香性与芳香族化合物的特性有机化学是研究有机物质的结构、性质、合成和反应的学科。
其中,芳香性是有机化学基础知识中的重要概念之一。
本文将对芳香性以及芳香族化合物的特性进行整理和阐述。
一、芳香性的定义和特点芳香性是指某些有机化合物具有特殊的稳定性和特性,表现为具有香味、稳定的分子结构和特殊的化学反应。
它通常与化合物的环状共轭结构相关。
具有芳香性的化合物有以下几个特点:1.稳定的共轭体系:芳香化合物中的π电子会形成一个稳定的、闭合的共轭体系。
这种闭合的π电子结构使得芳香化合物相对于非芳香化合物来说更加稳定。
2.具有香味:芳香化合物通常具有特殊的香味,这也是芳香性得名的原因之一。
例如,苯味道甜,香水等化妆品中常含有芳香化合物。
3.化学反应活性低:由于芳香化合物的稳定性较高,它们的化学反应活性通常较低。
例如,芳香化合物不容易与氢发生加成反应,不容易被氧化剂氧化。
二、芳香族化合物的分类根据芳香性的不同表现形式,芳香族化合物可以分为以下几个类别:1.单环芳香族化合物:最简单的芳香族化合物是苯,它由六个碳原子形成一个环状结构,每个碳原子上有一个氢原子。
苯是最基本的芳香化合物,也是很多芳香性化合物的基础结构。
2.多环芳香族化合物:由多个苯环连接而成的化合物被称为多环芳香族化合物。
这些化合物通常具有比单环芳香族化合物更复杂的结构和性质。
3.杂环芳香族化合物:除了由碳原子组成的环外,杂环芳香族化合物中还含有其他元素的环结构。
例如,呋喃是一种含有含氧杂环的芳香族化合物。
三、芳香性的判定方法确定一个化合物是否具有芳香性可以采用以下几种方法:1.分子轨道理论:通过计算分子轨道理论中的能级情况,可以预测一个化合物是否具有芳香性。
芳香性的分子通常具有稳定的分子轨道能级结构。
2.环电流检测:通过测量分子内部环电流的大小,可以间接地判断一个化合物是否具有芳香性。
具有芳香性的分子中,环电流通常较大。
芳香族化合物 材料

芳香族化合物材料
芳香族化合物是一类含有芳香环结构的有机分子。
这些分子通常具有共轭的π电子体系,表现出一些特征性的化学性质,如稳定性和芳香性。
以下是一些常见的芳香族化合物及其一些重要的用途:
1. 苯(Benzene):是最简单的芳香族化合物,具有六个碳原子形成的环状结构。
苯广泛用于有机合成和作为溶剂。
2. 甲苯(Toluene):是一种单取代苯,用作溶剂、涂料和油漆的成分。
3. 二甲苯(Xylene):包括邻二甲苯、间二甲苯和对二甲苯,常用作溶剂、油漆和橡胶的成分。
4. 苯酚(Phenol):具有苯环和一个羟基,用于生产树脂、消毒剂和药物。
5. 邻苯二甲酸二甲酯(Dimethyl terephthalate,DMT):用于生产聚对苯二甲酸二甲酯(Polyethylene terephthalate,PET),一种常用的塑料。
6. 萘(Naphthalene):由两个苯环共享一个碳原子形成,常用于生产染料、农药和塑料。
7. 安息香酸(Benzoic acid):包含苯环和一个羧基,广泛用于食品防腐剂、染料和药物。
8. 苯酐(Benzaldehyde):含有苯环和一个醛基,用于食品和香精的生产。
这些芳香族化合物在化学、医药、材料科学等领域中都有广泛的应用。
它们的稳定性和独特的化学性质使其成为许多工业和科学应用中不可或缺的组成部分。
9 苯系芳香族化合物和芳香性

P.200
芳香化合物的共性 休克尔(Hü ckel)规则 —— 在一个平面 单环 共軛 体系中, 含有 4n+2 (n=0,1,2,3...整数)个电子的体系具有芳香性。 具有芳香性的化合物通常是具有以下四个特点的分子: a. 分子是包括若干数目π键的闭合环状体系; b. 分子具有平面结构或非常接近于平面; c. 环上每个原子必须为sp2杂化(某些原子可以是sp杂化); d. 环上的π电子能够发生离域,且其离域电子数符合4n+2 Huckel 规则。
苯的离域 分子轨道
总结:
苯分子结构: 环状对称结构(碳原子sp2杂化,各碳碳键键角120°) 闭合的共轭体系 离域能大,非常稳定
H H
H
H
H
H
苯的性质:环体系稳定、易取代、不易加成、不易氧化 — 芳香性
P.198
9.2 苯及其衍生物的命名
一取代苯:
CH3
1)苯为母体
NO2
2)苯为取代基
9.10 芳烃的质谱和紫外、红外吸收光谱
IR:芳环骨架的伸缩振动在1625~1575cm-1 ,1525~1475cm-1 C-H伸缩振动在3100~3010cm-1 UV:205 nm K带,中强吸收,近紫外区边缘 255~275 nm B带,弱吸收,芳环特征吸收带(精细结构) 1H NMR: 苯环上dH ~7.26 13C NMR:苯环上dC ~128
1,2,4-(偏)
1,3,5-(均)
① 先定主官能团并编号为1; ② 取代基位次尽可能小; ③ 写名称,次序小的基团优先。
NO2 Cl
CHO NH2
HO
SO3H
2-氨基-5-羟基苯甲醛
有机化学基础知识点整理芳香性的定义与判断

有机化学基础知识点整理芳香性的定义与判断芳香性的定义与判断有机化学是研究碳元素化合物的化学性质和反应机理的学科。
在有机化学中,芳香性是一个重要的概念,指的是具有芳香性质的化合物。
芳香性的定义与判断是有机化学基础知识点中的一部分。
本文将从芳香性的定义、芳香性的判断以及具有芳香性的常见化合物等方面进行整理。
一、芳香性的定义芳香性是指具有芳香环结构的化合物所具有的一种特殊性质。
芳香环是由6个碳原子构成的六元环结构,其中的每个碳原子通过σ键相连,同时具有3个π电子。
芳香性是由芳香环上的π电子形成的共轭体系所决定的。
具有芳香性的化合物通常表现出稳定性高、反应性低的特点。
二、芳香性的判断判断一个化合物是否具有芳香性,需要考虑以下几个方面:1. 符合芳香环结构:化合物中存在由6个碳原子构成的六元环结构,其中的每个碳原子通过σ键相连,同时具有3个π电子。
这个结构通常被称为芳香环或芳香骨架。
2. 共轭体系存在:对于具有芳香性的化合物,芳香环上的π电子会形成一个共轭体系,即π电子在整个芳香环内进行共享。
这种共轭体系的存在是芳香性的重要特征。
3. Huckel规则的满足:Huckel规则是判断一个分子体系是否具有芳香性的经验规则。
根据Huckel规则,化合物中的π电子数必须满足4n+2的形式,其中n为任意正整数。
根据以上条件进行判断,如果化合物符合芳香性的定义,即具有芳香环结构、共轭体系存在以及满足Huckel规则,则可以判定该化合物具有芳香性质。
三、具有芳香性的常见化合物1. 苯:苯是最简单的芳香化合物,化学式为C6H6。
苯的芳香环结构由6个碳原子组成,每个碳原子上还连接有一个氢原子。
苯是一种无色液体,具有特殊的香味。
2. 甲苯:甲苯是另一种常见的芳香化合物,化学式为C7H8。
甲苯的芳香环结构由一个苯环和一个甲基基团组成。
甲苯是一种无色液体,具有特殊的香气。
3. 香兰素:香兰素是一种常见的天然芳香化合物,化学式为C8H6O3。
芳香性化合物精华版讲解

201结9/8/构17 或者反同芳结构的4n体系
33
五. 非芳香性(nonaromaticity)
非芳香性分子是指不共平面的多环烯烃,或电子数为奇数的中 间体。
如环辛四烯、10轮烯、14轮烯以及环戊二烯自由基环丙稀自由 基等。10轮烯和14轮烯由于内H位阻使其不能共平面。将14轮 烯中的一个双键换成三键,消除了H的位阻,而具有芳香性。
多环芳烃电子数的计算方法
1954年,Platt提出了周边修正法,对于多环芳烃 可以忽略中间的双键而直接计算外围的电子数。 对休克尔规则进行了完善和补充。
(1) 经典结构式的写法 画经典结构式时,应使尽量多的双键处在轮烯上, 处在轮烯内外的双键写成其共振的正负电荷形式, 将出现在轮烯内外的单键忽略后,再用休克尔规 则判断。
以分子轨道理论解释二茂铁的成键:环戊烯中6个填充满 的轨道和Fe原子九个轨道中1个s轨道3个p轨道和两个d轨 道,形成12个新轨道,其中六个是成键的。填充了9个轨 道有18个电子,6个是成键的3个轨道是成键弱或不成键 的。可以认为,其中10个来自环,8个来自零氧化钛的铁
富勒烯是C60、C50、C70 等一类化合物的总称。
由于C60这一重大发现Kroto 等人获1996年Nobel化学奖
C60是除石墨、金刚石以外碳的另一种同素异形体, 分子式为C60,由12个五边形和20个六边形组成 。
每个碳原子均以sp2杂化轨道与相邻碳原子形成 三个σ键,它们不在一个平面内。每个碳原子剩下的 p轨道彼此构成离域大π键,具有芳香性。
2019/8/17
30
反芳香性是指共平面、 π电子数为4n、共平面的 原子均为sp2或sp杂化的轮烯,其稳定性小于同类 开链烃,如环丁二烯环戊二烯正离子是反芳香性 的物质。如:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
液体 固体
馏分名称
煤焦油的 分馏产物 轻油 酚油
沸点范围/℃
<180 180~210
主要成分
苯、甲苯、二甲苯 苯酚、甲苯酚等
萘油
洗油 蒽油 沥青
210~230
230~300 300~360 >360
萘、甲基萘等
联苯、苊、芴等 蒽、菲等 沥青、游离碳
2、石油芳构化 —— 铂重整
铂重整 —— 在催化剂铂、钯、镍存在下,将轻汽油中含6~8个
氢化热(kJ/mol):
120
120×3 = 360 (假设), 实测:208kJ/mol
苯的共振能 = 152kJ/mol
+
-
苯的共振结构式
H H H
H sp2 H H
Csp2 , C-C键和C-H键;电 子云分布在平面上下;环闭共 轭体系,能量降低,稳定;键 长平均化。
平面分子,正六边形,碳碳键长均等:0.139nm ;键角120o
P.209
C H
NaNH2 / NH3(l)
(C6H5)3C-Na+
CH3OH
(C6H5)3CH + CH3ONa
碳正离子的稳定性大小: Ph3C+ > Ph2CH+ > R3C+ > R2CH+ ≈ PhCH2+ ≈ CH2=CHCH2+ >
RCH2+ > CH3+
碳自由基的稳定性大小: Ph3C。> Ph2CH。> PhCH2。≈ CH2=CHCH2。> R3C。> R2CH。> RCH2。> CH3。
间二甲苯的红外光谱图
3026
苯环 的C-H 伸缩 振动
C=C 骨架 伸缩 振动
不同取代的苯 =C-H面外弯曲 振动有较大不同
H 5.77ppm H 7.27ppm
P.200
芳香化合物的共性 休克尔(Hü ckel)规则 —— 在一个平面 单环 共軛 体系中, 含有 4n+2 (n=0,1,2,3...整数)个电子的体系具有芳香性。 具有芳香性的化合物通常是具有以下四个特点的分子: a. 分子是包括若干数目π键的闭合环状体系; b. 分子具有平面结构或非常接近于平面; c. 环上每个原子必须为sp2杂化(某些原子可以是sp杂化); d. 环上的π电子能够发生离域,且其离域电子数符合4n+2 Huckel 规则。
苯型芳香烃 例: 芳香烃 非苯型芳香烃 例: O
+
...
...
小结:
判别是否具有芳香性用Huckel规则。 类型 π电子数 稳定性
芳性
反芳性
4n+2
4n
稳定
很不稳定,似双自由基
非芳性
不符合4n+2
似烯烃
9.5 轮烯
轮烯 —— 单环共轭多烯
P.204
例如:环丁二烯、环辛四烯、环癸五烯、环十八碳九烯等
P.206
联苯碳原子编号:4'
C–C键自由旋转
O2N
NO2
O2N
NO2
C–C键不能 自由旋转
HOOC COOH HOOC COOH
联苯的亲电取代反应:
HNO3 H2SO4
NO2
1)Ph-为邻对位定位基;
2)空间位阻
O2N
H3C
HNO3 H2SO4
H3C
HOOC
HNO3 H2SO4
HOOC
NO2
9.7.3 三苯甲烷
电子数 n
6 1
10 2
14 3
14 3
环状共轭烯烃(CnHn)的π分子轨道能级和基态电子构型:
π* 反键轨道
能 量
0 π
非键轨道
成键轨道
π电子数 碳原子数
2 3
4 4
6 5
6 6
6 7
10 8
环丙烯 正离子
环丁二烯
环戊二烯 负离子
苯
环庚三烯 正离子
环辛四烯 二负离子
9.4 芳香性离子 环丙烯正离子:
OH CH3 CHO NH2
Cl SO3H
间氯苯酚
对甲苯磺酸
邻氨基苯甲醛
基团优先次序: –SO3H,–CO2H (R),–COX,–CONH2,–CN,–CHO,–CO(R),
–OH,–OR,–SH,–NH2,–C(炔),–C=C,–R,–X,–NO2
三 取 代 苯
1)三基团相同 2)三基团不同
1,2,3-(连)
芳烃通常可分为四大类: 1) 单环芳烃:
CH 3 NO2
CH 3
2) 多环芳烃:
CH
3) 非苯芳烃:
4) 杂环芳烃:
O S N H N N H N
9.1 苯的kekule结构式、稳定性和共振结构
KMnO4 H
+
P.196
不反应
C6H6 Br2 FeBr3 C6H5Br
Br2 CCl4
不反应
苯的性质:环体系稳定、易取代、不易加成、不易氧化 —— 芳香性
架桥基轮烯:
H
H
dH:-0.5(2H) 6.8~7.5(8H)
有芳香性
O
NAc
有芳香性
[18]轮烯:
Ha Hb
dHa:9.3(18H)
dHb:-2.99(6H)
有芳香性
9.6 杂环芳香性
P.205
9.7 多环芳烃
9.7.1 联苯 9.7.2 手性联苯类分子
3' 2' 1' 1 5' 6' 6 5 2 3 4
第9章 苯系芳香族化合物和芳香性 作业 P.218
9-1 / 2)4)
9-5 / 2)4)5)6)
9-6 / B C F
9 苯系芳香族化合物和芳香性
P.196
9.1 苯的kekule结构式、稳定性和共振结构 9.2 苯及其衍生物的命名 9.3 苯的分子轨道、芳香性和Huckel 4n+2理论 9.4 芳香性离子 9.5 轮烯 9.6 杂环芳香性 9.7 多环芳烃 9.8 芳香烃的来源、工业用途及安全性 9.9 全碳分子 9.10 芳烃的质谱和紫外、红外吸收光谱
COOH
4-溴-2-萘酚
1,6-萘二甲酸
9.7.5 稠环芳烃 9.7.6 稠环芳性
+ _ + _
P.212
薁(yù )
有芳性
Na _
茚 无芳性 有芳性
9.8 芳香烃的来源、工业用途及安全性
1、煤的干馏
气体 煤
干馏 隔绝空气
1000 1300 C
o
P.214
煤气 煤焦油 (分离提纯得苯、甲苯、二甲苯等) 50 年代 焦碳
COOH NH2 OH
CH(CH3)2
甲苯
硝基苯
异丙苯
苯甲酸
苯胺
苯酚
二取代苯:
ortho- (o,邻) (1,2) meta- (m,间) (1,3) para- (p,对) (1,4) 1)两基团相同 有三种异构体:邻(o)、间(m)、对(p) 2)两基团不同 主官能团与苯环一起作母体,另一个作取代基。
- H
+
P.202
H
- H - H
.
-
.
+ + +
+
环戊二烯负离子 :
-
. ..
.
. .. .
H
H
- H
+
- H - H
.
-
+
H
1
-H+
2
-
+
3
5
-
-
-
环庚三烯正离子:
H H
- H
+
H
- H
-
H
+ +
H
+ +
H
- H
.
H
+ +
H
+ +
H .
H
H
H H H H
+
H BrH H
2K
_ _ _
环辛四烯双负离子
苯的离域 分子轨道
总结:
苯分子结构: 环状对称结构(碳原子sp2杂化,各碳碳键键角120°) 闭合的共轭体系 离域能大,非常稳定
H H
H
H
H
H
苯的性质:环体系稳定、易取代、不易加成、不易氧化 — 芳香性
P.198
9.2 苯及其衍生物的命名
一取代苯:
CH3
1)苯为母体
NO2
2)苯为取代基
9.10 芳烃的质谱和紫外、红外吸收光谱
IR:芳环骨架的伸缩振动在1625~1575cm-1 ,1525~1475cm-1 C-H伸缩振动在3100~3010cm-1 UV:205 nm K带,中强吸收,近紫外区边缘 255~275 nm B带,弱吸收,芳环特征吸收带(精细结构) 1H NMR: 苯环上dH ~7.26 13C NMR:苯环上dC ~128
9.7.4 萘 蒽 菲
3 4 8 7 6 5 4 1 2 3 7 6 5 10 4 8 9 1 2 3 6 7 8 9 10 5 1 7 6 5 2 8 9
P.211
10 1 2 4 3
萘
蒽
菲
萘 (C10H8):
142.1 136.3pm
142.3
141.8
萘的芳性比苯差。
环闭共轭体系(大键); C-C键长不完全等同; 电子云不完全平均化; 离域能 ~255kJ/mol,比 苯的两倍 (151×2=302 KJ/mol) 小。
