莱氏衣藻鞭毛研究进展
莱茵衣藻外源基因转化和表达的研究进展

阴键匍 :衣 藻 ;外 源基 因蚌化 ;表 遣稠控 棱理 ;生物 反愿 器 微藻 在地 球生 物圈 中 占有 重要 的生 憋地 位 ,全 球约 5 %的有楗 碳是 由微 藻 固定 ,斡多 微藻 的天 然 0
廑物 具有珍 贵 的蘖用 但 值和食 用儇值 ,一些 微藻 遐 是研 究 生命代 甜橙 理 的模 式物 獯I。 随着人 颊 封臀 】 ] 面 的研 究 造展做 一综 述 ,以期 封 i 事 此方 面研究 的 芷 人 具有所 借 鉴 。
其 中 的莱茵 衣藻 ( ha y o n s e h rt ) C lm d mo a i adi rn i
因其细 胞 结横特 殊 、培 茬容 易 、生 畏速度 快 、遗傅 孥 背 景 清 晰和 耱 化 容 易 等原 因 而成 扇 研 究 基 因功
能 、外 源基 因表连 和生 物制 氢 的新 典模 式物 獯 ,被 稻焉 “ 色 酵母 ”或 “ 绿 光合 酵母 ” 目前 已分 别建 ,
[- 1 12
,
生 畏速度 快 ,绌胞 数量倍 增 峙 圈屠 5 ~6小 晴 ,可 在短 晴 同 内獾得大 量遗 傅後代 造 行遗 傅分析 ;培 巷
僚 件 馑 要 求 2  ̄ 和 日 光 烃 光 源 (2 0 ~ 5C 0 3 0 E m s ;能 在液 髓 中静止 培巷 或者 低速 水平 0  ̄ . 之 。) 摇 勤 ( 3 rm ) 善 ;也 能在 1 ~2 10p 培 % %理脂 的 固髓 培巷 基 上 生 畏 ,并且 能 形 成 罩克 隆 ;通遇 调 整光 一 暗周期 ,可使 衣藻 绌胞 分裂 连 到 同步化 。逭 些特 】
寅黢 带 来 巨大方便 ,更赋予 了莱 茵 衣藻作 局外 源基 因表 连髓 系 的新 型模式 物獯 的傻势 。
莱茵衣藻鞭毛内运输蛋白IFT81调控鞭毛组装

SU N J u ∞ 回
S c h o o l o f L i f e S c i e n c e , T s i n g h u a U n i v e r s i t y ,B e r i n g 1 0 0 0 8 4,C h i n a 回 C o r r e s p o n d i n g a u t h o r ,E ・ ma i l :s u n j u a n l 1 @m a i l s . t s i n g h u a . e d u . c a
1 g e n eo t h e mu t a n t 8 1
,
t h e p h e n o t y p e o f t h e mu t a n t wa s r e s c u e d a n d t h e e x p r e s s i o n o f I F _ r 8 1 一 HA c o u l d b e d e t e c t e d.w h i c h c o n i f r me d t h a t t h e d e f e c t i n/ F孺 1 g e n e l e d t o t h e a b n o r ma l l f a g e l l a d i r e c t l y .E l e c t r o n mi c r o s c o p y i ma g e s e x h i b i t e d t h e a b n o r ma l la f g e l l a o f t h e mu t a n t .An i mmu n o l f u o — r e s e e n e e a s s a y r e v e a l e d t h a t I F Y S I p r o t e i n w a s l o c a l i z e d t o t h e b a s a l b o d y a n d l f a g e l l a .T h i s w o r k S H O WS t h a t l o s s o f p r o t e i n I F T 8 1 w i l l d i r e c t l y l e a d t o t h e d e f e c t s o f l f a g e l l a r a s s e mb l y ,a n d I F T 8 1 p r o t e i n i s i n d i s p e n s a b l e f o r l f a g e l l a r a s s e mb l y i n C h l a my d o mo n a s
莱茵衣藻LZTFL1 蛋白的多克隆抗体制备及应用

和纯化后免疫新西兰大白兔制备多克隆抗体,最后采用间接 ELISA 法测得抗血清效价达到 1:512 000,
经 Western blot 对 C. reinhardtii CC125 检测具有较高特异性。[结果]首次实现了莱茵衣藻 LZTFL1 蛋白
的原核表达,制备出一支兔抗莱茵衣藻 LZTFL1 蛋白的多克隆抗体,为后续研究 LZTFL1 蛋白在莱茵
中国生物工程杂志 China Biotechnology
ChinaXiv合作期刊
莱茵衣藻 LZTFL1 蛋白的多克隆抗体制备及应用
刘雁霞 1,樊振川 1
天津科技大学大健康生物技术研究所,天津市大健康生物技术国际联合研究中心,天津科技大学食品工程与生物技术学院,天津 300457
chinaXiv:201711.02683v1
白骨架形成,通常所研究纤毛都为运动纤 研究到纤毛组装、功能、纤毛蛋白间的相
毛。纤毛具有协调细胞生长和进行细胞信 互作用、纤毛信号传导及纤毛与疾病间的
号传导的作用,纤毛缺失或信号传导功能 关系均取得了一定进展。已知纤毛内存在
障碍会造成一系列的疾病,目前已发现许
一种 BBSome 复合物,BBSome 依赖于纤
在动物实验研究中,亮氨酸拉链转录 因子 1(LZTFL1)位于 3 号染色体 3p21.3 区域,与毕氏综合征有密切关系,是迄今 为止发现的第 17 个与 BBS 有关的基因, 因此又被称为 BBS17,Lztfl1 基因 5 个碱基 的缺失便会引起 BBS[4-11];Lztfl1 基因突变 会引发恶性肿瘤,继而发展为癌症,比如 肺癌,胃癌等[12, 13]。另外,在人体及小鼠 的实验研究中,敲除 Lztfl1 基因会导致纤毛 内 BBSome 的累积[14-18],与 ift 基因缺陷对 BBSome 造成的影响一致,动物临床表现为 小鼠体重增加及引起失明[12],由此可判断, BBSome,LZTFL1 与 IFT 三种蛋白间存在 一 定 相 互 作 用 , Seo. S[15] 等 人 已 经 证 实 LZTFL1 在小鼠体内与 BBS9 直接作用,而 与 IFT 蛋白的作用至今没有明确数据证实, 有研究者猜测 IFT27 与 BBSome 之间可能
莱茵衣藻BBSome蛋白BBS2原核表达、纯化和多克隆抗体的制备及鉴定

研究论文莱茵衣藻BBSome蛋白BBS2原核表达、纯化和多克隆抗体的制备及鉴定董彬*',2(1.天津科技大学食品工程与生物技术学院,教育部食品营养与安全重点实验室,天津300457;2.天津科技大学新农村发展研究院,天津300457)摘要:BBSome蛋白复合物是纤毛蛋白组分之一,BBSome组装或纤毛运输缺陷可导致巴-比二氏综合征。
其中,BBSome组分BBS2缺失已被临床证明是导致B B S的病因之一。
莱茵衣藻是研究BBSome组装和纤毛运输的一种很好的模式生物。
为深入研究BBS2的致病机制,需要特异性识别其BBS2蛋白的抗体。
本文将莱茵衣藻BBS2基因5+端399 b p的cD N A序列克隆到原核表达载体pET28a-bbs2,转入大肠杆菌BL21(DE3)细胞进行诱导表达。
在8m o l/L尿素存在的情况下对该融合蛋白进行镍柱亲和纯化,并将纯化后的融合蛋白免疫新西兰大白兔。
SDS-PAGE电泳结果表明:分子量为15 k D a的重组6xH is-BBS2融合蛋白为水不溶性蛋白。
5次免疫后的抗莱茵衣藻BBS2抗血清效价高达1:256 000。
经Protein A琼脂糖CL-4B亲和纯化后的抗血清不仅在Western b lo ttin g分析中能特异性识别莱茵衣藻BBS2,而且在免疫荧光染色分析中能精确定位BBS2于基体和纤毛内。
这一多克隆抗体的成功制备为深入开展BBS2在BBSome组装和纤毛运输中 分 机制 基 。
关键词:莱茵衣藻,纤毛,BBS2,原核表达,蛋白纯化,多克隆抗体中图分类号:Q786 文章编号:1673-1689(2019)02-0145-08 D0I:10.3969/j.issn. 1673-1689.2019.02.021Prokaryotic Expression,Purification,Polyclonal Antibody Preparation and Identification of the Chlamydomonas reinhardtii BBSome Protein BBS2DONG Bin1,WU Son,',CHENG Rongqiang1,MENG Demei1’1,FAN Zhenchuan*1’1 (l.Key Laboratory of Food Nutrition and Safety ’ Ministry of Education ’ College of Food Science andBiotechnology,Tian j in University of Science and Technology,Tian j in 300457,China ;2. New Rural DevelopmentResearch Institute,Tian j in University of Science & Technology,Tian j in 300457,China)A bstract:BBS2 is a BBSome subunit and its loss causes Bardet-Biedl syndrome.Chlamydomonasreinhardtii is a model organism used for studying the Bardet-Biedl syndrome.To investigate the roleo f BBS2 in causing Bardet-Biedl syndrome’a prokaryotic expression vector,pET28a-bbs2 is收稿日期:2016-06-03基金项目:天津市应用基础与前沿技术研究计划(13JCYBJC41900);天津科技大学引进人才科研启动费(20130420)。
衣藻_精品文档

衣藻简介衣藻(学名:Chlamydomonas),又称短毛藻,是一种单细胞绿藻,属于蓝藻纲。
它具有双鞭毛,通常呈绿色或黄绿色,是一种常见的淡水藻类。
衣藻是一种原始的生物,具有重要的科学研究价值。
它被广泛应用于生物学研究、生物燃料、环境监测等领域。
特征衣藻细胞呈椭圆形或卵圆形,直径约为10-20微米。
它的细胞壁由纤维素构成,具有一定的弹性,能够包裹和保护细胞。
衣藻细胞内含有叶绿素,使其呈现出绿色的外观。
衣藻有两根等长的鞭毛,使其能够在水中自由游动。
衣藻细胞具有细胞核、质膜、线粒体、叶绿体等常见的细胞结构。
它的细胞核包含DNA,控制着细胞的生长和繁殖。
衣藻的叶绿体是进行光合作用的关键器官,能够充分利用阳光能量合成有机物质。
生活环境衣藻广泛分布于全球各地的淡水环境中,如湖泊、河流、水库等。
它可以在微观的水生生态系统中独立生存,并且能够适应各种环境条件。
衣藻是一种光合生物,需要光能进行光合作用。
因此,它通常生活在光照充足的水域中。
衣藻对水质有着很高的敏感性,它可以作为环境监测的指示生物。
当水域污染时,衣藻的生长状态会发生改变,从而表现出水质的变化。
因此,衣藻在环境监测和水质评估中有着重要的应用价值。
科学研究应用由于衣藻具有较为简单的细胞结构和短的生命周期,研究者可以方便地对其进行实验观察。
这使得衣藻成为生物学研究的理想模式生物之一。
科学家们借助衣藻,能够更好地了解植物细胞的生物功能和生物学过程。
衣藻还在生物燃料领域具有广泛的研究和应用。
由于衣藻能够利用阳光进行光合作用,并且富含油脂,可以通过提取其油脂制备生物柴油。
这种生物柴油既可用于替代传统的化石燃料,又能减少二氧化碳的排放,具有很大的经济和环境效益。
结语衣藻作为一种常见的绿藻,具有重要的科学研究价值和生物应用潜力。
通过对衣藻的研究,我们可以更好地了解生物的进化过程和机制,为人类的生物技术和环境保护提供有力的支持。
注:本文所述内容仅供参考,如需了解更多详细信息,请参阅相关专业文献。
衣藻

模式标本
采集 藻种保存
பைடு நூலகம்
扩大培养 观察
在有机质较丰富的池塘或河水中,于春秋雨季,用浮游采回衣藻样品,如果是小水体或浅水域,最好用碗取 水,注入中过滤,镜检后倒入培养缸内,置于向阳处,不久可见培养缸壁的水表面有一条绿线,这是集聚的衣藻。 用吸管自绿线处吸取绿水,可得纯衣藻群种,然后在室内长期培养和保存。
营养细胞
培养液中个体较大的营养细胞。很多,生理上亦很活跃,在显微镜视野中可以清楚地看到衣藻营养细胞的形 态和运动。加碘液染色后观察细胞内的叶绿体、蛋白核、眼点、鞭毛等显微结构也较方便。
孢子囊和孢子
从培养液细胞聚集处取材可以看到孢子囊和孢子。衣藻孢子囊的产生是在有利条件下开始的,通常在夜间由 营养细胞分化形成。细胞的原生质体发生几次连续纵裂,形成4、8或16个孢子,囊壁破裂时释放,形成新个 体。
谢谢观看
衣藻
衣藻科衣藻目原生生物
01 简介
03 分布范围
目录
02 形态特征 04 分类情况
05 生殖方式
07 研究进展
目录
06 模式标本
衣藻(Chlamydomonas)亦称“单衣藻”。绿藻门,衣藻科。藻体为单细胞,球形或卵形,前端有两条等长 的鞭毛,能游动。鞭毛基部有伸缩泡两个;另在细胞的近前端,有红色眼点一个。载色体大型杯状,具淀粉核一 枚。无性繁殖产生2、4、8或16个游动孢子;有性生殖为同配、异配和卵式生殖。在不利的生活条件下,细胞停 止游动,并进行多次分裂,外围厚胶质鞘,形成临时群体称“不定群体”。环境好转时,群体中的细胞产生鞭毛, 破鞘逸出。广布于水沟、洼地和含微量有机质的小型水体中,早春晚秋最为繁盛。衣藻属是原始的单细胞绿色植 物,已被记录的有500多个种。
莱茵衣藻纤毛内运送蛋白ift57抗原的原核表达、纯化及其多克隆抗体的制备

抗 血 清 经 Protein A 纯 化 后 ,Western b lottin g检 测 显 示 所 制 备 的 I F T 5 7 多 克 隆 抗 体 能 够 特 异 性 识
别 莱 茵 衣 藻 中 的 IF T 5 7 蛋 白 质 。这 一 结 果 表 明 ,为 表 达 纯 化 溶 解 性 较 差 的 蛋 白 质 抗 体 制 备 提 供
了 借 鉴 意 义 ,所 获 抗 体 为 深 入 研 究 IF T 5 7 在 鞭 毛 组 装 中 的 作 用 机 理 奠 定 了 基 础 。
关 键 词 :莱 茵 衣 藻 ;纤 毛 ;IF T 57&原 核 表 达 ;多
抗体
中图分类号:Q 786 文章编号"1673-1689(2019)11-0108-07 D01:10.3969/j .issn.1673-1689.2019.11.015
Prokaryotic Expression and Purification of Chlamydomonas reinhardtii Intraflagellar Transport Protein 57(IFT57) Antigen and Preparation of Polyclonal Antibody
A b s tra c t :IFT57 is a subunit o f the intraflagellar transport protein B com p lex and plays an important role in cilium assembly. To express ift57 g en e,D N A fragments were amplified by PCR and cloned into an in-house m odified version o f the pET28a vector. The resulting proteins contained a SxHis tag at their N terminus. BL21 (D E 3 ) E scherichia coli cells harboring the expression plasm id were grown in lysog en y broth (L B ) m edium at 37 U and then induced w ith isop rop yl-b-D -thiogalactosid e,
莱茵衣藻转化体系生产疫苗的研究进展

, , 。 , , 。 , , 。 。 , ,
o
o n a s r e
n
,
,
“
Hale Waihona Puke ”。,,
,
。
,
,
,
,
,
,
,
。
,
,
。
,
8
,
。
,
,
,
。
。
,
,
,
,
。
,
,
,
,
。
,
,
。
,
.
,
。
,
。
,
。
,
。
.
,
,
。
,
,
,
,
。
,
,
,
。
,
,
。
,
,
。
’
’
,
`
`
。
,
。
。
,
`
稳 定 性 实现外 源基 因 的 高效表 达 提 高 同质化水平 0 个 拷 贝 在转化 时 只 有 部 分 外 源 基 因 衣 藻基 因 组 中约有 8 和整 合 到衣 藻基 因 组 中 从而导 致 了 同一 藻 细 胞 的不 同拷 贝 中一 部 分 含 有 外 源 基 因 而一 部 分 不 含外 源基 因 这种 非同质化现 象 影 P e c 培 养筛 选 可 以 提 高转化子 响 了 外 源 基 因 的稳 定表 达 采 用 s 目 因 的同质化水平 的基 的表 达 2 5 调整培 养 环 境 影 响衣 藻 生长 的环 境 因 素 如光 照 温 度 营 养 胁 迫 P H 等 均 能影 响 目 的基 因 的 表 达 研 究 证 实 降低温 度会 影响 外 源基 因 的整 合 效 率 u V 照 射 可 以 使 衣 藻 叶 绿体 中大 多 数 m R N A 表 达 量 增 加 2 一 4 Pe c 浓度为 5 倍 培 养基 中 s 0 m 留m L 时 转化 率 为 2 0 % 左右 3 莱茵衣 藻 生 产疫 苗 的 研 究 植 物 基 因 工程疫 苗 具 有 高效 低成本 高 安 全 性的 特点 尤 其 近 是 年 发展 的 口 服疫 苗 这种疫 苗 通 过 食 用 含 有 特定抗原 的植 物 组 织 通 过 胃肠 道豁 膜 激 发特 异性 免 疫应 答 进 而 获 得 全 身 性 保 护 口 服疫 苗 给药 途径简 单 安全 性 好 避 免 了 静脉 注 射 带 来 的风 险 是 一 个 很 有 潜 力的研 发领 域 3 1 口 蹄疫疫 苗 孙 等 利 用 衣 藻 叶 绿体表 达 载体 p A C T B v P I 将含 有 口 蹄疫病 毒 的基 因 v P I 和 霍乱病毒 日 亚 单 位基 因 ( C T B ) 导 人 衣藻 叶 绿体 中 进行重 组表 达 得 到高 达 3 % 的总 可 溶 性 蛋 白 比 核 基 因 组蛋 白表 达含量 有 较大 的增 加 该 结果 显示 了衣 藻 叶绿 体 生 产粘 膜 疫 苗 的 可 能性 3 2 猪瘟病毒疫 苗 2 用 基 因 枪 法转人含 何 等构 建 了 衣 藻 叶绿体 表 达 载体 p 6 4 e I S A 分 析表 明表 达 的 E Z 可 溶 有 猪瘟病毒 的 结 构 蛋 白 E Z 基 因 E L 性 蛋 白积 累量 约为 1 5 2 % 将 该 可 溶 性 蛋 白与 弗 氏 佐剂混合 皮 下 注 射 小 鼠 可 诱导显 著 的免 疫 反应 但 口 服 给 药 时 未 检测 到 全 身 或 粘 膜 的免 疫 反 应 因 此 合 适 的粘 膜 佐 剂是 提 升疫 苗 免 疫 应 答 的重 要 组成部 分 3 3 1 型 糖尿病疫 苗 1型 糖 尿 病 的 发病与 H L A 抗原 有 关 患 者体 内可 检 出 谷 氨 酸 脱竣酶 ( C 、 D ) 抗体 利 用 传统 的细 菌或 哺 乳 动物细 胞表 达 体 系生 产 的 该 疫 苗 效 率较 低 王 等 利 用 衣 藻表 达 G A D 重组 h G A D 6 5 基 0 3% 因 转化 人 衣 藻 叶绿体 后 可 溶 性 蛋 白表 达 量 约为 0 2 5 且 该 重组 蛋 白可 与 糖 尿病 患 者 的血 清 发 生反 应 并 诱 导非肥 胖 性 糖 尿病 小 鼠 的脾 细胞 增 殖 表 明衣 藻 叶 绿体作 为生 产 h G A D 6 5 的工 具 具 有 巨 大 的应 用 价 值 衣 藻 为 基 础的 疫 苗 模 型 的研 究 意 味着全球 范围 对 相 关 疾 病 斗争 的可 行 性 这 项技 术 的潜 力 体现 在 它 已 经 得到 了世界各地 的研 究 者 的 关 注 鉴 于有 潜 力 的临 床实 验 的结果 研 发藻类衍 生 疫 苗 是未来 疫 苗 发展 的一 个 重 要 方 向 参考 文 献 : [ ]吴 志华 黎 双 飞 胡章 立 莱 茵 衣 藻 线 粒体外 源 基 因 表 达 系 l ] 广 东 省植 物 学 会 第 十 七 期 学 术 研 讨 会 论 文 集 A 统 的初 步 研 究 「 C1200 8 年 〔 2 [ ] 应彩 云 黄 小 琴 郭瑜琪 钟莉莉 刘艳 黎 事 伦 顾 晓敏 周 ] 南方 医 J 晓 红 番茄遗 传 转化 筛选 及 其 子 代选育体 系的优 化 研 究 [ 20 7 0 大 科 学学 报 8 年 期 0 3 [ ] 于 惠敏 侯 丙 凯 番 茄 基 因 工 程 及 生 物 反 应 器 研 究 与 开 发 ] 山 东农 业 科 学 2 0 0 7 年 0 2 期 J 进展 [ : 作 者简 介 窦 笑 菊 ( 1 9 8 1 一 ) 女 山 东 人 西藏 职 业 技 术 学 院 细 胞生 物 学 硕士 讲师
莱茵衣藻中ift80蛋白多克隆抗体的制备及其应用

第39卷湖北师范大学学报(自然科学版)Vol 39第4期JournalofHubeiNormalUniversity(NaturalScience)No 4ꎬ2019莱茵衣藻中IFT80蛋白多克隆抗体的制备及其应用冯㊀雳ꎬ丁㊀梅ꎬ邢俊俏ꎬ李丽丽ꎬ蒋俊龙(江汉大学系统生物学研究院遗传与生物技术研究中心ꎬ湖北武汉㊀430056)摘要:IFT80蛋白是莱茵衣藻(Chlamydomonasreinhardtii)纤毛内运输蛋白(intraflagellartransportꎬIFT)复合体中的一个重要组分ꎬ获得IFT80蛋白抗体为研究该蛋白作用机理提供有力的实验材料ꎮ通过构建大肠杆菌重组表达载体pGEX-4T-ift80ꎬ将重组表达载体转化到大肠杆菌E.coliRosetta中ꎬ构建表达IFT80蛋白的重组菌株ꎻ在合适的时间点加入浓度适当的IPTG诱导重组菌株表达IFT80蛋白ꎻ将收集的蛋白上清液过柱纯化ꎬ再以纯化后的IFT80蛋白作为抗原免疫新西兰白兔ꎬ动脉取血后ꎬ将血清分离纯化获得莱茵衣藻IFT80多克隆抗体ꎮ结果:经ELISA法测定该抗体效价达到512000ꎬWesternblot测定该抗体特异性好ꎮ该抗体可用于莱茵衣藻IFT80蛋白的检测和功能鉴定ꎬ对于研究莱茵衣藻IFT80蛋白的作用机理及生物学功能研究等具有重要意义ꎮ关键词:纤毛ꎻIFT80ꎻ抗体制备ꎻ血清分离纯化ꎻ莱茵衣藻中图分类号:Q53.2㊀㊀文献标识码:A㊀㊀文章编号:2096-3149(2019)04-0053-06doi:10.3969/j.issn.2096-3149.2019.04.010纤毛又叫鞭毛ꎬ是突起于真核细胞表面具有极性结构的一类细胞器[1~2]ꎬ可通过定向摆动ꎬ排出上皮表面的尘埃和细菌等物ꎬ另外还可以提供流体推动力参与细胞的运动功能ꎬ也参与了细胞信号传导ꎬ在细胞生命活动的各个方面发挥着多种关键作用[3]ꎮ纤毛结构和功能的缺失会导致肾脏㊁骨骼和中枢神经系统等相应纤毛疾病的发生[4]ꎬ因此ꎬ深入地探索纤毛调控机理对基础生物学理论的发展和人类纤毛相关疾病的攻克具有重要意义ꎮ研究发现ꎬ纤毛中大概有600多种可溶蛋白ꎬ但是没有蛋白质合成所需要的细胞器如核糖体等ꎬ所以目前报道的纤毛生物合成所需蛋白分子进出纤毛均是由IFT复合物进行运送的[5]ꎬ一旦IFT蛋白发生缺失将会导致纤毛的组装或者解聚发生异常ꎮ经研究表明ꎬ纤毛基因缺失或突变可能导致相关纤毛疾病的发生[6~7]ꎮ目前有关纤毛长度调控的知识主要是研究衣藻得来的[8~9]ꎬ而莱茵衣藻是研究真核生物纤毛功能的主要模式生物之一[6~7ꎬ10~11]ꎮIFT80蛋白是莱茵衣藻纤毛内运输蛋白IFT复合物中的一个重要组分ꎬ目前已报到的IFT80蛋白仅有单克隆抗体ꎬ制备IFT80蛋白多克隆抗体为研究IFT中多个蛋白的同时荧光定位创造了条件ꎮ此外ꎬ研究IFT80蛋白的功能对纤毛的组装及其调控机制的影响ꎬ及纤毛对相关疾病的发病机理和预防等科学问题都具有重大意义ꎮ1㊀材料与方法1.1㊀试验材料1.1.1㊀质粒㊀pGEX-4T-1质粒由本实验室长期保存ꎮ1.1.2㊀主要试剂㊀感受态细胞E.coliRosetta㊁BL21均购于北京全式金生物技术有限公司ꎬ植物总RNA提取试剂盒购于北京百泰克生物技术有限公司ꎬ反转录试剂盒R212㊁胶回收试剂盒㊁质粒小提收稿日期:2019-06-07基金项目:国家自科科学基金青年项目(31601090)作者简介:冯㊀雳(1990 ㊀)ꎬ女ꎬ湖北武汉人ꎬ硕士ꎬ讲师ꎬ研究方向为细胞生物学.35试剂盒购于南京诺唯赞生物科技有限公司ꎬL-Glutathionebesds(G4510)㊁弗氏完全佐剂㊁弗氏不完全佐剂均购于Sigma公司ꎬD-tube透析管(货号:71740-3CN)购于Merck公司ꎬDextrinsepharoseTMHighPerformance(货号:28-9355-97)购于GE公司ꎬHRP标记的羊抗兔抗体购于美国Bio-Rad公司ꎬFluoromount-G购于SouthernBiotech公司ꎮ1.1.3㊀主要仪器㊀PCR仪由美国ABI公司出产ꎬ高速离心机由美国Beckman公司出产ꎬ聚丙烯酰胺凝胶电泳仪由Bio-Rad公司出产ꎬ琼脂糖凝胶电泳仪由北京六一仪器厂产ꎬ恒温培养箱由日本松下电器产业株式会社出产ꎬ激光共聚焦显微镜(型号:TCSSP8)购于徕卡公司ꎮ1.2㊀试验方法1.2.1㊀莱茵衣藻ift80基因的扩增㊀用北京百泰克生物技术有限公司生产的通用植物总RNA提取试剂盒提取莱茵衣藻总RNAꎬ具体步骤参见产品说明书ꎮ以提取的总RNA为模板ꎬ用南京诺唯赞生物科技有限公司生产的反转录试剂盒R212获得莱茵衣藻cDNAꎮ以cDNA为模板ꎬ上游引物5-ATCTGGTTCCGCGTGGATCCATGGTGGACCAGCGCC-3ᶄ(斜体部分表示BamHI限制性酶切位点)㊁下游引物5ᶄ-GTCACGATGCGGCCGCTGAGTTACACGTAGCGCTTGGC-3ᶄ(斜体部分表示XhoⅠ限制性酶切位点)ꎬPCR扩增程序为:94ħ预变性4minꎻ94ħ变性30sꎬ60ħ退火30sꎬ72ħ延伸2minꎬ共35个循环ꎻ72ħ再延伸10min.用琼脂糖凝胶电泳分析鉴定扩增产物ꎮ1.2.2㊀原核表达载体pGEX-4T-ift80的构建与鉴定㊀将大肠杆菌表达载体pGEX-4T-1用BamHⅠ限制性内切酶和XhoⅠ限制性内切酶进行双酶切ꎬ在37ħ反应4h.用琼脂糖凝胶电泳分析鉴定pGEX-4T-1双酶切产物ꎬ并切胶回收ꎮ将PCR产物与经双酶切后的pGEX-4T-1载体用同源重组酶在37ħ恒温箱中连接反应30min.将重组产物转化到感受态细胞trans5α中ꎬ涂布于含有氨苄西林(Amp)的LB培养基上ꎬ置于37ħ恒温箱中倒置培养14hꎬ氨苄西林在培养基中浓度0.1mg/mL.挑取阳性克隆至含有氨苄西林抗性液体培养基中ꎬ37ħ恒温摇床200rpm摇菌4h.菌液浑浊后进行菌液PCRꎬ将PCR产物条带大小与目的片段大小吻合的菌液送苏州金唯智生物科技有限公司进行测序分析ꎮ1.2.3㊀抗原蛋白的制备与纯化㊀将测序结果正确的重组菌株pGEX-4T-ift80扩大培养ꎬ用质粒提取试剂盒提取质粒ꎬ转化至大肠杆菌BL21中ꎬ获得莱茵衣藻ift80基因编码序列的重组表达菌株ꎮ将重组表达菌株接入含有氨苄西林的LB液体培养基中ꎬ37ħ恒温摇床过夜培养ꎮ当菌液OD600值达到0.5时ꎬ吸取少量诱导前的菌液进行SDS-PAGE电泳检测ꎮ加入终浓度为0.8mM的异丙基-β-D-硫代吡喃半乳糖苷(IPTG)诱导目的蛋白表达ꎬ37ħ恒温摇床震荡培养14hꎬ吸取少量菌液进行SDS-PAGE电泳检测ꎮ收集诱导表达后的细菌ꎬ用适量PBS缓冲液于冰上重悬ꎬ加入1mLPMSF(蛋白酶抑制剂)ꎬ并加入终浓度为1mg/mL的溶菌酶ꎬ混匀后冰上敷育30min.超声波破碎细胞ꎬ将所得溶液10000rpm㊁4ħ离心30minꎬ取菌液上清进行SDS-PAGE电泳检测[12]ꎮ根据电泳检测的结果ꎬ对包涵体蛋白进行聚丙烯酰胺凝胶电泳ꎬ胶块经3mol/LKCl染色后ꎬ蛋白条带呈白色ꎬ用锋利的刀片切下与预测大小吻合的目的条带[13]ꎬ将胶块放入预先混有缓冲液的D-tube透析管中ꎬ电洗脱纯化目的蛋白[14~15]ꎬ期间更换两次缓冲液ꎮ洗脱完后获得的即为制备好的抗原蛋白ꎬ用超滤浓缩管浓缩并分装ꎬ冻存至-80ħ冰箱ꎮ1.2.4㊀多克隆抗体的制备及鉴定㊀以制备的蛋白为抗原免疫新西兰白兔ꎬ在未免疫前取耳缘静脉血1mLꎬ4ħ静置过夜ꎬ上层血清作为阴性对照ꎮ取1.5mg纯化好的蛋白抗原加入等体积的弗式完全佐剂ꎬ用注射器混匀至完全乳化ꎬ在其背部皮下免疫6个点ꎬ双后脚皮下各免疫1个点ꎬ记录第一次免疫时间ꎮ11天后进行第二次免疫ꎬ取1.5mg蛋白抗原加入等体积的弗式不完全佐剂ꎬ用注射器混匀至完全乳化ꎬ在背部皮下免疫4个点ꎮ11天后进行第三次免疫ꎬ免疫蛋白抗原剂量为0.75mgꎬ方法与第二次免疫相同ꎮ此后每隔11天分别进行一次加强免疫ꎬ共计两次ꎬ免疫方法㊁剂量均与第三次免疫相同ꎮ末次免疫后一周进行颈动脉取血至死亡ꎬ收集全血约80mL静置4ħ过夜ꎬ分离上层血清ꎮ免疫亲和纯化法纯化抗血清[16]ꎬ利用DextrinsepharoseTMHighPerformance树脂作为填料ꎬ结合纯化后的抗原蛋白pGEX-4T-IFT80ꎬ使血清缓慢过已偶联抗原的填料中ꎬ待血清全部过柱后平衡柱填料ꎬ然 45后用0.1mol/L㊁pH2.7的甘氨酸洗脱液洗脱并收集抗体ꎬ用1mol/L㊁pH9.0的Tris-HCl中和抗体至中性ꎮELISA法测定抗体效价[17]ꎬ利用酸性环境刺激莱茵衣藻野生型藻株CC-1690鞭毛脱落ꎬ收集分离得到的鞭毛蛋白沉淀并进行变性处理ꎬ将鞭毛蛋白作为抗原Westernblot测定抗体的特异性[18]ꎮ鉴定结果达到预期效果后ꎬ将血清分装保存至-80ħ.㊀1.2.5免疫荧光法检测IFT80蛋白定位㊀收集细胞状态良好的野生型衣藻细胞ꎬMTbuffer重悬ꎬ加入等体积8%PFA固定鞭毛后ꎬ使用0.5%NP40通透细胞壁ꎬ轻滴至已用PEE处理的载玻片上ꎬG-block封闭30minꎬ用blockingbuffer按1ʒ100比例稀释anti-IFT80ꎬ一抗孵育4hꎬPBS清洗后用荧光标记-羊抗兔二抗孵育2hꎬPBS清洗后加入防止荧光淬灭的Fluoromount-Gꎬ贴上盖玻片ꎬ封片ꎮ激光共聚焦扫描显微镜下观察染色结果ꎬ确认该蛋白定位ꎮ2㊀结果与分析2.1㊀莱茵衣藻ift80基因的克隆和表达载体的构建提取莱茵衣藻总RNA为模板反转得到cDNAꎬ图1A显示Chlamydomonasreinhardtii野生型CC-1690总RNA提取结果ꎻ该基因全长2298bpꎬ共计766个氨基酸ꎬ本次构建重组表达载体经序列分析仅表达该蛋白C端部分区域即第520~765个氨基酸区段ꎬ图1B所示为ift80基因PCR扩增产物ꎬ目的片段大小为744bpꎬ条带单一㊁特异性良好且分子量正确ꎮ送苏州金维智生物科技有限公司测序鉴定ꎬ其结果与预期目的片段一致ꎬ说明表达载体pGEX-4T-ift80构建成功ꎮ㊀㊀㊀㊀㊀㊀㊀图1㊀野生型CC-1690藻株RNA㊀㊀㊀㊀㊀㊀㊀图2㊀SDS-PAGE检测抗原蛋白在上清、提取及ift80基因扩增结果㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀包涵体中的表达量㊀㊀2.2㊀抗原蛋白的诱导表达及纯化重组表达菌株扩大培养后ꎬ经IPTG诱导表达蛋白ꎬ超声破碎重组表达菌株ꎬ其结果如图2所示ꎬ泳道1表示上清蛋白ꎬ泳道2㊁3㊁4分别表示包涵体经2㊁5㊁10倍稀释结果ꎮ目的蛋白在上清中含量较低ꎬ在包涵体中含量较高ꎬ但纯度偏低ꎬ故采用包涵体切胶方式获得抗原蛋白ꎮ包涵体经SDS处理后进行聚丙烯酰胺垂直电泳ꎬ用KCl-ddH2O对胶块进行染色-脱色处理ꎬ切胶去除杂蛋白ꎬ将含有目的蛋白的胶块浸入装有浸提液的透析管中透析ꎬ获得免疫用抗原蛋白ꎮ2.3㊀抗体的效价及特异性鉴定㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀图3㊀间接ELISA法测定抗血清效价㊀㊀㊀㊀㊀㊀㊀㊀图4㊀Westernblot检测抗体特异性利用纯化后的抗原蛋白pGEX-4T-IFT80免疫新西兰大白兔ꎬ五免后颈动脉取血ꎬ免疫亲和纯55化法纯化抗体ꎮ采用间接ELISA法测定抗血清效价ꎬ结果如图3所示ꎬ抗体滴定度达到1ʒ512000ꎬ该结果显示两个抗体均效价良好ꎮ分离野生型藻株鞭毛蛋白ꎬ将制得的抗体按比例1ʒ1000稀释ꎬ利用Westernblot方法检测该抗体的特异性ꎬ结果如图4所示ꎬ泳道1为全细胞蛋白ꎬ泳道2为鞭毛蛋白ꎬ主要条带大小均与预期相符合ꎬ结果表明该抗体特异性识别鞭毛蛋白良好ꎬ可以用于后续的实验ꎮ2.4㊀免疫荧光法检测IFT80蛋白定位将荧光色素标记在第二抗体上ꎬ利用激光共聚焦显微镜观察IFT80蛋白在细胞中的定位ꎬ结果如图5所示ꎬ由图可以看到anti-IFT80抗体可以与莱茵衣藻IFT80蛋白特异性结合ꎬ并在全细胞内均有分布ꎮ图5㊀免疫荧光法检测IFT80蛋白在莱茵衣藻中的定位3㊀讨论纤毛是突出于真核细胞表面的一类重要的细胞器ꎬ其参与多种生命活动进程ꎬ对于细胞运动及细胞信号传导具有重要意义ꎮ纤毛功能的缺陷可能导致相关疾病的发生ꎬ纤毛运动缺陷可能导致的疾病有原生纤毛不动综合征(PCD)ꎬ呼吸道感染㊁生殖功能降低等[19]ꎬ纤毛信号可能导致的疾病有巴德毕氏综合征(BBS)ꎬ并指症㊁肥胖症等ꎮ研究纤毛相关基因有助于纤毛生物学相关基础理论的发展以及人类对于纤毛相关疾病的预防及治疗ꎬ因此研究纤毛复合体相关基因的信号传导及运输机制ꎬ对于人类攻克纤毛相关疾病具有至关重要的作用ꎬ而制备抗体是研究相关蛋白不可或缺的实验材料ꎮ本实验构建了产IFT80蛋白的重组表达菌株pGEX-4T-ift80ꎬ通过谷胱甘肽亲和纯化得到抗原蛋白ꎬ五次免疫新西兰大白兔获得其多克隆抗体ꎬ通过ELISA测定其抗体效价达到512000ꎬWestern ̄blot鉴定该抗体具有良好的特异性ꎬ可以正确识别至少1ng莱茵衣藻纤毛中IFT80的抗原蛋白ꎬ并且免疫荧光技术显示其能特异性识别纤毛蛋白ꎮ表明该抗体可以用于Wsternblot及活体中的检测ꎬ以此研究莱茵衣藻IFT80蛋白的作用机制ꎬ为纤毛相关疾病的诊断及治疗提供了理论基础和实验材料ꎬ为研究相关作用蛋白的具体作用机制及理解纤毛疾病的致病机理奠定了重要基础ꎮ参考文献:[1]LuckerBFꎬMillerMSꎬDziedzicSAꎬetal.DirectinteractionsofintraflagellartransportcomplexBproteinsIFT88ꎬIFT52ꎬandIFT46[J].JBiolChemꎬ2010ꎬ285(28):21508~21518.[2]WheatleyDNꎬWangAMꎬStrugnellGE.Expressionofprimaryciliainmammaliancells[J].CellBiolIntꎬ2013ꎬ20(1):73~81.[3]CaoMQꎬPanJunmin.Ciliaandciliopathies[J].ChinJofCellBiolꎬ2012ꎬ34(9):849~856.曹木青ꎬ潘俊敏.纤毛及纤毛相关疾病研究进展[J].中国细胞生物学学报ꎬ2012ꎬ34(9):849~856. [4]LuoMNꎬCaoMQꎬKanYNꎬetal.ThephosphorylationstateofanAurora-Likekinasemarksthelengthofgrowingfla ̄gellainChlamydomonas[J].CurrBiolCbꎬ2011ꎬ21(7):586~591.[5]MadelineLRꎬAlexandreB.CiliarykinesinsbeyondIFT:ciliumlengthꎬdisassemblyꎬcargotransportandsignalling[J].Biolcell2019(111):1~16.65[6ə]WemmerKAꎬMarshallWF.FlagellarlengthcontrolinChlamydomonas-Aparadigmfororganellesizeregulation[J].IntRevCytolꎬ2007ꎬ260:175~212.[7]RosenbaumJ.Intraflagellartransport[J].NatRevMolCellBiolꎬ2002ꎬ12(4):R125~R125.[8]IominiCꎬLiLꎬEsparzaJMꎬetal.RetrogradeintraflagellartransportmutantsidentifycomplexAproteinswithmultiplegeneticinteractionsinChlamydomonasreinhardtii[J].Genetꎬ2009ꎬ183(3):885~896.[9]GerdesJMꎬDavisEEꎬKatsanisN.Thevertebrateprimaryciliumindevelopmentꎬhomeostasisꎬanddisease[J].Cellꎬ2009ꎬ137(1):32~45.[10]RenHY.TheprokaryoticexpressionandpurificationofChlamydomonasreinhardtiiintraflagellartransportprotein46andpreparationofpolyclonalantibody[D].Tianjin:TianjinUnivofScience&Technologyꎬ2016.任海月.莱茵衣藻IFT46的原核表达纯化及其多克隆抗体的制备[D].天津:天津科技大学ꎬ2016.[11]DongBꎬWangZꎬLiuYXꎬetal.ProkaryoticexpressionandpurificationofChlamydomonasreinhardtiiintraflagellartransportprotein70andpreparationofitspolyclonalantibody[J].ChinJBiolꎬ2017ꎬ30(9):924~930.董㊀彬ꎬ王㊀震ꎬ刘雁霞ꎬ等.莱茵衣藻纤毛内运送蛋白IFT70的原核表达㊁纯化及其多克隆抗体的制备[J].中国生物制品学杂志ꎬ2017ꎬ30(9):924~930.[12]MerchantSSꎬProchnikSEꎬVallonOꎬetal.TheChlamydomonasgenomerevealstheevolutionofkeyanimalandplantfunctions[J].Scienceꎬ2007ꎬ318(5848):245~250.[13]LiYꎬWangJꎬYangJꎬetal.RecombinantexpressionꎬpurificationandcharacterizationofantimicrobialpeptideORBKinEscherichiacoli[J].ProteinExpressionPurifꎬ2014ꎬ95(5):182~187.[14]BradfordMM.ARapidMethodforthequantitationofmicrogramquantitiesofproteinutilizingtheprincipleofprotein-dyebindingꎬAnal[J].Biochem.72ꎬ248~254.[15]陈格飞ꎬ张云龙ꎬ林森珠ꎬ等.蜘蛛HMW-gDNA的电洗脱纯化提取[J].动物学研究ꎬ2009ꎬ30(6):201~203.ChenGFꎬZhangYLꎬLinSZꎬetal.Extractionandelectroelutionofspiders HMW-gDNA[J].ZoolResꎬ2009ꎬ30(6):201~203.[16]HigginsRCꎬDahmusME.RapidvisualizationofproteinbandsinpreparativeSDS-polyacrylamidegels[J].AnalBio ̄chemꎬ1979ꎬ93(2):257~260.[17]HeLꎬSunY.Purificationoflysozymebymultistageaffinityfiltration[J].BioprocessbiosystEngꎬ2002ꎬ25(3):155~164. [18]董㊀彬ꎬ吴㊀松ꎬ王㊀晶ꎬ等.莱茵衣藻纤毛内运送蛋白IFT27的原核表达㊁纯化及多克隆抗体制备[J].生物技术ꎬ2016ꎬ26(6):532~538.DongBꎬWuSꎬWangJꎬetal.ProkaryoticexpressionꎬpurificationandpolyclonalantibodypreparationoftheChlamydomonasreinhardtiiintraflagellartransportprotein(IFT27)[J].Bioltechnolꎬ2016ꎬ26(6):532~538. [19]TianWꎬDongBꎬLiZFꎬetal.ProkaryoticexpressionꎬpurificationandpolyclonalantibodypreparationofChlamydo ̄monasreinhardtiiIFT139proteinantigen[J].TianjinUnivofSciTechnolꎬ2016ꎬ31(6):27~33.田㊀伟ꎬ董㊀彬ꎬ李镇芳ꎬ等.莱茵衣藻IFT139蛋白抗原的原核表达㊁纯化及多克隆抗体的制备[J].天津科技大学学报ꎬ2016ꎬ31(6):27~33.[20]WangZꎬDongBꎬFanZCꎬetal.ProkaryoticexpressionandpurificationofChlamydomonasreinhardtiiIFT25inEsche ̄richiacoliandpreparationofpolyclonalantibody[J].FoodSciBiotechnolꎬ2018ꎬ37(09):13~18.王㊀震ꎬ董㊀彬ꎬ樊振川ꎬ等.莱茵衣藻IFT25的原核表达㊁纯化及其多克隆抗体的制备[J].食品与生物技术学报ꎬ2018ꎬ37(09):13~18.Polyclonalantibody spreparationandapplicationinchlamydomonasreinhardtiiintraflagellartransportprotein80(IFT80)FENGLiꎬDINGMeiꎬXINGJun ̄qiaoꎬLILi ̄liꎬJIANGJun ̄long(CenterforGeneticsandBiotechnologyꎬInstituteforSystemsBiologyꎬJianghanUniversityꎬWuhan430056ꎬChina)Abstract:IFT80proteinisoneoftheimportantcomponentsofintraflagellartransport(IFT)complexinChlamydomonasrein ̄hardtiiꎬandthepolyclonalantibodywouldprovidesaneffectiveexperimentalmaterialforresearchingthemechanismofit.75Methods:TherecombinantexpressionvectorpGEX-4T-ift80wasconstructedandtransformedintoEscherichiacoli(E.coli)BL21.TherecombinantstrainexpressingIFT80proteinwasconstructedꎬandtheproteinwasinducedbyaddingIPTGattherighttimeꎬandthesupernatantofBL21lysateswithGST-IFT80waspurifiedbyL-Glutathioneabsorptioncolumn.Thepu ̄rifiedIFT80proteinwasusedasantigenforimmunitytoNewZealandwhiterabbitsꎬandtheserumwasisolatedandpurifiedbyimmunoaffinitycolumn.Results:Theantibodytiterwasdeterminedtobe512000byELISAandcanbeusedtodetectandidentifytheIFT80proteinofChlamydomonasreinhardtiipreciselybyWesternblot.Itwillbeofgreatsignificanceforthere ̄searchforthebiologicalfunctionofChlamydomonasreinhardtiiIFT80protein.Keywords:chlamydomonasreinhardtiiꎻciliaꎻIFT80ꎻpolyclonalantibodyꎻserumpurification85。
以莱茵衣藻为载体表达外源抗菌肽的研究

第42卷第3期2021年㊀5月水生态学杂志J o u r n a l o fH y d r o e c o l o g yV o l .42,N o .3M a y㊀2021D O I :10.15928/j.16743075.202003300080㊀㊀收稿日期:20200330㊀㊀修回日期:20210422基金项目:国家水体污染控制与治理重大科技专项(2017Z X 07203001);国家载人航天工程空间站任务空间应用项目(Y YWT 0801E X P 09).作者简介:赵艳苹,女,1995年5月生,硕士研究生,主要从事高效抗菌肽外源表达平台的构建及水污染控制方面的研究.E Gm a i l:2864499719@q q.c o m 通信作者:王高鸿.E Gm a i l :s pa c e @i hb .ac .c n 以莱茵衣藻为载体表达外源抗菌肽的研究赵艳苹1,2,李小燕1,彭婷婷1,黄开耀1,王高鸿1,2(1.中国科学院水生生物研究所藻类生物学重点实验室,武汉㊀430072;2.中国科学院大学,北京㊀100049)摘要:将黑水虻抗菌肽基因s a r c o t o x i n 3转入到莱茵衣藻细胞中,以期实现抗菌肽活性片段的大规模表达生产,为将来完成抗菌肽的临床测试及水产应用奠定实验基础.以质粒p H K 85为骨架,插入荧光素酶基因和黑水虻抗菌肽s a r c o t o x i n 3基因,用D N A 连接酶将质粒连接,构成抗菌肽质粒.抗菌肽质粒经克隆㊁提取㊁酶切线性化㊁衣藻玻璃珠转化㊁荧光素酶活性筛选和抑菌实验,结果表明:经过测序进一步确认质粒成功构建,碱基序列与所设计质粒序列一致,质粒浓度472.8n g /μL ㊁纯度(A 260/A 280)1.93,7d 后每个巴龙霉素平板长有单克隆约200个,大多数单克隆荧光素酶活力值可高达106,少数单克隆荧光值甚至可达108;藻株在26k D a 附近出现了特异信号,含有抗菌肽的蛋白对大肠杆菌D H 5α有一定的抑制作用.莱茵衣藻可以作为抗菌肽外源表达的一种载体,为抗菌肽的大量生产提供了一种可能.关键词:抗菌肽;莱茵衣藻;基因表达;载体中图分类号:Q 782,Q 786㊀㊀文献标志码:A㊀㊀文章编号:16743075(2021)03010608㊀㊀抗菌肽是一类广泛存在于自然界生物中的小分子多肽,一般由10~50个氨基酸组成.抗菌肽通过破坏细菌细胞膜的结构完整性,使细胞内外屏障丧失,从而杀死细菌(林文静,2014);作为生物体先天性免疫系统的一部分,还可以诱导生物体的免疫系统而发挥功能(刘书东等,2011);另外,抗菌肽还参与免疫调节,帮助伤口愈合,诱导细胞凋亡,抑制某些物质如促肾上腺皮质激素㊁蛋白激酶C 等的生物活性(卫银丹,2013).目前已发现来源于不同生物体的抗菌肽有2700多种(O r e n &S h a i ,1996;丁雪,2018).与传统抗生素相比,抗菌肽具有抗菌谱更广㊁活性更强㊁稳定性好㊁杀菌机制比较特殊及病原菌很难对其产生抗药性等优点,大大增加了其替代传统抗生素的可能性(王改玲等,2017;宫霞等,2005).抗菌肽在动植物细胞内表达含量很低,且动植物细胞生长周期长,分化慢,很难通过动植物来进行大量表达抗菌肽.如黑水虻(H e r m e t i a i l l u c e n s L )体内含有大量强抗菌作用的抗菌肽,以防止自身受病原体的侵袭,其中s a r c o t o x i n 3就是从黑水虻中分离的一种活性很强的抗菌肽(E l h a g e t a l ,2017),具有广阔的应用前景,但目前尚无很好的方法进行大规模生产.因此,寻找高效表达且能大规模生产的抗菌肽载体就成为抗菌肽广泛应用的关键.衣藻(C h l a m yd o m o n a s )具备完整的遗传转化系统,利用衣藻表达外源蛋白已经成为研究热点.黄亚萍(2019)在利用衣藻表达人表皮生长因子和C 反应蛋白时成功构建了一个双元表达载体,使得衣藻表达系统有了显著进步;刘芮均等(2018)研究了衣藻外源表达蛋白含量与衣藻基因组之间的关系,为提高衣藻表达蛋白含量提供了理论基础.莱茵衣藻(C h l a m y d o m o n a s r e i n h a r t i i )是一种真核绿藻,目前,其基因组已全部测序完成,并建立了分子遗传学研究技术与遗传分析系统和细胞核㊁线粒体㊁叶绿体3套遗传转化系统(G r o s s m a n ,2000).莱茵衣藻外源基因表达系统结合了细菌和高等植物的双重优势,具有生长快㊁生活周期短㊁成本低等特点;另外,与其他藻类不同,衣藻既能在光照下生长也能在黑暗条件下生长,并且能够将外界提供的碳源与光合成的碳源分开,是一种作为转基因生物反应器的良好材料.本研究通过将黑水虻抗菌肽基因s a r c o t o x i n 3转入到衣藻细胞中,通过基因和蛋白层面检测及体外抑菌试验等过程,进行逐步筛选,得到高效表达抗菌肽的藻株,并对其扩大培养,以期实现抗菌肽活性片段的大规模表达生产,建立抗菌肽体外表达的关键技术平台,为将来完成抗菌肽的临床测试及水产应用奠定实验基础.1㊀材料与方法1.1㊀实验材料莱茵衣藻C W 15株由本实验室保存,培养基为T A P 培养基,培养条件为25ħ,光强200μm o l /(m 2 s ).黑水虻抗菌肽s a r c o t o x i n 3基因序列由华中农业大学农业微生物学国家重点实验室张吉斌教授提供.1.2㊀实验方法1.2.1㊀构建抗菌肽质粒㊀以实验室原有的质粒pH K 85为骨架,用限制性内切酶N d e Ⅰ㊁E c o RⅤ㊁E c o RⅠ在对应的位点将p H K 85质粒切开,加入强启动子H S P 70R B C S 2,切除G F P 片段,插入荧光素酶(G a u s s i a l u c i f e r a s e )基因和黑水虻抗菌肽s a r Gc o t o x i n 3基因,最后用D N A 连接酶将质粒连接,构成抗菌肽质粒,如图1.图1㊀质粒构建F i g.1㊀P l a s m i d c o n s t r u c t i o n 1.2.2㊀质粒的克隆㊁提取㊁酶切线性化㊀将构建好的质粒转入大肠杆菌中,用L B 培养基无菌接种后置于摇床中37ħ㊁120r /m i n 扩大培养约16h .将上述培养物离心收集细胞,根据天根质粒小提试剂盒D P 10303的说明书提取质粒并测浓度.依据T h e r m o 公司的K p n Ⅰ限制酶说明书将提取的质粒进行线性化并测定线性化后质粒的浓度.配置1%的琼脂糖凝胶,对线性质粒进行电泳,依据诺唯赞产物纯化试剂盒D C 30101的说明书对8000b p 处的条带进行切胶回收,并对回收的线性质粒测定浓度.1.2.3㊀高活性衣藻细胞的培养㊀无菌接种衣藻,于25ħ㊁150μm o l /(m 2 s )光照㊁转速80r /m i n 下培养5~6d 时进入对数生长期,取此时期的藻液离心,去上清后用无菌T A P 培养基重悬细胞至密度为108个/m L .1.2.4㊀衣藻玻璃珠转化㊀取灭菌的直径为0.3mm的玻璃珠及1.5m L 离心管于无菌操作台.依次向离心管中加入适量玻璃珠㊁300μL 藻液㊁700n g ~1μg线性质粒,将涡旋仪速度调至最大,离心管在涡旋仪上涡旋15s ,停5s ,再涡旋15s (高翔,2016).吸取涡旋后的藻液到装有10m L 培养基的50m L 三角瓶中,置于摇床弱光修复18h 后离心收集藻细胞,涂布在含有10μg/m L 巴龙霉素的T A P 平板上,将平板放置在培养架上弱光培养(王亚丽,2015).约1周后平板上长出单克隆,用无菌吸头挑取单克隆到另一个T A P 平板上,并进行编号.1.2.5㊀荧光素酶活性筛选㊀使用P r o m e ga 公司的R e n i l l aL u c i f e r a s eA s s a y S y s t e m 试剂盒(T M 055)对衣藻进行荧光素酶活力测定.具体方法按试剂盒说明书.1.2.6㊀W e s t e r nb l o t 筛选㊀选取荧光素酶活力最强的50株单克隆进行W e s t e r nb l o t 筛选.培养待选单克隆藻株至对数期,离心收集藻细胞,提取衣藻蛋白.使用碧云天公司的B C A 蛋白浓度测定试剂盒P 0009对蛋白浓度进行测定.所有样品用1ˑP B S将浓度定量到50μg /μL ,然后加入5ˑ上样缓冲液沸水浴5m i n 对蛋白进行变性,存放在80ħ冰箱待用,上述所有过程均需在4ħ条件下操作.配置12%的S D S GP A G E 凝胶进行S D S GP A G E 凝胶电泳,先80V 电泳30m i n ,后120V 电泳2h .然后进行蛋白的转印,条件为250V 恒压转印60m i n ,取出P V D F 膜用丽春红染液染色观察是否成功转印并用记号笔标清孔道,最后用1ˑT B S T 溶液润洗膜3次,每次5m i n .将膜放入杂交袋,加入适量5%脱脂牛奶封闭液封闭1h ,1ˑT B S T 洗膜3次,每次10m i n .一抗选用T h e r m o 公司的P A 1181荧光素酶的商业化抗体,内参抗体选用S i g m a 公司的货号为T 6199的αGt u b l i n 抗体,根据说明书将抗体稀释,将膜放入杂交袋,加入5m L 一抗抗体稀释液反应1h ,1ˑT B S T 洗膜3次,每次10m i n .二抗选用S i g m a 公司的鼠二抗及兔二抗,操作同一抗.用M i l l i po r e 公司的E C L 发光液对结果进行显影(焦思恺,2017;李镇芳,2017;刘立闯,2008).1.2.7㊀抑菌实验㊀无菌接种野生型藻种及成功转入抗菌肽的藻种于10L 血清瓶内,通气培养至对数期,收集藻细胞提取蛋白.将蛋白依次用M i l l i p o r e 公司的50k D a 和3k D a 超滤管对蛋白进行浓缩纯化,并测定蛋白的最终浓度(马卫明,2004).无菌接种大肠杆菌D H 5α,置于摇床过夜培养7012021年第3期㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀赵艳苹等,以莱茵衣藻为载体表达外源抗菌肽的研究后用L B 培养基稀释至O D 600为0.2用于后续实验.采用测吸光度的方法测定抗菌肽对细菌生长的影响.取无菌1.5m L 离心管及96孔板若干,在无菌操作台内按每孔50μL 蛋白㊁10μL 菌液㊁140μL培养基的体系,其中阴性对照只加菌液和培养基,阳性对照添加野生型衣藻蛋白㊁菌液和培养基,实验组添加转抗菌肽衣藻蛋白㊁菌液及培养基,每组5个平行.先将所有成分在1.5m L 离心管内混匀,然后依次加到96孔板中,测定初始O D 600,然后将96孔板盖紧放置在37ħ培养箱中,24h 后测定O D 600.1.2.8㊀统计分析㊀采用S P S S8.01对数据进行统计分析.2㊀结果与分析2.1㊀载体构建经过酶切和连接,在原始质粒的基础上成功加入了H S P 70强启动子㊁G a u s s i a l u c i f e r a s e 基因以及目的抗菌肽s a r c o t o x i n 3基因,经过测序进一步确认质粒成功构建,碱基序列与所设计质粒序列一致,序列如下:801第42卷第3期㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀水生态学杂志㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀2021年5月2.2㊀质粒的克隆㊁提取㊁酶切线性化结果质粒克隆提取纯化后经超微量分光光度计测量浓度和纯度结果如表1,其中线性质粒的电泳图如图2.表1㊀各质粒浓度及纯度T a b .1㊀C o n c e n t r a t i o na n d p u r i t y of e a c h p l a s m i d 质粒名称质粒浓度/n g μL 1质粒纯度(A 260/A 280)s a r c o t o x i n 3+l u c i f e r a s e 1428.52.12s a r c o t o x i n 3+l u c i f e r a s e 线性质粒472.81.93图2㊀线性质粒电泳F i g .2㊀L i n e a r p l a s m i d e l e c t r o ph o r e s i s 2.3㊀转化结果由于载体中含有抗巴龙霉素的基因,只有转入载体的衣藻细胞能在巴龙霉素平板上存活,而未转入的衣藻细胞则不能在巴龙霉素平板上生长.大概7d 后,平板上长出了单克隆,每个平板有单克隆约200个,如图3.图3㊀巴龙霉素抗性筛选结果F i g .3㊀S c r e e n i n g r e s u l t s o f r e s i s t a n c e t ob a l a n o m yc i n 2.4㊀荧光素酶活性筛选结果挑取巴龙霉素平板上长出的700个单克隆进行荧光素酶活力的测定,结果如图4.大多数单克隆荧光素酶活力值可高达106,少数单克隆荧光值甚至可达108.图4㊀700个转化子荧光素酶活力F i g .4㊀L u c i f e r a s e a c t i v i t y of 700t r a n s f o r m a n t s 9012021年第3期㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀赵艳苹等,以莱茵衣藻为载体表达外源抗菌肽的研究2.5㊀W e s t e r nb l o t 筛选结果选取荧光素酶活力值达到107以上的6个单克隆进行W e s t e r n b l o t 筛选验证,在载体中,荧光素酶基因和抗菌肽基因结合在一起,共同受一个启动子的调控.只要表达了荧光素酶的转化子理论上也会表达抗菌肽,因此可通过判断单克隆藻株是否表达荧光素酶从而将表达抗菌肽的单克隆藻株筛选出来.W e s t e r nb l o t 结果如图5.荧光素酶蛋白大小为20.33k D a ,抗菌肽大小为5.47k D a ,2个蛋白一起约是25.8k D a ;内参基因t u b l i n 蛋白大小约为50k D a.经过和荧光素酶一抗和相应的二抗反应后,在内参t u b l i n 均有信号且信号强度近乎一致的情况下,编号为3231的藻株在26k D a 附近出现了特异信号,而野生型C W 15株及其他株均未有信号,表明3231株成功表达了抗菌肽蛋白.图5㊀荧光素酶信号及t u b l i n 信号F i g .5㊀L u c i f e r a s e s i g n a l a n d t u b l i n s i gn a l 2.6㊀抑菌试验结果蛋白经过50k D a 和3k D a 的超滤管处理,能将26k D a 左右的蛋白浓缩,从而将目的蛋白抗菌肽的浓度提高.蛋白加入到对应的菌液中后,通过测定菌细胞的生长曲线,判断蛋白对菌细胞生长产生的影响.实验结果表明,加入含有抗菌肽的蛋白(浓度为0.02m g /m L )对大肠杆菌D H 5α有一定的抑制作用,如图6.用S P S S 8.01对数据进行单因素方差分析,3个不同处理组对大肠杆菌的生长影响具有显著性差异(P <0.05).图6㊀蛋白对大肠杆菌D H 5ɑ生长的影响F i g.6㊀E f f e c t o f d i f f e r e n t p r o t e i n s o n t h e g r o w t h o f E .c o l i D H 5ɑ3㊀讨论目前常用于表达外源蛋白的反应器有酵母㊁大肠杆菌等(李荣荣等,2011;刘忠渊等,2003;孟兆丽等,2018;孙妍,2009;王改玲等,2017),这些微生物因转化效率低㊁无法表达结构复杂的蛋白等原因而在应用中受到限制(汪以真,2014).莱茵衣藻作为一种真核单细胞生物,具有叶绿体和线粒体2种细胞器,广泛存在于各种水体中,目前已经建立了分子遗传学研究技术与遗传分析系统和细胞核㊁线粒体㊁叶绿体3套遗传转化系统,其外源基因表达系统将细菌和高等植物的双重优势集于一体,素有 绿色酵母 之称,是一种用作转基因生物反应器的良好材料.在构建质粒的过程中,通常会选用一些抗性筛选基因以达到筛选的目的,如以B L E 基因为基础构建的含有对争光霉素家族有抗性的基因,它是一种以细菌耐药性基因为基础的标记基因(S t e v e n se t a l ,1996),巴龙霉素(S i z o v ae t a l ,2001)和潮霉素B (B e r t h o l d e t a l ,2002)抗性基因现在也普遍用于各种筛选中.随后,一些合成报告基因如绿色荧光蛋白基因和荧光素酶基因也用于转化子的筛选(F u h r Gm a n n e t a l ,1999),荧光素酶基因可以灵敏地反应启动子活性.R B C S 2启动子是源于莱茵衣藻的一种强启动子,其带有转录增强元件,可大大提高基因的表达效率.H S P 70是一个编码热休克蛋白的基因,可被热激和光照所诱导,热激后可明显提高外源蛋白的表达水平,与R B C S 2串联后仍能保持此特性(胡章立等,2005).本实验构建的载体在使用p S A D 启动子和终止子的情况下,加入H S P 70和R B C S 2串联的强启动子,确保目标蛋白能在衣藻中稳定表达;另外,报告基因使用荧光素酶和巴龙霉素基因,荧光素酶基因是一种常见的报告基因,最先由S h a o (2008)等将其应用到莱茵衣藻的转化系统中,因其遇到相应的底物后可发出荧光而测定方法简单,且目前已经开发了测定荧光素酶活力的试剂盒,测定过程更加方便快捷,因此受到了许多科研人员的青睐.另外现在也研发了针对荧光素酶的商业化抗体,为荧光素酶的体外表达提供了强有力的验证工具.为此,本研究选择在抗菌肽基因前加入1个荧光素酶基因,与已在衣藻转化筛选中广泛应用的巴龙霉素基因结合起来,大大方便了转化株的筛选且节约了成本,为衣011第42卷第3期㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀水生态学杂志㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀2021年5月藻表达系统的建立奠定了基础(S i z o v a e t a l,2001).将外源基因导入莱茵衣藻的方法有很多,如微粒轰击法㊁玻璃珠研磨法㊁电穿孔法㊁基因枪法和农杆菌感染法等.本研究选用细胞壁缺陷型的莱茵衣藻C W15,没有细胞壁的阻碍,外源基因能更容易地进入细胞,大大提高了转化效率(K i n d l e,1990).虽然有关衣藻外源表达蛋白的方法有很多,但是使用较多的只有基因枪法和电穿孔法,这2种方法都需要特定的仪器,且效率不高.刘佳等(2019)通过电穿孔法在莱茵衣藻中表达绿色荧光蛋白,不论是野生型衣藻还是细胞壁缺陷型衣藻,获得的单克隆数均较少,仅有几十个,基因枪法更多应用于衣藻叶绿体转化,效率也欠佳,而玻璃珠研磨法能获得数百个单克隆.本研究,通过玻璃珠转化,在1周的时间内经过巴龙霉素筛选便得到了较多数量的单克隆,表明玻璃珠转化可以很好地应用于衣藻外源表达中,同时使用荧光素酶基因作为报告基因,经试剂盒测定其活力,能够快速高效地将目标单克隆筛选出来.W e s t e r nb l o t技术是蛋白筛选的最常用技术,蛋白与对应的抗体结合后发生反应,遇到显影剂后能将反应结果呈现出来,而单纯的抗体遇到显影剂则不会有任何信号,因而W e s t e r nb l o t技术可以很好地将蛋白筛选出来,且准确性较高.抗菌肽最主要的生物活性便是抑制细菌的生长,其主要作用机制是通过在细菌细胞膜上形成跨膜的离子通道,破坏细胞膜的完整性,细胞内的内容物流出,从而将细胞杀死,因此,抗菌肽的抗菌谱很广(林文静,2014).通过抑菌试验可以很直观地呈现出抗菌肽的生物活性.本研究通过抑菌实验发现,在加入0.02m g/m L表达了黑水虻抗菌肽s a rGc o t o x i n3的蛋白后,对大肠杆菌D H5α便有较好的抑制作用,而对照组中细菌生长没有受到影响,可能是由于大肠杆菌D H5α是一种感受态细胞,对外界环境的刺激作用比较敏感,因而在如此低浓度蛋白情况下,依然能够对其生长产生明显的影响.总之,本研究利用衣藻为表达宿主,高效表达了外源抗菌肽蛋白,并且获得很好的抗菌活性,而且遗传转化方法简单方便㊁筛选方法高效便捷,这些都为莱茵衣藻表达抗菌肽提供了有力支撑,从而有望替代传统抗生素,也为抗菌肽在水产渔业养殖中疾病控制方面的应用奠定了基础.参考文献丁雪,2018.鱼鳞抗菌肽制备及抗菌包装应用研究[D].杭州:浙江工商大学:13.宫霞,乐国伟,李云飞,2005.家蝇幼虫抗菌肽的抗菌谱及其与抗生素的协同作用研究[J].微生物学报,45(4):516520.高翔,2016.m i R N A在衣藻应对三种胁迫环境过程中的作用研究[D].武汉:中国科学院水生生物研究所:5355.胡章立,王潮岗,吴锦霞,2005.增强型绿色荧光蛋白在莱茵衣藻中的高效表达[J].深圳特区科技,(00):217222.黄亚萍,2019.莱茵衣藻(C h l a m y d o m o n a sr e i n h a r d t i i)细胞核转化体系的构建及两种外源蛋白的表达研究[D].自贡:四川轻化工大学:10.焦思恺,2017.棉花幼苗叶片中谷胱甘肽转移酶响应盐胁迫的分析[D].郑州:郑州大学:2527.刘佳,何炫程,项晨,等,2019.一种高效的莱茵衣藻电转化方法[J].北京农学院学报,34(2):59.刘立闯,胡志和,刘彤,等,2008.螺旋藻蛋白提取方法比较研究[J].食品科学,29(11):228233.刘芮均,丁涛,彭丝伦,等,2018.莱茵衣藻外源基因整合特征分析[J].四川大学学报,55(3):655660.李荣荣,和祯泉,吕英军,等,2011.鸡源抗菌肽F o w l i c i d i n3表达条件的优化及生物学特性和体内疗效研究[J].南京农业大学学报,34(2):113118.刘书东,王娟娟,陈根元,等,2011.普通P C R与T DGP C R扩增叶尔羌高原鳅抗菌肽H e p c i d i n基因的比较[J].塔里木大学学报,23(4):4045.林文静,2014.斑马鱼h e p c i d i nG2抑菌活性的研究[D].青岛:中国海洋大学:13.李镇芳,2017.串联抗菌肽B a c t e r i o c i nL S2在莱茵衣藻中的表达,纯化及活性研究[D].天津:天津科技大学:59.刘忠渊,张富春,蔡伦,等,2003.酵母菌中表达的新疆家蚕抗菌肽(C e c r o p i nGX J)的特性研究[J].微生物学报,43(5):635641.马卫明,2004.猪小肠抗菌肽分离鉴定及其生物活性研究[D].北京:中国农业大学:4648.孟兆丽,丛丽娜,曾国洪,等,2018.枯草芽孢杆菌H SGA38高产抗菌肽突变株的筛选及其抑菌机理的研究[J].工业微生物,48(2):2328.孙妍,2009.抗菌肽C A P18的规模化表达及其表达产物的活性检测[D].哈尔滨:东北农业大学:36.王改玲,王明成,李传凤,等,2017.草鱼NKGl y s i n基因的克隆,原核表达与活性分析[J].水产学报,41(10):15001511.卫银丹,2013.组蛋白H2A衍生抗菌肽的重组表达及活性分析[D].太原:山西大学:6.1112021年第3期㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀赵艳苹等,以莱茵衣藻为载体表达外源抗菌肽的研究王亚丽,2015.小球藻C h l o r e l l av u l g a r i s转化系统的建立,淀粉形成突变体的筛选及初步分析[D].武汉:中国科学院水生生物研究所:1516.汪以真,2014.动物源抗菌肽的研究现状和展望[J].动物营养学报,26(10):29342941.B e r t h o l dP,S c h m i t tR,M a g e sW,2002.A ne n g i n e e r e dS t r e pGt o m y c e sh y g r o s c o p i c u s a p h7ᵡg e n e m e d i a t e sd o m i n a n t r e s i s t a n c e a g a i n s t h y g r o m y c i nB i nC h l a m y d o m o n a s r eGi n h a r d t i i[J].P r o t i s t,153(4):401412.E l h a g O,Z h o uD,S o n g Q,e t a l,2017.S c r e e n i n g,e x p r e s s i o n, p u r i f i c a t i o na n d f u n c t i o n a l c h a r a c t e r i z a t i o n o f n o v e l a n t iGm i c r o b i a l p e p t i d e g e n e s f r o m H e r m e t i a i l l u c e n s(L)[J].P l o SO n e,12(1):e0169582.F u h r m a n n M,O e r t e lW,H e g e m a n nP,1999.As y n t h e t i c g e n e c o d i n g f o r t h e g r e e n f l u o r e s c e n t p r o t e i n(G F P)i s a v e rGs a t i l er e p o r t e r i n C h l a m y d o m o n a sr e i n h a r d t i i[J].T h e P l a n t J o u r n a l,19(3):353361.G r o s s m a nA R,2000.C h l a m y d o m o n a s r e i n h a r d t i i a n d p h oGt o s y n t h e s i s:g e n e t i c st o g e n o m i c s[J].C u r r e n tO p i n i o n i nP l a n tB i o l o g y,3(2):132137.K i n d l eK L,1990.H i g hGf r e q u e n c y n u c l e a r t r a n s f o r m a t i o no fC h l a m y d o m o n a s r e i n h a r d t i i[J].P r o c e e d i n g so f t h eN aGt i o n a lA c a d e m y o f S c i e n c e s,87(3):12281232.O r e nZ,S h a iY,1996.Ac l a s so fh i g h l yp o t e n ta n t i b a c t e r i a l p e p t i d e s d e r i v e d f r o m p a r d a x i n,a p o r eGf o r m i n gp e p t i d e i s o l a t e d f r o m M o s e s s o l e f i s h P a r d a c h i r u sm a r m o r a t u s[J].E u r o p e a nJ o u r n a lo fB i o c h e m i s t r y,237(1):303310.S h a oN,B o c k R,2008.Ac o d o nGo p t i m i z e dl u c i f e r a s ef r o m G a u s s i a p r i n c e p sf a c i l i t a t e st h ei n v i v o m o n i t o r i n g o fg e n e e x p r e s s i o n i n t h em o d e l a l g a C h l a m y d o m o n a s r e i nGh a r d t i i[J].C u r r e n tG e n e t i c s,53(6):381388.S i z o v a I,F u h r m a n n M,H e g e m a n nP,2001.AS t r e p t o m y c e s r i m o s u s a p hV I I I g e n ec o d i n g f o ran e wt y p e p h o s p h oGt r a n s f e r a s e p r o v i d e s s t a b l e a n t i b i o t i c r e s i s t a n c e t o C h l a m y d o m o n a s r e i n h a r d t i i[J].G e n e,277(1/2):221229.S t e v e n sDR,P u r t o nS,R o c h a i x JD,1996.T h e b a c t e r i a l p h l eGo m y c i n r e s i s t a n c e g e n e b l e a s a d o m i n a n t s e l e c t a b l e m a r k e r i n C h l a m y d o m o n a s[J].M o l e c u l a ra n d G e n e r a l G e n e t i c sMG G,251(1):2330.(责任编辑㊀张俊友)211第42卷第3期㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀水生态学杂志㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀2021年5月E x p r e s s i o no fE x o g e n o u sA n t i m i c r o b i a l P e pt i d e s i n C h l a m y d o m o n a s r e i n h a r d t i i Z H A O Y a n Gp i n g 1,2,L IX i a o Gy a n 1,P E N G T i n g Gt i n g 1,HU A N G K a i Gy a o 1,WA N G G a o Gh o n g1,2(1.K e y L a b o r a t o r y o fA l g a l B i o l o g y ,I n s t i t u t e o fH y d r o b i o l o g y ,C h i n e s eA c a d e m yo f S c i e n c e s ,W u h a n ㊀430072,P .R.C h i n a ;2.U n i v e r s i t y o fC h i n e s eA c a d e m y o f S c i e n c e s ,B e i j i n g㊀100049,P .R.C h i n a )A b s t r a c t :A n t i m i c r o b i a l p e p t i d e s a r e s m a l l p e p t i d e s f o u n dw i d e l y di s t r i b u t e d i nn a t u r e .A s p a r t o f t h e i n Gn a t e i mm u n e s y s t e m ,t h e y p r o v i d e t h e f i r s t l i n e o f d e f e n s e a g a i n s t p a t h o g e n s .W h i l e a n t i m i c r o b i a l p e pt i d e s h a v e e x c e l l e n t p o t e n t i a l a s a n a n t i b i o t i c ,s c a l i n g u p p r o d u c t i o nh a s l i m i t e d a p p l i c a t i o n .C h l a m y d o m o n a s r e Gi n h a r d t i i ,k n o w n a s t h e g r e e n y e a s t ,i s a s i n g l e Gc e l l e d e u k a r y o t i c g r e e n a l ga e a n d a g o o db i o r e ac t o r t h a t i n t e g r a t e sm u l t i p l ead v a n t a ge s .I nt h i ss t u d y ,w et r a n sf e r r e dt h ea n t i b a c t e r i a l p e p t i d eg e n e s a r c o t o x i n 3f r o m H e r m e t i a i l l u c e n s i n t o C .r e i nh a r d ti i c e l l s t o r e a l i z e l a r g e Gs c a l e e x pr e s s i o na n d p r o d u c t i o no f a c t i v e a n t i b a c t e r i a l p e p t i d e f r a g m e n t s .T h e o b j e c t i v ew a s t o l a y a n e x p e r i m e n t a l f o u n d a t i o n f o r c o m pl e t i o n o f c l i n Gi c a l t e s t i n g a n d f u t u r e a q u a t i c p r o d u c t i o n o f a n t i b a c t e r i a l p e p t i d e s .U s i n g p l a s m i d p H K 85a s t h e l a t t i c e ,t h e g e n e s f o r l u c i f e r a s e g e n ea n d H e r m e t i a i l l u c e n s p e p t i d e s a r c o t o x i n 3w e r e i n s e r t e di n t ot h e p l a s m i d ,a n d D N Al i g a s ew a s u s e d t o l i g a t e t h e p l a s m i d t o f o r mt h e a n t i m i c r o b i a l p e p t i d e .T h e C .r e i n h a r d t i i p l a s m i d w a s c l o n e d o n g l a s s b e a d s a n d t h e a n t i m i c r o b i a l p e p t i d e p r o d u c e dw a s t h e n e x t r a c t e d a n d l i n e a r i z e du s i n g ar e s t r i c t i o n e n z y m e .F i n a l l y ,l u c i f e r a s ea c t i v i t y w a ss c r e e n e da n dt h ea n t i b a c t e r i a l a c t i v i t y w a s t e s t e d .S e Gq u e n c i n g w a s u s e d t o f u r t h e r c o n f i r mt h a t t h e p l a s m i dw a s s u c c e s s f u l l y c o n s t r u c t e d a n d t h e b a s e s e qu e n c e w a s c o n s i s t e n tw i t h t h a t o f t h e d e s i g n e d p l a s m i d s e q u e n c e .T h e p l a s m i d c o n c e n t r a t i o nw a s 472.8n g /μLa n d t h e p u r i t y (A 260/A 280)w a s 1.93.A f t e r 7d a y s ,e a c h p a r o m o m y c i n p l a t eh a da b o u t 200s i n g l e c l o n e s .T h e f l u o r e s c e n c e o f t h em o n o c l o n a l l u c i f e r a s ew a s a sh i g ha s106a n d ,i na f e wc a s e s ,r e a c h e d108.T h ea l g a e s t r a i n s h o w e d a s p e c i f i c s i g n a l n e a r 26k D a ,a n d t h e p r o t e i n c o n t a i n i n g a n t i b a c t e r i a l p e pt i d e s h a d a n i n h i b i Gt o r y e f f e c t o n E .c o l i D H 5α.O u r r e s u l t s s h o wt h a t C .r e i n h a r d t i i c a nb eu s e da s a c a r r i e r f o r t h e e x o ge Gn o u s e x p r e s s i o no fa n t i m i c r o b i a l p e p t i d e s ,p r o v i d i n g a p o s s i b l e m e a n sf o r m a s s p r o d u c i ng a n t i m i c r o b i a l p e pt i d e s .K e y wo r d s :a n t i m i c r o b i a l p e p t i d e ;C h l a m y d o m o n a s r e i n h a r d t i i ;g e n e e x p r e s s i o n ;c a r r i e r 3112021年第3期㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀赵艳苹等,以莱茵衣藻为载体表达外源抗菌肽的研究。
【高中生物】德科学家发现植物吃植物现象

【高中生物】德科学家发现植物吃植物现象一种动物捕食另一种动物是我们熟知的自然界现象,那植物吃植物呢?德国科学家的最新研究显示,一种绿藻就有“吃掉”其他植物的本领。
这一发现或可为人类更好地利用生物能源开拓新途径。
一般认为,只有蠕虫、细菌和真菌才能消化植物中的纤维素,并将其用作生长和生存的碳源,而植物则通过二氧化碳、水和阳光进行光合作用。
德国比勒菲尔德大学的研究人员于11月20日在《自然通讯》杂志上发表了他们的研究结果。
当他们观察到一种名为莱茵衣藻(Chlamydomonas reinhardtii)的绿藻时,他们发现这种单细胞生物不仅可以像普通植物一样进行光合作用,还可以清除其他植物作为自身能源的纤维素。
实验中,研究人员将“莱氏衣藻”放入一个低碳环境中观察,结果发现,莱氏衣藻会从周边的植物纤维素中获取能源,在这一过程中,它可释放出“消化”纤维素的酶,将纤维素这种大分子多糖物质分解为更小的糖,后者最终被运送至细胞内,转化为能量源。
也就是说,“莱氏衣藻”在低碳环境中同样可以继续生长。
奥拉夫谁参与了这项研究?克鲁兹教授说,这一现象首次在植物中发现,藻类本身可以消化纤维素的事实与“在某种程度上,它是植物吃植物”的传统理解相反。
目前,研究人员正观察这一机制在其他藻类中是否同样适用。
研究人员认为,新发现或有助未来更好地利用生物能。
目前,人们通常采用植物和真菌纤维素酶同时加热的方法来获取生物柴油等生物能源,而饲养这些真菌还需要一些有机物质。
研究人员设想,如果藻类可以被水、阳光和二氧化碳喂养,然后从中获得纤维素分解酶,那么未来生产生物燃料将更容易。
一种莱茵衣藻启动子功能检测系统的构建

一种莱茵衣藻启动子功能检测系统的构建王潮岗;黄惠珠;孙海珊;胡章立;雷安平【摘要】选用莱茵衣藻(Chlamydomonas reinhardtii)作为检测微藻启动子功能的生物系统,以pSP124质粒为基础,雨生红球藻β -胡萝卜素酮化酶基因bktl的启动子片段(450 base pair,记作450 bp)为间隔序列,引入两个Eam 1105 Ⅰ限制性内切酶位点,构建莱茵衣藻启动子功能检测T载体.将聚合酶链式反应(polymerase chain reaction,PCR)获得的1 986 bp的bkt1启动子片段直接克隆到T载体上,通过“珠磨法”转化到莱茵衣藻CC-849中,经Zeomycin筛选获得了TranB-0.45和TranBle转基因藻,而1 986 bp的bkt1启动子无转化子,原因可能是其含有负调控元件.PCR结果显示,ble可稳定存在于转基因藻中,bkt1启动子的450bp片段具有启动子活性,能正确表达BLE蛋白.该研究表明,莱茵衣藻和pB-0.45T载体所组成的检测系统可用于藻类启动子研究,为启动子功能的研究提供了一条新途径.%Chlamydomonas reinhardtii was employed as a bio-system for analyzing the function of algal promoter in this study. The C. reinhardtii T-vector based on pSP124 plasmid was constructed using 450 bp sequences of β-carotene ketolase gene ( bktl) promoter as insert fragment. Two Eaml 105 Ⅰ restriction sites were introduced into this T-vector. 1 986 bp sequences of bktl promoter was obtained by PCR and cloned into the C. reinhardtii T-vector directly. By "glass-bead method" , transformants of Tran and Tran Ble were generated from TAP c ontaining 10 (μg/mL Zeomycin. However, none of Tran B-2 were observed due to some negative regulatory elements in 1 986 hp-bkt 1 promoter. Results of PCR confirmed that ble was integrated into the genome DNA of C. reinhardtii .The 450 bp sequences of bktl promoter were able to express BLE in transgenic algae, which verified that it owned promoter ability in C. reinhardtii. These results indicate that the C. reinhardtii and pB-0. 45T system for analyzing promoter function is workable. It is a new way for studying algal promoters.【期刊名称】《深圳大学学报(理工版)》【年(卷),期】2012(029)006【总页数】7页(P534-540)【关键词】基因工程;T载体;莱茵衣藻;启动子功能;检测系统;珠磨法;克隆【作者】王潮岗;黄惠珠;孙海珊;胡章立;雷安平【作者单位】深圳大学生命科学学院,深圳市海洋生物资源与生态环境重点实验室,深圳518060;深圳大学生命科学学院,深圳市海洋生物资源与生态环境重点实验室,深圳518060;深圳大学生命科学学院,深圳市海洋生物资源与生态环境重点实验室,深圳518060;深圳大学生命科学学院,深圳市海洋生物资源与生态环境重点实验室,深圳518060;深圳大学生命科学学院,深圳市海洋生物资源与生态环境重点实验室,深圳518060【正文语种】中文【中图分类】Q782莱茵衣藻(Chlamydomonas reinhardtii)是单细胞、带鞭毛的真核光合生物,因具有培养简单、生长周期短、光合效率高和遗传转化技术成熟等优点,广泛用于生物学基础研究[1-2].它可以在细胞中表达各种异源蛋白,如荧光素酶[3]和SEC2蛋白[4]等;也可用于启动子功能的研究,如在莱茵衣藻中进行了 Rbcs2 启动子[5]和 Hsp 70A 启动子[6]功能的研究.但微藻启动子功能研究进展依然缓慢.究其原因,与未建立便捷、有效的研究系统直接相关.目前,研究微藻启动子功能的手段包括缺失突变和点突变等,它们都需要合适的T 载体辅助.缺乏商业化的微藻克隆、表达T载体,阻碍了微藻功能基因和相关启动子功能的研究.T载体一般包括克隆T载体和表达型T载体,一般通过平末端加T法和内切酶法获得[7-8].T载体末端带有突出的T碱基,可直接与Taq酶扩增产物末端突出的A碱基配对,提高了聚合酶链式反应 (polymerase chain reaction,PCR)产物与载体的连接效率,促进对基因克隆与表达的研究[9].然而,国内藻类启动子的研究主要集中在与光合作用、固氮作用相关基因的启动子上[10],如 Rubisco 启动子[11-12]和 cpc 启动子[13-14]等,可检测藻类启动子功能的T载体鲜有报道.笔者认为,通过PCR获得启动子5'或3'端缺失片段,连接到T载体,转化到成熟的表达系统,再通过筛选基因或报告基因分析启动子功能,可实现对其快速检测.莱茵衣藻作为研究真核微藻的模式生物,因其清晰的遗传背景和成熟的遗传转化体系,具有开发成微藻启动子功能检测系统的潜力.本研究尝试构建莱茵衣藻启动子功能检测T载体,并将PCR获得的雨生红球藻β-胡萝卜素酮化酶基因bkt1启动子[15]片段直接克隆到T载体上,在莱茵衣藻中验证启动子的功能,构建了一种新的检测微藻启动子功能的方法,为研究微藻启动子开辟了新的途径.1 材料与方法1.1 质粒、菌株与衣藻质粒091127-a3由本实验室筛选雨生红球藻基因组文库所得,测序分析发现其含有bkt1上游调控序列.质粒pSP124由英国伦敦大学Saul Purton教授惠赠,携带ble基因 (使宿主细胞获得腐草霉素和Zeomycin抗性)、Rbcs2启动子和终止子.载体pMD18-T购自Takara Biotechnology(大连)有限公司.大肠杆菌(Escherichia coli,E.coli)菌株XL1由本实验室保存.莱茵衣藻CC-849由美国杜克大学Chlamydomonas Genetic Center提供,培养在Tris-acetate-phosphate(TAP)培养基中.1.2 试剂和仪器质粒提取试剂盒、DNA片段纯化试剂盒和LA Taq酶 (含 dNTP、Taq酶和缓冲液)等均购自Takara Biotechnology(大连)有限公司;丙烯酰胺和TEMED等电泳试剂均购于Bio-Rad公司;十二烷基硫酸钠 (sodium dodecyl sulfate,SDS)、Tris碱和EDTA等购自生工生物工程 (上海)股份有限公司.以上试剂均为分析纯.实验所用PCR仪为MJ-Research公司的PTC-100;冷冻高速离心机为Eppendorf 公司的Centrifuge 5804 R;杂交箱为HL-2000 HybriLinker.1.3 引物设计根据091127-a3质粒上bkt1的上游调控序列设计引物pB-bkt4和pB-bkt5;根据pSP124质粒上的ble设计引物pBle1和pBle2;根据bkt1上游调控序列设计引物pcrto1、pcrto2、pB-bkt7和pB-bkt8,引物pB-bkt7和pB-bkt8引入了Eam 1105Ⅰ、EcoRⅤ和BamHⅠ位点;根据ble序列设计引物PrBle1和PrBle2,具体见表1.1.4 莱茵衣藻启动子功能检测T载体的构建pB124载体的构建.以pBle1和pBle2为引物,通过PCR从质粒pSP124中扩增出大小为970碱基对 (base pair,bp)的ble-3'-Rbcs2终止子 (扩增条件为94℃变性3 min;94℃反应1 min,58℃反应1 min,72℃反应1 min,25个循环;72℃ 延伸10 min),克隆到pMD 18-T载体中,获得T-p124质粒.通过EcoRⅤ和KpnⅠ双酶切质粒T-p124获得ble-3'-Rbcs2终止子,将其插入pSP124载体的EcoRⅤ和KpnⅠ位点,获得pB124载体.表1 引物列表Table 1 List of primer sets/bp pB-bkt4 5'-GGGCCGCGTCTGACTCTTCTGA-3'pB-bkt5 5'-TACTAGCTGCAGTCGGTTGTTATCC-3'引物引物序列扩增产物长度bkt1启动子序列3 735 pcrto1 5'-GTTGGATCCGGCACAGTAGTG-3'pcrto2 5'-CAAGATATCTCGTCTAGCTGTGC-3'bkt1启动子序列1 986 pBle1 5'-GTAGATATCATGGCCAGGTG-3'pBle2 5'-GCGGGTACCTTAATTAAGCTTC-3'ble和3'Rbcs2序列970 pB-bkt7 5'-GTTGGATCCG ACTTTACGTCTACTAGCTGCAGTCGGTTG-3'pB-bkt8 5'-CAAGATATC GACGCTTCGTCTCGTCTAGCTGTGCTATG-3'bkt1启动子序列2 276 PrBle1 5'-GGCCAAGCTGACCAGCGCCGTTC-3'PrBle2 5'-CTCCCGCCCCCACGGCTGCTC-3'检测转基因藻的ble基因片段464 Act-1 5'-GCGGAGTCGGAGGTTAGGT-3'Act-1 5'-GGCGGCGATGTTTAGATG-3'检测转基因藻的β-actin基因片段852pB载体的构建.通过Eam1105Ⅰ酶切pB124载体,获得线性载体,再经T4 DNA Polymerase使载体末端平滑化,突变原有的Eam1105Ⅰ位点,通过T4连接酶连接载体,获得pB载体.pB-0.45T载体的构建.以pB-bkt4和pB-bkt5为引物,从091127-a3中扩增出3 735 bp的bkt1上游调控序列,克隆到pMD 18-T载体获得T-5'bkt.以pB-bkt9和pB-bkt10为引物,通过PCR从质粒T-5'bkt中扩增出450 bp的启动子序列,获得引入Eam1105Ⅰ、EcoRⅤ和BamHⅠ位点的启动子序列,命名为5'bkt1-0.45.通过EcoRⅤ和BamHⅠ双酶切5'bkt1-0.45,将其插入pB载体的EcoRⅤ和BamHⅠ位点,最后获得pB-0.45T载体,见图1.1.5 启动子序列的T克隆T载体的制备.采用Eam1105Ⅰ 双酶切 pB-0.45T载体,于37℃反应1 h,酶切产物经琼脂糖凝胶 (琼脂糖质量浓度为10 g/L)电泳分离,回收的大片段即为T载体,经DNA片段纯化试剂盒纯化后可直接应用于PCR片段的T克隆.图1 pB-0.45T检测T载体的构建Fig.1 Construction of pB-0.45T启动子片段的T克隆.利用引物pcrto1和pcrto2,从质粒091127-a3中扩增出长度为1 986 bp的bkt1启动子片段,与T载体混匀,T4连接酶连接后转化到感受态大肠杆菌XL1细胞中,经氨苄抗生素筛选可获得转化子,经T3和T7引物测序验证 (深圳华大基因研究院),命名为pB-2T.1.6 莱茵衣藻的遗传转化莱茵衣藻遗传转化采用“珠磨法”[16].诱导时,加入3 mol/L的NaAC至终浓度为45 mmol/L.单个细胞遗传转化效率计算公式为1.7 衣藻基因组DNA提取微藻总DNA提取参照文献[16]的方法,如采用Qiagen®公司的Puregene Tissue Core Kit A提取微藻总DNA,则所有操作按产品说明书进行.1.8 转基因衣藻的DNA-PCR检测以提取的莱茵衣藻基因组DNA为模板,进行PCR扩增检测.使用特异性引物PrBle1和PrBle2扩增ble基因片段 (464 bp),Act1和Act2扩增βactin基因片段 (852 bp).PCR反应条件为:94℃变性5 min;94℃反应1 min,58℃反应90 s,72℃反应90 s,30个循环;72℃延伸10 min.1.9 转基因衣藻的Western杂交将培养至对数生长期后期的藻细胞进行处理,取藻液25 mL,于4℃,5 000r/min离心3 min,弃上清;加入1 mL PBS重悬藻细胞,小心加入0.5 mL玻璃珠(Biospec 11079105),加盖,冰上放置5 min;使用机械破碎机 (Mini-Beadbeater,Biospec)进行破碎,每次以最大速度破碎25 s,冰浴1 min,重复5次;然后,于4℃,12 000 r/min离心20 min,小心收集上清,上清即为藻细胞总蛋白.微藻总蛋白经聚丙烯酰胺凝胶电泳 (SDS-polyacrylamide gel electrophoresis,SDS-PAGE)分离后,通过半干式电转仪 (Trans-Blot SD,Bio-Rad,美国)转移到硝酸纤维膜 (Hybond C-super,Amersham)上.显色根据产品说明书进行操作(BCIP/NBT,aMRESCO®099OC099,美国).BLE多克隆抗体购自法国Invivogen公司,内参使用鼠抗β-Tubulin单抗 (EarthOx),作为二抗的羊抗兔IgG和羊抗鼠IgG购自Proteintech公司.2 结果与分析2.1 莱茵衣藻启动子功能检测T载体的构建其构建思路为:首先,利用PCR和酶切技术去除pSP124载体上的Rbcs2启动子;其次,利用T4 DNAPolymerasep突变启动子上面的一个Eam1105Ⅰ位点,以bkt1启动子的450 bp序列为间隔序列,并通过PCR引入了两个Eam1105Ⅰ位点,它的识别序列是5'-GACTTTACGTC-3',从3'第5个碱基开始水解,因此Eam1105Ⅰ双酶切恰好在5'末端获得两个突出的T碱基,可与PCR产物3'末端突出的A碱基互补;最后,经过T4连接酶的连接即可将PCR产物直接连到载体上,形成完整的ble表达框,在莱茵衣藻中表达BLE蛋白 (使宿主细胞获得腐草霉素和Zeomycin抗性),并通过Zeomycin筛选出转基因藻,见图2.图2 pB-0.45T的T载体示意图Fig.2 Diagram-0.45TpB-0.45T载体的鉴定.因 pB-0.45T载体由5'bkt1序列插入pB载体的BamHⅠ和EcoRⅤ位点得到,所以,它以450 bp的5'bkt1序列为间隔序列.采用引物pB-bkt9和pB-bkt10,可从pB-0.45T载体中扩增出450 bp的目的条带 (图3),表明pB-0.45T载体含有450 bp的5'bkt1.通过Eam1105Ⅰ双酶切pB-0.45T,得到长度为450 bp和约3 000 bp的片段,通过EcoRⅤ和KpnⅠ双酶切得到970 bp和约 3 000 bp的片段 (图4),表明 450 bp的5'bkt1序列是正向插入pB载体的.以上验证与pB-0.45T载体的构建吻合,表明已成功引入了两个Eam1105Ⅰ限制性酶切位点,由450 bp的bkt1启动子、ble和Rbcs2终止子组成了完整的ble表达框(图2),莱茵衣藻外源启动子功能检测T载体已构建成功.图3 pB-0.45T的PCR鉴定Fig.3 PCR analysis of pB-0.45TM为DL 2000 Marker;1为阴性对照 (H2O);2为阳性对照 (T-5'bkt);3为pB-0.45T的PCR产物图4 pB-0.45T的酶切鉴定Fig.4 Digesting pB-0.45T with restrictive enzymeM 为DL 2000 Marker;1和2为质粒pB-0.45T经Eam1105Ⅰ酶切;3和4为质粒pB-0.45T经EcoRⅤ和KpnⅠ酶切2.2 启动子序列的T克隆pB-0.45T属于穿梭载体,具有氨苄青霉素抗性,可转化到大肠杆菌中筛选重组子.同时,为方便于启动子活性分析,引入两个Eam1105Ⅰ位点来构建T载体,通过Eam1105Ⅰ酶解获得插入PCR产物的T克隆位点 (图2).本研究通过PCR获得bkt1启动子 (1 986 bp)的5'缺陷序列,插入pB-0.45T载体的T克隆位点.PCR结果显示,1 986 bp的bkt1启动子序列已成功插入pB-0.45T中,pB-2T检测载体已构建成功,见图5.2.3 转基因藻的获得通过“珠磨法”将pB-0.45T和pB-2T检测载体转化入细胞壁缺陷的莱茵衣藻CC-849中,获得的转基因衣藻分别命名为TranB-0.45和TranB-2.同时建立一个阳性对照,将质粒pSP124转化进入莱茵衣藻CC-849中,获得的转基因衣藻命名为TranBle.遗传转化结果显示:TranB-0.45未加醋酸钠时得不到转化子,加入后则单个细胞遗传转化效率提高到1.67×10-8,与 TranBle的转化效率接近,而TranBle上使用的Rbcs2启动子是莱茵衣藻转化效果最好的启动子之一,表明bkt1启动子的450 bp序列也可以用于莱茵衣藻转化.TranB-2未能获得转化子,可能是该启动子片段含有抑制外源基因整合的调控元件.各转基因藻遗传转化结果见表2.图5 pB-2T载体的PCR鉴定Fig.5 PCR analysis of pB-2TM为DL 2000 Marker;1为阴性对照 (H2O);2~4为pB-2T的PCR产物表2 转基因藻的遗传转化效率Table 2 Transformation frequency of transgenic algae/%TranB-0.45 0 1.67×10-8转基因藻不加NaAC诱导加入NaAC诱导PCR阳性率100 TranB-2 0 0 0 TranBle 5×10-8 6.7×10-8100 2.4 转基因藻的DNA-PCR鉴定提取转基因衣藻TranB-0.45、TranBle和莱茵衣藻CC-849的基因组DNA,利用PrBle1、PrBle2引物对和Act1、Act2引物对检测转基因藻.结果显示,转基因藻TranB-0.45和TranBle均能扩增出464 bp的ble片段和852 bp的β-actin基因片段,与阳性对照结果一致.转基因藻均在TAP平板 (含10 μg/mL Zeomycin)上培养,经多次传代后再提取基因组DNA,PCR仍可扩增出ble片段(图6),证明ble已经整合到莱茵衣藻基因组中,并可稳定传代.2.5 各插入片段的启动子功能分析离心收集培养至对数后期的转基因衣藻TranB-0.45和TranBle,提取其总蛋白,BLE抗体杂交,以检测转基因藻中BLE的表达情况.其中,TranBle为阳性对照,莱茵衣藻CC-849为阴性对照.结果显示,转基因衣藻TranB-0.45能正确表达BLE 蛋白,在13.6 kD处显示清晰的杂交印迹,与阳性对照一致,表明450 bp的bkt1启动子片段可以正确表达BLE蛋白,具有启动子活性 (图7).以上结果表明,莱茵衣藻及本研究所构建的启动子功能检测T载体所组成的检测系统是有效的.图6 转基因衣藻的PCR检测Fig.6 PCR analysis of transgenic algaeM为DL-2000 Marker;1为阴性对照 (H2O);2为阳性对照 (pSP124);3为TranBlePCR扩增产物;4为TranB-0.45PCR扩增产物图7 BLE蛋白在转基因衣藻中的表达Fig.7 Expression of BLE in transgenic algaeM为蛋白marker(PageRulerTMPrestained Protein Ladder);1为阴性对照(CC-849);2:阳性对照 (TranBle);3和4为TranB-0.45总蛋白的杂交结果3 讨论T载体是一种方便、高效的克隆载体,是基因工程领域重要的研究工具.它可直接将PCR产物连接到载体上,通过测序获得序列信息,也可直接用于目的基因的表达研究[17].目前,已有许多商业化的克隆T载体,如pMD 18-T(Takara),表达型的T载体则还不太成熟,仅有少数公司提供,如pTARGET载体 (Promega)和pGW-T载体 (Qiagem).可用于启动子功能检测的载体已有研究,但未见任何商业性的T载体,很多实验仍通过常规的PCR扩增、克隆和酶切连接到特定的载体上,转化到宿主细胞后再进行检测,该方法工作量大、效率低,用于研究微藻启动子就更困难了.因缺少针对微藻研究的商业化T载体,大大阻碍了微藻基因工程的研究.因此,建立一个拥有表达型T载体的微藻启动子功能研究系统具有重要科学价值.通过限制性内切酶获得可克隆PCR片段的T克隆位点,该方法具有方便、稳定的优点,是设计T载体的先进手段[18].利用XcmⅠ双酶切获得的T载体具有高效、低背景的优点[17].同样,利用Eam1105Ⅰ双酶切获得T载体的技术可以满足高通量克隆和表达基因的需要[19].本研究采用Eam1105Ⅰ双酶切获得的T载体效率高,根据TA克隆的原理,插入的外源启动子序列与ble、Rbcs2终止子组成完整的ble表达框.但是,T克隆载体也有弱点,太长的片段不易被直接克隆,而启动子由于具有复杂的功能,序列有时会非常长,因此,pB-0.45T载体上还设计了BamHⅠ和EcoRⅤ限制性内切酶位点,可以满足大多数启动子的克隆与功能研究.如插入的启动子片段具有活性,正确表达BLE蛋白,则转基因衣藻细胞因具有Zeomycin抗性而被筛选出来;如不能表达BLE蛋白则不能获得转化子.由于莱茵衣藻对Zeomycin非常敏感,本研究未检测到假阳性.研究表明,450 bp的bkt1启动子具有与莱茵衣藻Rbcs2启动子同样能力,在莱茵衣藻中表达异源蛋白.pB-0.45T载体和莱茵衣藻适合作为微藻启动子功能研究的有效平台,有望推动微藻启动子功能研究.参考文献/References:[1]Harris E H.The Chlamydomonas Source Book:A Comprehensive Guide to Biology and Laboratory Use[M].SanDiego(USA):Academic Press,1989.[2]WANG Chao-gang,HU Zhang-li.The research advance in nuclear transformation system of Chlamydomonas reinhardtii[J].Journal of Zhongkai University of Agriculture and Technology,2005,18(2):59-64.(in Chinese)王潮岗,胡章立.莱茵衣藻细胞核转化系统研究进展[J].仲恺农业技术学院学报,2005,18(2):59-64.[3]Ning Shao,Ralph Bock.A codon-optimaized luciferase from Gaussia princeps facilitates the in vivo monitoring of gene expression in the modelalga Chalmymononas reinhardtii[J].Current Genetics,2008,53:381-388.[4]LI Jian-cheng,PENG Shi-qing,HU Zhang-li.Expression and immunologicalactivity of enterotoxin C2 from Staphylococcusaureus in Chlamydomonasreinhardtii[J].Journal of Shenzhen University Science and Engineering,2012,29(2):159-164.(in Chinese)李建成,彭世清,胡章立.SEC2在莱茵衣藻中表达及免疫学活性分析[J].深圳大学学报理工版,2012,29(2):159-164.[5]Stevens D R,Rochaix J D,Purton S.The bacterial phleomycin resistance gene ble as a dominant selectable marker in Chlamydomonas [J].Molecular Genetics and Genomics,1996,251(1):23-30.[6]Lumbreras V,Stevens D,Purton S.Efficient foreign gene expression in Chlamydomonas reinhardtii mediated by an endogenous intron [J].The Plant Journal,1998,14(4):441-448.[7]HUANG Wen-jun,WANG Ying.Construction of the high efficiency and low background T vector[J].China Biotechnology,2010,30(12):60-65.(in Chinese)黄文俊,王瑛.一种高效低背景T载体的构建[J].中国生物工程杂志,2010,30(12):60-65.[8]LIN Chen-shui,WU Sheng-wei,YANG Dan-yan.Development of T vectors[J].Journal of Zhejiang University of Technology,2009,37(6):623-628.(in Chinese)林陈水,武胜伟,杨丹燕.T载体研究进展[J].浙江工业大学学报,2009,37(6):623-628.[9]QI Xiang-hui,CHEN Hui,SHEN Qi,et al.Simple construction method of a new T-vector and its application[J].Biotechnology Bulletin,2011(3):163-174.(in Chinese)齐向辉,陈辉,沈琦,等.一种构建新型T载体的简便方法及应用[J].生物技术通报,2011(3):163-174.[10]ZHANG Xue-cheng,GUO Nan,SONG Xiao-jin.Research progress on structure and function of algal promoters[J].Periodical of Ocean University of China,2008,38(3):404-412.(in Chinese)张学成,郭楠,宋晓金.藻类基因启动子结构与功能研究进展[J].中国海洋大学学报,2008,38(3):404-412.[11]Yuzuru M,Makoto H,Hitoshi K,et al.Reporter gene introductionand transientexpression in protoplastsof Porphyra yezoensis[J].Journal of Applied Phycology,2004,16(1):23-29.[12]Walker T L,Becker D K,Collet C.Characterisation of the Dunaliella tertiolecta RbcS genes and their promoter activity in Chlamydomonas reinhardtii[J].Plant Cell Reports,2005,23(10/11):727-735.[13]Lu Y Z,Zhang X C.Analysis on promoter elements of cpc operon from Arthrospina platensis[J].Acta Oceanologica Sinica,2008,27(1):85-91.[14]Guo N,Zhang X C,Lu Y Z,et al.Analysis on the factors affecting start-up intensity in the upstream sequence of phycocyanin β subunit gene from Arthrospira platensis by site-directed mutagenesis[J].Biotechnology Letters,2007,29(3):459-464.[15]HUANG Jun-chao,CHEN Feng,Sandmann G.Stress-related differential expre ssion of multiple β-carotene ketolase genes in the unicellular green alga Haematococcus pluvialis[J].Journal of Biotechnology,2006,122(2):176-185.[16]WANG Chao-gang,HU Zhang-li,HU Wei,et al.Expression and molecular analysis of phbB gene in Chlamydomonas reinhardtii[J].Chinese Science Bulletin,2004,49(16):1713-1717.[17]WANG Bao-li,LI Xiao-xia,ZHENG Fang,et al.pEGFPT,a novel T-vector for the direct,unidirectional cloning and analysis of PCR-amplified promoters[J].Biotechnol Letter,2007,29(2):309-312.[18]ZHANG Chao,LIU Gang,YU Shao-wen,et al.A Secretive Pichia pastoris expression vector for direct PCR product cloning[J].ChinaBiotechnology,2007,27(1):52-58.(in Chinese)张超,刘刚,余少文,等.可直接克隆PCR产物的毕赤酵母分泌型表达载体[J].中国生物工程杂志,2007,27(1):52-58.[19]CHEN Song-biao,Pattavipha Songkumarn,LIU Jian-li,et al.A versatile zero background T-vector system for gene cloning and functional genomics[J].Plant Physiology,2009,150:1111-1121.。
鞭毛

图7 FliF环的三维结构
2
Crystal structures of FliGMC, FliM, and FliN, and a model for subunit organization in the C ring
FliM,FliN和FliG 自装配成C环,并 位于MS环的胞质 侧,它们不但负责 产生扭矩,而且还 可以切换方向,使 得马达可以逆时针 (CCW)或顺时 针(CW)旋转, 因此C环又被称为 切换蛋白(复合 体)。
鞭毛蛋白输出设备: 位于转子胞质面,该 设备可以识别、展开 鞭毛组分,并可以使 这些组分移位进入鞭 毛的中央通道和生长 末端,进而在细胞膜 外构建鞭毛;
定子:图中绿色部分所显 示,它是一种穿膜蛋白复 合物,并与肽聚糖层相 连,起到锚定基体的作 用;另外,形成了质子或 钠离子通道,并把质子流 或钠离子流跨膜形成的运 动力转化成为鞭毛马达旋 转所需要的机械功。
图22 FliI及其六聚体的结构示意图
4.2、FliH、FliJ
FliH二聚体结合于一分 子的FliI上;
FliH是FliI ATP酶活性 的负调节蛋白,它与 FliI结合,不但可以使 没有与底物结合的FliI 保持ATPase的低活 性,而且,它还是将 携带底物的FliI定位于 FlhA和FlhB 所必需 的。
2 转子的结构
转子由四种蛋白组 成:FliF,FliG,FliM 和FliN; FliF自装配成嵌于细 胞膜中的MS环;
2.1、FliF(MS环)
利用去污剂溶解细菌 细胞膜碎片,可以分 离得到鞭毛基体,在 这个基体中的MS环主 要是由FliF构成的,所 以它又被称为FliF环, 具有5个结构域 :R, S,C,M,P。
图17 转子与定子上的一些重 要功能性残基示意图
衣藻鞭毛永久装片的简便方法

衣藻鞭毛永久装片的简便方法
王秀珍;杨震玲
【期刊名称】《生物学杂志》
【年(卷),期】1989(000)001
【摘要】鞭毛是衣藻在水中的运动器官.衣藻的鞭毛很纤细,不经染色,难以在普通显微镜下观察.观察衣藻的鞭毛,通常用鲁哥氏液染色,虽然这种方法很简便,但用此法染色后,经过脱水,鞭毛的颜色就会复失.为了制成永久装片长期观察,我们认为用以下方法制作手续比较简单,鞭毛的染色效果也较好.具体做法是:
【总页数】1页(P31-31)
【作者】王秀珍;杨震玲
【作者单位】[1]河北教育学院生物系;[2]河北教育学院生物系
【正文语种】中文
【中图分类】Q1
【相关文献】
1.字母"e"永久装片的制作 [J], 苏绍科
2.在染蓝幻灯片的基础上制作彩色幕幻灯片的简便方法 [J], 张玉燕;安建华
3.永久性装片的制片法 [J], 陈胜雅
4.“果蝇唾液腺永久装片制法”——与黄伟淦老师商榷 [J], 阚兆成
5.果蝇唾液腺永久装片制作法 [J], 黄伟淦
因版权原因,仅展示原文概要,查看原文内容请购买。
增强型绿色荧光蛋白基因(e-gfp)在莱茵衣藻中表达的研究

上清转移到另一离心管中。
(8)加入两倍体积无水乙醇沉淀 DNA,-20℃冰箱沉淀 1h 以上; (9)4℃、15000r/min、离心 5min 弃上清,用冰预冷的 70%乙醇 1ml 洗涤 DNA 沉淀,弃
其他:氯化钙、氨苄青霉素、饱和酚、氯仿、氧化铝等为国产,有关化学试剂,均为
分析纯或分子生物学级(Molecular biology grade)。
1.4 主要仪器设备
仪器
型号
制造商
离 大型离心机 2K15G Refrigerated Centifuge
心 小型离心机
1-13 Laboratory Centrifuge
上清,倒置于滤纸上,使乙醇完全挥发,直至试管内没有看见的液体存在。
(10)溶于 20ul 无菌水或含有去 DNA 酶的 RNA 酶的 TE 溶液。 (11)通过电泳鉴定该质粒是否为目的质粒以及判断质粒的纯度。 3.2 限制性内切酶酶切反应 (遵照所购试剂说明书)
(1) 据实验需要取一定量的 DNA,加入适量的限制性内切酶及相应的反应缓冲液、无菌去 离子水,使反应体系中的甘油浓度<5%.
增强型绿色荧光蛋白基因(e-gfp)
在莱茵衣藻中表达的研究
(生命科学学院,生物工程系生物技术专业 吴锦霞) (学号:2000302055)
内容提要:通过构建增强型绿色荧光蛋白基因(e-gfp)衣藻表达载体,利用“珠磨法” 将 e-gfp 导入细胞壁缺陷型莱茵衣藻(CC-849)中,经 Zeocin 抗性筛选出转 e-gfp 基因衣藻; 在光照下培养转基因藻,经 PCR 和 RT-PCR 对转基因藻进行分子检测,结果表明 e-gfp 已经 稳定整合到莱茵衣藻基因组中,并具有转录活性;随后的转基因藻相对荧光强度分析表明转 e-gfp 衣藻的相对荧光强度明显高于野生型衣藻。
莱茵衣藻BBS1基因RNAi载体的构建及应用

莱茵衣藻BBS1基因RNAi载体的构建及应用陈利红;李丽丽;高利芬;周俊飞;李甜甜;彭海【摘要】巴德-毕氏综合症(Bardet-Biedl syndrome,BBS)是一种由多种基因突变造成、与原生纤毛功能缺失相关的疾病,包含12种致病基因,分别为BBS1-12.旨在通过对衣藻BBS1基因进行RNAi干扰来研究其在衣藻中的功能.首先搭建衣藻快捷简单的RNAi骨架载体;再用RT-PCR克隆莱茵衣藻BBS1基因的一段cDNA序列于中间载体pEASY-T1上;测序后通过两次酶切连接到RNAi骨架载体上,经菌液PCR、酶切和测序验证,成功构建BBS1基因的RNAi干涉载体.经基因枪介导法转化莱茵衣藻CC503,转基因衣藻具有明显不同于对照的表现型,趋光性发生了改变.【期刊名称】《生物技术通报》【年(卷),期】2015(031)007【总页数】6页(P109-114)【关键词】莱茵衣藻;RNAi载体;BBS1基因;趋光性【作者】陈利红;李丽丽;高利芬;周俊飞;李甜甜;彭海【作者单位】江汉大学系统生物学研究院,武汉430056;江汉大学系统生物学研究院,武汉430056;江汉大学系统生物学研究院,武汉430056;江汉大学系统生物学研究院,武汉430056;江汉大学系统生物学研究院,武汉430056;江汉大学系统生物学研究院,武汉430056【正文语种】中文莱茵衣藻(Chlamydomonas reinhardtii)属于绿藻门、团藻目、衣藻科,是真核单细胞生物。
进化上比较古老,介于高等植物和动物之间。
衣藻的培养条件简单、生长周期短、光合效率高、遗传背景清楚,是重要的能源作物,素有“绿色酵母”之称[1]。
其生物学特性与高等植物和动物密切相关,如纤毛病理学[2],是目前用于研究纤毛的模式生物中最为广泛使用的一个[3]。
近年来,人们关于纤毛的知识大多来自于对莱茵衣藻的研究,如我们对纤毛结构的了解,“鞭毛内运输”的机制的发现以及与纤毛相关疾病的确定等[3]。
E.coli Nissle 1917(EcN)curli菌毛和鞭毛对其生物被膜形成的影响
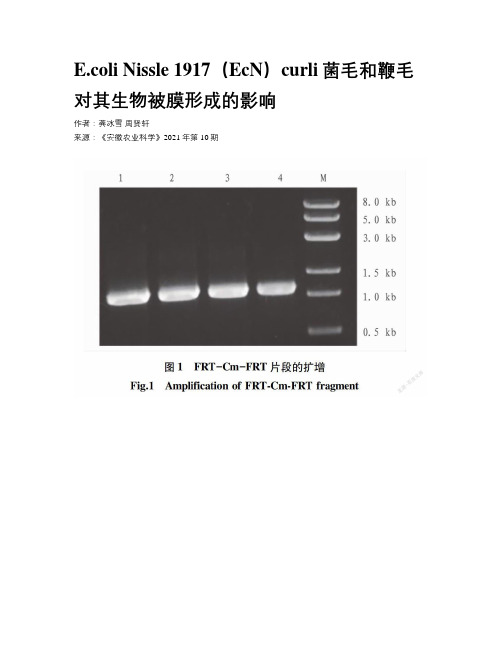
E.coli Nissle 1917(EcN)curli菌毛和鞭毛对其生物被膜形成的影响作者:龚冰雪周贤轩来源:《安徽农业科学》2021年第10期摘要 E.coli Nissle 1917 是被廣泛认可的益生菌,可以通过形成生物被膜定殖在肠道中抑制沙门氏菌等病原菌的生长。
通过λ-Red同源重组系统构建curli菌毛合成基因(csgA)和鞭毛调控基因(hnsA)突变菌株,探究curli菌毛和鞭毛对EcN生物被膜形成的影响。
结果表明,curli菌毛对EcN运动能力以及生物膜形成没有影响;EcNΔhnsA菌株的运动能力下降,生物被膜含量升高,说明鞭毛通过促进EcN运动,抑制细菌的附着,从而抑制生物膜的形成。
关键词 E.coli Nissle 1917(EcN);curli菌毛;鞭毛;生物被膜;形成;影响中图分类号 Q939.9 文献标识码 A 文章编号 0517-6611(2021)10-0008-04doi:10.3969/j.issn.0517-6611.2021.10.003开放科学(资源服务)标识码(OSID):Effects of Curli and Histone-like Nucleoid Structuring Protein on Biofilm Formation of E.coli Nissle 1917 (EcN)GONG Bing-xue,ZHOU Xian-xuan(School of Food Science and Engineering, Hefei University of Technology, Hefei,Anhui 230009)Abstract E.coli Nissle 1917 is a widely recognized probiotics, which can inhibit the growth of Salmonella and other pathogenic bacteria in the intestinal tract by forming biofilm colonization. The mutants of curli fimbriae synthesis gene (csgA) and flagellum regulatory gene (hnsA) were constructed by λ-Red homologous recombination system, and the effects of curli fimbriae and flagellum on the biofilm formation of EcN were investigated. The results showed that curli fimbriae had no effect on the ability of motility and biofilm formation of EcN. While the ability of motility of EcNΔhnsA strain decreased and biofilm formation increased, indicating that flagellum inhibited the formation of biofilm by promoting the motility ability and inhibiting the attachment of EcN.Key words E.coli Nissle 1917(EcN);Curli fimbriae;Flagellum;Biofilm;Formation;Effect生物被膜是嵌入在生物或非生物表面上的自生三维结构基质中的微生物细胞集合[1],其生长发育一般由初始黏附、固定、成熟和分散4个阶段组成[2]。
eubacterium xylanophilum分类 -回复

eubacterium xylanophilum分类-回复Eubacterium xylanophilum是一种鞭毛菌科细菌,属于厌氧菌群。
它在自然界中非常常见,主要分布于土壤、湖泊和大肠道等环境中。
Eubacterium xylanophilum对环境的调节和生态功能具有重要意义。
它在生态系统中的角色以及其分类学特征值得我们进一步了解和探讨。
首先,让我们从Eubacterium xylanophilum的外观和生物学特性开始。
Eubacterium xylanophilum是一种革兰氏阳性菌,可以通过鞭毛运动来移动。
细胞通常呈现杆状或球状形态,尺寸在0.5到1.0微米之间。
它是厌氧菌,具有较强的异养性能力,可以利用碳水化合物和纤维素等有机物为能源。
Eubacterium xylanophilum的生境分布非常广泛。
它主要存在于土壤中,特别是那些富含纤维素的环境。
此外,它也可以在湖泊和其他水体中被发现。
最引人注意的是,Eubacterium xylanophilum还可以在人和动物的肠道中发现,其中它在大肠道中的数量相对较高。
这种广泛的分布表明了它在环境中的重要作用。
关于Eubacterium xylanophilum的分类问题,它被归类为鞭毛菌目(Clostridiales),属于鞭毛菌科(Eubacteriaceae)。
它的属名“Eubacterium”来源于希腊语,意为“真菌样细菌”,这是因为早期研究人员发现其细胞形态与真菌类似。
其种名“xylanophilum”源于拉丁语,意为“爱好木聚糖”,这与其对纤维素和木聚糖的异养能力相对应。
此外,Eubacterium xylanophilum在其种内部还有不同的亚种和菌株。
亚种之间的差异主要表现在菌株的形态特征、生长条件和代谢能力等方面。
这些亚种的差异在一定程度上决定了它们对环境的适应能力和功能。
接下来,我们来探讨一下Eubacterium xylanophilum在生态系统中的作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
关键词: 莱氏衣藻,鞭毛,运动,合成,缩短. 中图分类号: Q 949. 2
0引言
在微生物领域 中,鞭 毛 的 协 调 统 一 性 一 直 都 是 最普遍引人关注的焦点之一. 纤毛的内在结构在真 核 生 物 界 中 ,从 藻 类 到 人 类 都 保 留 得 很 好 ,都 存 在 着 可以 自 由 移 动 的 结 构. 莱 氏 衣 藻 ( Chlamydomonas reinhardtii) 这 种 单 细 胞 藻 类 ( 体 积 大 约 在 7 μm 到 10 μm) ,靠两根 鞭 毛 移 动,结 构 简 单 但 很 具 有 代 表 性[1],是 长 期 以 来 用 于 研 究 鞭 毛 运 动 的 最 理 想 模型.
无论是对莱氏衣藻鞭毛的合成还是缩短都离不 开 IFT,因为莱氏衣藻鞭毛中没有蛋白的合成机制,它 必须 IFT 过程从合成位运输到鞭毛[8]. Kozminski KG 等首先提出了 IFT 的 概 念,即 鞭 毛 中 粒 子 的 传 递 是 沿着鞭毛长度做双向流动的[9]( 如图 2 所示) .
图 2 莱氏衣藻鞭毛中的 IFT 过程( 引自 Cosima T Baldari 和 Joel Rosenbaum)
图 1 莱氏衣藻鞭毛“9 + 2”结构( 引自 Gregory J. Pazour 和 Joel L. Rosenbaum)
藻 鞭 毛 的 长 度 ,说 明 在 衣 藻 的 细 胞 质 中 存 在 了 对 衣 藻鞭毛长度“测量”控制机制[21,22]. 那 鞭 毛 究 竟 被 多 少 机 制 支 配 着 ,这 些 复 杂 的 机 制 之 间 又 有 何 种 联 系 , 引起了科学家们的高度关注. 2. 2. 1 IFT 研究
从微观角度来说,由 Polin 等 提 出 的,莱 氏 衣 藻 鞭毛是协同运动与 非 协 同 运 动 交 替 进 行 的,而 这 两 种运动的交替是通过两条鞭毛击打频率的改变来实 现的,同时也证实了 这 种 击 打 能 量 的 传 递 是 通 过 衣 藻所处环境中的液体运动来实现的. 而鞭毛之所以 有这两种运动的交 替,从 根 本 来 说 是 莱 氏 衣 藻 对 资 源的需求 以 及 为 了 逃 避 捕 食 者 的 自 然 属 性 所 决 定 的. 当两条 鞭 毛 协 调 运 动 时,莱 氏 衣 藻 进 行 直 线 运 动,能很快的接近它所要的生存资源; 而当两条鞭毛 做 非 协 调 运 动 时 ,衣 藻 开 始 做 翻 滚 运 动 ,结 合 实 验 表 明,小型 桡 足 类 捕 食 者 的 捕 食 半 径,大 约 4 ~ 8 mm, 比衣藻平均 1 mm 的 逃 跑 长 度 要 大,所 以 翻 滚 时 的 随 机 定 位 能 帮 助 衣 藻 逃 脱 捕 食 者 的 捕 食[1] .
目前关于莱氏 衣 藻 鞭 毛 的 研 究 国 内 很 少,国 外 学 者 研 究 居 多 ,为 了 更 好 的 引 起 国 内 的 关 注 ,本 文 对 国内外的研究进行 了 综 合 阐 述,以 期 在 国 内 得 到 更 好的发展.
1 莱氏衣藻运动研究
从宏观角度看,单 细 胞 莱 氏 衣 藻 有 三 种 运 动 方 式: 趋光运动,避光 运 动 和 滑 行. 其 直 线 运 动 是 同 时 绕 自 身 的 纵 轴 旋 转 ,以 螺 旋 型 路 径 向 光 源 运 动 ,这 样
通过对 IFT 微粒 的 观 测,可 以 从 根 本 上 了 解 鞭 毛变化的过程,发现其中的规律. 但是由于技术和生 物材料的缺乏,关 于 IFT 的 一 些 假 说 都 无 法 得 到 验 证. 最近 提 出 了 新 的 关 于 IFT 的 理 论,指 出 IFT 已 经不是只在纤毛中 存 在,在 一 些 没 有 纤 毛 结 构 的 细 胞也发现了,如 T 淋巴细胞[13]. 2. 2. 2 鞭毛合成机制
45
首都师范大学学报( 自然科学版)
2012 年
释 ,是 依 靠 对 微 小 的 偏 离 的 积 累 而 发 生 的 扩 散 运 动 , 但是却缺少明确 的 鞭 毛 击 打 的 动 力 学 证 明[4]. 2009 年,Marco Polin 等结合高速影像以及三维跟踪技术, 通 过 两 条 鞭 毛 间 的 视 频 光 强 度 ,得 到 振 荡 强 度 信 号 :
46
第1期
秦 琅等: 莱氏衣藻鞭毛研究进展
病已经被归类到了一起统称为“纤 毛 病 变 ”[26,27]. 所 有的纤毛类 或 者 非 纤 毛 类 真 核 生 物 都 需 要 IFT,纤 毛的缺失可能会引起生理病变. 这些病变包括多囊 性肾病,视网膜病 变,内 脏 移 位,而 其 他 明 显 依 附 于 纤 毛 的 病 变 还 需 要 进 一 步 发 现[23] .
莱氏衣藻鞭毛的长度是由一系列复杂的自我平 衡 机 制 来 控 制 的 ,这 些 机 制 确 定 了 鞭 毛 的 特 定 长 度 , 并且决定了每个细胞有两根相等长度的鞭毛. 当然 也存在有不止两根 鞭 毛 的 衣 藻 细 胞,这 主 要 取 决 于 它 们 鞭 毛 蛋 白 的 含 量[15] .
第 33 卷 第 1 期 2012 年 2 月
首都师范大学学报( 自然科学版) Journal of Capital Normal University
( Natural Science Edition)
No. 1 Feb.,2012
莱 氏 衣 藻 鞭 毛 研 究 进 展*
秦 琅1 朱 毅2**
( 1 . 首都师范大学 资源环境与旅游学院 首都圈生态环境过程重点实验室 ,北京 100048 ; 2. 中国农业大学食品科学与营养工程学院,北京 100083 )
对莱氏衣藻鞭 毛 长 度 控 制 研 究,最 初 主 要 是 通 过 去 除 鞭 毛 观 察 其 合 成 ,随 着 生 物 技 术 发 展 ,科 学 家 开始利用培养出的 衣 藻 的 变 种 进 行 研 究,不 断 深 入 到了基因蛋白层次. 在对突变体研究中,通过在野生 型衣藻细胞质中进 行 配 对 实 验 后,观 察 到 在 配 对 几 分钟内,lf 的鞭毛缩短到了( shf 增长到了 ) 野生型衣
1987 年,U. Rüffer 等首先将莱氏衣藻的两根鞭 毛按其位置区分开 了,将 靠 近 眼 点 的 称 为 顺 式 鞭 毛 cis,另一根为反式鞭毛 trans[5]. 2005 年时 K Josef 等 和 N Okita 等人,在黑暗的环境中 实 验 ( 避 免 莱 氏 衣 藻的趋光运动的干扰) ,在 1 ~ 2 s 的 间 隔 时 间 内,发 现大多数的细胞 ( ~ 95% ) 鞭 毛 都 做 协 同 运 动 并 伴 随偶尔反式鞭毛的滑行; 而其他的细胞( ~ 5% ) 作 非协同运动,而通常 反 式 鞭 毛 比 顺 式 鞭 毛 打 击 频 率 更高. 但是始终不知道控制协同运动的生物化学或 者物理过程,并且虽 然 存 在 了 对 莱 氏 衣 藻 游 动 的 解
摘要
莱氏衣藻作为最理想的纤毛类研究模型,长期以来就受到研究者关注. 虽然它 没 有 神 经 细 胞 的 支 配 ,但 是 鞭 毛 能够通过精确的调控来应对不同的环境变化. 而这种复 杂 精 确 的 调 控 机 制 涉 及 很 多 领 域 的 知 识 ,所 以 其 机 理 研 究 还处于探索阶段. 近年来随着微 - 纳米技术以及传感器技术的发展,在遗传学的助 力 推 动 下,对 莱 氏 衣 藻 鞭 毛 的 研 究已经取得了一定的突破,创立了很多新理论. 文章阐 述 了 目 前 鞭 毛 研 究 中 的 突 破,结 合 研 究 现 状,指 出 了 莱 氏 衣 藻鞭毛未来的研究方向以及在各领域中的广阔应用前景.
Rosenbaum 等通过实验观察到,当将其中一根鞭 毛去除以后 ,另 外 一 根 鞭 毛 就 迅 速 缩 短 ,大 约 为 原 长 度的一半,直到新生长出来的鞭毛与缩短后的鞭毛一 样长了以后,两根鞭毛才开始一起生长. 有时候会出 现一些衣藻细胞缩短后的鞭毛长度超过( 或短于) 应 该停止分解的位置,此时生长中的鞭毛就会停止直到 另一根回到正常的缩短长度. 同时在实验中也测试到 它们的生长速度是与生长的长度呈现一定的反比关系 的: 最开始的鞭毛生长速度是迅速的( - 0. 4 μm / min) , 但当它们生长到接近原有的长度时生长速度就变得 缓慢( - 0. 15 - 0. 2 μm / h) . [14] Paul A. Lefebvre 等 提出这个生长过程大约会在 90 min 内完成[15]. 2. 2. 3 鞭毛缩短机制
而通过生物化学分析 IFT 粒子揭示了它们主要 是由两种多蛋白复合体组成,复合体 A 和复合体 B, 其中复合体 A 由 四 种 蛋 白 构 成,而 复 合 体 B 则 由 12 ~ 13种蛋白 相 互 作 用 构 成. IFT 粒 子 与 机 动 蛋 白 FLA10 驱动蛋白 II 以 及 细 胞 质 动 力 蛋 白 Dhc1b 一 起,沿着二联微管在 鞭 毛 细 胞 膜 下 传 输 进 出 鞭 毛 的 蛋白[10 ~ . 12] 自 从 IFT 提 出 以 来,通 过 基 础 细 胞 学 和 分子生物学对 各 种 细 胞 器 的 纤 毛 的 IFT 的 研 究,已 经将理论扩展到了纤毛类疾病领域[23 ~ . 25] 而这类 疾
X L,R ( t) = ГL,R ( t) sin[2 θπL,R ( t) ] ( 1 ) 式 中: X—signal; L—left; R—right; Г— amplitude; t— time; θ—phase[2] 发现 虽 然 它 们 趋 光 性 响 应 机 制 有 本 质 的 区 别[5 ~ 7],但是却没 有 表 现 出 明 显 的 频 率 不 对 称 性,并 同时证明了莱氏衣藻的扩散运动是鞭毛非协同运动 的结果,更得到了更加精确的扩散常数 D≈ ( 0. 47 ± 0. 05) × 10 - 3 cm2 / s,确定了鞭毛击打的频率是在细 胞控制下进行的,而 衣 藻 细 胞 正 是 通 过 精 确 地 改 变 鞭毛的固有频率来控制协同运动. 值得注意的是,这 里纠正了前人的一 个 错 误,得 出 了 每 个 细 胞 的 一 组 鞭毛中,并没有表现 出 一 根 比 另 一 根 鞭 毛 更 快 的 打 击频率的结论. 但是对莱氏衣藻鞭毛运动的管理机 制 还 是 未 知[2] .
