化工原理第十章-液-液萃取和液-固浸取
萃取技术 萃取的基本概念

分 层—萃取相与萃余相分离。 静置沉降。
脱溶剂—从两相中分别回收溶剂和溶质。 蒸馏,蒸发。
萃取
液-液萃取的基本原理及定义
在液体混合物中加入与其不完全混溶的液体溶剂(萃取剂),形 成液-液两相,利用液体混合物中各组分在两液相中溶解度的差 异而达到分离的目的。也称溶剂萃取,简称萃取。
溶质:混合液中被分离出的物质,以A表示; 稀释剂(原溶剂):混合液中的其余部分,以B表示; 萃取剂:萃取过程中加入的溶剂,以S表示。 萃取剂对溶质应有较大的溶解能力,对于稀释剂则不互溶或仅部 分互溶。
工业废水处理:用二烷基乙酰胺脱除染料厂、炼油厂、焦化厂废 水中的苯酚。
有色金属冶炼:湿法冶金中溶液分离、浓缩和净化的有效方法。 例如从锌冶炼烟尘的酸浸出液中萃取鉈、铟、镓、锗,以及铌钽、镍-钴、铀-钒体系的分离,以及核燃料的制备。
制药工业:从复杂的有机液体混合物中分离青霉素、链霉素以及 维生素等。
液-液萃取:用溶剂分离液体混合物中的组分,又称溶剂萃取。 液-固萃取:用溶剂分离固体混合物中的组分,又称溶剂浸取。 由此可见,液-液萃取与蒸馏具有相同的分离对象和目标。 但是二者在分离原理、操作方式、生产工艺、设备装置等方
液-液萃取过程的分类
按性质可分为物理萃取和化学萃取;按萃取对象可分为有机物萃 取和无机物萃取。
液-液萃取的应用举例
19世纪,用于无机物和机物的分离,如1842年用二乙醚萃取硝酸 铀酰,用乙酸乙脂类的物质分离水溶液中的乙酸等。
石油化工:链烷烃与芳香烃共沸物的分离。例如用二甘醇从石脑 油 裂 解 副 产 汽 油 或 重 整 油 中 萃 取 芳 烃 ( 尤 狄 克 斯 法 —Udex process),如苯、甲苯和二甲苯。
化工原理下册课件液液萃取和液固浸取

第十章 液-液萃取和液-固浸取
10.4 萃取设备 10.4.1 萃取设备的基本要求与分类 10.4.2 萃取设备的主要类型 10.4.3 萃取设备的选择
萃取设备的选择
萃取设备选择考虑的因素
❖ 需要的理论级数 ❖ 生产能力 ❖ 物系的物性
密度差 界面张力 腐蚀性 ❖ 物系的稳定性和液体在设备内的停留时间 ❖ 其他
一、超临界萃取的基本原理
3.超临界萃取的原理
萃取剂
在超临界状 态下, 压力 微小变化引 起密度变化 很大, 使溶 解度增大。
压缩到超 临界状态
液体(或固 升温、降压 体)混合物
萃取 组分
溶剂与萃取 组分分离
二、超临界萃取的典型流程
超临界萃取过程分为萃取和分离两个阶段, 按 分离方法不同分为三种流程。
超临界萃取是具有特殊优势的分离技术。多年 来, 众多的研究者以炼油、食品、医药等工业中的 许多分离体系为对象开展了深入的应用研究。在石 油残渣中油品的回收、咖啡豆中脱除咖啡因、啤酒 花中有效成分的提取等工业生产领域, 超临界萃取 技术已获得成功地应用。
用超临界CO2从咖啡中提取咖啡因的流程
1-萃取塔;2-水洗塔;3-蒸馏塔;4-脱气罐
一、萃取设备的基本要求
萃取设备的基本要求
❖ 两相充分的接触并伴有较高程度的湍动 ❖ 有利于液体的分散与流动 ❖ 有利于两相液体的分层
二、萃取设备的分类
液体分散的动力 重力差
脉冲
外加能量
旋转搅拌
往复搅拌 离心力
逐级接触式 筛板塔
脉冲混合-澄清器 混合澄清器 夏贝尔塔
卢威离心萃取机
微分接触式 喷洒塔 填料塔
作业题: 7、8
本章小结
本章重点掌握内容
液液萃取

实验15 液—液萃取实验一.实验目的1.了解液-液萃取原理和实验方法。
2.熟悉转盘萃取塔的结构、操作条件和控制参数。
3.掌握评价传质性能(传质单元数、传质单元高度)的测定和计算方法。
二.实验原理液-液萃取是分离液体混合物和提纯物质的重要单元操作之一。
在欲分离的液态混合物(本实验暂定为:煤油和苯甲酸的混合溶液)中加入一种与其互不相溶的溶剂(本实验暂定为:水),利用混合液中各组分在两相中分配性质的差异,易溶组分较多地进入溶剂相从而实现混合液的分离。
萃取过程中所用的溶剂称为萃取剂(水),混合液中欲分离的组分称为溶质(苯甲酸),萃取剂提取混合液中的溶质称为萃取相,剩余的混合液称为萃余相。
图2-15-1是一种单级萃取过程示意图。
将萃取剂加到混合液中,搅拌混合均匀,因溶质在萃取相的平衡浓度高于在混合液中的浓度,溶质从混合液向萃取剂中扩散,从而使溶质与混合液中的其他组分分离。
图2-15-1单级萃取过程示意图由于在液-液系统中,两相间的密度差较小,界面张力也不大,所以从过程进行的流体力学条件看,在液-液的接触过程中,能用于强化过程的惯性力不大。
为了提高液-液相传质设备的效率,常常从外界向体系加能量,如搅拌、脉动、振动等。
本实验采用的转盘萃取塔属于搅拌一类。
与精馏和吸收过程类似,由于过程的复杂性,传质性能可用理论级和级效率表示,或者用传质单元数和传质单元高度表示,对于转盘萃取塔、振动萃取塔这类微分接触萃取塔的传质过程,一般采用传质单元数和传质单元高度来表征塔的传质特性。
萃取相传质单元数N OE 表示分离过程的难易程度。
对于稀溶液,近似用下式表示:**ln *2112x x x x x x dxN x x OE --=-=⎰(2-15-1) 式中:N OE ——萃取相传质单元数x ——萃取相的溶质浓度(摩尔分率,下同) x * ——溶质平衡浓度x l 、x 2 ——分别表示萃取相进塔和出塔的溶质浓度。
萃取相的传质单元高度用H OE 表示:OE OE H/N H = (2-15-2)式中:H 为塔的有效高度(m )。
萃取过程及设备

萃取是利用系统中组分在溶剂中有不同的溶解度来分离混合物的单元操作,利用相似相溶原理,萃取有两种方式:液-液萃取,用选定的溶剂分离液体混合物中某种组分,溶剂必须与被萃取的混合物液体不相溶,具有选择性的溶解能力,而且必须有好的热稳定性和化学稳定性,并有小的毒性和腐蚀性。
如用苯分离煤焦油中的酚;用有机溶剂分离石油馏分中的烯烃;用CCl4萃取水中的Br2.固-液萃取,也叫浸取,用溶剂分离固体混合物中的组分,如用水浸取甜菜中的糖类;用酒精浸取黄豆中的豆油以提高油产量;用水从中药中浸取有效成分以制取流浸膏叫“渗沥”或“浸沥”。
虽然萃取经常被用在化学试验中,但它的操作过程并不造成被萃取物质化学成分的改变(或说化学反应),所以萃取操作是一个物理过程。
萃取是有机化学实验室中用来提纯和纯化化合物的手段之一。
通过萃取,能从固体或液体混合物中提取出所需要的化合物。
用溶剂从液体混合物中提取其中某种组分的操作称为液/液萃取。
萃取是利用溶液中各组分在所选用的溶剂中溶解度的差异,使溶质进行液液传质,以达到分离均相液体混合物的操作。
萃取操作全过程可包括:1.原料液与萃取剂充分混合接触,完成溶质传质过程;2.萃取相和萃余相的分离过程;3.从萃取相和萃余相中回收萃取剂的过程。
通常用蒸馏方法回收。
现以提取含有A、B两组分的混合液中的A组分为例说明萃取操作过程。
选用一种适宜的溶剂S,这种溶剂对欲提取的组分A应有显著的溶解能力,而对其它组分B应是完全不溶或部分互溶(互溶度越小越好)。
所选用的溶剂S称为萃取剂。
待分离的混合液(含A+B)称为原料液,其中被提取的组分A称为溶质,另一组分B(原溶剂)称为稀释剂。
萃取过程的三个步骤:(1)首先将原料液(A+B)与适量的萃取剂S在混合器中充分混合。
由于B与S不互溶,混合器中存在S与(A+B)两个液相。
进行搅拌,造成很大的相界面,使两相充分接触,溶质A由原料液(稀释剂B)中经过相界面向萃取剂S中扩散。
萃取分离技术

如中药大黄中的大黄酸、大黄素和大黄酚的分离
OH O OH
OH O OH
OH O OH
COOH HOCH3O NhomakorabeaO
大黄酸
大黄素
酸性最强
酸性其次
溶于NaHCO3
溶于Na2CO3
CH3 O
大黄酚
酸性最弱
溶于NaOH
2、萃取溶剂的选择原则
萃取溶剂与溶液的溶剂互溶性差,两溶剂的密度 差异明显 “相似相溶”,萃取剂对目标物的选择性高 化学性质稳定(洗涤例外) 沸点较低,易回收 价格低,毒性小,不易着火。
• (2)分子中非极性部分越大,碳链越长或结构越大, 则亲脂性越强。
• (3)结构母核相同的成分,分子中功能基的极性越大, 或极性功能基数量越多,则整个分子的极性越大,亲 水性越强,亲脂性越弱。
影响提取效率的因素
影响提取效率的因素
溶剂类型 原料的粉碎度 提取时间 提取温度 提取次数 固液比 设备条件
溶质 咖啡 豆油 蛋白质 香料成分 蔗糖 维生素B 玉米蛋白质 胶质 果汁 鱼油 鸦片提取物 胰岛素 肽、缩氨酸 水 海盐 咖啡因 药用成分 药用成分
溶剂 溶质水 己烷 NaOH溶液,pH 9 80%乙醇 水 乙醇-水 90%乙醇 稀酸 水 己烷,丁醇,CH2Cl2 CH2Cl2或超临界CO2 酸性醇 水 50%的糖液 稀盐酸 氯代甲烷,超临界CO2 水 酒
甲乙酮
乙腈
沸点℃
77.1 101.3 40.8 83.8 61.2 76.8 120.0 76.6
81.6
密度
0.90 1.03 1.34 1.24 1.49 1.58 1.14 0.81
0.78
(1)水
优点:溶解范围广、穿透能力强、易得、安全 缺点:a.有些苷类成分的酶解
柴诚敬《化工原理》笔记和课后习题(含考研真题)详解(10-12章)【圣才出品】

量分数。
b.对于萃取剂 S 与原溶剂 B 互不相溶的物系,溶质在两液相中的分配关系与吸收中的
类 似,即 Y KX
式中 Y——萃取相 E 中溶质 A 的质量比组成;X——萃余相 R 中溶质 A 的质量比组成;K—
e MR r ME
结合三角形相似定理可得
e xA zA MR m xA yA RE
3 / 96
圣才电子书
及
十万种考研考证电子书、题库视频学习平台
r zA yA ME m xA yA RE
式中 ——线段 的长度,m。
③若向 A、B 二元混合液 F 中加入纯溶剂 S,则三元混合液的总组成点 M 必位干 SF 的
④过 M 点分别作三个边的垂线 MN、ML 及 MJ,则垂直线段
及 分别代表 A、
B 及 S 的组成。由图可知,M 点的质量分数为:
和
(2)杠杆规则
如图 10-3 所示,将质量为 r,组成为 xA、xR、xS 的混合液 R 与质量为 e,组成为 yA、yB、
ys 的混合液 E 相混合,得到一个质量为 m,组成为 zA、zB、zS 的新混合液 M,其在三角形坐
连线上,具体位置由杠杆规则确定,即
MF S MS F
2.三角形相图 (1)根据萃取操作中各组分的互溶性,可将三元物系分为以下三种情况,即 ①溶质 A 完全溶于 B 及 s,B 与 S 不互溶; ②溶质 A 完全溶于 B 及 S,B 与 S 部分互溶; ③溶质 A 完全溶于 B,A 与 s 及 B 与 S 部分互溶。 (2)溶解度曲线及联结线 ①设溶质 A 可完全溶于 B 及 S,但 B 与 S 为部分互溶,一定温度下的平衡相图如图 l0-4 所示,图中曲线 R0R1R2RiRnKEnEiE2E1E 0 称为溶解度曲线。 ②溶解度曲线将三角形相图分为两个区域 曲线以内的区域为两相区,曲线以外的区域为均相区。位于两相区内的混合物分成两个 互相平衡的液相,称为共轭相,连接两共轭相组成坐标的直线称为联结线,显然萃取操作只 能在两相区内进行。 ③若组分 B 与组分 S 完全不互溶,则点 R。与 E。分别与三角形顶点 B 及顶点 S 相重合。
萃取分离

萃取分离技术Extraction 5.1 概述利用物质在互不相容的两相之间溶解度的不同而使物质得到分离纯化或浓缩的方法称为萃取。
目标物液体:液液萃取固体:液固萃取(浸取)有机溶剂萃取双水相萃取液膜萃取反胶束萃取超临界萃取5.2 液固萃取(浸取)¾液固萃取,又称浸取或提取,是一种分离和富集某些天然产物、生化试剂和添加剂的有效手段。
由于溶剂渗入固体试样内部是比较缓慢的过程,因此液固萃取需要较长的时间,一般需要连续萃取。
浸提分为冷浸和热浸两种:¾冷浸法:适用于提取遇热易被破坏的物质及含淀粉、树胶、果胶、黏液质的样品。
¾热浸法:由于提高温度有利于有效成分的溶解度故提取效果较冷浸好。
该方法操作时间长,浸出溶剂用量大,往往浸出效率差,不易完全浸出,不适合有效成分含量低的原料。
为了有效成分的浸出,固体样品尽量粉碎传统的液固萃取装置是利用索氏(Soxhlet)提取器浸取在食品工业中的应用食用油¾除了采用传统的压榨法外,常采用溶剂浸提其中所含的油脂。
黄豆经溶剂浸提后,豆渣中残油量往往低于l%,远较压榨法的豆渣的残油率2%~2.5%为低。
除了油料种籽可以采用浸提法抽取其所含的油脂外,有时还采用浸提法抽取鱼肝或鱼皮的油脂。
常用溶剂:己烷、庚烷、环己烷速溶咖啡¾从咖啡豆中浸提出可溶性成分,经喷雾干燥或冷冻干燥可制得速溶咖啡。
食品功能成分的提取5.3 溶剂萃取法(Solvent Extraction)杂质目的产物料液萃取剂Light phaseHeavy phase溶剂萃取过程示意图实验室溶剂萃取过程分液漏斗有机相水相溶剂萃取法的原理萃取是根据不同物质在两相中分配平衡的差异是实现分离的。
物理萃取:利用溶剂对需分离的组分有较高的溶解能力,分离过程纯属物理过程,理论基础是分配定律;化学萃取:溶剂首先有选择性地与溶质化合或络合,从而在两相中重新分配而达到分离目的,服从相律及一般化学反应的平衡定律。
萃取技术

2.液-液萃取过程的特点
1.)液-液萃取过程的依据是混合液中各组分在所 选萃取剂与原溶剂中溶解度的差异 2.)液-液萃取过程是溶质从一种液相转移到另 一种液相的传质过程 3.)液-液萃取中,萃取剂的用量比较大,所以萃 取剂应价廉易得,稳定性好,可回收循环使用,从 而降低萃取过程的成本 4.)萃取过程的极限是达到液-液相平衡,萃取过 程传质推动力的计算也要通过相平衡组成来表达
3.乳化和破乳化
1.)乳化:是一种液体以微小液滴的形式均匀分散在另 一种不相混溶的液体中的现象。
乳状液形式: ①水包油型(O/W)(oil in water) ②油包水型(W/O)(w稀释法和吸附破乳 b.化学法 电解质可消除界面上的电荷作用,促使乳状液 聚 沉,达到破乳目的 c.顶替法 生产常用 d.转型法 乳状液的转型首先是原乳状液的破坏,然后 形成新乳状液
2.萃取操作实训目标要求 3.萃取操作实训方案设计与能力培养
七、液-液萃取设备
分类
两相接触方式不同分为 分级接触式、微分接触式(连续接触式)两大类 设备操作级数不同分为 单级、多级 设备结构形式 外加能量方式
1.混合设备 流动混合器 、搅拌式混合器 2.分离设备 重力式澄清器、离心式分离机 3.离心萃取机
五、液-液萃取过程问题分析及处理
1.影响液-液萃取的因素
影响液-液萃取的因素很多,主要有四个方面:被分 离物系本身;萃取剂的选择及用量;操作条件;设备因 素。
2.萃取剂的选择
1.)分配系数 被分离物质在萃取剂与原溶剂两相间的 平衡关系是选择萃取剂首先要考虑的问题。 2.)选择性系数 为了定量表示某种萃取剂分离两种溶 质的难易程度,引入选择性系数β。选择性系数β为两相 平衡时萃取相E和萃余相R中被萃取组分A与另一组分B 组成比的比值。 3.)萃取剂S与原溶剂B 的互溶度
萃取技术

β越大,A、B的分离效果越好,即产物与 杂质越容易分离。
四、萃取剂的选择
一个良好的溶剂要满足以下要求: a. 有很大的萃取容量; b. 良好的选择性; c. 与被萃取的液相(通常是水相)互溶度要小, 且粘度低、界面张力小或适中,有利于相的分 散和两相分离; d. 溶剂的回收和再生容易; e. 化学稳定性好,不易分解,对设备腐蚀性小; f. 价廉易得; g. 安全性好,对人体无毒性或毒性低。
双水相萃取
过滤和离心依赖于被分离颗粒的尺寸或密度的差异, 当希望收集微生物的细胞器、分离去除细胞碎片、提 取和浓缩胞内物质时,普通的过滤和离心技术就显得 力不从心了。
溶剂萃取法难于应用于蛋白质分离。
值得注意的是溶液的分相不一定完全依赖于有机溶剂, 在一定条件下,水相也可以形成两相甚至多相。于是 有可能将水溶性的酶、蛋白质等生物活性物质从一个 水相转移到另一水相中,从而完成分离任务。
二、液-液萃取过程机理(×)
萃取过程机理主要有以下四种类型:
(1) 简单分子萃取(物理萃取)
(2) 中性溶剂络合萃取
(3) 酸性阳离心交换萃取 (4) 离子络合萃取
三、分配系数和分配因素
分配定律(表征萃取剂对溶质的萃取能力)
是指在一定温度、压力下,溶质分子分布在 两个互不相溶的溶剂里,达到平衡后,它在 两相的浓度之比为一常数K,这个常数称为 分配系数,即:
,
工业萃取方式
工业萃取的流程 混合 分离
分离器(如碟片式离心机)
溶剂回收
混合器 (如搅拌混合器)
溶剂回收装置 (如蒸馏塔)
化工原理下册答案

第九章 蒸馏1.在密闭容器中将A 、B 两组分的理想溶液升温至82 ℃,在该温度下,两组分的饱和蒸气压分别为*A p =107.6 kPa 及*B p =41.85 kPa ,取样测得液面上方气相中组分A 的摩尔分数为0.95。
试求平衡的液相组成及容器中液面上方总压。
解:本题可用露点及泡点方程求解。
()()()()95.085.416.10785.416.107总总*B*A 总*B 总*A A 总*AA =-=--==p p p p p p p p x p p y - 解得 76.99=总p kPa8808.085.416.10785.4176.99*B*A *B =--=--=p p p p x 总本题也可通过相对挥发度求解571.285.416.107*B *A ===p p α由气液平衡方程得()()8808.095.01571.295.095.01=-+=-+=y y y x α()()[]kPa 76.99kPa 8808.0185.418808.06.1071A *BA *A =-+⨯=-+x p x p p =总 2.试分别计算含苯0.4(摩尔分数)的苯—甲苯混合液在总压100 kPa 和10 kPa 的相对挥发度和平衡的气相组成。
苯(A )和甲苯(B )的饱和蒸气压和温度的关系为 24.22035.1206032.6lg *A +-=t p 58.21994.1343078.6lg *B +-=t p式中p ﹡的单位为kPa ,t 的单位为℃。
苯—甲苯混合液可视为理想溶液。
(作为试差起点,100 kPa 和10 kPa 对应的泡点分别取94.6 ℃和31.5 ℃)解:本题需试差计算 (1)总压p 总=100 kPa初设泡点为94.6℃,则191.224.2206.9435.1206032.6lg *A =+-=p 得 37.155*A =p kPa同理 80.158.2196.9494.1343078.6lg *B =+-=p 15.63*B =p kPa4.03996.015.6337.15515.63100A ≈=--=x或 ()kPa04.100kPa 15.636.037.1554.0=⨯+⨯=总p则 46.215.6337.155*B *A ===p p α6212.04.046.114.046.2)1(1=⨯+⨯=-+=x x y αα(2)总压为p 总=10 kPa通过试差,泡点为31.5℃,*A p =17.02kPa ,*B p =5.313kPa203.3313.502.17==α 681.04.0203.214.0203.3=⨯+⨯=y随压力降低,α增大,气相组成提高。
液液萃取和液固浸取
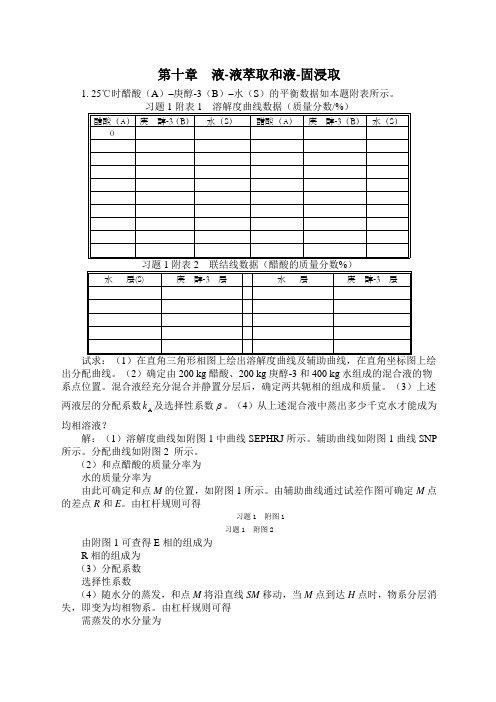
第十章液-液萃取和液-固浸取1. 25℃时醋酸(A)–庚醇-3(B)–水(S)的平衡数据如本题附表所示。
出分配曲线。
(2)确定由200 kg醋酸、200 kg庚醇-3和400 kg水组成的混合液的物系点位置。
混合液经充分混合并静置分层后,确定两共轭相的组成和质量。
(3)上述k及选择性系数 。
(4)从上述混合液中蒸出多少千克水才能成为两液层的分配系数A均相溶液?解:(1)溶解度曲线如附图1中曲线SEPHRJ所示。
辅助曲线如附图1曲线SNP 所示。
分配曲线如附图2 所示。
(2)和点醋酸的质量分率为水的质量分率为由此可确定和点M的位置,如附图1所示。
由辅助曲线通过试差作图可确定M点的差点R和E。
由杠杆规则可得习题1 附图1习题1 附图2由附图1可查得E相的组成为R相的组成为(3)分配系数选择性系数(4)随水分的蒸发,和点M将沿直线SM移动,当M点到达H点时,物系分层消失,即变为均相物系。
由杠杆规则可得需蒸发的水分量为2. 在单级萃取装置中,以纯水为溶剂从含醋酸质量分数为30%的醋酸–庚醇-3混合液中提取醋酸。
已知原料液的处理量为1 000 kg/h,要求萃余相中醋酸的质量分数不大于10%。
试(1)水的用量;(2)萃余相的量及醋酸的萃取率。
操作条件下的平衡数据见习题1。
解:(1)物系的溶解度曲线及辅助曲线如附图所示。
由原料组成x F=可确定原料的相点F,由萃余相的组成x A=可确定萃余相的相点R。
借助辅助曲线,由R可确定萃取相的相点E。
联结RE、FS,则其交点M即为萃取操作的物系点。
由杠杆规则可得(2)由杠杆规则可确定萃余相的量。
由附图可读得萃取相的组成为萃取率=()0.14242379176.2%10000.3⨯-=⨯3. 在三级错流萃取装置中,以纯异丙醚为溶剂从含醋酸质量分数为30%的醋酸水溶液中提取醋酸。
已知原料液的处理量为2000 kg,每级的异丙醚用量为800 kg,操作温度为20 ℃,试求(1)各级排出的萃取相和萃余相的量和组成;(2)若用一级萃取达到同样的残液组成,则需若干千克萃取剂。
化工原理下萃取过程的流程与计算

化工原理下萃取过程的流程与计算化工原理中的萃取过程是指利用溶剂将目标物质从混合物中分离出来的操作过程。
该过程适用于从可溶液中获得目标物质,或者将两相液体或气体中的目标物质转移至另一相中。
萃取过程的流程一般包括以下几个步骤:1.选择合适的溶剂:根据目标物质的物化性质,选择适合的溶剂。
该溶剂应与混合物中其他成分相互不溶或溶度低。
同时,溶剂的选择还要考虑到需求的目标物质浓度、产率和分离度等因素。
2.混合物预处理:将待萃取的混合物进行预处理,以提高目标物质的相对浓度。
预处理手段可以包括调整溶剂酸碱性、溶剂萃取剂的加入以及混合物的预处理等。
3.萃取过程:在一定温度条件下,将混合物与溶剂充分接触并反应。
在这个过程中,目标物质会从混合物中转移到溶剂中,得到所需的提取液。
4.分离过程:对提取液进行分离,获得目标物质。
分离过程可以采用各类分离工艺,如蒸馏、结晶、过滤等。
萃取过程的计算主要涉及到平衡和热力学方面的内容。
其中,平衡计算主要包括挥发分离计算、浸出平衡计算和溶剂选择计算等。
而热力学计算主要包括传热和传质方面的内容,例如浸出塔传质速率的估算、提取液的热力学性质计算等。
以浸出平衡计算为例,其步骤如下:1.确定混合物的成分:通过实验或其他手段,获得混合物的成分组分,包括所需的目标物质。
2.根据热力学平衡关系,建立分离物质在混合物与溶剂中的分配系数。
该系数表示分离物质在两相中的相对分配情况。
3.在给定温度和溶剂比例下,根据分配系数计算提取液中目标物质浓度。
4.根据计算结果,可以调整溶剂比例、反应温度或溶剂浓度等参数,以提高目标物质的回收率和分离度。
需要注意的是,萃取过程的最终计算结果可能受到外部因素的影响,如反应速率、传质速率、传质过程中的温度变化和浓差极化等。
因此,在进行计算时,需要综合考虑多个因素,进行系统的分析和优化。
综上所述,化工原理中的萃取过程是一种分离技术,其流程包括溶剂选择、混合物预处理、萃取过程和分离过程。
化工原理:10-1 液-液萃取概述

超临界萃取 凝胶萃取 反向胶团萃取
按萃取组分数目分类
萃取
单组分萃取√
多组分萃取
二、萃取操作的应用
萃取操作应用场合
❖ 相对挥发度 1物系的分离
❖ 溶质浓度很低 ,且为难挥发组分物系的分离 ❖ 热敏性物系的分离(从发酵液中对青霉素及咖
啡因的提取)
第十章 液-液萃取和液-固浸取
萃取操作示意图
第十章 液-液萃取和液-固浸取
10.1 液-液萃取概述 10.1.1 萃取的原理与流程 10.1.2 萃取的分类与应用
一、萃取过程的分类
按有无化学反应分类
萃取
物理萃取
化学萃取√
按萃取级数分类
萃取
单级萃取
多级萃取√
多级逆流萃取 多级并流萃取
一、萃取过程的分类
按萃取技术分类
单溶剂萃取√
传质接触面积↓→分离效果↓,此时需要较多的外加能 量用于分散相的建立。
若 LL过小,液体易分散甚至产生乳化现象,难
以分层。
3. L,S S 的L,S↓→利于两相的混合与分层、流
动与传质。若S 的粘度太大,可以用其它溶剂调节。 萃取剂要有良好的化学稳定性,不分解不聚合,
要有足够的热稳定性和抗氧化稳定性,对设备的腐蚀 性要小;应具有较低的凝固点;毒性小、不易燃、来 源充足、价格低廉等。
若S为易挥发组分,则其气化热要小。若S萃取 能力大,则循环量小,E相中S的回收费用低;或S在 B中的溶解度小,也可减小R相中S的回收费用。
若 1,可以考虑用反萃取和结晶的方法分离。
四、萃取剂的其它物性
1. LL↑→液-液分层速度↑→设备生产能力↑ 2. 界面张力 LL LL↑,分散相中的细小液滴易于 聚结,有利于分层;但 LL↑↑,则液体不易分散,
萃取名词解释

萃取名词解释
萃取是利用系统中组分在溶剂中有不同的溶解度来分离混合物的单元操作。
即,是利用物质在两种互不相溶(或微溶)的溶剂中溶解度或分配系数的不同,使溶质物质从一种溶剂内转移到另外一种溶剂中的方法。
广泛应用于化学、冶金、食品等工业,通用于石油炼制工业。
另外将萃取后两种互不相溶的液体分开的操作,叫做分液。
萃取有两种方式:
1.液-液萃取,用选定的溶剂分离液体混合物中某种组分,溶剂必须与被萃取的混合物液体不相溶,具有选择性的溶解能力,而且必须有好的热稳定性和化学稳定性,并有小的毒性和腐蚀性。
如用苯分离煤焦油中的酚;用有机溶剂分离石油馏分中的烯烃等。
2.固-液萃取,也叫浸取,用溶剂分离固体混合物中的组分,如用水浸取甜菜中的糖类;用酒精浸取黄豆中的豆油以提高油产量;用水从中药中浸取有效成分以制取流浸膏叫“渗沥”或“浸沥”。
虽然萃取经常被用在化学试验中,但它的操作过程并不造成被萃取物质化学成分的改变(或说化学反应),所以萃取操作是一个物理过程。
萃取是有机化学实验室中用来提纯和纯化化合物的手段之一。
通过萃取,能从固体或液体混合物中提取出所需要的物质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十章 液-液萃取和液-固浸取1. 25℃时醋酸(A )–庚醇-3(B )–水(S )的平衡数据如本题附表所示。
习题1附表1 溶解度曲线数据(质量分数/%)试求:(1)在直角三角形相图上绘出溶解度曲线及辅助曲线,在直角坐标图上绘出分配曲线。
(2)确定由200 kg 醋酸、200 kg 庚醇-3和400 kg 水组成的混合液的物系点位置。
混合液经充分混合并静置分层后,确定两共轭相的组成和质量。
(3)上述两液层的分配系数A k 及选择性系数β。
(4)从上述混合液中蒸出多少千克水才能成为均相溶液?解:(1)溶解度曲线如附图1中曲线SEPHRJ 所示。
辅助曲线如附图1曲线SNP 所示。
分配曲线如附图2 所示。
(2)和点醋酸的质量分率为25.0400200200200A =++=x水的质量分率为50.0400200200400S =++=x由此可确定和点M 的位置,如附图1所示。
由辅助曲线通过试差作图可确定M 点的差点R 和E 。
由杠杆规则可得kg 260kg 80040134013=⨯==M R()kg 540kg 260800=-=-=R M E由附图1可查得E 相的组成为A SB 0.28,0.71,0.01y y y ===R 相的组成为 A S B 0.20,0.06,0.74x x x ===(3)分配系数A A A 0.281.40.20ykx ===B B B 0.010.01350.74y k x === 选择性系数 7.1030135.04.1B A ===k k β (4)随水分的蒸发,和点M 将沿直线SM 移动,当M 点到达H 点时,物系分层消失,即变为均相物系。
由杠杆规则可得kg 5.494kg 80055345534=⨯==M H 需蒸发的水分量为()kg 5.305kg 5.494800=-=-H M2. 在单级萃取装置中,以纯水为溶剂从含醋酸质量分数为30%的醋酸–庚醇-3混合液中提取醋酸。
已知原料液的处理量为1 000 kg/h ,要求萃余相中醋酸的质量分数不大于10%。
试(1)水的用量;(2)萃余相的量及醋酸的萃取率。
操作条件下的平衡数据见习题1。
解:(1)物系的溶解度曲线及辅助曲线如附图所示。
由原料组成x F =0.3可确定原料的相点F ,由萃余相的组成x A =0.1可确定萃余相的相点R 。
借助辅助曲线,由R 可确定萃取相的相点E 。
联结RE 、FS ,则其交点M 即为萃取操作的物系点。
由杠杆规则可得习题1 附图1 习题1 附图23726F S ⨯=⨯kg 1423kg 100026372637=⨯=⨯=F S (2)由杠杆规则可确定萃余相的量。
4916R M ⨯=⨯ ()kg 791kg 1423100049164916=+==M R 由附图可读得萃取相的组成为 A 0.14y =萃取率=()0.14242379176.2%10000.3⨯-=⨯3. 在三级错流萃取装置中,以纯异丙醚为溶剂从含醋酸质量分数为30%的醋酸水溶液中提取醋酸。
已知原料液的处理量为2000 kg ,每级的异丙醚用量为800 kg ,操作温度为20 ℃,试求(1) 各级排出的萃取相和萃余相的量和组成;(2)若用一级萃取达到同样的残液组成,则需若干千克萃取剂。
20 ℃时醋酸(A )–水(B )–异丙醚(S )的平衡数据如下:习题3附表 20 ℃时醋酸(A )–水(B )–异丙醚()的平衡数据(质量分数)水 相 有 机 相醋酸(A ) 水(B ) 异丙醚(S ) 醋酸(A ) 水(B ) 异丙醚(S ) 0.69 98.1 1.2 0.18 0.5 99.3 1.41 97.1 1.5 0.37 0.7 98.9 2.89 95.5 1.6 0.79 0.8 98.4 6.42 91.7 1.9 1.9 1.0 97.1 13.34 84.4 2.3 4.8 1.9 93.3 25.50 71.7 3.4 11.4 3.9 84.7 36.7 58.9 4.4 21.6 6.9 71.5 44.3 45.1 10.6 31.1 10.8 58.1 46.40 37.1 16.5 36.2 15.1 48.7习题2 附图解:由平衡数据在直角三角形坐标图上绘出溶解度曲线及辅助曲线,如附图所示。
由原料组成x F=0.3,在图中确定原料相点F。
由物料衡算确定一级萃取物系的组成A 20000.30.2142000800x⨯==+S8000.2862000800x==+由此可确定一级萃取物系点M1的位置。
借助辅助曲线,通过试差作图可由M1确定一级萃取的萃取相点E1和萃余相点R1。
由杠杆规则可得115034.5R M⨯=⨯kg19322800kg505.34505.341=⨯==MR()kg868kg19322800111=-=-=RME由附图可读得一级萃取相和萃余相的组成为110.1100.255yx==由R1的量及组成,以及所加萃取剂的量,通过物料衡算可求得二级萃取的物系点M2。
与一级萃取计算方法相同可得2930E=kg21800R=kg220.100.23yx==与二级萃取计算相同,可得三级萃取计算结果3920E=kg习题3 附图31890R =kg330.080.21y x ==(2)若采用一级萃取达到同样的萃取效果,则萃取物系点为附图中的N 点。
由杠杆规则可得37.526.5F S ⨯=⨯ kg 2830kg 20005.265.375.265.37=⨯==F S 4. 在多级错流萃取装置中,以水为溶剂从含乙醛质量分数为6%的乙醛—甲苯混合液中提取乙醛。
已知原料液的处理量为1 200kg/h ,要求最终萃余相中乙醛的质量分数不大于0.5%。
每级中水的用量均为250 kg/h 。
操作条件下,水和甲苯可视为完全不互溶,以乙醛质量比表示的平衡关系为Y =2.2X 。
试求所需的理论级数。
解:(a )直角坐标图解法 在X –Y 直角坐标图上绘出平衡曲线Y =2.2X ,如附图所示。
F F F 0.060.064110.06x X x ===-- 原料中稀释剂的量为()()h kg 1128h kg 06.0112001F =-⨯=-=x F B 操作线的斜率为习题4 附图1128 4.512250B S -=-=- 过X F 作斜率为–4.512的直线,与平衡线交于Y 1,则X F Y 1为一级萃取的操作线。
过Y 1作Y 轴的平行线,与X 轴交于X 1。
过X 1作X F Y 1的平行线,与平衡曲线交于Y 2,X 1Y 2即为二级萃取的操作线。
同理可作以后各级萃取的操作线,其中X i 为第i 级萃余相的组成,直至X n 小于或等于所规定的组成0.005为止。
操作线的条数即为理论级数,即 n =7(b )解析法 由于B 与S 不互溶,故可采用式(10–35)计算理论级数。
F n S 2.20.0640.0050K X X Y ==≈=m 2.22500.48761128KS A B ⨯=== ()()F S n S m 0.064ln ln 0.005 6.4ln 1ln 10.4876X Y K X Y K n A ⎡⎤-⎢⎥-⎣⎦===++ 取n =7也可采用迭代计算求理论级数。
平衡关系为 i i 2.2Y X = 操作关系为()i i i-14.512Y X X =-- 由此可得迭代关系为 i i-10.6722X X =迭代计算结果为0F 12345670.0640.04300.02890.01940.01310.008790.005910.003970.005X X X X X X X X X =========<即所需理论级数为7级。
5. 在多级逆流萃取装置中,以水为溶剂从含丙酮质量分数为40%的丙酮–醋酸乙酯混合液中提取丙酮。
已知原料液的处理量为2 000kg/h ,操作溶剂比(F S )为0.9,要求最终萃余相中丙酮质量分数不大于6%,试求(1)所需的理论级数;(2)萃取液的组成和流量。
操作条件下的平衡数据列于本题附表。
萃取相萃余相丙酮(A)醋酸乙酯(B)水(S)丙酮(A)醋酸乙酯(B)水(S)07.492.6096.3 3.53.28.388.54.891.0 4.26.08.086.09.485.6 5.09.58.382.213.580.5 6.012.89.278.016.677.2 6.214.89.875.420.073.07.017.510.272.322.470.07.621.211.867.027.862.010.226.415.058.632.651.013.2解:(1)由平衡数据在直角三角形坐标图上绘出溶解度曲线及辅助曲线,如附图所示。
由原料组成x F=0.40,在图中确定原料相点F。
F=1000kg/h、S/F=0.9,再根据杠杆规则可确定F、S的和点M。
由最终萃取要求x n=0.06确定R n。
联结R n、M,其延长线与溶解度曲线交于E1,FE1、R n S两线的交点Δ即为操作点。
借助辅助曲线作图可得E1的共轭相点R1(第一级萃取萃余相点),联结R1Δ与溶解度曲线交于E2。
同理可找到R2、R3……,直至萃余相的组成小于0.06为止,操作线的条数即为理论级数。
由作图可得n=6(2)联结S、E1,并延长交AB与E′,E′即为萃取液的相点,读图可得A0.65y'=hkg1800hkg20009.0=⨯=⎪⎭⎫⎝⎛=FFSS()hkg3800hkg18002000=+=+=SFM习题5 附图由杠杆规则可得 135.527E M ⨯=⨯ h kg 2890h kg 38005.35275.35271=⨯==M E 172.529E E '⨯=⨯h kg 1156h kg 5.722928905.72291=⨯=⨯='E E 6. 在多级逆流萃取装置中,以纯氯苯为溶剂从含吡啶质量分数为35%的吡啶水溶液中提取吡啶。
操作溶剂比(F S )为0.8,要求最终萃余相中吡啶质量分数不大于5%。
操作条件下,水和氯苯可视为完全不互溶。
试在X –Y 直角坐标图上求解所需的理论级数,并求操作溶剂用量为最小用量的倍数。
操作条件下的平衡数据列于本题附表。
解:将以质量分数表示的平衡数据转化为质量比表示,其结果列于附表2中。
习题6 附表2由表中数据在–直角坐标系中绘出平衡曲线,如附图中曲线12所示。
由S /F =0.8及x F =0.35可得操作线的斜率0.80.812535165S S SBF A BSB ===⇒=+⎛⎫+ ⎪⎝⎭由最终萃取要求可确定点X n ,n n n 0.050.053110.05x X x ===--过点X n 作斜率为0.8125的直线与直线F F F 0.350.538110.35x X X x ====--交于J ,则X n J 即为操作线。
