cho4
营养师公式总结

人日数计算1.人日数:就餐人数×餐次比概念:1个人吃早、中、晚三餐为1人日。
2.折合系数=各类人群能量推荐摄入量/标准人能能量推荐摄入能量标准人概念:60kg成年男子,从事轻体力劳动,每日能量推荐摄入量为2400kcal。
3.标准人日数=人日数×折合系数(标准人系数)4.混合系数:总标准人日数/总人日数5.平均每日某营养素(食物)摄入量=实际摄入量/总人日数6.标准人每日营养素(食物)摄入量=平均每人每日营养素/混合系数例:人日数计算1.幼儿园小班15人中班18人大班15人早餐20% 中餐40% 晚餐40%小班人日数=就餐人数×餐次比=15人×20%+15人×40%+15人×40%=15人日中班人日数=就餐人数×餐次比=18人×20%+18人×40%+18人×40%=18人日大班人日数=就餐人数×餐次比=15人×20%+15人×40%+15人×40%=15人日总人日数=小班人日数+中班人日数+大班人日数=48人日经计算该幼儿园总人日数为48人日。
例:一单位:轻体力10人中体力12人重体力20人早餐3人8人20人午餐4人6人15人晚餐2人4人17人问题1.该企业总人日数?2.该企业混合系数?3.假如每日摄入米饭4800g,平均每人米饭摄入量?标准人每日米饭摄入量?答:1. 三餐餐次比为:30% 40% 30%轻体力人日数=3人×30%+4人×40%+2人×30%=3.1人日中体力人日数=8人×30%+6人×40%+4人×30%=6人日重体力人日数=20人×30%+15人×40%+17人×30%=17.1人日总人日数=轻体力人日数+中体力人日数+重体力人日数=26.2人日经计算该企业总人日数为26.2人日。
化学习题答案
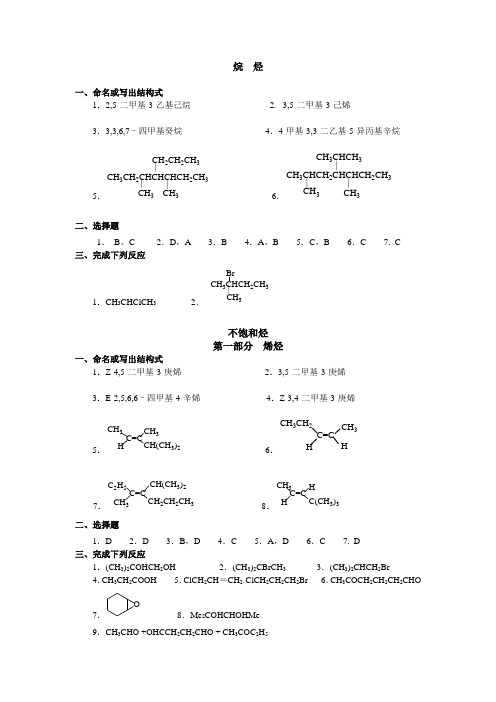
烷烃一、命名或写出结构式1.2,5-二甲基-3-乙基己烷2.3,5-二甲基-3-己烯3.3,3,6,7–四甲基癸烷4.4-甲基-3,3-二乙基-5-异丙基辛烷5.CH3CH2CHCHCHCH2CH3|CH3|CH2CH2CH3|CH36.CH3CHCH2CHCHCH2CH3|CH3|CH3CHCH3|CH3二、选择题1.B、C 2.D,A 3.B 4.A,B 5.C,B 6.C 7. C 三、完成下列反应1.CH3CHClCH32.|CH3CH3CHCH2CH3Br不饱和烃第一部分烯烃一、命名或写出结构式1.Z-4,5-二甲基-3-庚烯2.3,5-二甲基-3-庚烯3.E-2,5,6,6–四甲基-4-辛烯4.Z-3,4-二甲基-3-庚烯5.CH3CH3H3)2C=C6.CH3CH2C=CCH3H H7.C2H5CH(CH3)2CH3CH2CH2CH3C=C8.CH3HH C(CH3)3C=C二、选择题1.D 2.D 3.B,D 4.C 5.A,D 6.C 7. D三、完成下列反应1.(CH3)2COHCH2OH 2.(CH3)2CBrCH33.(CH3)2CHCH2Br4.CH3CH2COOH 5.ClCH2CH=CH2,ClCH2CH2CH2Br 6.CH3COCH2CH2CH2CHO7.O8.Me2COHCHOHMe9.CH3CHO +OHCCH2CH2CHO + CH3COC2H510.CH 3COCH 3 + CH 3CH 2CHO 11.||ClOH四、推断结构1.解:H 2催化剂AB ||2(1)O 3OHCCH 2CH 2CHOA||2.解:(1)CH 2=C(CH 3)2 (2) CH 3CH=CHC(CH 3)2 (3)CH 3或CH 3(4) CH 3CH 2CH=CHCH 2CH 3五、由指定有机原料合成下列化合物解:1.CH 3CH =CH 2−−−−→−︒C Cl 500/2CH 2=CHCH 2Cl −→−2Br T.M 2.CH 3CHOHCH 3−−−→−∆/42SO H CH 3CH =CH 2−−→−HOBr T.M3.CH 3CHOHCH 3−−−→−∆/42SO H CH 3CH =CH 2−−−−→−22/O H HBr T.M4.Cl第二部分 炔烃和二烯烃一、命名或写出结构式1.2,2-二甲基-3-庚炔 2.6-溴己炔 3.1,4-己二烯4.4-甲基-2-己炔 5.2,2,6,6-四甲-3-庚炔 6.3-丁基-1,6-庚二烯7.(CH 3)2CHC ≡CC(CH 3)3 8.(CH 3)3CC ≡C CH 2CH 2CH 39.CH 2=C(CH 3)CH=CHCH 2CH 3 10.HC ≡CCH=CHCH 3 二、选择题1.C 2.A 3.C 4. B 5.C 三、完成下列反应1.CH 3CH 2CH 2C(Br)=CH 2 2. CHO3.CH 3CH 2C(CN)=CH 24.CH 3COCH 3 5. CHCH=CH 2 + BrCH 2C=CHCH 3_BrCH 2_|CH 3|CH 36.C=CHCH 2Br_CH 3|CH 3四、鉴定与提纯1.解:⎪⎪⎩⎪⎪⎨⎧⎪⎩⎪⎨⎧−→−−−→−−−−−→−−−→−−−→−−−−→−↓+C B ANH Ag CCl Br 无白色褪色不褪色未知物2342)(/ 2.解:⎪⎪⎪⎩⎪⎪⎪⎨⎧−−−→−⎪⎪⎩⎪⎪⎨⎧⎪⎩⎪⎨⎧−→−−−→−−−−−→−−→−−−→−−−−−→−−−→−−−−→−↓↓+A B D CNH Ag CCl Br 不褪色无白色顺丁烯二酸酐无白色褪色未知物2342)(/ 五、推断结构1.解:ClCH 2CH =CH 2−−−−←高温/2Cl CH 3CH =CH 3−−−→−低温/2Cl CH 3CHClCH 2ClC A B↓C 2H 5MgICH 3CH 2CH 2CH =CH 2−−→−NBS CH 3CH 2CHBrCH =CH 2 D E ↓KOH ―EtOHCH 3CH =CHCH =CH 2 FO O O+O OOO O O+O O O2.解:A CH 3CH=CC ≡CH_C 2H 52H 5B CH 3CH=CCH=CH 2CH 3C C O==OO_C 2H 5_六、以乙炔为原料合成下列化合物解:1.2CH ≡CHCH ≡CCH=CH 2H 24Cu 2Cl 2CH 2=CHCH=CH 2CH ≡CH224CH 2TM2.3CH ≡CNaC 2H 5ClCH 3CH 2C ≡CHH 2O424NaNH 2TMCH ≡环 烃一、命名或写出结构式1.3-甲基环己烯 2.反-1-甲基-4-乙基环己烷 3.4-硝基-2-氯甲苯4.3-甲基-4-硝基苯磺酸 5.3,5-二溴乙苯 6.对溴苯胺7.8.CH 3 9.|NH 2ClBr10.NO 2二、选择题1.D 2.A 3.A ,C 4.A 5.A 6.D 7.B 8. A , B 9. B 10. B 11.B 三、完成下列反应1.(CH 3)2CHCBr(CH 3)2 2.COOH CH 3H 3C+CH 3COOH3.C(CH 3)3C(CH 3)3H 3CH 2C C(CH 3)3HOOC4. O5.CH 3CH 3 +ClCl四、鉴定下列化合物1.解:⎪⎪⎩⎪⎪⎨⎧⎪⎩⎪⎨⎧−−→−−−→−−−−→−−−→−−−→−−−−→−C B A KMnO CCl Br 褪色不褪色褪色不褪色未知物442/ 2.解:⎪⎪⎪⎪⎩⎪⎪⎪⎪⎨⎧⎪⎩⎪⎨⎧−−→−−−→−−−−→−−−→−⎪⎪⎩⎪⎪⎨⎧⎪⎩⎪⎨⎧−→−−→−−−−−→−−→−−→−−−−→−−−→−−→−↓↓+E A D C BKMnO NH Ag Br 不褪色褪色不褪色无白顺丁烯二酸酐无白褪色未知物4232)( 五、推断结构1.解:ACH 3 B C CH 3CH 2CHBrCH 3 D CH 3CH 2CH 2CH 3BrCH 3+Br 2BrCH 2CH 2CHBrCH 3CH 3+HBr CH 3CH 2CHBrCH 3+HBrCH 3CH 2CH 2CH 2Br2.解:构造式及有关的反应式:C CH 332C CH 3CCuAC CH 3C 2H 5CH 3CHH 2/cat-H 2OO OOB CDCCH 3CH+E3.解:+COOHH 2SO 4HNO 3NO 2_CH 2CH 2CH 3[O]_|___CH 2CH 2CH 3CH 2CH 2CH 3NO 2AH 2SO 4HNO 3NO 2|C|_|CH 3CH 3CH 3|_|COOHCOOHCOOH|_|CH 3CH 3CH 3六、以甲苯为原料合成下列化合物1.CH 33CH ||NO 24|KMnO 4||COOHNO 22.|3223_CH 3CH 3CH(CH 3)23.BrBr 2NO2|CH 3_CH 3_FeBr 3BrCOOH3H 2SO 4Br __COOH4.CH 32|||_||NO 2CH 3324BrCH 3NO 2|Br旋光异构一、命名或写出结构式1.(3R)-4-甲基-3-溴戊烯 2.(2R,3S)-2,3-二甲基-2,3-二羟基丁二酸3.(2S ,3S)-3-氯-2-丁醇 4.(R)-2,3-二甲基己烷 5.(R)-2-氯丙酸6.3C ≡CHH CH 2CH 3 7.6H 13-n IH CH 38.6H 5H HOCH 39.HHC 2H 5C 2H 5NO 2NO 2 10.C 2H 5H HOCH 3二、选择题1.C 2.D 3.D 4. A 5. D 6. A 7.D卤代烃一、命名或写出结构式1.(E)-4,4-二甲基-3-氯甲基-2-戊烯 2.2,4,4-三甲基-2-溴戊烷3.3-甲基-4-氯环戊烯 4.2-甲基-3-氯-6-溴-1,4-己二烯5.顺-1-氯-3-溴环己烷 6.2-溴-1-己烯-4-炔7.CHClC 2H 5C 2H 5H H 3C 8. HC ≡CCHCHCH 2CH 3C 2H 5_Cl _9.CH 2=CHCH 2Cl 10.ClCH 2Cl二、选择题1.D ,A 2.A ,B 3.A ,B 4.C 5.A 6.B,C,D,F/A,E 三、完成下列反应1. C 6H 5CH 2MgCl ,C 6H 5CH 2COOMgCl ,C 6H 5CH 2COOH 2.CH 2=CHCH 2OC 2H 5 3.MgBrCH 3,CH 34. Br Br, ,CHO5. CH 2ClCl四、写出下列反应机理解:CH 3CHCHCH 3CH 3Cl3CHCHCH 3CH 3+OH 2CH 3CCH 2CH CH 3+OH 2H 2O CH 3CHCHCH CH 3+CH 3CHCH 2CH 3CH 3+H 2O -H +-H +3CHCHCH 3CH 3OH 3CCH 2CH 3CH 3OH五、推断结构1.解:A CH 3CH 2CH 2CH 2Br B (CH 3)3CBr C C 2H 5CHBrCH 32.解:CH 3CH 2CH 2Br −−−−→−-EtOHKOHCH 3CH=CH 2−−→−HBr CH 3CHBrCH 3 A B C六、由2-甲基-1-溴丙烷及其它无机试剂制备下列化合物解:1.(CH 3)2CHCH 2Br −−−−→−-EtOHKOHT.M 2.(CH 3)2CHCH 2Br −−→−NaOHT.M 3.(CH 3)2CHCH 2Br −−−−→−-EtOHKOH (CH 3)2C=CH 2−−→−HBr T.M 4.(CH 3)2CHCH 2Br −−−−→−-EtOH KOH (CH 3)2C=CH 2−→−2Br T.M 5.(CH 3)2CHCH 2Br −−−−→−-EtOH KOH (CH 3)2C=CH 2−−→−HOBr T.M醇酚醚一、命名或写出结构式1.4-羟基-2-戊烯 2.2-苯基乙醇 3.乙基异丙基醚4.苯乙醚 5.1-甲基环己醇 6.1,2-环氧丁烷7.2-甲基-4-乙基苯酚 8.4,5-二甲基萘酚9.CHOH |CH 2OHCH 2OH 10.CH 2OH11.O O12.NO 2OHNO 2O 2N13.OHOCH 3OCH 3二、选择题1.B ,C 2.A ,C 3. A/B ,D/D 4.D 5.C 6.C三、完成下列反应1.CH 2BrHO2. CH 3COCH 33.CH 3CHCH 2OH OCH 3 ,CH 2=CHCH 2CHCH 3OH 4.HO + CH 3I5. CH 3CHCH 2OCH 3OH 6.,Br Br7. CH 3I+CH 3CH 2CH 2OH 8. BrCH 2CH 2CH 2CH 2CH 2Br9.,OHOH ,HOC(CH 2)4CHO 四、用化学方法鉴别下列各组化合物1.解:⎪⎪⎩⎪⎪⎨⎧−→−⎪⎩⎪⎨⎧−→−−−→−−−→−−−→−−→−↑B AC FeCl H Na无无紫色未知物32 2.解:⎪⎪⎩⎪⎪⎨⎧−→−⎪⎩⎪⎨⎧−→−−−→−−−→−−−→−−→−↑B C A FeCl H Na 无无紫色未知物32 五、推断结构1.解:AOH OHCH 3CH 3BCH 3CH 3 C H 3C H 3C OHOH2.解:A .CH 3CH 2OCHMe 2 B .CH 3CH 2Br C .BrCHMe 2D .CH 3CH 2OHE .HOCHMe 2F .CH 3CHOG .CH 3COCH 3六、合成1.解:CH 2=CHCH 3−−−−→−22/O H HBr CH 3CH 2CH 2Br −−→−-OH CH 3CH 2CH 2OH −→−Na CH 3CH 2CH 2ONa CH 2=CHCH 3−−→−NBS CH 2=CHCH 2Br −−−−−→−ONaCH CH CH 223T.M 2.解:PhCH 3−−→−NBSPhCH 2Br −−→−-OHT.M 七、写出下列反应机理解:H 3C CH 3OH H+H 3CCH 3OH +2H 3CCH333醛酮一、命名或写出结构式1.2-羟基-4-甲氧基苯乙酮 2.对甲基苯甲醛 3.苯乙醛 3.2-甲基丙醛 4.3-甲基丁酮 5.丙烯醛 6.2,5-己二酮 7.OO8.CH 3CH 2COCH 2CHO 9.BrCH 2CHCHO10.PhCOCH 3 11.Cl 3CCH 2COCH 2CH 3二、选择题1.AC/D 2.A 3.D/A 4.B 5.D 6.BC 7.A/B 8.D 9.D 10.D三、完成下列反应1. NNHC 6H 52. CH 3CCH 2CH 3NOH3.CH 3CH 2CHOHCH(CH 3)CHO 4.ArCC 2H 5OHCH 35.(CH 3)3CCOOH + (CH 3)3CCH 2OH 6 .ArCH=CHCOCH3 7.BrCH 2CH 2COCH 38.CNCH=CHCHO + CH 2=CHCHOHCN 9.ArCOCH 2Cl 10.ArCOOH + CHCl3四、鉴别下列各组化合物1.解:⎪⎪⎪⎩⎪⎪⎪⎨⎧⎪⎩⎪⎨⎧−→−−−→−−−−→−−→−⎪⎩⎪⎨⎧−→−−−→−−−−→−−−→−−−−−−→−↓-↓-↓C D A B NaOHI NaOH I 无黄无无黄黄二硝基苯肼未知物22-4,2 2.解:⎪⎪⎪⎩⎪⎪⎪⎨⎧−→−⎪⎪⎩⎪⎪⎨⎧⎪⎩⎪⎨⎧−→−−−→−−−−→−−→−−−→−−−−→−−→−−−−→−↓↓-↓+D C A BAg NH Ag NaOH I NaHSO 无无无黄白未知物2323)(3.解:⎪⎪⎪⎪⎩⎪⎪⎪⎪⎨⎧⎪⎪⎩⎪⎪⎨⎧−→−⎪⎩⎪⎨⎧−→−−−→−−−→−−−→−−→−−→−⎪⎩⎪⎨⎧−→−−−→−−−−→−−−→−−−−−−→−↑↓↓+A C B E D FeCl H Na Ag NH Ag 无无紫色无无黄二硝基苯肼未知物3223)(-4,2 五、推断结构1.解:A CH 3COCH=CHCH 3 CH 3COCH 2CH(CH 3)2 C (CH 3)2CH(OH)CH=CHCH 3D CH 3CH=CHC(CH 3)=CH 2E CH 3H 3COH OH2.解:A CH 3OB CH 3HO OC CH 3CH 2D CH 3CH 3ECOCH 3CHOH 3CFCOCH 3COOH H 3C六、合成解:1.2CH 3COCH 3−−−→−NaOH%5 (CH 3)2COHCH 2COCH 3−−−→−-∆OH 2/(CH 3)2C=CHCOCH 3−−−−−→−+HNaOH I )2(;/)1(2(CH 3)2C=CHCOOH2.解:CH 2=CH 2−−−→−∆+,/2H O H CH 3CH 2OH −−−→−莎瑞特试剂CH 3CHO↓HClCH 3CH 2Cl −−−→−OEt Mg 2/CH 3CH 2MgCl −−−−−−→−+OH H CHO CH 23,)2(,)1(T.M 3.解:CH 3CH 2CH =CH 2−−−→−∆+,/2H O H CH 3CH 2CHOHCH 3−−−−→−∆+,/722H O Cr K3+CH 3CCH 2CH 3CNOHCH 3CH 2COCH CH 3CCH 2CH 3COOHOH4.解:CH 3CH 3CH 3COCH 2CH 2Br 22H +CH 3CH 3H 3CCCH 2CH 2BrO O2CH 3CH 3H 3CCCH 2CH 2MgBrO OT.M。
有机化学-第五版答案(完整版)

《有机化学》(第五版,李景宁主编)习题答案 第一章3、指出下列各化合物所含官能团的名称。
(1) CH 3CH=CHCH 3 答:碳碳双键 (2) CH 3CH 2Cl 答:卤素(氯) (3) CH 3CHCH 3OH 答:羟基(4) CH 3CH 2 C=O 答:羰基 (醛基)H(5)CH 3CCH 3O答:羰基 (酮基)(6) CH 3CH 2COOH 答:羧基 (7)NH 2答:氨基(8) CH 3-C ≡C-CH 3 答:碳碳叁键4、根据电负性数据,用和标明下列键或分子中带部分正电荷和负电荷的原子。
答:6、下列各化合物哪个有偶极矩?画出其方向(1)Br 2 (2) CH 2Cl 2 (3)HI (4) CHCl 3 (5)CH 3OH (6)CH 3OCH 3 答:以上化合物中(2)、(3)、(4)、(5)、(6)均有偶极矩(2)H 2C Cl (3)I (4) Cl 3 (5)H3COH(6)H3CCH 37、一种化合物,在燃烧分析中发现含有84%的碳[Ar (C )=12.0]和16的氢[Ar (H )=1.0],这个化合物的分子式可能是(1)CH 4O (2)C 6H 14O 2 (3)C 7H 16 (4)C 6H 10 (5)C 14H 22 答:根据分析结果,化合物中没有氧元素,因而不可能是化合物(1)和(2); 在化合物(3)、(4)、(5)中根据碳、氢的比例计算(计算略)可判断这个化合物的分子式可能是(3)。
第二章习题解答1、用系统命名法命名下列化合物 (1)2,5-二甲基-3-乙基己烷 (3)3,4,4,6-四甲基辛烷 (5)3,3,6,7-四甲基癸烷(6)4-甲基-3,3-二乙基-5-异丙基辛烷2、写出下列化合物的构造式和键线式,并用系统命名法命名之。
(3)仅含有伯氢和仲氢的C 5H 12答:符合条件的构造式为CH 3CH 2CH 2CH 2CH 3;键线式为; 命名:戊烷。
第四章合成气的生产过程

1.8737 107 T2 11.894
lg K P2
2.183 T
0.09361 lg T 0.632 103 T
1.08 107 T2 2.298
图解法或迭代法求 解x,y
c. 影响转化反应平衡组成的因素 水碳比 反应温度 反应压力
水碳比的影响
P=3.5MPa、T=800℃
水碳比
水碳比为2
甲烷平衡含量% 5.0 2.0 1.0 0.5 0.2
压力 (MPa)
温度 ℃
1
800 870 910 950 1000
2
870 950 1000 1030 1100
4
940 1020 1080 1130 1200
温度增加,甲烷平衡含量下降
(3)反应动力学 在镍催化剂表面甲烷和水蒸汽解离成次甲基和原子态氧, 并在催化剂表面吸附与互相作用,生成CO、CO2和H2
2 4 6
甲烷平衡含量(%)
18.0 7.9 1.0
水碳比越高,甲烷平衡含量越低。
反应压力影响
甲烷平衡含量%
反应压力 MPa 水碳比=2、T=800℃
• 压力增加,甲烷平衡 含量也随之增大。
• 在烃类蒸汽转化方法 的发展过程中,压力 都在逐步提高,主要 原因是加压比常压转 化经济效果好。
反应温度的影响
催化剂中毒 a S S≤0.5ppm,可逆性中毒
催化剂活性越高,允许S含量越低。 温度越低,S对镍催化剂毒害越大。 b As 永久性中毒
As来源:含As碱液脱碳 c 卤素 卤素 ≤0.5ppm,永久性中毒
催化剂活性下降判断方法:
甲烷含量升高;平衡温距增大;“红管”现象
(6)工业生产方法 甲烷蒸汽转化过程中控制的主要工艺条件是温度、压力、 水碳比、空气加入量等。同时还要考虑到炉型、原料、炉 管材料、催化剂等对这些参数的影响。参数的确定,不仅 要考虑对本工序的影响,也要考虑对压缩、合成等工序的 影响,合理的工艺条件最终应在总能耗和投资上体现出来。
高中有机化学方程式总结

高中有机化学方程式总结一、烃1. 烷烃 —通式:C n H 2n -21氧化反应①甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O②甲烷不可使酸性高锰酸钾溶液及溴水褪色; 2取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl二氯甲烷:CH 3Cl+Cl 2 CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HClCHCl 3又叫氯仿四氯化碳:CHCl 3+Cl 2 CCl 4+HCl3分解反应CH 4 C+2H 22. 烯烃 —通式:C n H 2n乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O 1氧化反应①乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2②乙烯可以使酸性高锰酸钾溶液褪色,2加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br 与氢气加成:H 2C=CH 2+H 2 CH 3CH 3与氯化氢加成: H 2C=CH 2+HCl CH 32Cl与水加成:H 2C=CH 2+H 2O CH 3CH 2OH 3聚合反应乙烯加聚,生成聚乙烯:n H 2C=CH n3. 炔烃 —通式:C n H 2n-2乙炔的制取:CaC 2+2H 2O HC ≡CH↑+CaOH 2 1氧化反应①乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O②乙炔可以使酸性高锰酸钾溶液褪色,2加成反应与溴水加成:HC ≡CH+Br 2 HC=CHBr CHBr=CHBr+Br 2 CHBr 2—CHBr 2与氢气加成:HC ≡CH+H 2 H 2C=CH 2与氯化氢加成:HC ≡CH+HCl CH 2=CHCl 3聚合反应氯乙烯加聚,得到聚氯乙烯:n CH 2n乙炔加聚,得到聚乙炔:n HC ≡n 4. 苯 C 6H 6点燃光光光光浓硫酸170℃ 点燃催化剂 △ 催化剂加热加压 2-CH 2图1 乙烯的制取点燃图2 乙炔的制取催化剂△催化剂△Br2—CHClCH=CH催化剂 △高温1氧化反应①苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O②苯不能使溴水和酸性高锰酸钾溶液褪色; 2取代反应 ①苯与溴反应+HO 3加成反应环己烷5. 甲苯 苯的同系物通式:C n H 2n-61氧化反应①甲苯的燃烧:C 7H 8+9O 2 7CO 2+4H 2O②甲苯不能使溴水褪色,但可以使酸性高锰酸钾溶液褪色; 2取代反应3加成反应二、烃的衍生物点燃点燃+Br +3H CH 3| +3HNO 3浓硫酸 △ O 2N — CH 3 | —NO 2| NO 2 +3H 2O 三硝基甲苯TNT,是一种淡黄色晶体,不溶于水;它是一种烈性炸药CH 3 | + Cl 2 光CH 2Cl | + HCl CH 3 | + Cl 2 Fe CH 3 |+ HCl —Cl 甲苯和氯气在光照和铁的催化条件下发生的取代反应不一样 CH 3 |+ 3H 2 催化剂△ CH 3|烃的衍生物的重要类别和主要化学性质:6. 卤代烃1取代反应溴乙烷的水解:C 2H 5—Br+NaOH C 2H 5—OH+NaBr2消去反应溴乙烷与NaOH 溶液反应:CH 3CH 2Br+NaOH CH 2=CH 2↑+NaBr+H 2O7. 醇1与钠反应乙醇与钠反应:2CH 3CH 2OH+2Na 2CH 3CH 2ONa+H 2↑乙醇钠2氧化反应①乙醇的燃烧;②2CH 3CH 2OH+O 2 2CH 3CHO+2H 2O 乙醛3取代反应乙醇与浓氢溴酸反应:CH 3CH 2OH+HBr CH 3CH 2Br+H 2O4消去反应CH 3CH 2OH H 2C=CH 2↑+H 2O 注意:该反应加热到140℃时,乙醇进行另一种脱水方式,生成乙醚; 2C 2H 5OH C 2H 5—O —C 2H 5+H 2O 乙醚5酯化反应CH 3CH 2—OH+C 2H 5—OH CH 3—C —OC 2H 5+H 2O 乙酸乙酯8. 苯酚苯酚是无色晶体,露置在空气中会因氧化显粉红色;苯酚具有特殊的气味,熔点43℃, 水中溶解度不大,易溶于有机溶剂;苯酚有毒,是一种重要的化工原料;H 2O醇△Cu 或Ag△浓硫酸140℃ 浓硫酸170℃ △浓硫酸△1苯酚的酸性苯酚钠 苯酚钠与CO 2反应:+CO 2+H 2O +NaHCO 32取代反应+3Br 2 ↓+3HBr三溴苯酚 3显色反应苯酚能和FeCl 3溶液反应,使溶液呈紫色 4缩聚反应9. 醛乙醛是无色无味,具有刺激性气味的液体,沸点20.8℃,密度比水小,易挥发;1加成反应 乙醛与氢气反应:CH 3—C —H+H 2 CH 3CH 2OH2氧化反应 乙醛与氧气反应:2CH 3—C —H+O 2 2CH 3COOH 乙酸乙醛的银镜反应:CH 3CHO +2AgNH 32OH CH 3COONH 4+2Ag↓+3NH 3+H 2O注意:硝酸银与氨水配制而成的银氨溶液中含有AgNH 32OH 氢氧化二氨合银, 这是一种弱氧化剂,可以氧化乙醛,生成Ag;有关制备的方程式:Ag ++NH 3·H 2O===AgOH↓++4NHAgOH+2NH 3·H 2O===AgNH 32++OH -+2H 2O乙醛还原氢氧化铜:CH 3CHO+2CuOH 2 CH 3COOH+Cu 2O↓+2H 2O10. 羧酸1乙酸的酸性乙酸的电离:CH 3COOH CH 3COO -+H+2酯化反应CH 3CH 2—OH+C 2H 5—OH CH 3—C —OC 2H 5+H 2O 乙酸乙酯注意:酸和醇起作用,生成酯和水的反应叫做酯化反应;11. 酯乙酸乙酯是一种带有香味的无色油状液体; 1水解反应—OH +NaOH +H 2O —ONa —ONa—OH—OH—BrBr — OH| Br |O || 催化剂△O || 催化剂△△△O ||浓硫酸 △无机酸催化剂酚醛树脂的制取CH 3COOC 2H 5+H 2O CH 3COOH+C 2H 5OH 2中和反应CH 3COOC 2H 5+NaOH CH 3COONa+C 2H 5OH注意:酚酯类碱水解如: 的水解 +2NaOH→CH 3COONa+ + H 2O其他1葡萄糖的银镜反应 CH 2OHCHOH 4CHO +2AgNH 32OH CH2OHCHOH 4COONH 4+2Ag +3NH 3+H 2O2蔗糖的水解 C 12H 22O 11+ H 2OC 6H 12O 6 + C 6H 12O 6蔗糖 葡萄糖 果糖 3麦芽糖的水解 C 12H 22O 11 + H 2O2C 6H 12O 6麦芽糖 葡萄糖 4淀粉的水解:5葡萄糖变酒精 CH 2OHCHOH 4CHO 2CH 3CH 2OH +2CO 26纤维素水解7油酸甘油酯的氢化8硬脂酸甘油酯水解 ①酸性条件②碱性条件皂化反应附加:官能团转化示意图CH 3COO - -ONa CH 3COO -烃三、有机合成的常用方法 1、官能团的引入:在有机化学中,卤代烃可谓烃及烃的衍生物的桥梁,只要能得到卤代烃,就可能得到诸如含有羟基、醛基、羧基、酯基等官能团的物质;此外,由于卤代烃可以和醇类相互转化,因此在有机合成中,如果能引入羟基,也和引入卤原子的效果一样,其他有机物都可以信手拈来;同时引入羟基和引入双键往往是改变碳原子骨架的捷径,因此官能团的引入着重总结羟基、卤原子、双键的引入; 1引入羟基-OH①醇羟基的引入:a.烯烃与水加成;b.卤代烃碱性水解;c.醛酮与氢气加成;d.酯的水解; ②酚羟基的引入:酚钠盐过渡中通入CO 2 、的碱性水解等;③羧羟基的引入:醛氧化为酸被新制CuOH 2悬浊液或银氨溶液氧化、酯的水解等; 2引入卤原子:a.烃与X 2取代;b.不饱和烃与HX 或X 2加成;c.醇与HX 取代; 3引入双键:a.某些醇或卤代烃的消去引入C=C ;b.醇的氧化引入C=O; 2、官能团的消除1通过加成反应消除不饱和键;2通过消去、氧化或酯化等消除羟基-OH 3通过加成或氧化等消除醛基—CHO 4通过取代或消去消除卤素原子; 3、官能团间的衍变①利用官能团的衍生关系进行衍变,如伯醇[]−→−O 醛[]−→−O 羧酸;②通过某种化学途径使一个官能团变为两个,如一元醇经过消去、加成、取代变成二元醇如CH 3CH 2OH OH 2-−−→−消去CH 2=CH 22Cl +−−→−加成Cl —CH 2—CH 2—Cl−−→−水解HO —CH 2—CH 2—OH; ③通过某种手段,改变官能团位置;如丙醇 丙烯 2-丙醇 4、有机化学中碳链的增减方法 1增长碳链的方法①加聚反应:如nCH 3CH=CH 2消去加成H 2O一定条件下催化剂②缩聚反应:如③加成反应:如④酯化反应:如⑤卤代烃的取代反应:如⑥醛酮与HCN、ROH的加成反应:如2减短碳链的方法①氧化反应;包括燃烧,烯烃、炔烃的部分氧化,丁烷直接氧化成乙酸,某些苯的同系物氧化成苯甲酸,羧酸钠盐在碱石灰条件下的脱羧反应;②水解反应;主要包括酯的水解、蛋白质的水解和多糖的水解;5、常见有机官能团的保护1物质检验中碳碳双键与醛基的先后处理检验碳碳双键时,当有机物中含有醛基、碳碳双键等多个官能团时,可以先用弱氧化剂,如银氨溶液、新制的CuOH2悬浊液等氧化醛基,再用溴水、酸性KMnO4溶液进行碳碳双键的检验;2物质合成中酚羟基的保护由于酚羟基易被氧化,在有机合成中,如果需要用氧化剂进行氧化时,经常先将酚羟基通过酯化反应,使其成为酯而被保护,待氧化过程完成后,再通过水解反应,使酚羟基恢复;也可用NaOH处理成-ONa,再加H+复原;3为防止醇-OH被氧化可先将其酯化;4芳香胺-NH2的保护:转化为酰胺保护氨基;1.能使溴水Br2/H2O褪色的物质1有机物①通过加成反应使之褪色:含有、—C≡C—的不饱和化合物②通过取代反应使之褪色:酚类注意:苯酚溶液遇浓溴水时,除褪色现象之外还产生白色沉淀;③通过氧化反应使之褪色:含有—CHO醛基的有机物有水参加反应注意:纯净的只含有—CHO醛基的有机物不能使溴的四氯化碳溶液褪色④通过萃取使之褪色:液态烷烃、环烷烃、苯及其同系物、饱和卤代烃、饱和酯2无机物①通过与碱发生歧化反应3Br2 + 6OH- =5Br- + BrO3- + 3H2O或Br2 + 2OH- = Br- + BrO- + H2O②与还原性物质发生氧化还原反应,如H2S、S2-、SO2、SO32-、I-、Fe2+2.能使酸性高锰酸钾溶液KMnO4/H+褪色的物质1有机物:含有、—C≡C—、—OH较慢、—CHO的物质与苯环相连的侧链碳碳上有氢原子的苯的同系物与苯不反应2无机物:与还原性物质发生氧化还原反应,如H2S、S2-、SO2、SO32-、Br-、I-、Fe2+ 3.与Na反应的有机物:含有—OH、—COOH的有机物与NaOH反应的有机物:常温下,易与含有酚羟基...、—COOH的有机物反应加热时,能与卤代烃、酯反应取代反应与Na2CO3反应的有机物:含有酚.羟基的有机物反应生成酚钠和NaHCO3;含有—COOH的有机物反应生成羧酸钠,并放出CO2气体;含有—SO3H的有机物反应生成磺酸钠并放出CO2气体;与NaHCO3反应的有机物:含有-COOH、-SO3H的有机物反应生成羧酸钠、磺酸钠并放出等物质的量的CO2; 4.银镜反应的有机物1发生银镜反应的有机物:含有—CHO的物质:醛、甲酸、甲酸盐、甲酸酯、还原性糖葡萄糖、麦芽糖等2银氨溶液AgNH32OH多伦试剂的配制:向一定量2%的AgNO3溶液中逐滴加入2%的稀氨水至刚刚产生的沉淀恰好完全溶解消失;3实验现象:①反应液由澄清变成灰黑色浑浊;②试管内壁有银白色金属析出4有关反应方程式:AgNO3 + NH3·H2O == AgOH↓ + NH4NO3AgOH + 2NH3·H2O == AgNH32OH + 2H2O银镜反应的一般通式:RCHO + 2AgNH32OH 2 Ag↓+ RCOONH4 + 3NH3 + H2O悬浊液斐林试剂的反应5.与新制CuOH21有机物:羧酸中和、甲酸先中和,后氧化、醛、还原性糖葡萄糖、麦芽糖、甘油等多羟基化合物;2斐林试剂的配制:向一定量10%的NaOH溶液中,滴加几滴2%的CuSO4溶液,得到蓝色絮状悬浊液;3实验现象:①若有机物只有醛基-CHO,则滴入新制的CuOH2悬浊液中,常温时无变化,加热煮沸后有砖红色沉淀生成②若有机物为多羟基醛如葡萄糖,则滴入新制的氢氧化铜悬浊液中,常温时溶解变成绛蓝色溶液,加热煮沸后有砖红色沉淀生成4有关反应方程式:2NaOH + CuSO4 == CuOH2↓+ Na2SO4RCHO + 2CuOH2RCOOH + Cu2O↓+ 2H2OHCHO + 4CuOH2CO2 + 2Cu2O↓+ 5H2O巩固练习:1,乙酸苯甲酯可用作茉莉、白兰、月下香等香精的调合香料;它可以用甲苯和乙醇为原料进行人工合成;合成路线:1C 的结构简式为__________________________;2反应②、③的反应类型为_______________,_______________; 3甲苯的一氯代物有 种;4写出反应①的化学方程式_______________________________;5为了提高乙酸苯甲酯的产率应采取的措施是写一项 ; 2,下面是一个合成反应的流程图A BCH 2=CH 2 BrCH 2-CH 2Br C请写出:1.中间产物A 、B 、C 的结构简式:A .__________B . ________ C .____________ 2.①、②、③、④各步反应所需用的反应试剂及各步反应的类型①________、_______②__________、_______③________、______④________、______3,分子式为C 12H 14O 2的F 有机物广泛用于香精的调香剂;为了合成该物质,某实验室的科技人员设计了下列合成路线:1A 物质在核磁共振氢谱中能呈现 种峰;峰面积比为 2C 物质的官能团名称3上述合成路线中属于取代反应的是 填编号;4写出反应④、⑤、⑥的化学方程式:④ ⑤ ⑥5F 有多种同分异构体,请写出符合下列条件的所有结构简式:①属于芳香族化合物,且含有与F 相同的官能团;②苯环上有两个取代基,且苯环上的一氯代物只有两种;③其中一个取代基为-CH 2COOCH 3; 4,菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸发生酯化反应的产物;⑴甲一定含有的官能团的名称是 ;⑵5.8g 甲完全燃烧可产生0.3mol CO 2和0.3 mol H 2O,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,其结构简式是 ;⑶苯氧乙酸有多种酯类的同分异构体,其中能与FeCl 3溶液发生显色反应,且有2种一硝基取代物的同分异构体是写出任意2种的结构简式 ;CH CH 3Cl 2 光 ① CH 2OH CH 2OH ② 催化剂 CHO CHO O 2 催化剂 ③ △ NaOH 水溶液 ④COOCH 2CH 2OH COOCH 2CH 2OH⑷已知:R-CH 2-COOH 2Cl −−−→催化剂R-ONa 'Cl-R∆−−−→R-O-R′R -、R′-代表烃基 菠萝酯的合成路线如下:①试剂X 不可选用的是选填字母 ;a. CH 3COONa 溶液b. NaOH 溶液c. NaHCO 3溶液d.Na②丙的结构简式是 ,反应II 的反应类型是 ; ③反应IV 的化学方程式是 ; 5,以石油裂解气为原料,通过一系列化学反应可得到重要的化工产品增塑剂G;OOAF E 2△①②③△浓硫酸△C 13H 16O 42C 2H 4C 4H 8O 21E 是一种石油裂解气,能使酸性高锰酸钾溶液褪色;同温同压下,E 的密度是H 2的21倍;核磁共振氢谱显示E 有3种不同化学环境的氢原子,其个数比为1:2:3;E 的结构简式为 ;2反应类型:① ,④ ; 3反应条件:③ ,⑥ ; 4反应②、③的目的是 ; 5反应⑤的化学方程式为 ;6B 被氧化成C 的过程中会有中间产物生成,该中间产物可能是 写出一种物质的结构简式,检验该物质存在的试剂是 ;7G 的结构简式为 ;。
化学习题

第九章习题一、名词解释1有机化合物2有机化学3共价键4同分异构现象二、填空题l.按照有机化合物的碳骨架形式,可将有机物分为____、____两大类。
2.官能团是指决定有机化合物的主要____原子或原子团。
3.有机化合物之间的反应速度____,而且反应产物____,常伴有____反应发生。
4.按照反应方式可将有机反应分为,____、____、____、____、____五种类型。
三、选择题1.下列有机物中,属于开链化合物的是( )2.下列物质中,属于有机物的是( )A、CH4B、HCNC、NaHCO3D、CO3.炔烃的官能团是( )A、羟基B、醛基C、碳碳叁键D、碳碳双键4.下列物质中,容易燃烧的是( )A、KCIB、无水酒精C、HNO3D、金属Cu5.下列物质中,不容易变质的是( )A、维生素片剂B、抗生素片剂C、油脂D、大理石四、筒答题1、筒述有机化合物的特性。
2、简述有机化合物的结构特点。
五、指出下列化合物所属类别及所含的官能团的名字1、CH3CH2OCH2CH32、CH3CH2OH3、CH3CH2CHO4、CH3CH2CH2NH25、CH3CH2CH2COOH、6、CH3—CH2—CH2—CH=CH2第十章习题一、名词解释1、同系物2、取代反应3、加成反应二、填空题1、烷烃的分子通式为;烯烃的分子通式为;炔烃的分子通式为。
2、苯和苯的同系物的分子通式为。
3、分子中台有________的链烃称为烯烃;分子中合有的链烃称为炔烃,最简单的烯烃是;最简单的炔烃是。
三、选择题1、不能使酸性高锰酸钾溶液褪色的是( )A、乙烯B、乙炔C、苯D、甲苯2、下列化合物中同时含有伯、仲、叔、季碳厚子的是( )A、正丁烷B、异丁烷C、新戊烷D、2,2,d三甲基戊烷3、既能用酸性高锰酸钾溶液鉴别,又能用溴的四氯化碳溶液鉴别的一组物质是( )A、苯与甲苯B、己烷与苯C、乙烯与乙炔D、乙烯与乙烷4、关于苯的下列说法中不正确的是( )A、苯不能发生取代反应和加成反应B、苯环中6个碳碳键键长完全相同C、苯环中碳碳键的键能介于C-C和C=C之间D、组成苯的12个原子在同一平面上5、下列物质中,没有固定沸点的是( )A、苯B、石油C、煤油D、氯仿6、在相同条件下,下列哪种燃料产生的污染程度最低( )A、沼气B、石油C、煤D、木柴7、下列分子武表示烯烃的是( )A、C4H8B、C6H6C、C6H14D、C7H88、下列物质能与硝酸银的氨溶液反应生成白色沉淀的是( )A、乙醇B、乙烯C、1-丁炔D、2-丁炔9、鉴别环丙烷、丙烯与丙炔需要的试剂是( )A、AgNO3的氧溶液;KMnO4溶液B、HgSO4/H2SO4;KMnO4溶液C、Br2的CC14溶液;KMnO4溶液D、AgNO3的氨溶液10、下列不属于有机化合物的为( )A、乙烷B、碳酸C、乙烯D、乙醇四、用系统命名法命名下列化合物或根据名称写出结构式1、2、3、4、5、2-甲基-3-乙基戊烷6、环己烷7、甲苯8、对二甲苯9、4-甲基-2-已烯10、硝基苯五、完成下列反应方程式1、CH3-CH=CH2+Br2→2、CH3-CH2-CH=CH2+HI→3、4、5、六、用化学方法鉴别下列各组化台物1、l-丁炔和2-丁炔2、苯和甲苯3、乙烷、乙烯、乙炔七、分子式为C4H6的化合物,能使高锰酸钾溶液褪色,而且能与硝酸银的氨溶液发反应,试写出该化合物的结构式。
cho4 第四节 变换群和置换群,凯莱定理

第四节
第二章
变换群和置换群,凯莱定理
一、置换群 二、凯莱(Cayley)定理 三、小结与思考
机动
目录
上页
下页
返回
结束
一、 置换群
1、置换的轮换分解
A 1)定义1 设 A是一个非空集合, 上的所有
可逆变换构成的群称为 A 上的对称群。 此群的任何子群称为 A 上的变换群。 当 A n 时, 上的对称群称为 n 次对称群, A 记为S n . 而 S n 的任何一个子群称为 n 次置换群。
机动
目录
上页
下页
返回
结束
2)定义2 设
r 是一个 n 次置换,满足:
(a) r (a1 ) a 2 , r (a 2 ) a3 ,, r (a l ) a1 , (b) r (a ) a , 当
a a i ( i 1,2,, l ),
则称 r 是一个长度为 l 的轮换(cycle), 并记为:
1 2 s . 其中 i ( i 1,2,, s ) 是对换,且对换的个数
s的奇偶性由 惟一确定,与分解方法无关。
机动
目录
上页
下页
返回
结束
3、置换的奇偶性 定义3 当对换个数是偶数(奇)时,称为偶(奇) 置换((evencold)permutation)。
n 次对称群 S n 中所有的偶置换构成一个子群,
G G.
机动 目录 上页 下页 返回 结束
2、实例 例1 Klein四元群:
K {e, a, b, c} {(1), (12)(34), (13)(24), (14)(23)}.
例2 证明 :
S n (12), (13),, (1n) .
有机化学-醛和酮

O R CH2 C CH CHO
HR
O
H2O
R CH2 C CH CHO
HR
OH
R CH2
C
α
CH CHO
+ OH-
HR (-羟基醛)
Problem: 完成下列反应式:
稀碱
H3C CH2 CH2 CHO 4~5oC
OH O H3C CH2 CH2 CH CH C H
H2C CH2CH3
干燥HCl
R C H+ R’- OH
R C H + H2O
OR'
OR' 缩醛
例:
O
HCl
C H + 2 CH3CH2OH
CH OCH2CH3 OCH2CH3
苯甲醛缩 二乙醇
◆ 酮不易生成缩酮,但环状缩酮较易生成。
R
C=O + CH2OH 干燥HCl
R
O C
CH2
R
CH2OH
R O CH2
应用: 缩醛和缩酮对碱、氧化剂稳定,常用 于有机合成中保护醛(酮)基。缩醛(酮) 在酸性条件下水解回原来的醛(酮)和醇。
沉淀。
通常
R
为橙黄色
C NNH
NO2
的沉淀
R' NO2
(二) - 碳和 -氢的反应
-H,有弱酸性
HO
R-CH2-CH-C-H βα
p- 共轭,使碳 负离子稳定
R-CH2-CHO
NaOH
O R CH- C H
碳负离子
1. 醇醛缩合
在稀碱溶液中, 含α-H的醛的α-碳可以与另一 醛的羰基碳加成形成新的碳碳键,生成β-羟基醛 类化合物,该反应称为醇醛缩合。
cho细胞培养知识

cho细胞培养知识摘要:1.CHO 细胞的概述2.CHO 细胞的培养条件3.CHO 细胞的培养方法4.CHO 细胞的培养注意事项5.CHO 细胞培养的意义正文:【CHO 细胞的概述】CHO 细胞,全称为中国仓鼠卵巢细胞,是一种来源于中国仓鼠卵巢上皮的细胞系。
它们具有较高的生长速度、易于培养、易于转化等特点,因此在生物制药领域被广泛应用。
例如,许多重组蛋白药物、单克隆抗体药物的生产都涉及到CHO 细胞的培养。
【CHO 细胞的培养条件】CHO 细胞的培养需要满足一定的条件,包括温度、气体、营养和pH 值等。
一般来说,CHO 细胞在37℃左右生长最佳,同时需要5% 的CO2 环境。
营养方面,CHO 细胞需要含有充足氨基酸、核苷酸、脂肪酸等营养物质的培养基。
此外,合适的pH 值(一般在7.2-7.4)也是CHO 细胞生长的关键。
【CHO 细胞的培养方法】CHO 细胞的培养方法主要包括贴壁培养和悬浮培养两种。
贴壁培养是指将CHO 细胞种植在培养皿或瓶中,让其贴壁生长。
这种方法操作简单,易于观察细胞生长情况,但随着细胞密度的增加,细胞间的相互作用会增强,可能导致细胞生长受限。
悬浮培养则是将CHO 细胞悬浮在培养液中生长,其生长空间更大,生长速度也相对更快。
但是,悬浮培养需要特殊的培养设备,且细胞易于出现聚集现象。
【CHO 细胞的培养注意事项】在CHO 细胞培养过程中,需要注意以下几点:首先,要确保无菌操作,避免细胞污染。
其次,要根据细胞生长阶段调整培养条件,如密度、温度、营养等。
再次,要定期更换培养液,以清除代谢废物和满足细胞生长需求。
最后,要观察细胞生长情况,如形态、密度等,及时发现并解决问题。
【CHO 细胞培养的意义】CHO 细胞培养在生物制药领域具有重要意义。
首先,通过CHO 细胞培养,可以获得大量具有生物活性的蛋白质,为药物研发提供物质基础。
其次,CHO 细胞培养技术可以为药物生产提供稳定的细胞来源,保证药物生产的连续性和规模化。
cho细胞培养参数

cho细胞培养参数
CHO细胞(Chinese Hamster Ovary Cell)是一种常用的哺乳动物细胞系,常用于重组蛋白的生产。
细胞培养参数主要包括以下几个方面:
1. 培养基:常用的CHO细胞培养基有DMEM/F12、RPMI 1640等,其中含有必需的氨基酸、维生素、葡萄糖以及其他生长因子和辅助物质。
2. 温度:CHO细胞的最适生长温度一般为37°C。
3. CO2浓度:为了维持细胞培养环境的酸碱平衡,一般在细胞培养箱中提供5% CO2气氛。
4. pH值:细胞培养液的pH值通常在7.2-7.4之间。
5. 细胞密度:细胞密度的种植密度根据所需的细胞产量,一般可根据细胞生长曲线和培养容器的尺寸来确定。
6. 培养时间:CHO细胞的培养时间一般为2-7天,具体根据细胞类型和实验目的而定。
7. 摇床速度:细胞培养时的摇床速度一般为80-120rpm,旋转摇床的旋转半径也会影响细胞的生长。
8. 营养物质浓度:选择适当的营养物质浓度,如葡萄糖、氨基酸、维生素等,对细胞的生长和产量有重要影响。
9. 培养容器:常用的培养容器有细胞培养板、细胞培养瓶、细胞培养滚筒等,选择合适的培养容器也会影响细胞的生长和产量。
以上为一般常用的CHO细胞培养参数,实际情况可能根据实
验目的和细胞特性的不同而有所调整。
在进行细胞培养实验时,需根据实际情况进行优化调整。
序号结构式化合物thodcodcrcodcrcodmncodmn浓度thod

64.5
1682 -1690 1682 -1680
9693.9
1630 96.4 1640 97.6
9 63.3
CH3
2151
C
CH CH OH 甲基,丁 2 2
二醇 CH3 │
-2140
30
(1,3)
OH
1000
ClCHCHCH 3 │
1,氯丙二 │ 31 醇(1,2) OH OH 1000
CH \ 3
19
ClCH2CH2O
4
氯乙醇
H
1000
993
NCCH CH O 22
5
氰乙醇
H
1000 1350
1310 1200
NH CH CH 222
6 氨基乙醇 OH
1000 388.9 -198.3 51
CH2CH2OH
乙酰氨基 │
7
乙醇 NH2COCH3 1000
1400
CH CH OH 22
甲氧基乙 │
704.7
4
全 1200
2800
100~490 -66.9
93 ~388
704.7
737
749 387
4
4
4 0. 4
50
29
221
95.8
0.3
38.7
77.5
625
96.8
39
100.8
3.33
300
30
1160 68.6
473
0.71 3.56
全
276
16.1
473
0.16 3.56
全
1350
12
苯甲醛 C6H5CHO 1000 120.8
第6章 烃的衍生物

乙酸
又名醋酸
C2H4O2
分子式
O H3C C OH
结构式
CH3COOH
结构简式
O C OH
羧基
饱和饱和一元羧酸的通式为CnH2nO2 1.乙醛的物理性质
※有强烈刺激性气味、无色液体,沸点是117.9℃,熔点是16.6℃,易溶于水和乙醇。 ※温度低于16.6℃时,乙酸就会凝结成像冰一样的晶体,所以又称冰醋酸。
CH3CHCOH3C2HAOg( 2NAHg3()2ONH3)2OHCH3COCOHN3CHO4ON2HA4g2AHg2OH3N2OH3 3NH3
现象: Ag+得到电子被还原为金属Ag而附着在玻璃内壁上形成光亮的银镜 与新配制的Cu(OH)2溶液发生反应
CH3CHOCH3C2CHuO(O2CHu)(2 OH)2 CH3CCOHO3HCOOCHu2OCu2O2H2O2H2O
化合物的反应,叫做消去反应。
C2H5OH+HOC2H5 浓 14硫0℃ 酸C2H5OC2H5 +H2O(取代反应)
苯酚
又称石炭酸
C6H6O 分子式
OH 或 C6H5OH
结构简式
1.苯酚的物理性质
※纯净的苯酚是具有特殊气味的无色晶体,熔点是43℃, ※露置在空气中易被氧化而呈粉红色,所以苯酚要密闭保存。 ※常温时,苯酚在水里的溶解度不大,当温度高于65℃时,则能与水任意比互溶。 ※苯酚易溶于乙醇、乙醚等有机溶剂。 ※苯酚有腐蚀性,与皮肤接触能引起灼伤,如果不慎溅到皮肤上,应立即用酒精洗涤。
苯酚
2.苯酚的化学性质
(1)苯酚的酸性
OH + NaOH
ONa + H2O
命名与写结构
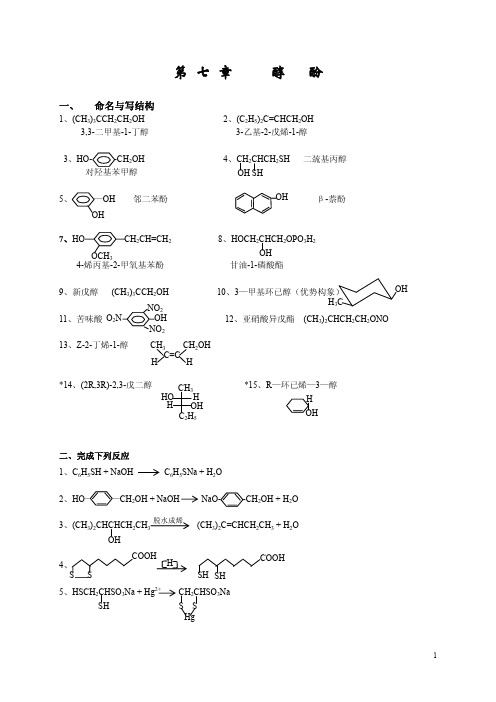
△
—CH2CH3
7
6、(CH3)3CCOCH3 + NaOH + I2
(CH3)3CCOO- + CHI3
OH
丙酮/干 HCl
7、
CHCH2OH
OCH3
OO —CHCH2 OCH3
8、CH3CH2CHO
A OH
B
OH
Br
Br
若 A 不溶于 NaOH,则 A 可能为
—CH2OH 或
—O—CH3
CH3
CH3
Br
2、化合物A(C5H12O),在酸作用下易失水成B,B用冷、稀KMnO4处理得C(C5H12O2)。… A (CH3)2CCH2CH3 或 (CH3)2CHCHCH3
OH
B (CH3)2CO=HCHCH3
(CH3)2C=CHCH2CH3 + H2O
4、 SS
COOH H
SH SH
5、HSCH2CHSO3Na + Hg2+ SH
CH2CHSO3Na SS
Hg
Байду номын сангаасCOOH
1
6、 OH
+ 稀HNO3 7、
—OH K2Cr2O7/H+
OH OH
6、 +
NO2
NO2 =O
8、CH2CHCH2 + Cu(OH)2 OH OHOH
峰,就可断定有醚的存在。× 3、环氧化合物的活泼性符合小环不稳定、大环稳定的原理。√ 4、醚在水中有一定的溶解度,是因为分子中 O 原子具有未成键的孤对电子对的缘故。√ 5、醚能溶于浓酸溶液,故可用浓硫酸鉴别环已烷与正丁醚。√
*八、问答题
1、将 cis-1,2-二甲基环氧乙烷进行酸催化水解,可得(2R,3R)-2,3-二丁醇和 (2S,3S)- 2,3-二
生物化学实验

生物化学实验生物化学实验一、糖的颜色反应及还原作用实验一:糖的颜色反应实验1.1 莫氏实验一、目的掌握莫氏(molisch)实验鉴定糖的原理和方法。
二、原理糖经浓无机酸(浓硫酸、浓盐酸)脱水产生糠醛或糠醛衍生物,后者在浓无机酸作用下,能与α-萘酚生成紫红色缩合物,在糖液和浓硫酸的液面间形成紫环,因此又称“紫环反应”,其反应如下图:利用这一性质可以鉴定糖。
三、实验器材1、棉花或滤纸。
2、吸管1.0ml(*4)、2.0ml(*1)。
3、试管1.5*15cm(*4)。
四、实验试剂1、莫氏试剂:称取α-萘酚5g,溶于95%乙醇并稀释至100ml。
此试剂需新鲜配置,并贮于棕色试剂瓶中。
2、1%蔗糖溶液:称取蔗糖1g,溶于蒸馏水并定容至100ml。
3、1%葡萄糖溶液:称取葡萄糖1g,溶于蒸馏水并定容至100ml.4、1%淀粉溶液:讲1g可溶性淀粉与少量冷蒸馏水混合溶液合成薄浆状物,然后缓缓倾入沸蒸馏水中,边加边搅。
最后以沸蒸馏水稀释至100ml。
五、操作于4支试管中,分别加入1ml1%葡萄糖溶液、1%蔗糖溶液、1%淀粉溶液和少1,摇匀,讲试管2滴1ml水中)。
然后各加莫氏试剂许纤维素(棉花或滤纸浸在倾斜,沿管壁慢慢加入浓硫酸1.5ml(切勿振摇!)硫酸层沉于试管底部与糖溶液分成两层,观察液面交界处有无紫色环出现。
六、注意事项1、试管中加入各种糖后,应做好标记,浓硫酸加入的方式应保持一致。
2、莫氏反应非常灵敏,所用的试剂应洗净,不可再样品中混入纸屑等杂物。
3、当糖浓度过高时,由于浓硫酸对他的焦化作用,将呈现红色及褐色而不呈现紫色,需稀释后再做。
思考题:1、解释α-苯酚反应的原理。
2、用莫氏试验鉴定糖时需注意哪些?试验1.2 塞氏试验一、目的掌握塞氏(Seliwanoff)实验鉴定酮糖的原理和方法。
二、原理酮糖在浓酸的作用下,脱水生产5-羟甲基糠醛,后者与间苯二酚作用,呈2,以果红色反应,有时亦同时产生棕色沉淀,此沉淀溶于乙醇,呈鲜红色沉淀糖为例,其反应如下:三、实验器材1、吸管0.5ml(*3)、5.0ml(*1)。
大学生化学实验竞赛试题及答案20290

第一题单项选择题(共 25题)1 .下列化合物,在NaOH 溶液中溶解度最大的是 ( ) [A] . PbCrO 4[B] . AgCrQ[C] . BaCrO [D] .CaCrQ2 .向酸性K 2C 2Q 溶液中加入 H2Q ,却未观察到蓝色物质生成,其原因肯定是4 .滴加O.lmol • L -1CaCb 溶液没有沉淀生成,再滴加氨水有白色沉淀生成,该溶液是( )[A] . NaPQ [B] . NaHPQ [C] . NaHPQ [D].以上三种溶液均可 5 .从滴瓶中取少量试剂加入试管的正确操作是 ( )[A]将试管倾斜,滴管口贴在试管壁,再缓慢滴入试剂[B]将试管倾斜,滴管口距试管口约半厘米处缓慢滴入试剂[C]将试管垂直,滴管口伸入试管内半厘米再缓慢滴入试剂[D]将试管垂直,滴管口贴在试管壁,再缓慢滴===============================试剂 6 .制备下列气体时可以使用启普发生器的是( )启普发生器是用固体与液体试剂在常温条件(不用加热)下反应制取气体的装置 对于1可( )[A] .未加入乙醚,因CrQ s 与乙醚的加合 物为蓝色[B] .未加入戊醇,因CrQ s 萃取到戊醇中 显蓝色3 .实验室配制洗液,最好的方法是([A] .向饱和K 2C 2Q 溶液中加入浓硫酸[B] .将K 2Cr 2Q 溶于热的浓硫酸[C] .未将溶液调至碱性,因CrQ s 在酸性 介质中分解[D] .因K262O (和/或)H2Q 浓度过稀)[C] .将K 262O 溶于1: 1硫酸[D] .将K 2Cr 2O 与浓硫酸共热溶性固体、2固体呈粉末状,3或者反应过程中产生高温的情况则不能使用该仪器制取。
另外,一些会产生糊状物质从而导致启普发生器堵塞的反应也不能使用该仪器制取DACBC DCCBB BBCDB BCDCC[A] .高锰酸钾晶体与盐酸反应制氯气[D].块状硫化亚铁与稀硫酸反应制备硫[B] .块状二氧化锰与浓盐酸反应制氯气化氢[C] .无水碳酸钾与盐酸反应制二氧化碳7 .实验室用浓盐酸与二氧化锰反应制备氯气,欲使氯气纯化则应依次通过( )[A] .饱和氯化钠和浓硫酸[B]浓硫酸和饱和氯化钠[C]氢氧化钙固体和浓硫酸[D]饱和氯化钠和氢氧化钙固体8 .使用煤气灯涉及的操作有:①打开煤气灯开关;②关闭空气入口;③擦燃火柴;④点燃煤气灯;⑤调节煤气灯火焰。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
对象: 对象是系统中用来描述客观事物的一个实体,它是构成系统的一个基本单位。一个对象由一组属性和对这属性进行操作的一组服务(方法,构造器)组成;
类以对象的关系:类的实例化就是对象,而对一类对象的抽象就是类;
封装性:就是把对象的属性和方法结合成一个独立的相同单位,通过的类的成员施以一定的访问权限,实现了类中成员的内部细节的信息隐藏;
继承性:就是扩展已有类的功能
பைடு நூலகம்
多态性:同一个行为具有多个不同表现形式或形态的能力
重载:同一类中方法名相同,参数不同,与返回值无关
重写:子类中定义某方法与其父类有相同的名称和参数
包:为了便于管理大型软件系统中数目众多的类,解决类命名冲突的问题;
