乙酸钠溶液(2molL,pH4.8)
常用缓冲溶液的配制方法

常用缓冲溶液的配制方法磷酸氢二钠–柠檬酸缓冲液24Na 2HPO 4·2H 2O 分子量 = 178.05,0.2 mol/L 溶液含35.01克/升。
C 4H 2O 7·H 2O 分子量 = 210.14,0.1 mol/L 溶液为21.01克/升。
pH 4.0 20mL :Na2HPO4 0.219g + C4H2O7·H2O 0.258g柠檬酸–柠檬酸钠缓冲液(0.1 mol/L )6872柠檬酸钠Na 3 C 6H 5O 7·2H 2O :分子量294.12,0.1 mol/L 溶液为29.41克/毫升。
pH 4.0 20mL : C4H2O7·H2O 0.275g + Na3 C6H5O7·2H2O 0.203g乙酸–乙酸钠缓冲液(0.2 mol/L )Na 2Ac·3H 2O 分子量= 136.09,0.2 mol/L 溶液为27.22克/升。
pH 4.0 20mL :NaAc 0.098g + HAc 0.282mL甘氨酸–氢氧化钠缓冲液(0.05M )甘氨酸分子量=75.07; 0.2M溶液含15.01克/升。
pH 10.0 20mL :甘氨酸0.075g + NaOH 0.013g碳酸钠-碳酸氢钠缓冲液(0.1M ) 2+2+ 无水Na 2CO 2分子量=105.99;0.1M 溶液为10.60克/升。
Na 2CO 2·10H 2O 分子量=286.2;0.1M 溶液为28.62克/升。
Na 2HCO 3分子量=84.0;0.1M 溶液为8.40克/升。
pH 10.0 20mL :无水碳酸钠 0.127g +碳酸氢钠0.067g补注:pH 4.0 EDTA2-McIlvaine2O0. 05 mol/L EDTA(372.2)+ 0. 06 mol/L Na2HPO4·12HO(358.14)+ 0. 08 mol/L 柠檬酸(210.14)18. 61g/L EDTA + 21. 4884 g/L Na2HPO4·12HO + 16.8112 g/L 柠檬酸20mL 0. 372g EDTA + 0. 430 g Na2HPO4 ·12HO + 0.336 g 柠檬酸。
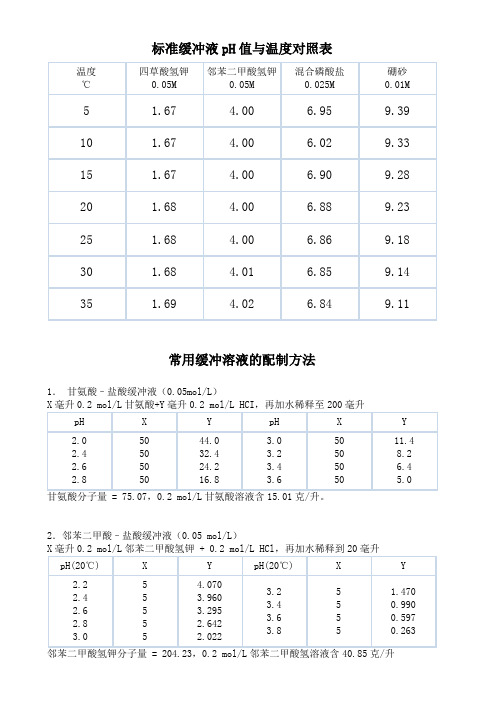
标准缓冲液pH值与温度对照表

标准缓冲液pH值与温度对照表温度℃四草酸氢钾 0。
05M邻苯二甲酸氢钾0.05M混合磷酸盐0.025M硼砂0。
01M5 1.67 4.00 6。
95 9.3910 1。
67 4.00 6.02 9。
3315 1.67 4。
00 6.90 9。
2820 1。
68 4.00 6。
88 9.2325 1.68 4.00 6。
86 9.1830 1。
68 4。
01 6。
85 9。
1435 1。
69 4.02 6.84 9.11常用缓冲溶液的配制方法1.甘氨酸-盐酸缓冲液(0.05mol/L)X毫升0。
2 mol/L甘氨酸+Y毫升0。
2 mol/L HCI,再加水稀释至200毫升pH X Y pH X Y2.0 50 44.0 3。
0 50 11。
42.4 50 32.4 3。
2 50 8.22.6 50 24.23.4 50 6。
42。
8 50 16.8 3。
6 50 5。
0 甘氨酸分子量=75。
07, 0.2 mol/L甘氨酸溶液含15。
01克/升。
2.邻苯二甲酸-盐酸缓冲液(0。
05 mol/L)X毫升0。
2 mol/L邻苯二甲酸氢钾+ 0。
2 mol/L HCl,再加水稀释到20毫升pH(20℃)X Y pH(20℃)X Y2。
2 5 4.0703。
2 5 1。
4702.4 53.9603。
4 5 0.9902.6 53.2953。
6 5 0.597 2。
8 5 2。
6423.8 5 0.2633。
0 5 2。
022邻苯二甲酸氢钾分子量=204.23, 0。
2 mol/L邻苯二甲酸氢溶液含40。
85克/升3.磷酸氢二钠-柠檬酸缓冲液pH 0。
2mol/LNa HPO(ml) 0。
1mol/L柠檬酸 (ml)pH 0.2mol/L Na HPO (ml) 0。
1mol/L 柠檬酸 (ml) 2.2 0.40 10。
60 5。
2 10.72 9。
28 2.4 1.24 18.76 5.4 11.15 8.85 2。
溶液各种配制
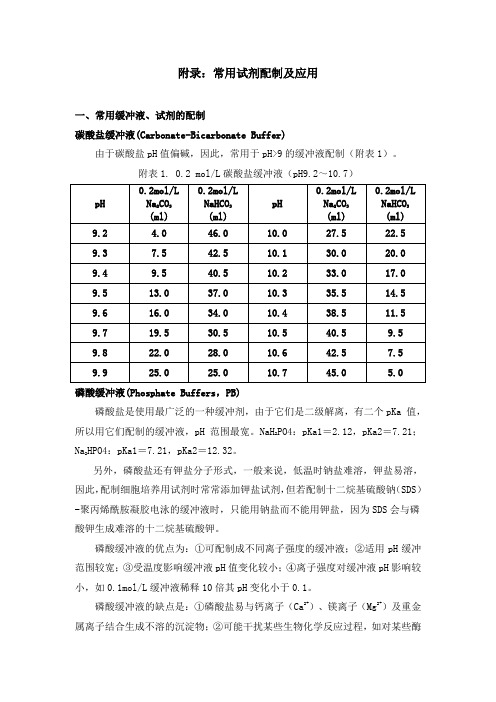
附录:常用试剂配制及应用一、常用缓冲液、试剂的配制碳酸盐缓冲液(Carbonate-Bicarbonate Buffer)由于碳酸盐pH值偏碱,因此,常用于pH>9的缓冲液配制(附表1)。
附表1. 0.2 mol/L碳酸盐缓冲液(pH9.2~10.7)磷酸缓冲液(Phosphate Buffers,PB)磷酸盐是使用最广泛的一种缓冲剂,由于它们是二级解离,有二个pKa 值,PO4:pKa1=2.12,pKa2=7.21;所以用它们配制的缓冲液,pH 范围最宽。
NaH2HPO4:pKa1=7.21,pKa2=12.32。
Na2另外,磷酸盐还有钾盐分子形式,一般来说,低温时钠盐难溶,钾盐易溶,因此,配制细胞培养用试剂时常常添加钾盐试剂,但若配制十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳的缓冲液时,只能用钠盐而不能用钾盐,因为SDS会与磷酸钾生成难溶的十二烷基硫酸钾。
磷酸缓冲液的优点为:①可配制成不同离子强度的缓冲液;②适用pH缓冲范围较宽;③受温度影响缓冲液pH值变化较小;④离子强度对缓冲液pH影响较小,如0.1mol/L缓冲液稀释10倍其pH变化小于0.1。
磷酸缓冲液的缺点是:①磷酸盐易与钙离子(Ca2+)、镁离子(Mg2+)及重金属离子结合生成不溶的沉淀物;②可能干扰某些生物化学反应过程,如对某些酶的催化活性具有一定程度的抑制作用。
NaH2PO4的pH值偏酸性,可用作pH<4的缓冲液。
Na2HPO4的pH值偏碱性,可用作pH>10的缓冲液。
而pH=6~8的中性缓冲液是更常用的缓冲液,需要NaH2PO4与Na2HPO4两种磷酸盐混合配制(附表2)。
附表2. 0.2 mol/L磷酸盐缓冲液(pH5.7~8.2)磷酸盐缓冲溶液(Phosphate-buffered saline, PBS)磷酸盐缓冲液是在磷酸缓冲液基础上添加NaCl以维持溶液的渗透压,因此,PBS适用于做细胞缓冲液,常用PBS配制如下。
蛋白测定国标

食品安全国家标准食品中蛋白质的测定[ 关闭本页 ] 转载于:卫生部发布时间:2010-05-21T10:40:00食品安全国家标准食品中蛋白质的测定National food safety standardDetermination of protein in foods中华人民共和国国家标准GB 5009.5—2010前言本标准代替GB/T 5009.5-2003《食品中蛋白质的测定》、GB/T 14771-1993《食品中蛋白质的测定方法》和GB/T 5413.1-1997《婴幼儿配方食品和乳粉蛋白质的测定》。
本标准与GB/T 5009.5-2003相比主要修改如下:——在第一法中增加了自动蛋白质测定仪的方法;——增加了燃烧法,作为第三法;——修改了换算系数;——对计算结果的有效数字规定进行了修改;——增加pH计对滴定终点的判定。
本标准所代替标准的历次版本发布情况为:——GB/T 5009.5-1985、GB/T 5009.5-2003;——GB 5413.1-1985、GB/T 5413.1-1997 ;——GB/T 14771-1993。
食品安全国家标准食品中蛋白质的测定1 范围本标准规定了食品中蛋白质的测定方法。
本标准第一法和第二法适用于各种食品中蛋白质的测定,第三法适用于蛋白质含量在 10 g/100 g 以上的粮食、豆类、奶粉、米粉、蛋白质粉等固体试样的筛选测定。
本标准不适用于添加无机含氮物质、有机非蛋白质含氮物质的食品测定。
第一法凯氏定氮法2 规范性引用性文件本标准中引用的文件对于本标准的应用是必不可少的。
凡是注日期的引用文件,仅所注日期的版本适用于本标准。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本标准。
3 原理食品中的蛋白质在催化加热条件下被分解,产生的氨与硫酸结合生成硫酸铵。
碱化蒸馏使氨游离,用硼酸吸收后以硫酸或盐酸标准滴定溶液滴定,根据酸的消耗量乘以换算系数,即为蛋白质的含量。
标准缓冲液pH值与温度对照表
标准缓冲液pH值与温度对照表常用缓冲溶液的配制方法1.甘氨酸–盐酸缓冲液(0.05mol/L)2.邻苯二甲酸–盐酸缓冲液(0.05 mol/L)3.磷酸氢二钠–柠檬酸缓冲液Na 2HPO 4分子量 = 142.98,0.2 mol/L 溶液为28.40克/升。
Na 2HPO 4·2H 2O 分子量 = 178.05,0.2 mol/L 溶液含35.61克/升。
C 4H 2O 7·H 2O 分子量 = 210.14,0.1 mol/L 溶液为21.01克/升。
4.柠檬酸–氢氧化钠-盐酸缓冲液 ① 使用时可以每升中加入1克克酚,若最后pH 值有变化,再用少量50% 氢氧化钠溶液或浓盐酸调节,冰箱保存。
②柠檬酸C 6H 8O 7·H 2O :分子量210.14,0.1 mol/L 溶液为21.01克/升。
6872柠檬酸钠Na 3 C 6H 5O 7·2H 2O :分子量294.12,0.1 mol/L 溶液为29.41克/毫升。
227.磷酸盐缓冲液242NaH 2PO 4·2H 2O 分子量 = 156.03,0.2 mol/L 溶液为31.21克/升。
242KH 2PO 4分子量 = 136.09,1/15M 溶液为9.078克/升。
8.磷酸二氢钾–氢氧化钠缓冲液(0.05M )10.Tris –盐酸缓冲液(0.05M ,25℃)50毫升0.1M 三羟甲基氨基甲烷(Tris )溶液与X 毫升0.1N 盐酸混匀后,加水稀释至100毫升。
232升。
Tris 溶液可从空气中吸收二氧化碳,使用时注意将瓶盖严。
2472硼酸H 2BO 3,分子量=61.84,0.2M 溶液为12.37克/升。
硼砂易失去结晶水,必须在带塞的瓶中保存。
2472硼酸H 2BO 3,分子量=61.84, 0.2M 溶液为12.37克/升。
硼砂易失去结晶水,必须在带塞的瓶中保存。
12.甘氨酸–氢氧化钠缓冲液(0.05M )13.硼砂-氢氧化钠缓冲液(0.05M 硼酸根)14.碳酸钠-碳酸氢钠缓冲液(0.1M )232NaHCO 3分子量=84.0;0.1M 溶液为8.40克/升。
DNA提取过程中各种试剂的作用及原理

DNA提取过程中各种试剂的作用及原理1.溶液I—溶菌液:溶菌酶:它是糖苷水解酶,能水解菌体细胞壁的主要化学成分肽聚糖中的β-1,4糖苷键,因而具有溶菌的作用。
当溶液中pH小于8时,溶菌酶作用受到抑制。
葡萄糖:增加溶液的粘度,维持渗透压,防止DNA受机械剪切力作用而降解。
EDTA:(1)螯合Mg2+、Ca2+等金属离子,抑制脱氧核糖核酸酶对DNA的降解作用(DNase作用时需要一定的金属离子作辅基);(2)EDTA的存在,有利于溶菌酶的作用,因为溶菌酶的反应要求有较低的离子强度的环境。
2.溶液II-NaOH-SDS液:NaOH:核酸在pH大于5,小于9的溶液中,是稳定的。
但当pH>12或pH<3时,就会引起双链之间氢键的解离而变性。
在溶液II中的NaOH浓度为0.2mo1/L,加抽提液时,该系统的pH就高达12.6,因而促使染色体DNA与质粒DNA的变性。
SDS:SDS是离子型表面活性剂。
它主要功能有:(1)溶解细胞膜上的脂质与蛋白,因而溶解膜蛋白而破坏细胞膜。
(2)解聚细胞中的核蛋白。
(3)SDS能与蛋白质结合成为R-O-SO3-…R+-蛋白质的复合物,使蛋白质变性而沉淀下来。
但是SDS能抑制核糖核酸酶的作用,所以在以后的提取过程中,必须把它去除干净,防止在下一步操作中(用RNase去除RNA时)受到干扰。
3. 溶液III--3mol/L NaAc(pH4.8)溶液:NaAc的水溶液呈碱性,为了调节pH至4.8,必须加入大量的冰醋酸。
所以该溶液实际上是NaAc-HAc的缓冲液。
用pH4.8的NaAc溶液是为了把pH12.6的抽提液,调回pH至中性,使变性的质粒DNA能够复性,并能稳定存在。
而高盐的3mol/L NaAc有利于变性的大分子染色体DNA、RNA以及SDS-蛋白复合物凝聚而沉淀之。
前者是因为中和核酸上的电荷,减少相斥力而互相聚合,后者是因为钠盐与SDS-蛋白复合物作用后,能形成较小的钠盐形式复合物,使沉淀更完全。
食品蛋白质测定原始记录GB 5009.5-2016
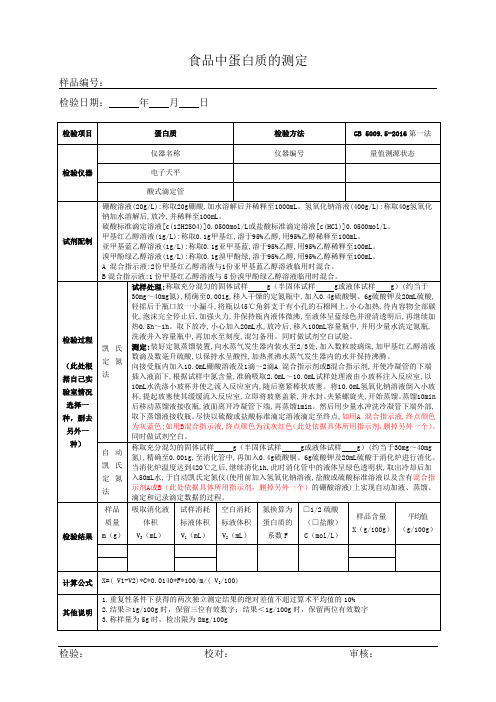
基苯酚指示剂溶液,摇匀后滴加氢氧化钠溶液中和至黄色,再滴加乙酸溶液至溶液无色,用水稀释至刻度,混匀试样溶液总体积为V3mL。
标准曲线的绘制:吸取0.00mL、0.05mL、0.10mL、0.20mL、0.40mL、0.60mL、0.80mL和1.00mL氨氮标准使用溶液(相当于0.00μg、5.00μg、10.0μg、20.0μg、40.0μg、60.0μg、80.0μg和100.0μg氮),分别置于10mL比色管中。加4.0mL乙酸钠-乙酸缓冲溶液及4.0mL显色剂,加水稀释至刻度,混匀。置于100℃水浴中加热15min。取出用水冷却至室温后,移入1cm比色杯内,以零管为参比,于波长400nm处测量吸光度值,根据标准各点吸光度值绘制标准曲线或计算线性回归方程。
检验结果
试样中氮含量C(g/100g)
氮换算为蛋白质的系数F
样品含量X(g/100g)
平均值(g/100g)
计算公式
X=C*F
其他说明
1.重复性条件下获得的两次独立测定结果的绝对差值不超过算术平均值的10%
2.结果保留三位有效数字
检验仪器
仪器名称
仪器编号
量值溯源状态
电子天平
氮/蛋白质分析仪
检验过程
按照仪器说明书要求称取g充分混匀的试样(精确至0.0001g),用锡箔包裹后置于样品盘上。试样进入燃烧反应炉(900℃~1200℃)后,在高纯氧(≥99.99%)中充分燃烧。燃烧炉中的产物(NOx)被载气二氧化碳或氦气运送至还原炉(800℃)中,经还原生成氮气后检测其含量。
氨氮标准使用溶液(0.1g/L):用移液管吸取10.00mL氨氮标准储备液于100mL容量瓶内,加水定容至刻度,混匀,此溶液每毫升相当于0.1mg氮。
乙酸乙酸钠缓冲溶液公式

乙酸乙酸钠缓冲溶液公式乙酸乙酸钠缓冲溶液在化学实验和实际应用中可是相当重要的存在呢!咱们先来说说这个乙酸乙酸钠缓冲溶液的公式到底是怎么一回事。
乙酸乙酸钠缓冲溶液的公式,简单来说,就是用来计算其中各种成分的浓度,以达到我们期望的缓冲效果。
缓冲溶液嘛,它的作用就是能在一定程度上抵御外界酸碱的影响,保持溶液 pH 值的相对稳定。
咱们就拿一个具体的例子来说吧。
比如说在实验室里,咱们要配制pH 值为 4.8 的乙酸乙酸钠缓冲溶液。
这时候,咱们就得用到那个复杂又有点让人头疼的公式啦。
先给您列一下这个公式:pH = pKa + log([Ac-]/[HAc]) 。
这里的 pH就是咱们要达到的目标 pH 值,pKa 是乙酸的解离常数,[Ac-]是乙酸钠的浓度,[HAc]是乙酸的浓度。
要想算出合适的浓度比例,就得先知道乙酸的解离常数 pKa 。
乙酸的 pKa 大约是 4.76 。
然后把咱们想要的 pH 值 4.8 带进去,通过一番计算,就能得出乙酸钠和乙酸的浓度比例啦。
记得有一次,我在实验室里指导学生们配制乙酸乙酸钠缓冲溶液。
有个学生特别较真,一直在问我:“老师,这公式到底咋来的呀?为啥这么算就能得到缓冲溶液呢?”我就耐心地给他解释,从酸碱平衡的原理开始讲起,讲到解离常数的意义,再到这个公式的推导过程。
这孩子听得那叫一个认真,眼睛都不眨一下。
最后,经过一番努力,大家终于都配制出了符合要求的缓冲溶液。
看着那些一瓶瓶的溶液,同学们脸上都露出了满意的笑容,我心里也特别有成就感。
其实啊,理解这个公式不仅仅是为了会做题目、会配制溶液,更是为了让咱们明白化学世界里那种精妙的平衡和变化。
通过对乙酸乙酸钠缓冲溶液公式的研究和应用,咱们能更深入地理解化学的奥秘。
在实际的科研和生产中,乙酸乙酸钠缓冲溶液的应用也是非常广泛的。
比如说在生物化学实验里,要保持某些酶的活性,就需要特定 pH 值的缓冲溶液环境。
这时候,乙酸乙酸钠缓冲溶液就派上用场啦。
乙酸钠溶液(2molL,pH4.8)

北京雷根生物技术有限公司
乙酸钠溶液(2mol/L,pH4.8)
简介:
乙酸钠也称醋酸钠、NaAc ,是常规分子生物学试剂。
乙酸钠溶液(2mol/L,pH4.8) 又称醋酸钠溶液,主要由2M NaAc 、醋酸组成,调节pH 至4.8,未经高压灭菌,主要提供乙酸根,调节pH 值等。
组成:
操作步骤(仅供参考):
1、根据实验具体要求操作。
注意事项:
1、 如果每次的使用量很小,可以适当分装后再使用。
2、 注意密闭保存,否则pH 值会升高。
3、 为了您的安全和健康,请穿实验服并戴一次性手套操作。
有效期: 18个月有效。
相关:
编号 名称 R00758 Storage NaAc(2mol/L,pH4.8) 500ml RT 使用说明书 1份 编号 名称 DC0032 Masson 三色染色液
NH0042 SSC 缓冲液(10×,pH7.0)
NH0053 变性鲑鱼精DNA(10mg/ml)
NE0022 SDS 溶液(10%)
NR0001 DEPC 处理水(0.1%)
PW0111 Super ECL Plus 超敏发光液
TC0713 葡萄糖检测试剂盒(GOD-POD 比色法)。
溶出伏安法测定食品中营养强化剂锌

溶出伏安法测定食品中营养强化剂锌pH 4.8,锌在HOAc-NaOAc底液中可产生一个灵敏吸附波的最佳条件,应用于测定食品中锌含量,方法简便、快速、灵敏度、回收率较高。
[Abstract] It was reported in this paper that in a buffer solution of HOAc-NaOAc (pH=4.8 ),Zn(Ⅱ) which was usually added as nutritive intensifying agents could be determined successively by stripping voltammetry in food.The proposed method was proved to be accurate,rapid,sensitive and also convenient to operate.[Key words] Zinc;Food ;Stripping voltammetry在一定的电位下,锌能在电极上还原成金属汞齐进行预电解富集,当对电极施加反向扫描电压时,被还原在电极上的锌溶脱,并在-1.05V处产生一电流峰,其峰电流与富集在电极上的金属浓度成正比,由此计算锌的含量。
本法与AAS 法所测锌含量进行比较,结果无明显差异。
1 材料与方法1.1仪器与试剂AD-3型极谱仪(江苏金坛市环宇科技仪器厂);电解池:25 ml石英或聚四氟乙烯杯。
乙酸钠溶液(0.4 mol/l):称取13.6 g乙酸钠(CH3COONa·3H2O),加水溶解后稀释至250 ml。
乙酸(0.4 mol/L):量取2.0 ml冰乙酸,加水稀释至85 ml。
HOAc-NaOAc底液(0.2 mol/L,pH4.8):乙酸钠溶液(0.4 mol/L)与乙酸(0.4 mol/L)等量混合,用二硫腙-四氯化碳溶液(0.1 g/L)10 ml提取数次至四氯化碳无色,弃去四氯化碳层。
溶液各种配制
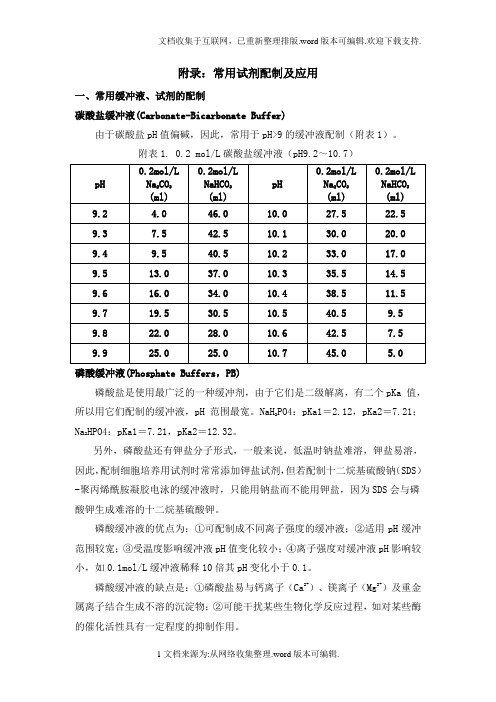
附录:常用试剂配制及应用一、常用缓冲液、试剂的配制碳酸盐缓冲液(Carbonate-Bicarbonate Buffer)由于碳酸盐pH值偏碱,因此,常用于pH>9的缓冲液配制(附表1)。
附表1. 0.2 mol/L碳酸盐缓冲液(pH9.2~10.7)磷酸缓冲液(Phosphate Buffers,PB)磷酸盐是使用最广泛的一种缓冲剂,由于它们是二级解离,有二个pKa 值,PO4:pKa1=2.12,pKa2=7.21;所以用它们配制的缓冲液,pH 范围最宽。
NaH2HPO4:pKa1=7.21,pKa2=12.32。
Na2另外,磷酸盐还有钾盐分子形式,一般来说,低温时钠盐难溶,钾盐易溶,因此,配制细胞培养用试剂时常常添加钾盐试剂,但若配制十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳的缓冲液时,只能用钠盐而不能用钾盐,因为SDS会与磷酸钾生成难溶的十二烷基硫酸钾。
磷酸缓冲液的优点为:①可配制成不同离子强度的缓冲液;②适用pH缓冲范围较宽;③受温度影响缓冲液pH值变化较小;④离子强度对缓冲液pH影响较小,如0.1mol/L缓冲液稀释10倍其pH变化小于0.1。
磷酸缓冲液的缺点是:①磷酸盐易与钙离子(Ca2+)、镁离子(Mg2+)及重金属离子结合生成不溶的沉淀物;②可能干扰某些生物化学反应过程,如对某些酶的催化活性具有一定程度的抑制作用。
NaH2PO4的pH值偏酸性,可用作pH<4的缓冲液。
Na2HPO4的pH值偏碱性,可用作pH>10的缓冲液。
而pH=6~8的中性缓冲液是更常用的缓冲液,需要NaH2PO4与Na2HPO4两种磷酸盐混合配制(附表2)。
附表2. 0.2 mol/L磷酸盐缓冲液(pH5.7~8.2)磷酸盐缓冲溶液(Phosphate-buffered saline, PBS)磷酸盐缓冲液是在磷酸缓冲液基础上添加NaCl以维持溶液的渗透压,因此,PBS适用于做细胞缓冲液,常用PBS配制如下。
醋酸钠饱和溶液 ph值

醋酸钠饱和溶液 ph值醋酸钠饱和溶液是一种物理化学实验中常用的试剂,其ph值与酸碱度密切相关。
本文将介绍醋酸钠饱和溶液的含义、制备方法、ph值的测定以及影响ph值的因素,并阐述其在不同领域的应用。
1. 含义醋酸钠(CH3COONa)是一种无色晶体,易溶于水,呈弱酸性。
将醋酸钠溶于水中,达到其溶解度时,所得到的溶液称为醋酸钠饱和溶液。
2. 制备方法醋酸钠饱和溶液的制备方法与醋酸钠的溶解度密切相关。
醋酸钠在水中的溶解度随温度的升高而增大,因此,制备醋酸钠饱和溶液时,应控制好温度。
(1)以100ml三角瓶为例,将5.65g醋酸钠溶解于50ml去离子水中,经混合、搅拌后加入适量去离子水至瓶口,用塞子密封。
待其在恒温器内沉淀并达到饱和状态后,取出备用。
3. ph值的测定ph值是溶液酸碱度的指标,是指羟离子离子活度的对数(即-pOH)。
醋酸钠饱和溶液为弱酸性溶液,在25℃下其ph值约为4.8。
测定方法:(1)用酸碱指示剂蓝色素(Bromothymol Blue,简称BTB)作为指示剂。
(2)将醋酸钠饱和溶液放入滴定管,并加入适量的BTB指示剂。
(3)利用0.1mol/L NaOH滴定至溶液颜色变为蓝色,记录用量。
(4)利用计算公式计算出醋酸钠饱和溶液的ph值。
4. 影响ph值的因素醋酸钠饱和溶液的ph值受许多因素影响,其中温度、溶质浓度、共沸物等是主要的影响因素。
(1)温度:当温度升高时,醋酸钠饱和溶液的溶解度增大,溶液pH值相应降低。
(2)溶质浓度:溶液中溶质浓度越高,pH值越低。
二、应用领域1. 生物学在细胞生物学研究中,醋酸钠饱和溶液可以用于离子交换层析分离和纯化肝细胞内分泌体。
2. 化学分析醋酸钠饱和溶液可用于分析方法的制备、标准溶液的制备和配制一些有机合成试剂和催化剂。
3. 医学醋酸钠饱和溶液可以用于药物的制备和储存,如抗菌药物氯霉素,以及用于肝脏疾病的药物等。
4. 食品工业醋酸钠饱和溶液可以用于面包、饼干、巧克力等食品的制备中,以调节酸碱度,使食品口感更佳。
溶液各种配制

附录:常用试剂配制及应用一、常用缓冲液、试剂的配制碳酸盐缓冲液(Carbonate-Bicarbonate Buffer)由于碳酸盐pH值偏碱,因此,常用于pH>9的缓冲液配制(附表1)。
附表1. 0.2 mol/L碳酸盐缓冲液(pH9.2~10.7)磷酸缓冲液(Phosphate Buffers,PB)磷酸盐是使用最广泛的一种缓冲剂,由于它们是二级解离,有二个pKa 值,PO4:pKa1=2.12,pKa2=7.21;所以用它们配制的缓冲液,pH 范围最宽。
NaH2HPO4:pKa1=7.21,pKa2=12.32。
Na2另外,磷酸盐还有钾盐分子形式,一般来说,低温时钠盐难溶,钾盐易溶,因此,配制细胞培养用试剂时常常添加钾盐试剂,但若配制十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳的缓冲液时,只能用钠盐而不能用钾盐,因为SDS会与磷酸钾生成难溶的十二烷基硫酸钾。
磷酸缓冲液的优点为:①可配制成不同离子强度的缓冲液;②适用pH缓冲范围较宽;③受温度影响缓冲液pH值变化较小;④离子强度对缓冲液pH影响较小,如0.1mol/L缓冲液稀释10倍其pH变化小于0.1。
磷酸缓冲液的缺点是:①磷酸盐易与钙离子(Ca2+)、镁离子(Mg2+)及重金属离子结合生成不溶的沉淀物;②可能干扰某些生物化学反应过程,如对某些酶的催化活性具有一定程度的抑制作用。
NaH2PO4的pH值偏酸性,可用作pH<4的缓冲液。
Na2HPO4的pH值偏碱性,可用作pH>10的缓冲液。
而pH=6~8的中性缓冲液是更常用的缓冲液,需要NaH2PO4与Na2HPO4两种磷酸盐混合配制(附表2)。
附表2. 0.2 mol/L磷酸盐缓冲液(pH5.7~8.2)磷酸盐缓冲溶液(Phosphate-buffered saline, PBS)磷酸盐缓冲液是在磷酸缓冲液基础上添加NaCl以维持溶液的渗透压,因此,PBS适用于做细胞缓冲液,常用PBS配制如下。
常用pH缓冲液 缓冲液缓冲范围
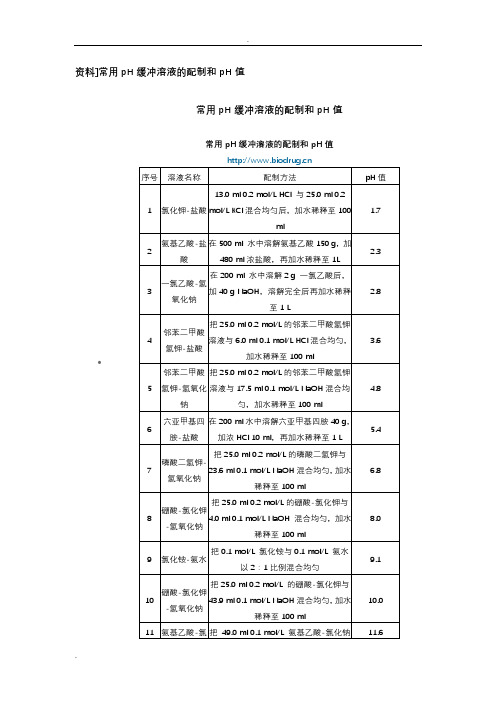
资料]常用pH缓冲溶液的配制和pH值•常用pH缓冲溶液的配制和pH值常用pH缓冲溶液的配制和pH值一、常用溶液的配制(一)溶液配制注意事项1.药品要有较好的质量试剂分为优级纯(保证试剂,Guaranteed reagent,G.R.)、分析试剂(Antalytical reagent,A.R.)化学纯(Chemical pure,C.P.)和实验试剂(Laboratory reagent,L.R.)等等。
工业用的化学试剂,杂质较多,只在个别情况下应用,如配洗液用的硫酸、配干燥剂的氯化钙等。
2.药品称量要精确。
3.配制试剂用水应用新鲜的去离子水或双蒸馏水,比电阻值在50万欧姆以上,pH在5.5~7.0之间才可应用,在组织培养等特殊用途时应注意此项要求,配制一般化验用溶液只要求用双蒸馏水或去离子水。
4.配好后的溶液,应立即除菌处理(如高压灭菌、抽滤或加抑菌物质),以防杂菌生长。
(二)0.067(1/15)Mol/L磷酸缓冲液1.1/15Mol/L磷酸二氢钾溶液的配制:称取磷酸二氢钾(KH2PO4,A.R.)9.08g,用蒸馏水溶解后,倾入1 000ml容量瓶内,再稀释至刻度(1 000ml)。
2.1/15Mol/L磷酸二氢钠溶液的配制:称取无水磷酸氢二钠(Na2HPO4,A.R.)9.47g(或者Na2HPO4·2H2O 11.87g)用蒸馏水溶解后,放入1 000ml容量瓶内,再加蒸馏水稀释至刻度(1 000ml)。
3.按附表的比例,配制成不同pH值的缓冲溶液。
•(三)0.15Mol/L PB 液Na 2HPO 4·2H 2O 分子量=175.05 0.15Mol/L 溶液含26.7g/L 。
Na 2HPO 4·12H 2O 分子量=358.22 0.15Mol/L 溶液含53.7g/L 。
NaH 2PO 4·H 2O 分子量=138.00 0.15Mol/L 溶液含20.7g/L 。
葡萄酒中铁含量测定的影响因素

光谱曲线。
表1 样品在相同浓度、不同波长下测得的吸光度值
Table 1. The absorbances of samples with the same concentration
under different wavelengths
由图2可知,随着显色剂用量的增加,溶液的吸光度也 不断增大,当显色剂的加入量在0.75mL~1.25mL范围内, 测得体系的吸光度稳定且保持不变,所以选择1.00mL作为 显色剂的加入量。 2.4 pH值的影响
分别用 pH 值 为 2.0、3.0、4.0、5.0、6.0、7.0、9.0 和 10.0的 缓冲溶液调整显色体系,然后在不同的pH值条件下测定其 吸光度值,结果见图3。
浓硫酸,过氧化氢溶液,氨水,盐酸羟胺溶液(100g/L), 邻啡罗啉溶液(2g/L),铁标准使用液(10μg/mL)。 1.1.3 实验仪器
721分光光度计。 1.1.4 实验方法
取1.00mL浓度为10μg/mL的铁标准使用液于25mL比 色管中,加水至10mL,加5.0mL乙酸-乙酸钠溶液(pH4.8)、 1.0mL邻啡罗啉溶液,然后加水至刻度,摇匀,放置10min 后用2cm比色皿,以试剂空白作参比,于波长505nm处,采 用721分光光度计测定吸光度。 2 结果与讨论 2.1 波长的选择
按照试验条件下,测定不同时间显色体系的吸光度 值,结果见表2。
收稿日期:2008-09-08 作者简介:鲍会梅(1974-),女,江苏淮安人,实验师,主要从事食品理化检验实验教学工作。
分析与检测
中国酿造
2009 年 第 2 期
DNA提取过程中各种试剂的作用及原理

DNA提取过程中各种试剂的作用及原理1.溶液I—溶菌液:溶菌酶:它是糖苷水解酶,能水解菌体细胞壁的主要化学成分肽聚糖中的β-1,4糖苷键,因而具有溶菌的作用。
当溶液中pH小于8时,溶菌酶作用受到抑制。
葡萄糖:增加溶液的粘度,维持渗透压,防止DNA受机械剪切力作用而降解。
EDTA:〔1〕螯合Mg2+、Ca2+等金属离子,抑制脱氧核糖核酸酶对DNA的降解作用〔DNase作用时需要一定的金属离子作辅基〕;〔2〕EDTA的存在,有利于溶菌酶的作用,因为溶菌酶的反响要求有较低的离子强度的环境。
2.溶液II-NaOH-SDS液:NaOH:核酸在pH大于5,小于9的溶液中,是稳定的。
但当pH>12或pH<3时,就会引起双链之间氢键的解离而变性。
在溶液II中的NaOH浓度为0.2mo1/L,加抽提液时,该系统的pH就高达12.6,因而促使染色体DNA与质粒DNA的变性。
SDS:SDS是离子型外表活性剂。
它主要功能有:〔1〕溶解细胞膜上的脂质与蛋白,因而溶解膜蛋白而破坏细胞膜。
〔2〕解聚细胞中的核蛋白。
〔3〕SDS能与蛋白质结合成为R-O-SO3-…R+-蛋白质的复合物,使蛋白质变性而沉淀下来。
但是SDS能抑制核糖核酸酶的作用,所以在以后的提取过程中,必须把它去除干净,防止在下一步操作中〔用RNase去除RNA时〕受到干扰。
3. 溶液III--3mol/L NaAc〔pH4.8〕溶液:NaAc的水溶液呈碱性,为了调节pH 至4.8,必须参加大量的冰醋酸。
所以该溶液实际上是NaAc-HAc的缓冲液。
用pH4.8的NaAc溶液是为了把pH12.6的抽提液,调回pH至中性,使变性的质粒DNA能够复性,并能稳定存在。
而高盐的3mol/L NaAc有利于变性的大分子染色体DNA、RNA以及SDS-蛋白复合物凝聚而沉淀之。
前者是因为中和核酸上的电荷,减少相斥力而互相聚合,后者是因为钠盐与SDS-蛋白复合物作用后,能形成较小的钠盐形式复合物,使沉淀更完全。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
北京雷根生物技术有限公司
乙酸钠溶液(2mol/L,pH4.8)
简介:
乙酸钠也称醋酸钠、NaAc ,是常规分子生物学试剂。
乙酸钠溶液(2mol/L,pH4.8) 又称醋酸钠溶液,主要由2M NaAc 、醋酸组成,调节pH 至4.8,未经高压灭菌,主要提供乙酸根,调节pH 值等。
组成:
操作步骤(仅供参考):
1、根据实验具体要求操作。
注意事项:
1、 如果每次的使用量很小,可以适当分装后再使用。
2、 注意密闭保存,否则pH 值会升高。
3、 为了您的安全和健康,请穿实验服并戴一次性手套操作。
有效期: 18个月有效。
相关:
编号 名称 R00758 Storage NaAc(2mol/L,pH4.8) 500ml RT 使用说明书 1份 编号 名称 DC0032 Masson 三色染色液
NH0042 SSC 缓冲液(10×,pH7.0)
NH0053 变性鲑鱼精DNA(10mg/ml)
NE0022 SDS 溶液(10%)
NR0001 DEPC 处理水(0.1%)
PW0111 Super ECL Plus 超敏发光液
TC0713 葡萄糖检测试剂盒(GOD-POD 比色法)。
