结构化学习题解答6
结构化学复习题及答案

结构化学复习题及答案一、选择题1. 原子轨道的波函数是关于原子核对称的,下列哪个轨道是关于z轴对称的?A. s轨道B. p轨道C. d轨道D. f轨道答案:A2. 根据分子轨道理论,下列哪个分子具有顺磁性?A. O2B. N2C. COD. NO答案:A3. 氢键通常影响分子的哪种性质?A. 熔点B. 沸点C. 密度D. 折射率答案:B二、填空题4. 原子轨道的电子云图是按照______概率密度绘制的。
答案:最高5. 根据价层电子对互斥理论,水分子H2O的几何构型是______。
答案:弯曲6. 一个分子的偶极矩为零,则该分子可能是______分子。
答案:非极性三、简答题7. 简述杂化轨道理论中sp^3杂化的特点。
答案:sp^3杂化是指一个原子的1个s轨道和3个p轨道混合形成4个等价的杂化轨道,这些杂化轨道的电子云呈四面体分布,通常用于描述四面体构型的分子,如甲烷。
8. 什么是分子轨道理论?它与价键理论的主要区别是什么?答案:分子轨道理论是一种化学理论,它将分子中的原子轨道组合成分子轨道来描述分子的电子结构。
与价键理论不同,分子轨道理论不假设电子成对形成共价键,而是将电子视为分布在整个分子空间中的分子轨道上的粒子。
分子轨道理论可以解释分子的磁性和电子的离域性,而价键理论则不能。
四、计算题9. 假设一个氢原子的电子从n=3的能级跃迁到n=2的能级,计算该过程中释放的光子能量。
答案:根据氢原子能级公式E_n = -13.6 eV / n^2,电子从n=3跃迁到n=2时释放的光子能量为ΔE = E_3 - E_2 = -13.6 eV / 3^2 - (-13.6 eV / 2^2) = 1.89 eV。
10. 计算一个CO分子的键能,已知C和O的电负性分别为2.55和3.44,CO的键长为1.128 Å。
答案:根据键能公式E = (χ1 - χ2)^2 / (4 * χ1 * χ2) * (1 - r / r0)^2,其中χ1和χ2分别是C和O的电负性,r是CO的键长,r0是C和O单键的标准键长1.43 Å。
结构化学习题解答

又
,
因此有两个光谱支项:
J113或 J111
22
22
2 P3 和 2 P1
2
2
对C原子激发态(1s)2(2s)2(2p)1(3p)1,只考虑组态(2p)1(3p)1即可。2P和3P电子是不等价电子,因而(2p)1(3p)1组态不受 Pauli原理限制,可按下述步骤推求其谱项:由
。因此可得6个光谱项:3D,3P,3S,1D,1P,1S。根据自旋一轨道相互作用,每一光谱项又分裂为数目不等的光谱
r =0 1 s
2
的表达式可
r 最大,因而 也最大。但实际上 不能为0(电子不可能落1到s 原子核上),因此更确切的说法是
趋近于0时1s电子6 的几率密度最大。
e r ((de))LLii原2+为子单的 电基a 0子组r“态原为子(1s”)2,(2s组)1态。的.对能2量s电只子与来主1说2s量,子1s数电有子关为,其所相以邻2内s和一2组p态电简子并,,=即0即.85E。2因s=而E:2p.
S2 1/ 2
F原子的基组态为(1s)2(2s)2(2p)5。与上述理由相同,该组态的光谱项和光谱支项只决定于(2p)5组态。根据
等价电子组态的“电子—空位”关系,(2p)5组态与(2p)1组态具有相同的谱项。因此,本问题转化为推求
(2p)1组态的光谱项和光谱支项。这里只有一个电子,S= ½ , L=1 ,故光谱项为2P。
r
e a0
ra0和 r2a0
而
1
1 a0
3/
2
a0
e a0
e1 e 2.71828
1
1 a0
3/
2
2a0
e a0
e2
12s在ra0和r2a0两处的比较 e2值 7.为 389: 06
结构化学习题答案.

exp[ix]{(i
d ) exp[ix]}* dx dx
1.12 下列函数中,哪几个是算符 的本征函数?若是,求出本征值
e x , sin x,2 cos x, x3 , sin x cos x
2 d2 x d 解: 2 e 1 e x , e x是 2 的本征函数,本征值为 1 dx dx
第一章 习题
1.1 将锂在火焰上燃烧,放出红光,波长 λ=670.8nm,这是Li原子由电子组态 (1s)2(2p)1→(1s)2(2s)1跃迁时产生的,试计算该红 光的频率、波数以及以kJ/mol为单位的能量。
解
2.998108 m s 1 4.4691014 s 1 670.8nm c
( ) d
1 1
*
exp ix(i
exp[ix]{(i
d ) exp[ix]}* dx dx
d ) exp[ ix]}dx dx
e ix (i
d ix )e dx dx
exp[ ix]{( i
e ixi e ix idx
d2 dx2
d2 d2 sin x 1 sin x, sin x是 2 的本征函数,本征值为 1; 2 dx dx
d2 d2 2 cos x 2 cos x,2 cos x是 2 的本征函数,本征值为 1 2 dx dx
2 d2 3 d 3 3 x 6 x cx , x 不是 2 的本征函数 2 dx dx
2 2 2
d d f d g f ( x), g ( x), ( f g) 2 2 2 dx dx dx
满足线性算符的要求,是线性算符。
d i , 1 exp[ ix], 1* exp[ ix] dx
结构化学习题解答

< p >= ψ ( x ) p ψ ( x )dx
x
∫
l
l
∗
∧
n
x
n
0
2 nπx ih d 2 nπx =∫ sin sin dx − 0 l l 2π dx l l ih l nπx nπx nπ = − ∫ sin cos ⋅ dx l πl 0 l l nih l nπx nπx = − 2 ∫ sin cos dx l l l 0 =0
E =
∫
ψ * H ψ dτ
∧
∫
ψ *ψ d τ
进行计算,所得结果是上述能级表达式计算所得结果的 进行计算,所得结果是上述能级表达式计算所得结果的1.0132 倍。
② 根据受一定势能场束缚的微粒所具有的量子效应和箱 ψ 中粒子的边界条件 [ n (0 ) = ψ n (l ) = 0] ,箱长应该等于半 波长的整数倍, 波长的整数倍,即:
2 n
即
2 px
n2h2 = 4l 2
将此式代入粒子的能量表达式,得:
1 1 n 2h 2 2 E = T +V = T = px = × 2m 2m 4l 2 n 2h 2 = 8 ml 2
若不知道粒子的波函数,则可采用下列两种方法求算能量: 若不知道粒子的波函数,则可采用下列两种方法求算能量: 解箱中粒子的Schrodinger方程, 在求解过程中会自然 方程, ① 解箱中粒子的 方程 得到与上述结果相同的能级表达式(参见周公度、 得到与上述结果相同的能级表达式(参见周公度、段连云 编著《结构化学基础》第二版, 北京大学出版社) 编著《结构化学基础》第二版,p27,北京大学出版社)。 若只求粒子最低能量(零点能)的近似值, 若只求粒子最低能量(零点能)的近似值,则亦可根据变 2 分法的思路, 为变分函数,用式: 分法的思路,选 ψ = xl − x 为变分函数,用式:
结构化学第6章配位化合物的结构和性质习题答案.doc

第6章配位化合物的结构和性质习题答案1、过渡金属配合物与一般以主族元素为屮心原子的配合物遵循的规则有何不同?为什么?答:过渡金属配合物一般遵守18电子规则,而一般主族元素为中心原子的配合物遵守8隅律。
一般主族元素的价轨道只有ns、叩共叫条价轨道,而过渡金属原子则有ns、np、nd共9条价轨道。
二者与配体成键吋都是倾向于尽可能完全使用所有价轨道,以使配合物达到最稳足状态。
2、杏阅文献得到碳酸肝酶(carbonic anhydrase)和质体蓝素(plastocyanin)的活性中心的结构,说明巾心原子的配位情况(配位数、配位原子、配体、空间构型)。
答:碳酸酐酶活性中心质体蓝素活性中心中心原子Zn2+Cu2十配位数44配体3个组氨酸的咪唑基,1个水分子两个组氨酸侧链上的咪吨,1个半光氨酸侧链,1个甲硫氨酸侧链配位原子3个N, 1个02个N,2个S空间构型四面体四面体3、CO是惰性分子,力什么能够与过渡金属形成稳定的羰基配合物?CO参与配位时是以C还是0配位,为什么?答:CO 与金属形成配合物时,可以形成协同的G-K 配键,获得显著的稳定化能,从而有 利于过渡金属配合物的形成。
CO 的电子组态为lo 22o 23o 24o 2l7T 45o 227r n ,最高占据轨道5o 主要由C 的原子轨道构成, 电荷密度偏向C ,因此,羰基配合物中,配体CO 以C 而不是O 原子与金属配位。
4、PF 3、PC13、PR 3等与过渡金属如Pd (Pd(PF 3)4)> Ni (Ni(PF 3)4)形成配合物时,可以形成 类似M-CO 的G-K 配键,试对其协同成键作用进行分析。
答:PF 3、PC13、卩^中卩是以sp 3不等性杂化轨道与3个F 或Cl 、R 成键,此外P 上还 有一对孤对电子。
Pd 、Ni 的价电子组态分别为SdYs 1、3d 84s 2,价电子数为10。
Pd 、 Ni 都采用sp 3杂化,当形成配合物时,屮心原子空的sp 3杂化轨道接受4个配体上的 孤对电子形成G 配键,而金属原子上的d 电子反馈给P 上的空轨道,形成反馈7C 键。
结构化学试题库及答案

结构化学试题库及答案1. 请简述原子轨道的概念,并说明s、p、d轨道的形状。
答案:原子轨道是描述电子在原子核外的空间运动状态的数学函数。
s轨道呈球形,p轨道呈哑铃形,d轨道则有四个瓣状结构。
2. 什么是化学键?请列举三种常见的化学键类型。
答案:化学键是相邻原子之间强烈的相互作用,使得原子能够结合在一起形成分子或晶体。
常见的化学键类型包括离子键、共价键和金属键。
3. 描述分子轨道理论的基本原理。
答案:分子轨道理论是基于量子力学的化学键理论,认为分子中的电子不再属于单个原子,而是在整个分子范围内分布,形成分子轨道。
4. 什么是杂化轨道?请举例说明sp3杂化。
答案:杂化轨道是指原子轨道在形成化学键时,由于原子间的相互作用而重新组合成新的等价轨道。
sp3杂化是指一个s轨道和三个p轨道混合形成四个等价的sp3杂化轨道,常见于四面体构型的分子中。
5. 请解释价层电子对互斥理论(VSEPR)。
答案:价层电子对互斥理论是一种用来预测分子几何形状的理论,它基于中心原子周围的价层电子对(包括成键电子对和孤对电子)之间的排斥作用,从而推断出分子的空间几何结构。
6. 什么是超共轭效应?请给出一个例子。
答案:超共轭效应是指在有机分子中,非成键的σ电子与π电子之间的相互作用,这种效应可以增强分子的稳定性。
例如,在乙烷分子中,甲基上的σ电子可以与乙烯的π电子发生超共轭,从而稳定乙烯。
7. 描述共振结构的概念及其在化学中的重要性。
答案:共振结构是指分子中电子分布的两种或多种等效的描述方式,这些描述方式虽然不同,但都能合理地解释分子的性质。
共振结构在化学中的重要性在于它们提供了一种理解分子稳定性和反应活性的方法。
8. 什么是芳香性?请列举三个具有芳香性的化合物。
答案:芳香性是指某些环状有机化合物具有的特殊稳定性,这种稳定性来源于环上的π电子的离域化。
具有芳香性的化合物包括苯、吡啶和呋喃。
9. 请解释什么是分子的极性,并举例说明。
王顺荣编高教版社结构化学习题答案第6章

(dxy)
(dz2)
(dxz,dyz) LFSE(D4h)=-[2× 0.228+2× (-0.428)+4× (-0.514)] =2.456 所以,LFSE(D4h)>LFSE(Td),即 Ni2+的低自旋配合物通常为正四方形构型。 若 Ni2+的高自旋配合物呈四面体构型,则 d 电子排布如图:
14、为什么羰基配合物中过度金属原子可以是零价(例如 Fe(CO)5) ,甚至是负 价(例如[Co(CO)4]-)? 答:CO 分子的结构为:KK(3σ)2(4σ)2(1π)4(5σ)2(2π)0 可见 CO 分子 中既有低能的 π 占有轨道----1π,又有高能的 π 空轨道----2π,CO 被占用的分子 轨道中,3σ 轨道中电子云大部分密集于 C 和 O 核之间,电子不易给出。4σ 轨道 中电子云主要集中于氧原子一侧, 由于氧的电负性较大, 电子也不易给出。 所以, 能对中心离子给予电子对而形成 σ 键的 CO 的分子轨道只有 1π 和 5σ 轨道。 在 Fe(CO)5 中,中心原子与配位体 σ 轨道,即 CO 的 5σ 轨道可形成 a1g t1u 和 eg 成键 σ 轨道,有 5 个 CO 共 10 个电子填充。这相当于配位体上的电子部分与中
结构化学第六章 配位化合物和簇合物的结构与性质习题解答
组员:林景 070601332 邱丽清 070601327 王华 070601328 林培海 070601349
黄水英 070601329 余建红 070601330 刘梅丽 070601331
1、为什么大多数配合物都有鲜艳的颜色,而四面体 Zn2+的配合物却例外? 答: 配合物中心金属原子或离子的 d 轨道分裂后,在光照下 d 电子可从能级低的 d 轨道跃迁到能级高的 d 轨道,产生 d—d 跃迁和吸收光谱。由于 d—d 跃迁对应 的光子频率在近紫外和可见光区,故过渡金属配合物通常都有颜色。Zn2+的 3d 轨道已充满电子,它通常以 sp3 杂化 轨道形成配建,无 d—d 能级跃迁,电子跃 迁只能发生在 σ—σ*之间,能级差大,在可见光的短波之外。因此,在配位化合 物一般是无色的。
结构化学课后习题答案

结构化学课后习题答案结构化化学课后习题答案一、化学键与分子结构1. 选择题a) 正确答案:D解析:选择题中,选项D提到了共价键的形成是通过电子的共享,符合共价键的定义。
b) 正确答案:B解析:选择题中,选项B提到了离子键的形成是通过电子的转移,符合离子键的定义。
c) 正确答案:C解析:选择题中,选项C提到了金属键的形成是通过金属原子之间的电子云重叠,符合金属键的定义。
d) 正确答案:A解析:选择题中,选项A提到了氢键的形成是通过氢原子与高电负性原子之间的吸引力,符合氢键的定义。
2. 填空题a) 正确答案:共价键解析:填空题中,根据问题描述,两个非金属原子之间的键称为共价键。
b) 正确答案:离子键解析:填空题中,根据问题描述,一个金属原子将电子转移到一个非金属原子上形成的键称为离子键。
c) 正确答案:金属键解析:填空题中,根据问题描述,金属原子之间的电子云重叠形成的键称为金属键。
d) 正确答案:氢键解析:填空题中,根据问题描述,氢原子与高电负性原子之间的吸引力形成的键称为氢键。
二、有机化学1. 选择题a) 正确答案:C解析:选择题中,选项C提到了烷烃是由碳和氢组成的,符合烷烃的定义。
b) 正确答案:D解析:选择题中,选项D提到了烯烃是由含有一个或多个双键的碳原子组成的,符合烯烃的定义。
c) 正确答案:B解析:选择题中,选项B提到了炔烃是由含有一个或多个三键的碳原子组成的,符合炔烃的定义。
d) 正确答案:A解析:选择题中,选项A提到了芳香烃是由芳香环结构组成的,符合芳香烃的定义。
2. 填空题a) 正确答案:醇解析:填空题中,根据问题描述,含有羟基(-OH)的有机化合物称为醇。
b) 正确答案:醚解析:填空题中,根据问题描述,含有氧原子连接两个碳原子的有机化合物称为醚。
c) 正确答案:酮解析:填空题中,根据问题描述,含有羰基(C=O)的有机化合物称为酮。
d) 正确答案:酯解析:填空题中,根据问题描述,含有羧基(-COO)的有机化合物称为酯。
结构化学习题答案(课堂PPT)

L/O/G/O
刘义武
2020/4/27
1
参考书
• 结构化学习题解析 周公度等著 • 物质结构学习指导 倪行等著 • 结构化学500题解 刘国范等 • 结构化学学习指导 韦吉崇等
2020/4/27
2
常用物理常数
普朗克常数 h 6.626×10−34 J•s 真空中光速 c 2.998×108 m•s -1 电子质量 me 9.110×10−31 kg 中子质量mn 1.675×10−27 kg
d2 dx2
的本征函数。
(a-x)e-x
d2 dx2
(a-x)e-x
=
d2 dx2
(ae-x - xe-x)
=
d dx
(ae-x ∙ (-1) – (e-x + xe-x ∙(-1)))
= d (-ae-x – e-x +xe-x) dx
= ae-x + e-x+ e-x- xe-x = ae-x + 2e-x- xe-x = (a+ 2- x)e-x
2020/4/27
22
14. 确定碳原子的基普项及激发态p1d1的所有可能的谱项
1 0 -1
2020/4/27
23
15. 确定Cr、Cu、Br的基普支项 0
解:Cr的价电子排布为:3d54s1 2 1 0 -1 -2
ms = 3, S = 3,mL = 0 , L = 0, J = 3,基普支项是:
2020/4/27
5
9
解:根据 h ν = mυ 2 / 2 + W0公式得
υ = √ 2(h ν - W0) / m = √ 2(h c / λ - h ν ) / m
结构化学章节习题(含答案)

结构化学章节习题(含答案)第⼀章量⼦⼒学基础⼀、单选题: 1、32/sinx l lπ为⼀维势箱的状态其能量是:( a ) 22229164:; :; :; :8888h h h hA B C D ml ml ml ml 2、Ψ321的节⾯有( b )个,其中( b )个球⾯。
A 、3 B 、2 C 、1 D 、03、⽴⽅箱中2246m lh E ≤的能量范围内,能级数和状态数为( b ). A.5,20 B.6,6 C.5,11 D.6,174、下列函数是算符d /dx的本征函数的是:( a );本征值为:( h )。
A 、e 2xB 、cosXC 、loge xD 、sinx 3E 、3F 、-1G 、1H 、2 5、下列算符为线性算符的是:( c )A 、sine xB 、C 、d 2/dx 2D 、cos2x6、已知⼀维谐振⼦的势能表达式为V = kx 2/2,则该体系的定态薛定谔⽅程应当为( c )。
A [-m 22 2?+21kx 2]Ψ= E ΨB [m 22 2?- 21kx 2]Ψ= E Ψ C [-m 22 22dx d +21kx 2]Ψ= E Ψ D [-m 22 -21kx 2]Ψ= E Ψ 7、下列函数中,22dx d ,dxd的共同本征函数是( bc )。
A cos kxB e –kxC e –ikxD e –kx2 8、粒⼦处于定态意味着:( c )A 、粒⼦处于概率最⼤的状态B 、粒⼦处于势能为0的状态C 、粒⼦的⼒学量平均值及概率密度分布都与时间⽆关系的状态.D 、粒⼦处于静⽌状态9、氢原⼦处于下列各状态 (1)ψ2px (2) ψ3dxz (3) ψ3pz (4) ψ3dz 2 (5)ψ322 ,问哪些状态既是M 2算符的本征函数,⼜是M z 算符的本征函数?( c )A. (1) (3)B. (2) (4)C. (3) (4) (5)D. (1) (2) (5) 10、+He 离⼦n=4的状态有( c )(A )4个(B )8个(C )16个(D )20个 11、测不准关系的含义是指( d ) (A) 粒⼦太⼩,不能准确测定其坐标; (B)运动不快时,不能准确测定其动量(C) 粒⼦的坐标的动量都不能准确地测定;(D )不能同时准确地测定粒⼦的坐标与动量12、若⽤电⼦束与中⼦束分别作衍射实验,得到⼤⼩相同的环纹,则说明⼆者( b ) (A) 动量相同 (B) 动能相同 (C) 质量相同13、为了写出⼀个经典⼒学量对应的量⼦⼒学算符,若坐标算符取作坐标本⾝,动量算符应是(以⼀维运动为例) ( a )(A) mv (B) i x ?? (C)222x ?-? 14、若∫|ψ|2d τ=K ,利⽤下列哪个常数乘ψ可以使之归⼀化:( c )(A) K (B) K 2 (C) 1/K15、丁⼆烯等共轭分⼦中π电⼦的离域化可降低体系的能量,这与简单的⼀维势阱模型是⼀致的,因为⼀维势阱中粒⼦的能量( b )(A) 反⽐于势阱长度平⽅ (B) 正⽐于势阱长度 (C) 正⽐于量⼦数16、对于厄⽶算符, 下⾯哪种说法是对的( b )(A) 厄⽶算符中必然不包含虚数 (B) 厄⽶算符的本征值必定是实数(C) 厄⽶算符的本征函数中必然不包含虚数17、对于算符?的⾮本征态Ψ( c )(A) 不可能测量其本征值g . (B) 不可能测量其平均值.(C) 本征值与平均值均可测量,且⼆者相等18、将⼏个⾮简并的本征函数进⾏线形组合,结果( b )(A) 再不是原算符的本征函数(B) 仍是原算符的本征函数,且本征值不变 (C) 仍是原算符的本征函数,但本征值改变19. 在光电效应实验中,光电⼦动能与⼊射光的哪种物理量呈线形关系:( B )A .波长B. 频率C. 振幅20. 在通常情况下,如果两个算符不可对易,意味着相应的两种物理量( A)A .不能同时精确测定B .可以同时精确测定C .只有量纲不同的两种物理量才不能同时精确测定 21. 电⼦德布罗意波长为(C )A .λ=E /h B. λ=c /ν C. λ=h /p 22. 将⼏个⾮简并的本征函数进⾏线形组合,结果( A) A .再不是原算符的本征函数B .仍是原算符的本征函数,且本征值不变C .仍是原算符的本征函数,但本征值改变23. 根据能量-时间测不准关系式,粒⼦在某能级上存在的时间τ越短,该能级的不确定度程度ΔE (B)A .越⼩ B. 越⼤ C.与τ⽆关24. 实物微粒具有波粒⼆象性, ⼀个质量为m 速度为v 的粒⼦的德布罗意波长为:A .h/(mv)B. mv/hC. E/h25. 对于厄⽶算符, 下⾯哪种说法是对的 ( B )A .厄⽶算符中必然不包含虚数B .厄⽶算符的本征值必定是实数C .厄⽶算符的本征函数中必然不包含虚数 26. 对于算符?的⾮本征态Ψ (A ) A .不可能测得其本征值g. B .不可能测得其平均值.C .本征值与平均值均可测得,且⼆者相等 27. 下列哪⼀组算符都是线性算符:( C )A . cos, sinB . x, logC . x d dx d dx,,22⼆填空题1、能量为100eV 的⾃由电⼦的德布罗依波波长为( 122.5pm )2、函数:①xe ,②2x ,③x sin 中,是算符22dxd 的本征函数的是( 1,3 ),其本征值分别是( 1,—1;)3、Li 原⼦的哈密顿算符,在(定核)近似的基础上是:(()23213212232221223222123332?r e r e r e r e r e r e mH +++---?+?+?-= )三简答题1. 计算波长为600nm(红光),550nm(黄光),400nm(蓝光)和200nm(紫光)光⼦的能量。
结构化学课后习题及答案
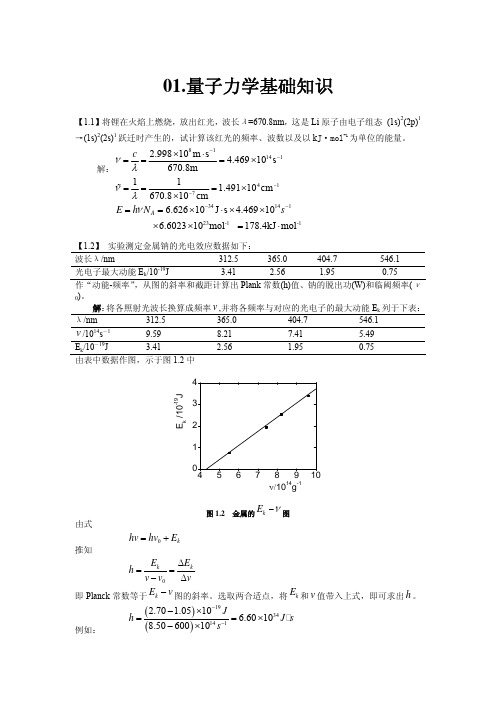
01.量子力学基础知识【1.1】将锂在火焰上燃烧,放出红光,波长λ=670.8nm ,这是Li 原子由电子组态 (1s)2(2p)1→(1s)2(2s)1跃迁时产生的,试计算该红光的频率、波数以及以k J·mol -1为单位的能量。
解:811412.99810m s 4.46910s 670.8m cνλ−−×⋅===× 41711 1.49110cm 670.810cm νλ−−===××%3414123-1 -16.62610J s 4.46910 6.602310mol 178.4kJ mol A E h N sν−−==×⋅××××=⋅【1.2】 实验测定金属钠的光电效应数据如下:波长λ/nm 312.5 365.0 404.7 546.1 光电子最大动能E k /10-19J 3.41 2.56 1.95 0.75 作“动能-频率”,从图的斜率和截距计算出Plank 常数(h)值、钠的脱出功(W)和临阈频率(ν0)。
解:将各照射光波长换算成频率,并将各频率与对应的光电子的最大动能E k 列于下表:v λ/nm 312.5 365.0 404.7 546.1v /1014s -19.59 8.21 7.41 5.49E k /10-19J 3.41 2.56 1.95 0.75 由表中数据作图,示于图1.2中E k /10-19Jν/1014g-1图1.2 金属的kE ν−图由式 0k hv hv E =+推知0k kE E h v v v Δ==−Δ即Planck 常数等于图的斜率。
选取两合适点,将和v 值带入上式,即可求出h 。
例如: k E −v k E ()()19341412.708.50 1.0510 6.601060010J h J s s −−−×==×−×图中直线与横坐标的交点所代表的即金属的临界频率,由图可知,。
中国科学技术大学结构化学习题参考答案

间恒为零。 取 xy 平 面
为
解之可得两个特解 7. (a)
(b) 在区间 8. 用 不 确 定 原 virial定理应成立。 9. 要求
整数,且
,得n为
12.
是的本 征函数, 所以动量 平方有确 粒子的 定值 几率为
-12
4. (a) 1.2 Å (b) 1.2×10 Å 5. 6. 势能算符 则圆周上的波函数不为零,其他区
作为用圆周面,则θ=90 °,r=a,Schröinger方程
理估算其电子的动能,对于Coulomb作用体系,
,
,利用单
值条件
10. 电 离能等 于轨
。
该
体
道能
量之负
2
值。
系 只有 一 个边 界 条件11. 2n 。
(即单值条件),无法
确定其通解的两个系 数 ,只 求 特解 就 可以。
了。
,当n=3
。
时有最大值
在
区间为
有限值,则k必
须是纯虚数,
此时本征值为
实数。
以忽略万有引力的贡献。
。完全可
13. 和具有相同的本征函数,本征值相差常数c。本题说明能量零点
的选取不影响体系的状态。
,
,
,
17. 0.32。
14.
15.
。
16. 0.°,135°
20.
21. ①
第 五章 多原子分 子
;(c)
3.
;(d) ;
; (e) 。
1. 。 2. 。
;
。
4. 相同。
; ,
, ,
。
11(略)。
5. 。 6.
7.
。 8. 四面体构型。
结构化学课后答案

一、练习题1.立方势箱中的粒子,具有的状态量子数,是A. 211 B. 231 C. 222 D. 213。
(参考答案)解:(C)。
2.处于状态的一维势箱中的粒子,出现在处的概率是多少?A.B.C.D.E.题目提法不妥,以上四个答案都不对。
(参考答案)解:(E)。
3.计算能量为100eV光子、自由电子、质量为300g小球的波长。
( )(参考答案)解:光子波长自由电子300g小球。
4.根据测不准关系说明束缚在0到a范围内活动的一维势箱中粒子的零点能效应。
(参考答案)解:。
5.链状共轭分子在波长方向460nm处出现第一个强吸收峰,试按一维势箱模型估计该分子的长度。
(参考答案)解:6.设体系处于状态中,角动量和有无定值。
其值是多少?若无,求其平均值。
(参考答案)解:角动量角动量平均值7.函数是不是一维势箱中粒子的一种可能的状态?如果是,其能量有没有确定值?如有,其值是多少?如果没有确定值,其平均值是多少?(参考答案)解:可能存在状态,能量没有确定值,8.求下列体系基态的多重性。
(2s+1) (1)二维方势箱中的9个电子。
(2)二维势箱中的10个电子。
(3)三维方势箱中的11个电子。
(参考答案)解:(1)2,(2)3,(3)4。
9.在0-a间运动的一维势箱中粒子,证明它在区域内出现的几率。
当,几率P怎样变?(参考答案)解:10.在长度l的一维势箱中运动的粒子,处于量子数n的状态。
求 (1)在箱的左端1/4区域内找到粒子的几率?(2)n为何值,上述的几率最大?(3),此几率的极限是多少?(4)(3)中说明什么?(参考答案)解:11.一含K个碳原子的直链共轭烯烃,相邻两碳原子的距离为a,其中大π键上的电子可视为位于两端碳原子间的一维箱中运动。
取l=(K-1)a,若处于基组态中一个π电子跃迁到高能级,求伴随这一跃迁所吸收到光子的最长波长是多少?(参考答案)解:12.写出一个被束缚在半径为a的圆周上运动的质量为m的粒子的薛定锷方程,求其解。
结构化学习题解答

= 2 2sin πx cos πx cos πx = 2 sin 2πx cos πx
a aaaaa a
的箱体长度)。
解:一维箱粒子的Shrödinger方程、能量本征值En和本征函数ψ n ( x) − 2 d 2ψ ( x) = Eψ ( x)(1) 2m dx 2
En
=
h2 8ma 2
n2 (2)
ψ n(x) =
2 sin nπx (3)
aa
由ψ ( x) 和ψ n ( x)的表达式可知,① ψ ( x)是一品优函数,故ψ ( x)
dx
∂x
设体系的粒子数为1,则有
[ x, Hˆ ] = [ x,{−
2 ∂2 2m ( ∂x 2
+
∂2 ∂y 2
+
∂2 ∂z 2
) +V (x,
y, z)}]
=
[ x,{−
2 2m
∂
[x,( ∂ ∂x
)2
]
2
∂∂ ∂ ∂
= − {[ x, ] + [ x, ]}
2m ∂x ∂x ∂x ∂x
若是,则对应的本征值为何(结合一维箱粒子的势能设置思考
一下)?
3. 证明一维粒子动量算符
pˆ x
=
−i
d dx
是Hermite算符。
4. 若 Fˆ 和 Gˆ 均为Hermite算符,则 c1Fˆ + c2Gˆ 和 cFˆGˆ 是否亦为
Hermite算符?
5. 证明 [ Aˆ , Bˆ Cˆ ] = [ Aˆ , Bˆ ]Cˆ + Bˆ[ Aˆ , Cˆ ] [ Aˆ Bˆ , Cˆ ] = Aˆ[Bˆ , Cˆ ] + [ Aˆ , Cˆ ]Bˆ
第六章 《结构化学》第六章题库及答案

《结构化学》第六章题库6001试述正八面体场中,中心离子d 轨道的分裂方式。
6002试用分子轨道理论阐明X-,NH3和CN-的配体场强弱的次序。
6003按配位场理论,在O h场中没有高低自旋络合物之分的组态是:---------------- ( )(A) d3 (B) d4(C) d5(D) d6(E) d76004凡是中心离子电子组态为d6的八面体络合物,其LFSE 都是相等的,这一说法是否正确?6005络合物的中心离子的d 轨道在正方形场中,将分裂成几个能级:---------------- ( )(A) 2 (B) 3 (C) 4 (D) 56006Fe(CN)63-的LFSE=________________。
6007凡是在弱场配位体作用下,中心离子d 电子一定取高自旋态;凡是在强场配位体作用下,中心离子d 电子一定取低自旋态。
这一结论是否正确?6008t,故LFSE为_____________。
Fe(CN)64-中,CN-是强场配位体,Fe2+的电子排布为6g26009尖晶石的一般表示式为AB2O4,其中氧离子为密堆积,当金属离子A占据正四面体T d空隙时,称为正常尖晶石,而当A占据O h空隙时,称为反尖晶石,试从晶体场稳定化能计算说明NiAl2O4晶体是什么型尖晶石结构( Ni2+为d8结构)。
6010在Fe(CN)64-中的Fe2+离子半径比Fe(H2O)62+中的Fe2+离子半径大还是小?为什么?6011作图证明CO 是个强配位体。
6012CoF63-的成对能为21?000 cm-1,分裂能为13?000 cm-1,试写出:(1) d 电子排布(2) LFSE 值(3) 电子自旋角动量(4) 磁矩6013已知ML6络合物中(M3+为d6),f=1,g= 20?000 cm-1,P= 25?000 cm-1,它的LFSE绝对值等于多少?------------------------------------ ( )(A) 0 (B) 25?000 cm-1(C) 54?000 cm-1(D) 8000 cm-16014四角方锥可认为是正八面体从z方向拉长,且下端没有配体L的情况。
结构化学习题解答6

(c)
Cl Pt O NH2 H O H NH2
Cl NH2
O
H H
Cl Pt Cl
O
NH2
该化合物无σ—π配键。
[6.15] 硅胶干燥剂中常加入 CoCl (蓝色),吸水 2 后变为粉红色,试用配位场理论解释其原因。
[ 解 ] : Co2+ 为 d7 构型。在无水 CoCl2 中, Co2+ 受配体 Cl-的作用d轨道能级发生分裂,7个d电子按电子排 布三原则填充在分裂后的轨道上。当电子发生 d—d 跃迁时,吸收波长为 650~750nm 的红光,因而显示 蓝色。但CoCl2吸水后,变为[Co(H2O)6]Cl2,即由相 对较强的配体H2O取代了相对较弱的配体Cl-,引起 d轨道分裂能变大,使电子发生d—d跃迁时吸收的能 量增大,即吸收光的波长缩短(蓝移)。 [Co(H2O)6]Cl2 吸收波长为 490~500nm 的蓝光,因而 呈粉红色。
a1g e2g
处在高能级轨道a1g*上的电子易失去,所以Co(C5H5) 2易被氧 化成为Co(C5H5) 2+ 。
[6.12] 用Jahn-Teller效应说明下列配位离子中哪些会发生变形。 (a) N i(H2O)62+ (b) CuCl42(c)CuCl64(d)Ti(H2O)63+ (e)Cr(H2O)62+ (f) MnCl64[解]: Jahn-Teller效应的大意是:在对称的非线型配合物中, 若出现简并态,则该配合物是不稳定的。此时它必然会发 生变形,使其中一个轨道能级降低,消除简并,获得额外 的稳定化能。对过渡金属配合物来说,产生Jahn-Teller效 应的根源是中心原子d电子分布的不对称性。 对于六配位的配合物,d电子的构型为d0 , d5(HS)和d10 时,其电子分布是球对称的,最稳定的几何构型是正八面 体。d电子的构型为d3 ,d6(LS) 和d8时,其分布是八面体 对称,配合物也呈正八面体构型。 若d电子分布不对称,则配合物将发生畸变,产生长键 和短键之别。若d电子分布的不对称性涉及到能级较高eg* 的轨道,则畸变程度大;若d电子分布的不对称性只涉及 到能级较低的t2g轨道,则畸变程度较小。具体情况是:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(a) 8
(b) 4
(c )
[6.3] 判断下列配位离子是高自旋还是低自旋,画出d电子 排布方式,计算LFSE(用0表示)。
2 4 a MnH2O6 b FeCN 6 c FeF63
[解]
配位离子 d电子排布 自旋情况 LFSE 0
MnH 2O 2 6 HS 0
, 配位场稳定化
* 0 g 3
能为1.2 0。反键轨道上无电子是 H 2O 6 较稳定的 Cr 原因。该配位离子不发 Jahn Teller畸变。 生
Hale Waihona Puke FeCN 64FeF63 HS 0
LS 2 .4
[6.6] 解释为什么在水溶液中八面体配位的Mn3+不稳定,而八面 体配位的Cr3+却稳定。 [解]
水是弱场配体,故 H 2O 为高自旋配位离子 Mn
3 6 3
(P 28000 1, 0 21000 1),其d电子排布 cm cm 为t 2 g e
[6.1] 写出下列配合物中各配位体提供给中心金属原子的电子 数目,计算中心原子周围的价电子总数:
(a) ( 5 C5 H 5 ) 2 Fe
[解]
(c) K PtCl3 C2 H 4 H 2O (a) 5,18 (b) 2,16 (c )
(b) Ni (CN ) 2 4 (d )
Co(en) 2 Cl2
(d ) 4,2,18
2,2,16
[6.2] 计算下列配位化合物中金属原子的配位数:
(a) Ti(C5 H 5 ) 2 Cl2 (c) Cr (C6 H 6 )(CO)3
[解]
(b) (d ) 6
Co(en) 2 Cl2
(d ) 6
Ag( NH 3 ) 4
, 配位场稳定化能为0.6 。处在e 轨道
* 1 g 0 * g 3
上的电子易失去 失去后配位场稳定化能 , 增大为 .2 0。 1 这就是MnH 2O 6 不稳定的原因。另外, 它还容易发 生Jahn Teller畸变。
3 6 3
Cr H 2O 中d电子的排布位t 2 g e
