2020版高考化学一轮复习含最新2019高考题第8章 第26讲 新题培优练
2020届高考化学一轮复习人教版第八章恒定电流Word版含答案

第八章⎪⎪⎪恒定电流第46课时 电阻定律、欧姆定律(双基落实课)点点通(一) 电流的三个表达式[小题练通]1.(鲁科教材原题)关于电流,以下说法正确的是( ) A .在导体中,只要自由电荷在运动,就一定会形成电流B .电流的方向就是电荷定向移动的方向C .电流总是从电势高的一端流向电势低的一端D .导体两端没有电压就不能形成电流解析:选D 只有电荷的定向移动才能形成电流,A 错误;正电荷定向移动的方向为电流方向,B 错误;在电源内部,电流从电势低的一端流向电势高的一端,在电源外部,电流从电势高的一端流向电势低的一端,C 错误;电压是形成电流的原因,导体两端没有电压就不能形成电流,D 正确。
2.(教科教材原题)在示波管中,电子枪2 s 内发射6×1013个电子,则示波管中电流大小约为( )A .4.8×10-6 AB .3×1013 AC .9.6×10-6 AD .3×10-6 A解析:选A 由题意知,2 s 内发射的电荷量为q =1.6×10-19×6×1013 C =9.6×10-6 C ,根据电流的定义式I =qt ,得I =9.6×10-62A =4.8×10-6 A ,A 正确。
3.安培提出了著名的分子电流假说,根据这一假说,电子绕核运动可等效为一环形电流。
设电荷量为e 的电子,以速率 v 绕原子核沿顺时针方向做半径为r 的匀速圆周运动,关于该环形电流的说法正确的是( )A .电流大小为v e2πr ,电流方向为顺时针B .电流大小为v er ,电流方向为顺时针 C .电流大小为v e2πr ,电流方向为逆时针D .电流大小为v er,电流方向为逆时针解析:选C 电子做匀速圆周运动的周期T =2πr v ,由I =eT 得I =v e 2πr ,电流的方向与电子运动方向相反,故电流方向为逆时针,C 正确。
第26讲 物质的分离、提纯、检验与鉴别(练)- 2024年高考化学大一轮复习【精讲精练+专题讲座】

第26讲 物质的分离、提纯、检验与鉴别1.下列关于仪器使用的说法正确的是A .a 和f 可用于蒸发结晶B .c 和d 均有“0”刻度C .b 、e 和g 常用于物质分离D .d 、f 、g 使用前需检漏 【答案】C【解析】a 为泥三角、f 为坩埚,泥三角和坩埚均可用于灼烧,而不是蒸发结晶,故A 错误;c 为量筒无“0”刻度,d 为碱式滴定管其零刻度在上端,故B 错误;b 、e 、g 分别为蒸馏烧瓶、直形冷凝管和球形分液漏斗,常用于物质的分离,故C 正确;d 、f 、g 分别为碱式滴定管、坩埚和球形分液漏斗,其中只有坩埚在使用前不需捡漏外其余在使用前均要捡漏,故D 错误;故选C 。
2.下列有关气体除杂的试剂选择正确的是 A .除去2CO 中的HCl :饱和食盐水 B .除去22C H 中的2H S :硫酸铜溶液 C .除去38C H 中的24C H :酸性高锰酸钾溶液 D .除去2CO 中的2SO :饱和碳酸钠溶液 【答案】B【解析】盐酸能与碳酸氢钠溶液反应生成二氧化碳,二氧化碳不溶于饱和碳酸氢钠溶液,则除去二氧化碳中的氯化氢杂质应选用饱和碳酸氢钠溶液,不能饱和食盐水,故A 错误;硫化氢能与硫酸铜溶液反应生成硫化铜沉淀和硫酸,而乙炔与硫酸铜溶液不反应,则除去乙炔中的硫化氢杂质应选择硫酸铜溶液,故B 正确;乙烯与酸性高锰酸钾溶液发生氧化反应生成二氧化碳气体,则除去丙烷中的乙烯杂质不能选用酸性高锰酸钾溶液,否则会引入新杂质二氧化碳,应选择溴水,故C 错误;二氧化碳和二氧化硫电能与碳酸钠溶液反应,所以除去二氧化碳中的二氧化氯杂质不能选用饱和碳酸钠溶液,应选用饱和碳酸氢钠溶液,故D 错误;故选B 。
3.为提纯下列物质(括号内的物质为杂质),所选用的除杂试剂和分离方法均正确的有几项A.1B.2C.3D.4【答案】B【解析】①二氧化碳和二氧化硫均会和饱和碳酸钠溶液反应,除杂方法错误;①生石灰和水生成氢氧化钙,然后利于乙醇沸点较低的性质蒸馏出乙醇,正确;①碳酸钠和乙酸反应生成盐溶液、和乙酸乙酯不反应且分层,能用分液的方法分离出有机层乙酸乙酯,正确;①溴和苯酚生成的三溴苯酚溶于苯中,不能过滤分离,错误;①苯与溴苯互溶,不能分液分离,错误;故选B。
2019高考化学一轮选练编题8含解析新人教版

人教化学2019高考一轮选练编题(8)李仕才一、选择题1.某溶液中含有NH+4、SO2-3、SiO2-3、Br-、CO2-3、Na+,向该溶液中通入过量的Cl2,则下列判断正确的是( )①反应前后,溶液中离子浓度基本保持不变的有NH+4、Na+②有胶状物质生成③有气体产生④溶液颜色发生变化⑤共发生了2个氧化还原反应A.①②③④ B.②③④C.①③⑤ D.②④⑤解析:通入过量的Cl2后,SO2-3被Cl2氧化为SO2-4;SiO2-3和氯水中的HCl反应生成硅酸胶状沉淀;Br-被Cl2氧化为Br2,使溶液颜色变为橙黄色;CO2-3和氯水中的HCl反应生成CO2气体;只有NH+4和Na+没有发生反应。
发生的反应中有3个氧化还原反应,即Cl2氧化SO2-3、Cl2氧化Br-、Cl2和H2O的反应,故①②③④正确。
答案:A2.在加入金属Al产生H2的溶液中,一定不能大量共存的离子组是( )A.Na+、Mg2+、Cl-、SO2-4B.K+、AlO-2、SO2-3、Cl-C.Ag+、K+、NO-3、Na+D.Ba2+、Na+、Cl-、NO-3解析:“加入金属Al产生H2”,溶液可能是酸性(不含NO-3)也可能是碱性。
选项A中Mg2+在碱性条件下不能存在,但在酸性条件下可以共存;选项B在酸性条件下与SO2-3生成气体、与AlO-2生成沉淀,在碱性条件下能共存;C、D两选项中均含有NO-3,酸性条件下都不产生H2,C选项中Ag+与OH-不能共存,D选项能在碱性条件下共存。
答案:C3.有甲、乙两个完全相同的装置,分别在它们的侧管中装入1.06 g Na2CO3和0.84 g NaHCO3,试管中各有10 mL相同浓度的盐酸(如图),同时将两个侧管中的物质全部倒入各自的试管中,下列叙述正确的是( )A.甲装置的气球膨胀速率大B.若最终两气球体积相同,则一定有c(HCl)≥2 mol·L-1C.若最终两气球体积不同,则一定有c(HCl)≤1 mol·L-1D.最终两溶液中Na+、Cl-的物质的量相同A.SiO2属于两性氧化物B.盛放Na2CO3溶液的试剂瓶能用玻璃塞C.硅胶吸水后可重复再生D.图中所示转化反应都是氧化还原反应解析:SiO2是酸性氧化物,它能与氢氟酸反应是其特殊性质,A错;在图示转化关系中只有第一行的变化是氧化还原反应,其余均为非氧化还原反应。
2020高考化学一轮复习基础练8含解析

【2019最新】精选高考化学一轮复习基础练8含解析李仕才一、选择题1、设NA为阿伏加德罗常数的值。
下列说法正确的是( )A.18 g H2O中含有10NA个质子B.1 mol甲苯中含有6NA个C—H键C.标准状况下,22.4 L氨水中含有NA个NH3分子D.将56 g铁片投入足量浓H2SO4中生成NA个SO2分子解析每个水分子中含有10个质子,18 g H2O的物质的量为1 mol,1 mol H2O中含有10 mol质子,A项正确;1 mol甲苯中含有8NA个C—H键,B项错误;标准状况下,氨水为液体,不能用气体摩尔体积计算,C项错误;Fe在浓H2SO4中会发生钝化,不能生成SO2,D项错误。
答案A2、下列变化中,前者是物理变化,后者是化学变化,且都有明显颜色变化的是( )A.打开盛装NO的集气瓶;冷却NO2气体B.用冰水混合物冷却SO3气体;加热氯化铵晶体C.木炭吸附NO2气体;将氯气通入品红溶液中D.向品红溶液中加入Na2O2;向FeCl3溶液中滴加KSCN溶液解析打开盛装NO的集气瓶和冷却NO2气体都发生化学反应,A项不符合题意;用冰水混合物冷却SO3气体、加热氯化铵晶体,前者是物理变化,后者是化学反应,但均无颜色变化,B项不符合题意;木炭吸附NO2气体是物理变化,将氯气通入品红溶液中发生化学反应,且均有颜色变化,C项符合题意;向品红溶液中加入Na2O2和向FeCl3溶液中滴加KSCN溶液均为化学反应,D项不符合题意。
答案C3、(2018.河南十校联考)X、Y、Z、W四种物质的转化关系如图所示。
下列组合中不符合该关系的是( )解析W,B项中NaOH 和Na2CO3不反应,不符合题意。
答案B4、下列对氯及其化合物的说法正确的是( )A.过量的铁在氯气中燃烧可生成氯化亚铁B.用pH试纸测得氯水的pH=4C.溴化钠溶液中加入少量新制氯水振荡,再加入少量四氯化碳振荡,静置后,上层颜色变浅,下层颜色变橙红色D.由Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO可推出Ca(ClO)2+SO2+H2O===CaSO3↓+2HClO解析Cl2与变价金属反应生成高价金属氯化物,其产物与氯气和金属的相对量无关,A错误;氯水中含具有漂白作用的HClO,不能用pH试纸测定氯水的pH,B错误;2NaBr+Cl2===2NaCl+Br2,Br2易溶于CCl4而被萃取,故上层颜色变浅,下层颜色变橙红色,C正确;HClO有强氧化性,能将CaSO3氧化为CaSO4,D错误。
2020版高考化学一轮复习(含最新2019高考题)第2章第6讲 新题培优练

一、选择题1.(2019·大连第二十四中学高三质检)下列说法正确的一组是()①不溶于水的盐都是弱电解质②可溶于水的盐都是强电解质③0.5 mol·L-1一元酸溶液H+浓度为0.5 mol·L-1④强酸溶液中的H+浓度一定大于弱酸溶液中的H+浓度⑤电解质溶液导电的原因是溶液中有自由移动的阴、阳离子⑥熔融的电解质都能导电A.①③⑤⑥B.②④⑤⑥C.只有⑤D.只有⑥解析:选C。
①电解质的强弱与溶解性无关,不溶于水的盐可能是强电解质,如硫酸钡,故①错误;②电解质的强弱与溶解性无关,可溶于水的盐可能是弱电解质,如醋酸铅,故②错误;③0.5 mol·L-1一元酸溶液H+浓度不一定为0.5 mol·L-1,如醋酸,故③错误;④强酸溶液中的H+浓度不一定大于弱酸溶液中的H+浓度,H+浓度与酸的浓度、分子中氢离子的个数以及电离程度有关,与电解质的强弱无关,故④错误;⑤电解质溶液导电的原因是溶液中有自由移动的阴、阳离子,故⑤正确;⑥酸在熔融状态时均不导电,只有溶于水时才导电,故⑥错误。
2.下列说法中正确的是()A.三氧化硫的水溶液能导电,所以三氧化硫是电解质B.自由移动离子数目多的电解质溶液导电能力一定强C.NaHSO4在水溶液及熔融状态下均可电离出Na+、H+、SO2-4D.NH3属于非电解质,但其水溶液能够导电解析:选D。
三氧化硫本身不能电离出离子,SO3是非电解质,A错误;离子数目多的溶液中,离子浓度不一定大,离子所带电荷数不一定多,其导电能力不一定强,B错误;NaHSO4在熔融状态下只能电离出Na+、HSO-4,C错误;NH3是非电解质,但其溶于水后可形成电解质NH3·H2O,溶液能导电,D正确。
3.(2019·高考江苏卷)下列指定反应的离子方程式正确的是()A.室温下用稀NaOH溶液吸收Cl2:Cl2+2OH-===ClO-+Cl-+H2OB.用铝粉和NaOH溶液反应制取少量H2:Al+2OH-===AlO-2+H2↑C.室温下用稀HNO3溶解铜:Cu+2NO-3+2H+===Cu2++2NO2↑+H2OD.向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+===H2SiO3↓+2Na+解析:选A。
2020高考化学一轮复习 有机化学复习 人教_新目标版
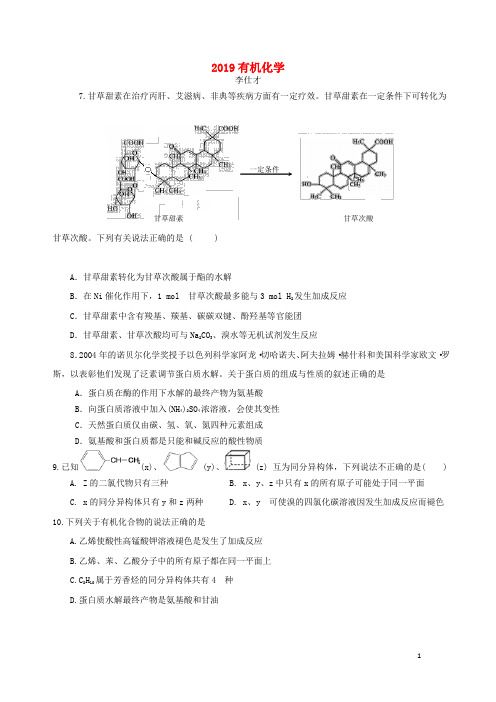
2019有机化学李仕才7.甘草甜素在治疗丙肝、艾滋病、非典等疾病方面有一定疗效。
甘草甜素在一定条件下可转化为甘草次酸。
下列有关说法正确的是 ( )A .甘草甜素转化为甘草次酸属于酯的水解B .在Ni 催化作用下,1 mol 甘草次酸最多能与3 mol H 2发生加成反应C .甘草甜素中含有羧基、羰基、碳碳双键、酚羟基等官能团D .甘草甜素、甘草次酸均可与Na 2CO 3、溴水等无机试剂发生反应8.2004年的诺贝尔化学奖授予以色列科学家阿龙·切哈诺夫、阿夫拉姆·赫什科和美国科学家欧文·罗斯,以表彰他们发现了泛素调节蛋白质水解。
关于蛋白质的组成与性质的叙述正确的是A .蛋白质在酶的作用下水解的最终产物为氨基酸B .向蛋白质溶液中加入(NH 4)2SO 4浓溶液,会使其变性C .天然蛋白质仅由碳、氢、氧、氮四种元素组成D .氨基酸和蛋白质都是只能和碱反应的酸性物质 9.已知(x)、(y)、(z) 互为同分异构体,下列说法不正确的是( )A. Z 的二氯代物只有三种B. x 、y 、z 中只有x 的所有原子可能处于同一平面C. x 的同分异构体只有y 和z 两种D. x 、y 可使溴的四氯化碳溶液因发生加成反应而褪色 10.下列关于有机化合物的说法正确的是A.乙烯使酸性高锰酸钾溶液褪色是发生了加成反应B.乙烯、苯、乙酸分子中的所有原子都在同一平面上C.C 8H 10属于芳香烃的同分异构体共有4 种D.蛋白质水解最终产物是氨基酸和甘油甘草次酸甘草甜素 一定条件11.某芳香族酯类化合物甲的分子式为C 14H 10O 5,1mol 甲水解后只生成一种产物乙,其物质的量为2mol ,下列说法正确的是( )A 、符合上述条件的甲共有3种B .1mol 甲最多可以和3molNaOH 反应C .乙不能和溴水发生反应D .2mol 乙最多消耗1molNa 2CO 3反应 12.维通橡胶是一种耐腐蚀、耐油、耐高温、耐寒性能都特别好的氟橡胶。
2019高考化学一轮复习基础习练8含解析新人教版.docx

人教化学2019高考一轮基础习练(8)李仕才一、选择题1、同温同压下,等体积的两容器内分别充满由叩、叱、18o三种原子构成的一氧化氮和一氧化碳,两容器含有的(D )A.分子数和气体质量均不同B.分子数和电子数均相同C.质子数和中子数均相同D.分子数、原子数和中子数均相同解析由阿伏加德罗定律可知,同温同压下,相同体积的气体具有相同的分子数,故这两种气体的分子数相同。
分子数相同,但二者的摩尔质量不同,故质量不同,A项错误;分子数相同,但电子数不同,B项错误;质子数不同,中子数相同,C项错误;分子数相同,又“N“0 和叱%都是双原子分子,故原子数相同,且1个“N%、1个叱%分子的中子数都为17, D 项正确。
2、下列实验装置或操作与微粒的大小无直接关系的是(C )B.渗析D. 丁达尔效应解析萃取是利用了物质在不同溶剂屮溶解性的不同,与分散质粒子的大小无关。
3、下列除去杂质的方法不正确的是(B )A.镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥B.用过量氨水除去Fe'+溶液屮的少量A『+C.用新制的生石灰,通过加热蒸馆,以除去乙醇中的少量水D.Al(0H)3中混有少量Mg(0H)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量C02后过滤解析氢氧化铁和氢氧化铝沉淀均不能溶于弱碱(氨水)中。
4、实验室里保存下列试剂的方法错误的是(C )A.新制氯水盛放在棕色试剂瓶屮,存放于低温避光的地方B.液漠易挥发,盛放在用水液封的棕色试剂瓶中C.碘易升华,盛放在有水的棕色广口试剂瓶中D.浓盐酸易挥发,盛装在无色密封的细口玻璃试剂瓶中解析碘单质应盛放在广口瓶屮,但瓶屮不能加水。
5、(2018 •武汉平原中学高三月考)核内中子数为艸的F十离子,质量数为儿则z?g它的氧化物所含电子的物质的量为(A )血04—忤10) molA.C. (/1-A4-2) mol解析氧化物的化学式为R0,则/7 g它的氧化物所含电子的物质的量为士花X (J-AH-8) molo6、下列说法不正确的是(B )A.已知冰的熔化热为6.0 kj/mol,冰中氢键键能为20.0 kJ/mo I,假设1 mol冰中含有2 mol氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰屮15%的氢键M 2B.已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为a, K.、=—。
2019高考化学一轮复习选训习题8含解析新人教版.docx

人教化学2019高考一轮选训习题(8)李仕才一、选择题1、设佩为阿伏加德罗常数的值。
下列说法正确的是(c )A.0. 1 mol Na2COs • 10H20晶体中,阴离子总数大于0. 1加B.常温常压下,18 niL水中所含的氢离子数约为1(TWC.标准状态下,22.4 L氮气中含有的原子数约为皿D.23 g组成为CJU)的有机物,C—H键的数目为3抠解析A项,M阴离子)=0. 1加,错误;B项,1L水屮艸(『)=10一7瓜,错谋;D项,C2H6O 的结构简式若为CH;5CH2—0H,则C—H键的数目为2. 5加,错误。
2、汽车剧烈碰撞时,安全气囊中发生反应:NdNs+KMO:;—K2O+N32O+N2 f。
对上述反应的描述错误的是(B )A.NaNs是还原剂,KNOs是氧化剂B.该反应屮有两种元素的化合价发生变化C.配平后物质的系数依次为10、2、1、5、16D.若生成8 mol N2,则转移电子的物质的量为5 mol解析该反应中,N Q N S中N元素化合价升高,KNO3中N元素化合价降低,则NaU是还原剂,KM):,是氧化剂,A项正确;该反应中,只有N元素的化合价发生了变化,B项错误;根据得失电子守恒及原子守恒配平可得10NaN3+2KNO3=K2O+5Na2O+16N2 t , C项正确;由C项分析可知,该反应中生成16 mol N2时转移10 mol电子,则生成8 mol比时转移5 mol电子, D项正确。
3、某同学采用硫铁矿焙烧取硫后的烧渣(主耍成分为FeG、Si()2、AlA,不考虑其他杂质)制备七水合硫酸业铁(FeSO4・7H,0),设计了如下流程:足量酸NaOH^液一T7777T71鯉戶」E试剂X控制屮沁创溶液1| ----- - ------- !—LJ 溶液2|~4^S()/7HQ 下列说法不正确的是(D )A.溶解烧渣选用足量硫酸,试剂X选用铁粉B.固体1中一定有SiO2,控制pH是为了使Al'+转化为Al(0H)3进入固体2C.从溶液2得到FeSOx 7H,0产品的过程屮,须控制条件防止其氧化和分解D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSOt・7出0解析流程设计意图是用硫酸将Fe203. AI2O3转化为硫酸盐,除去SiO2,然后用铁粉还原F(? +得到硫酸亚铁,A项正确;固体1为SiO2,分离FeSO.[和AL(SO,)s采用的是调控pH的方法, 使Al3+转化为AKOHh沉淀而与FeSO4分离,B项正确;F『+容易被氧化,所以在得到FeSOi - 7IL0产品的过程中,要防止其被氧化和分解,C项正确;在溶液1中直接加过量的NaOH得到的是Fe (0H)3沉淀,最终得到的是Fe2(S01)3, D项不正确。
2019-2020年高三一轮复习测试化学试卷 含答案

2019-2020年高三一轮复习测试化学试卷含答案可能用到的相对原子质量:H:1 , O:16, C:12, N:14, Fe:56 , S:32, Cl:35.5, V:51选择题:本题共13小题,每题6分。
在每小题给出的四个选项只有一项是符合题目要求7.信息、材料、能源被称为新科技革命的“三大支柱”。
下列观点或做法错误的是A.在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源B.加大煤炭的开采速度,增加煤炭燃料的供应量,以缓解石油危机C.光缆在信息产业中有广泛应用,制造光缆的主要材料是二氧化硅D.高温结构陶瓷氮化硅(Si3N4)具有较高的硬度和耐磨性,可用于制造汽车发动机8. 有一无色溶液,仅含有K+、Al3+、Mg2+、NH+4、Cl-、SO2-4、HCO-3、MnO-4中的几种。
为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,无沉淀产生。
下列推断正确的是A.肯定有Al3+、Mg2+、Cl-,可能有NH+4B.肯定有Al3+、Mg2+、HCO-3,肯定没有MnO-4C.肯定有Al3+、Mg2+、Cl-,可能有K+D.肯定有K+、Al3+、MnO-4,可能有HCO-39.有下列几种反应类型:①消去②加聚③水解④加成⑤还原⑥氧化,用丙醛制取1,2一丙二醇,按正确的合成路线依次发生的反应所属类型应是A.⑤①④③B.⑥④③①C.①②③⑤D.⑤③④①10..短周期中的A、B、C、D、E五种元素,原子序数依次增大,A和D,C和E分别同主族,A为非金属元素,且A与B的原子序数之和等于C的原子序数,C2-与D+的核外电子数相等。
则下列说法正确的是A.B与A只能组成BA3化合物B.C、D、E形成的化合物与稀硫酸可能发生氧化还原反应C.A、B、C形成的化合物一定不能发生水解反应D.E的氧化物对应的水化物一定有强的氧化性11.下列实验过程中产生的现象与图中曲线变化相对应的是12.下列离子方程式书写正确的是A.已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2 2ClO-+CO2+H2O=2HClO+CO32-B.向Fe(NO3)2和NaBr混合溶液中滴加稀盐酸:6Br-+8H++2NO3-=3Br2+2NO↑+4H2O C.Na2S溶液中滴加NaClO溶液:S2-+ClO–+H2O=S↓+Cl-+2OH-D.双氧水使酸性KMnO4溶液褪色:2MnO4-+5H2O2=2Mn2++5O2↑+6OH-+2H2O13. 在1 L溶液中含有Fe(NO3)3和H2SO4两种溶质,其浓度分别为0.2 mol•L-1和1.5 mol•L-1,现向该溶液中加入39.2 g铁粉使其充分反应。
2019高考化学一轮复习选习练题含解析新人教版(全套10份)

人教化学2019高考一轮选习练题(1)含答案李仕才一、选择题1、对物质的量的理解正确的是()A.物质的量就是物质的质量的另一种表达方式,单位是g/molB.物质的量就是物质的数量,数值上等于式量,单位是molC.物质的量就是6.02×1023个微粒的质量,单位是gD.物质的量是国际单位制中的一个物理量,表示含有一定数目微粒的集体【答案】D2、下列离子方程式书写正确的是()A.NaHSO4溶液与Ba(OH)2溶液混合后溶液呈中性:H++OH-+Ba2++SO42-=H2O+BaSO4↓B.FeBr2溶液中通入足量的Cl2:2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-C.用两个铜电极电解食盐水:2Cl-+2H2O=2OH-+H2↑+Cl2↑D.用三氯化铁溶液腐蚀印刷线路板:Fe3++Cu=Fe2++Cu2+【答案】B【解析】A.溶液呈中性的反应为:2H++2OH-+Ba2++SO42-=2H2O+BaSO4↓,A错误;B.Cl比Br 的非金属性强,能将Br-氧化,同时将铁离子氧化,根据电荷守恒和物料守恒,B正确;C.阳极为金属时,将首先失去电子生成Cu2+,负极为H得到电子生成氢气,C错误;D.未配平,2Fe3++Cu=2Fe2++Cu2+,D错误。
故选择B。
3、下列物质的性质和用途描述错误的是A.铜质地漏具有独特的杀菌功能,能较好的抑制细菌生长B.明矾溶于水生成氢氧化铝胶体,起消毒杀菌的作用C.铁粉具有还原性,可用作食品袋内的抗氧化剂D.镁燃烧发出耀眼的白光,可以制造照明弹【答案】B【解析】A.细菌是由蛋白质构成的,铜是重金属,可使蛋白质变性,从而杀灭细菌,故A 正确;B.明矾溶于水生成胶状物可吸附悬浮于水中的杂质,不能除掉可溶性杂质和细菌等,不能起到消毒杀菌的作用,故B错误;C.铁粉具有还原性,易与氧气反应,可作食品抗氧化剂,故C正确;D.镁能在空气中燃烧发出耀眼的白光,可以用于制造照明弹,故D正确;故答案选B。
2020届高三化学一轮复习步步高全书完整的Word版文档

质的量的大小)。
(2)含义:单位物质的量的气体所占的体积,符号为 Vm,标准状况下,Vm 约为 22.4 L·mol-1。
(3)基本关系式:n=VVm=Mm=NNA
(4)影响因素:气体摩尔体积的数值不是固定不变的,它决定于气体所处的温度和压强。
4.阿伏加德罗定律及其推论
(1)阿伏加德罗定律:在相同的温度和压强下,相同体积的任何气体,含有相同数目的粒子(或
,
可能是
气体。
(2)标准状况下,1.92 g 某气体的体积为 672 mL,则此气体的相对分子质量为
。
(3)在一定条件下,m g NH4HCO3 完全分解生成 NH3、CO2、H2O(g),按要求填空。
①若所得混合气体对 H2 的相对密度为 d,则混合气体的物质的量为
。NH4HCO3
的摩尔质量为
(用含 m、d 的代数式表示)。
C.CO 的摩尔体积比 CO2 的摩尔体积小 D.甲中 CO 的密度比乙中 CO2 的密度小 答案 D
解析 质量相等的 CO 和 CO2 的物质的量之比为 11∶7,在温度和压强相同时体积之比为 11∶7,但摩尔体积相同。
题组三 气体相对分子质量的计算
7.(1)已知标准状况下,气体 A 的密度为 2.857 g·L-1,则气体 A 的相对分子质量为
双原子分子的摩尔质量=源自a pg=aNp A g·mol-1,
NA mol
所以 b g 气体在标准状况下的体积为
aNA p
b g ×22.4 g·mol-1
L·mol-1=22a.N4Apb
L。
解法二 比例法:
同种气体的分子数与质量成正比,设 b g 气体的分子数为 N
ag ~ p
bg ~ N
2019高考化学一轮复习选习练题含解析新人教版(全套10份)

人教化学2019高考一轮选习练题(1)含答案李仕才一、选择题1、对物质的量的理解正确的是()A.物质的量就是物质的质量的另一种表达方式,单位是g/molB.物质的量就是物质的数量,数值上等于式量,单位是molC.物质的量就是6.02×1023个微粒的质量,单位是gD.物质的量是国际单位制中的一个物理量,表示含有一定数目微粒的集体【答案】D2、下列离子方程式书写正确的是()A.NaHSO4溶液与Ba(OH)2溶液混合后溶液呈中性:H++OH-+Ba2++SO42-=H2O+BaSO4↓B.FeBr2溶液中通入足量的Cl2:2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-C.用两个铜电极电解食盐水:2Cl-+2H2O=2OH-+H2↑+Cl2↑D.用三氯化铁溶液腐蚀印刷线路板:Fe3++Cu=Fe2++Cu2+【答案】B【解析】A.溶液呈中性的反应为:2H++2OH-+Ba2++SO42-=2H2O+BaSO4↓,A错误;B.Cl比Br 的非金属性强,能将Br-氧化,同时将铁离子氧化,根据电荷守恒和物料守恒,B正确;C.阳极为金属时,将首先失去电子生成Cu2+,负极为H得到电子生成氢气,C错误;D.未配平,2Fe3++Cu=2Fe2++Cu2+,D错误。
故选择B。
3、下列物质的性质和用途描述错误的是A.铜质地漏具有独特的杀菌功能,能较好的抑制细菌生长B.明矾溶于水生成氢氧化铝胶体,起消毒杀菌的作用C.铁粉具有还原性,可用作食品袋内的抗氧化剂D.镁燃烧发出耀眼的白光,可以制造照明弹【答案】B【解析】A.细菌是由蛋白质构成的,铜是重金属,可使蛋白质变性,从而杀灭细菌,故A 正确;B.明矾溶于水生成胶状物可吸附悬浮于水中的杂质,不能除掉可溶性杂质和细菌等,不能起到消毒杀菌的作用,故B错误;C.铁粉具有还原性,易与氧气反应,可作食品抗氧化剂,故C正确;D.镁能在空气中燃烧发出耀眼的白光,可以用于制造照明弹,故D正确;故答案选B。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、选择题1.(2019·洛阳第一次统考)能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的措施是()A.向水中通入SO2B.将水加热煮沸C.向纯水中投入一小块金属钠D.向水中加入NaCl解析:选A。
在水中存在电离平衡:H2O H++OH-。
当向水中通入SO2时发生反应:SO2+H2O H2SO3,H2SO3H++HSO-3,H2SO3电离产生的H+使溶液中的H+的浓度增大,对水的电离起抑制作用,最终使水电离产生的H+(OH-)的浓度远远小于溶液中的H+浓度,即溶液中的c(H+)>c(OH-),A项正确;水的电离是吸热过程,升高温度促进水的电离,所以将水加热煮沸促进水的电离,但是水电离产生的H+和OH-的个数总是相同的,所以升温后水中的H+和OH-的浓度仍然相等,B项错误;向纯水中投入一小块金属钠,钠与水发生反应:2Na+2H2O===2NaOH+H2↑,促进水的电离,并使溶液中的c(OH -)>c(H+),C项错误;向水中加入NaCl,NaCl是强酸强碱盐,对水的电离平衡无影响,所以溶液中的H+和OH-的浓度仍然相等,D项错误。
2.(2019·福建质检)常温下,下列溶液的pH最大的是()A.0.02 mol·L-1氨水与水等体积混合后的溶液B.pH=2的盐酸与pH=12的NaOH溶液等体积混合后的溶液C.0.02 mol·L-1盐酸与0.02 mol·L-1氨水等体积混合后的溶液D.0.01 mol·L-1盐酸与0.03 mol·L-1氨水等体积混合后的溶液解析:选A。
A项,混合后得到0.01 mol·L-1氨水,NH3·H2O不能完全电离,则c(OH -)<0.01 mol·L-1,7<pH<12;B项,混合后得到NaCl溶液,pH=7;C项,混合后得到NH4Cl 溶液,该溶液因NH+4水解而呈酸性,pH<7;D项,混合后得到0.01 mol·L-1氨水和0.005 mol·L -1 NH4Cl的混合溶液,相当于往A项溶液中加入NH4Cl,NH3·H2O的电离平衡逆向移动,c(OH-)减小,pH减小,故A项中溶液的pH最大。
3.一定温度下,水溶液中H+和OH-的浓度变化曲线如图。
下列说法正确的是()A .升高温度,可能引起由c 向b 的变化B .该温度下,水的离子积常数为1.0×10-13C .该温度下,加入FeCl 3可能引起由b 向a 的变化D .该温度下,稀释溶液可能引起由c 向d 的变化解析:选C 。
A.c 点溶液中c (OH -)>c (H +),溶液呈碱性,升温,溶液中c (OH -)不可能减小。
B.由b 点对应 c (H +)与c (OH -)可知,K w =c (H +)·c (OH -)=1.0×10-7×1.0×10-7=1.0×10-14。
C.FeCl 3溶液水解显酸性,溶液中c (H +)增大,因一定温度下水的离子积是常数,故溶液中c (OH -)减小,因此加入FeCl 3溶液可能引起由b 向a 的变化。
D.c 点溶液呈碱性,稀释时c (OH -)减小,同时c (H +)应增大,故稀释溶液时不可能引起由c 向d 的变化。
4.(2019·合肥一中月考)常温下,0.1 mol ·L-1某一元酸(HA)溶液中c (OH -)c (H +)=1× 10-8。
下列叙述正确的是( ) A .该一元酸溶液的pH =1B .该溶液中由水电离出的c (H +)=1×10-11 mol ·L -1 C .该溶液中水的离子积常数为1×10-22D .将V 1 L pH =11的NaOH 溶液和V 2 L 0.1 mol ·L-1该一元酸(HA)溶液混合,若混合溶液的pH =7,则V 1<V 2 解析:选B 。
将c (OH -)=K w c (H +)代入原题关系式中可得1×10-14c 2(H +)=1×10-8,解得 c (H +)=1×10-3 mol ·L -1,所以该一元酸溶液的pH =3,A 项错误;酸溶液中水的电离看氢氧根离子,c (OH -)=1×10-141×10-3 mol ·L -1=1×10-11 mol ·L -1,所以由水电离出的c (H +)=1× 10-11 mol ·L -1,B 项正确;常温下,水的离子积是一个常数,为1×10-14,C 项错误;由于HA 的浓度大于NaOH 的浓度,二者若等体积混合则溶液呈酸性,当混合溶液的pH =7时应有V1>V2,D项错误。
5.如图曲线a和b是盐酸与氢氧化钠相互滴定的滴定曲线。
下列叙述正确的是()A.盐酸的物质的量浓度为1 mol/LB.P点时反应恰好完全,溶液呈中性C.曲线a是盐酸滴定氢氧化钠的滴定曲线D.酚酞不能用作本实验的指示剂解析:选B。
根据曲线a知,滴定前盐酸的pH=1,c(HCl)=0.1 mol/L,A项错误;P 点表示盐酸与氢氧化钠恰好完全中和,溶液呈中性,B项正确;曲线a是氢氧化钠溶液滴定盐酸的曲线,曲线b是盐酸滴定氢氧化钠溶液的曲线,C项错误;强酸与强碱相互滴定,酚酞可以用作指示剂,D项错误。
6.(2019·岳阳检测)某温度下,水的离子积常数K w=1×10-12。
该温度下,将pH=4的H2SO4溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为()A.1∶10B.9∶1C.1∶9 D.99∶21解析:选B。
设稀硫酸的体积为a L,NaOH溶液的体积为b L,则10-3b-10-4a=10-5(a+b),a∶b=9∶1。
7.(2019·江西红色七校二联)常温下,用NaOH溶液滴定H2C2O4溶液,溶液中-lgc(H+)c(H2C2O4)和-lg c(HC2O-4)或-lgc(H+)c(HC2O-4)和-lg c(C2O2-4)关系如图所示。
下列说法错误的是()A.K a1(H2C2O4)=1×10-2B.滴定过程中,当pH=5时,c(Na+)-3c(HC2O-4)>0C .向1 mol/L 的H 2C 2O 4溶液中加入等体积等浓度的NaOH 溶液,完全反应后显酸性D .向0.1 mol/L 的H 2C 2O 4溶液中加水稀释,c (HC 2O -4)c (H 2C 2O 4)的值将增大 解析:选B 。
根据图示,K a1(H 2C 2O 4)=c (H +)·c (HC 2O -4)c (H 2C 2O 4)=10-1×10-1=1×10-2,A 正确;根据电荷守恒c (Na +)+c (H +)=c (HC 2O -4)+2c (C 2O 2-4)+c (OH -),根据图示,K a2(H 2C 2O 4)=c (H +)·c (C 2O 2-4)c (HC 2O -4)=10-2×10-3=1×10-5,当pH =5时,c (HC 2O -4)=c (C 2O 2-4),所以c (Na +)-3c (HC 2O -4)=c (OH -)-c (H +)=10-9-10-5<0,B 错误;向1 mol/L 的H 2C 2O 4溶液中加入等体积等浓度的NaOH溶液,溶液中的溶质是NaHC 2O 4,HC 2O -4电离平衡常数是1×10-5、水解平衡常数是1×10-141×10-2=1×10-12,HC 2O -4的电离常数大于其水解常数,因此该溶液显酸性,C 正确;K a1(H 2C 2O 4)=c (H +)·c (HC 2O -4)c (H 2C 2O 4),向0.1 mol/L 的H 2C 2O 4溶液中加水稀释,氢离子浓度减小,K a1(H 2C 2O 4)不变,所以c (HC 2O -4)c (H 2C 2O 4)的值将增大,D 正确。
8.(2019·安徽皖北协作区联考)用0.10 mol·L-1盐酸滴定20 mL 0.050 mol·L -1 Na 2CO 3和0.025 mol·L -1 NaHCO 3混合溶液,得出如图所示的滴定曲线。
下列说法中不正确的是( )A .a 点溶液显碱性的主要原因是CO 2-3+H 2O HCO -3+OH - B .b 点溶液中:c (Na +)=c (HCO -3)+c (CO 2-3)+c (H 2CO 3)C .c 点溶液中:c (Na +)=c (HCO -3)+2c (CO 2-3)+c (Cl -) D .d 点溶液中:c (Na +)>c (Cl -)>c (HCO -3)>c (H +)>c (OH -)解析:选B 。
a 点溶液为0.050 mol·L -1 Na 2CO 3和0.025 mol ·L -1 NaHCO 3混合溶液,Na 2CO 3和NaHCO 3均能水解使溶液呈碱性,但主要原因是CO 2-3的水解,A 项正确;b 点加入10 mL 盐酸后,溶液中的溶质为NaHCO 3和NaCl ,由物料守恒得:c (Na +)=c (HCO -3)+c (CO 2-3)+c (H 2CO 3)+c (Cl -),B 项错误;根据电荷守恒可知,c (Na +)+c (H +)=c (HCO -3)+2c (CO 2-3)+c (Cl -)+c (OH -),由于c 点溶液显中性,c (H +)=c (OH -),所以c (Na +)=c (HCO -3)+2c (CO 2-3)+c (Cl -),C 项正确;d 点加入20 mL 0.10 mol·L -1盐酸后,溶液中c (NaCl)=0.050 mol·L -1,c (NaHCO 3)=0.012 5 mol·L -1,所以c (Na +)>c (Cl -)>c (HCO -3),又因为d 点溶液pH<7,所以c (H +)>c (OH -),D 项正确。
9.(2019·石家庄一模)常温下,向20.00 mL 0.1 mol·L -1 HA 溶液中滴入0.1 mol·L -1 NaOH 溶液,溶液中由水电离出的氢离子浓度的负对数[-lg c 水(H +)]与所加NaOH 溶液体积的关系如图所示。
