单克隆抗体技术个人总结
高中生物单克隆抗体实验总结

⾼中⽣物单克隆抗体实验总结 考试是检测学⽣学习效果的重要⼿段和⽅法,考前需要做好各⽅⾯的知识储备。
下⾯是店铺为⼤家整理的⾼中⽣物单克隆抗体实验总结,希望对⼤家有所帮助! ⾼中⽣物单克隆抗体实验总结 (⼀)动物的选择 ⽬前应⽤最⼴的是⼩⽩⿏和⼤⽩⿏,尤以⼩⽩⿏为好。
就品系⽽⾔以Balb/c⼩⽩⿏应⽤最⼴,由于所有的⼩⽩⿏⾻髓瘤系均从Balb/c⼩⽩⿏系诱导出来。
Balb/c系⼩⽩⿏必须⽤纯系的,雌雄均可,以8~12周龄为宜。
⼤⽩⿏也可,能产⽣较多量的单抗体。
现在已经在⼩⿏杂交瘤的基础上,发展了⼩⿏-⼤⿏,⼩⿏-⼈以及⼈-⼈杂交瘤技术。
(⼆)免疫 ⼀般⽽⾔,抗原的纯度不很重要,特别是免疫原性较强的抗原。
免疫程序、剂量和⽅法是关系到是否能得到所需要的单抗体的关键之⼀。
正常⼩⿏脾脏含有能产⽣各种不同抗体的B淋巴细胞,⼀只纯种⼩⽩⿏估计能产⽣1.0×107~5.0×107种不同的抗体。
因此⼀只正常的⼩⽩⿏的脾细胞与⼩⿏⾻髓瘤融合,只能有千万分之⼀的机会获得某⼀种特定抗体。
所以为了进步得到某种杂交瘤的机会,必须加强免疫,使产⽣特异性抗体的B淋巴细胞⼤量增加。
B淋巴细胞的不同发育阶段对获得阳性杂交瘤也有很⼤影响。
有⼈以为处在转化时期的B淋巴细胞可能更易于融合,⽽免疫以后7~8天,固然是抗体产⽣的⾼峰时期,但形成有活⼒的杂交瘤细胞的可能反⽽减少。
故⼀般以为加强免疫后的第三天应杀⿏取脾做细胞融合。
1.可溶性抗原(蛋⽩质) 以1mg/ml~5mg/ml的溶液加等量的弗⽒完全佐剂乳化,分多点⼩⿏⽪下注射,总量为0.3ml~0.6ml,间隔3~5周再同样注射⼀次,10天后,断尾取⾎⼀滴,测抗体效价,选滴度⾼的⼩⿏做融合试验。
⼀个⽉后可以经静脉(尾静脉)给予⽆佐剂抗原0.2ml~0.4ml,3~4天后,杀死⼩⿏取脾做融适⽤。
2.颗粒性抗原如抗原来源⽅便,可以不加佐剂⽽增加免疫次数,缩短间隔时间。
单克隆抗体药物关键技术分析教学总结

单克隆抗体药物关键技术分析1.高通量的动物细胞表达技术一方面,从表达体系来看,近年来,人们不断发展和完善了许多抗体分子的表达体系,如:细菌、酵母、昆虫细胞、哺乳动物细胞、植物细胞表达系统和体外翻译系统等。
哺乳动物细胞表达系统具有活性高、稳定性好等重要优点,已成为抗体等生物技术产品最重要的系统。
2007年销售额排名前列的6类生物技术药物中,有5类是由动物细胞表达生产(肿瘤治疗抗体类、抗TNF-α抗体类、EPO 类、β干扰素类、凝血因子类),仅胰岛素类药物是由大肠杆菌和酵母表达的。
欧美国家哺乳动物细胞表达产品种类占60%-70%,市场份额占65%以上。
另一方面,从抗体制备规模、速度和功能来看,高通量抗体制备技术的发展十分重要。
哺乳动物细胞表达生物技术产品大规模高效培养技术是生物医药产品主要的生产方式和关键“瓶颈”技术。
目前,国际上该项技术发展较快,已趋成熟,以默克公司为代表的流加培养生产规模达10,000L以上,以贝尔公司为代表的灌流培养生产规模达200L以上,蛋白表达浓度为0.5-2g/L;我国在该技术领域起步较晚,基础较差,但近年来经过努力,已经实现了该项技术的突破。
2.人源化抗体的构建及优化技术随着免疫学和分子生物学技术的发展以及抗体基因结构的阐明,DNA重组技术开始用于抗体的改造。
抗体药物已经进入基因工程抗体时代。
基因工程抗体具有以下优点:①降低人体对异种抗体的排斥反应;②减小抗体的分子量,利于其穿透血管壁,进入病灶的核心部位;③根据需要,制备新型抗体;④采用多种表达方式,大量表达抗体分子,降低生产成本。
(1)表面重塑抗体对鼠抗体表面氨基酸残基进行人源化改造。
该方法的原则是仅替换与人抗体SAR差别明显的区域,在维持抗体活性并兼顾减少异源性基础上选用与人抗体表面残基相似的氨基酸替换;另外,所替换的区段不应过多,对于影响侧链大小、电荷、疏水性,或可能形成氢键从而影响到抗体互补决定区(CDR)构象的残基尽量不替换。
浅谈单克隆抗体

浅谈单克隆抗体摘要:1975年Kohler和Milstein首先报道,用细胞杂交技术,使经绵羊红细胞(SRBC)免疫的小鼠的脾细胞,与小鼠的骨髓瘤细胞融合,并由此创建了第一个B细胞杂交瘤细胞株,获得了抗SRBC的单克隆抗体。
这是免疫学乃至医学史上的一个里程碑。
克隆抗体经历了鼠源性、人源性和全人化抗体三个阶段。
迄今为止世界上已研制出数以千计的单克隆抗体,并广泛应用于生物学、医学领域,在疾病的发病机制、诊断和治疗方面发挥重要作用。
本文从单克隆体的制备技术和临床应用方面进行综述。
关键词::抗体;单克隆抗体;制备1单克隆抗体制备技术1.1杂交瘤技术该技术主要包括免疫动物、细胞融合和杂交瘤细胞的筛选三个环节。
先用特定的外来抗原一或多次免疫动物,刺激B淋巴细胞增殖形成浆细胞,分泌针对该抗原的抗体。
再将骨髓瘤细胞和小鼠脾细胞融合,通常采用PEG法或PEG电融合法,该法稳定,安全简单。
最后将杂交瘤细胞放在HAT选择培养基中培养。
筛选出杂交瘤细胞,因它具有B淋巴细胞和骨髓瘤细胞的双重特性,在HAT培养基中长期生存又可产生抗体,成为制造单克隆抗体的细胞源。
1.2基因工程抗体技术1.2.1嵌合抗体将小鼠抗体的可变区基因与人免疫球蛋白(immunoglobulin,Ig)恒定区基因重组,构建人/鼠嵌合重链、轻链基因,在原核或真核细胞中表达。
该抗体减少了鼠单抗的免疫原性,恒定区可有效发挥补体激活和与Fc受体结合的生物学活性。
1.2.2重构抗体将编码小鼠单抗决定簇互补区基因序列移植到编码人Ig可变区的骨架区,构建新的抗体。
该方法与嵌合抗体相比,虽减少了人抗鼠抗体反应,但仍然保持着鼠源性抗体的特异性。
1.3展示技术1.3.1噬菌体展示技术该技术属于体内展示技术,其原理是通过RT-PCR克隆扩增人淋巴细胞谱中的VH和VL基因片段,导人噬粒,转化细胞,建立噬菌体抗体文库,此时噬菌体核心DNA中有编码人抗体VH、VL基因片段,所编码蛋白与噬菌体膜蛋白相连,分布于噬菌体表面。
单抗体克隆知识点总结

单抗体克隆知识点总结一、单抗体的基本概念1. 单抗体的结构和功能:单抗体是免疫球蛋白的一种形式,由两个重链(H链)和两个轻链(L链)组成。
每条链含有可变区(variable region,V区)和恒定区(constant region,C区)。
单抗体通过与抗原特异性结合,发挥免疫应答、中和毒素、调节细胞功能等作用。
2. 单抗体的种类:单抗体可根据抗原结构、特异性、功能等特点进行分类,包括IgG、IgM、IgA、IgE和IgD等不同种类。
3. 单抗体的产生:单抗体产生于B细胞,其多样性由基因分子的不连续变异和DNA重组产生,经过成熟的B细胞选择和调节后,形成特异性高、免疫力强的单克隆抗体。
二、单抗体克隆的制备方法1. 体外免疫法(in vitro immunization):将抗原注射到实验动物体内,激发其免疫应答,然后从动物的脾脏或淋巴结中分离B细胞,融合成B淋巴母细胞瘤细胞,形成杂交瘤细胞株,最后筛选出特异性单抗体生产细胞。
2. 体外免疫法(in vitro immunization):通过将抗原直接与幼年机体灌肠,刺激其进行非特异性免疫反应,然后分离B细胞融合,以得到特异性单克隆抗体。
3. 转基因技术法:将人工构建的外源抗原基因导入哺乳动物的生殖细胞中,通过繁殖来产生含有人类抗原的哺乳动物,然后收集其血浆,最终通过分离B细胞融合并筛选出特异性单抗体细胞。
4. 单克隆抗体的制备技术:通过将B淋巴母细胞瘤细胞与合适的浆性细胞融合,并在含有肿瘤抑制剂的培养基中培养,然后筛选出特异性单抗体类细胞。
三、单抗体在医学研究中的应用1. 西方博洛莫法:单抗体可以用于研究抗原与抗体的相互作用,如利用抗体检测目的蛋白在蛋白质印迹中的位置,提供制定质量控制和标准的依据。
2. 免疫组化技术:单抗体可用于免疫组化染色,观察组织结构和细胞分布,对于诊断疾病和研究生物分子的功能等方面有重要意义。
3. ELISA方法:单抗体可用于酶联免疫吸附实验(ELISA),用于检测特定蛋白或抗体的水平,广泛用于临床诊断和药物筛选。
单克隆抗体

单克隆抗体兽医免疫学是一门系统性非常强的学科,全面系统的介绍了免疫学的相关理论和技术。
在传统概念中,免疫是指机体对病原微生物的再感染有抵抗力,不患病,即为抗感染。
在免疫的现代感念里,免疫是指机体识别自己与非己,并能将非己成分排出体外的复杂生理过程,它可能对机体产生不同的影响。
正常情况下,免疫功能使机体内环境得以维持稳定,具有保护作用;在异常情况下,免疫功能可能导致某些病理过程的发生和发展。
免疫系统是机体在长期的进化过程中形成的防御体系,通过免疫系统识别自己和非己成分,并产生免疫应答排除非己,维持机体生理平衡。
在免疫学中单克隆隆抗体有着其广阔的发展前景。
常规制备抗体的方法是将免疫原接种给动物,采集其血清,其中含有多种特异性、多种不同类型的免疫球蛋白。
因为抗原是多价多特异性表位的。
此类抗体存在着质量难以控制,不易标准化等特点,在临床诊断、免疫预防治疗及科学研究的应用方面受到了一定的限制。
单克隆抗体的定义:由单一B细胞克隆产生的高度均一、仅针对某一特定抗原表位的抗体,称为单克隆抗体。
通常采用杂交瘤技术来制备。
单克隆抗体的基本原理:: B淋巴细胞能够产生抗体,但在体外不能进行无限分裂; 而瘤细胞虽然可以在体外进行无限传代,但不能产生抗体。
将这两种细胞融合后得到的杂交瘤细胞具有两种亲本细胞的特性。
单克隆抗体技术的基本程序:一.提取合成专一性抗体的单个B淋巴细胞,但这种B淋巴细胞不能在体外生长。
二.二.应用细胞杂交技术使骨髓瘤细胞与B淋巴细胞融合,得到杂交瘤细胞。
这种细胞既具有B淋巴细胞合成专一抗体的特性,也有骨髓瘤细胞能在体外培养增殖永存的特性三.三.对杂交瘤细胞进行细胞培养,选出所需要的细胞群,体外或体内培养,从培养液或动物腹水中提取单克隆抗体四.单克隆抗体的提纯一般常用金黄色葡萄球菌蛋白A-琼脂糖4B亲和层析法。
单克隆抗体的保存由腹水中获得的抗体,经离心去除细胞成分,再经冷冻超速离心,取上清液加0.1%NaN3,少量分装,冷冻于-70℃可保存几年。
单克隆抗体制备知识点总结
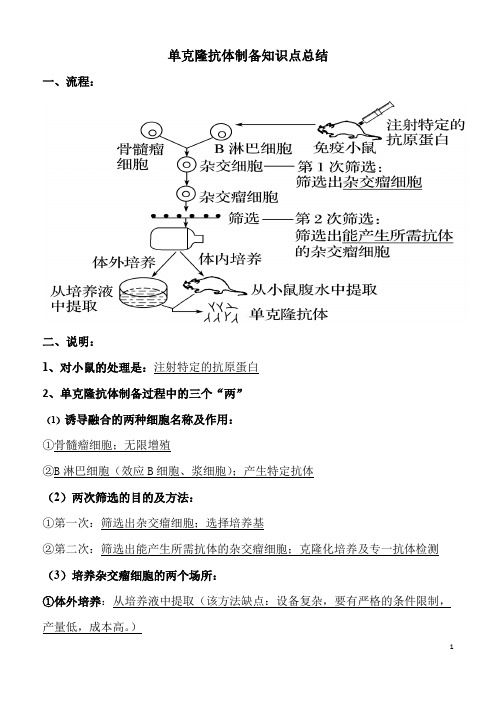
单克隆抗体制备知识点总结一、流程:二、说明:1、对小鼠的处理是:注射特定的抗原蛋白2、单克隆抗体制备过程中的三个“两”(1)诱导融合的两种细胞名称及作用:①骨髓瘤细胞;无限增殖②B淋巴细胞(效应B细胞、浆细胞);产生特定抗体(2)两次筛选的目的及方法:①第一次:筛选出杂交瘤细胞;选择培养基②第二次:筛选出能产生所需抗体的杂交瘤细胞;克隆化培养及专一抗体检测(3)培养杂交瘤细胞的两个场所:①体外培养:从培养液中提取(该方法缺点:设备复杂,要有严格的条件限制,产量低,成本高。
)②体内培养:从小鼠腹水中提取(最常用的方法)(4)单克隆抗体制备所用到的两种技术:动物细胞培养、动物细胞融合(5)两个原理:细胞增殖、细胞膜流动性3、动物细胞融合特有的方法是:灭活的病毒。
(融合率低,有一定局限性。
)4、第二次筛选出的杂交瘤细胞的特点:①无限增殖②产生所需抗体5、单克隆抗体的优点:灵敏度高,特异性强,可大量制备6、单克隆抗体的用途:①作为诊断试剂:能准确地识别各种抗原物质的细微差异,并跟一定抗原发生特异性结合,具有准确、高效、简易、快速的优点。
②用于治疗疾病和运载药物:主要用于癌症治疗,可制成“生物导弹”,也有少量用于其他疾病的治疗。
“生物导弹”=“瞄准装置”(单克隆抗体)+“杀伤性弹头”(药物)7、抗体的传统生产方法:向动物体内反复注射某种抗原,使动物产生抗体,然后从血清中分离所需抗体。
缺点是:产量低、纯度低,特异性差、灵敏度低。
练习:1、科研人员将抗癌药物连接在单抗上制成“生物导弹”用于癌症治疗。
“生物导弹”由两部分组成,一是“瞄准装置”,二是“杀伤性弹头”,分析下列有关描述,其中不正确的是[]A.“瞄准装置”由识别肿瘤的单克隆抗体组成B.“弹头”由放射性同位素、化学药物或毒素等物质构成C.“弹头”中的药物有选择杀伤肿瘤细胞的功能D.“生物导弹”的制备应用了细胞工程技术2、下图是单克隆抗体制备流程阶段示意图(1)单克隆抗体制备过程用到了技术。
单克隆抗体特点范文

单克隆抗体特点范文首先,单克隆抗体具有高度特异性。
由于单克隆抗体是由单一的淋巴细胞产生的,因此其结合特异性明确,只能结合一个抗原。
这使得单克隆抗体在特定的检测和诊断中具有很高的准确性和可靠性。
而多克隆抗体由多种不同的淋巴细胞克隆产生,因此可能存在交叉反应的问题,导致特异性降低。
其次,单克隆抗体具有较高的亲和力和稳定性。
由于单克隆抗体是由单一的淋巴细胞克隆产生的,其亲和力和稳定性通常较强,可以更好地结合和稳定抗原。
这使得单克隆抗体在药物研发和治疗中具有更好的效果和安全性。
第三,单克隆抗体具有更好的一致性和可重复性。
由于单克隆抗体是由单一的细胞克隆产生的,在抗体的组成和结构上具有更好的一致性。
这意味着单克隆抗体的性能和效果在不同的实验室和条件下是可重复的,这对于科研和产品开发具有重要意义。
第四,单克隆抗体可以通过重组技术进行改良和优化。
通过重组技术,可以将单克隆抗体的变量区域与人类抗体的恒定区域进行结合,生成更适合临床应用的人源化单克隆抗体。
这不仅可以降低抗体的免疫原性,还可以提高抗体的稳定性和效果。
第五,单克隆抗体可以通过后续的分子工程手段进行改良和优化。
通过改变抗体的结构和功能,可以使其具有更好的靶向性、增强的效应和减少的毒副作用。
这为单克隆抗体的临床应用和治疗提供了更多的可能性。
第六,单克隆抗体具有较低的免疫原性。
由于单克隆抗体只能结合一个抗原,因此往往具有较低的免疫原性。
这使得单克隆抗体在体内使用时不容易引起免疫反应和排斥,降低了副作用和风险。
总之,单克隆抗体具有高度特异性、亲和力和稳定性、一致性和可重复性、可优化和改良的潜力以及较低的免疫原性等特点。
这使得单克隆抗体在疾病的检测、诊断和治疗中具有广泛的应用前景,并且对于药物研发和生物医学领域的发展具有重要意义。
单克隆抗体概述范文

单克隆抗体概述范文单克隆抗体(Monoclonal Antibodies,mAb)是一类具有高度特异性和亲和性的抗体,由同一种源于单个B细胞的克隆细胞分泌而来。
单克隆抗体具有广泛的应用价值,广泛应用于生物医学领域、科学研究和临床诊断、治疗等方面。
本文将对单克隆抗体的概念、历史、制备技术、应用领域等进行综述。
单克隆抗体是由单个克隆细胞产生的一类抗体,它们具有高度的特异性和亲和性。
与多克隆抗体相比,单克隆抗体能够精确地识别和结合特定的抗原,从而在生物医学研究和临床应用中具有广泛的用途。
单克隆抗体的制备依赖于杂交瘤细胞技术,该技术是1975年由科学家CesarMilstein和Georges Köhler发明的。
他们通过将髓系细胞(B细胞)与肿瘤细胞融合,得到具有长期稳定的可分泌抗体的杂交瘤细胞系。
这一技术的发明奠定了单克隆抗体制备的基础,也为获得大量特异性抗体提供了有效的方法。
单克隆抗体的制备技术主要包括混合细胞杂交、限制性稀释与分克隆、发生突变与亲和成熟等步骤。
首先,从免疫动物中获取抗原,然后将其免疫到小鼠等实验动物中。
接下来,收集小鼠脾脏,分离出髓系细胞。
将髓系细胞与骨髓瘤细胞(如SP2/0、NS0等)融合,得到杂交瘤细胞。
这些杂交瘤细胞具有两个细胞系的特点,既能够分泌抗体,又具有无限增殖的能力。
然后,通过适当的培养和筛选,分离出分泌特定抗原抗体的杂交瘤细胞,通过稀释、单克隆化等步骤,获得具有单一抗原特异性的单克隆抗体。
单克隆抗体在生物医学领域有着广泛的应用。
首先,单克隆抗体可以用于疾病的诊断和预测。
通过检测患者体液中的特定标志物,如肿瘤标志物、病毒抗原等,可以帮助医生确定疾病的类型和进展,并帮助制定个体化的治疗方案。
其次,单克隆抗体还可以用于治疗。
目前,有多种单克隆抗体被用于临床治疗,如肿瘤治疗药物Herceptin、Rituxan等,它们可以通过不同机制来抑制肿瘤的生长和转移。
此外,单克隆抗体还可以用于治疗自身免疫性疾病、传染病等。
单克隆抗体的制备技术

单克隆抗体的制备技术单克隆抗体是一种特定的抗体,由同一种克隆的B细胞产生,并具有相同的抗原结合特异性。
这种抗体制备技术是通过将B细胞与瘤细胞融合而形成的杂交瘤细胞来实现的。
以下是关于单克隆抗体制备技术的详细解释。
1. 免疫原制备:要制备单克隆抗体,首先需要准备免疫原。
免疫原可以是蛋白质、多肽、糖脂或其他小分子化合物。
免疫原的选择基于所需抗体的特异性。
一般来说,免疫原应具有较高的纯度,并且能够激发免疫系统产生特定的抗体。
2. 免疫动物免疫:接下来,将免疫原注射到实验动物体内,以激发其免疫系统产生抗体。
常用的实验动物包括小鼠、大鼠或兔子。
在注射过程中,免疫原通常与佐剂混合以增强免疫反应。
注射免疫通常在一段时间内进行多次,以确保充分激发免疫系统产生抗体。
3. B细胞的筛选和融合:在动物免疫后,从其脾脏或骨髓中收集B细胞。
这些B细胞是产生抗体的主要细胞类型。
通过在培养基中培养,可以增加B细胞的数量。
然后,将这些B细胞与一种名为骨髓瘤细胞的癌细胞融合。
这种骨髓瘤细胞有着无限增殖的能力,而B细胞则提供了抗体生产所需的特定性。
4. 杂交瘤细胞的筛选:融合后的细胞形成了杂交瘤细胞。
这些细胞具有两个来源的特性,具有骨髓瘤细胞的无限增殖能力和B细胞的抗体产生能力。
为了筛选出产生特定抗体的杂交瘤细胞,可以使用细胞培养基中的特定抗原进行筛选。
只有与特定抗原结合的杂交瘤细胞才能存活和增殖。
5. 克隆的建立:经过筛选后,单个杂交瘤细胞被分离并单独培养,以建立纯化的单个细胞克隆。
这些克隆细胞会持续产生与免疫原结合的特定抗体。
这些单克隆抗体可以通过培养细胞并收集培养上清液来获取。
6. 单克隆抗体的纯化和特性分析:单克隆抗体的纯化是将其从其他细胞产物和杂质中分离出来。
这通常包括离心、过滤和亲和层析等步骤。
纯化后的抗体可以进行各种特性分析,如亲和性测定、特异性测定和功能性分析等。
这些测试可以验证抗体的特异性和效能。
总结:单克隆抗体的制备技术是一种通过将免疫的动物B细胞与骨髓瘤细胞融合形成杂交瘤细胞的方法。
简述单克隆抗体技术的原理及应用

简述单克隆抗体技术的原理及应用1. 单克隆抗体技术概述单克隆抗体技术(Monoclonal Antibody Technology)是一种重要的分子生物学技术,用于制备高纯度、高亲和力的单克隆抗体。
该技术的研发与应用在医学、科研和生物工程领域有重要的应用价值。
2. 技术原理单克隆抗体技术是通过克隆和复制具有相同抗原特异性的抗体细胞群体,制备出一类抗体分子。
主要的步骤包括免疫原注射、融合、筛选和扩增等。
•免疫原注射:将特定抗原注射到小鼠或其他动物的体内,触发其免疫系统产生抗原特异性的抗体。
•融合:将免疫细胞与肿瘤细胞融合,形成杂交瘤细胞。
•筛选:通过特定抗原与杂交瘤细胞的亲和力筛选出产生单克隆抗体的杂交瘤细胞。
•扩增:将单个抗体细胞扩增为大量的细胞群体,使其能够进行大规模生产。
3. 应用领域单克隆抗体技术在医学、科研和生物工程领域有广泛的应用。
3.1 医学应用•疾病诊断:单克隆抗体可以特异性地识别和结合特定的抗原,用于疾病的早期诊断。
•药物研发:单克隆抗体可以作为药物的靶点,用于开发和研制新的治疗药物。
•免疫治疗:单克隆抗体可以用于治疗癌症、自身免疫性疾病等疾病。
3.2 科研应用•蛋白质研究:单克隆抗体可以用于检测特定蛋白质的表达和功能研究。
•细胞信号转导:单克隆抗体可以用于研究细胞信号转导通路的机制和调控。
•分子识别:单克隆抗体可以用于分子的定位、识别和分析。
3.3 生物工程应用•生物药物生产:单克隆抗体可以用于生产大规模的重组抗体药物。
•生物传感器:单克隆抗体可以用于构建高灵敏度和高选择性的生物传感器。
•工业酶制剂:单克隆抗体可以用于酶的定向进化和改良。
4. 发展前景随着单克隆抗体技术在医学、科研和生物工程领域的不断发展和应用,其发展前景非常乐观。
随着技术的不断进步和成本的降低,单克隆抗体技术将有更广泛的应用和深入研究,同时也会推动其他相关技术的发展。
5. 结论单克隆抗体技术是一项重要的分子生物学技术,通过克隆和复制具有相同抗原特异性的抗体细胞群体,制备出具有高纯度、高亲和力的单克隆抗体。
单克隆抗体制备教学反思梅胜举

单克隆抗体制备教学反思梅胜举单克隆抗体制备教学反思梅胜举单克隆抗体制备教学反思梅胜举《动物细胞融合与单克隆抗体》是《动物细胞工程》的重点内容,其中的动物细胞融合技术主要用于制备单克隆抗体。
本节内容以学过的动物细胞融合、免疫等知识为基础,如何有效开展这节内容的教学,在自己设计的基础上,在完成课堂教学的基础上反过来看,我认为应该做到以下几点:第一,情境的创设创设情境组织教学是基于建构主义的教学观。
我们创设的情境最好是一个真实的客观现实,这样基于现实的情境会让学生快速的卷入到教师的教学活动过程中来。
基于必修三免疫内容学习时曾经遇到过人被毒蛇咬伤可用经蛇毒处理过的兔子的血清来治疗。
我就以此作为切入点引出抗体的提取和制备问题。
然后以问题驱动学生看书并联系已经学过的知识来解决问题。
第二,如何处理已学知识与新课学习的关系已有知识是学生学习新课的前提。
学生的学习一定是建立在已有经验的基础上建构性学习。
是在已有知识基础上的同化和顺应的有意义学习。
如何处理两者关系和教学安排是我们教师应该设计的。
我的处理是在回顾细胞融合技术基础上,再联系必修三免疫的相关内容以问题串的形式引导学生看书思考讨论作答。
学生想到抗体的基础上自然回忆抗体的产生细胞及细胞特点(如一种实质为浆细胞的免疫过的B淋巴细胞只产生一种抗体)、相关结构、作用和作用特点,以及传统手段生产抗体的不足。
在认知冲突后猜想问题解决。
第四,关于单克隆抗体制备过程的教学我的想法很简单,基于学生看书的情况下,教师利用问题和课本图片组织教学。
需要注意的是要引导学生对图片信息的提取和语言的有效阐述。
基于图片的再次开发性讲授,让学生明白和把握全流程相关知识。
并用流程图阐述有关知识。
第五,概念的`辨析基于制备单克隆抗体过程的讲解,可以尝试对单克隆抗体的下定义,并对其特点有效阐述。
第六,单克隆抗体作用的阐述,在比较联系中内化单克隆抗体的作用相对简单,如何有效记忆。
在学生阅读的基础上提问这些应用的原理是抗原抗体杂交,同时以“生物导弹”作用的讲解呼应情境创设,使课堂教学的设计前后有效呼应。
单克隆抗体技术相关总结

单克隆抗体技术相关总结一、前言1975年,Kohler和Milstein发现将小鼠骨髓瘤细胞和绵羊红细胞免疫的小鼠脾细胞进行融合,形成的杂交细胞既可产生抗体,又可无限增殖,从而创立了单克隆抗体杂交瘤技术。
这一技术上的突破不仅为医学与生物学基础研究开创了新纪元,也为临床疾病的诊、防、治提供了新的工具。
制备单克隆抗体包括动物免疫、细胞融合、选择杂交瘤、检测抗体、杂交瘤细胞的克隆化、冻存以及单克隆抗体的大量生产,要经过几个月的一系列实验步骤。
虽然单抗技术已经非常成熟,但是由于其经济价值,仍然有很多人在从事这项研究,而且其中也会遇到很多这样那样大问题。
我本人就是其中一个,由于是第一次做单抗,所以过程中遇到了很多困难,终于在前几天得到了几株阳性克隆。
鉴于此,我将单克隆抗体制备的整个过程贴出来,同时搜索了丁香园里面一些战友的求助帖以及一些经典的应助帖,希望能对将要或是正在从事这项研究的战友们有些帮助。
二、动物的免疫选择合适的免疫方案对于细胞融合杂交的成功,获得高质量的McAb至关重要。
一般要在融合前两个月左右确立免疫方案开始初次免疫,免疫方案应根据抗原的特性不同而定。
1. 颗粒性抗原免疫性较强,不加佐剂就可获得很好的免疫效果。
下面以细胞性抗原为例的免疫方案:初次免疫1×107/0.5ml ip (腹腔内注射)↓2~3周后第二次免疫1×107/0.5ml ip↓3周后加强免疫(融合前三天)1×107/0.5ml ip或iv(静脉内注射)↓取脾融合2. 可溶性抗原免疫原性弱,一般要加佐剂,常用佐剂:福氏完全佐剂,福氏不完全佐剂。
要求抗原和佐剂等体积混合在一起,研磨成油包水的乳糜状,放一滴在水面上不易马上扩散呈小滴状表明已达到油包水的状态。
商品化福氏完全佐剂在使用前须振摇,使沉淀的分枝杆菌充分混匀。
初次免疫 Ag 1~50μg 加福氏完全佐剂皮下多点注射│(一般0.8~1ml 0.2ml/点)↓3周后第二次免疫剂量同上,加福氏不完全佐剂皮下或ip│(ip剂量不宜超过0.5ml)↓3周后第三次免疫剂量同上,不加佐剂,ip│(5~7天后采血测其效价,检测免疫效果)↓2~3周后加强免疫,剂量50~500μg为宜,ip或iv↓3天后取脾融合目前,用于可溶性抗原(特别是一些弱抗原)的免疫方案也不断有所更新,如①将可溶性抗原颗粒化或固相化,一方面增强了抗原的免疫原性,另一方面可降低抗原的使用量。
单克隆抗体制备实验报告

一、实验目的1. 了解单克隆抗体制备的基本原理和实验流程;2. 掌握单克隆抗体制备过程中各步骤的操作方法;3. 通过实验,获得特异性单克隆抗体。
二、实验原理单克隆抗体是由单个B细胞克隆产生的高度均一、仅针对某一特定抗原表位的抗体。
制备单克隆抗体的基本原理是杂交瘤技术,即将具有分泌特异性抗体能力的致敏B细胞和具有无限繁殖能力的骨髓瘤细胞融合,形成杂交瘤细胞,进而培养出单克隆细胞,最终获得单克隆抗体。
三、实验材料1. 实验动物:Balb/c小鼠;2. 细胞:SP2/0骨髓瘤细胞;3. 抗原:待筛选的抗原;4. 试剂:弗氏完全佐剂、弗氏不完全佐剂、氢氧化铝佐剂、细胞培养液、抗生素、无菌操作器具等。
四、实验步骤1. 动物免疫(1)首免:将抗原与弗氏完全佐剂混合,通过多点注射法注射给Balb/c小鼠,剂量为150-200g/只。
(2)加强免疫:在首免后2-3周,重复首免过程。
2. B细胞提取(1)无菌操作,处死小鼠,取脾脏,制成单细胞悬液。
(2)用细胞分离液分离B细胞。
(3)洗涤、计数,调整细胞浓度。
3. 细胞融合(1)将B细胞与SP2/0骨髓瘤细胞按一定比例混合,加入聚乙二醇(PEG)诱导细胞融合。
(2)将融合细胞在含有抗生素的细胞培养液中培养。
4. 杂交瘤细胞筛选(1)在培养液中加入抗原,筛选出能分泌特异性抗体的杂交瘤细胞。
(2)将筛选出的杂交瘤细胞进行克隆化培养,获得单克隆细胞。
5. 单克隆抗体制备(1)将单克隆细胞在培养液中扩大培养,收集上清液。
(2)对上清液进行抗体检测,鉴定抗体特异性。
(3)采用适当方法纯化抗体,如亲和层析、离子交换层析等。
五、实验结果1. 成功获得特异性单克隆抗体。
2. 抗体特异性经ELISA等方法验证,与待筛选抗原具有高度特异性。
3. 抗体亲和力良好,可用于后续实验。
六、实验总结本次实验成功制备了特异性单克隆抗体,掌握了单克隆抗体制备的基本原理和实验流程。
在实验过程中,应注意以下几点:1. 动物免疫时,抗原与佐剂的混合比例、注射剂量、注射次数等要严格控制。
单克隆抗体技术手册

单克隆抗体技术手册一、什么是单克隆抗体技术单克隆抗体技术,简单来说,就是一种能够生产出大量高纯度、高特异性抗体的生物技术。
在生物医学领域,它就像是一把精准的钥匙,能够准确地打开特定疾病的“锁”。
抗体,大家都知道,是我们身体免疫系统产生的用来对抗病原体的“武器”。
但传统方法得到的抗体往往是混合物,纯度不高,特异性也有限。
而单克隆抗体技术则改变了这一局面。
二、单克隆抗体技术的原理要理解单克隆抗体技术,得先从免疫系统说起。
当我们的身体受到病原体入侵时,免疫系统中的 B 淋巴细胞会被激活,产生抗体来对抗病原体。
每个 B 淋巴细胞产生的抗体都略有不同。
单克隆抗体技术的核心就是要从众多的 B 淋巴细胞中,筛选出一个能够产生我们所需要的特定抗体的细胞。
这个过程就像是在大海里捞针。
首先,将抗原(比如某种疾病的蛋白质)注射到小鼠体内,让小鼠的免疫系统产生反应。
然后,从小鼠的脾脏中取出产生抗体的 B 淋巴细胞。
接下来,将这些 B 淋巴细胞与一种能够无限增殖的骨髓瘤细胞融合。
这一步非常关键,因为骨髓瘤细胞可以不停地分裂生长,而 B 淋巴细胞能够产生抗体。
融合后的细胞就兼具了两者的优点,既能产生抗体,又能无限增殖。
然后,通过特定的筛选方法,找出那些能够产生我们所需要的抗体的融合细胞。
这些细胞就是单克隆抗体的“源头”。
三、单克隆抗体技术的步骤1、免疫动物选择合适的动物(通常是小鼠),给它们注射特定的抗原,激发免疫系统产生抗体反应。
2、细胞融合将免疫后的动物脾脏细胞(包含产生抗体的 B 淋巴细胞)与骨髓瘤细胞在一定条件下进行融合。
3、筛选与克隆使用特定的培养基和检测方法,筛选出能够产生目标抗体的融合细胞。
然后对这些细胞进行克隆培养,得到大量相同的细胞。
4、抗体的提取与纯化从培养的细胞上清液或细胞内提取抗体,并通过一系列的纯化方法,去除杂质,得到高纯度的单克隆抗体。
四、单克隆抗体技术的应用1、疾病诊断单克隆抗体可以特异性地识别疾病相关的标志物,用于疾病的早期诊断。
单克隆抗体工作总结怎么写

单克隆抗体工作总结怎么写单克隆抗体工作总结。
单克隆抗体是一种高度特异性的抗体,由单一的B细胞克隆产生,具有一致的抗原结合特性。
它们在医学、科研和生物制药领域发挥着重要作用,为疾病诊断、治疗和疫苗研发提供了有力支持。
单克隆抗体的工作原理主要包括以下几个步骤:
1. 抗原筛选,选择目标抗原并进行筛选,以获得特异性高的单克隆抗体。
2. B细胞克隆,从免疫动物中获取B细胞,并通过细胞融合技术获得单克隆抗体生产的细胞株。
3. 抗体表征,对单克隆抗体进行亲和力、特异性和稳定性等方面的表征。
4. 应用开发,将单克隆抗体应用于疾病诊断、治疗和生物制药等领域,如药物研发、肿瘤治疗和疫苗生产等。
单克隆抗体的工作总结可以从以下几个方面展开:
首先,介绍单克隆抗体的基本原理和工作流程,包括抗原筛选、B细胞克隆、抗体表征和应用开发等内容。
其次,总结单克隆抗体在疾病诊断和治疗中的应用,如肿瘤标志物检测、免疫治疗和药物靶向等方面的进展。
最后,展望单克隆抗体在未来的发展趋势和应用前景,如个性化医疗、精准药物和新型疫苗等方面的潜在应用。
总之,单克隆抗体作为一种重要的生物制药工具,在医学和科研领域具有广阔的应用前景,其工作总结将有助于推动其在临床和生产中的更广泛应用。
单克隆抗体实验报告

一、实验目的1. 学习单克隆抗体的制备方法;2. 掌握单克隆抗体的鉴定技术;3. 了解单克隆抗体在免疫学研究和临床诊断中的应用。
二、实验原理单克隆抗体(Monoclonal Antibody,mAb)是由单个B细胞克隆产生的,具有高度特异性和亲和力。
单克隆抗体的制备通常采用杂交瘤技术,即将B细胞与肿瘤细胞融合,形成杂交瘤细胞,杂交瘤细胞既具有B细胞的抗体产生能力,又具有肿瘤细胞的无限增殖能力。
通过筛选和培养杂交瘤细胞,可以得到大量相同的单克隆抗体。
三、实验材料1. 实验动物:Balb/c小鼠;2. 抗原:目的蛋白;3. 细胞株:SP2/0(小鼠骨髓瘤细胞);4. 培养基:IMDM培养基、DMEM培养基、RPMI-1640培养基;5. 试剂:FCS、HAT(Hypoxanthine-Aminopterin-Thymidine)、PEG(聚乙二醇)、兔抗小鼠IgG-HRP(辣根过氧化物酶标记)、羊抗兔IgG-FITC(荧光素异硫氰酸酯标记);6. 仪器:CO2培养箱、倒置显微镜、酶标仪、流式细胞仪等。
四、实验方法1. 抗原免疫小鼠:将抗原注入Balb/c小鼠体内,免疫小鼠,制备抗体。
2. 细胞融合:收集免疫小鼠脾细胞,与SP2/0细胞按一定比例混合,加入PEG,诱导细胞融合。
3. 融合细胞筛选:将融合细胞接种于96孔板,加入HAT培养基,培养7-10天,观察细胞生长情况,筛选出阳性克隆。
4. 阳性克隆扩大培养:将阳性克隆扩大培养,制备杂交瘤细胞。
5. 阳性克隆抗体检测:收集杂交瘤细胞培养上清,进行ELISA检测,鉴定阳性克隆。
6. 阳性克隆抗体纯化:将阳性克隆抗体进行亲和层析或蛋白A/G层析,纯化抗体。
7. 阳性克隆抗体鉴定:采用流式细胞术或免疫荧光技术,鉴定阳性克隆抗体。
五、实验结果1. 免疫小鼠制备抗体:免疫小鼠后,血清抗体水平明显升高。
2. 细胞融合:融合细胞生长良好,阳性克隆筛选成功。
3. 阳性克隆扩大培养:阳性克隆杂交瘤细胞生长旺盛。
单克隆抗体技术论文(2)

单克隆抗体技术论文(2)单克隆抗体技术论文篇二抗CLCN5单克隆抗体的制备及鉴定[摘要] 目的:制备抗氯离子通道蛋白5(CLCN5)单克隆抗体(mAb)并对其进行鉴定。
方法:用人CLCN5为抗原免疫BLAB/c小鼠,用常规方法进行细胞融合,经筛选及克隆化建立可稳定分泌抗CLCN5 mAb的杂交瘤细胞株;用ELISA及Western blot进行抗体的鉴定。
结果:筛选到4株可稳定分泌抗CLCN5 mAb的细胞株;Western blot显示,在4株抗体中有1株在相对分子量为83 kDa处出现1条特异性条带,说明该单克隆抗体可与HSG胞浆蛋白中的CLCN5蛋白特异性地结合。
结论:本实验成功获得1株可特异性识别CLCN5的单克隆抗体细胞株,可用于肾结石、X-连锁综合征的进一步研究、临床诊断及相关试剂盒等的开发研制。
[关键词] 氯离子通道蛋白(CLCN5);单克隆抗体;抗体鉴定;细胞融合[中图分类号] R392-33[文献标识码]A[文章编号]1673-7210(2008)01(a)-014-02Preparation and identification of the monoclonal antibodies against chloride channel 5CHEN Li, SHI Zhi-hua(The Third People’s Hospital of Dalian City, Dalian116000,China)[Abstract]Objective:To prepare and identify monoclonal antibody against chloride channel 5 (CLCN5) . Methods:We prepared hybridoma cell lines secreting CLCN5 mAb from immunized BALB/c mice with antigen CLCN5, then by cell fusion, screened with indirect ELISA and cloned with limited dilution methods. The properties of antiserum against CLCN5 were characterized by ELISA and Western blot. Results:Four hybridoma cell lines secreting CLCN5 mAb had been developed, and theELISA titre of the mAbs was respectively detected. According to the Western blot,we could see that the CLCN5 protein was highly expressed with a molecular weight of 83 kDa, it meaned that the monoclonal antibodies specially recognized a protein band expressed in the human submandibular gland(HSG) cell line. Conclusion:We gets a CLCN5 mAb which can be specially recognized by CLCN5. The successful generation monoclonal antibodies protein will provide efficient affinity reagents for the further functional studies of clcn5 gene expressed in human body and it's relation with kidney stone dent's disease and X-linked disorder.[Key Words] Chloride channel 5; Monoclonal antibody; Identification of the antibodies; Cell fusion氯离子通道(CLC)是迄今发现的唯一电压门控氯离子通道,在细胞兴奋性调节、细胞容积调节和跨上皮物质转运等生理过程的调节中发挥重要作用。
单克隆抗体技术相关总结

单克隆抗体技术相关总结、前言1975 年,Kohler 和Milstein 发现将小鼠骨髓瘤细胞和绵羊红细胞免疫的小鼠脾细胞进行融合,形成的杂交细胞既可产生抗体,又可无限增殖,从而创立了单克隆抗体杂交瘤技术。
这一技术上的突破不仅为医学与生物学基础研究开创了新纪元,也为临床疾病的诊、防、治提供了新的工具。
制备单克隆抗体包括动物免疫、细胞融合、选择杂交瘤、检测抗体、杂交瘤细胞的克隆化、冻存以及单克隆抗体的大量生产,要经过几个月的一系列实验步骤。
虽然单抗技术已经非常成熟,但是由于其经济价值,仍然有很多人在从事这项研究,而且其中也会遇到很多这样那样大问题。
我本人就是其中一个,由于是第一次做单抗,所以过程中遇到了很多困难,终于在前几天得到了几株阳性克隆。
鉴于此,我将单克隆抗体制备的整个过程贴出来,同时搜索了丁香园里面一些战友的求助帖以及一些经典的应助帖,希望能对将要或是正在从事这项研究的战友们有些帮助。
、动物的免疫选择合适的免疫方案对于细胞融合杂交的成功,获得高质量的McAb至关重要。
一般要在融合前两个月左右确立免疫方案开始初次免疫,免疫方案应根据抗原的特性不同而定。
1.颗粒性抗原免疫性较强,不加佐剂就可获得很好的免疫效果。
下面以细胞性抗原为例的免疫方案:初次免疫1×107/0.5ml ip (腹腔内注射)↓ 2~3 周后第二次免疫1×107/0.5ml ip↓ 3 周后加强免疫(融合前三天)1×107/0.5ml ip 或iv (静脉内注射)↓取脾融合2.可溶性抗原免疫原性弱,一般要加佐剂,常用佐剂:福氏完全佐剂,福氏不完全佐剂。
要求抗原和佐剂等体积混合在一起,研磨成油包水的乳糜状,放一滴在水面上不易马上扩散呈小滴状表明已达到油包水的状态。
商品化福氏完全佐剂在使用前须振摇,使沉淀的分枝杆菌充分混匀。
初次免疫Ag 1~50μg 加福氏完全佐剂皮下多点注射│ (一般0.8 ~1ml 0.2ml/ 点)↓ 3 周后第二次免疫剂量同上,加福氏不完全佐剂皮下或ip│(ip 剂量不宜超过0.5ml )↓ 3 周后第三次免疫剂量同上,不加佐剂,ip│ (5~7 天后采血测其效价,检测免疫效果)↓ 2~3 周后加强免疫,剂量50~500μg为宜,ip 或iv↓3 天后取脾融合目前,用于可溶性抗原(特别是一些弱抗原)的免疫方案也不断有所更新,如①将可溶性抗原颗粒化或固相化,一方面增强了抗原的免疫原性,另一方面可降低抗原的使用量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常用的方法有:
1.ELISA用于可溶性抗原(蛋白质)、细胞和病毒等McAb的检测。
2.RIA用于可溶性抗原、细胞McAb的检测。
FACS(荧光激活细胞分类仪)用于检查细胞表面抗原的McAb检测。
(2)同时制备免疫脾细胞悬液,用不完全培养液洗涤2次。
(3)将骨髓瘤细胞与脾细胞按1∶10或1∶5的比例混合在一起,在50ml
料离心管内用不完全培养液洗1次,1200rpm,8分钟。
(4)弃上清,用滴管吸净残留液体,以免影响PEG的浓度。
(5)轻轻弹击离心管底,使细胞沉淀略加松动。
(6)在室温下融合:
⑤ 混匀后立即倾注于琼脂基底层上,在室温中10分钟,使其凝固,孵育于
37℃,5%CO2孵箱中。
⑥4~5天后即可见针尖大小白色克隆,7~10天后,直接移种至含饲养细胞的24孔板中进行培养。
⑦ 检测抗体,扩大培养,必要时再克隆化。
(二)杂交瘤细胞的冻存
及时冻存原始孔的杂交瘤细胞、每次克隆化得到的亚克隆细胞是十分重要的。因为在没有建立一个稳定分泌抗体的细胞系的时候,细胞的培养过程中随时可能发生细胞的污染、分泌抗体能力的丧失等等。如果没有原始细胞的冻存,则因为上述的意外而全功尽弃。
0.5%琼脂:由
份1%琼脂加1份含20%小牛血清的2倍浓缩的RPMI1640配制而成。置42℃保温。
② 用上述0.5%琼脂液(含有饲养细胞)15ml倾注于直径为9cm的平皿中,在室温中待凝固后作为基底层备用。
③ 按100/ml,500/ml或5000/ml等浓度配制需克隆的细胞悬液。
④1ml 0.5%琼脂液(42℃预热)在室温中分别与1ml不同浓度的细胞悬液相混合。
4.IFA用于细胞和病毒McAb的检测。
上述方法均为一般实验室的常规方法,故在此不介绍具体的实验过程。
可靠的筛选方法必须在融合前建立,避免由于方法不当贻误整个筛选时机。
四、杂交瘤的克隆化和冻存
克隆化一般是指将抗体阳性孔进行克隆化。犚r为经过HAT筛选后的杂交瘤克隆不能保证一个孔内只有一个克隆。在实际工作中,可能会有数个甚至更多的克隆,可能包括抗体分泌细胞、抗体非分泌细胞;所需要的抗体(特异性抗体)分泌细胞和其它无关抗体分泌细胞。要想将这些细胞彼此分开,就需要克隆化。克隆化的原则是,对于检测抗体阳性的杂交克隆应尽早进行克隆化,否则抗体分泌的细胞会被抗体非分泌的细胞所抑制,因为抗体非分泌细胞的生长速度比抗体分泌的细胞生长速度快,二者竞争的结果会使抗体分泌的细胞丢失。即使克隆化过的杂交瘤细胞也需要定期的再克隆,以防止杂交瘤细胞的突变或染色体丢失,从而丧失产生抗体的能力。
.2 ml,共2~4点。待肿瘤达到一定大小后(一般10~20天)则可采血,从血清中获得单克隆抗体含量可达到1-10mg/ml。但采血量有限。
② 腹水的制备 常规是先腹腔注射0.5mlPristane(降植烷)或液体石腊于BaLb/c鼠,1~2周后腹腔注射1×106个杂交瘤细胞,接种细胞7~10天后可产生腹水,密切观察动物的健康状况与腹水征象,待腹水尽可能多,而小鼠频于死亡之前,处死小鼠,用滴管将腹水吸入试管中,一般一只小鼠可获1~10ml腹水。也可用注射器抽取腹水,可反复收集数次。腹水中单克隆抗体含量可达5-20mg/ml,这是目前最常用的方法,还可将腹水中细胞冻存起来,复苏后转种小鼠腹腔则产生腹水快、量多。
制备单克隆抗体包括动物免疫、细胞融合、选择杂交瘤、检测抗体、杂交瘤细胞的克隆化、冻存以及单克隆抗体的大量生产,要经过几个月的一系列实验步骤,下面按照制备单克隆抗体的流程顺序,逐一介绍其实验方法。
一、细胞融合前准备
(一)免疫方案
选择合适的免疫方案对于细胞融合杂交的成功,获得高质量的McAb至关重要。一般要在融合前两个月左右确立免疫方案开始初次免疫,免疫方案应根据抗原的特性不同而定。
小鼠腹腔巨噬细胞的制备
小鼠采用与免疫小鼠相同的品系,常用BaLb/c小鼠6~10周龄
↓
拉颈处死 浸泡于75%酒精,消毒3~5分钟
↓
用无菌剪刀剪开皮肤,暴露腹膜
↓
用无菌注射器注入6~8ml培养液
↓
反复冲洗,吸出冲洗液
↓
放入10ml离心管,1200转/分离心5~6分钟
↓
用20%小牛血清(NCS)或胎牛血清(FCS)的培养混悬,调整细胞数1×
排,为每孔0.5个细胞。
④ 培养4~5天后,在倒置显微镜上可见到小的细胞克隆,补加完全培养液200μl/孔。
⑤ 第8~9天时,肉眼可见细胞克隆,及时进行抗体检测。
注:初次克隆化的杂交瘤细胞需要在完全培养液中加HT。
2.软琼脂法
① 软琼脂的配制
含20%FCS(小牛血清)的2倍浓缩的RPMI1640
1%琼脂水溶液:高压灭菌,42℃预热。
宜,ip或iv
↓3天后
取脾融合
目前,用于可溶性抗原(特别是一些弱抗原)的免疫方案也不断有所更新,如①将可溶性抗原颗粒化或固相化,一方面增强了抗原的免疫原性,另一方面可降低抗原的使用量。②改变抗原注入的途径,基础免疫可直接采用脾内注射。③使用细胞因子作为佐剂,提高机体的免疫应答水平,促进免疫细胞对抗原反应性。
一般在准备融合前的两周就应开始复苏骨髓瘤细胞,为确保该细胞对HAT的敏感性,每3~6月应用8~AG(8氮杂鸟嘌呤)筛选一次,以防止细胞的突变。
保证骨髓瘤细胞处于对数生长期,良好的形态,活细胞计数高于95%,也是决定细胞融合的关键。
(四)
免疫脾细胞指的是处于免疫状态脾脏中B淋巴母细胞棗浆母细胞。一般取最后一次加强免疫3天以后的脾脏,制备成细胞悬液,由于此时B淋巴母细胞比例较大,融合的成功率较高。
1.颗粒性抗原免疫性较强,不加佐剂就可获得很好的免疫效果。下面以细胞性抗原为例的免疫方案:
初次免疫1×107/0.5ml ip (腹腔内注射)
↓2~3周后
第二次免疫1×107/0.5ml ip
↓3周后
加强免疫(融合前三天)1×107/0.5ml ip或iv(静脉内注射)
↓
取脾融合
2.可溶性抗原免疫原性弱,一般要加佐剂,常用佐剂:福氏完全佐剂,福氏不完全佐剂。要求抗原和佐剂等体积混合在一起,研磨成油包水的乳糜状,放一滴在水面上不易马上扩散呈小滴状表明已达到油包水的状态。商品化福氏完全佐剂在使用前须振摇,使沉淀的分枝杆菌充分混匀。
脾细胞悬液的制备:在无菌条件下取出脾脏,用不完全的培养液洗一次,置平皿中不锈钢筛网上,用注射器针芯研磨成细胞悬液后计数。一般免疫后脾脏体积约是正常鼠脾脏体积的2倍,细胞数为2×108左右。
二、细胞融合,选择杂交瘤
(一)细胞融合流程
(1)取对数生长的骨髓瘤细胞SP2/0,1000rpm离心5分钟,弃上清,用不完全培养液混悬细胞后计数,取所需的细胞数,用不完全培养液洗涤2次。
05/ml
↓
加入96孔板,100μl/孔
↓
放入37℃CO2孵箱培养
一般饲养细胞在融合前一天制备,一只小鼠可获得5~8×106腹腔巨噬细胞,若用小鼠胸腺细胞作为饲养细胞时,细胞浓度为5×106/ml,小鼠脾细胞为1×106/ml,小鼠的成纤维细胞(3T3)1×105/ml,均为100μl/孔。
(三)骨髓瘤细胞
①30秒内加入预热的1ml45%PEG(Merek,分子量4000)含5%DMSO,边加边搅拌。
② 作用90秒钟,若冬天室温较低时可延长至120秒钟。
③ 加预热的不完全培养液,终止PEG作用,每隔2分钟分别加入
1ml,2ml,3ml,4ml,5ml和10ml。
(7)离心,800rpm,6分钟。
(8)弃上清,先用6ml左右20%小牛血清RPMI1640轻轻混悬,切记不能用力吹打,以免使融合在一起的细胞散开。
一般在融合24小时后,加HAT选择培养液。HT和HAT均有商品化试剂50×贮存,用时1ml加入50ml20%小牛血清完全培养液中。
因为在培养板内已加入饲养细胞、融合后的细胞,200μl/孔。所以在加选择培养液时应加3倍量的HAT。我们认为,融合后最初补加的量可用全量的2/3进行选择,可得到满意的筛选结果。
骨髓瘤细胞系应和免疫动物属于同一品系,这样杂交融合率高,也便于接种杂交瘤细胞在同一品系小鼠腹腔内产生大量McAb
常用骨髓瘤细胞系有:NS1、SP2/0、X63 Ag8.653等。
骨髓瘤细胞的培养适合于一般的培养液,如RPMI1640,DMEM培养基。小牛血清的浓度一般在10~20%,细胞的最大密度不得超106/ml,一般扩大培养以1∶10稀释传代,每3~5天传代一次。细胞的倍增时间为16~20小时,上述三株骨髓瘤细胞系均为悬浮或轻微贴壁生长,只用弯头滴管轻轻吹打即可悬起细胞。
(一)克隆化方案
用克隆化的方法很多,而最常用就是有限稀释和软琼脂平板法。
1.有限稀释法的程序
① 制备饲养细胞悬液(同融合前准备)
② 阳性孔细胞的计数,并调细胞数在1~5×103/ml
③ 取130个细胞放入6.5ml含饲养细胞完全培养液,即20个细胞/ml,100μl/孔加A、B、C三排为每孔2个细胞。余下2.9ml细胞悬液补加2.9ml含饲养细胞的完全培养液,细胞数为10个/ml,100μl/孔加D、E、F三排,为每孔1个细胞。余下2.2ml细胞悬液补加2.2ml含饲养细胞的完全培养液,细胞数5个/ml,100μl/孔,加G、H
(二)饲养细胞
在制备单克隆抗体过程中,许多环节需要加饲养细胞,如:在杂交瘤细胞筛选、克隆化和扩大培养过程中,加入饲养细胞是十分必要的。常用的饲养细胞有:小鼠腹腔巨噬细胞(较为常用)、小鼠脾脏细胞或小鼠胸腺细胞,也有人用小鼠成纤维细胞系3T3经放射线照射后作为饲养细胞,使用比较方便,照射后可放入液氮罐长期保存,随用随复苏。
50×HAT
H:5×10-3M
A:2×10-5M
