化合价和化学式
2018.11.4化学式与化合价

化学式与化合价化合价与化学式(一)1.书写下列元素的元素符号并分类(指出单质存在的状态)He 、Ne 、 Ar 、 Kr 、 Xe ;F 、 Cl 、Br 、 I 、 H 、 O 、 N ;K 、 Ca 、 Na 、 Mg 、 Al 、 Zn 、 Fe 、 Cu 、 Hg 、 Ag ;金属________________________________________________,存在状态 ______。
非金属 ,存在状态 。
稀有气体 ,存在状态 。
2.下列符号分别代表某些物质,从组成中所含元素的种类判断各属哪一类物质。
Al 、 CuO 、 He 、H 2、NH 3 、SO 2 、ZnO 、 NaCl 、KMnO 4单质 ;化合物 ;氧化物 。
一、化学式1.定义:用元素符号和数字的组合表示物质组成的式子叫做化学式。
2.单质化学式的书写方法只有氟、氯、溴、碘、氢、氧、氮是双原子分子,化学式就这样写:F 2 、Cl 2 、Br 2 、I 2 、H 2 、O 2 、N 2 ,其余单质的化学式都用元素符号表示。
3.氧化物化学式的书写方法:氧的元素符号写在后,其余元素的符号写在前。
如:氧化铜CuO 、四氧化三铁Fe 3O 4 、五氧化二磷P 2O 5 、二氧化碳CO 2 。
读法:顺写反读。
4.化学式的意义(以H 2O 为例说明之)(1)表示一种物质:水(2)表示该物质的元素组成:水由氢氧两种元素组成 宏观 (3)表示物质的一个分子:一个水分子 (4)表示物质的分子构成:一个水分子是由两个氢原子一个氧原子组成 微观在元素符号或化学式前加上数字,就只能表示微观意义。
如2H:两个氢原子2H2:两个氢分子。
【课堂练习】3.写出下列符号所表示的意义H:2H:H2:2H2:Mg2+:【分析与思考】①不是任何物质都有化学式,只有纯净物才能用化学式表示其组成。
②一种物质只有一个化学式与之对应,与该物质的状态无关。
初中常见化合价化学式化学方程式
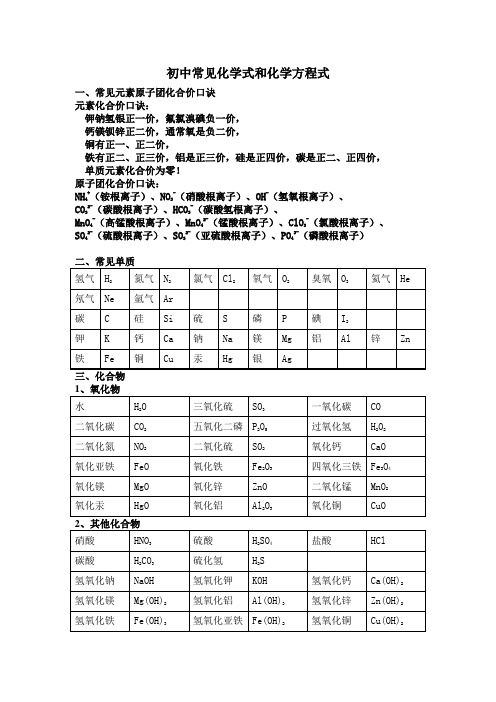
初中常见化学式和化学方程式一、常见元素原子团化合价口诀元素化合价口诀:钾钠氢银正一价,氟氯溴碘负一价,钙镁钡锌正二价,通常氧是负二价,铜有正一、正二价,铁有正二、正三价,铝是正三价,硅是正四价,碳是正二、正四价,单质元素化合价为零!原子团化合价口诀:NH4+(铵根离子)、NO3-(硝酸根离子)、OH-(氢氧根离子)、CO32-(碳酸根离子)、HCO3-(碳酸氢根离子)、MnO4-(高锰酸根离子)、MnO42-(锰酸根离子)、ClO3-(氯酸根离子)、SO42-(硫酸根离子)、SO32-(亚硫酸根离子)、PO43-(磷酸根离子)初中常见的化学方程式一、化合反应1、红磷在空气(或氧气)中燃烧:4P+5O2 2P2O52、氢气在空气中燃烧生成水:2H2+O22H2O3、硫磺在空气(或氧气)中燃烧:S+O2SO24、镁条在空气(或氧气)中燃烧:2Mg+O22MgO5、铁丝在氧气中燃烧:3Fe+2O2Fe3O46、木炭在空气(或氧气)中完全燃烧:C+O2 CO27、木炭不充分燃烧:2C+O22CO8、一氧化碳燃烧:2CO+O2 2CO29、二氧化碳和水反应生成碳酸:CO2+H2O ==H2CO310、二氧化碳通过灼热的炭层:CO2+C 2CO点燃点燃点燃点燃点燃点燃点燃高温点燃11、生石灰作为干燥剂:CaO +H2O == Ca(OH)2二、分解反应11、高锰酸钾制氧气:2KMnO4K2MnO4+MnO2+O2↑12、氯酸钾制氧气:2KClO32KCl+3O2↑13、双氧水制氧气:2H2O22H2O + O2↑14、电解水:2H2O 2H2↑+ O2↑15、碳酸分解:H2CO3H2O+CO2↑16、高温煅烧石灰石(工业制取二氧化碳):CaCO3 CaO +CO2↑三、置换反应17、铜和硝酸银溶液反应:Cu + 2AgNO3 == 2Ag +Cu(NO3)218、铁和硫酸铜溶液反应:Fe + CuSO4 == Cu + FeSO419、锌和硫酸反应制取氢气:Zn + H2SO4== ZnSO4+ H2↑20、铝和稀硫酸反应:2Al + 3H2SO4== Al2(SO4)3+ 3H2↑21、木炭还原氧化铁:3C+2Fe2O34Fe + 3CO2↑木炭还原氧化铜:C+2CuO 2Cu +CO2↑木炭还原四氧化三铁:2C+Fe3O43Fe +2CO2↑氢气还原氧化铜:H2+ CuO Cu + H2O四、复分解反应(一)酸 + 碱→盐 + 水22、氢氧化钠与盐酸反应:NaOH + HCl == NaCl + H2O23、氢氧化钠与硫酸反应:2NaOH + H2SO4== Na2SO4+ 2H2O24、氢氧化铝治疗胃酸过多:Al(OH)3 + 3HCl == AlCl3+ 3H2O25、氢氧化镁与硫酸反应:Mg(OH)2 + H2SO4== MgSO4+ 2H2O(二)酸 + 盐→新酸 + 新盐26、盐酸与硝酸银溶液反应:HCl+AgNO3== AgCl↓+HNO3△MnO2△MnO2通电高温高温高温高温高温27、氯化钡溶液与硫酸溶液反应:BaCl2 +H2SO4== BaSO4↓+ 2HCl28、碳酸钠与稀盐酸:Na2CO3+2HCl == 2NaCl+H2O+CO2↑碳酸氢钠与稀盐酸:NaHCO3+HCl == NaCl+H2O+CO2↑29、石灰石与稀盐酸反应(实验室)制取二氧化碳:CaCO3+2HCl =CaCl2+H2O+CO2↑(三)碱 + 盐→另一种碱 + 另一种盐30、硫酸铜溶液和氢氧化钠溶液反应:CuSO4+2NaOH = Na2SO4+Cu(OH)2↓31、氯化铁溶液和氢氧化钠溶液反应:FeCl3+3NaOH==Fe(OH)3↓+3NaCl(四)盐 + 盐→两种新盐32、硝酸银溶液与氯化钠溶液反应:AgNO3 + NaCl == AgCl↓+ NaNO333、氯化钡溶液与碳酸钠溶液反应:BaCl2+ Na2CO3= BaCO3↓+ 2NaCl(五)金属氧化物 + 酸→盐 + 水34、稀盐酸清洗铁锈:6HCl+Fe2O3== 2FeCl3+3H2O35、氧化铜与稀硫酸反应:CuO+H2SO4== CuSO4+H2O五、非金属氧化物 + 碱→盐 + 水36、二氧化碳通入澄清石灰水中:CO2+Ca(OH)2== CaCO3↓+H2O37、氢氧化钠在空气中变质:CO2+2NaOH=Na2CO3+H2O38、氢氧化钠溶液吸收二氧化硫:SO2+2NaOH==Na2SO3+H2O39、氢氧化钠溶液吸收三氧化硫:SO3 +2NaOH==Na2SO4+H2O六、其他反应类型40、一氧化碳还原氧化铜:CO + CuO Cu + CO241、一氧化碳还原氧化铁:3CO+ Fe2O32Fe + 3CO2↑42、一氧化碳还原四氧化三铁:4CO+ Fe3O43Fe + 4CO2↑43、酒精燃烧:C2H5OH + 3O22CO2+ 3H2O44、甲烷燃烧:CH4 + 2O2CO2+ 2H2O△点燃点燃高温高温。
化学式与化合价的关系 → 化学式与化合价的相互关系

化学式与化合价的关系→ 化学式与化合价的相互关系化学式与化合价的相互关系引言化学式和化合价是化学中非常重要的概念。
化学式描述了化合物中元素的种类和相对数量,而化合价则表示了元素在化合物中的电荷数或配位数。
本文探讨了化学式和化合价之间的相互关系,并介绍了一些常见的例子。
化学式和化合价的定义化学式由元素符号和下标组成,用于描述化合物中元素的相对数量。
化合价是一个整数,反映了元素在化合物中的电荷数或配位数。
化合价为正数表示元素带正电荷,化合价为负数则表示元素带负电荷。
化学式与化合价之间的关系化学式和化合价有着密切的关联。
化合物的化学式可以提供有关元素的种类和数量,而化合价可以帮助我们确定元素在化合物中的电荷数或配位数。
1. 一些元素的化合价是固定的,比如氢的化合价为+1,氧的化合价为-2。
2. 在某些情况下,元素的化合价可能存在多个可能性。
比如,铁的化合价可以是+2或+3,氮的化合价可以是-3或+5。
3. 元素的化合价可以通过阴离子和阳离子的数量和电荷平衡来确定。
一个正离子的化合价等于它的电荷数,而一个阴离子的化合价等于其电荷数的绝对值。
示例以下是一些示例,说明了化学式和化合价之间的关系:1. 水的化学式是H2O,其中氢的化合价为+1,氧的化合价为-2。
根据电荷平衡,氧原子需要两个氢原子与之配位,因此化合价为2。
2. 二氧化碳的化学式是CO2,其中碳的化合价为+4,氧的化合价为-2。
每个氧原子需要两个碳原子与之配位,因此化合价为4。
结论化学式和化合价之间存在着紧密的关系。
通过化学式,我们可以了解到元素在化合物中的相对数量,而化合价可以帮助我们确定元素在化合物中的电荷数或配位数。
理解化学式与化合价的相互关系对于理解化学反应和化合物的性质非常重要。
初中常见化合价化学式及化学方程式
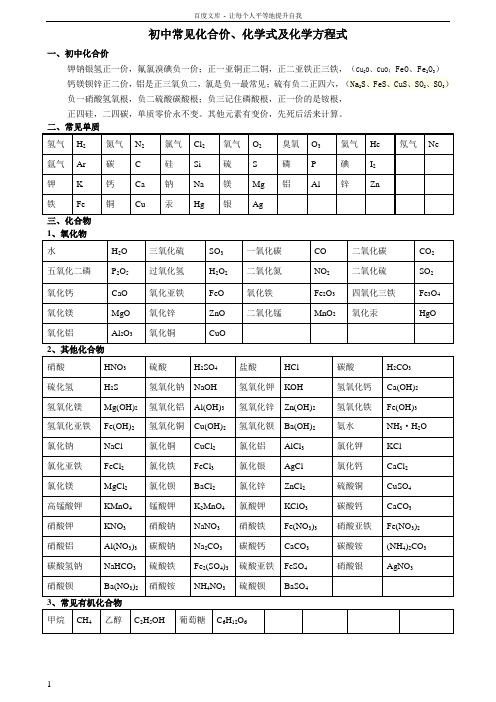
初中常见化合价、化学式及化学方程式一、初中化合价钾钠银氢正一价,氟氯溴碘负一价;正一亚铜正二铜,正二亚铁正三铁,(Cu2O、CuO;FeO、Fe2O3)钙镁钡锌正二价,铝是正三氧负二,氯是负一最常见;硫有负二正四六,(Na2S、FeS、CuS、SO2、SO3)负一硝酸氢氧根,负二硫酸碳酸根;负三记住磷酸根,正一价的是铵根,正四硅,二四碳,单质零价永不变。
其他元素有变价,先死后活来计算。
三、化合物初中化学方程式全(已配平)一、化合反应1、镁在空气中燃烧:2Mg+O2点燃2MgO2、铁在氧气中燃烧:3Fe+2O2点燃Fe3O43、铝在空气中燃烧:4Al+3O2点燃2Al2O34、氢气在空气中燃烧:2H2+O2点燃2H2O5、红磷在空气中燃烧:4P+5O2点燃2P2O56、硫粉在空气中燃烧:S+O2点燃SO27、碳在氧气中充分燃烧:C+O2点燃 CO28、碳在氧气中不充分燃烧:2C+O2点燃2CO9、二氧化碳通过灼热碳层:C+CO2高温2CO10、一氧化碳在氧气中燃烧:2CO+O2 点燃2CO211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2+H2O=H2CO312、生石灰溶于水:CaO+H2O=Ca(OH)213、无水硫酸铜作干燥剂:CuSO4+5H2O=CuSO4·5H2O14、钠在氯气中燃烧:2Na+Cl2点燃2NaCl二、分解反应15、实验室用双氧水制氧气:2H2O2MnO22H2O+O2↑16、加热高锰酸钾:2KMnO4△K2MnO4+MnO2+O2↑17、水在直流电的作用下分解:2H2O通电2H2↑+O2↑18、碳酸化学性质不稳定而分解:H2CO3=H2O+CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温CaO+CO2↑20、加热氯酸钾分解:2KClO3=2KCl+3O2↑21、氧化汞加热分解:2HgO△2Hg+O2↑三、置换反应(单质+化合物→新的单质+新的合化物)22、锌和稀盐酸反应(实验室制氢气):Zn+2HCl=ZnCl2+H2↑锌和稀硫酸反应(实验室制氢气):Zn+H2SO4=ZnSO4+H2↑23、镁和稀盐酸反应:Mg+2HCl=MgCl2+H2↑镁和稀硫酸反应:Mg+H2SO4=MgSO4+H2↑24、铁和稀盐酸反应:Fe+2HCl=FeCl2+H2↑铁和稀硫酸反应:Fe+H2SO4=FeSO4+H2↑25、铝和稀盐酸反应:2Al+6HCl=2AlCl3+3H2↑铝和稀硫酸反应:2Al+3H2SO4=Al2(SO4)3+3H2↑26、铁和硫酸铜溶液反应:Fe+CuSO4 =FeSO4+Cu铝和硫酸铜溶液反应:2Al+3CuSO4=Al2(SO4)3+3Cu27、铜和硝酸银反应:Cu+2AgNO3=Cu(NO3)2+2Ag28、氢气还原氧化铜:H2+CuO△Cu+H2O29、木炭还原氧化铜:C+2CuO高温 2Cu+CO2↑30、焦炭还原氧化铁:3C+2Fe2O高温 4Fe+3CO2↑31、水蒸气通过灼热碳层:H2O+C高温 H2+CO四、复分解反应复分解反应是由两种互相交换成分,生成另外两种化合物的反应。
《化学式与化合价》知识总结

课题4 化学式与化合价一、化学式1、化学式,就是用元素符号和数字的组合来表示纯净物组成的式子。
提出的依据:任何纯净物都有固定的组成,不同的物质组成不同2、化学式所表示的含义(一般包括宏观和微观角度)微观上:表示某物质;表示该物质由哪些元素组成的宏观上:表示该物质的一个分子或者一个原子;由分子构成的物质,还可以表示一个分子的构成情况以水(H2O)为例说明3、化学式中元素符号周围的数字的意义如aR b ca表示有a个这样的微粒b 表示一个微粒中有b个原子或原子团c 表示一个该离子中带有c个正(负)电荷如:3H2SO4一个硫酸分子中含有4个氧原子一个硫酸分子中含有1个硫原子一个硫酸分子中含有2个氢原子3个硫酸分子二、简单化合物的命名1、两种元素组成的化合物的命名根据元素的名称,从右往左读作“某化某”。
如NaCl读作“氯化钠”,ZnO读作“氧化锌”,Fe3O4读作“四氧化三铁”。
但要注意,H2O就是“水”,不能读成“氧化氢”,NH3就是“氨气”。
2、含有OH-原子团的化合物的命名一般命名为“氢氧化某”如:NaOH读作“氢氧化钠”,Cu(OH)2读作“氢氧化铜”3、含有其他原子团的化合物的命名一般根据原子团和另一元素的名称从右到左的顺序读作“某酸某”。
如:CaCO3读作“碳酸钙”,Cu(NO3)2读作“硝酸铜”但注意,H2CO3就读作“碳酸”,H2SO4就读作“硫酸”等。
4、某些比较复杂物质的命名如:Cu2(OH)2CO3读作“碱式碳酸铜”,H2O2读作“过氧化氢”等三、化合价和化学式的写法1、各种物质的化学式都是通过实验方法测定出来的,一种纯净物只能由一个化学式来表示,不能主观臆造2、化合价。
大量的化合物中不同元素的原子数目中都是一个固定的比值,体现这种关系的数值就是化合价某种元素的化合价数值与它原子的最外层电子数是密切相关的3、单质的化学式的写法(1)金属单质、固体非金属单质、稀有气体单质用元素符号表示。
大学常见原子团及其化合价、化学式、化学方程式

大学常见原子团及其化合价、化学式、化
学方程式
1. 水合离子 (Hydrated Ions)
- 化合价:根据离子的电荷来确定
- 化学式:离子名后加上适当数量的水分子,例如:铜(II)离子(Cu^2+)的化学式是Cu(H2O)4^2+
- 化学方程式:反应中水分子的数目保持恒定,例如:
Cu(H2O)4^2+ + 4Cl^- → CuCl4^2- + 4H2O
- 化合价:配位号减去配体的电荷
- 化学式:金属离子在前,配体在后,例如:[Co(NH3)6]^3+
- 化学方程式:反应中金属离子和配体的数目保持恒定,例如:[Co(NH3)6]^3+ + 3Cl^- → [CoCl3(NH3)3]
3. 氧化物 (Oxides)
- 化合价:氧元素的化合价通常为-2
- 化学式:元素符号和下标表示氧的数量,例如:二氧化碳的
化学式是CO2
- 化学方程式:与其他物质反应时需要根据具体情况调整氧的
数目,例如:2CO + O2 → 2CO2
4. 酸 (Acids)
- 化合价:酸中氢离子的化合价通常为+1
- 化学式:以H开头表示酸,例如:盐酸的化学式是HCl
- 化学方程式:酸与碱或金属反应时产生相应的盐和水,例如:HCl + NaOH → NaCl + H2O
请注意,以上只是一些常见的原子团及其化学性质的简单介绍,具体化合价、化学式和化学方程式可能会根据具体情况而有所不同。
在进行具体计算或化学实验时,请根据实际情况进行确认。
化学化学式和化合价

04 化合价的应用
根据化合价判断化合物的类型
根据化合物中元素的化合价是否 为0,可以判断化合物是否为单
质。
根据化合物中元素的化合价是否 相同,可以判断化合物是否为同
素异形体。
根据化合物中元素的化合价是否 相等,可以判断化合物是否为同
分异构体。
根据化合价判断化合物的性质
正价元素通常具有氧化性,负价元素通常具有还原性。
03 化合价的概念
化合价的定义
化合价是指在化合物中,元素原子的电子数与其在分子中的成键数之间的关系。 化合价反映了元素在化合物中的氧化状态或电子得失情况。
在离子化合物中,正负离子的化合价等于其电荷数。
化合价的表示方法
通常在元素符号的正上方标出 化合价,如$H^{+}$、$O^{2 -}$等。
对于共价化合物,化合价用分 数表示,分子中的原子个数写 在分数前面,如$CO_{2}$中C 为$+ 4$价,O为$- 2$价。
根据化合物中元素的化合价,可以判断 制取该化合物的反应是否需要加热或冷
却。
05 化合价与化学式的关系
化合价与化学式的对应关系
每个元素在化学式中都有一个特定的化合价,这个化合价与 该元素在化合物中的电子得失和共用情况有关。
化合价决定了化学式中各元素的比例关系,例如,在H₂O中, 氢元素的化合价为+1,氧元素的化合价为-2,因此氢元素和氧 元素的原子个数比为2:1。
化合物中元素的化合价越高,其氧化性越强;化合价越低,其还原性越 强。
化合物中元素的化合价越高,其稳定性越差;化合价越低,其稳定性越 好。
根据化合价判断化合物的制取方法
根据化合物中元素的化合价,可以判断 制取该化合物所需的原料和反应条件。
化学式与化合价

化学式与化合价一、化合价(1)化合价有正价和负价之分①氧元素通常显-2价②氢元素通常显+1价。
③金属元素跟非金属元素化合时,金属元素显正价,非金属元素显负价④一些元素在不同物质中可显不同的化合价(2)化合物里正负化合价的代数和为0(3)单质分子里,元素的化合价为0【注意】要注意化合价的表示方法与离子符号的区别:头顶价,肩挑离化合价离子表示方法标在元素符号的正上方左符号右数目(1要写标在元素符号的右上角左数目右符号(1不写)符号+3 -2 +2Al、O、MgAl3+、O2-、Mg2+联系同种元素的化合价与离子的电荷,通常数值相等,正负相同,位置不同,写法相反如:试区别2Ca+与Ca2+,2S-与S2-中数字的含义。
解析:2Ca+表示钙元素显+2价(或钙元素的化合价为+2价);2S-表示硫元素显-2价。
Ca2+表示一个钙离子带2个单位的正电荷;S2-表示1个硫离子带2个单位的负电荷。
4.牢记常见元素及原子团的化合价:(1)常见元素的化合价(5、读法某化某:指该物质中含两种元素某酸某:指该物质中含“某酸根”原子团氢氧化某:指该物质中含“氢氧根”原子团某化亚某:某酸亚某:指该物质中正价元素有两种化合价,且取该元素较氢氧化亚某:低的化合价。
2、化学式的意义:(1)由分子构成的物质其化学式的意义【注意】化学式前一旦有数字,就不能表示物质和组成元素,失去了宏观意义,只具有微观意义。
例如:在2H2O中各数字有什么意义?数字的意义(2)由原子构成的物质,其化学式的意义例:符号H、2H、H2、2H2各具有什么意义?Ⅰ.H表示氢元素或一个氢原子。
Ⅱ.2H表示2个氢原子。
Ⅲ.H2表示氢气这种物质;氢气是由氢元素组成;一个氢分子;每个氢分子由2个氢原子构成。
Ⅳ.2H2表示两个氢分子3、化学式的书写与命名:(1)单质①书写:②命名:一般读元素名称。
气体“元素名称+气”(2)化合物的化学式:(读写顺序相反)(1)氧化物中氧元素写后面如:CO2、Fe3O4、P2O5、 MnO2等.读作:“几氧化几某”化合物(2)金属元素写前面,非金属元素写后面如:NaCl、CaCl2等;读作:从右往左读作“某化某”(3)正价写前面,负价写后面如:H2O、SO2、KCl等练习1:标出各物质中元素化合价。
初中常见物质化学式与元素化合价

初中常见物质化学式与元素化合价物质的化学式是用元素符号表示化学元素的种类和原子数目的式子。
而元素的化合价是指元素与其他元素形成化合物时所呈现的既成规律,反映了元素在化合物中与其他元素结合的能力。
下面将介绍一些初中常见物质的化学式以及元素的化合价。
1.二氧化碳:化学式为CO2,由1个碳原子和2个氧原子组成。
其中,碳的化合价为+4,氧的化合价为-2、碳与氧原子的化合价之和为0。
2.水:化学式为H2O,由2个氢原子和1个氧原子组成。
其中,氢的化合价为+1,氧的化合价为-2、氢原子与氧原子的化合价之和为0。
3.氯化钠:化学式为NaCl,由1个钠原子和1个氯原子组成。
其中,钠的化合价为+1,氯的化合价为-1、钠原子与氯原子的化合价之和为0。
4.硝酸:化学式为HNO3,由1个氢原子、1个氮原子和3个氧原子组成。
其中,氢的化合价为+1,氮的化合价为+5,氧的化合价为-2、氢的化合价与氮、氧原子的化合价之和都为0。
5.二氧化硫:化学式为SO2,由1个硫原子和2个氧原子组成。
其中,硫的化合价为+4,氧的化合价为-2、硫原子与氧原子的化合价之和为0。
6.氨气:化学式为NH3,由1个氮原子和3个氢原子组成。
其中,氮的化合价为-3,氢的化合价为+1、氮原子与氢原子的化合价之和为0。
7.二氧化硅:化学式为SiO2,由1个硅原子和2个氧原子组成。
其中,硅的化合价为+4,氧的化合价为-2、硅原子与氧原子的化合价之和为0。
8.硫酸:化学式为H2SO4,由2个氢原子、1个硫原子和4个氧原子组成。
其中,氢的化合价为+1,硫的化合价为+6,氧的化合价为-2、氢的化合价与硫、氧原子的化合价之和都为0。
9.乙烯:化学式为C2H4,由2个碳原子和4个氢原子组成。
其中,碳的化合价为-3,氢的化合价为+1、碳原子与氢原子的化合价之和为0。
10.氯气:化学式为Cl2,由2个氯原子组成。
氯的化合价为0,因为不需要与其他元素结合。
以上是一些初中常见物质的化学式和元素的化合价。
化合价及化学式

化合价及化学式一、化合价口诀:钾钠银氢+1价,钙镁钡锌+2价,氟氯溴碘-1价,通常氧硫-2价;铜+2,铝+3,铁有+2和+3,莫忘单质是零价。
三、常见物质的名称及化学式:1、单质:氢气H2氮气N2氧气O2臭氧O3 氯气Cl2 氦气He 铁Fe 铜Cu 碳C 硫磺S2、氧化物:氧化钠Na2O 氧化钾K2O 氧化铜CuO 氧化镁MgO 氧化铁(三氧化二铁)Fe2O3氧化亚铁FeO 四氧化三铁Fe3O4五氧化二磷P2O5 氧化铝Al2O3氧化钙CaO 水H2O 双氧水(过氧化氢)H2O2 二氧化碳CO2 二氧化硫SO2三氧化硫SO33、酸:盐酸HCl 硫酸H2SO4硝酸HNO3碳酸H2CO3醋酸CH3COOH4、碱:氢氧化钠NaOH 氢氧化钾KOH 氢氧化铜Cu(OH)2氢氧化镁Mg(OH)2氢氧化铝Al(OH)3氢氧化铁Fe(OH)3氢氧化亚铁Fe(OH)2氢氧化钙Ca(OH)25、盐:(1)盐酸盐:氯化钠(食盐)NaCl 氯化钾KCl 氯化钙CaCl2氯化镁MgCl2氯化铜CuCl2 氯化锌ZnCl2氯化铁FeCl3氯化亚铁FeCl2氯化银AgCl 氯化铝AlCl3氯化钡BaCl2(2)硫酸盐:硫酸钠Na2SO4硫酸钾K2SO4硫酸铜CuSO4硫酸镁MgSO4硫酸锌ZnSO4硫酸铁Fe2(SO4)3硫酸亚铁FeSO4硫酸铝Al2(SO4)3硫酸钡BaSO4(3)硝酸盐:硝酸钠NaNO3硝酸钾KNO3硝酸银AgNO3硝酸铜Cu(NO3)2硝酸锌Zn(NO3)2 硝酸亚铁Fe(NO3)2硝酸镁Mg(NO3)2硝酸铝Al(NO3)3 硝酸钡Ba(NO3)2(4)碳酸盐:碳酸钠Na2CO3碳酸钾K2CO3碳酸钙CaCO3碳酸镁MgCO3碳酸钡BaCO3碳酸银Ag2CO3(5)铵盐:硝酸铵NH4NO3碳酸铵(NH4)2CO3 硫酸铵(NH4)2SO4 氯化铵NH4Cl※找出书写规律了吗?。
化学考点之化合价与化学式

化学考点之化合价与化学式化合价是元素的一种性质,它只有在元素彼此化合时才表现出来。
在化合物中正、负化合价代数和等于零,这是求化合价的准则。
下面是作者给大家带来的化学考点之化合价与化学式,欢迎大家浏览参考,我们一起来看看吧!初中化学知识点:化合价的求法几种求法:一、由化学式或根式1.求AmBn化合物中A元素化合价的公式: (B元素的化合价×B的原子个数)/A的原子个数2.求多元化合物中未知化合价的元素的化合价公式: (已知化合价诸元素价数的代数和)/未知化合价的元素的原子个数3.根据正、负电荷数判定元素(或原子团)的化合价。
在根式中,正、负化合价总价数的代数和等于根式所带的正、负电荷数。
二、由元素养量比1.(A元素的相对原子质量×B元素的化合价)/(B元素的相对原子质量×元素的化合价)=A元素的质量比值/B元素的质量比值2.A元素的质量比值(或百分组成)×A的化合价/A的相对原子质量=B元素的质量比值(或百分比组成)×B的化合价/B相对原子质量三、由质量比(B的化合价×A的相对原子质量比值)/(A的化合价×B的相对原子质量比值)=A元素的质量比值/B元素的质量比值a)化合价的原则:在化合物中,正负化合价的代数和为0。
b)化合价规律:(1)在单质中,元素的化合价为0。
(2)在化合物中,氢常显+1价,氧显-2价。
金属元素通常显正价,非金属元素显负价。
在非金属氧化物中,氧显-2价,非金属元素显正价,因此非金属元素可以有正价和负价。
(3)在不同的条件下,某元素可以表现出不同的化合价(4)原子团也表现化合价,其化合价数值由构成原子的正负化合价的代数和算出。
c)常见元素化合价口诀:一价氢氯钾钠银二价氧钙钡镁锌三铝、四硅、五价磷二三铁、二四碳二四六硫都齐全氢一氧二为标准铜汞二价最常见单质价数都为零负一氢氧硝酸根负二硫酸碳酸根负三记住磷酸根正一价的是铵根正负代化合价数和为零:【例1】试肯定化合物K2MnO4中Mn元素的化合价。
化学式化合价以及化学方程式

化学方程式
一、质量守恒定律
1.定义:参加化学反应的各物质的质量总和,等于反应后生 成的各物质的质量总和。这个规律叫作质量守恒定律
2.适用范围:化学变化(所有) 3.质量守恒的实质:
{ 微观:化学反应前后
⑴原子的种类不变 ⑵原子的数目不变 ⑶原子的质量不变
{ 宏观:化学反应前后
⑴元素的种类不变 ⑵物质的总质量不变 ⑶元素的质量不变
③金属元素跟非金属元素化合时,金属元素显正价,非金属元 素显负价。
④在化合物里,化合价有正、负,正负化合价的代数和为零。
⑤许多元素具有可变价态,同种元素在不同的化合物里可显不 同的化合价(FeO,Fe2O3)
⑥有些元素具有可变化合价,同种元素在同一种化合物里可 显不同的化合价(NH4NO3) ⑦在原子团中正负化合价代数和等于原子团的化合价。
{ 化学反应前后一定变的是
宏观:物质的种类 微观:分子的种类
{ 化学反应前后可能变的是
宏观:元素的化合价 微Leabharlann :分子的数目二、化学方程式
1.定义:用化学式来表示化学反应的式子。
2.化学方程式表示的意义:
①表示反应物,生成物及反应条件。 ②质量比:(即各物质的相对分子质量与化学式前的计量数 的乘积之比) ③粒子个数
⑵计算物质组成的质量比:
各元素之间的质量比=(各原子的相对原子质量总积)之比 (元素相对原子质量×其原子个数)之比
例如:CO2中的碳元素和氧元素的质量比? ⑶计算物质中某一元素的质量分数:
=该元素的相对原子质量×该元素的原子个数 物质的相对分子质量
×100%
例:硝酸铵(NH4NO3)中氮元素的质量分数-----35%
上不存在的物质和化学反应。 ②遵守质量守恒定律,等号两边各原子的种类和数目必
初中常见化合价化学式及化学方程式

初中常见化合价化学式及化学方程式集团文件发布号:(9816-UATWW-MWUB-WUNN-INNUL-DQQTY-初中常见化合价、化学式及化学方程式一、初中化合价钾钠银氢正一价,氟氯溴碘负一价;正一亚铜正二铜,正二亚铁正三铁,(Cu 2O 、CuO ;FeO 、Fe 2O 3)钙镁钡锌正二价,铝是正三氧负二,氯是负一最常见;硫有负二正四六,(Na 2S 、FeS 、CuS 、SO 2、SO 3)负一硝酸氢氧根,负二硫酸碳酸根;负三记住磷酸根,正一价的是铵根, 正四硅,二四碳,单质零价永不变。
其他元素有变价,先死后活来计算。
二、常见单质三、化合物 1、氧化物2、其他化合物3、常见有机化合物 初中化学方程式全(已配平)一、化合反应1、镁在空气中燃烧:2Mg+O 点燃2MgO2、铁在氧气中燃烧:3Fe+2O 点燃Fe 3O 43、铝在空气中燃烧:4Al+3O 点燃2Al 2O 34、氢气在空气中燃烧:2H 2+O 点燃2H 2O5、红磷在空气中燃烧:4P+5O 点燃2P 2O 56、硫粉在空气中燃烧:S+O 点燃SO 27、碳在氧气中充分燃烧:C+O 点燃 CO 28、碳在氧气中不充分燃烧:2C+O 2 点燃2CO9、二氧化碳通过灼热碳层:C+CO 高温2CO10、一氧化碳在氧气中燃烧:2CO+O 2 点燃2CO 211、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO 2+H 2O=H 2CO 3 12、生石灰溶于水:CaO+H 2O=Ca(OH)213、无水硫酸铜作干燥剂:CuSO 4+5H 2O=CuSO 4·5H 2O 14、钠在氯气中燃烧:2Na+Cl 2点燃2NaCl 二、分解反应15、实验室用双氧水制氧气:2H 2O 2MnO 22H 2O+O 2↑ 16、加热高锰酸钾:2KMnO 4△K 2MnO4+MnO 2+O 2↑ 17、水在直流电的作用下分解:2H 2O 通电2H 2↑+O 2↑ 18、碳酸化学性质不稳定而分解:H 2CO 3=H 2O+CO 2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO 3高温CaO+CO 2↑ 20、加热氯酸钾分解:2KClO 3=2KCl+3O 2↑21、氧化汞加热分解:2HgO △2Hg+O 2↑三、置换反应(单质+化合物→新的单质+新的合化物) 22、锌和稀盐酸反应(实验室制氢气):Zn+2HCl=ZnCl 2+ H 2↑ 锌和稀硫酸反应(实验室制氢气):Zn+H 2SO 4=ZnSO 4+ H 2↑ 23、镁和稀盐酸反应:Mg+2HCl=MgCl 2+H 2↑ 镁和稀硫酸反应:Mg+H 2SO 4=MgSO 4+ H 2↑ 24、铁和稀盐酸反应:Fe+2HCl=FeCl 2+ H 2↑ 铁和稀硫酸反应:Fe+H 2SO 4=FeSO 4+ H 2↑ 25、铝和稀盐酸反应:2Al+6HCl=2AlCl 3+3H 2↑ 铝和稀硫酸反应:2Al+3H 2SO 4=Al 2(SO 4)3+3 H 2↑ 26、铁和硫酸铜溶液反应:Fe+CuSO 4 =FeSO 4+Cu 铝和硫酸铜溶液反应:2Al+3CuSO 4=Al 2(SO 4)3+3Cu 27、铜和硝酸银反应:Cu+2AgNO 3=Cu(NO 3)2+2Ag28、氢气还原氧化铜:H 2+CuO △Cu+H 2O29、木炭还原氧化铜:C+2CuO 高温 2Cu+CO 2↑ 30、焦炭还原氧化铁:3C+2Fe 2O 高温 4Fe+3CO 2↑ 31、水蒸气通过灼热碳层:H 2O+C 高温 H 2+CO 四、复分解反应复分解反应是由两种互相交换成分,生成另外两种化合物的反应。
常见元素化合价和化学式 -回复

常见元素化合价和化学式 -回复
常见元素的化合价是指元素与其他元素结合形成化合物时的电荷状态。
以下是一些常见元素的化合价和化学式:
1. 氢:化合价为 +1,化学式为 H2。
2. 氧:化合价为 -2,化学式为 O2。
3. 氮:化合价为 -3,化学式为 N2。
4. 碳:化合价为 -4,化学式为 C2。
5. 钠:化合价为 +1,化学式为 NaCl。
6. 铁:化合价可以为 +2 或 +3,化学式为 FeCl2 或 FeCl3。
7. 氯:化合价为 -1,化学式为 Cl2。
8. 铜:化合价可以为 +1 或 +2,化学式为 CuI 或 CuO。
这里只列举了一些常见元素的化合价和化学式,还有很多其他元素的化合价和化学式。
需要根据具体的元素和化合物进行具体的分析和确认。
常见化学反应及其化合价、化学式、化学方程式

常见化学反应及其化合价、化学式、化学
方程式
本文将介绍一些常见的化学反应,包括化合价、化学式和化学方程式。
氧化反应
1. 氧化铁反应
- 化合价:Fe为+2或+3
- 化学式:FeO、Fe2O3
- 化学方程式:4Fe + 3O2 -> 2Fe2O3
2. 氧化铜反应
- 化合价:Cu为+1或+2
- 化学式:Cu2O、CuO
- 化学方程式:2Cu + O2 -> 2CuO
酸碱反应
1. 盐酸与氢氧化钠反应
- 化合价:Na为+1,H为+1,Cl为-1
- 化学式:NaCl、H2O
- 化学方程式:HCl + NaOH -> NaCl + H2O
2. 硫酸与氢氧化钠反应
- 化合价:Na为+1,H为+1,S为+6,O为-2
- 化学式:Na2SO4、H2O
- 化学方程式:H2SO4 + 2NaOH -> Na2SO4 + 2H2O
双替换反应
1. 氯化银与溴化钾反应
- 化合价:Ag为+1,Cl为-1,K为+1,Br为-1
- 化学式:AgCl、KBr
- 化学方程式:AgCl + KBr -> AgBr + KCl
2. 氯化银与硝酸钾反应
- 化合价:Ag为+1,Cl为-1,K为+1,N为+5,O为-2 - 化学式:AgCl、KNO3
- 化学方程式:AgCl + KNO3 -> AgNO3 + KCl
以上是一些常见化学反应及其化合价、化学式和化学方程式的
简要介绍。
如需更详细的了解,请深入研究每种反应的背景和条件。
化合价与化学式

一、化合价与化学式
1、常见元素的常见化合价
+1价:、、、
+2价:、、、、
氧铝氯铁
2、常见原子团的化合价
OH- NO3- CO32- SO42- NH4+
3、化学式
(1)碳硫磷铁银锌镁铝汞
氩气氦气氖气氧气氢气氮气(2)水二氧化碳一氧化碳二氧化硫三氧化硫
过氧化氢五氧化二磷四氧化三铁氧化铜
氧化镁氧化钠氧化钾氧化银氧化钙氧化铝
氧化铁氧化亚铁二氧化锰
(3)氢氧化钠氢氧化钾氢氧化钙氢氧化钡氢氧化锌氢氧化镁氢氧化铜氢氧化铁
氢氧化亚铁
(4)硝酸钠硝酸钾硝酸银硝酸钙
硝酸镁硝酸钡硝酸锌硝酸铝
硝酸铁硝酸亚铁硝酸铜
(5)碳酸钠碳酸钾碳酸银碳酸钙碳酸镁
碳酸钡碳酸锌碳酸亚铁碳酸铜
(6)硫酸钠硫酸钾硫酸银硫酸钙硫酸镁
硫酸钡硫酸锌硫酸铜硫酸铝硫酸铁硫酸亚铁
(7)氯化氢氯化钠氯化钾氯化银氯化钙
氯化镁氯化钡氯化锌氯化铜氯化铝氯化铁
氯化亚铁
(8)氯化铵硝酸铵碳酸铵硫酸铵(9)盐酸硝酸硫酸碳酸。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(2)M-1×n-16×(2n-1)
=M-33n+16
+1 +6
-2 +7
O2 H2O NaCl H2S
KClO3 H2SO4 KMnO4 Ca(OH)2
练一练: 标出下列划线元素的化合价
+1 +4 +3
Na 2O
+6
BaCO3
+2
AlO3
+5
H2SO4
-3
Cu(OH)2
+3
KNO3
NH4NO3
+5
Fe2(SO4)3
课题4 化学式与化合价
课时2
六、化合价的运用:
2 5 2
五、化合价--化合物均有固定的组成
注意点:
元素的化合价是元素的原子在形成 化合物时表现出来的一种化学性质
1、化合价有正价和负价
(1)氧元素通常显-2价,氢元素通常显-1价
(2)金属元素显正价,非金属元素显负价-- “金正, 非负”
(3)一些元素在不同的物质里有不同的化合价
2、在化合物里正负化合物的代数和为0
(一)、根据化学式确定元素的化合价: 1、标出化学式中各元素的化合价
例1、标出下列物质中各元素的化合价:
氯化锌 +2 -1 金属锌 0 氢氧化钠
ZnCl2
Zn
+1 -2 +1 NaOH
注意:化合价标在相应元素符号的正上方
课堂练习:标出下列物质中各元素的化合价:
+2 -2 +1-2
(1)MgO
(2)K20 (3) H20 (4)Ca(OH)2
例7、关于S 和.S2-的叙述中错误的是( D
A 具有相同的核电荷数 B 电层数相同
)
C 最外层电子数不相同 D 核外电子数相同 例8、燃放爆竹产生一种污染物,其元素的质量比为 l:1,该污染物是( C ) A、 H2S B、CO C、S02 D、N02 例9、甲醛(化学式为CH2O)是室内装潢时的主要 污染物之一,下列说法正确的是( A ) A. 甲醛是由碳、氢、氧三种元素组成 B. 甲醛是由碳原子和水分子构成 C.甲醛分子是由 碳原子、氢气分子、氧原子构成 D. 甲醛是由一个碳元素、二个氢元素、一个氧元素 组成
+1-2
+2 -2+1
六、化合价的运用:
(二)确定物质中某元素的化合价 例2、试确定氯酸钾中氯元素的化合价
【思路】
先写出化学式 设未知数
KClO3 解:设KClO3中Cl的化合价为X
+5
列等式(正负总价和为0)
+1+X+(-2)×3=0
X=+5
解答
答:氯酸钾中氯元素的化合价为+5
(三)、根据化合价确定元素的化学式:
二、化学式的意义:
回忆:H、5O所表示的意义? 以H2O为例,它表示了几种意义?阅读P79页。 1、表示这种物质 2、表示水由氢元素和氧元素组成 H2O 3、表示一个水分子
4、表示一个水分个H分子和一 个O原子。这句话是否正确,为什么?
讨论: H、2H、 H2、2H2O各具有什么意义?
课题4 化学式与化合价
请同学们写出下列物质的元素符号: 氢、碳、氧、硫、钡、锰、氯、铁。
思 考
那么,水、双氧水、二氧化锰、五氧化磷、 高锰酸钾等化合物该用什么符号来表示呢?
一、什么是化学式
这种用元素符号表示物质组成的式子。 注意:每种纯净物的组成是固定不变的。 所以表示每种物质组成的化学式只有一个
课堂练习:
例1、说明下列化学元素用语各表示的意义
(1) H
(4) 2H2 (7) Mg
(2) 2H
(5) H2O (8) Mg2+
(3)H2
(6)2H2O (9) 2Mg2+
+2
思考:标的化合价与离子符号的关系如何? 如:Mg 和 Mg2+
试一试 标出下列物质中划线 元素的化合价
0 +5
+2
-2
三、化学式的写法
1、单质的写法: 稀有气体和金属是由原子直接构成,及常温下为 固态的大多数非金属,单质直接由元素 符号来表 示 .如:He,Ne, Fe,Cu,S,P
2、化合物的写法 (1)这种物质由那些元素 组成 (2)化学式时元素 排列顺序的规定 “金左, 非 右” “氧在后” 。 (3)化学元素式中各元素的原子个数比是多少 (4)表示原子数的“小写数字”的书写部位
相对分子质量的运用
2、计算物质组成元素的质量 比
各元素之间的质量比=各原子的相对原子质量总和之比
例2、MnO2中锰元素和氧元素的质量比等于
练习2:
1、 H2O2、 Cu(OH)2中各元素的质量比? 2、NH4NO3中各元素的质量比?
相对分子质量的运用
该元素相对原子质量×原子个数 化合物的相对分子质量 × 100﹪
+ 3 -2
PO
+ 5 -2
省 略
P2O 3 P2O3
P2O 5 P2O5
1、说出下列物质中硫元素的化合价 H2S
-2 0
S
-1
H2SO3
+4
H2SO4
-2
+6
2、试确定下列化合物中原子团的化合价
KOH
-1
Mg(NO3)2
BaSO4
Na2CO3 Na3PO4
-2
-3
原子团的化合价都是负价吗?
+1
不是,如 NH4
六. 化合价的运用
1. 根据元素化合价推出实际存在的物质的化学式 (1). 排列元素 符号------正价在前负价在后 (2). 确定原子个数-------求两种元素正负化合价绝对值的最小公倍数 (3). 写出化学式----------把原子个数写在各元素 符号的右下方 (4). 检查化学式----------依据: 化合价代数和为0
3、单质分子里,元素的化合价为0
顺口溜:
说明:
一价钠钾银氢;二价镁钙锌钡; 按谐音记: 那家银清 三铝四硅记在心; 没盖新被 单质都为0; 永远也不变。
一二铜,二三铁, 二四碳,二四六硫要记全。 负价氯一硫二最常见。 在氯化物 和硫化物中 氯和硫分别 显负一价和 负二价。
原子团( 根 ): 常见原子团 OH、 NO3、NH4、SO4、 CO3 化合价分别为 –1、 -1、 +1、 -2、 -2价。
1、已知在H3RO4中,氢元素为+1价,氧为-2价, 则其中R的化合价为( C )
A、+3 B、+4 C、+5 D、+6 2、下列化合物中,氮元素为+5价的是( D ) A、N0 B、NO2 C、HNO2 D、KNO3
3、元素R的氧化物的化学式为R2O3,则R元素 与OH-组成的物质的化学式为( C ) A、ROH B、R(OH)2 C、R(OH)3 D、R(OH)4
例.写出氧化铝的化学式 2. 根据化学式判断元素的化合价 求 MnO2, FeO,Fe2O3, NH4NO3中 Mn , Fe , N 三种元素的 化合价 依据 :化合物里正负化合价代数和为0 结论:1.同种元素 在不同的化合物里有不同的化合价
2.同一化合物里同种元素 也可能有不同的化合价
课题4 化学式与化合价
课堂练习1. 说明下列化学元素用语各表示 (1)H (2)2H (3)H2 (4)2H2 (5)H2O (6)2H2O (7)Mg2+ (8)2Mg2+的意义
2、18gH2O所含氧元素与多少gCO2中所含氧元素的质 量相同( B ) A、18g B、22g C、44g D、88g 3、海洛因是政府明令禁止的毒品,其化学式为 C21H23NO5,它由 C.H.O.N共4种 种元素组成 ,每个 共有50 海洛因中共有________个原子 4、已知 SO3、SO2、O2三种物质的质量比5:4:2为 则其分子个数比为__________ 1:1:1 5.某化合物的化学式为HnROm,其中R的化合价为( B ) A 、+(m-n) B 、+(2m-n) C 、+(n-m) D、+(2n-m)
课时3 相对分子质量的有关计算
相对分子的运用:
思考:原子的质量很小,故我们采用相对原子 质量,那么由原子构成的分子,质量仍然很小, 又如何表示呢? 化学式中各原子的相对原子质量的总和,就是相 对分子质量 (符号为Mr)
八、相对分子质量
1、根据化学式计算相对分子质量 例1、 求 O2、 H2O、 KMnO4的相对分子质量 练习1、求Fe3O4、CO(NH2)2的相对分子质量
四、化学式的读法:
一般从右向左读作“某化某”有时还要读出化 学式中各种元素的原子个数 (1) 氧化物:如HgO、SO2 、Fe3O4,读作“氧 化某”,.有时还要读出化学式中各种元素的原 子个数,如Fe3O4读作四氧化三铁 “几氧化几 某” 。 (2) 金属与非金属组成 的化合物如:如NaCl 、 KCl 、 ZnS 读作“某化某” 如ZnS读作硫化锌。 (3) 其它如: P O 读作五氧化二磷, BaCl 读作 氯化钡 ,H2O2读作过氧化氢 (双氧水) , KMnO4 读作高锰酸钾 , KClO3读作氯酸钾
某元素的质量分数=
例3、H2O2中氢元素的质量分数?
练习3、计算化肥硝酸铵中(NH4NO3)中氮元素的质量分数
3.求物质中某元素的质量 分数
相对分子质量的运用
4、一定量的某物质中含有某元素的质量 元素的质量=某物质的质量×某元素的质量分数
例4、求18gH2O中氢元素的质量?
练习4、某农田里的作物需N施含35kg的氮肥, 如果施用的氮肥是尿素( CO(NH2)2 ),则 需要多少kg
