超级--第一节_元素周期表
第一节元素周期表
碱金属的物理性质的比较
颜色 硬度 密度 Li Na K Rb Cs 均为银白色(Cs略带金色) 柔软 较小
相 似
点
熔沸点
ⅠA
0
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
主族序数=最外层电子数
注 意
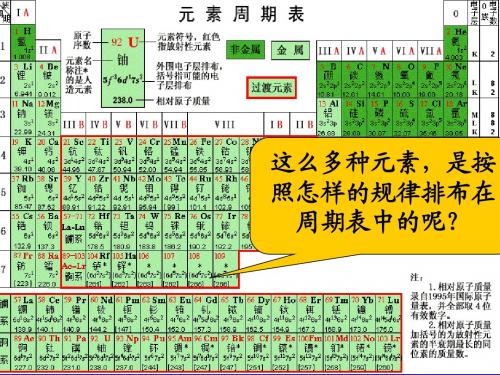
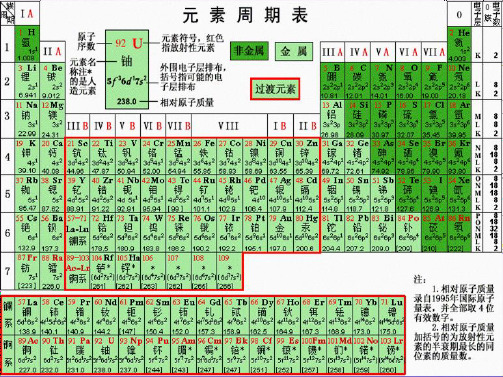
周 七 —— 2 种 第 1周期 总结: 期 主 短周期 第 2周期 —— 8 种 表 七 副 —— 8 种 里 和 第 3周期 —— 18 种 数 零 周期 第 4周期 周 族 (7个) —— 18 种 第 5周期 期 , 长周期 —— 32 种 第 6周期 , 最 后 第 7周期 —— 26 种 1 莫 2 忘 共 7 个主族,包括短周期和长周期元素 主族 3 第 副族 共 7 个副族,只包括在长周期中 4 族 5 族 第VIII族 包括第8、9、10 纵行 。 (16个) 6 0族 稀有气体元素 7 Ⅷ
(A) 2
3 11 19ຫໍສະໝຸດ 4(B)2 10 11 18 19
(C)
6 11 12 13 24
(D)
6 14 31 32
7
练习与思考:
3.在短周期元素中,原子最外电子层只 有1个或2个电子的元素是 (D ) A.金属元素 B.稀有气体元素 C.非金属元素 D.无法确定为哪一类元素
4.下列说法中正确的是(C ) A.每一周期的元素都是从碱金属开始, 最后以稀有气体结束 B.同一周期中(除第一周期外),从左 到右,各元素原子核的电子数都是从1 个逐渐增加到8个 C.第二、三周期上下相邻元素的原子 核外电子数相差8个 D.第七周期只有23种元素
元素周期表助记词
横行叫周期,共有七周期; 三四分长短,第七不完全。 纵行称作族,共有十六族; 二、三分主副,先主后副族; VIII族最特殊,三行是一族; 二次分主副,副后是主族。 一、八依次现,一、零再一遍。 锕、镧各十五,均属IIIB族。
第一节 元素周期表(人教版)必修二
Page 29
卤素单质与水的反应
2F2+2H2O = 4HF+O2 (特例) Cl2 +H2O = HCl+HClO
Br2+ H2O = HBr+HBrO
反 应 越 来 越 难 以 发 生
Page 30
卤素单质与金属的反应
与钠的反应 2Na+Cl2=2NaCl 与铁的反应 2Fe+3Cl2=2FeCl3 Fe+I2=FeI2 与铜的反应 Cu+Cl2=CuCl2 Cu+Br2=CuBr2
反应条件(F2 → I2)
所需条件越来越高。
生成的氢化物的稳定性(F2→I2)
氢化物的稳定性越来越差。
Page 28
氢化物性质的递变规律
• 酸性:HF<HCl<HBr<HI • 热稳定性: HF>HCl>HBr>HI • 沸点:HF>HI>HBr>HCl
• 还原性:HI>HBr>HCl>HF
Page 41
2.3 卤素单质的物理性质
溴的物理性质:
常温下,是深红棕色液体
易挥发,溴蒸气为红棕色,有刺激性气味
密度比水,大在水中的溶解度不大
溴的保存:
密闭保存,加水液封,盛溴的试剂瓶不可 选用橡胶塞。
Page 42
碘的物理性质: 碘是一种紫黑色固体 具升华性质,碘的蒸气呈紫色 固态物质不经过转变成液态而直接变成气态 的现象) 碘(I2)遇淀粉变蓝色 溴和碘易溶于有机溶剂
Page 23
碱金属物理性质的相似性与递变性
(1)相似性
①除Cs外,其余的都呈银白色; ②碱金属都比较柔软,有延展性; ③密度较小; ④熔、沸点较低; ⑤导热、导电的性能都很强。
第一节元素周期表

【解析】选C。本题考查对元素周期表的认识,第1周期只有两
种元素,故A项错。2号元素位于元素周期表中的最后一列,故B
项错。10号元素为稀有气体元素,其下面必为18号稀有气体元
素,故D项错。
类型 二
元素周期表的应用 )
【典例】(2013·聊城高一检测)下列说法正确的是( A.原子序数之差为2的两种元素不可能位于同一主族 B.D-核外有36个电子,则元素D位于第4周期第ⅦA族
二、现行元素周期表的编排原则
周期表 中的顺序给元素编号。 1.原子序数:按照元素在_______ 2.原子序数与原子结构之间的关系: 核电荷数 质子数 核外电子数 。 原子序数=_________=_______=___________
电子层数 原子序数
最外层电子数
电子层数
三、元素周期表的结构 1.周期(横行): 7 个横行,即有__ 7 个周期。 (1)数目:元素周期表有__
C.位于同一主族相邻的甲乙两种元素,甲的原子序数为x,则乙 的原子序数可能为x+4
D.位于同一周期的甲乙两种元素,甲位于ⅠA族,原子序数为x,
乙位于ⅢA族,则乙原子序数可能为x+19
【解题指南】解答本题要注意以下3点: (1)第1~7周期分别含有2、8、8、18、18、32、32种元素,同 一主族两种元素的原子序数的差值为上列数值或连续几个数值 之和。 (2)不同周期ⅠA族与ⅢA族之间相隔的元素数量不一定相同。
(3)简单阴离子的核外电子与同周期的稀有气体相同。
【解析】选B。氢和锂两种元素的原子序数之差为2,却同位于 第ⅠA族,A错误;简单阴离子的核外电子与同周期的稀有气体相 同,D-核外有36个电子,即与第4周期的0族元素Kr处于同一周期, 且D比Kr少一个电子,即在第ⅦA族,B正确;甲乙同主族,根据元
第一节元素周期表(共40张PPT)
第ⅦA 族
与水缓慢反应
(2)原子结构特点 Cl2+H2O=HCl+HClO
静置后,液体分为两层。
通一过个以 12上C相质比量较同×,1点/思12考:钠和钾最的外性质层有 7个电子
静置后,液体分为两层。
和递变性。 (氧化性:Cl2 >I2)
核电荷数依次增多
不同点: 电子层数依次增多 上层无色,下层分别呈橙红色、紫红色
第一章 物质结构、元素周期律
第一节 元素周期表 一、元素周期表的结构
原子序数:依原子核电荷数由小到大的顺序给元素编号,这种
编号叫原子序数。
原子序数=核电荷数=质子数=核外电子数 (一)元素周期表的编排原则
1、横行: 把电子层数相同的各种元素按原子序数递增顺序
从左到右排列。
2、纵行: 把最外层电子数相同的各种元素按电子层数递增顺序 从上而下排成。
性逐渐增强,非金属性逐渐减弱。
2. 元素性质与原子结构有有密切的关系,主要与原子
核外的排布,特别是最外层电子数有关。原子结构
相似的一族元素,它们在化学性质上表现出相似性 和递变性。
1、砹(At)原子序数85,与F、Cl、Br、I同族,推测砹或
砹的化合物不可能具有的性质是( B)
A、砹易溶于某些有机溶剂 B、砹能与水剧烈反应
应越来越
,剧生烈成的氧化物越来越
。
最高复价杂氧化物对应水化物的碱性越来越 。
强
讨论1:Li与K 应如何保存? Li封存于固体石蜡中, 少量K保存于煤油中。
讨论2:碱金属与盐酸: 2R+2H+= 2R++H2 ↑ 讨论3:碱金属与盐溶液: 先与水反应
讨论4:Li+、Na+、K+、Rb+、Cs+也具有强还原性吗? 没有。 有较弱的氧化性。 氧化性: Li+ > Na+ > K+ > Rb+ > Cs+
超级元素周期表记忆

元素周期表记忆
侵害
从前,有一个富裕人家,用鲤鱼皮捧碳,煮熟鸡蛋供养着有福气的奶妈,在那个家还有个很美丽的女儿,叫桂林,不过她留有两颗绿色的大门牙(哇,僵尸牙!太恐怖了吧),后来只能嫁给了一个叫康太的反革命。
刚(新)嫁入门的那天,就被小姑子号称“铁姑”狠狠地捏痛了,亲娘一生气,当时就休克了。
如此娘家一上告,拟好了状纸,目的是为了给桂林讨回公道。
铁姑的老爸(丁老汉)竟然夜闯县太爷府,把银制大印假偷走,放在口袋的暗格里,因为太重,希望不被人看见。
提着一直往西跑,跑到一个的地方,那里竟然住了一点些仙人。
这里风景优美:彩色贝壳蓝蓝的河,但见一只乌鸦飞过来。
后面还看见一只天鹅,依靠在乌鸦后面,竟然还戴着铂金戒指,供他牵着。
乌鸦必然很累,由于不爱北方的冬天,他们一起向南方迁徙,突然下起雨来,天鹅说:注意防雷啊!
看完了吗?现在把这个故事浓缩一下,再用10分钟时间,把它背下来。
第一周期:氢氦----侵害
第二周期:锂铍硼碳氮氧氟氖----鲤皮捧碳蛋养福奶
第三周期:钠镁铝硅磷硫氯氩----那美女桂林留绿牙
第四周期:钾钙钪钛钒铬锰----嫁给康太反革命(谐音)
铁钴镍铜锌镓锗----铁姑捏痛新嫁者
砷硒溴氪----生气休克
第五周期:铷锶钇锆铌钼锝----如此一告拟目的
钌铑钯银镉铟锡----丁老把银格因希
锑碲碘氙----提地点仙
第六周期:铯钡镧铪钽钨铼----(彩)色贝(壳)蓝(色)河但乌来
锇铱铂金汞砣铅----鹅依铂金供他牵
铋钋砹氡----必不爱冬(天)
第七周期:钫镭锕----防雷啊!
(关键是在脑子里把文字转化图片)
Master Lian。
第一节元素周期表教材
O2
钠、钾化学性质比较 钠 钾 剧烈燃烧,火 剧烈燃烧,火焰 焰呈 黄 色, 呈 紫 色 生成 淡黄色 色 的固体
浮 在水面上、熔 成银白色、在水面 上四处 游 、滴入酚 酞溶液呈 红 色,有 水雾、微弱爆炸
浮 在水面上、 熔 成银白色、在水 H2O 面上四处 游、滴 入酚酞溶液呈 红 色
(2) 碱金属的原子结构与化学性质的关系
2种元素 短周期 三长三短 横向 8种元素 一不全 (7个横行) 8种元素 18种元素 7个周期 18种元素 长周期 周 32种元素 期 26种元素 不完全周期 七主七副 表 ★7个主族:(IA~VIIA) 零八族 纵向 (18个纵行) 7个副族:(ⅠB~ⅦB) 16个族 VIII族( 8、9、10三个纵行) 1 2 3 4 5 6 7
D
2、不能作为元素周期表中元素排列顺序的依据的是 ( ) DA.原子的核电荷数 C.原子的质子数
B.原子的核外电子数
D.原子的中子数
6.X、Y都是短周期元素,若X的原子序数为n, X2+与Y2-具有相同的电子层结构,则Y的原子 序数是( B )
A.n-2 B.n-4
C.n+2
D.n+4
解析:电子层结构相同是指核外电子数一样多。 根据题意可知X2+与Y2-核外电子数一样多。设Y的原子 序数是y,则有关系n-2=y+2,即有y=n-4。
遇水立即 燃烧,爆 炸和CsOH (碱性非 常强)
从上到下,与O2和H2O反应越来越剧烈, 表现为: 产物越来越复杂,生成的碱碱性越强。 (LiOH< NaOH< KOH< RbOH< CsOH)
从上到下,碱金属元素的原子结构有何相似性和递变性?
(2) 碱金属的原子结构与化学性质的关系
1-1元素周期表

元素周期表的结构
主族:ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA
共七个主族
副族:ⅠB , ⅡB , ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB
族
共七个副族
(纵向) 第VIII 族:三个纵行,位于Ⅶ B 与ⅠB中间
4)熔、沸点低,随着核电荷数的递增,碱金属的熔、 沸点依次降低。 K、Na常温下为固态,而K、Na的合金常温下为 液态,它是原子反应堆的导热剂。
5)导电、导热
4.比较元素金属性强弱的方法
(1)根据金属活动性顺序表判断。自左至右金属性减 弱,即失电子能力减弱,如:Zn>Cu。
(2)根据元素周期表判断。同周期,从左至右金属性 减弱。同主族,自上而下金属性增强。如: Na>Mg>Al,Na<K。
71
7 87 88 89103
104
105
106
107
108
109
110
111
112
②族: 元素周期表中有18个纵行,分为16个族,其中
7个主族、7个副族、1个第Ⅷ族和1个0族。 (用罗马数字) 除短周期外,从左到右各族的排列顺序为 ⅠA ⅡA ⅢB … ⅦB Ⅷ ⅠB ⅡB
ⅢA … ⅦA 0族。
71
89
7
87
88
10
10 410 510 6来自10 710 8
10 9
11 0
11 1
11 2
3
不完全 周期
元素周期表的结构
短周期
第1周期:2 种元素 第2周期:8 种元素 第3周期:8 种元素
第一章第一节第1课时元素周期表

第一节元素周期表第1课时元素周期表1.简单了解元素周期表的发展历程。
2.了解元素周期表的编排原则及结构。
3.了解周期、族等概念。
4.理解原子结构与其元素在周期表中位置的关系。
知识点一元素周期表的发展历程和编排原则[学生用书P1]阅读教材P4,思考并填空。
1.元素周期表的发展历程(1)第一张元素周期表:由俄国化学家门捷列夫编制,元素按照原子的相对原子质量由小到大的顺序排列。
(2)现行元素周期表:元素按照原子的核电荷数由小到大的顺序排列。
2.现行元素周期表(1)原子序数①含义:按照元素在周期表中的顺序给元素的编号。
②原子序数与原子结构的关系原子序数=核电荷数=核外电子数=质子数。
(2)周期表中元素名片3.编排原则1.判断正误(1)第一张元素周期表就是现行元素周期表。
()(2)现行元素周期表的编排依据是原子的核电荷数。
()(3)周期表中同一横行元素具有相同的最外层电子数。
()(4)周期表中,同一纵行元素具有相同的电子层数。
()答案:(1)×(2)√(3)×(4)×2.请画出周期表中钠、硫、氮元素的名片(相对原子质量用近似整数表示) 答案:11Na 钠2316S硫327N氮143.下列各组原子序数表示的元素在元素周期表中属于同一纵行的是()A.2、3、5B.6、14、32C.7、16、32 D.15、16、17解析:选B。
在元素周期表中,不同横行中最外层电子数相同的元素,按电子层数递增的顺序由上而下排成纵行。
知识点二元素周期表的结构[学生用书P2]阅读教材P4~P5,思考并填空。
1.元素周期表的结构2.常见族的元素的特别名称第ⅠA族(除氢):碱金属元素;第ⅦA族:卤族元素;0族:稀有气体元素。
1.判断正误(1)元素周期表有7横行18纵行,包括7个周期18个族。
()(2)每个周期元素原子最外层电子数都是由1到8。
()(3)最外层电子数是2的元素一定为第ⅡA族的元素。
()(4)硅元素在元素周期表中的位置为第三周期第ⅣA族。
超级元素周期表

超级元素周期表昂贵的“废柴”锕跟其他具有放射性的哥们都有一个共同的特点――稀缺!1吨铀矿石里面顶多0.2毫克的锕。
这货半衰期又还短,也就21.772年,也就是说你好不容易从5吨铀矿石里找到了1毫克的锕,在差不多21年之后就全没了。
科学家们也是会想辙。
在核反应堆里用中子轰击镭-225,将其转换成镭-227之后,镭-227以42分钟的速度半衰成锕-227。
虽然过程非常的费劲,而且成本也非常高,奈何锕这个家伙你说它一点用处也没有的话,它又有那么一丁点用处,叫人不得不以极高的成本制备它。
医学上,少数情况会用到锕作为中子源来对抗肿瘤,最新的动物研究发现,通过注射锕元素与一种名为DOTA(你没看错)的螯合剂后,可以有效对抗白血病、淋巴癌、乳腺癌、卵巢癌与神经母细胞瘤。
元素八卦1 锕-227的放射性非常的强烈,以至于肉眼都可以直接看到银白色的锕发出暗蓝色的光。
2 由于锕极强的放射性与约21年的半衰期,科学家正在琢磨将其应用于宇宙飞船上的核能电池中,也就是作为反射型同位素热电机的燃料。
发现史居里夫人在沥青油矿中分离出镭以后,法国科学家路易?德贝尔恩继续研究居里夫人研究剩下的残渣,结果他发现了锕。
待挖掘的宝藏与其他放射性元素不同的是,钍在地壳里的含量真的很高,甚至是锡的3倍有余。
虽然在多年以前,钍是一种不怎么受待见的元素,早在1960年的时候,美国橡树岭国家实验室就尝试完成钍循环的核能试验,但到了1976年由于经费问题而终止了这个试验计划。
随着现在对绿色能源的要求越来越高,科学家们终于打起了钍的主意――以钍为原料的核反应堆。
比如新能源汽车的开发项目中,近期可见的目标有电力汽车、混合动力汽车与氢燃料汽车,而在远期项目中则有以钍为燃料的核能汽车,预计添加一次燃料可以续航50万千米。
不过说起来,以前对钍的利用范围很少,仅仅是利用其化学性质干点粗活,而且很长一段时间内都没有意识到它的放射性有致癌风险。
元素八卦第二次世界大战激战正酣的时候,美国情报部发现德国一家名叫奥厄的军火承包商从巴黎运了大量的钍回德国。
第一节 元素周期表

(B)
2
10 11
18 19
(C)
6 11 12 13 24
(D)
6 14 31 32
7
元素周期表
(第二课时)
1、
碱金属元素
锂(Li) 钠(Na) 钾(K) 铷(Rb) 铯(Cs) 钫(Fr) 碱金属的原子结构
放射性元素
碱金属:
元素名称
核电荷 数
3 11 19 37 55
原子结 构示意 图
总结:
Li
碱金属的原子结构 Na K Rb Cs
1) 都易失电子表现强还 原性
1.相似性:
最外层上都只 有一个电子
化学性质相似
2) 化合物中均为+1价
核对最 核电荷数 外层电 2.递变性: 原子半径 子的引 电子层数 力 (电子层数的影响大于核电荷数的影响)
失电 子能 力
还原 性
金 属 性
碱金属的化学性质
规律:
同一主族中,随原子核外电子层数增加, 得电子能力逐渐减弱失电子能力逐渐增强, 非金属性逐渐减弱,金属性逐渐增强。
元素的金属性和非金属性强弱的判断依据
元素单质与酸反应的难易 (易~强)
元素
金属性
元素单质与水反应的难易
(易~强)
元素最高价氧化物的水化物(氢氧化物)
的碱性强弱
(强~强)
元素最高价氧化物的水化物 (含氧酸) 元素 非金属性
3锂 Na
3
11钠 K
4
族:具有相同的最外层电子数的列
19钾
IIIB Sc 21 钪
IVB Ti 22钛
VB V 23钒
VIB Cr 24铬
VIIB Mn 25锰 Fe 26铁
元素周期表(33张)

6、若把元素周期表原先的主副族及族号取消,由左至右改为18列
。如碱金属元素为第1列,稀有气体元素为第18列。按此规定,下
列说法错误的是( A D )
第18列中的氦
×A.只有第2列元素的原子最外层有2个电子第14列中的碳元素形 成的化合物种类最多
B.第14列元素形成的化合物种数最多
√√C.第3列元素种类最多
第3列中的第六、七周期 中包含镧系、锕系元素
×D.第16、17列元素都是非金属元素
第17列中最后一种元素可能为金属
三短三长一不全 镧系锕系挤一格
7A 7 B和 0族 3个纵行第VIII族
周期序数=电子层数 主族序数=最外层电子数
2He
1.各周期元素种数=
10Ne
本周期0族元素与上周期0族元素原子序数差
ⅢAⅣAⅤAⅥA ⅦA 0
ⅢBⅣBⅤBⅥBⅦB Ⅷ ⅠB ⅡB
2He 10Ne 18Ar 36kr 54Xe 86R
n
118
22种
3.周期表元素分区 右上角为非金属元素集中区 左下角为金属元素集中区 主族序数小于周期序数的为非金属 H在左上角
1.请在下面的虚线框中用实线画出元素周期表第一至第六周 期的轮廓,并画出金属与非金属的分界线和第Ⅷ族的轮廓。
。这4个原子生成数微秒后衰变成第11第3号七元周素期。Ⅴ下A列有金属
关叙述正确的是( B )
第七周期 ⅢA 金属
×A.115号元素在第六周期 115=118-3 √B.113号元素在第七周期ⅢA族113=118-5
×C.115号和113号元素都是非金属元素 ×D.镅元素和115号元素不在同一周期
■ 根据0族元素确定元素在周期表中的位置
118 – 115 = 3 即在第7周期第ⅤA族
《元素周期表》课件ppt课件

观察,可得 A是氮元素
B是 氧元素
C是
二、元素的性质与原子结构
1.碱金属元素
元素 元素 名称 符号
核电 荷数
最外层电子 电子
数
层数
原子结构
相同点
递变性
锂
碱
金 属
钠
元
素钾
铷
Li
3
Na
11
K
19
Rb
37
1
2
最
1
3
1
外 层 都 有
核电 原 电子 子 荷层 半 数数 径
1
4
个
逐逐 逐
电
渐渐 渐
子
增增 增
1
原子 序数
6
13 34 53 88
周期 2 3 4 5 7
族 IVA IIIA VIA VIIA IIA
课 堂 练
4.下列各表为周期表的一部分(表中为 原子序数),其中正确的是(D )
习 (A)
(B)
234
2
11
10 11
19
(C) 6
18 19
(D) 67
11 12 13
14
24
31 32
课 堂 5、元素X的原子获得3个电子或元素Y的原 练 子失去2个电子后,它们的电子层结构与 习 氖原子的电子层结构相同。X、Y两种元
H、Be 、 Al
。
族序数等于周期序数2倍的元素
有: C S
。
周期序数=族序数2倍的有: Li、Ca
。
课 堂 7. A、B、C是周期表中相邻的三种元素, 练 其中A、B是同周期,B、C是同主族。此三 习 种元素原子最外层电子数之和为17,质子数
1.1.1元素周期表
族
纵行
共七个主族 副族: Ⅰ B , Ⅱ B , Ⅲ B , Ⅳ B ,Ⅴ B , Ⅵ B , Ⅶ B 共七个副族 0族: 稀有气体元素 三个纵行(8、9、10),位于Ⅶ B 第Ⅷ族:
与ⅠB中间
七主七副零八族
族的别称
2、哪周期元素种类最多?族呢?
注 意
周 —— 2 种 第 1周期 总结: 期 短周期 第 2周期 —— 8 种 表 —— 8 种 里 第 3周期 —— 18 种 数 第 4周期 周期 周 —— 18 种 第 5周期 (7个) 期 长周期 —— 32 种 第 6周期 , 第 7周期 —— 32 种 1 2 共 7 个主族,包括短周期和长周期元素 主族 3 共 7 个副族,只包括在长周期中 4 副族 族 5 第VIII族 包括第8、9、10 纵行 6 (16个) 0族 稀有气体元素 7
卤素的用途
卤素在工业生产、大众生活领域和科学 研究中有着广泛的用途
SF6是很稳定的气体,在高温下也不分解, 氟 :
因此可作为理想的气体绝缘材料。大量的氟气用 于制取氟的有机化合物,如氟利昂-12(CCl2F2)用 于制冷剂,CCl3可用作杀虫剂,CBr2F2可用作灭火 剂。液态氟也是火箭、导弹和发射人造卫星方面 所用的高效燃料。
难易程度。置换出氢越容易,则金属性越强。
2、根据金属元素最高价氧化物对应水化物碱性 强弱。碱性越强,则原金属元素的金属性越强。 3、可以根据对应阳离子氧化性强弱判断。金属 阳离子氧化性越弱,则单质金属性越强。
卤族元素
小资 料
氟的发现是一篇悲壮的历史
氟是卤族中的第一个元素,但发现得最晚。从1771年瑞典化 学家舍勒制得氢氟酸到1886年法国化学家莫瓦桑分离出单质氟经 历了100多年时间。 在此期间,戴维、盖· 吕萨克、诺克斯兄弟等 很多人为制取单质氟而中毒,鲁耶特、尼克雷因中毒太深而献出 了自己的生命。
第一节元素周期表

归纳:碱金属的主要物理性质
相似性: 1) 银白色有金属光泽(铯略带金色) 2) 较柔软,有延展性 3) 密度小 4) 熔点低(均小于200℃) 5) 导电、导热
递变性: 随着核电荷数的增加:
• 密度增大 (但K 反常) • 熔、沸点逐渐降低
2、卤族元素
(1)物理性质
物理性质
随原子序数的递增: 1.颜 色: 颜色逐渐加深 2.状 态: 气态~液态~固态 3.熔沸点: 逐渐升高 4.密 度: 逐渐增大
(2)原子结构
(3)化学性质
①卤素单质与氢气反应
卤素单质与氢气反应 剧烈程度:F2>Cl2>Br2>I2 生成氢化物稳定性:
HF>HCl>HBr>HI
②卤素单质间的置换反应
颜色
溶于水
溶于CCl4
Cl2
黄绿色
黄绿色
黄绿色
Br2
深红棕色 橙黄色
橙红色
I2
紫黑色
褐色
紫红色
实验1—1
实验
现象
化学方程式
57
6 55 56 - 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86
71
7 87 88 89103
104
105
106
107
108
109
110
111
112
过渡元素
镧 系 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71
碳有两个电子层,位于第二周期,镁有三个电子层, 位于第三周期;溴有四个电子层,位于第四周期。
(2)族(16个) 七个主族 七个副族 一个第Ⅷ族(3个纵行) 一个0族
元素周期表

1. 通过观看视频,学生能说出门捷列夫对元素周期表的贡献; 2. 通过1-18号元素原子结构示意图的观察与分析,能说出元素周 期表的编排原则及周期、族的概念; 3. 通过阅读课本p5页第1、2自然段及观察元素周期表,能说出元素 周期表的结构,知道金属、非金属在周期表中的位置; 4. 通过[实战演练4],能利用原子结构确定元素在周期表中的位置。
3、元素的位置推导原子序数 ⑴同周期 周期 ⅡA n 2、 3 4、 5 6、 7 n n
ⅢA n+1
n+11 n+25
⑵同族:若A、B为同主族元素,A所在周期有m种元 素,B所在周期有n种元素,A在B的上一周期,设A 的原子序数为a。 ①若A、B为第IA族或第IIA族(位于过渡元素左边的 元素),则B的原子序数为(a+m)。 ②若A、B为第IIIA~第IIA族(位于过渡元素右边的 元素),则B的原子序数为(a+n)。
学习重难点
重点:元素周期表的结构、确定元素在周期表中的位置 难点:确定元素在周期表中的位置
1-18号元素原子结构示意图
现行元素周期表的编排原则
横行:
周期:将电子层数相同的元素,按原子序数递增的顺
序从左到右排成一横行。 纵行:
族:
把最外层电子数相同的元素,按电子层数递增 的顺序由上而下排成一纵行。
短周期
长周期
注 意
周期序数 = 原子核外电子层数
类别
周期 序数 1 2 3 4 5 6 7 核外电子 层数 1 2 3 4 5 6 7
起止元素
H—He Li—Ne Na—Ar K—Kr Rb—Xe Cs—Rn Fr— 118
元素种数
2 8 8 18 18 32 32
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、元素周期表
1、元素周期表的编排原则
按照元素在周期表中的顺序给元素编号,所得的序号,就叫原子序数。
原子序数 = 核电荷数 = 质子数 = 核外电子数 按_______________的顺序从_左到右 排列 ______
原子序数递增
2. 周期 具有相同的电子层数的元素按照原子序数递增的顺 序排列的一个横行称为一个周期
0族
2.元素周期表的结构
3个短周期 (1、2、3周期) 周期(7个) 元 7个横行 4个长周期 (4、5、6、7周期) 周期数= 各周期元素的种数分别是:2、8、 素 电子层数 8、18、18、32、32 周 主族 (7个) IA ~ VIIA 期 副族 (7个) IB ~ VIIB 表 族(16个) VIII族(1个) 8、9、10三个纵行 18个列 0族 (1个)最右边一个纵行( 主族序数=最 稀有气体元素) 外层电子数
【练习4】推算原子序数为34、53、88、 115的元素在周期表中的位置。
原子序 数 周期 族
34
53
88
115
4 VIA
5 VIIA
7 IIA
7 ⅤA
差值法:用原子序数减去比它小而相近的稀有气 体元素的原子序数,即得该元素所在的纵行数, 可求出族数,周期数为所减0族的周期数+1。
要求:熟记稀有气体元素的原子序数: 周期数: 1 2 3 4 5 6 7 元素种类: 2 8 8 18 18 32 32 0族元素的 2 10 18 36 54 86 118
注意:酸性HF<HCl<HBr<HI
④卤素单质与碱溶液的反应
通式 (F2除外)
2NaOH + X2 = NaX + NaXO + H2O 相应卤化物 次卤化物
⑤卤素单质之间的置换反应
2NaBr + Cl2 = 2NaCl + Br2 (溶液由无色变成橙 [实验]Cl2水和NaBr、KI的反应; 黄色) 溴水和KI的反应 2KI + Cl2 = 2KCl + I2 (溶液由无色变成棕黄色) 2KI + Br2 = 2KBr + I2 (溶液由无色变棕黄色)
碘的特殊性质:遇热升华
溴的特殊性质:常温唯一液态非金属
[思考]根据卤素的原子结构,试推测氟、 氯、溴、碘在化学性质上所表现的相似 性和递变性。 (3)卤素单质的化学性质 ①卤素单质与氢气反应
越 越 越 Cl2 + H2 = 2HCl 来 来 来 500℃ 越 越 越 Br2 + H2 = 2HBr 缓 苛 差 持久加热 慢 刻 I2 + H2 2HI 一定条件 通式: X2 + H2 = 2HX (空气中均为白雾)
周期序数=电子层数
3.族
元素周期表中共有18个纵行,第8、9、10三个纵行 为一个族,其余15个纵行,每个纵行为一族,共16个族。
族序数符号用罗马数字表示: Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ、Ⅶ、Ⅷ
主族序数=最外层电子数
• (练习)已知某主族元素的原子结构示意
图如下,判断其位于第几周期,第几族?
X位于第四周期、第一主族; Y位于第五周期、第七主族。
氟
氯
溴 碘
相似性: 有颜色,密度小,熔沸点都较低。 不易溶于水(F2除外),易溶于有机溶剂(如: C2H5OH CCl4 苯 汽油等) ,有毒性。 递变性: 颜色:逐渐加深 状态:气 液 固 密度:逐渐增大 熔沸点:依次增高
卤素在水和有机溶剂中的颜色
水 有机溶剂
Cl2 Br2 I2紫红
ⅢA~ ⅦA区域:下一周期元素的原 子序数=上一周期元素的原子序数+ 下一周期所含元素种类
[讨论] 3、若是三、四周期同主族元素的原子序
数差是多少?
(相差8或18 )
相差1、11、25
[讨论]4同周期ⅡA、ⅢA相邻元素的 原子序数相差多少?
[练习1]下列各表为周期表的一部分(表
中为原子序数),其中正确的是( D )
B)
C、 ⅠB族
D、ⅠA族
[练习3]已知A为ⅡA族元素, B 为ⅢA族
元素,它们的原子序数分别为 m 和 n ,
且A、B为同一周期元素。下列关系式错
误的是(
D
) B. n = m + 11
A. n = m + 1
C. n = m + 25
D. n = m + 1 0
规律:奇族奇序,偶族偶序。
[讨论]给出元素的原子序数,如何快速推算出元 素在周期表中的位置?
+3 2 1
元素 元素 原子结构示意图 最外层 电子 原子半 电子数 层数 径/nm 名称 符号 1 锂 Li 2 0.152
+11 2 8 1
碱 钠 Na 金 属 钾 K 元 銣 Rb 素 铯 Cs
1
1
18 8 1
3 0.186 4
0.227
+19
2 88 1
+37
2
8
1
1
5 0.248 6 0.265
678.4
略带金色光泽, 1.879 柔软
结论:
相似性:
①有金属光泽、固体,大多数呈银白色 (Cs略带金色光泽) ②质地柔软 ③热和电的良导体 ④密度小,熔沸点低
递变性:
降低 ①熔、沸点逐渐_______________ ②密度呈增大趋势(______例外) K
自然界的存在: 均以化合态存在 保存:
煤油或液 体石蜡 实验室中钾、钠常保存在_______中,
但是锂的密度小于煤油的密度,
石蜡油 所以锂应保存在________中。
(3)碱金属的化学性质 ①与非金属单质(如O2)反应 4Li + 2Na + K + O2 O2 O2
点燃
点燃 点燃
2Li2O Na2O2 KO2 (超氧化钾)
Rb、Cs与O2反应更剧烈,产物更复杂。
反映
反映
(2)卤素单质的物理性质
名 称
熔点 沸点 符 颜色和状态 密 度 (℃) 号 (℃) 1.69g/L -219.6 淡黄绿 F2 -188.1 (15℃) 色气体 3.214g/L 黄绿色 -101 Cl2 -34.6 (0℃) 气体 深红棕 58.78 3.119g/L -7.2 Br2 色液体 (20℃) 紫黑色 4.93g/L 113.5 184.4 I2 固体
过渡元素 镧系和锕系 元素
( IVA族 ) ; (ⅢB族)
[讨论]1、在元素周期表中,所能形成化合物种类 最多的元素族是哪一族?所含元素最多的元素族
又是哪一族?
2、8、18、32
[讨论]2、在元素周期表中,同主族相邻元素的原
子序数之间相差多少?
ⅠA,ⅡA区域:下一周期元素的原子 序数=上一周期元素的原子序数+上 一周期所含元素种类
+55
2
8
18
18
8
1
(1)碱金属元素原子结构特点:
相似性:最外层电子数均为1,均易失去电 子,具有强还原性 递变规律:随着核电荷数的递增,电子层数逐 渐增多,原子半径逐渐增大,失电子能力逐渐 增强,元素金属性逐渐增强,还原性逐渐增 强。 结构 决定 性质 决定 变化 反映 反映 [结论]碱金属元素原子结构的相似性和递变性决 定了其元素性质的相似性和递变性。
(2)碱金属的主要物理性质
碱金属 颜色和状态 密度 熔点 (g﹒cm-3) ℃ 单质 Li 银白色,柔软 0.534 180.5 沸点
℃ 1347 882.9 774
Na 银白色,柔软
K
银白色,柔软
0.97 0.86
97.81 63.65
Rb 银白色,柔软 Cs
1.532
38.89
28.40
688
★卤族元素除了单质的性质具有相似性和递变性 外,其化合物的性质也具有相似性和递变性。
AgF
水溶性 可溶 稳定性 稳定
AgCl
AgBr
AgI
黄色固体
色、态 白色固体 白色固体 淡黄色固体
难溶 难溶 溶解度逐渐减小
见光分解 见光分解
难溶
见光分解
稳定性减弱 [小结]元素性质与原子结构有密切的关系, 用途 感光材料 人工降雨 结构决定性质。原子结构相似的一族元素, 光照 它们的单质和化合物在化学性质上表现出 2AgX = 2Ag + X2 相似性和递变性。
F2 + H2 = 2HF
点燃或光照
冷暗处
反应 生成物的 反应 程度 条件 稳定性
非金属活动性(氧化性)F2 >Cl2 > Br2 > I2
②卤素单质与金属的反应 △ 3 X2 + 2Fe = 2FeX3(X为F、Cl、Br) △ I2 + Fe = FeI2 (I2的氧化性较弱) ③卤素单质与水的反应 2F2 + 2H2O = 4HF + O2 (剧烈反应) Cl2 + H2O HCl + HClO 逐 渐 Br2 + H2O HBr + HBrO 困 难 I2 + H2O HI + HIO
[结论] 碱金属与水反应,从上到下逐渐 剧烈。 碱金属元素最高价氧化物的水化物的碱性: LiOH <NaOH <KOH < RbOH < CsOH
③与酸反应 通式: 2M + 2H+ = 2M+ +H2↑ 在溶液中有酸先与酸反应, 无酸与水反应 ④与某些盐溶液的反应 类似钠与盐溶液的反应,碱金属先与水 反应,因此不能置换出不活泼金属.
氧化性 由上述反应可比较卤素单质______的强弱。
氧化性: F2 > Cl2 > Br2 >I2 还原性:I->Br->Cl- ★从F → I ,元素的非金属性逐渐减弱。
