化学平衡状态的判断秒杀绝招
化学平衡状态的判断方法与易错点精析

12:化学平衡状态的判断方法与易错点精析(总5页)-CAL-FENGHAI.-(YICAI)-Company One1-CAL-本页仅作为文档封面,使用请直接删除化学平衡状态的判断方法与易错点精析一、化学平衡状态的判断方法1、抓住可逆反应平衡状态的本质:对达到平衡状态的某一反应体系中的某一物质而言,其参加反应的速率与其生成的速率相等,即v正=v逆,其最直接的表现是该物质在体系中的组分不发生变化。
2、外显的条件都可以根据本质进行分析和判断。
3、技巧:“变量”不变时可以判断反应达到平衡状态,不变量不变不能作为判断依据。
【例】将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)2NH 3(g ) +CO 2(g)。
判断该分解反应已经达到化学平衡的是()A. 2υ(NH3)=υ(CO2)B.密闭容器中总压强不变C.密闭容器中混合气体的密度不变D.密闭容器中氨气的体积分数不变【答案】BC【分析】A选项:平衡前后各物质反应速率的比值是一个定值,为不变量,且题中给出的比例关系不正确,应为υ(NH3)=2υ(CO2),不能作为该反应是否达到平衡的依据;B选项:题中反应未达平衡时体系的压强是一个变化量,达到平衡时,气体的量不再发生变化,压强不再发生变化,变量达到不变,可以作为该反应是否达到平衡的判据;=m(气体)C选项:密闭容器中气体密度的计算公式为r V(容器),达到平衡前气体的质量是变量,容器体积不变,因此混合气体的密度是一个变量,变量达到不变,可以作为平衡判据;D 选项:题中体系的初识状态是没有气体,从反应开始发生到平衡状态NH3和CO2的体积比值恒定不变,因此容器中氨气的体积分数是一个不变量,不能作为平衡的判据。
故选BC。
Tip:有时候整理归纳那么多,不如把握本质,掌握方法来得有效,要的就是以不变应万变!二、化学平衡状态问题易错点1、两种提问方式的混淆①判断某一可逆反应达到平衡的依据;②某一可逆反应达到平衡时具有的特征。
化学平衡状态的判断

化学平衡状态的判断化学平衡是指在反应物和生成物之间达到一种稳定状态的状态。
当反应物和生成物之间的速率相同时,化学反应即处于平衡状态。
虽然不是所有反应都可以达到平衡状态,但在某些情况下,平衡状态可以很容易地达到。
由于化学反应是一个动态的过程,因此能够达到平衡状态的反应是受一些条件限制的。
化学反应平衡的状态可以通过一些特定的判断条件来确定。
在本文中,我们将讨论这些判断条件。
1.浓度比根据浓度比的判断方法,当反应物和生成物的浓度比达到一定数值时,反应即达到平衡。
浓度比的计算方法为,将反应物的浓度除以生成物的浓度。
当浓度比接近常数值时,反应即可认为达到平衡。
2.平衡常数平衡常数是反应物和生成物之间达到平衡状态的量化指标。
在化学平衡状态下,平衡常数等于反应物和生成物的浓度比的乘积的比值。
如果一个反应物的浓度比和平衡常数相等,那么该反应物达到了平衡状态。
在某些情况下,仅需要测量反应物或生成物的浓度,就可以计算出平衡常数。
通过这样的计算,就可以判断化学反应是否达到平衡状态。
3.温度变化温度变化可以影响反应物和生成物的浓度比,从而影响化学反应的平衡状态。
当温度上升时,反应速率会增加,而当温度下降时,反应速率会减慢。
因此,温度的变化可以改变化学反应的平衡状态。
一些反应可以通过调整温度来实现平衡状态。
当反应物和生成物在低温下达到平衡时,增加温度可以使反应物的浓度比变得更大,从而改变反应物和生成物的浓度比,从而改变反应的方向。
相反,当反应物和生成物在高温下达到平衡时,减少温度可以使生成物的浓度比变得更大,同样可以改变反应的方向。
4.化学计量关系化学计量关系是指反应物和生成物之间的摩尔比。
当反应物的摩尔比与生成物的摩尔比相等时,反应即达到平衡状态。
在某些情况下,可以通过反应物和生成物的摩尔比来计算出反应的平衡常数。
5.化学势化学势是一种度量化学反应状态的指标。
当反应物和生成物的化学势相等时,化学反应即处于平衡状态。
化学势可以通过反应物和生成物的浓度、温度和其他因素计算得出。
高一化学——快速突破化学平衡及其判定!

高一化学——快速突破化学平衡及其判定!化学平衡及其判定1.可逆反应2.化学平衡3.化学平衡的判定4.课后作业page1可逆反应【例1】在一定量的密闭容器中进行反应:N2(g) +3H2(g) ⇋ 2NH3(g)。
已知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1mol/L,0.3mol/L,0.2mol/L。
当反应达到平衡时,可能存在的数据是( )A.N2为0.2mol/L,H2为0.6mol/LB.N2为0.15mol/LC.N2、H2均为0.18mol/LD.NH3为0.4mol/Lpage2化学平衡定义:在一定条件下的某可逆反应中,当正反应速率和逆反应速率相等,反应物与生成物的浓度不再改变,达到了一种表面静止的状态,化学上称之为“化学平衡状态”,简称化学平衡。
注意:化学平衡状态是可逆反应达到的一种特殊状态,是在给定条件下可逆反应所能达到的最大程度,即该化学反应进行的限度。
page3化学平衡的判定化学平衡的判定:1. 直接方法:速率角度2. 间接方法:n、P、M、ρ3. 其他温度、颜色、单一物质的质量(体积)和质量分数(体积分数)1、直接判定: V正=V逆(化学平衡状态的本质)(1)同一物质:该物质的生成速率等于它的消耗速率。
(2)不同的物质:不同物质的生成速率和消耗速率之比等于化学方程式的计量数之比。
即一种物质表示V正,另一物质表示V逆,且数值之比等于计量数之比。
2、间接方法:n(气体)、p看方程式中的气体的系数m(气体)看的是方程式中是否出现非气态(s、l),若有则是变量。
判断n跟m是否是变量:三、其他(达到平衡)1. 单一物质的“量”或百分数(浓度、物质的量、质量、气体体积)2、体系温度3、气体颜色【例4】在一恒容密闭容器中,发生反应:H2(g)+I2(g) 2HI(g),证明该反应已达到平衡状态的是:(①③⑨)①HI的体积分数不再改变②HI的浓度是I2浓度的2倍。
③ H2的浓度不再改变④ 气体的总物质的量不再改变⑤混合气体的总质量不再改变⑥混合气体的密度不再改变⑦反应体系的总压强⑧混合气体的平均摩尔质量不再改变⑨ 混合物的颜色不再改变⑩混合气体中各组分的浓度都相等【例5】在一恒容密闭容器中,发生反应:2SO2+O2 2SO3 ,下列说法能够证明上述反应已达平衡状态的是(①③④⑦⑧⑨⑩)①各物质的物质的量浓度不再改变②SO2 、O2、SO3的浓度之比为2:1:2③ SO2的转化率不再改变④ SO3的体积分数不再改变⑤混合物的总质量不再改变⑥混合气体的密度不再改变⑦混合物的颜色不再改变⑧混合物的平均摩尔质量不再改变⑨绝热容器中反应体系的温度不再改变⑩恒温容器中混合气体的压强一定小试牛刀。
化学平衡状态的判断

化学平衡状态的判断
化学反应可以描述为一系列物质互相作用后得到新物质,当化学反应达到最终状态
(也就是物质的成分和量不再发生变化),我们就说该反应达到化学平衡状态。
化学平衡
状态的判断以及反应晶体的制备和理解,是化学教学、和科学研究中的重要内容,并且有
着重要的理论意义。
平衡状态的判断一般需要满足以下几个条件:
1、反应系统是否已经处于动力学稳定状态
化学反应和物理反应有明显的不同,化学反应物之间有一定的物质组成态。
此时,当
反应物之间处于动力学稳定状态时,就可以说反应达到平衡状态。
热力学稳定状态平衡可以通过计算平衡常数K来证明,其中k等于反应产物物质浓度
的乘积,除以反应物物质浓度的乘积。
当反应物和产物的浓度一定时,可以剪接计算K 值,K的计算公式为 K=CF/CA
3、反应是否处在化学动力学理论反应
可以通过分析反应各步骤的反应速率,最终分析反应中物质的变化情况,确定反应的
平衡状态。
从物质的变化情况可以得出反应的发展方向,当反应的发展方向不变,即可以
判定是否处于化学平衡状态。
综上所述,我们可以通过以上3点来判断一个反应是否处于化学平衡状态。
若需要制
备和研究化学反应的晶体,首先要满足平衡条件;其次,必须使反应晶体的热力学稳定性
得到维持;最后,要保证反应能够按照化学动力学理论正确发展。
只有这三个步骤都达成,反应才能够达到化学平衡状态。
化学平衡状态的判断方法

化学平衡状态的判断方法直接判断法1、若反应混合物中各组成成分的物质的量、质量,物质的量浓度或各成分的百分含量(体积分数、质量分数),转化率,等不随时间变化而变化。
2、若V正=V逆(1)用同一种物质来表示反应速率时,该物质的生成速率与消耗速率相等。
即单位时间内生成与消耗某反应物(或生成物)的量相等,或单位时间内化学键断裂量等于化学键的形成量。
(2)用不同种物质来表示反应速率时速率不一定相等但必须符合两方面(i)表示两个不同的方向。
(ii)速率之比==化学方程式中相应的化学计量数之比。
间接判断法m总3、从反应混合气体的平均相对分子质量M考虑Mn总(I)若各物质均为气体对于非等化学计量数的反应,M一定时可做为达到平衡标志。
如:2SO2(g)+O2(g) 2SO3(g)对于等化学计量数反应,M一定时不能做为平衡标志。
如:H2(g)+I2(g) 2HI(g)(II)若有非气体参与,无论等计量数或非等计量数反应,M一定时可做为达到平衡标志。
如:C(s)+O2(g) CO2(g)、CO2(g)+C(s) 2CO(g)m4、从气体密度考虑v(I)当反应前后各成分均为气体时恒容:ρ不变时,不能做为达到平衡的标志。
恒压:等计量数的反应,ρ不变时,不能作为达到平衡的标志。
非等计量数的反应,ρ不变时,可做为达到平衡的标志。
(II)当有非气体物质参与时恒容:ρ不变时,可作为达到平衡的标志。
恒压:ρ不变时,可作为达到平衡的标志。
5、从体系内部压强考虑:因为在恒温、恒容条件下,气体的物质的量越大则压强p就越大,所以只需考虑气体物质的量的变化量Δn(g)。
当Δn(g)=0,即等计量数的反应则p为恒值,不能作平衡标志。
当Δn(g)≠0,即非等计量数的反应则当p一定时,可做平衡标志。
6、反应体系中有颜色的物质,若体系颜色不变,则达到平衡。
注意:对于反应前后气体体积不变的反应(即反应前后化学计量数相等的反应),通常不能用物质的量、容器的压强、气体的密度、平均相对分子质量等是否变化作为判断平衡状态的标志。
化学平衡状态的判断方法与易错点精析

化学平衡状态的判断方法与易错点精析一、化学平衡状态的判断方法1、抓住可逆反应平衡状态的本质:对达到平衡状态的某一反应体系中的某一物质而言,其参加反应的速率与其生成的速率相等,即v正=v逆,其最直接的表现是该物质在体系中的组分不发生变化。
2、外显的条件都可以根据本质进行分析和判断。
3、技巧:“变量”不变时可以判断反应达到平衡状态,不变量不变不能作为判断依据。
【例】将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4s2NH 3 g +CO 2 g 。
判断该分解反应已经达到化学平衡的是()A. 2(NH3)(CO2)B.密闭容器中总压强不变C.密闭容器中混合气体的密度不变D.密闭容器中氨气的体积分数不变【答案】BC【分析】A 选项:平衡前后各物质反应速率的比值是一个定值,为不变量,且题中给出的比例关系不正确,应为(NH3)2(CO2),不能作为该反应是否达到平衡的依据;B选项:题中反应未达平衡时体系的压强是一个变化量,达到平衡时,气体的量不再发生变化,压强不再发生变化,变量达到不变,可以作为该反应是否达到平衡的判据;=m(气体)C选项:密闭容器中气体密度的计算公式为r V(容器),达到平衡前气体的质量是变量,容器体积不变,因此混合气体的密度是一个变量,变量达到不变,可以作为平衡判据;D 选项:题中体系的初识状态是没有气体,从反应开始发生到平衡状态NH3和CO2的体积比值恒定不变,因此容器中氨气的体积分数是一个不变量,不能作为平衡的判据。
故选 BC。
Tip:有时候整理归纳那么多,不如把握本质,掌握方法来得有效,要的就是以不变应万变!二、化学平衡状态问题易错点1、两种提问方式的混淆①判断某一可逆反应达到平衡的依据;②某一可逆反应达到平衡时具有的特征。
微信公众号:上海试卷平时做练习时遇到①的情况比较多,会习惯用①的思路思考第②类问题。
【例】自然界的矿物、岩石的成因和变化受到许多条件的影响。
化学平衡状态判断口诀

化学平衡状态判断口诀化学平衡是化学中非常重要的一个概念,在学习化学的过程中我们必须要掌握如何判断一个化学反应是否处于平衡状态。
为了更好地帮助大家掌握这个技巧,今天我为大家介绍一下化学平衡状态判断口诀。
首先,我们需要明确一个概念,那就是平衡常数。
平衡常数是一个比例系数,与一种化学反应的反应物和生成物的浓度有关。
平衡常数越大,说明反应越向生成物的方向进行;平衡常数越小,说明反应越趋于反应物的方向进行。
当平衡常数等于1时,反应混合物中反应物和生成物的摩尔各半,反应混合物处于平衡状态。
然后,我们可以根据下面的口诀来判断化学反应是否处于平衡状态:1. 见高温、见高压,放弃治疗这句话告诉我们,当反应物处于高温、高压环境下时,往往会促进反应的进行,而离开平衡状态。
因此,在这种情况下,我们就无法判断化学反应是否处于平衡状态。
2. 见液体常数,认定稳又保险液体常数是指液体之间的平衡常数。
当涉及到两种液体反应时,我们可以通过液体常数来判断反应是否处于平衡状态。
液体常数稳定,则说明反应处于平衡状态;反之亦然。
3. 较弱会反,较强热吸这句话告诉我们,如果反应物之间的化学键较弱,则往往会发生反应;而当反应物之间的化学键较强时,反应则会吸收热量,进而达到平衡状态。
4. 浓稠常守,稀漏常逃这句话告诉我们,反应物的浓度是判断化学反应是否处于平衡状态的关键。
当反应物浓度较稠时,反应往往会达到平衡状态;而当反应物浓度较稀时,则会逃离平衡状态。
5. 见气体总压,算起反应稳妥气体总压是指反应混合物中气体的压强。
通过观察气体的压强,我们可以判断反应在所处的压强下是否处于平衡状态。
如果气体总压稳定,则说明反应处于平衡状态;反之则相反。
以上就是化学平衡状态判断口诀的全部内容。
通过这些口诀,我们可以更好地掌握化学平衡状态的判断方法,为后续的化学学习打下坚实的基础。
化学平衡状态的特征与及判断

化学平衡状态的特征与及判断化学平衡是指反应物转化为产物的速度与产物转化为反应物的速度相等的状态。
在化学平衡状态下,反应物和产物的浓度或分压不再发生明显的变化,系统处于稳定的状态。
1.反应物与产物浓度或分压不再改变:在平衡状态下,反应物转化为产物的速率与产物转化为反应物速率相等。
虽然反应仍然发生,但是反应物与产物的浓度或分压不再发生明显的变化。
这种平衡状态可以通过化学方程式的两边的物质的系数比来表达。
2.反应物与产物浓度或分压之间存在定量关系:根据化学平衡常数(K)的定义,平衡时反应物与产物的浓度或分压之间存在确定的定量关系。
在平衡状态下,反应物和产物浓度或分压的比值等于化学平衡常数,这可以用平衡常数表达式表示。
3.系统处于动态平衡:化学平衡是一个动态过程,反应物分子和产物分子之间仍然发生着碰撞和反应。
在平衡状态下,虽然反应物和产物的浓度或分压保持不变,但是由于分子之间的碰撞,反应和反应的逆反应仍然在继续进行。
4.反应速度的速度常数相等:在平衡状态下,反应物转化为产物的速率与产物转化为反应物的速率相等。
这意味着在达到平衡状态后,反应速率不再改变,且其速度常数相等。
5.平衡可以通过改变温度、压力和浓度等条件来调整:平衡可以通过改变反应条件来调整,例如改变温度、压力和浓度等条件。
这些条件的改变会导致平衡位置的移动,从而使反应向有利于生成产物的方向推进。
判断化学平衡状态的方法:1.反应物与产物浓度或分压不再发生明显的变化:判断化学平衡状态最直接的方法是观察反应物和产物的浓度或分压是否稳定,是否不再发生明显的变化。
如果反应物和产物的浓度或分压在一段时间内保持不变,那么可以判断系统已经达到化学平衡。
2.反应速率相等:在反应达到平衡之前,反应物和产物的浓度或分压会发生变化,但是一旦达到平衡状态,反应物转化为产物的速率与产物转化为反应物的速率相等,反应速率不再发生变化。
通过连续测定反应速率并观察是否变化可以判断系统是否达到平衡。
怎么判断是否达到化学平衡状态

解答化学平衡和速率的方法在遇到关于化学平衡和速率问题时,首先分析清楚习题的疑问是关于化学反应速率的,还是关于化学平衡的。
如果是有关反应速率的问题,始终把握如下几点理论1、温度升高时,反应速率增大,在此时对于可逆反应来说,正反应速率和逆反应速率都增大,而且正反应速率和逆反应速率增大的幅度一定不同,正向为放热反应,则逆反应速率增大幅度大一些。
2、增大反应物的浓度,增反应速率增大,在刚加入反应物的那一时刻,逆反应速率和加入前相同,过了那一个时刻,逆反应速率也增大;另外若所加物质为固体或纯液体时,正逆反应速率都不变。
除此外,增大一种反应物的浓度,其自身的转化率降低,其它反应物的转化率都增大。
3、增大压强时,若不能使反应物和生成物浓度发生改变,则正逆反应速率都不变,如向体系内加入惰性气体时,容器体积不变的情况。
4、增大压强时,若能使反应物和生成物浓度发生改变,反应速率增大。
在此时对于可逆反应来说,正反应速率和逆反应速率都增大,正反应速率和逆反应速率增大的幅度可能相同也可能不同,反应物中气体的计量数大于生成物中气体的计量数时,则正反应速率增大幅度大一些。
5、催化剂对可逆反应来说,正反应速率和逆反应速率都增大,正反应速率和逆反应速率增大的幅度一定相同。
如果是化学平衡类的问题,首先注意体系为恒容容器还是恒压容器,然后要分析清楚是化学平衡中的哪一类型的问题,不同的类型要用不同的解题方法分析,在化学平衡类的习题中包含的类型主要有如下五种:1、判断某状态时是否为平衡状态,这类问题主要会从以下几个方面提出,每个方面都要把握其原理和本质。
(1)、所有物质的浓度或物质的量都保持不变时,达到了平衡状态。
(2)、正逆反应速率相等时,达到平衡状态。
但是这种问题中一定要注意,必须是同一种物质的生成速率等于其消耗速率,或同一种物质的化学键断裂速率等于其化学键的生成速率。
若选项中指的不是同一种物质,要根据不同物质的反应速率之比等于它们的计量数之比进行转化。
化学平衡的判断
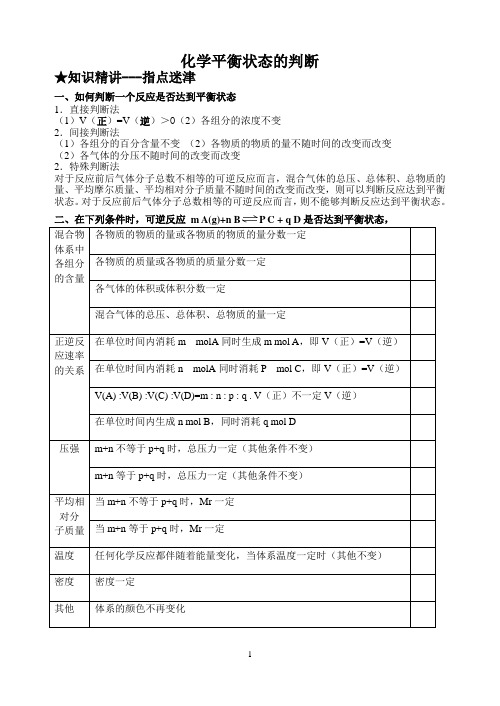
化学平衡状态的判断★知识精讲---指点迷津一、如何判断一个反应是否达到平衡状态1.直接判断法(1)V(正)=V(逆)>O(2)各组分的浓度不变2.间接判断法(1)各组分的百分含量不变(2)各物质的物质的量不随时间的改变而改变(2)各气体的分压不随时间的改变而改变2.特殊判断法对于反应前后气体分子总数不相等的可逆反应而言,混合气体的总压、总体积、总物质的量、平均摩尔质量、平均相对分子质量不随时间的改变而改变,则可以判断反应达到平衡状态。
对于反应前后气体分子总数相等的可逆反应而言,则不能够判断反应达到平衡状态。
混合物体系中各组分的含量各物质的物质的量或各物质的物质的量分数一定各物质的质量或各物质的质量分数一定各气体的体积或体积分数一定混合气体的总压、总体积、总物质的量一定正逆反应速率的关系在单位时间内消耗m molA同时生成m mol A,即V(正)=V(逆)在单位时间内消耗n molA同时消耗P mol C,即V(正)=V(逆)V(A) :V(B) :V(C) :V(D)=m : n : p : q . V(正)不一定V(逆)在单位时间内生成n mol B,同时消耗q mol D压强m+n不等于p+q时,总压力一定(其他条件不变)m+n等于p+q时,总压力一定(其他条件不变)平均相对分子质量当m+n不等于p+q时,Mr一定当m+n等于p+q时,Mr一定温度任何化学反应都伴随着能量变化,当体系温度一定时(其他不变)密度密度一定其他体系的颜色不再变化★典型例题例1、在一定条件下,可逆反应2A B+3C在下列4种状态中,处于平衡状态的是()A.正反应速度v(A)=2mol/(L·min)逆反应速度v(B)=2 mol/(L·min)B.正反应速度v(A)=2mol/(L·min)逆反应速度V(c)=2 mol/(L·min)C.正反应速度v(A)=1mol/(L·min)逆反应速度v(B)=1.5 mol/(L·min)D.正反应速度v(A)1mol/(L·min)逆反应速度v(C)=1.5mol/(L·min)例2、可逆反应2HI H2+I2(g);达到平衡的标志是()A. 混合气体密度恒定不变B. 混合气体颜色不再变化C. HI、H2、I2(g)浓度相等D.I2在混合气体中的体积分数不变例3、在一定温度下,反应:A2(气)+B2(气)2AB(气)已达平衡的标志是()A.在单位时间内生成n molA同时生成n mol ABB.容器内的总压不随时间的改变而改变C.在单位时间内生成2n molAB同时生成n mol B2D.在单位时间内生成n molA2同时生成n mol B2例4、在一定温度下的定容密闭容器中,当下列物理量不再变化时,表明反应:A(固)+2B(气)C(气)+D(气)已达平衡的是()A.混合气体的压强B.混合气体的密度C.的物质的量浓度D.气体总物质的量例5、下列方法中可以说明N2+3H22NH3已达到平衡的是()A.一个N≡N键断裂的同时有三个H-H键形成B.一个N≡N键断裂的同时有三个H-H键断裂C.一个N≡N键断裂的同时有六个N-H键断裂D.一个N≡N键断裂的同时有六个N-H键形成★练习反馈1、下列方法中可以说明2HI(g)H2(g)+I2(g)已达到平衡的是()①单位时间内生成n mol H2的同时生成n mol HI②一个H-H键断裂的同时有两个H-I键断裂③百分组成ω(HI)=ω(I2)④反应速率υ(H2)=υ(I2)=1/2υ(HI)时⑤c(HI):c(H2):c(I2)=2:1:1时⑥温度和体积一定时,容器内压强不再变化⑦温度和体积一定时,某一生成物浓度不再变化⑧条件一定,混合气体的平均相对分子质量不再变化⑨温度和体积一定时,混合气体的颜色不再变化⑩温度和压强一定时,混合气体的密度不再变化A.②③⑤B.①④⑦C.②⑦⑨D.⑧⑨⑩。
专题——化学平衡状态的判断

1专题——化学平衡状态的判断一、考点分析 化学平衡是高考的热点,化学平衡状态的判断是化学平衡的考点之一,在历年的高考试题中屡有出现。
难度系数在0.50~0.55左右。
二、考查方向1、主要以选择题的形式考查。
2、主要从浓度、速率、压强、密度、颜色、温度、平均摩尔质量等角度考查。
三、解题指导思想1、细心审题,注意关键字词,留心陷阱。
2、运用公式并注意状态与系数。
四、判断方法(大部分资料都介绍以下方法)(一)、判断化学平衡状态的标志1、什么是化学平衡状态 : 化学平衡状态是指一定条件下的可逆反应里,正反应速率=逆反应速率,反应混合物中各组分的含量保持不变的状态。
2、平衡状态的判断方法 :直接判定: V 正=V 逆 >0①同一物质,该物质的生成速率等于它的消耗速率。
②不同的物质分两种情况:在方程式同一侧的不同物质,它们的生成速率与消耗速率之比(或消耗速率与生成速率之比,前后比较项必须相反)等于反应方程式中化学计量数之比;方程式不同侧的物质,它们的生成速率与生成速率之比(或消耗速率与消耗速率之比,前后比较项必须相同)等于反应方程式中化学计量数之比。
③从微观化学键的断裂与生成判断。
如N 2(g )+3H 2(g )== 2NH 3(g )化学键 N ≡N 3H-H 6 N-H同种物质,新键生成和旧键断裂数目相同同侧不同物质,生成与断裂(或断裂与生成)数目;不同侧物质,生成与生成(断裂与断裂)数目例1、N 2(g )+3H 2(g )== 2NH 3(g )的生成或消耗速度来表示下列各关系中能说明反应已达平衡状态的是( )A. 3V (N 2消耗)=V (H 2消耗)B. V (N 2生成)=V (N 2消耗)C. 2V (H 2消耗)=3V (NH 3消耗)D. 2V (N 2生成)=V (NH 3消耗)例2、可逆反应2NO 2(g)= 2NO(g) + O 2(g),在体积固定的密闭容器中,达到平衡状态的( )A 单位时间内生成n mol O 2的同时生成2n mol NO 2B 单位时间内生成n mol O 2的同时生成2n mol NOC 单位时间内生成n mol NO 2的同时消耗n mol NO 2D 用NO 2、NO 、O 2表示的反应速率的比为2 : 2 : 1的状态例3、4NH 3(g) + 5O 2(g)==4NO(g) + 6H 2O(g)( ) A 4v 正(O 2)=5v 逆(NO) B x mol NO 的同时消耗x mol NH3 C ,则正反应速率减小,逆反应速率增大 D 2v 正(NH 3)=3v 正(H 2O)例3、下列方法中可以说明N 2+3H 2 = 2NH 3已达到平衡的是( ) A N ≡N 键断裂的同时有三个H-H 键形成 B N ≡N 键断裂的同时有三个H-H 键断裂 C N ≡N 键断裂的同时有六个N-H 键断裂 D N ≡N 键断裂的同时有六个N-H 键形成间接判定①组成成分的质量、物质的量、分子数、体积(气体)、物质的量浓度保持不变。
快速准确判断化学平衡状态的方法

快速准确判断化学平衡状态的方法景全国赵明翠1.用“等”即v正=v逆①同一物质表示的v正= v逆②不同物质表示的v正︰v逆=它们的化学计量数之比。
例如:4NH3(g)+5O2(g)催化剂加热4NO(g)+6H2O(g)①单位时间内断开3molN-H,同时形成3molN-H,即v(NH3)正= v(NH3)逆②单位时间内断开3molN-H,同时断开3molO-H,即v(NH3)正︰v(H2O)逆=2︰3以上两种状态均为化学平衡状态。
小结:用“等”来判断是否为平衡状态时,第一看描述中有无v正和v逆,第二看是否满足速率与化学计量数成正比。
2.用“定”即各组分浓度不再改变。
①直接有关于某组分浓度不变的描述;②组分中存在有色气体,颜色不再改变;③对于固定容积,有非气体参加或生成时,密度不变;④对于反应前后气体总体积改变的反应,总压强不变;⑤对于全气体且反应前后气体总体积改变的反应,平均相对分子质量不变;⑥对于有非气体参加或生成且气体总体积不变的反应,平均相对分子质量不变;⑦体系温度不再改变;以上7种状况均为化学平衡状态(一定条件下)。
例如:③4NH3(g)+5O2(g)催化剂加热4NO(g)+6H2O(g),密度=m(总)/V,由质量守恒定律知,m(总)不变,V固定不变,密度就不会变,所以不管什么状态密度均不变。
C(s)+ H2O(g)△CO(g)+H2(g),密度不变,则为平衡状态。
④4NH3(g)+5O2(g)催化剂加热4NO(g)+6H2O(g),4+5=9,4+6=10,即反应前后气体总体积改变,总压强不变,为平衡状态;而H2(g)+I2(g)=2HI(g),1+1=2,即反应前后气体总体积不变,总压强不变,不能确定为平衡状态。
⑤4NH3(g)+5O2(g)催化剂加热4NO(g)+6H2O(g),4+5=9,4+6=10,即反应前后气体总物质的量改变,由质量守恒定律知,m(总)不变,气体平均相对分子质量= m(总)/n(总)改变。
高考化学热点《化学平衡状态的判断及平衡移动的影响因素》 Word版含解析

【热点思维】【热点释疑】1、如何判断一个状态达到平衡状态(1)本质标志v(正)=v(逆)≠0。
对于某一可逆反应来说,正反应消耗掉某反应物的速率等于逆反应生成该反应物的速率。
(2)等价标志①全是气体参加的体积可变反应,体系的压强不随时间而变化。
例如:N2+3H22NH3。
②体系中各组分的物质的量浓度或体积分数、物质的量分数保持不变。
③全是气体参加的体积可变反应,体系的平均相对分子质量不随时间变化。
例如:2SO2(g)+O2(g) 2SO3(g)。
④对同一物质而言,断裂化学键的物质的量与形成化学键的物质的量相等。
⑤对于有颜色物质参加或生成的可逆反应,体系的颜色不再随时间而变化,如2NO2(g) N2O4(g)。
⑥体系中某反应物的转化率或某生成物的产率达到最大值且不再随时间而变化。
2、如何判定平衡移动的方向?(1)应用平衡移动原理。
如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向着能够减弱这种改变的方向移动。
①原理中“减弱这种改变”的正确理解应当是升高温度时,平衡向吸热反应方向移动;增加反应物浓度,平衡向反应物浓度减小的方向移动;增大压强时,平衡向气体体积缩小的方向移动。
②化学平衡移动的根本原因是外界条件(如温度、压强、浓度等)的改变破坏了原平衡体系,使得正、逆反应速率不再相等。
当v(正)>v(逆)时,平衡向正反应方向移动。
当v(正)<v(逆)时,平衡向逆反应方向移动,移动的结果是v(正)=v(逆)。
若条件的改变不能引起正、逆反应速率的变化,或者正、逆反应速率的变化相同,则平衡不发生移动。
(2)运用浓度商Q 与平衡常数K 之间的关系Q c⎩⎪⎨⎪⎧<K 反应向正反应方向进行,v 正>v 逆=K 反应处于化学平衡状态,v 正=v 逆>K 反应向逆反应方向进行,v 正<v逆3、如何理解等效平衡?(1)等价转化思想。
化学平衡状态的建立与反应途径无关,即无论可逆反应是从正反应方向开始,还是从逆反应方向开始,或从中间状态开始,只要起始投入物质的物质的量相等,则可达到一样的平衡状态。
什么是化学平衡状态

什么是化学平衡状态目录化学平衡状态判断化学平衡状态的标志口诀判断化学平衡状态例子化学平衡状态在一定条件下,当一个可逆反应的正反应速率与逆反应速率相等时,反应物的浓度与生成物的浓度不再改变(混合物中各组分的百分含量不再改变),达到一种表面静止的状态,即"化学平衡状态".特点化学平衡状态具有逆,等,动,定,变、同六大特征。
逆:化学平衡研究的对象是可逆反应。
等:平衡时,正、逆反应速率相等,即v正=v逆。
动:平衡时,反应仍在进行,是动态平衡,反应进行到了最大限度。
定:达到平衡状态时,反应混合物中各组分的浓度保持不变,反应速率保持不变,反应物的转化率保持不变,各组分的含量保持不变。
变:化学平衡跟所有的动态平衡一样,是有条件的,暂时的,相对的,当条件发生变化时,平衡状态就会被破坏,由平衡变为不平衡,再在新的条件下建立新平衡,即化学平衡发生了移动。
同:一定条件下化学平衡状态的建立与反应的途径无关。
即无论是从正反应开始,还是从逆反应开始,或是从任一中间状态开始建立,只要外界条件相同,达到平衡时的效果都相同。
判据吉布斯自由:当ΔrGm=0时,反应达最大限度,处于平衡状态。
化学平衡的建立是以可逆反应为前提的。
可逆反应是指在同一条件下既能正向进行又能逆向进行的反应。
绝大多数化学反应都具有可逆性,都可在不同程度上达到平衡。
从动力学角度看:反应开始时,反应物浓度较大,产物浓度较小,所以正反应速率大于逆反应速率。
随着反应的进行,反应物浓度不断减小,产物浓度不断增大,所以正反应速率不断减小,逆反应速率不断增大。
当正、逆反应速率相等时,系统中各物质的浓度不再发生变化,反应达到了平衡。
化学平衡是动态平衡。
判断化学平衡状态的标志口诀一、等的标志:(平衡的本质)口诀:“同向”不可断, “异向”比例才可断正反应速率:V(反应物)消耗、V(生成物)生成逆反应速率:V(反应物)生成、V(生成物)消耗1、同一物质表示:V(反应物)消耗= V(反应物)生成或V(生成物)消耗= V(生成物)生成2、不同物质表示:一种物质表示的正反应速率与另一种物质表示的逆反应速率之比等于物质前的计量数之比。
【高中化学】高中化学反应平衡的判断_0

【高中化学】高中化学反应平衡的判断_0如何判断一个化学反应是否已达平衡,方法很多,本文总结如下,供大家参考。
一、根据化学平衡的概念:一定条件下的可逆反应,正反应和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
也就是说,化学平衡的基本符号是V(正)=V(逆):在一定条件下的可逆反应:物质的消耗速率等于物质的生成速率;这表明反应达到平衡。
因为反应速率之比等于方程式的系数比。
所以要描述一个可逆反应达平衡,必须一个描述正反应,一个描述逆反应,且描述的量之比等于方程式的系数比。
例1:反应n2+3h22nh3一般来说,以下不能解释反应达到平衡是()。
a.同一时间内消耗1moln二的同时生成3molh二b.同一时间内消耗1moln二的同时消耗2molnh三c.1mol氮氮三键断裂的同时,6mol氮氢键断裂d、每种物质的数量和浓度在一定时间内是相等的解:a中消耗1moln二描述的是正反应,生成3molh二描述的是逆反应。
(根据方程式生成3molh二的同时一定生成1moln二),所以a可以说明该反应达平衡。
1在B中消耗的摩尔数2它描述了一种阳性反应,消耗2molnh3描述了反向反应;(根据方程式消耗2molnh三的同时一定生成1moln二),所以b可以说明该反应达平衡在C中,1mol氮氢键断裂描述正反应,6mol氮氢键断裂描述逆反应;(根据方程式6mol氮氢键断裂的同时一定生成1mol氮氮三键),所以c可以说明该反应达平衡。
答案D二、根据其他条件判断(一)气体参与或形成的反应(1)平均摩尔质量m=M(总)/N(总)① 如果所有气体:a:在密闭容器中,如果不是等体积反应:例:n2(g) +3h2(g) 2nh3(g)其平均摩尔质量m反应肯定达到平衡。
(因为它都是气体,气体的总质量m保持不变;假设天平向左移动,气体的总物质增加;假设天平向右移动,气体的总物质减少,即天平移动,m(必须改变)b:在密闭容器中,如果是等体积反应:比如我2(g) +h2(g) 2hi(g)的平均摩尔质量m是确定的,这并不意味着反应达到平衡。
速率与平衡方面试题的解题方法与技巧

速率与平衡方面试题的解题方法与技巧金点子:在化学反应中物质的变化必经过三态,即起始态、变化态和最终态。
对于化学反应速率、化学平衡及其它化学反应方面的计算,如能根据反应方程式,对应地列出三态的变化,哪么便可使分析、解题变得一目了然。
此方面的试题的题型及方法与技巧主要有:1.化学平衡状态的判断化学反应是否达到平衡状态,关键是要看正反应速率和逆反应速率是否相等及反应混合物中各组分百分含量是否还随时间发生变化。
2.化学反应速率的计算与分析要充分利用速率之比等于化学方程式中的计量数之比。
3.化学平衡移动的分析影响因素主要有:浓度、压强、温度,其移动可通过勒沙特列原理进行分析。
化学平衡移动的实质是浓度、温度、压强等客观因素对正、逆反应速率变化产生不同的影响,使V 正≠V逆,原平衡状态发生移动。
4.等效平衡的分析主要有等温等容和等温等压两种情况。
5.速率与平衡的图象分析主要要抓住三点,即起点、拐点和终点。
经典题:例题 1 :在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是()A.反应的化学方程式为:B.t2时,正逆反应速率相等,达到平衡C.t3时,正反应速率大于逆反应速率D.t1时,N的浓度是M浓度的2倍方法:图象分析法。
捷径:从图中得到N为反应物,M为生成物。
从0→t2min,M增加2mol,N消耗4mol,且到达t3min,M、N的浓度保持不变,即反应为可逆反应,反应式为。
t2时反应物和生成物物质的量相等,此时不是正、逆反应速率相等。
当t3时正逆反应的速率相等。
t1时n(N)=6mol,n(M)=3mol,由于在同一容器中,所以c(N)=2c(M)。
因此此题正确答案为D。
总结:选项B最容易被误认为正确说法。
造成错判的原因有三:①没有看清纵坐标的物理量;②概念错误,认为物质的量相等时,化学反应速率就相等;③没有读懂图。
例题2 :体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O22SO3,并达到平衡。
判断一个化学反应是否平衡的方法

判断一个化学反应是否平衡的方法如何判断一个化学反应是否已达平衡,方法很多,本文总结如下,供大家参考。
一、根据化学平衡的概念:一定条件下的可逆反应,正反应和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
即:化学平衡的根本标志是V(正)=V(逆):一定条件下的可逆反应:某物质的消耗速率等于该物质的生成速率;说明该反应达平衡。
因为反应速率之比等于方程式的系数比。
所以要描述一个可逆反应达平衡,必须一个描述正反应,一个描述逆反应,且描述的量之比等于方程式的系数比。
例1:对反应N2+3H22NH3而言,以下不能说明反应达平衡的是( )。
A.同一时间内消耗1 mol N2的同时生成3 mol H2B.同一时间内消耗1 mol N2的同时消耗2 mol NH3C.1 mol氮氮三键断裂的同时,6 mol氮氢键断裂D.某时刻各物质的物质的量浓度相等解:A中消耗1 mol N2描述的是正反应,生成3 mol H2描述的是逆反应。
(根据方程式生成3 mol H2的同时一定生成1 mol N2),所以A可以说明该反应达平衡。
B中消耗1 mol N2描述的是正反应,消耗2 mol NH3描述的是逆反应;(根据方程式消耗2 mol NH3的同时一定生成1 mol N2),所以B可以说明该反应达平衡C中1 mol氮氮三键断裂描述的是正反应,6 mol氮氢键断裂描述的是逆反应;(根据方程式6 mol氮氢键断裂的同时一定生成1 mol氮氮三键),所以C可以说明该反应达平衡。
答案选D二、根据其他条件判断(一)有气体参加或生成的反应(1)平均摩尔质量M=m(总)/n(总)① 如果全为气体:A:在密闭容器中,如果不是等体积反应:例:如N2(g)+3H2(g)2NH3(g)其平均摩尔质量M一定,可以说明该反应达平衡。
(因为全是气体,所以气体的总质量m不变;假设平衡左移,气体总物质的量增大,假设平衡右移,气体总物质的量减小,即平衡移动,M一定改变)B:在密闭容器中,如果是等体积反应:例如I2(g)+H2(g)2HI(g)其平均摩尔质量M一定,不能说明该反应达平衡。
化学平衡移动判断口诀

化学平衡移动判断口诀
化学平衡移动判断口诀:J〉K,平衡向左移动;J〈K,平衡向右移动;J=K,达到平衡状态。
化学平衡考点口诀
可逆反应条件同,
正逆等速两非零,
正逆等速不再变,
可把达平来判断,
常数式子方程看,
数值紧随温度变,
算数你就列三段,
符号口诀判移向,
归零等效切莫忘。
如何判断平衡移动的方向
影响平衡移动的因素只有有浓度、压强和温度三个。
1.浓度对化学平衡的影响:在其他条件不变时,增大反应物浓度或减小生成物浓度,平衡向正反应方向移动;减小反应物浓度或增大生成物浓度,平衡向逆反应方向移动。
2.压强对化学平衡的影响:在有气体参加、有气体生成而且反应前后气体分子数变化的反应中,在其他条件不变时,增大压强(指压缩气体体积使压强增大),平衡向气体体积减小方向移动;减小压强(指增大气体体积使压强减小),平衡向气体体积增大的方向移动。
3.温度对化学平衡的影响:在其他条件不变时,升高温度平衡向吸热反应方向移动。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
C(g) + D(g)反应的平衡常数和温度的关系如下:
温度/ ℃ 700 900 830 1000 1200
平衡常数 1.7 1.1 1.0
0.6
0.4
(2)830℃时,向一个5 L的密闭容器中充入0.20 mol的A和0.80 mol的B, 如反应初始6 s内A的平均反应速率v(A)=0.003 mol•L-1•s-1。 则6 s时c(A)=_______ mol•L-1, C的物质的量为______mol; 若反应经一段时间后,达到平衡时A的转化率为______,如果 这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为_____。
2C(g)
已知A(g) + B(g)
C(g) + D(g)反应的平衡常数和温度的关系如下:
温度/ ℃ 700 900 830 1000 1200
平衡常数 1.7 1.1 1.0
0.6
0.4
(1)该反应的平衡常数表达式K =_____,△H____0 (填“<”“>”“=”)。
已知A(g) + B(g)
化学平衡状态的判断 秒杀绝招
考点解读
在一定温度下的定容容器中,当下列物理量不再发生变化时,表明
反应A(s) + 2B(g)
C(g) + D(g)已达到平衡状态的是( )
A. 混合气体的压强
B. 混合气体的密度
C. B的物质的量浓度
D. 气体总物质的量
在一定温度下,下列叙述不是可逆反应A(g) + 3B(g) 达到平衡状态标志的是( ) (1)C的生成速率与C的分解速率相等; (2)单位时间生成a mol A,同时生成3a mol B; (3)A、B、C的浓度不再变化; (4)恒压时混合气体的密度不变; (5)混合气体的总压强不再变化; (6)混合气体的物质的量不再变化; (7)单位时间消耗a mol A,同时生成3a mol B; (8)A、B、C的分子数目比为1:3:2。 A. (2)(8) B. (7)(4) C. (1)(3) D. (5)(6)
已知A(g) + B(g)
C(g) + D(g)反应的平衡常数和温度的关系如下:
温度/ ℃ 700 900 830 1000 1200
平衡常数 1.7 1.1 1.0
0.6
0.4
(4)1200℃时反应C(g) + D(g)
A(g) + B(g)的平衡常数的值为______。
准确判断化 学平衡状态
化学平衡常数 的计算和表达
已知A(g) + B(g)
C(g) + D(g)反应的平衡常1200
平衡常数 1.7 1.1 1.0
0.6
0.4
(3)判断该反应是否达到平衡的依据为_________ 。 a. 压强不随时间改变 b. 气体的密度不随时间改变 c. c(A)不随时间改变 d. 单位时间里生成C和D的物质的量相等
