高中化学竞赛题--金属综合框图题
高中化学竞赛试题非金属综合框图题

中学化学竞赛试题资源库——非金属综合框图题A 组1.已知A 、B 、C 、D 四种不同粒子。
它们之间存在着如右图所示的关系: (1)如果A 、B 、C 、D 均是10电子的粒子,则①用电子式表示C 与H +反应生成A 粒子的形成过程 ; ②A 与D 反应的离子方程式为(2)如果A 和C 是18电子的粒子,B 和D 是10电子的粒子,请写出:A 和B 在溶液中反应的离子方程式 ; 由上述离子方程式,可以判断C 与B 结合质子的能力大小是(用化学式或离子符号表示): > 。
2.A 、B 、C 是常见的三种单质,它们分别由甲、乙、丙三种元素构成;D 、E 、F 是常见的三种氧化物。
上述物质间存在如右图所示的关系,试推断:(1)上述化合物中含有甲元素的是 。
(2)上述反应中,B 是 剂(填氧化、还原、催化),理由是 。
(3)若甲为非金属,则D 为 ,E 为 。
3.单质A 、M 、X 有如下转化关系(反应物和生成物中的水及反应条件已略去)。
已知X 、B 、C 、N 是常见气体。
(1)X 的一种同素异形体与人类的生存环境关系密切,该同素异形体的分子式为 。
(2)能否确定A 、M 一定是非金属单质? (填“能”、“不能”),理由是 。
(3)C 、E 的分子结构相似,E 的电子式为 。
(4)N 能使溴水褪色,反应的化学方程式为 。
请写出鉴别C 和N 的一种试剂 (不能用溴水)(5)请写出下列反应的化学方程式:①N +X →P : 。
②A +Q : 。
4.甲、乙、丙、丁是常见的单质,其中甲、乙、丙是摩尔质量依次增加的气体。
A 和B 以物质的量2︰1通入水中,得到C 溶液。
请根据下图的转化关系回答:(1)按要求写出下列物质:乙分子的电子式A分子的结构式白色沉淀E、F的化学式、(2)写出溶液C中加氯水的离子方程式:(3)在催化剂和加热条件下,A可与丙反应,化学方程式为:5.如图所示。
已知:①甲、乙、丙、丁均为前三周期元素的单质。
2020-2021高考化学专题题库∶铁及其化合物的综合题附答案

2020-2021高考化学专题题库∶铁及其化合物的综合题附答案一、高中化学铁及其化合物练习题(含详细答案解析)1.图中,固体A是铁锈的主要成分。
请回答:(1)固体C的化学式是___,上述框图中体现了SO2的___(填“氧化性”、“还原性”或“漂白性”)。
(2)写出A→B的化学方程式___。
(3)写出D→E的离子方程式___。
(4)若通入的SO2是足量的,请你设计实验方案检验“溶液D”中的金属阳离子___。
【答案】FeCl3还原性 Fe2O3+3CO高温2Fe+3CO2 Ba2++SO42-=BaSO4↓取少量溶液D于试管中,滴加KSCN溶液,无明显现象,再滴加适量氯水(或双氧水),溶液变成血红色,则含有Fe2+【解析】【分析】固体A是铁锈的主要成分,则A为Fe2O3,结合图中转化可知,A与CO反应生成B为Fe,B与氯气反应生成C为FeCl3,C与二氧化硫发生氧化还原反应,溶液D中Fe2+、SO42-等,溶液D与氯化钡反应生成白色沉淀E为BaSO4。
【详解】(1)由上述分析可知,固体C的化学式是:FeCl3,上述框图中SO2失去电子转化为硫酸根离子,作还原剂;(2)A→B的化学方程式为:Fe2O3+3CO高温2Fe+3CO2;(3)D→E的离子方程式为:Ba2++SO42−=BaSO4↓;(4)若通入的SO2是足量的,溶液D中金属阳离子为Fe2+,检验该阳离子的方法为:取少量溶液D于试管中,滴加KSCN溶液,无明显现象,再滴加适量氯水(或双氧水),溶液变成血红色,则含有Fe2+。
2.已知A、B、C、D四种物质均含有铁元素,彼此转化关系如下:请回答:(1)反应①称为铝热反应(属于置换反应),写出该反应的化学方程式:__、其中Al作__剂。
(2)反应④的离子方程式为:__。
(3)新配制的C溶液中应加入__,以防止其转化为D。
检验D溶液中阳离子的常用试剂是__(填化学式),实验现象为__。
【答案】2Al+Fe2O3高温2Fe+Al2O3还原剂 2Fe2++H2O2+2H+=2Fe3++2H2O 铁粉(屑) KSCN (或NH4SCN)溶液变红(或呈现血红色)【解析】【分析】氧化铁与铝单质在高温下发生铝热反应,生成A,则A为Fe,铁和水蒸气在高温下反应生成B,B为黑色磁性氧化物,则B为Fe3O4,Fe3O4中铁元素的化合价含有+2、+3价,与盐酸反应生成FeCl3和FeCl2,铁与过量盐酸反应生成FeCl2,则C为FeCl2,FeCl2与双氧水反应生成FeCl3,则D为FeCl3,据此分析解答。
27届全国高中化学竞赛试题、答案、评分标准及细则

X 的结构式:
1分
若画成两个 Cr-O 单键,只得 0.5 分; 若画成一个 Cr-O 单键和一个 Cr=O 双键,不得分。 2-7 实验得到一种含钯化合物 Pd[CxHyNz](ClO4)2,该化合物中 C 和 H 的质量分数分别为 30.15% 和 5.06%。将此化合物转化为硫氰酸盐 Pd[CxHyNz](SCN)2,则 C 和 H 的质量分数分 别为 40.46%和 5.94%。通过计算确定 Pd[CxHyNz](ClO4)2 的组成。 解法一: Pd[CxHyNz](ClO4)2 中,C 和 H 的比例为 (30.15/12.01) : (5.06/1.008) = 1:2 即 y=2x (1) 1分 Pd[CxHyNz](SCN)2 中, C 和 H 的比例为 (40.46/12.01) : (5.94/1.008) = 0.572 即 (x+2) / y= 0.572 (2) 综合(1)、(2),解得:x=13.89 ≈ 14, y=28 1分 设 Pd[CxHyNz](ClO4)2 的摩尔质量为 M:则 14×12.01/M= 30.15%, 得 M=557.7 (g mol-1) 1分 z = {557.7–[106.4 + 12.01× 14 + 1.00828 + 2× ( 35.45 + 64.00 ) ]}/14.01 = 3.99 = 4 0.5 分 Pd[CxHyNz](ClO4)2 的组成为 Pd[C14H28N4](ClO4)2 。 0.5 分 解法二: 设 Pd[CxHyNz](ClO4)2 的摩尔质量为 M,比较 Pd[CxHyNz](ClO4)2 和 Pd[CxHyNz](SCN)2 知, Pd[CxHyNz](SCN)2 的摩尔质量为:M-2×[35.45+64.00-(32.01+12.01+14.01)]=M- 82.74 (g mol-1) 根据 C 的质量分数,有: 12.01× x= 0.3015 M 12.01× (x+2) = 0.4046 × (M-82.74) 24.02 = ( 0.4046-0.3015) M-0.4046 × 82.74 解得:M=557.7, x= 14 2分 根据 H 的质量分数,有:y = 557.7× 0.0506 / 1.008 =27.99 = 28 1分 则:z= {557.7-[106.4+12.01×14+1.008 ×28+2 ×(35.45+64.00)]}/14.01=3.99=4 1分 其他合理计算且得出正确结果亦得 4 分 2-8 甲烷在汽车发动机中平稳、完全燃烧是保证汽车安全和高能效的关键。甲烷与空气按一 定比例混合,氧气的利用率为 85%,计算汽车尾气中 O2、CO2、H2O 和 N2 的体积比(空气 中 O2 和 N2 体积比按 21: 79 计;设尾气中 CO2 的体积为 1) 。 甲烷完全燃烧:CH4+2O2=CO2+2H2O 1 体积甲烷消耗 2 体积 O2 生成 1 体积 CO2 和 2 体积 H2O
高中化学竞赛题有机框图推断综合
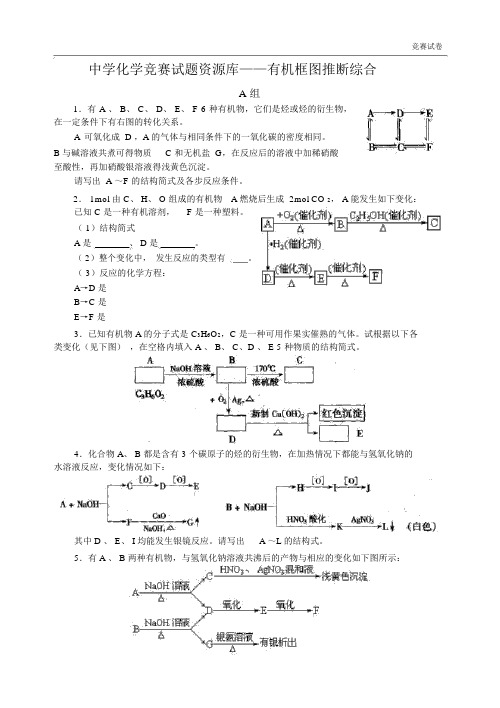
竞赛试卷中学化学竞赛试题资源库——有机框图推断综合A组1.有 A 、 B、 C、 D、 E、 F 6 种有机物,它们是烃或烃的衍生物,在一定条件下有右图的转化关系。
A可氧化成 D ,A 的气体与相同条件下的一氧化碳的密度相同。
B 与碱溶液共煮可得物质C 和无机盐 G,在反应后的溶液中加稀硝酸至酸性,再加硝酸银溶液得浅黄色沉淀。
请写出 A ~F 的结构简式及各步反应条件。
2. 1mol 由 C、 H、 O 组成的有机物 A 燃烧后生成 2mol CO 2, A 能发生如下变化:已知 C 是一种有机溶剂, F 是一种塑料。
( 1)结构简式A 是、 D 是。
( 2)整个变化中,发生反应的类型有。
( 3)反应的化学方程:A→D 是B→C 是E→F 是3.已知有机物 A 的分子式是 C3H6O2,C 是一种可用作果实催熟的气体。
试根据以下各类变化(见下图),在空格内填入 A 、 B、 C、D 、 E 5 种物质的结构简式。
4.化合物 A、 B 都是含有 3 个碳原子的烃的衍生物,在加热情况下都能与氢氧化钠的水溶液反应,变化情况如下:其中 D 、 E、 I 均能发生银镜反应。
请写出 A ~L 的结构式。
5.有 A 、 B 两种有机物,与氢氧化钠溶液共沸后的产物与相应的变化如下图所示:竞赛试卷D 和 F 反应可生成 H, H 的化学式是 C4H 8O2。
写出 A ~ H 的化学式。
6.现有分子式为 C8H13O2Br 的有机物 A , A 在不同条件下,分别生成B1+C1和 B2+ C2(如下图):生成的 C1又能发生如下的变化(如下图):其中只有 B 1既能使溴水褪色,又能和碳酸钠溶液反应放出二氧化碳,则 A 是(填结构简式,下同);B1是;C1是;B2是;C2是;甲是;乙是。
7.现有 A 、 B、 C 三种有机物,它们在一定条件下均可跟KOH 溶液发生化学反应,其相互间的关系如下图所示。
其中 J 与 H 反应生成一种单质,K 为分子量最小的烃。
我爱奥赛网第一届我爱奥赛杯高中化学竞赛试题

1 / 3我爱奥赛网年第一届“我爱奥赛杯”高中化学竞赛试题(年月日 : :共计小时)第题(分)、经过连续衰变直到,期间经过次α衰变,次β衰变。
、现已知的一千多种放射性同位素中,绝大部分是人工产生的。
如就是用中子轰击 而得到的人造元素,写出该核反应式 第题(分)等电子原理通常是指原子数和价层电子数都相同的化合物,可能具有相似的结构。
例如:、、都有个价电子,都为平面三角形结构,都有个σ键和个∏键。
试根等电子原理、理论和八电子隅规则讨论以下化合物或离子的结构。
()和是等电子体, 空间构型是,以杂化轨道与形成共价键。
中-键键长(填>、=或<) 中-键键长,原因是。
()①化合物的分子中原子的连接顺序为——,与为等电子体,结构式为(要体现分子的几何构型)。
可以结合一个成为阴离子,与为等电子体;还可以失去一个成为阳离子,的结构式为;②、、中具有最短的键的是.第题(分)化学物质的制备方法种类繁多,千差万别,下面涉及到几种物质的制备。
请回答提出的问题:原子序数小于的几种元素组成的两种气态化合物分子式均为形式,将他们在常温下通入真空瓶中,生成一种白色粉末,除此之外没有其他生成物,试推断生成该白色化合物的反应方程式。
为了得到铬(Ⅲ)的乙二胺()配合物,我爱奥赛网的一位网友在的水溶液中边搅拌边加入乙二胺,结果得到一种灰蓝色的沉淀,沉淀中并无乙二胺配体。
试用方程式解释实验现象,并提出实验的改进方法某些羰基化合物也可以由氧化物与反应制得,与铁为同一族的锇的四氧化物与制备得到锇的羰基化合物,写出反应方程式第题(分)磁性材料在人们的日常生活中有着重要的应用,对磁性材料的研究也是日渐深入。
回答下列问题。
.磁致冷材料是用于磁致冷系统的具有磁热效应的物质,用它可制成磁冰箱。
磁致冷首先是给材料加磁场,使磁矩按磁场方向整齐排列,如状态所示;然后再撤去磁场使磁矩的方向变得杂乱,如状态所示,通过这个过程达到致冷的目的。
请从热力学的角度解释上述过程。
中学化学竞赛试题资源库——金属晶体

中学化学竞赛试题资源库——金属晶体A组1.不仅与金属的晶体结构有关,而且与金属原子本身的性质有关的是A 导电性B 电热性C 延展性D 密度2.下列何种物质的导电性是由自由电子的运动所决定的A 熔融的食盐B 饱和食盐水C 石墨D 铜3.金属晶体的特征是A 熔点都很高B 熔点都很低C 都很硬D 都有导电、导热、延展性4.含有阳离子而不含有阴离子的晶体是A 原子晶体B 分子晶体C 离子晶体D 金属晶体5.金属晶体的形成是通过A 金属原子与自由电子之间的相互作用B 金属离子之间的相互作用C 自由电子之间的相互作用D 金属离子与自由电子之间的较强的相互作用6.氢气是重要而洁净的能源,要利用氢气作能源,必须安全有效地储存氢气。
有报道称某种合金材料有较大的储氢容量,其晶体结构的最小单元如右图所示。
则这种合金的化学式为A LaNi3B LaNi4C LaNi5D LaNi67.铁原子半径为1.26×10-8cm,质量为55.8μ(μ=1.67×10-24g),则铁原子的体积(用cm3表示)为,铁原子的密度为(用g/cm3表示)。
铁原子密度比一块铁试样的密度大的原因是。
8.晶体是质点(分子、离子、或原子)在空间有规则地排列的,具有整齐外形,以多面体出现的固体物质。
在空间里无限地周期性的重复能成为晶体的具有代表性的最小单元,称为晶胞。
一种Al-Fe合金的立体晶胞如图所示。
(1)确定该合金的化学式____________。
(2)若晶胞的边长=a nm,计算此合金的密度________________(不必化简)g/cm3。
(3)取一定质量的该合金粉末溶于足量的稀NaOH溶液中,待反应完全停止后得到气体6.72L。
过滤,将残渣用蒸馏水洗净后,取其质量的十分之一,投入100mL一定浓度的稀硝酸中,恰好完全反应,共收集到气体0.672L,求硝酸的物质的量浓度。
(以上气体体积均在标准状况下测定)B组9.锂金属晶体由体心立方晶胞组成。
2019安徽高中化学竞赛结构化学第八章金属的结构和性质习题答案不全语文

一选择题1、CsCl晶体中,每个铯离子周围紧靠着的氯离子数目是( c )(A)4个(B)6个(C)8个(D)12个2、在离子晶体中,决定正离子配位数的关键因素是( A)(A) 正负离子半径比 (B) 正负离子电价比 (C) 正负离子电负性之比3、对于二元离子晶体,下列哪一式成立:( B )(A) n+/n-=Z-/Z+=CN-/CN+ (B) n-/n+=Z-/Z+=CN-/CN+ (C) n+/n-=Z-/Z+=CN+/CN-4、马德隆(Madelung)常数与离子晶体的哪种因素有关:( B)(A) 化学组成 (B) 晶体结构型式 (C) 离子键长5、Ge晶体(A4,即金刚石结构)的空间利用率(堆积系数)小于W晶体(A2),它们的晶胞中的原子数目是( B )(A) Ge<W (B) Ge>W (C) Ge=W6. NaCl与CaF2晶体的相同之处是:( B)(A) 结构基元 (B) 负离子堆积方式 (C) 点阵型式7. 4:4是下列哪一种晶体的CN+/CN-:( C)(A) CsCl (B) NaCl (C) 六方ZnS8. 对于CaF2晶体,“简单立方”一词描述的是它的( B )(A) 负离子堆积方式 (B) 点阵型式 (C) 正离子堆积方式9. 某种离子晶体AB被称为NaCl型, 这指的是( B)(A) 它的化学组成 (B) 它的结构型式 (C) 它的点阵型式二简答题1.已知金属Ni为A1型结构,原子间最近接触距离为249.2pm试计算:(1)Ni立方晶胞参数;(2)金属Ni 的密度(以g×表示);(3)画出(100),(110),(111)面上原子的排布方式。
1. (1) 352.4pm(2) 8.91g·cm-32. 已知金属钛为六方最密堆积结构,金属钛原子半径为146pm,试计算理想的六方晶胞参数。
2. a=b=292pm, c=477pm3. 计算A2型体心立方密堆积的空间利用率。
全国高中生化学竞赛试题3 配位化合物

配位化合物(全国初赛)第1题(13分)六配位(八面体)单核配合物MA 2(NO 2)2呈电中性;组成分析显示:M 21.68%,N 31.04%,C 17.74%;配体A 含氮不含氧;配体(NO 2)x 的两个氮氧键不等长。
1-1该配合物中心原子M 是什么元素?氧化态多大?给出推论过程。
(2002年第5题)1-2画出该配合物的结构示意图,给出推理过程。
13指出配体(NO 2)x 在“自由”状态下的几何构型和氮原子的杂化轨道类型。
1-4除本例外,上述无机配体还可能以什么方式和中心原子配位?画出三种。
第2题(7分)研究发现,钒与吡啶-2-甲酸根形成的单核配合物可增强胰岛素降糖作用,它是电中性分子,实验测得其氧的质量分数为25.7%,画出它的立体结构,指出中心原子的氧化态。
要给出推理过程。
(2004年第5题)第3题(8分)今有化学式为Co(NH 3)4BrCO 3的配合物。
(2004年第8题)3-1画出全部异构体的立体结构。
3-2指出区分它们的实验方法。
第4题(6分)本题涉及3种组成不同的铂配合物,它们都是八面体的单核配合物,配体为OH -和/或Cl -。
(2005年第4题)4-1PtCl 4·5H 2O 的水溶液与等摩尔NH 3反应,生成两种铂配合物,反应式为:。
4-2BaCl 2·PtCl 4和Ba(OH)2反应(摩尔比2:5),生成两种产物,其中一种为配合物,该反应的化学方程式为:。
第5题(11分)化合物A 是近十年开始采用的锅炉水添加剂。
A 的相对分子质量90.10,可形成无色晶体,能除去锅炉水中溶解氧,并可使锅炉壁钝化。
(2006年第7题)5-1A 是用碳酸二甲酯和一水合肼在70℃下合成,收率80%。
画出A 的结构式。
5-2写出合成A 的反应方程式。
5-3低于135℃时,A 直接与溶解氧反应,生成三种产物。
写出化学方程式。
5-4高于135℃时,A 先发生水解,水解产物再与氧反应。
2020全国高中化学竞赛初赛模拟试卷六(含答案)
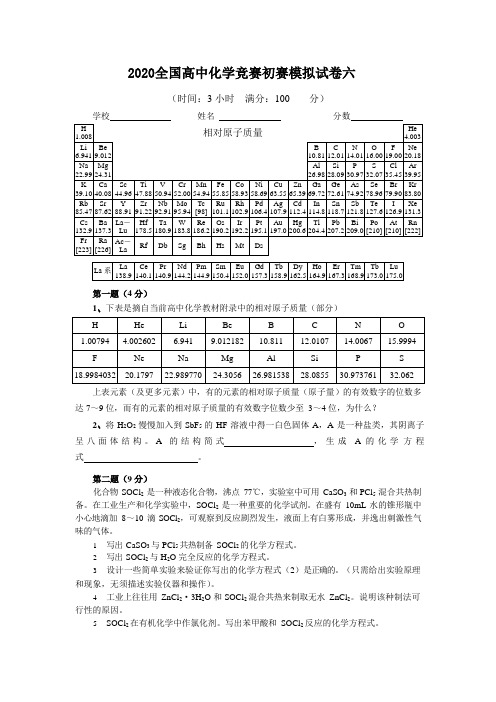
2020全国高中化学竞赛初赛模拟试卷六(时间:3 小时满分:100 分)学校姓名分数第一题(4 分)1、下表是摘自当前高中化学教材附录中的相对原子质量(部分)上表元素(及更多元素)中,有的元素的相对原子质量(原子量)的有效数字的位数多达7~9 位,而有的元素的相对原子质量的有效数字位数少至3~4 位,为什么?2、将H2O2慢慢加入到SbF5的HF 溶液中得一白色固体A,A 是一种盐类,其阴离子呈八面体结构。
A 的结构简式,生成 A 的化学方程式。
第二题(9 分)化合物SOCl2是一种液态化合物,沸点77℃,实验室中可用CaSO3和PCl5混合共热制备。
在工业生产和化学实验中,SOCl2是一种重要的化学试剂。
在盛有10mL 水的锥形瓶中小心地滴加8~10 滴SOCl2,可观察到反应剧烈发生,液面上有白雾形成,并逸出刺激性气味的气体。
1.写出CaSO3与PCl5共热制备SOCl2的化学方程式。
2.写出SOCl2与H2O 完全反应的化学方程式。
3.设计一些简单实验来验证你写出的化学方程式(2)是正确的。
(只需给出实验原理和现象,无须描述实验仪器和操作)。
4.工业上往往用ZnCl2·3H2O 和SOCl2混合共热来制取无水ZnCl2。
说明该种制法可行性的原因。
5.SOCl2在有机化学中作氯化剂。
写出苯甲酸和SOCl2反应的化学方程式。
6.为了使(5)生成的有机物与混溶在其中的过量的SOCl2分离,可以采用的分离操作是。
第三题(11 分)车祸严重危害了司乘人员的生命安全,为了降低车祸给司乘人员所带来的损害,有人利用化学反应在小汽车前排设计了一气袋。
气袋由固体化合物 A +B +C 组成,在汽车受到撞击的一刹那,由于剧烈碰撞,导致气袋里发生化学反应,气袋迅速膨胀,随及弹出,从而保护司乘人员的头颈不致于撞到钢架、挡风玻璃,该气袋已挽救了成千上万人的生命。
化合物 A 为白色固体,通常情况下相对稳定,碰撞时剧烈分解,产生熔融状态的 D 与气体 E 。
最新高一化学框图强化训练题(A)及详细答案

最新高一化学框图强化训练题(A)1.A、B、C、D、F五种物质的焰色反应均为黄色,A、B、C、D与盐酸反应均生成E,此外B还生成一种可燃性气体。
而C、D还生成一种无色无味气体H,该气体能使澄清石灰水变浑浊。
D和A可反应生成C,F和H也可反应生成C和另一种无色无味气体。
请回答下列问题:(1)写出A、C、F的化学式:A________;C________;F________。
(2)写出F和H反应的化学方程式_____________________________________________________。
(3)写出下列反应的离子方程式:①D+盐酸__________________________________________________;②B+水______________________________________________________________。
2.下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色。
填写下列空白:(1)写出化学式:A______________,B______________,D______________。
(2)以上反应中属于氧化还原反应的有______________(填序号)。
(3)写出反应⑤的离子方程式:__________________________________________________。
写出反应⑥的化学方程式:______________________________________________。
3.如图A、B、C、D、E、F六种物质中除D为单质外其余均是常见的化合物,E 和F的水溶液均呈碱性,它们的转化关系如图所示。
请回答下列问题。
(1)A、B、D的化学式是:A__________,B__________,D________;(2)E和F可相互转化,图中已标明F向E转化的关系,请写出E转化为F的化学方程式:____________________。
历年高中化学竞赛有机题

历年有机试题一. 有机结构第六题(10分)曾有人用金属钠处理化合物A (分子式C 5H 6Br 2,含五元环),欲得产物B ,而事实上却得到芳香化合物C (分子式C 15H 18)。
6-1请画出A 、B 、C 的结构简式。
6-2为什么该反应得不到B 却得到C ?6-3预期用过量酸性高锰酸钾溶液处理C ,得到的产物是D ,写出D 的结构式。
[解题思路]1.对比产物C 的分子式(C 15H 18)和起始物A 的分子式(C 5H 6Br 2)可见一个C 分子是3个A 分子脱去溴原子连接而成的,而且A 转化为C 的反应是用金属钠消除A 分子中的溴。
可见此题并没有要求应试者必须学过武兹反应,此思路的知识基础没有超过中学化学。
2.试题用A 是溴代环戊烯和C 是芳香化合物2个信息同时限定了A 和C 的结构。
溴代环戊烯因溴原子连在不同碳原子上而有多种位置异构体,它们与金属钠反应失去溴连接的方式更多,但是,为满足C 是分子式为C 15H 18的芳香化合物(至少要有一个含共轭双键的苯环)的条件,A 必须是1,2-二溴环戊烯,C必定有答案给出的结构式。
应试者得出这个结论的过程和花费的时间自然很不相同,有的学生可能在草稿纸画满各种各样的二溴环戊烯,并令其脱溴相连,甚至得出很大的环状化合物,有的学生则只需在脑子里想清楚,其差别不是知识水平高低而是智力水平高低。
在思考过程中,下述联想是有助于应试者得出结论:3.为什么A 与金属钠反应会得到C 呢?如果应试者联想起中学化学里学过乙炔合成苯的反应,就会想到,A 脱去溴首先得到的应是含C C 键的环戊炔(B ),既然乙炔经催化可三聚成苯,对比乙炔和环戊炔的结构,理应联想到中学化学学到:乙炔的碳氢处在一条直线上(《化学读本》的sp 杂化当然有帮助,属竞赛大纲要求,但并非必需),环戊炔的炔碳在五元环上,其不稳定性就不至犹豫,不需催化剂也会聚合就在意料之中。
4.命题人考虑到环戊烯不稳定,有的学生可能将B 写成它的双聚物,以求得到较稳定的化合物,因而答双聚体也算对,而且对两种B 的不稳定给了注释性说明(注:不要求学生达到这种注释水平)。
高中化学竞赛初赛模拟试卷(13)

中学化学竞赛初赛模拟试卷(13)第一题(4分)有人受中国传统“水烟筒”的启发,利用其工作原理,设计出了一个特别的烟斗。
内盛Cu(NH3)2Ac溶液(专业商店有售),当吸烟时,烟气通过烟斗发生如下反应:Cu(NH3)2Ac+CO+NH 3Cu(NH3)3Ac·CO ΔH<01.物质Cu(NH3)2Ac为协作物,其名称为。
2.用这种特别烟斗除去CO的试验原理为。
3.用久后的Cu(NH3)2Ac又可送专业商店回收再生。
相宜再生的条件是什么?第二题(6分)当邻苯二甲酸氯在苯中用三氯化铝处理时,得到内酯A,而不是邻二苯甲酸苯。
已知邻苯二甲酸氯以另一种形式存在,其中两个氯原子连在一个碳原子上,试向这种酰氯的结构和内酯A的最可能结构。
第三题(8分)关于核的稳定性有以下两条阅历规则:①对于原子序数为20以前的元素而言,最稳定的核是核中的质子数(p)等于中子数(N)的核,即比值N/p=1;对于原子序数为20~83的元素而言,随着质子数增多,稳定核的N/p值随着原子序数的增加而增大,直到约为1.6,超过此值时,核就变得太大,而发生裂变。
这种改变趋势可用稳定核的N/p比值与p 的关系图(右图)表示。
该图的意义是:对某一元素X,其稳定核的N/p将落在曲线上或曲线上下旁边,若N/p 过高或过低,核将不稳定。
②马涛契规则(Mattauch’s rule)指出,两原子序数相连接的元素,如有相同质量的同位素,那么这两个同位素都不会是稳定的。
现已知42Mo的稳定同位素的质量数有:92、94、95、96、97、98、100;44Ru的稳定同位素的质量数有:96、98、99、100、101、102、104。
回答下列问题:1.为什么随着质子数增多,稳定核的N/p值随着原子序数的增加而增大?2.假如43Tc只可能存在两种同位素,那么分别是什么?3.可能存在43Tc的两种核是最稳定的吗?为什么?4.从本题你能得出关于43Tc什么样的结论?第四题(7分)苎烯是存在于橘子、柠檬等水果中的一种化合物,可被KMnO4氧化成等物质的量的和CO2。
竞赛题库6年第一届“我爱奥赛杯”高中化学竞赛试题

我爱奥赛网2006年第一届“我爱奥赛杯”高中化学竞赛试题 (2006年5月6日 9:00 - 12:00共计3小时) 题号 1 2 3 4 5 6 7 8 9 10 11 总分 满分 4 11 8 8 9 11 7 10 13 9 10 100 得分 评卷人 ● 竞赛时间3小时。
迟到超过30分钟者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
● 姓名、考号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论。
● 请将答案写在指定的位置。
● 允许使用非编程计算器以及直尺等文具。
1.008Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Ac-Lr H Li Be B C N O F Na Mg Al Si P Cl S K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Rb Cs Fr Sr Ba Ra Y La Lu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210][210]126.979.9035.454.00320.1839.9583.80131.3[222]He Ne Ar Kr Xe Rn 相对原子质量Rf Db Sg Bh Hs Mt 第1题(4分) 1、23992U 经过连续衰变直到20782Pb,期间经过 次α衰变, 次β衰变。
安徽高中化学竞赛-结构化学 8 金属的结构和性质(共47页PPT)(共47张PPT)
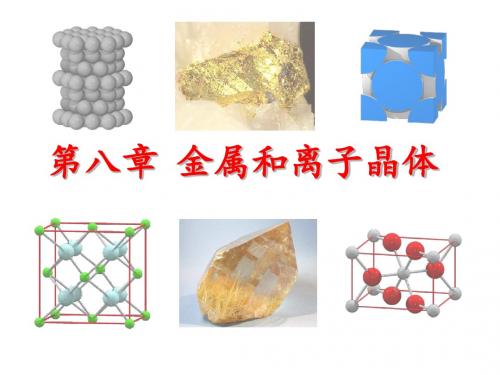
4) 晶胞内空隙数及空隙中心位置 正四面体空隙: 8个(顶角) 正八面体空隙 4个(体心1个,棱心3个 )
球数:正八面体空隙数: 正四面体空隙数=4:4:8=11/4, 1/4, 1/4) (1/4, 3/4, 1/4) (3/4, 1/4, 1/4) (3/4, 3/4, 1/4) (1/4, 1/4, 3/4) (1/4, 3/4, 3/4) (3/4, 1/4, 3/4) (3/4, 3/4, 3/4)
晶胞内球体积
晶胞体积 100%
4 r3 2
=3
74.05%
ab sin(60)c
6) 对称性:
c 轴方向有 3mh 6
密置层与c 轴垂直,只有在垂直于c 的方向 易滑移
A1 A3堆积对比
共 同 点:
不 同 点:
都为最密堆积 配位数一样 12 球数:正八面体空隙数: 正四面体空隙数=1:1:2
正 八 面 体 空 隙
(1/3, 2/3, 1/4) (1/3, 2/3, 3/4)
正 四 面 体 空 隙
(2/3, 1/3, 1/8) (2/3, 1/3, 7/8) (0, 0, 3/8)
(0, 0, 5/8)
四面体空隙
八面体空隙
5) 晶胞空间利用率~A3型密堆积系数
001面接触情况;a = b = 2r, c/a=1.633
对于边长为l的立方体,有:
x,y,z 2 l 3sinnx lxsinny lysinnz lz
E8m h2l2 nx 2ny 2nz2 8 nm 2hl2 2
n2 nx2ny2nz2
nx,ny,nz为 正 整 数
考虑到晶体的周期性
xlx
Eg < 3 eV
化学框图题(带答案)
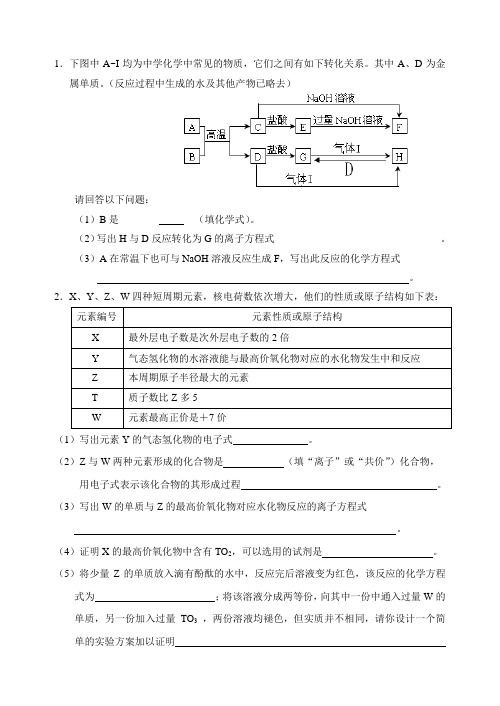
1.下图中A~I均为中学化学中常见的物质,它们之间有如下转化关系。
其中A、D为金属单质。
(反应过程中生成的水及其他产物已略去)请回答以下问题:(1)B是________ __(填化学式)。
(2)写出H与D反应转化为G的离子方程式_________________________________。
(3)A在常温下也可与NaOH溶液反应生成F,写出此反应的化学方程式 ___ ____。
2.X、Y、Z、W四种短周期元素,核电荷数依次增大,他们的性质或原子结构如下表:(1)写出元素Y的气态氢化物的电子式。
(2)Z与W两种元素形成的化合物是(填“离子”或“共价”)化合物,用电子式表示该化合物的其形成过程。
(3)写出W的单质与Z的最高价氧化物对应水化物反应的离子方程式。
(4)证明X的最高价氧化物中含有TO2,可以选用的试剂是。
(5)将少量Z的单质放入滴有酚酞的水中,反应完后溶液变为红色,该反应的化学方程式为;将该溶液分成两等份,向其中一份中通入过量W的单质,另一份加入过量TO3,两份溶液均褪色,但实质并不相同,请你设计一个简单的实验方案加以证明3.已知X、Y、Z为三种短周期元素,其中X的原子核中只有1个质子,X与Y原子的最外层电子数之和等于Z原子的最外层电子数,Z的-2价离子的电子层结构与氖的相同。
现有A、B、C、D、E五种中学化学中常见的化合物,转化关系如下所示。
A → B→ C → D → E涉及反应的所有反应物和产物均由X、Y、Z中的一种或几种元素组成。
请回答:(1)D的浓溶液与铜反应产生红棕色气体,由此可知D的化学式为____________。
(2)E是一种离子化合物。
在实验室中检验该物质所含阳离子的实验操作方法和现象为:取少量E放入试管中,加入少量NaOH溶液并加热,________________________ ____________________________________________________________________。
高中化学《金属》专题综合习题(详解)——精品文档

高中化学《金属》专题综合习题1.下列有关金属及其化合物的说法正确的是( )A .1 L 生理盐水(0.9%NaCl 溶液)中含有9 molNa +B .出土的古代铜制品表面覆盖着铜绿,其主要成分是CuOC .装修门窗使用的铝合金材料的硬度比铝小,熔点比铝低D .节日燃放的烟花是某些金属元素发生焰色反应所呈现出来的色彩答案:D2. 铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:Fe 2O 3(s)+3CO(g)2Fe(s)+3CO 2(g) ①该反应的平衡常数表达式为:K= 。
②该温度下,在2L 盛有Fe 2O 3粉末的密闭容器中通入CO 气体,10min 后,生成了单 质铁11.2g 。
则10min 内CO 的平均反应速率为 。
(2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态:① ② 。
(3)某些金属氧化物粉末和Al 粉在镁条的引燃下可以发生铝热反应。
下列反应速率(v )和温度(T )的关系示意图中与铝热反应最接近的是 。
(4)写出氢氧化铝在水中发生酸式电离的电离方程式: , 欲使上述体系中Al 3+浓度增加,可加入的物质是 。
答案:(本题共8分)(1)323[CO ][CO] 0.015mol /(L min) (2)①CO 或(CO 2)的生成速率与消耗速率相等;②CO(或CO 2)的质量不再改变(合理即给分)(3)b (4)Al(OH)3H ++AlO 2-+H 2O 盐酸4. 把铜粉和过量的铁粉加入到热的浓硝酸中,充分反应后,溶液中大量存在的金属阳离子是 ( )A.只有Fe 2+B.只有Fe 3+C.有Fe 2+和Cu 2+D.有Fe 3+和Cu2+ 答案:A例1. 9.2g 金属钠投入到足量的重水中,则产生的气体中含有( )A .0.2mol 中子B .0.4mol 电子C .0.2mol 质子D .0.4mol 分子解析与评价:本题典型考察了单质钠与水反应的相关计算。
高中化学《金属和非金属框图题》补充练习

高中化学《金属和非金属框图题》补充练习本练习题旨在巩固和提高高学生对金属和非金属性质、反应及转化关系的理解和运用能力。
题目涵盖了常见金属和非金属元素及其化合物性质,并通过框图的形式展现元素间的转化关系,要求学生能够根据已知信息推断未知物质,并写出相应的化学方程。
第一部分:基础练习 (约 2000 字)一、单一物质推断题:1.题型一:已知一种物质,推断其性质及可发生的反应。
例如:已知一种黑色粉末A,能与稀盐酸反应生成无色气体B,B能使澄清石灰水变浑浊。
A是什么物质?写出有反应的化学方程式。
(答案:A为氧化铜(CuO),B为二氧化碳(CO2)。
反应方程式为:CuO + 2HCl = CuCl2 + H2O;CO2 + Ca(OH)2 = CaCO3↓ + HO)2.题型二:已知一种物质的性质,推断其可能是什么物质。
例如:一种金属单质,能与稀硫酸反应生成氢气,也能与氯气反应生成白色固体。
该金属可能是哪几种?写出有反应的化学方程式。
(答案:该金属可能是铁(Fe)、锌(Zn)等。
反应方程式例如:Fe + H2SO4 = FeSO4 + H2↑;2Fe + 3Cl2 = 2FeCl3)3.型三:已知物质的某些性质和反应产物,推断其组成和结构。
例如:某化合物X,白色固体,能溶于水,其水溶液呈碱性,能与盐酸反应生成一种白色沉淀Y,Y不溶于硝酸。
X是什么物质?写出有关反应的化学方程式。
(答案:X可能是碳酸钙(CaCO3),Y是碳酸钙(CaCO3)。
反应方程式:CaCO3 + 2HCl = CaCl2 + H2O + CO2)二、简单框图推断题:1.题型一:简单的转化关系推断。
例如:A → B → C,已知A是金属单质,B是金属氧化物,C是金属盐。
请写出可能的反应物、B、C及其转化过程的化学方程式。
2.题型二:涉及简单反应类型的框图推断。
例如:A(金属单质) + B(酸) → C(盐) + D(气体),已知D是氢气请推断A、B、C的可能物质,并写出化学方程式。
2019高考化学二轮增分策略 27题专练 金属及其化合物的框图推断

27题专练金属及其化合物的框图推断1.(2018·温州市高三上学期期中考试)下图中M是紫红色金属。
据此回答问题:(1)M的化学式是________________________________________________________。
(2)M―→MSO4过程中,氧化剂是__________。
(3)写出Z→K2EO4的化学反应方程式:___________________________________________________________________________________________________________________。
(4)向Y溶液中滴加KI-淀粉溶液,变为蓝色,其原因用离子方程式解释:________________________________________________________________________。
答案(1)Cu (2)H2O2(3)10KOH+3Cl2+2Fe(OH)3===2K2FeO4+6KCl+8H2O (4)2Fe3++2I-===2Fe2++I2解析M是紫红色金属,M是Cu;与稀硫酸、双氧水反应生成硫酸铜。
根据Y与KSCN反应显血红色可知Y中含有铁离子,所以E是Fe,X是硫酸亚铁,被双氧水氧化生成硫酸铁,硫酸铁与氢氧化钾反应生成氢氧化铁,在碱性溶液中被氯气氧化生成高铁酸钾。
则(1)M的化学式是Cu。
(2)根据以上分析可知M―→MSO4过程中氧化剂是H2O2。
(3)根据电子得失守恒和原子守恒可知Z―→K2EO4的化学反应方程式为10KOH+3Cl2+2Fe(OH)3===2K2FeO4+6KCl+8H2O。
(4)向Y溶液中滴加KI-淀粉溶液,变为蓝色,原因是铁离子把碘离子氧化为单质碘,碘遇淀粉显蓝色,离子方程式为2Fe3++2I-===2Fe2++I2。
2.(2018·浙江省五校高三上学期第一次联考)铁橄榄石是天然的铁矿石,由实验测得铁橄榄石的摩尔质量为204 g·mol-1,其中铁元素的质量分数为54.9%,可以通过如下反应和相应的数据推知它的化学式。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中学化学竞赛试题资源库——金属综合框图题
A组
1.如图所示,6个编号分别代表下列物质中的一种物质,凡
是用直线相连的两种物质均能发生化学反应(已知高温下氨气能
还原氧化铁)。
图中⑤表示的物质是
a.Al b.Fe2O3 c.NaOH溶液 d.氢碘酸溶液 e.NH3 f.Cl2
A a或b
B
C C d
D e或f
2.常见化合物X由两种短周期元素
组成,其阴、阳离子相差一个电子层,且
阴、阳离子数目比为1︰1。
它在一定条件
下可发生图示的变化。
写出X的电子式。
3.要完成下列无机物质间的化学变化,
各无机物质应是A_____,B_____,C_____,D_____,E_____,F_____,X_____。
(Y和Z不必回答)
4.有物质M、N、A、B、C、D、E、F、G、H,其中C、H为常见金属,且混合气体A在常温下不与空气接触时能发生如图所示变化(其他有关反应条件均略去):
试回答:
(1)写出C、D和H的化学式:
(2)写出反应①②③的化学方程式:
5.A、B、C是常见单质,X、Y、Z是氧化物,它们之间有如下转化关系:请写出符合下列要求的化学方程式:
(1)若X为CO2,则:
反应①;
反应②;
(2)若X为Fe3O4。
则:
反应①;
中学综合学科网第 1 页共 25 页。
