第18-3 六元杂环化合物
六元杂环化合物

Q有机化学精品课件第十五章杂环化合物第一节杂环化合物的分类和命名一、 分类二、 命名杂环的命名常用音译法,是按外文名词音译成带 字旁的同音汉字。
(pyrimidine) (quinoline) (furan) 咲喃 (thiophene) (pyridine)(indole)卩弭朵 (purine) 卩票吟(pyrrole)毗咯 NN卩塞吩卩密噪卩奎卩林II第二节五元杂环化合物in咲喃「噬吩、毗咯杂环的结构咲喃、卩塞吩、毗咯在结构上具有共同点,即构成环的五个原子都为Sp2杂化,故成环的五个原子处在同一平面, 杂原子上的孤对电子参与共辘形成共辘体系,其兀符合休克尔规则(兀电子数二4n+2),为口2共轨体系71电子=6 符合4n + 2 具有芳性富电子芳环电子数所以,它们都具B 二、咲喃、I®吩、毗咯的性质 ・'(一)存在与物理性质(二) 光谱性质(三) 化学性质1.亲电取代反应从结构上分析,五元杂环为口56共辘体系 苯大,如以苯环上碳原子的电荷密度为标准 则五元杂环化合物的有效电荷分布为:o oo o O +0.20 -0.04 -0.06 ■J ----- ji -0.06 匸丿-0.10 壯 +0.32 H &AV-V MX ,电荷密度比 (作为0),亲电取代反应的活性为: 要毗咯〉咲喃 > 囈吩〉苯,主還j进入位。
说明:毗咯、咲喃、卩塞吩的亲电取代反应,对试剂及反应条件必须有所选择和控制。
卤代反应不需要催化剂,要在较低温度和进行。
硝化反应不能用混酸硝化,一般是用乙酰基硝酸酯|【(CH3COONOJ作硝化试剂,在低温下进行。
磺化反应咲喃、毗咯不能用浓硫酸磺化,要用特殊的磺化试剂——毗噪三氧化硫的络合物,嗟吩可直接用浓硫酸磺化。
2・加氢反应四氢咲喃(THF)四氢毗咯不能用Pd催化因卩塞吩能Pd使中毒W 3.咲喃、毗咯的特性反应(1)咲喃易起D・A反应&AV-V MX内式(90%)o2II ⑵毗咯的弱酸性和弱碱性毗咯虽然是一个仲胺,但碱性很弱。
杂环化合物

第十八章杂环化合物教学要求1.了解杂环化合物的分类、命名。
2.掌握重要的五元、六元及稠环杂环化合物的结构和性质。
如:呋喃、噻吩、吡咯、喹啉(斯克奥浦合成)。
3.了解嘧啶及嘌呤的结构。
4.了解生物碱的一般概念。
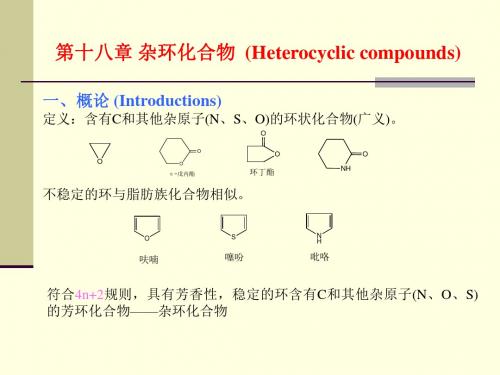
杂环化合物是指组成环的原子中含有除碳以外的原子(杂原子——常见的是N、O、S等)的环状化合物。
杂环化合物不包括极易开环的含杂原子的环状化合物,例如:本章我们只讨论芳香族杂环化合物。
杂环化合物是一大类有机物,占已知有机物的三分之一。
杂环化合物在自然界分布很广、功用很多。
例如,中草药的有效成分生物碱大多是杂环化合物;动植物体内起重要生理作用的血红素、叶绿素、核酸的碱基都是含氮杂环;部分维生素,抗菌素;一些植物色素、植物染料、合成染料都含有杂环。
第一节杂环化合物的分类和命名一、分类二、命名杂环的命名常用音译法,是按外文名词音译成带“口”字旁的同音汉字。
当环上有取代基时,取代基的位次从杂原子算起依次用1,2,3,… (或α,β,γ…)编号。
如杂环上不止一个杂原子时,则从O、S、N顺序依次编号。
编号时杂原子的位次数字之和应最小。
第二节五元杂环化合物含一个杂原子的典型五元杂环化合物是呋喃、噻吩和吡咯。
含两个杂原子的有噻唑、咪唑和吡唑。
本节重点讨论呋喃、噻吩和吡咯,简单介绍一下噻唑、咪唑和吡唑。
一、呋喃、噻吩、吡咯杂环的结构呋喃、噻吩、吡咯在结构上具有共同点,即构成环的五个原子都为sp2杂化,故成环的五个原子处在同一平面,杂原子上的孤对电子参与共轭形成共轭体系,其π电子数符合休克尔规则(π电子数 = 4n+2),所以,它们都具有芳香性。
二、呋喃、噻吩、吡咯的性质1、存在与物理性质2、光谱性质3、化学性质(1)亲电取代反应从结构上分析,五元杂环为∏56共轭体系,电荷密度比苯大,如以苯环上碳原子的电荷密度为标准(作为0),则五元杂环化合物的有效电荷分布为:五元杂环有芳香性,但其芳香性不如苯环,因环上的π电子云密度比苯环大,且分布不匀,它们在亲电取代反应中的速率也比要苯快得多。
杂环化合物的分类和命名

稠
苯
杂 茚
环 蒽
重要的杂环
N
喹啉
N
异喹啉
N 吲哚
O 苯并呋喃
N N 嘌呤
八 七
九一 二
六 五
一N0
三 四
吖啶
第三节:五元杂环化合物
O
呋喃
S
噻吩 返回
呋喃:
呋喃存在于松木焦油中,无色易挥发的液体, 难溶于水,易溶于乙醇乙醚等有机溶剂沸点 三二℃,其蒸气遇被HCl浸过的松木片时呈绿色, 此法可用于鉴定呋喃的存在。
三H二S
S
二乙炔通过加热至三00℃的铁矿分解S,或H二S在Al二O三加 热至四00℃可制得
二CH--CH S 三00℃
S
二CH--CH
H二S
Al二O三 四00℃
S
H二
⑵实验室制取:用丁二酸钠盐或一,四二羰基化合物与P二S三 作用
NaOOCCH二CH二COONa
P二S三 △
S
HOCCH二CH二COH
一.制备
原料:米糠麦秆玉米芯甘蔗渣高粱壳玉米壳等农产品, 它们都含有缩戊糖
C五H八O四n nH二O H二SO四 nC五H一0O五
--- -- -
HH HO-C C-OH
H-C-H C-H OH OH CHO
O CHO
返回
二.性质:
O -CHO
Cu H二 一00~二00℃
O -CH2OH
骨架镍 一七0~一八0℃
P二S三
△
S
二.性质:
化性:一亲电取代反应
Br二,CH三COOH,0℃
HNO三,CH三COO二
S
H二SO四 CH三C=OCl,SNCl四
S Br
杂环化合物

N
N
Br2 300 oC
Br N
β-溴吡啶 溴吡啶 β-吡啶磺酸 吡啶磺酸
H2SO4, SO3 230 oC, 24 h
KNO3 + H2SO4 Fe, 300 oC
SO3H N
NO2 β-硝基吡啶 硝基吡啶 N
N
亲电取代反应为什么主要发生在β 位上? 亲电取代反应为什么主要发生在β-位上?
如果取代在 a 位
4 5
CH3
1-甲基吡唑 甲基吡唑
S
1
CH3 6
CH3 4 5 N3 N 2
1
4-甲基咪唑 甲基咪唑
5-甲基噻唑 甲基噻唑
4-甲基嘧啶 甲基嘧啶
3. 具有特定名称的稠杂环的编号一般和稠环芳烃相同, 具有特定名称的稠杂环的编号一般和稠环芳烃相同 但少数有例外(比如 嘌呤) 但少数有例外 比如 嘌呤
5 6 7 8 4 8 3 2 7 6 5 9 1 2 3 4
N H H
反 发 无 应 生
浓 H2SO4 / HgSO4 N 220oC Br2 / 浮 石 300oC N N
SO3H
Br
环上有给电子基时反应相对较易进行
4 芳环上的亲核取代反应
亲核取代比苯容易,主要发生在 位上 位上。 亲核取代比苯容易,主要发生在α位上。 比苯容易
PhLi N O2 or PhNO2, 化 (氧 ) N Ph
(3)周边编号的方法 (3)周边编号的方法 为表明取代基的位置,还需要对稠杂环的周边给与编号, 为表明取代基的位置,还需要对稠杂环的周边给与编号, 编号原则是基本环用英文字母编号,附加环要用数字编号。 编号原则是基本环用英文字母编号,附加环要用数字编号。
然后对稠杂环进行整体编号,共用碳原子不参与编号, 然后对稠杂环进行整体编号,共用碳原子不参与编号, 共用杂原子参与编号。 共用杂原子参与编号。
杂环化合物的分类和命名

O2,NaOH Cu2O-HgO,55℃ -COOH
O2,320~350℃ V2O5-TiO2-SiO2
O H-C-C = O H-C-C O
15
2
O
-CHO
O
-CH2OH
O
-COOH
O
-CHO
+(CH3CO)2O
O
-CH=CH-COOH
16
三、噻吩: 噻吩: 制法: 1.制法: 制法 ⑴工业上: 工业上:
-CH3 KMnO ,OH4 △ N -COOH N
还原: 还原:
H2,Pt 或C2H5OH+Na N
N
28
二、喹啉和异喹啉: 喹啉和异喹啉:
存在: 存在:存在于煤焦油或骨焦油中 制备——斯克洛浦合成法: 斯克洛浦合成法: 1.制备 制备 斯克洛浦合成法
- - - CH2-CH-CH2 OH OH OH H2SO4 -3H2O CH2=CH-CHO - H O=C
+H2SO4+靛蓝 △
兰色
反应灵敏
20
四、吡咯
1、制备: 制备: 为催化剂, ⑴工业上用Al2O3为催化剂,呋喃和氨气相反应 工业上用
+NH3 Al2O3 450℃ + H 2O
O
N
⑵工业上还可用乙炔与NH3通过红热的管子 工业上还可用乙炔与 通过红热的管子
2CH -CH - +NH3 △ + H2
N
N
吡啶
喹啉
4
当环上有取代基时: 2.当环上有取代基时: 当环上有取代基时 ⑴以杂环为母体,编号时从杂原子开始,将杂原子编为1号, 以杂环为母体,编号时从杂原子开始,将杂原子编为1 依次1 依次1,2,3······,或与杂原子相邻的碳原子遍为 ,依 ,或与杂原子相邻的碳原子遍为α, 次为α, , 次为 ,β,γ······
第十八章 杂环化合物 Heterocyclic compounds
N
异喹啉 isoquinoline
NN
喋啶
第二节 五元杂环化合物
一杂五环
O
Furan
S
thiophene
一、结构特点:
N H
pyrrole
p sp2
O
sp2 NH
p sp2
S
呋喃:π6 5 有一对孤电子参与π-π共轭,有另一对孤对电子参与环上π-π共轭 吡咯:π6 5 N上有一对孤对电子参与环上π-π共轭 噻吩:π 6 5 S上有一对孤对电子参与环上π -π 共轭,另一对孤对电子未共轭
N N
O
吡喃 pyriane
N
嘧啶 pyrimidine
N
吡嗪 pyrozine
N N
哒嗪 pyridazine
按环的形成
单杂环
五杂环
一杂五环 二杂五环
O
S
N
H
Furan thiophene pyrrole
N
N
N N H
吡唑 pyrazole
N H
咪唑 imidazole
S
噻唑 thiazole
一杂六环
Cl2
Cl
Cl
Cl
Cl
S
S
ROOC-C C-COOR
△ (Diels-Alder)
COOR
S
COOR
COOR COOR
[H]
[H]
Ni
H
H
Ni
N H
N H
CHCl3 KOH
N H N H
Cl
Cl
N H
CHCl2
N H
CHO
HN
4.吡咯弱碱性和弱酸性
弱碱性:
第十八章 杂环化合物

NH : 供 电 子
2、溶解性: 是与水、油均能混溶的良好溶剂。 烃基R:易溶于有机溶剂
N
孤对电子:与水成氢键,易溶于水。
3、化学性质
(1)N原子的性质 碱性
N
+ HCl
HCl N
盐酸吡啶
含 孤 对 电 子 : 弱 碱
叔胺
N + RX
N R X-
+
(2) 亲电取代:吡啶环看作苯环,N看作NO2。
机化学、有机化学、生理学乃至物理学多学科共同配合,共同努 力的结果。
CH 2OH
维生素 B12
-
H H O O CH 2 HN O=C (CH 2)2 H H2C H C=O H2N N CH 3 CH 3 O P O
H OH
O N N
H CH 3 CH 3 CO-NH 2 CH 2 CH 3 CH 2
芳香性强弱的次序 • 苯 > 噻吩 117 > 吡咯 88 > 呋喃 67 KJ/mol
离域能: 152
取代反应活性的次序 • 吡咯 > 呋喃 > 噻吩 > 苯
如:
+ 4 I2
N H
I I N H
I I
四碘吡咯(伤口消毒剂)
+ H2SO4
S
室 温 S SO3H
α-噻吩磺酸
(CH 3CO) 2O
O
SnCl 2
叶绿素
叶绿素是含于植物的叶和茎中的绿色素,它与蛋白质
结合存在于叶绿体中,是植物进行光合作用所必需的催化 剂,通过叶绿素吸收了太阳能才能进行光合作用。 叶绿素是叶绿素a和叶绿素b的混合物(a:b=3:1),叶 绿素a是蓝色结晶,m.p.150-153℃,其乙醇溶液为蓝绿色, 并有深红色荧光。叶绿素b是深绿色粉末, m.p.120-130℃, 其乙醇溶液为黄色或蓝绿色,并有红色荧光。二者都有旋 光性。
重要的五六元杂环化合物

含两个氮原子的杂环
苯并咪唑(间二氮茚)
H N
CO N H
苯并咪唑酮
Cl
Cl
Cl
NN
Cl 四氯嘧啶
Cl
F
F
NN
F 三氟一氯嘧啶
4.含三个氮的杂环
Cl NN Cl N Cl
三聚氰酰氯(三聚氯氰)
5. 含一个氮和一个硫原子的杂环
43
HC N
HC CH 5S2
重要的五、六元杂环化合物
1
含一个氧原子的杂环
2
含一个氮原子的杂环
3
含两个氮原子的杂环
4
含三个氮的杂环
5
含一个氮和一个硫原子的杂环
1.含一个氧原子的杂环
HC CH HC CH
O
呋喃(氧茂)
H2C CH2 H2C CH2
O
四氢呋喃
CH CH O
苯并呋喃(氧茚,香豆酮)
含一个氧原子的杂环
5 6
7 8
4 3
含一个氮原子的杂环
HC CH HC CH
N H
吡咯(氮茂)
H2C CH2 H2C N C O
H
吡咯烷酮
H2C CH2 H2C N CH2
H
四氢吡咯
N H
吲哚 (苯并氮茂、氮茚)
含一个氮原子的杂环
N
6-羟基(1H)吡啶-2-酮 (吡啶酮)
吡啶
N 喹啉(1-氮萘)
N OH
8-羟基喹啉
3.含两个氮原子的杂环
1 噻唑 (1,3-硫氮茂)
N CH S
苯并噻唑
小结
1. 含氮、氧、硫杂原子的杂环化合物具 有重要的用途; 2. 有些杂环化合物存在多种互变异构体。
六元环杂环化合物记忆口诀

六元环杂环化合物记忆口诀【一层】1.六元环:六甲基吡咯环2.杂环化合物:环内碳原子中,六甲基吡咯环与其他杂环共同构成的化合物【背景介绍】杂环化合物是一类以杂环框架定义的新型化合物,其在药物合成、生物活性和制药工艺等领域一直受到广泛关注,而其中最为重要的是六元环杂环化合物。
六元环杂环化合物,也称为“宽带分子”,是指以六甲基吡咯环为核心组成的杂环系列化合物。
它们具有层状结构,由六甲基吡咯环构成一个层并由多种其他环组成另外几个层,因此上下层被连接起来形成螺旋结构。
它包含众多种类,以及各种类型、结构格局,具有高覆盖面和多组合空间等特点,因此具有重要的研究价值。
【研究内容】1. 六元环杂环化合物的结构表征六元环杂环化合物的结构表征是对其进行有效、准确表征的基础,可以更加全面地描述其局部结构和性质,及其衍生物的结构形状和活性面积。
2. 六元环杂环化合物的合成方法分子设计和合成工艺是六元环杂环化合物研究的两个关键点,设计出具有一致性结构和活性的六元环杂环化合物,体现出六元环杂环化合物的特定性质,方便进行后续的研究并获得特异的作用。
3. 六元环杂环化合物的性质研究性质研究是六元环杂环化合物的主要内容,围绕结构及化学性质的研究已经被深入开展,包括药物的抗菌作用、抗病毒作用、抑制癌症细胞的产生作用、改善人体免疫力和机体新陈代谢能力等,即根据测定结果进行功能性和抗性预测。
4. 六元环杂环化合物的应用六元环杂环化合物在药物研究和生物活性调控等方面有着重要的应用前景。
六元环杂环化合物可以用于抗菌、抗病毒、抑制肿瘤细胞等药物合成,其中包括基于RNA等药物设计和合成。
此外,它们还可以用于材料科学、便携式传感器的设计和制造等。
【结论】通过对六元环杂环化合物的研究,可以发现它们的重要研究价值和重要的应用前景,为后续的研究及其在药物研究、生物活性和制药工艺等方面的应用打下坚实的基础。
此外,六元环杂环化合物的结构表征、分子设计和合成以及性质研究也是值得研究的重要方向,为研究人员提供更多的可能性和机会。
十八杂环化合物

吡啶用过氧羧酸氧化(或30%的H2O2和CH3COOH作用) 时,生成吡啶N-氧化物或称氧化吡啶:
• 吡啶经催化氢化或用乙醇和钠还原,可得六氢吡啶:
第35页/共43页
湿AgOH,Δ ?
吡啶和哌啶的衍生物
尼古丁
第36页/共43页
二、 喹啉和异喹啉
喹啉的制备
Q. Liu
October 13, 2024
Q. Liu
October 13, 2024
第40页/共43页
罂粟花
三、 嘧啶、嘌呤及其衍生物
(1)嘧啶的衍生物——广泛存在于生物体内。
•是核酸的重要组成部分
Q. Liu
October 13, 2024
第41页/共43页
(2)嘌呤及其衍生物
• 嘌呤的结构
• 嘌呤的衍生物(1)
Q. Liu
October 13, 2024
强的亲核试剂
亲核取代 取代产物
与硝基苯相似:吡啶与强的亲核试剂起亲核取代反 应,主要生成取代产物(齐齐巴宾反应):
• 与2-硝基氯苯相似,2-氯吡啶与碱或氨等亲核试剂 作用,可生成相应的羟基吡啶或氨基吡啶:
第33页/共43页
(C)氧化与还原——吡啶比苯稳定,不易被氧化剂氧 化。吡啶的同系物被氧化时总是侧链先氧化而芳杂环 不破坏,生成相应的吡啶甲酸:
• 命名2:位,其次为位,再次为位:
第4页/共43页
含有两个或以上的相同杂原子的单杂环衍生物,编 号从连有取代基(或氢原子)的那个杂原子开始,顺 序定位,使另一个杂原子的位次保持最小:
第5页/共43页
命名3:根据相应的碳环来命名。把杂环看作相应碳环 中的碳原子被杂原子取代而形成的化合物,命名时在 相应的碳环名称前加上杂原子的名称:
杂环化合物大全

杂环化合物大全【药师学习百科】——第5期杂环一概念与碳环相对,指的是成环的原子不仅包括碳,还包括氮、氧或硫等原子。
简单的杂环环系从3到10元不等;可以是脂环(如四氢呋喃),也可以是芳环(如吡啶)。
复杂的杂环系可以由2个或更多简单环并合而成(如吲哚)。
杂环化合物的系统命名法如下把杂环看作碳环中碳原子被杂原子替换而形成的环,称为“某杂(环的名称)”;给杂原子编号,使杂原子的位置号尽量小。
其他官能团视为取代基。
,杂环化合物大全(部分学员对基本杂环方面知识还有所欠缺,本人特整理此表,志于全面,欢迎补充)环数名称分子式结构式衍生物单环)三元环吖丙啶C2H5N环氧乙烷C2H4O环氧丙烷,环硫乙烷C2H4S四元环吖丁啶C3H7N恶丁烷~C3H6O 噻丁环C3H6S五元环含一个杂原子呋喃—C4H4O四氢呋喃呋喃甲醛吡咯C4H5N四氢吡咯~噻吩C4H4S四氢噻吩含两个杂原子吡唑C3H4N2咪唑C3H4N2恶唑噻唑异恶唑: 异噻唑六元环含一个杂原子吡啶C5H5N`六氢吡啶烟酸烟酸胺异烟肼吡喃C5H6O噻喃。
C5H6S含两个杂原子哒嗪"嘧啶吡嗪哌嗪七元环及以上杂䓬䓬指环庚三烯正离子……:稠环五元及六元稠杂环吲哚苯并咪唑<咔唑喹啉` 异喹啉蝶啶7H-嘌呤吖啶<吩嗪吩噻嗪非杂环》C5H6环戊二烯或简易药化学习法一、大多数药物可根据药名提示联想其具有的结构(药名与结构)二、通过具有的结构认识化学名,即看见化学名,知道是什么药物。
三、根据结构分析得出理化性质。
>由此,基本上就掌握了该药的主要性质。
有少部分药物的药名与结构之间找不出任何的联系,这种情况只好下工夫记忆了。
四、药物的用途,通常指的是它属于哪类药物,例如吲哚美辛为非甾体抗炎药,呋噻米为利尿药。
考题一般不要求知道更具体的用途。
另外,执业药师考题上,要求我们记药物的结构式,并不是要求我们默写出每个药物的结构式,而是看到结构式能够知道它是哪个药物,这比默写出结构式要容易了。
常见杂环化合物

吡嗪(pyrazine)
六元杂环苯并环系
5 6
7 8
4 3
N2 1
喹啉
(quinoline)
5 6
7 8
4 3
N2 1
异喹啉
(isoquinoline)
54
O
6
3
7
2喃
苯并--吡喃酮
(benzopyran) (benzo--pyrone)
杂环并杂环
6 5
1N
2 N4 3
7 N
8
N H
γ 4
5
3β
6 N 2α 1
γ 4
5
3β
6 O 2α 1
O
4
5
3
6O 2 1
4
5
3
6
2
OO
1
吡啶(pyridine) 吡喃(pyran)
4
5
3
4
5
N3
γ-吡喃酮 (γ-pyrone)
5
α-吡喃酮 (α-pyrone)
4 N3
6
N2
N
1
6
2
N
1
6
2
N
1
哒嗪(pyridazine) 嘧啶(pyrimidine)
9
嘌呤(purine)
产品结 构式
丙二酰脲
中文别 名
英文别 名
分子式 分子量
巴比妥酸 ,丙二酰脲,2,4,6-三羟基 嘧啶
Barbituric acid,2,4,6-Trihydroxy pyrimidine,Malonylurea, 2,4,6Trioxohexahydropyrimidine,2,4, 6-(1H,3H,5H) Pyrimidinetrione
杂环化合物

噻吩
噻唑
N
N H
吡咯
N
N H
咪唑
N H
N
吡唑
六元杂环
N
吡啶
N
嘧啶
O
吡喃(无芳香性)
苯并杂环
N N
N H
N N H
吲哚
N
喹啉
N
异喹啉
杂环并杂环
嘌呤
记 忆 口 诀:
氮五吡咯六吡啶;
间氮咪唑和嘧啶; 吲哚喹啉左并苯; 嘧咪相稠是嘌呤。
指出下列杂环化合物中,各含有哪些 杂环母核?
NH N N N H CH2 N
属于富电子结构 结构决定性质,五元杂化富电子结 构会决定它们与苯环哪些性质上的 不同呢?
三.化学性质—3.亲电取代反应 重点
亲电取代活性与环上电子云密度有关—— 电子云密度越大,带正电的亲电试剂的进 攻越容易。 *1 亲电取代反应的活性顺序为:
N H
>
O
>
S
>
吸电子诱导:O(3.5) > N(3.0) > S(2.6) 给电子共轭:N > O > S 综合:N贡献电子最多,O其次,S最少
*2 杂原子和取代基的定位效应
A 杂原子的定位效应:邻位
取代反应主要发生在α-C 上
B 取代基的定位效应:以噻吩为例:
(1) α- 位上有取代基
X = o、 p - 定位基
3 5
Y = m - 定位基 (主) (次)
5 4
(次 ) X
(主 )
S
S
Y
(2) β- 位上有取代基
X = o、 p - 定位基 X (次)
黄连素(小檗碱)是喹啉类生物碱,存在于黄连、黄柏和三颗针等植物
第十八章 杂环化合物

呋喃: 存在于松木焦油中,无色液体,bp.31.36℃ 噻吩: 存在于煤焦油中, 无色液体, bp. 84.16℃ 吡咯: 存在于煤焦油和骨焦油中,无色液体
bp.130~131℃
2、松木片反应——呋喃、吡咯、噻吩的鉴定反应: 呋喃: 其蒸气遇到盐酸浸湿的松木片——呈绿色 吡咯: 其蒸气遇到盐酸浸湿的松木片——呈红色 噻吩: 在浓H2SO4作用下与松木片反应——呈蓝色 (噻吩最好用如下反应鉴定)
乙酰化和烷基化反应:
呋喃和吡咯的烷基化 反应大多生成聚合物
吡咯、呋喃、噻吩的亲电取代反应说明:
取代基主要进入α-位 对试剂及反应条件必须有所选择和控制: 卤代反应: 不需要催化剂,要在较低温度下进行;
硝化反应: 不能用混酸硝化,一般是用乙酰基硝酸酯 (CH3COONO2)作硝化试剂,在低温下进行
• 环上只有一个杂 原子时,有时也把 靠近杂原子的位置 叫位,其次为位 ,再次为位:
特殊编号!
• 含有两个或以上的相同杂原子的单杂环衍生物,编 号从连有取代基(或氢原子)的那个杂原子开始, 顺序定位,使另一个杂原子的位次保持最小:
异噁唑
噁唑
第二节 五元杂环化合物
一、呋喃、噻吩、吡咯杂环的结构: 芳香性:苯 > 噻吩 > 吡咯 > 呋喃
二、呋喃、噻吩、吡咯的性质 松木片反应; 亲电取代反应活性: 吡咯 > 呋喃 > 噻吩 > 苯 取代基主要进入α-位 卤代、硝化、磺化时试剂要求; 加成反应;吡咯的弱碱性和弱酸性; 了解——糠醛、噻唑、咪唑和吲哚、卟啉化合物
返回教学内容
第二节 五元杂环化合物
重点讨论呋喃、噻吩、吡咯 一、呋喃、噻吩、吡咯杂环的结构 :
大学有机化学课件-杂环化合物

β —CHO
γ 4 5 6
3β 2α
COOH
1 吡啶—3—甲酸 (尼古丁酸 —吡啶甲酸 或烟酸)
N
CH3
4 5
3 N
Br
2
4 5
N S1
2
3
N1 H
5—甲基咪唑
4—溴噻唑
9
稠杂环化合物(P232)
5 6 7 8 N 1 4 3 2
6 7 8 1 5 4 3
N2
喹啉 (quinoline)
糠醛是不具α—氢的芳醛,能进行类似于苯甲 醛的反应。
NaOH
__
O
CH2OH
+
O
__
COONa
O
2
O
__
CHO
康尼查罗反应
OH KCN 乙醇
__
CH___ C___
O
O
安息香缩合反应
O CH3COONa CHO + (CH3CO)2O 150C CH=CHCOOH O
30
普尔金反应
O
CH3COONa CHO + (CH3CO)2O 150C
4β 5α
O 1
β 3 α2
4β 5α
β 3
4β 5α
β 3 α2
呋喃(furan)
1 α2 N H
吡咯(pyrrole)
S 1 噻吩(thiophene)
唑的命名 含有两个或两个以上杂原子的五元杂环,若至少有 一个杂原子是氮时,则该杂环化合物称为唑。
4 5 N H1 3 N2
5 4 N3 2
4 5
N H
>
O
>
S
>
>
12
有机化学复习-杂环化合物

N SO3
(2)吡啶的亲核性 吡啶的烷基化
N + CH3I
+ N CH3
I
N甲基吡啶盐 • N-甲基吡啶盐的重排
NaOH 300 C I 重排
o
+ N CH3
N H CH3
I CH3
N CH3 NaOH
CH3
I N H N
2) 亲电取代反应
取代位置和反应活性
PhN2 X N H
N H
N N Ph
环上已有取代基对亲电取代取向的影响
Electron Donating Group
E
A EDG
+ p
E
A
EDG
HNO3//Ac Ac2O O HNO 3 2 CH S S CH3 3 (AcONO2)) (AcONO 2 O O2N N
2
S S 70%
NO2
S 85%
NO S2
85%
+ + O N NO2 2
S O2 N
NO S 2
E
A
EWG
15% 15%
EWG
EWG
E
+ m
COOH COOH
Br2 Br 2 CHCOOH COOH CH 33 Br Br SS
COOH COOH
A
E
A
SS
2)五员芳杂环的其它反应
(i)还原成饱和杂环化合物(催化氢化)
5 4 4 3 3 65 7 6 8 7
4
2
6 7
3
5N 6
77
O21 N1
第18章 杂环化合物

N Pyridine
O Pyran
吡啶
吡喃
六元 环
N N
含两个杂原子:
N
N
N Pyrimidine
N Pyrazine
Pyridazine
哒嗪
嘧啶
吡嗪
N N Quinoline N Isoquinoline N
N N N
稠杂 环
喹啉
异喹啉
N N N H Purine N
蝶啶
吖啶
N H Indole
+E
N
+
E
进攻β 位
N
+
H
+
E H N
+
E H
N
吡啶的亲电取代反应示例 (a )磺化
SO3
H2SO4, HgSO4
N
70% 230 C ,
o
N H
+
(b )硝化
H2SO4, KNO3
NO2 N
N
Fe, C ,22% 330
o
(c )卤化
Br2 N 300 C
o
Br + N
Br
Br
N
吡啶可被催化加氢为六氢吡啶(哌啶)。 吡啶可被催化加氢为六氢吡啶(哌啶)。 六氢吡啶的碱性( =2.7) 六氢吡啶的碱性(pKb=2.7)比一般脂肪族仲 胺略强
单环 含一个杂原子
O Furan N H Pyrrole S Thiophene
呋喃
N
吡咯
N N H Imidazole
噻吩
N S Thiazole
五元环
O Oxazole
噁唑
咪唑
N H Pyrazole N
杂环化合物——精选推荐

第十六章杂环化合物和生物碱学习要点:掌握各类常见杂环化合物如呋喃、噻吩、吡咯、吡啶等的结构、命名和化学性质,了解常见生物碱的分类及提取方法。
环状有机化合物中,构成环的原子除了碳原子外还有诸如氮、氧、硫等其它原子,该类结构的化合物一般具有芳香性,这类有机化合物都属于杂环化合物。
组成杂环的原子除碳原子以外都叫杂原子。
杂环上可以具有一个、两个或者多个杂原子。
杂环氢化后可以形成饱和的或者部分饱和的环。
习惯上把这种氢化后的环看作杂环的衍生物。
如:四氢呋喃可以看作呋喃的衍生物。
所以含有这些环的化合物,不论饱和的、不饱和的或者芳香结构的都可以称为杂环化合物。
O O四氢呋喃呋喃tetrahydrofuran furan至于某些含有杂原子的环状化合物如:环状酸酐、内酯、环氧乙烷等,因它们的性质同酐、酯、醚,所以习惯上不看作杂环化合物。
第一节杂环化合物的分类和命名杂环类化合物可以按照芳香性分为非芳香性杂环和芳香性杂环两大类。
非芳香性杂环化合物具有环内杂原子所具有的典型性质,例如:四氢噻吩是典型的硫醚,六氢吡啶是典型的胺类化合物。
S N H四氢噻吩六氢吡啶tetrahydrothiophene piperidine杂环类化合物按照环来分类可以分为单杂环和稠杂环两大类。
常见的单杂环为五元杂环和六元杂环。
稠杂环是由苯环与单杂环或由两个以上的单杂环稠合而成的。
杂环的命名常用音译法。
按照外文名词音译,用带“口”字旁的同音汉字表示。
例如:O 呋喃N 吡啶SNH噻吩thiophene吡咯pyrroleNNN嘧啶pyrimidine喹啉quinolineN H吲哚indolefuranpyridine如杂环上有取代基时,取代基的位次从杂原子算起依次用1,2,3,4,5等(或α,β,δ等)编号。
如杂环上不止一种杂原子时,则从O ,S ,N 顺序依次编号。
编号时杂原子的位次数字之和应最小。
例如:N H N2-羧基咪唑COOH12345N H N 123453-苯基吡唑表16-1常见杂环化合物的分类和名称对于没有特定名称的杂环,可以看作是相应碳环中碳原子被杂原子取代的衍生物来命名。
有机合成:杂环化合物

学
性
质 利用此反应可分离、提纯吡啶,也可用吡啶
吸收反应中所生成的酸。
36
1. 碱性和成盐反应
吡 啶 吡啶还可以与三氧化硫和三氧化铬形成复合物:
的
3
3
化
学
3
温合的磺化试剂,也可用作氧化剂
性
质
3
3
温合的氧化剂,可使羟基氧化在醛的阶段
37
2.与卤代烃/酰卤/酸酐反应
吡
啶
与卤代烃反应成季铵盐
的
化
学
1.选择基本环。 附加环[数字-英文字母]噻唑 2.标注基本环的稠合边。附加环[数字-d]噻唑 3.标注附加环原子。 附加环[1,2-d]噻唑 4.写上附加环。 苯并[1,2-d]噻唑
1 cN db 2 Sa
苯并[d]噻唑 【苯环稠合边可略去】
24
2. 标识稠合边 附加环[数字-英文字母]基本环
1.选择基本环。 附加环[数字-英文字母]呋喃 2.标注基本环的稠合边。附加环[数字-b]呋喃 3.标注附加环原子。 附加环[2,3-b]呋喃 4.写上附加环。 噻吩并[2,3-b]呋喃
15
①从杂原子开始编号,杂原子位次为1。当环上只有一个
杂原子时,也可把与杂原子直接相连的碳原子称为α位, 其后依次为β位和γ位。
2-呋喃甲醛(糠醛)
8-羟基喹啉
(α-呋喃甲醛)
(不叫8-喹啉酚)
16
②若含有多个相同的杂原子,则从连有氢或取代基的杂 原子开始编号,并使其他杂原子的位次尽可能最小。
(4-甲基咪唑)
1. 选定基本环
2. 对稠合边进行表征
3. 对周边(整体分子)
1
进行编号
3
2
21
第六讲 六元杂环化合物的构建

Reaction mechanism
Halberkann variant
This reaction is also known as the Skraup-Doebner-Von Miller quinoline synthesis, and is named after the Czech chemist Zdenko Hans Skraup (1850-1910), and the Germans (Doebner) (1850-1907) and (1848-1899). When the α,β-unsaturated carbonyl compound is prepared in situ from two carbonyl compounds (via an Aldol condensation), the reaction is known as the Beyer method for quinolines. The reaction is catalyzed by lewis acids such as tin tetrachloride and scandium(III) triflate and bronsted acids such as p-toluenesulfonic acid, perchloric acid, amberlite and iodine.
第六讲 六元杂环化合物的构建
第一节. 吡啶的合成 第二节. 喹啉的合成 第三节. 其它六员杂环化合物的合成Leabharlann 第一节. 吡啶的合成R
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
六氢吡啶,哌啶 (piperidine)
3、Synthesis of pyridine ring system
韩奇(Hantzsch A)合成法
R'' CHO + R O NH3 O R R N H R O C OR' R'' R'OOC COOR'
PhLi N N Li Ph 110oC 8h N Ph
(3)Oxidation
oxidation of side chain oxidation
H3C N
oxidation of pyridine ring
oxidation of nitrogen atom
CH 3 N
HNO 3 N
COOH
N
Explain:
2-,6-position
H N Nu H Nu N H Nu N H Nu N H N Nu H NU N H Nu N N H Nu H NU
Nu 3-,5-position
-
N
4-position
N
H
H N
H Nu N N
Nu
Nu
N
H NU N H NU
a、Leaving-group-replaced nucleophilic substitutions
O R'O C
1,4-二氢吡啶 (1,4-dihydropyridine)
NO 2
EtOOC H 3C N H
COOE t CH 3
尼群地平(nitrendipine)
Review: the synthesis of pyrrole derivatives
R O O R + R'NH2 H+ R
N N NH 2 NH 2
(3)Oxidation reactions
Oxidation occurs on benzene ring.
KMnO 4 N H+
N COOH COOH
KMnO 4 N H+
COOH N COOH
(4)Reduction reactions
Reduction maily occurs on pyridine ring.
N Cl
CH3OH,
N
OCH 3
Br Br N
NH3, H2O 160oC
NH 2 Br N
b、Hydrogen-replaced nucleophilic substitutions
NaNH 2 N Ph N(CH 3)2 N NH - Na + H2O N NH 2
齐齐巴宾反应(Chichibabin reaction)
The activity of electrophilic substitutions :
>
N H O
>
S
>
>
N
The electrophilic substitutions of pyridine mainly occur on 3-,5-positions.
Explain:
2-,6-position
N
+ H
E H
+
N
H E H E N N N
+
H E H E
E+
N
3-,5-position
N
E
H
E
H
E
H
E
4-position
N N + N
H
H N
H E N N
+
E
E
H E
N +
H E N
Examples:
Cl 2, AlCl3 100oC Br 2, Cat. 300oC
N N
Cl
Br
N
浓 H2SO4 HgSO4,220oC 浓 H2SO4,浓HNO3 300oC, 1d
+
Ph
O +
OR' Ph O
NH4OAc
Summary:
structure electrophilic substitution
pyridine
chemical properties
nucleophic substitution
oxidation
reduction
home
synthesis
Hantzsch method
. .
. .
第十八章 杂环化合物 Chap 18 Heterocyclic Compounds
N ..
. .
任课教师: 石 枫
所属单位:化学化工学院
1
2
N N CH 3
尼古丁(nicotine)
COOH N
烟酸 (nicotinic acid)
§18-3 六元杂环化合物
(Six-membered heterocyclic compoundddition R R'' R
O C OR' R
-H2O
O H2N
R'' COOR' 1)H2O R 2) -CO2 R N R
Improvement of Hantzsch method:
Ar CHO CH3 R + O NH4OAc O Ar CH3 MWI R H2O R N R
O O
HO H3CO
H3CO N OCH3
N
奎宁 (quinine)
黄连素 (berberine )
二、喹啉和异喹啉 (quinoline and isoquinoline)
1、Structure
. . . . . . .
N
.
.
. .
.
..
.
. . .
.
.
.
. . N .
quinoline
isoquinoline
N CH 3
HNO 3
COOH N
Pyridine ring is more stable than benzene ring in acidic oxidant.
N KMnO 4 H
H2O2 N HOAc N O
+
N
COOH
吡啶-N-氧化物 (pyridine-N-oxide)
Application: Change the position of electrophilic substitution in pyridine to 4-position.
一、吡啶 (pyridine) 1、Structure of pyridine
. . . . . .
.
sp
2
. p . . sp2
. . N
sp2
N ..
N
2、Chemical properties of pyridine
electrophilic substitution nucleophic substitution pyridine ring pyridine oxidation reduction reaction with electrophic reagents
Review:
Cl
Cl NH 2
NH 2
NO 2 2
NO 2 NO
2
NH 3 NH
NO
3
NO NO 2 2
NO NO 22
OCH OCH 3 3 Cl Cl
Cl Cl Cl Cl CH CH 3ONa 3ONa
CH CH 3OH 3OH
NO NO 2 2 Cl
NO NO 2 2 OCH
CH3ONa
[H] N [H] N NH [H] = Sn/HCl, Na/EtOH, 2 mol H2/Pt N H
end
Exercise:
2. Synthesizing
Ph
Analysis: CH 3
CH 3
end
N
Ph
CH 3 CH 3 CHO CH 3 Ph
Ph
N
Ph
Ph
O
+ O NH4OAc
CH 3 ROOC Ph N
ROOC COOR CH 2 Ph Ph
CH 3 CHO H2C O
COOR H3C
COOR
N N
SO3H
NO 2
Examples:
Br 2, HOAc
N NH 2
Br N NH 2
20oC
Br2, Cat
N
Comparison :
Br N
300 C
o
Br
Br2/H2O
Br NH 2 NH 2 Br
(2) Reactions with nucleophilic reagents
i) The activity of pyridine on nucleophilic substitutions is higher than benzene. ii) The nucleophilic substitutions of pyridine mainly occur on 2-,6- and 4positions.
S. Tu et al., Tetrahedron, 2007, 63, 381-388.
Ar CHO CH3 Ar' + O NH4OAc O O Ar MWI DMF Ar' N O
茚-1,3-二酮
茚并吡啶
(indene-1,3-dione)
