石蜡基因组提取实验SOP
磁珠法石蜡包埋组织基因组DNA 提取详细步骤

磁珠法石蜡包埋组织基因组DNA 提取详细步骤注意事项需要自备材料:二甲苯、无水乙醇、异丙醇、磁铁或磁架、1.5mL离心管(最好低吸附的离心管);需要去除RNA自备RNase A(100mg/ml),在蛋白酶K消化这一步加入4 μl RNase A;◆整个过程请勿离心,以免磁珠不可逆聚集而影响提取效果。
实验准备磁珠用前一定要充分混匀;◆56℃和80℃加热源;◆使用前需在Buffer FTGWI中加入相应体积的无水乙醇,使乙醇比例占80%。
操作步骤1.脱蜡:①切下5 片厚度约为10μM(重约10mg)的组织块,尽量切去石蜡部分,置于1.5ml的离心管中。
加入1ml二甲苯,并振荡30s,然后室温放置5分钟。
20℃,14000 x g 离心3 min,用移液器移尽上清。
②加入1ml 100%乙醇振荡离心管20s,然后20℃,14000 x g 离心3 min,用移液器移去上清,室温干燥组织沉淀15min。
注意:任何残留的乙醇可能会影响蛋白酶K的消化以及减少核酸的得率2. 消化:加300 μL Buffer FTGL,振荡至彻底悬浮,用匀浆机进行匀浆破碎(使其彻底无大块组织残留),再加入20 μL蛋白酶K(PK),于56℃温浴15min (期间不时混匀),然后置于80℃ 15min;注意:①组织大于50mg时需要增加蛋白酶K (PK)的用量。
3. 裂解结合:将离心管从80℃加热器上离开,冷却至室温,在上清液中加入600 μl Buffer FTGB和600uL 异丙醇,最后加入磁珠悬浮液(MB) 30 μL(使用前充分重悬),颠倒混匀5分钟;将离心管放置于磁力架上,待磁珠完全吸附后吸弃液体。
4. 漂洗:(1) 将离心管从磁力架上取下,向离心管中加入500 μl Buffer FTGW0,轻微涡旋振荡5S,使磁珠重悬,将离心管放置于磁力架上,待磁珠完全吸附后吸弃液体,重复该步骤一次。
(2) 将离心管从磁力架上取下,向离心管中加入500 μl Buffer FTGW I,轻微涡旋振荡5S,使磁珠重悬,将离心管放置于磁力架上,待磁珠完全吸附后吸弃液体。
从石蜡组织中提取DNA

石蜡包埋组织DNA提取方法
一脱蜡:
1、切取石蜡组织5-10片(5um—7um)放入1.5ml的离心管中;
2、加入1ml二甲苯,55°10min,离心轻弃上清,重复两到三次(因组织而定);
3、加入1ml无水乙醇,室温三分钟,重复二次,离心弃上清,并干燥待酒精挥发。
二消化:
例:设置250ul体系,加入2x裂解液125ul、10%SDS 5ul、蛋白酶k25ul(1mg /ml)、纯水95ul(以上根据裂解液、SDS、蛋白酶K的配置浓度不同和组织量多少而需重新设置),55°消化过夜(按组织的消化情况而定,若没消化完全可适量加入蛋白酶k),直至组织完全液化。
三抽提:
1、加纯水至500ul,加入Tris饱和酚250ul,颠倒混匀,静置5min,再加入250ul 氯仿,颠倒混匀静置5min ,瞬时离心,
2、取出上清液至1.5ml离心管中,加入500ul氯仿,轻混匀,室温静置5min瞬时离心;取上清400ul(吸取液体量可比总体积小,避免吸到蛋白)
四沉淀DNA :
1、加入3M醋酸钠40ul(醋酸钠的量是吸取上清体积的十分之一),轻混匀,加入880ul无水乙醇(两倍体积)混匀,-20°过夜。
五收集DNA
1、13000rpm 15min,离心轻弃上清
2、加入75% 1ml酒精轻洗,即刻13000rpm 5min 轻弃上清,空气干燥(可用55℃),待干燥为止。
六加入50-100ul纯水溶解,30分-1小时。
4-石蜡切片组织DNA抽提-26Aug2011

庄建立/ Jerry Zhuang 厦门艾德生物医药科技有限公司
2011.08.26
ANNUAL BUSINESS REVIEW
概览
EGFR 突变检测申请 病理学评估
DNA 抽提
样品处理
DNA 定量(质控) EGFR突变检测
DNA测序
ARMS
-2-
内容
1、样品处理 2、DNA抽提
-9-
石蜡组织切片DNA提取:实验原理
二甲苯&QIAgen DNA试剂盒: 通过二甲苯的去蜡以及蛋白酶K使DNA从石蜡组织中裂解释 放,并通过DNA吸附柱有效提取DNA 关键点:
二甲苯:溶解并去除石蜡 蛋白酶K:消化与DNA结合的组蛋白 DNA吸附柱:有效快速收集DNA,有效减少PCR反应抑制剂对后续实
验的影响
- 10 -
石蜡组织切片DNA提取步骤
1.石蜡组织切片收集 及鉴定
2.组织切片刮取 3.去除石蜡
4.裂解消化DNA 5.吸附柱收集DNA
每个样本以约4~5cm25µm的石蜡组织 切片量为宜,每张片子应由病理医生进 行病理鉴定,并圈出肿瘤区域
使用一次性解剖刀从组织片中刮取石蜡 组织至离心管中,尽量防止组织碎片飞 散造成交叉污染
- 12 -
控制交叉污染
必须严格控制样品间交叉污染
一个样品用一个解剖刀片 实验前后清洁工作区 经常换手套 无PCR产物区域
- 13 -
Thanks!
- 14 -
向含有石蜡组织的离心管中加入二甲苯, 通过二甲苯溶解石蜡并去除,再用无水乙 醇去除二甲苯。
通过蛋白酶K消化组蛋白,消化裂解过夜。 (至少加入20µL蛋白酶K,若组织量比较 多,可适当提高加入蛋白酶K的量,使组 织能够完全裂解)
石蜡标本DNA提取

石蜡标本DNA提取第一天:1.脱蜡①加入二甲苯1.2-1.3ml,震荡混匀,70℃,10min孵育,13000rpm离心2min,弃上清。
②重复①操作2-3次。
2.脱二甲苯:①加酒精即无水乙醇1.2-1.3ml,震荡混匀(剧烈),13000rpm离心1.5min,弃上清。
②重复①操作2-3次。
3.开盖,70℃,静置30min,直至管中无水乙醇挥发完全。
4.加入180ul ATL Buffer,20ul蛋白水解酶混匀,放入56℃水浴锅孵育过夜。
第二天:1.观察组织消化程度,若组织消化不完全,加适量蛋白水解酶(5-10ul),56℃孵育0.5-1.0h。
2.90℃金属浴1h。
3.待温度冷却至室温,加入200ul AL Buffer,轻轻混匀后,迅速加入200ul无水乙醇,上下颠倒混匀。
4.13000rpm离心10-20s,将上清移至吸附柱内,勿吸入白色沉淀。
5.13000rpm离心1min,至离心柱内液体全部离心至收集管中。
6.弃收集管,将吸附柱放于新的收集管中,加入AW1 Buffer 500ul,13000rpm离心1min。
7.弃去收集管中液体,加入AW2 Buffer 500ul,13000rpm离心1min。
8.弃收集管,将吸附柱放于另一个新的收集管中,13000rpm离心3min。
9.弃收集管,将吸附柱放于干净的1.5ml EP管中,开盖,70℃,金属浴放置20-30min,至酒精挥发完全。
10.离心柱中央加入50-100ul ATE Buffer(70℃预热),置70℃5-10min。
11.13000rpm离心1.5min。
12.将DNA保存于-20℃。
百泰克石蜡组织基因组DNA自动提取试剂盒(磁珠法)说明书

北京百泰克生物技术有限公司BioTeke Corporation地址:北京海淀区留学人员创业园电话:************传真:************网址: Email:****************一般实验室使用,仅用于体外石蜡组织基因组DNA自动提取试剂盒(磁珠法)自动、快速提取石蜡组织基因组DNA目录号:AU7111116次使用手册2016年11月,第4版北京百泰克生物技术有限公司BiotekeCorporation一、试剂盒组成、储存、稳定性本试剂盒在室温储存12个月不影响使用效果。
注意事项1.为避免降低活性,方便运输,提供蛋白酶K为冻干粉状,使用时可短暂离心后,加入1mL灭菌水溶解,-20℃保存,经常使用可以放在4℃。
2.避免试剂长时间暴露于空气中发生挥发、氧化、pH值变化,各溶液使用后应及时盖紧盖子。
3.核酸提取仪在运行前请先检查仪器是否正常,磁力架是否在水平位置。
4.深孔板在核酸提取仪中放置时要平稳,并用底部卡槽卡紧,避免晃动。
二、操作步骤1)将石蜡组织切成4~10um厚的薄片,用灭菌小镊子将切片放入1.5ml离心管中,组织的量在5-20mg左右(5-10片),加入400uL溶液B,90°C 水浴30min。
2)12,000rpm离心2min,石蜡会浮于液体表面,组织沉于管底,将除石蜡外的液体及组织转移至预装深孔板的第1、7列,加入20ul蛋白酶K。
裂解温度设置65°C,按照下面程序,点击“运行”开始实验,运行40分钟之后加入300ul无水乙醇。
步骤孔位名称等待时间(min)混合时间(min)磁吸时间(s)混合速度容积运行状态11裂解0400慢500否22转移磁珠0130慢300否31吸附核酸02060慢500否42洗涤0030中400否53漂洗0330中400否64漂洗0230中500否75漂洗0130中600否86洗脱21560中200否92弃磁珠000慢0否3)DNA可以存放在2-8℃,如果要长时间存放,请放置在-20℃。
石蜡标本DNA提取

石蜡标本DNA提取第一天:1.脱蜡①加入二甲苯1.2-1.3ml,震荡混匀,70℃,10min孵育,13000rpm离心2min,弃上清。
②重复①操作2-3次。
2.脱二甲苯:①加酒精即无水乙醇1.2-1.3ml,震荡混匀(剧烈),13000rpm离心1.5min,弃上清。
②重复①操作2-3次。
3.开盖,70℃,静置30min,直至管中无水乙醇挥发完全。
4.加入180ul ATL Buffer,20ul蛋白水解酶混匀,放入56℃水浴锅孵育过夜。
第二天:1.观察组织消化程度,若组织消化不完全,加适量蛋白水解酶(5-10ul),56℃孵育0.5-1.0h。
2.90℃金属浴1h。
3.待温度冷却至室温,加入200ul AL Buffer,轻轻混匀后,迅速加入200ul无水乙醇,上下颠倒混匀。
4.13000rpm离心10-20s,将上清移至吸附柱内,勿吸入白色沉淀。
5.13000rpm离心1min,至离心柱内液体全部离心至收集管中。
6.弃收集管,将吸附柱放于新的收集管中,加入AW1 Buffer 500ul,13000rpm离心1min。
7.弃去收集管中液体,加入AW2 Buffer 500ul,13000rpm离心1min。
8.弃收集管,将吸附柱放于另一个新的收集管中,13000rpm离心3min。
9.弃收集管,将吸附柱放于干净的1.5ml EP管中,开盖,70℃,金属浴放置20-30min,至酒精挥发完全。
10.离心柱中央加入50-100ul ATE Buffer(70℃预热),置70℃5-10min。
11.13000rpm离心1.5min。
12.将DNA保存于-20℃。
石蜡组织DNA提取

Goelz氏DNA提取方法的主要步骤 .切除多余石错,暴露组织 .将组织切碎(最大径<0.5mm),称重;3.溶于TE9提取液(组织<50mg/5ml.50-500mg/10ml),高速混悬2-3min,于48℃放置24h TE9提取液的制备500mmol/L Tris 20mmol/L EDTA 10mmol/L NaCl 1%SDS 500 μg/ml 蛋白酶KpH8.0 4.再次混悬组织,加入蛋白酶K至终浓度1mg/ml,SDS至2%,孵育40h;5.用等体积酚-氯仿溶液抽提3次;6.2.5倍体积乙醇沉淀DNA 7.-70℃放置2-4h 8.9 000xg离心1h 9.沉淀物用70%乙醇洗1次0.干燥,TE(pH7.2)溶解。
不同类型的基因分析所要求的DNA质量和数量不同。
Southern 印迹杂交分析需要10-15μg大片段DNA(>20kb),因为杂交前要进行相诮的限制性内切酶消化和凝胶分离不同片段长度的DNA。
故DNA提取要求高,小片段DNA存在会直接影响杂交信号。
与之相反,多聚酶链反应(PCR)则可在相对粗制的小片段DNA存在会直接影响杂交信号。
与之相反,多聚酶链反应(PCR)则可在相对粗制的小片段DNA样本上进行,分析所需的DNA很少,0.5μg甚至更少即可。
PCR的模板DNA制备方法很多,除上述两种方法外,还有更简便的直接水煮法(Slebos,et al,1990;Smit, et al, 1988 )、蛋白酶消化法(Impraimet al.1987;Brice,et al.1989)。
这些方法不经过酚-氯仿-异戊醇抽提、DNA纯化等步骤,直接将组织放在去离子水中煮沸10min 或在蛋白酶K缓冲液中消化4h,DNA即可释放出来。
此提取物可直接用作模板,进行PCR扩增,但是,我们发现直接水煮法和蛋白酶消化法提取的DNA,扩增率较低,且征对性不好。
这可能是由于DNA附着的蛋白质去除不净而影响DNA变性和与引物的结合,亦可能是由于标本中残留的固定剂等成分对Taq DNA多聚酶的抑制所致。
12. 石蜡组织切片DNA提取操作流程-09Apr2010

轻弹混匀 2 次。之后每间隔 1 小时再加等量蛋白激酶 K,至少两次。如 果组织过大,需增加至 6 次蛋白酶 K 的加入。55°C 孵育过夜。 4.99°C 孵育 10 分钟。 5.将离心管置于 4°C 离心机中 10500g 离心 15 分钟。 6.将离心管放置于冰上 5 分钟硬化上层石蜡。 7.吸取石蜡层下的溶液至一新的 1.5mL 离心管中。注意吸取时应尽量小心 以避免吸入石蜡等污染物。 步骤四:QiAmp DNA Mini Kit 提取 DNA 1.将 500µL Buffer AL 加 入含有样本的离心管中,振荡混匀 15 秒。 2.56°C 孵育 10 分钟,离心数秒去除管壁上的液滴。 3.加入 500µL 的无水乙醇,振荡混匀 15 秒,离心数秒去除管壁上的液滴。 4.吸取离心管中溶液 500µL 加至 QiAamp spin 柱,盖上盖子, 14,000 rpm 离心 1 分钟。倒掉收集管中的滤出液。 5.重复步骤 4 直至所有的样本均被移至 QiAamp spin 柱中。将 QiAamp spin 柱置于一个新的收集管中。 6.加 AW1 Buffer 500µL 至 QiAamp Spin 柱,盖上盖子,14000 rmp 离心 1 分钟。将 QiAamp Spin 柱移至一个新的收集管中。 7.加 AW2 Buffer 500µL 至 QiAamp Spin 柱,盖上盖子,14000 rmp 离心 3 分钟。倒掉收集管中的滤出液,将 QiAamp Spin 重新放回收集管中。 8.重复步骤 7。 9.14,000 rpm 空离 1 分钟。 10. 将 QiAamp Spin 柱置于新的 1.5mL 离心管中,将 100µL 去离子水加入 至 QiAamp Spin 柱中心,盖上盖子,室温放置 5 分钟,14000rmp 离心 1 分钟。 11. 将 DNA 置于-20°C 冰箱保存。
QIAgen_FFPE_DNA_kit石蜡组织提取DNA说明书

1) 实验试剂的准备a. 配置QIAamp DNA FFPE Tissue试剂盒缓冲液检查Buffer ATL及Buffer AL原液是否有沉淀物形成。
有沉淀形成时,须升温至70℃同时适度晃动,使沉淀物全部溶解。
b. 配置Buffer AW1在19ml Buffer AW1原液中加入25ml(96-100%)无水酒精,盖紧瓶盖并摇匀。
在试剂瓶上作已加入无水酒精的标记,同时须标注配置时间。
配置好的溶液可在室温(15-20℃)下保存一年。
c. 配置Buffer AW2在13ml Buffer AW2原液中加入30ml(96-100%)无水酒精,盖紧瓶盖并摇匀。
在试剂瓶上作已加入无水酒精的标记,同时须标注配置时间。
配置好的溶液可在室温(15-20℃)下保存一年。
2) 操作步骤a. 使用刻刀修整石蜡组织上组织周围多余的石蜡。
b. 根据组织大小不同切取10μm厚的石蜡组织切片4~10张。
如石蜡标本组织面暴露于空气中时间过长,须舍弃前2~3张石蜡组织切片。
c. 将切取的石蜡组织切片置入已做好标记的1.5ml eppendorf tube中,加入1ml 二甲苯。
盖紧盖子并使用vortex振荡器充分振荡10s。
d. 使用Thermo离心机在全速状态下离心2min。
实验全程须保持在室温状态下进行(15~25°C)。
e. 离心结束后,使用移液器吸取并遗弃上部已溶解石蜡的二甲苯溶液,操作中应注意不要将下方的组织也同时丢弃。
f. 加入1ml 96%~100%无水酒精,再次vortex振荡器充分振荡。
目的是用酒精充分溶解组织中残留的二甲苯。
g. 在室温下全速离心2min。
h. 使用移液器吸取并遗弃上部已溶解二甲苯的酒精溶液,操作中应使用细小的移液器头并应注意不要移去下方荡洗后的组织。
i. 在室温下打开eppendorf tube盖子,静置至所有残余酒精全部挥发。
j. 加入180μl buffer ATL及20μl蛋白酶K,vortex振荡器充分振荡。
10-石蜡组织切片DNA提取操作流程(ADx)

石蜡组织切片DNA提取操作流程实验目的本实验使用二甲苯和QIAamp DNA FFPE Tissue 试剂盒相结合的方法抽提石蜡包埋组织DNA,有效减少PCR抑制剂对后续实验的影响。
实验材料∙二甲苯∙吐温 20∙一次性解剖刀∙ 1.5 ml 离心管∙无水乙醇∙振荡器∙干浴∙冷冻离心机∙QIAamp DNA FFPE Tissue Kit (QIAGNE Cat No: 56404)实验步骤步骤一:切片组织刮取步骤二:DNA脱蜡及消化步骤三:QIAamp DNA FFPE Tissue Kit 提取DNA步骤一:切片组织刮取经过病理评估的组织切片,需事先将肿瘤区域标识出来。
通常本方法使用适当数量5µm厚度切片,刮取肿瘤组织面积约4cm2抽提的DNA量足够检测之用。
DNA提取的得率和质量很大程度上取决于组织本身的性质以及切片制备情况。
1.将相应的样本号标识于1.5mL离心管上。
2.吸取微量(2µl ~ 8µl,根据肿瘤标识区域面积决定吸取的量)的吐温20滴于切片肿瘤标识区域正面以防止刮取切片时组织飞散。
3.用一次性的解剖刀刮取组织至 1.5mL离心管中,注意需刮肿瘤标识区域的组织。
(注意在刮取组织的过程中,尽量仔细小心)4.重复步骤2直至该样本的所有切片均已被刮下转至同一离心管中.步骤二:DNA脱蜡及消化1.加入1 ml二甲苯至样本管中,盖紧并混匀10秒。
2.室温(15-25℃)下最大离心速度(14000rpm)离2分钟。
3.小心的吸去上清,切勿吸去颗粒(沉淀),弃上清液。
4.加入1 ml 无水乙醇到沉淀中,震荡混匀(去除二甲苯)。
5.室温(15-25℃)下最大离心速度(14000rpm)离2分钟。
6.吸去上清,切勿吸去沉淀,弃上清液。
7.打开离心管盖子,室温或37℃晾干,约10分钟,直到乙醇完全蒸干。
8.向沉淀中加入180µl Buffer ATL,再加入20µl 蛋白酶K,震荡混匀9.56℃消化过夜,直至样品完全裂解。
石蜡包埋组织DNA提取

石蜡包埋组织DNA提取操作步骤:1.样本处理:制作石蜡切片2.将装有石蜡切片样本的1.5ml离心管中加入1ml二甲苯,震荡均匀后56度温育5min,12000r室温离心2min,用枪头将上清吸出,注意不要去除掉沉淀,重复该步骤3次。
3.向弃沉淀后的离心管内加入1ml无水乙醇,震荡均匀后12000r室温离心5min,用枪头将上清吸出,注意不要去除掉沉淀,重复该步骤2次。
4.室温放置5-10min,充分挥发乙醇,使样品呈现干燥无水状态。
5.加入200μl缓冲液GA和20μl蛋白酶K(可根据样本数量提前将GA和蛋白酶K混合分装,使充分混匀与方便加样),充分混匀后56度温育至样本完全裂解(根据具体实验室情况选择时间,必要和时间允许时可选择过夜温育)。
6.将离心管至于90度孵育1h(原则上不少于30min)。
7.在离心管中加入220μl缓冲液GB和250μl无水乙醇(可根据样本数量提前将GB和无水乙醇混合分装),充分混匀12000r室温离心2min使沉淀沉于管底。
8.准备样本数量相对应的吸附柱(标注样本名称信息等)和收集管,将上述离心管中液体移入吸附柱中(不要吸取沉淀),8000r室温离心2min,将收集管中液体重新移入吸附柱中再8000r室温离心2min,倒掉废液,吸附柱放回收集管中。
9.向吸附柱中加入500μl缓冲液GD,8000r室温离心1min,弃废液,将吸附柱放回收集管中。
10.向吸附柱中加入600μl缓冲液PW,8000r室温离心1min,弃废液,将吸附柱放回收集管中。
重复一遍。
11.将收集管12000r室温空离2min,弃收集管,将吸附柱开盖置于预先准备的1.5ml新离心管中悬空放置2-5min,以彻底晒干吸附材料中残余的漂洗液(主要为乙醇,乙醇残留会对酶反应有抑制作用)。
此时可以将TE置于65度预热。
12.向吸附膜中间部位悬空加入40μl洗脱缓冲液TE,静置3-5min,12000r离心2min。
EASYspin-石蜡包埋组织RNA快速提取试剂盒操作方法及步骤说明书精品

EASYspin 石蜡包埋组织RNA 快速提取试剂盒目录号:RN3001适用范围:适用于快速从福尔马林固定、石蜡包埋组织样品中提取总RNA ,RNA 可用于反转录PCR ,荧光定量PCR 。
❖ 试剂盒组成、储存、稳定性:本试剂盒在室温储存12个月不影响使用效果。
储存事项:1. 所有的溶液应该是澄清的,如果环境温度低时溶液可能形成沉淀,此时不应该直接使用,可在37℃水浴加热几分钟,即可恢复澄清。
2. 不合适的储存于低温(4℃或者-20℃)会造成溶液沉淀,影响使用效果,因此运输和储存均在室温下(15℃-25℃)进行。
3. 为避免降低活性,方便运输,提供蛋白酶K 为冻干粉状,收到后,可短暂离心后,加入0.5毫升灭菌水溶解(终浓度40mg/ml )。
因为反复冻融可能会降低酶活性,试剂盒组成 保存50次(RN3001) 裂解液PKD 室温 15 ml 结合液RBC 室温25 ml 漂洗液RW 室温10ml 第一次使用前按说明加指定量乙醇 蛋白酶K 粉 40mg/ml -20℃ 20mg RNase-free H 2O 室温 10 ml 基因组DNA 清除柱和收集管室温 50套 RNA 吸附柱RA 和收集管 室温 50套因此溶解后立即按照每次使用量)分装冻存,-20℃保存。
4.避免试剂长时间暴露于空气中产生挥发、氧化、PH值变化,各溶液使用后应及时盖紧盖子。
❖注意事项1.所有的离心步骤均在室温完成,使用转速可以达到13,000 rpm的传统台式离心机,如Eppendorf 5415C 或者类似离心机。
2.样品处理量绝对不要超过基因组DNA清除柱和RNA吸附柱RA处理能力,否则造成DNA残留或者产量降低。
不同组织细胞种类RNA/DNA相差极大,例如胸腺脾脏DNA含量丰富,超过5mg就会超过柱子处理能力。
COS细胞RNA含量丰富,超过3x106细胞就会超过柱子吸附能力。
所以开始摸索实验条件时,如果不清楚样品DNA/RNA含量时宁可使用较少的样品处理量,如不超过2个10μm厚度石蜡切片。
石蜡组织DNA提取SOP

石蜡组织DNA提取SOP提取石蜡包埋组织基因组DNA标准操作规程1. 目的:由石蜡包埋组织中提取出基因组DNA,以保证后续检测的正常进行。
2. 操作者:病理科负责取材的技术员、病理医师以及分子病理技术员。
3. 准备工作:3.1 56℃和90℃水浴锅3.2二甲苯或无毒脱蜡液(Deparaffinization Buffer)3.3无水乙醇3.4蛋白酶K溶液:每管干粉状的蛋白酶K中加入1.1ml蛋白酶K 溶解液,颠倒让蛋白酶K充分溶解,分装保存于-20℃。
3.5洗涤液GW1使用前,须加入17ml无水乙醇进行稀释。
3.6洗涤液GW2使用前,须加入80ml无水乙醇进行稀释。
4. 步骤:4.1标本接收:分子病理技术员负责核对送样登记表所记录的病理号与标本编号是否一致,要求10um肿瘤组织病理石蜡切片不少于4张,可以是已经切好并放在载玻片上的切片;所有切片均应是未经染色的白片。
4.2脱蜡(可按以下方案A或方案B去除石蜡):方案A:二甲苯去除石蜡(经典方案)A1:石蜡蜡卷A1-1:将石蜡切片置于1.5ml离心管中,加入1ml二甲苯,盖紧涡旋振荡10s,13000r/min 离心2min,吸去上清,保留沉淀;如脱蜡不完全,可重复该步骤一次。
A1-2:向离心管中加入1ml无水乙醇,涡旋振荡混匀,13000r/min离心2min,吸弃上清,用移液器吸头小心将组织摊开粘附于管壁,置于恒温加热器(预先设置为37℃)10min晾干,直到乙醇完全挥发,之后按4.3步骤进行操作。
A2:石蜡切片A2-1:将组织切片置于二甲苯浸泡10分钟,两次;A2-2:无水乙醇浸泡5分钟,一次;A2-3:蒸馏水中浸泡,刮取肿瘤区域到1.5ml离心管中,之后按4.3步骤进行操作。
方案B:无毒脱蜡液(Deparaffinization Buffer)去除石蜡B1-1:加入0.5ml Deparaffinization Buffer至样品中,剧烈涡旋10s。
宝生物石蜡切片DNA提取试剂盒说明书

5.在 Microtube 中配制下列 PCR 反应液。 DNA 提取液 10×Ex Taq Buffer dNTP Mixture(250 μM each) Each Primer(final 10 pmol) TaKaRa Ex Taq(0.625 U/25 μl) dH2O
Polymerase:
TaKaRa Ex Taq
PCR 反应条件:
94℃ 60 sec
94℃ 30 sec
55℃ 60 sec
35 Cycles
72℃ 60 sec
72℃ 5 min
【冷冻切片来源 DNA 的 K-ras 12 基因、β-globin 基因的扩增结果】
K-ras 12 107 bp
β-globin 408 bp
β-globin 262 bp
M12345M1234512345
3% Agarose 5 μl 电泳
M:pHY Marker 1:包埋组织切片提取液 1 μl 的扩增结果 2:包埋组织切片提取液 2.5 μl 的扩增结果 3:冷冻切片提取液 1 μl 的扩增结果 4:冷冻切片提取液 2.5 μl 的扩增结果 5:Negative Control
2. 颠倒混合DEXPAT®试剂,向装有实验材料的Microtube中加入 0.5 ml(约 20 滴)。分取DEXPAT® 时要不断混合试剂,防止树脂不均。静置时吸附PCR阻害物质的树脂会沉降,故每次分取DEXPAT®之 前都要将其颠倒混匀。 -1-
3. 盖上 Microtube 盖,100℃加热处理 10 分钟。此时使用 Heating Block 比较方便。Microtube 盖 事先应用注射器的针头扎上孔,防止因内压上升导致 Microtube 盖弹起,造成溶剂溅出。同时请用 铝铂纸将 Microtube 盖包上,防止水份蒸发。
DNA提取操作规程-石蜡切片Omega试剂盒方法

1 目的依据《EZAN.FFPE DNA KIT D3399-01》使用说明书及实际使用情况制定标准操作规程,确保正确、安全操作。
2 适用范围适用于石蜡切片中DNA提取的规范操作。
3 职责实验操作人员负责本程序的进行,实验室负责人负责该程序的监控。
4 标准操作程序4.1实验前准备4.1.1 55-60°C水浴;70°C水浴。
4.1.2. OB蛋白酶加入1.5ml Protease Storage Buffer溶解后,分装保存于-20℃。
4.1.3. DNA Wash Buffer中加入80ml无水乙醇,并于室温保存。
4.2实验操作4.2.1 刮取切片上组织部分的样品至1.5ml离心管,加入1ml二甲苯,剧烈涡旋10s 混匀。
4.2.2 10,000×g离心2min,小心吸掉上清(不要吸到切片)。
4.2.3 加入1ml 无水乙醇涡旋混匀,10,000×g离心2min,小心吸掉上清(不要吸到切片)。
4.2.4 打开盖子放置15min或直到乙醇挥发。
4.2.5 加入200μL Buffer T1和20μL OB蛋白酶。
4.2.6 55℃水浴3h或至组织消化,每隔20-30min混匀一次。
如果有需要也可消化过夜。
4.2.7 90℃处理60min。
4.2.8 室温静置10-30min,室温10,000×g离心5min去除杂质,小心转移上清至一新1.5ml 离心管中。
4.2.9 加入220ul Buffer BL涡旋混匀。
4.2.10 加入250ul的无水乙醇,高速涡旋15秒混匀。
4.2.11 转移混合液至套有收集管HiBind DNA柱子中,室温下8,000×g离心1 min,弃去滤液。
4.2.12 把柱子装在收集管,加入500ul HB Buffer,室温下8,000×g 离心1min,弃去滤液。
4.2.13 把柱子装在新收集管,加入500ul DNA Wash Buffer,室温8,000×g离心1min。
石蜡切片组织DNA抽提

蔡旭
- 17 -
EGFR 突变检测申请 病理学评估
DNA 抽提
样品处理
DNA 定量(质控)
EGFR突变检测
DNA测序
ARMS
-3-
1. EGFR 突变检测申请
-4-
样品处理
组织蜡块
切片
病理学评估
DNA
实验/数据
存放位置, 使用情况, 是否返还 样品移交记录(实验室间)
LIMS (实验室信息管理系统) Microsoft Excel or Access 手写记录
实验部分:安全注意事项 实验室内必须戴专用安全眼镜 实验室内必须穿实验服 办公区内不准穿实验服 实验室内动手做实验前必须戴手套
- 16 -
实验部分:分组
组 姓名
邢岳士麓超
#1
张稷 陈建
韩晓红
#2
王帅 吴传勇
李喆
#3
冯芬 时利
组 姓名
刘毅
#4
王高文 李建民
王玉艳 谭小军
#5
张晔 李喆
-5-
DNA抽提前
福尔马林固定石蜡包 埋组织(FF-PET)
病理学评估 确认肿瘤细胞
数大于50
-6-
3. DNA 抽提
福尔马林固定石蜡包埋组织
受破坏DNA(固定步骤)
降低DNA 得率
需要可靠的DNA抽提方法
后续分析困难
-7-
DNA抽提方法
• 商业试剂盒 vs. 实验室固有方法
试剂盒
实验室固有方法
通过吐温20释放使DNA从细胞核中释放, 蛋白酶K消化组蛋白,消化裂解过夜,期 间至少重复加入4µL 10mg/mL蛋白酶K两 次,每次间隔1小时以上
QIAamp-DNA-FFPE-Tissue-Handbook中文版
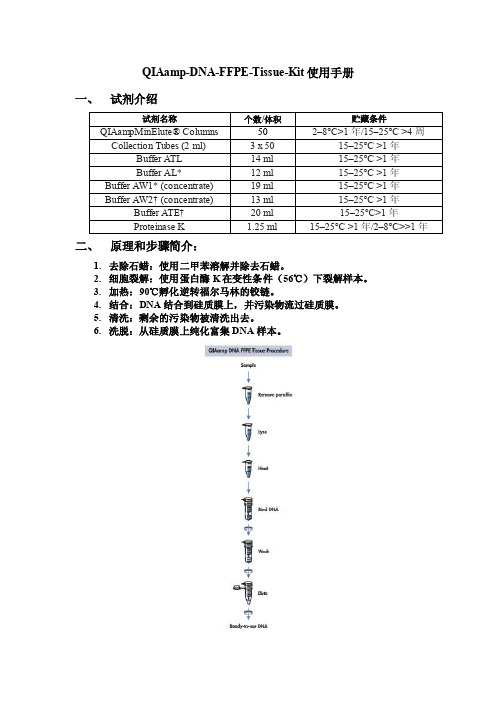
QIAamp-DNA-FFPE-Tissue-Kit使用手册一、试剂介绍二、原理和步骤简介:1.去除石蜡:使用二甲苯溶解并除去石蜡。
2.细胞裂解:使用蛋白酶K在变性条件(56℃)下裂解样本。
3.加热:90℃孵化逆转福尔马林的铰链。
4.结合:DNA结合到硅质膜上,并污染物流过硅质膜。
5.清洗:剩余的污染物被清洗出去。
6.洗脱:从硅质膜上纯化富集DNA样本。
三、所用试剂和耗材四、重要注意事项:1.石蜡样本准备:(1)4—10%福尔马林固定组织样本(2)固定时间14-24h,不宜太长易使DNA片段降解,不利于下游检测(3)完全脱水的样本优先包埋,残留的二甲苯抑制蛋白酶K的消化切片要求:(1)切片厚度:>10μm(2)切片面积:>250mm2(3)切片个数:>8片2.共纯化RNA:(1)QIAamp DNA FFPE Tissue Kit提取的样本RNA也会被纯化出来。
虽然RNA不影响整体PCR的反应,但可能会抑制下游一些酶的反应。
(2)如果需要提取出无RNA的DNA样本,按照protocol在样品中加入100 mg/ml RNase A。
(3)如果需要纯化RNA,可以选择RNeasy® FFPE Kit进行纯化。
3.洗脱DNA(1)允许的最小洗脱体积:20μl(2)最大洗脱体积建议不超过:100μl(3)洗脱Buffer ATE洗脱前应放在室温,加入Buffer ATE洗脱时,室温放置5min可提高DNA产量。
(4)提取的DNA样本贮藏:2-8℃可保存>24h;-20℃可保存>1周4.缓冲液准备(1)Buffer AW1:加入25ml 无水乙醇到19ml Buffer AW1浓缩液瓶中。
在瓶子标注―ethanol has been added‖出打勾,在15–25°C可保存一年。
注:使用前摇晃混匀。
(2)Buffer AW2:加入30ml 无水乙醇到13ml Buffer AW1浓缩液瓶中。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
石蜡切片基因组提取实验SOP
一、实验准备
1、实验所用材料
1)试剂QIAGEN#56404(石蜡组织DNA)
#19101(RNA酶)
2、准备步骤
1)准备1.5ml,2ml离心管,高温灭菌。
2)新试剂盒准备
Buffer ATL:检查有无沉淀,有的话70℃水浴,并摇晃。
Buffer AT:检查有无沉淀,有的话70℃水浴,并摇晃。
Buffer AW1:加入25ml乙醇到19ml Buffer AW1,用前摇晃。
Buffer AW2:加入30ml乙醇到13ml Buffer AW2,用前摇晃。
3)准备材料
刀片;无水乙醇;二甲苯;冰;
4)水浴锅温度调好(56℃,90℃)
5)桌子喷洒干净
6)实验人员带手套。
二、实验步骤
1、用刀片划取5个玻片上的石蜡,放入1.5ml离心管中;短暂离心,使蜡块聚
集在管底。
2、加入1ml二甲苯,vortex10s,全速离心2min,吸取上清。
3、加入1ml无水乙醇,vortex10s,全速离心2min,吸取上清。
4、重复上述操作;之后空转1min;吸掉全部乙醇后,晾干,使乙醇完全挥发
掉(残留的乙醇会影响下游的反应)。
5、加入180μL Buffer ATL,涡旋振荡混匀。
6、加入20μL的蛋白酶K(平时4℃放置),混匀。
7、恒温56℃1h(期间需不断震荡,时间可以延长至完全裂解)。
8、恒温90℃1h(必须恒温,如果只有一个水浴锅,可将样品从56℃取出,置于
室温,待水浴锅温度升至90℃时将样品放入。
时间不能超过1h,否则容易导致DNA断裂)。
9、轻轻离心,甩一下管壁伤的水珠。
10、冷却到室温后,加入2μLRNase A(100mg/ml),室温2min。
11、加入200μL Buffer AL,涡旋震荡混匀;加入200μL的乙醇,涡旋震荡混匀。
(也可以一起加入,最后混匀)。
12、将全部液体转移到柱子中,并8000rpm离心1min,之后放入新的收集管
中。
13、加入500μL的Buffer AW1,12000rpm离心1min;弃掉废液,并让入新的收
集管中。
14、重复上一步骤;
15、全速离心3min(14000rpm),使膜上的乙醇挥发。
16、加入60μL Buffer ATE;(损失5μL),室温孵育5min,离心1min。
17、吸取1μL DNA,测DNA的浓度。
附:
1)纯DNA:OD260/OD280≈1.8(>1.9,表明有RNA污染;<1.6,表明有蛋白质、酚等污染)。
