13种杀菌剂对葡萄灰霉病病菌的室内毒力及田间防治效果
葡萄 病害

葡萄病害1、白粉病:主要危害葡萄的叶、果、蔓部位。
防治药剂:环唑醇、乙唑醇、甲基硫菌灵、腈菌唑、嘧菌酯、氟菌唑、咪鲜胺、苯醚甲环唑等药剂。
2、房枯病:主要危害果梗、穗轴、叶片和果粒。
防治药剂:石硫合剂、百菌清、多菌灵、甲基硫菌灵、代森锰锌、福美双+多菌灵等药剂。
3、灰霉病:是葡萄春季引起花穗腐烂的主要病害。
主要危害花序、幼果和成熟的果实。
有时候也会危害新梢、叶片和果梗。
防治药剂:甲基硫菌灵、多抗霉素、苯醚甲环唑.丙环唑、腐霉利、嘧菌环胺、噻菌灵、异菌脲、苯菌灵、己唑醇等药剂。
4、炭疽病:葡萄近成熟期引起的果实腐烂的主要病害之一。
主要危害果粒,造成果粒腐烂。
严重时候也会危害枝干、叶片。
防治药剂:多菌灵、代森锰锌、丙森锌、中生菌素、丙环唑.多菌灵、咪鲜胺、醚菌酯、溴菌腈等药剂。
5、黑腐病:主要为害果实、叶片、叶柄和新梢等部位。
防治药剂:多菌灵、甲基硫菌灵、代森锰锌、百菌清、苯菌灵、苯醚甲环唑、唑菌胺酯等药剂。
6、白腐病:主要危害果穗、穗轴、果粒、枝蔓和叶片。
防治药剂:福美双、百菌清、代森锰锌.波尔多液、代森锌、甲基硫菌灵、嘧菌酯、戊唑醇、氟硅唑、苯醚甲环唑等药剂。
7、黑痘病:果面出现深褐色斑点,逐渐形成圆形病斑,周围紫褐色,中部灰白色,形如鸟眼。
病斑仅限于果表,不深入果内,但是果味酸,影响品质。
药剂防治:喹啉铜、丙森锌、百菌清、代森锰锌、甲基硫菌灵、戊唑醇、氟硅唑、噻菌灵、苯醚甲环唑、烯唑醇等药剂。
8、霜霉病:主要危害叶片,也危害新梢、叶柄、卷须、幼果、果梗及花序等幼嫩部分。
防治药剂:烯酰吗啉、霜脲氰、喹啉铜、咪唑喹啉铜、松脂酸铜、波尔多液、代森锰锌、精甲霜灵.代森锰锌、唑菌胺酯等药剂。
葡萄灰霉病咋防效果好?

葡萄灰霉病咋防效果好?
作者:董信
来源:《果农之友》 2015年第11期
葡萄灰霉病俗称“烂花穗”,也称灰腐病,是目前葡萄生产和贮藏过程中发生比较严重的
一大病害,生长期间主要危害葡萄的花序、幼小或成熟期的花穗以及果梗、新梢、叶片等,贮
藏期间该病对葡萄造成的损失也最为严重。
防治措施:
(1)选用抗病品种。
(2)结合修剪搞好冬季清园,消灭越冬菌源。
幼芽萌动前喷施5 波美度石硫合剂或21%过氧乙酸水剂300倍液。
棚室栽培的,扣棚前结合整地用50%异菌脲悬浮剂1 000 倍液处理土壤。
(3)增施腐熟有机肥,有徒长现象的要控制氮肥施用量,芽前用15%多效唑可湿性粉剂每
株5~6 克对水穴浇于树下,或于开花末期喷施15%多效唑可湿性粉剂500~800 倍液,抑制新梢
生长,增强抗病能力。
(4)药剂喷雾除治(尤其是开花前后)。
(a)50%异菌脲悬浮剂1 000 倍液。
(b)70%
嘧霉胺水分散粒剂1 500倍液。
(c)50%腐霉利可湿性粉剂900 倍液。
(d)“菌思奇”牌25%啶菌恶唑乳油750 倍液。
董信(河北省邯郸市魏县瑞丰农资有限公司河北邯郸056800)。
12种杀菌剂对葡萄灰霉病菌的室内毒力测定

12种杀菌剂对葡萄灰霉病菌的室内毒力测定姜彩鸽;杨小伟;张怡;王国珍;王广录;方治永【摘要】为筛选出对葡萄灰霉病有良好防治效果的杀菌剂,本试验采用菌丝生长速率法和离体叶片法分别测定12种不同作用机制的杀菌剂对葡萄灰霉病菌的室内毒力.结果表明:生物制剂在离体叶片法预防作用试验中的毒力效果远好于治疗作用,可见该种制剂的保护作用更优,适于病前预防.化学药剂在试验中均表现出了较稳定且较强的毒力,尤其是咯菌腈、啶酰菌胺、啶菌恶唑、腐霉利及氟啶胺对葡萄灰霉病菌的抑制作用明显高于其他药剂,可在生产中协调施用.【期刊名称】《宁夏农林科技》【年(卷),期】2017(058)008【总页数】4页(P33-35,封2)【关键词】杀菌剂;葡萄;灰霉病菌;毒力;EG50值【作者】姜彩鸽;杨小伟;张怡;王国珍;王广录;方治永【作者单位】宁夏农林科学院植物保护研究所,宁夏银川 750002;宁夏大学农学院,宁夏银川 750021;宁夏农林科学院植物保护研究所,宁夏银川 750002;宁夏农林科学院植物保护研究所,宁夏银川 750002;御马国际葡萄酒业(宁夏)有限公司,宁夏青铜峡751600;御马国际葡萄酒业(宁夏)有限公司,宁夏青铜峡751600【正文语种】中文【中图分类】S436.631.1葡萄是我国果树中的大树种之一,其产量和栽培面积居世界前列[1],但葡萄灰霉病已成为葡萄生产中常见、危害最大的病害之一,在我国南方地区和北方温室葡萄生产中发生尤为严重[2],是制约我国葡萄生产的一大障碍。
灰霉病菌的腐生性强,它可以通过侵染果实、幼苗及贮藏器官等途径导致病害发生,从而造成巨大的经济损失。
虽然有高效杀菌剂和先进的贮藏技术,但每年因灰霉病造成的葡萄产后损失依然高达50%,一般损失在20%~30%[3-4]。
另外,它还给葡萄酒带来不良味感,同时使葡萄酒不耐陈酿,降低葡萄酒的质量[5]。
宁夏贺兰山东麓地区是全国最大的葡萄酒地理标志保护产区,随着葡萄种植面积不断扩大以及单一的生态环境的持续,有害生物的生态适应性也不断提高,葡萄灰霉病已成为宁夏葡萄生产中的主要病害之一。
几种杀菌剂对葡萄病害的防治效果

7 .3 药后 1 2 5%, 0 d的平 均防效可达 7 .2 1 5%。7%代森锰锌 0 可湿性粉剂 5 0 液在药后 7 c 0倍 l 的平均防效达 5 .7 药后 3 5%, l 0d的平 均防效为 4 . 8 4 4 %。4  ̄ 施佳乐 10 0倍液、5% 0o , / 0 0 农利 灵 l 0 倍液 、5 %速克 灵 l 5 0 2 0 0 0 倍液与 5%甲基托布 0 津 50 0 倍液之 间的 田间防效差 异达极显著水平 , 同时多重比
关键 词 : 葡萄 ;灰 霉 病 ; 白腐 病 t药 剂 防 治 ; 防效
葡萄灰霉病和白腐病是葡萄生产上的主要病 害。葡萄灰
级, 病花穗 占 1 2以下;3 ,病花穗 占 1 2 / , 级 , / 级 / ~3 4 4 病 花穗 占 3 4以上。病穗率 ( = ( , / %) 发病穗数 /调查总穗数 ) X10 0 ;病情指数 [ ( ∑ 各级病穗数 X 应级数值 )/ ( 相 调
后l 的平均防效仍达7 .8 Od 7 7 %。5 %农利灵干悬浮剂l2 0 O 0 倍液在药后 7 的平均 防效达 7 .4 而药后 1 的平均防 d 8 5 %, 0d 效仍达 7 .5 5 6 %。5 %速克灵可湿性粉 剂 1 5 0 0 0 倍液在药后 7 d 的平均 防效达 7 .6 药后 1 的平均防效可达7 .6 5 5 %. 0d 30 %。
霉病 主要 危害花穗 和花刚凋谢 的小 果穗 , 是避雨栽培葡萄的
主要 病害; 葡萄 白腐病俗称 水烂或穗烂 , 主要危害果穗和枝 梢, 也可危害n 片 , 十 露地 栽培 的葡萄 发病 多且重 ,葡萄果 实 着色期和成熟期为白腐病发病盛期。两种病 害对 葡萄 的产量
葡萄病害用对杀菌剂才能事半功倍
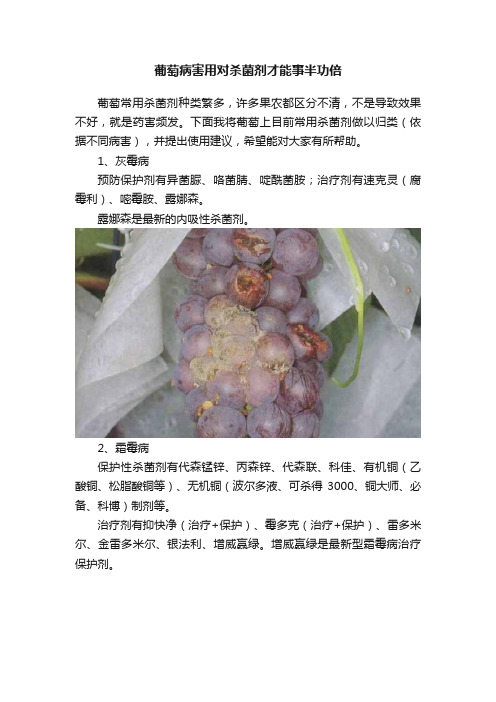
葡萄病害用对杀菌剂才能事半功倍葡萄常用杀菌剂种类繁多,许多果农都区分不清,不是导致效果不好,就是药害频发。
下面我将葡萄上目前常用杀菌剂做以归类(依据不同病害),并提出使用建议,希望能对大家有所帮助。
1、灰霉病预防保护剂有异菌脲、咯菌腈、啶酰菌胺;治疗剂有速克灵(腐霉利)、嘧霉胺、露娜森。
露娜森是最新的内吸性杀菌剂。
2、霜霉病保护性杀菌剂有代森锰锌、丙森锌、代森联、科佳、有机铜(乙酸铜、松脂酸铜等)、无机铜(波尔多液、可杀得3000、铜大师、必备、科博)制剂等。
治疗剂有抑快净(治疗+保护)、霉多克(治疗+保护)、雷多米尔、金雷多米尔、银法利、增威赢绿。
增威赢绿是最新型霜霉病治疗保护剂。
3、穗轴褐枯病预防保护剂剂有代森锰锌、丙森锌、代森联等。
治疗剂主要是三唑类,如苯醚甲环唑、氟硅唑、丙环唑、戊菌唑、四氟醚唑等。
甲氧基丙烯酸酯类及其复配制剂也有效,如阿陀、拿敌稳、百泰、阿米西达等。
4、白腐病预防保护剂有代森锰锌、丙森锌、代森联等。
治疗剂主要是三唑类,基本和穗轴褐枯病防治药剂相同。
5、炭疽病预防保护剂有代森锰锌、丙森锌、代森联咪鲜胺及咪鲜胺锰盐等。
治疗剂主要有溴菌腈、丙环唑等。
6、黑痘病预防保护剂有代森锰锌、丙森锌、代森联等。
治疗剂主要是三唑类,如苯醚甲环唑、丙环唑、氟硅唑等。
7、房枯病预防保护剂有代森锰锌、丙森锌、代森联等。
治疗剂主要是三唑类及甲氧基丙烯酸酯类。
8、酸腐病主要是灭杀醋蝇,常用药剂有灭蝇胺、高氯氟等拟除虫菊酯类。
9、溃疡病:指真菌性溃疡病预防保护剂有代森锰锌、丙森锌、代森联及甲氧基丙烯酸酯类。
治疗剂主要是抑霉唑等。
以上是我个人观点,欢迎大家共同讨论!。
不同化学药剂对葡萄灰霉病的防治效果

不同化学药剂对葡萄灰霉病的防治效果作者:刘晓芬来源:《现代农业科技》2018年第16期摘要试验采用6种化学药剂防治葡萄灰霉病,结果表明,在发病前施药防治葡萄灰霉病,供试的6种化学药剂均具有一定的防效,在处理剂量范围内对果树安全。
第4次药后15 d,宁南霉素1 000、2 000 mg/kg效果最好,防效分别为90.32%和92.51%;其后为40%苯醚·甲硫可湿性粉剂500、1 000 mg/kg,30%戊唑·咪鲜胺可湿性粉剂500、1 000 mg/kg,速克灵500、1 000 mg/kg,防治效果均在85%以上。
生产上建议在发病前施药,每隔15 d 喷1次,连喷4次。
关键词葡萄灰霉病;化学药剂;田间药效中图分类号 S436.631 文献标识码 A 文章编号 1007-5739(2018)16-0093-01葡萄灰霉病是由灰葡萄孢菌侵染引起的,是葡萄生产中最严重的病害之一。
该病一般于每年7—8月在田间出现症状,9月为高发期。
一旦发病,果实将会腐烂,丧失价值[1-2]。
近年来,由于果农过于追求产量,致使灰霉病发生机率和程度逐渐增加,一般会造成减产3成左右,重者在5成以上。
为此,本文研究了6种化学药剂对葡萄灰霉病的防治效果,以期筛选出防治葡萄灰霉病的理想药剂。
1 材料与方法1.1 试验地概况试验在朝阳市龙城区果园进行,供试葡萄品种为巨峰,株行距为5 m×6 m。
该园每年都发生灰霉病,试验期间为了防治其他病虫害,喷施供试药剂的同时还喷施了杀虫剂,但对试验无影响。
1.2 供试药剂供试药剂有多抗霉素、施佳乐、40%苯醚·甲硫可湿性粉剂、30%戊唑·咪鲜胺可湿性粉剂、宁南霉素、速克灵。
1.3 试验设计试验共设 13个处理,分别为多抗霉素250、500 mg/kg;施佳乐1 000、1 500 mg/kg;40%苯醚·甲硫可湿性粉剂500、1 000 mg/kg;30%戊唑·咪鲜胺可湿性粉剂500、1 000 mg/kg;宁南霉素1 000、2 000 mg/kg;速克灵500、1 000 mg/kg;以清水作空白对照(CK)。
葡萄灰霉病的防治

葡萄灰霉病的防治葡萄灰霉病又叫葡萄灰腐病,病原菌为灰葡萄孢。
葡萄灰霉病是目前世界上发生比较严重的一种病害,在所有贮藏发生的病害中,它所造成的损失最为严重。
1.症状特点:在贮藏期间,罹病部位开始呈圆形,有时界限分明,在白色品种上呈褐色,在红色品种上呈浅褐色,在蓝色品种上由于颜色变异很小,病斑难以区别。
在侵染点有明显裂纹,用很小的压力,果皮即脱离感病部位,把内部组织暴露在外面,这便是灰霉病侵染的早期特征“脱皮”阶段。
到腐烂前期为止,仅有表皮和亚表皮细胞层被离析。
涨压可引起果皮开裂,病原菌通过开裂处形成灰色分生孢子梗和分生孢子而生长,致使产生灰色霉层和腐烂。
在冷藏温度下,病原菌产生少量孢子,菌丝体呈白色,而在葡萄园内的侵染则呈灰色。
果实感病后,其内部化学成分发生显著变化,单宁及某些芳香物质遭到破坏。
2.发病规律:雨、雾、露水及高湿度最适病菌孢子的产生及侵染。
孢子发芽最适温度为26℃,侵染的速度取决于温度、湿度及果皮表面是否存在露珠。
如果果皮上存在水分,病菌也可以不通过伤口侵染。
在12℃以下侵染需12~24小时,在2℃以下为18~36小时。
只要孢子发芽所需要的湿度得到满足时,低温并不能阻止孢子发芽。
灰霉菌可以在0℃以下生长,所以它是葡萄贮藏中最严重的病害。
观察表明,在贮藏过程中,灰霉病的侵染是从穗梗开始的,穗梗表皮组织对真菌的抗性远远低于果粒对真菌的抗性。
葡萄采收后,穗梗水分即开始急剧蒸腾而很快萎缩,失去生活能力和对霉菌的抵抗能力,这时霉菌即开始在穗梗的病部和枯死部位急剧生长,然后不经过表皮组织而进入浆果内部,这时霉菌在危害了中央维管束及相邻的果肉之后,便使浆果脱落,而后全部腐烂。
3.防治方法:(1)药剂防治:防治贮藏葡萄灰霉病的为害,必须从加强葡萄园病虫防治开始,按时喷布杀菌剂。
从花前到采收前,每隔10~15天喷一次500~800倍多菌灵或800~1000倍甲基托布津,能有效减少贮藏中灰霉病引起的腐烂。
对葡萄有明显效果的主要杀菌剂

对葡萄有明显效果的主要杀菌剂1、20%苯醚甲环唑水分散粒剂20%苯醚甲环唑是三唑类高效内吸性杀菌剂,杀菌彻底,对炭疽病、白腐病、白粉病、黑痘病、黑腐病等有优异防效,能兼治穗轴褐枯病。
对葡萄安全,不会抑制生长,前期综合防治时,与保护剂配合施用3000~5000倍液;后期对炭疽病治疗处理穗部时施用1000~1500倍液;最好不要和铜制剂混用,如需混用,要增加10%用药量。
对藤稔,夏黑,高妻这3个葡萄品种,连续阴天时不要施用,有药害。
2、80%霜脲氰水分散粒剂霜脲氰是具有渗透性的霜霉病治疗剂,在药剂喷洒到的地方,能进入葡萄植株内部,杀菌和抑菌。
目前由于大量应用,抗药性比较重。
常见的品种是由72%或36%与代森锰锌混配的药剂,因霜脲氰含量低,建议按照保护性杀菌剂施用。
在葡萄园施用霜脲氰,建议施用纯的霜脲氰制剂,例如80%霜脲氰水分散粒剂,施用2000~3000倍液,也可以3000~4000倍液与保护性杀菌剂(如喷克、喷富露等)混合施用。
3、25%凯润(吡唑醚菌酯)乳油或60%百泰(6%吡唑醚菌酯和54%代森联)水分散粒剂吡唑醚菌酯是最新型甲氧基丙烯酸酯类的杀菌剂之一,是在醚菌酯基础上改进后的高效线粒体呼吸抑制剂,杀菌谱广,对葡萄霜霉病、炭疽病、白粉病等都有较好防效。
且持效时间长,安全性好,对作物有刺激生长作用,可用于葡萄各个生长期,25%凯润施用2000~4000倍液,60%百泰施用800~1500倍液。
4、80%戊唑醇水分散粒剂戊唑醇是高效内吸性杀菌剂,对白腐病、白粉病、黑痘病、黑腐病等有优异防效,能兼治炭疽病和灰霉病。
前期预防施用8000~10000倍液,作治疗时施用6000倍液,成熟期治疗炭疽病处理穗部时施用3000倍液。
有轻微抑制生长作用,小幼果期慎用。
5、40%氟硅唑(稳歼菌)氟硅唑是三唑类内吸性杀菌剂,对白腐病、白粉病、黑痘病、黑腐病等有优异防效,能兼治炭疽病。
施用8000~10000倍液。
葡萄常用杀菌剂,这些效果比较好!别说你不知道

葡萄常⽤杀菌剂,这些效果⽐较好!别说你不知道⼀、⽩腐病
1、喹啉·戊唑醇
由戊唑醇和喹啉铜复配⽽成,兼具预防和治疗作⽤,对真菌、细菌及混发性病害有效。
葡萄上
推荐稀释1500倍,套袋后使⽤。
对霜霉、⿊痘、酸腐、⽩腐、炭疽、⿊腐均有效。
2、苯醚甲环唑
本品属三唑类内吸性杀菌剂,通过抑制病原菌的孢⼦形成,⼲扰病菌的正常⽣长。
葡萄上推荐
稀释3000-4000倍。
⼆、灰霉病
开花前预防可选药剂(腐霉利、异菌脲、代森锌等),喷1~2次;病初防治可选药剂(嘧霉胺、
苯醚甲环唑·丙环唑、嘧霉菌胺、噻菌灵等),隔10~15天,连喷2~3次。
三、炭疽病
苯甲·咪鲜胺
苯醚甲环唑与咪鲜胺复配。
配⽅合理,杀菌更强。
葡萄上推荐每亩45-60毫升,发病初期使⽤,
对⿊痘、⽩粉病亦有效。
四、⽩粉病
露娜森
葡萄初花期、谢花80%,分别使⽤露娜森43%氟菌·肟菌酯,能有效防治葡萄花、叶、果上灰霉
病和⽩粉病的发⽣,同时新叶更舒展、果⽪⼲净,果粉更厚,提⾼采收后优质果率。
五、霜霉病
1、嘧菌酯
防治霜霉病,葡萄上推荐稀释1000-2000倍,喷雾。
防治⽩腐病、⿊痘病,推荐稀释830-1250
倍,喷雾。
2、氟菌·霜霉威
本品为内吸性杀菌剂,由氟吡菌胺和霜霉威盐酸复配⽽成,特别对霜霉属和疫霉属病菌导致的
病害具有很好的防效。
具有活性⾼、持效期长、内吸性强、施药时间灵活的特点。
葡萄上使⽤
推荐:60-75毫升/亩,喷雾。
几种新型杀菌剂对葡萄灰霉病的防治效果

2 № ,增 PatQ/ 'l/ tr n N n n 10 8 C /a . / //l/ S / , aj g 2 00 , hn ) n Ga,l a o te /
Ab t a t Th e to e d c n r le e to w o i un i i e n Bor t ie e e s i iats 10 i s sr c : e t s ff l o to f c fl txc f gc d s o ty i cn r a P r nd c e 00 t i o s me
3 5% F n s o c u o e h e o 2. e g h u h n c nis t e s o nd.a d oh r s p id ts u g cde a e b d r s ls. n te up l e tf n i i s h v a e u t e Ke y wor s: g a e; Bo r t ie e r f g cd o r l d rp ty i cr ra Pe s; un ii e c nto s l
葡 萄 灰 霉 病 病 原 为 真 菌 门半 知 菌 亚 门丝 孢 纲 丝 孢 目灰 葡 萄 孢 霉 B t t i r es or /cle Pr。该 病 可 危 害 葡 ys r a e 萄 的 花序 、幼果 和成 熟 的 果 实 、果 梗 、新 梢 、叶 片 ,主 要 危 害 花穗 和 花 刚 凋 谢 时 的小 果 穗 。病 部 感 染 初 期 呈 淡 褐 色水 渍 状 ,整 个 果 穗 软 腐 ,眼 观 被 害 花 序 似 开 水 烫 过 状 ,随后 变 成 暗 褐 色 。 遇 潮 湿 天 气 , 病 穗 上 长 出 浅灰 色霉 层 ,为 病 菌 的 分 生 孢 子 和 分 生 孢 子 梗 ,如 若 在 晴 好 天 气 ,腐 烂 的病 穗 则 逐 渐 失 水 干枯 脱 落 。若 成 熟 的 果 实 被 害 ,果 实 表 面则 出现 褐 色 凹 陷 的 病 斑 ,果 实 全 部 软 腐 ,生 出 浅 灰 色 霉 层 , 果 梗 变黑 ,最后 在 病 部 长 出黑 色 块 状 菌 核 。新 梢 及 叶片 感 病 产 生淡 褐 色 、不 规 则 病 斑 ,病 斑 上 有 时 也 出 现 不 明 显 轮 纹 ,出 现 灰 色 霉 层 。该 病 在 低 温 多 湿 条 件 下 易 流 行 ,病 情 严 重 时 可 减 产 7 % ~8 % 。 0 0 灰霉 病 是 严 重影 响 我 区 葡 萄 生 产 的 主 要 病 害 之 一 ( 区 的 主栽 品 种 巨 峰 为 灰 霉 病 的 易 感 品 种 ,19 我 99 年 在 本 区 江 心 洲 镇 开 始 发 现该 病 ) ,延 续 多 年 使 用 的 多 菌 灵 、 甲 基 托 布 津 、 速 克 灵 等 对 该 病 已几 乎 不 产 生 作 用 。 为 减 轻 葡 萄 灰 霉 病 的 危 害 ,提 高 葡 萄 的 产 量 和质 量 ,并 探 索 葡 萄 的 无 公 害 化 技 术 ,20 01 年 我 们 与 南 京 市 植 保 站 共 同选 取 了 5种 低 毒 、低 残 留杀 菌 剂 ,在 江 心 洲 镇 千 亩 葡 萄 园对 葡 萄灰 霉 病 进 行了药剂防治试验 。
葡萄常用杀菌剂,这些效果比较好

葡萄常用杀菌剂,这些效果比较好葡萄是一种病虫害较多的果树,特别是随着夏季的到来,温度攀升快、雨水充足,大量病虫害集中爆发。
目前,北方露地葡萄陆续结束花期,而谢花后、幼果期、套袋前的三次药十分关键,关系着葡萄的品质与产量,那具体这药该怎么打呢?1、20%苯醚甲环唑水分散粒剂20%苯醚甲环唑是三唑类高效内吸性杀菌剂,杀菌彻底,对炭疽病、白腐病、白粉病、黑痘病、黑腐病等有优异防效,能兼治穗轴褐枯病。
对葡萄安全,不会抑制生长,前期综合防治时,与保护剂配合施用3000~5000倍液;后期对炭疽病治疗处理穗部时施用1000~1500倍液;最好不要和铜制剂混用,如需混用,要增加10%用药量。
对藤稔,夏黑,高妻这3个葡萄品种,连续阴天时不要施用,有药害。
2、80%霜脲氰水分散粒剂霜脲氰是具有渗透性的霜霉病治疗剂,在药剂喷洒到的地方,能进入葡萄植株内部,杀菌和抑菌。
目前由于大量应用,抗药性比较重。
常见的品种是由72%或36%与代森锰锌混配的药剂,因霜脲氰含量低,建议按照保护性杀菌剂施用。
在葡萄园施用霜脲氰,建议施用纯的霜脲氰制剂,例如80%霜脲氰水分散粒剂,施用2000~3000倍液,也可以3000~4000倍液与保护性杀菌剂(如喷克、喷富露等)混合施用。
3、25%凯润(吡唑醚菌酯)乳油或60%百泰(6%吡唑醚菌酯和54%代森联)水分散粒剂吡唑醚菌酯是最新型甲氧基丙烯酸酯类的杀菌剂之一,是在醚菌酯基础上改进后的高效线粒体呼吸抑制剂,杀菌谱广,对葡萄霜霉病、炭疽病、白粉病等都有较好防效。
且持效时间长,安全性好,对作物有刺激生长作用,可用于葡萄各个生长期,25%凯润施用2000~4000倍液,60%百泰施用800~1500倍液。
4、80%戊唑醇水分散粒剂戊唑醇是高效内吸性杀菌剂,对白腐病、白粉病、黑痘病、黑腐病等有优异防效,能兼治炭疽病和灰霉病。
前期预防施用8000~10000倍液,作治疗时施用6000倍液,成熟期治疗炭疽病处理穗部时施用3000倍液。
不同化学药剂对葡萄灰霉病的防治效果

表1不同化学药剂对葡萄灰霉病的防治效果药剂浓度mg ·kg -1第3次药后第4次药后指数%指数%多抗霉素250 1.7581.83 2.6583.86500 1.5484.01 2.4385.20施佳乐1000 1.8780.58 2.9881.851500 1.5983.49 2.5984.2340%苯醚·甲硫可湿性粉剂500 1.4385.15 2.1187.151000 1.1288.37 1.6789.8330%戊唑·咪鲜胺可湿性粉剂500 1.3585.98 2.0787.391000 1.0189.51 1.5590.56宁南霉素1000 1.0988.68 1.5990.3220000.9190.55 1.2392.51速克灵500 1.6582.87 2.4385.2010001.2387.23 1.6390.07CK9.63-16.42-摘要试验采用6种化学药剂防治葡萄灰霉病,结果表明,在发病前施药防治葡萄灰霉病,供试的6种化学药剂均具有一定的防效,在处理剂量范围内对果树安全。
第4次药后15d ,宁南霉素1000、2000mg/kg 效果最好,防效分别为90.32%和92.51%;其后为40%苯醚·甲硫可湿性粉剂500、1000mg/kg ,30%戊唑·咪鲜胺可湿性粉剂500、1000mg/kg ,速克灵500、1000mg/kg ,防治效果均在85%以上。
生产上建议在发病前施药,每隔15d 喷1次,连喷4次。
关键词葡萄灰霉病;化学药剂;田间药效中图分类号S436.631文献标识码A 文章编号1007-5739(2018)16-0093-01不同化学药剂对葡萄灰霉病的防治效果刘晓芬(辽宁省朝阳市龙城区林业局,辽宁朝阳122000)葡萄灰霉病是由灰葡萄孢菌侵染引起的,是葡萄生产中最严重的病害之一。
该病一般于每年7—8月在田间出现症状,9月为高发期。
葡萄灰霉病防治方法

葡萄灰霉病防治方法
葡萄灰霉病是一种常见的葡萄病害,会对葡萄产生严重的影响,因此需要采取适当的防治措施。
以下是葡萄灰霉病的防治方法:
1. 排水和通风:保持葡萄园的排水和通风良好,尽量减少水分积聚和湿度,以降低病菌的生长和繁殖。
2. 剪除感染部位:及时发现并剪除感染部位,避免病菌传播,同时要保持剪刀的清洁卫生。
3. 使用杀菌剂:使用合适的杀菌剂进行防治,选择对灰霉病菌有特效的药剂,按照说明书正确使用。
4. 喷洒保护剂:使用适当的保护剂进行预防,可以在病害高发期间定期喷洒,使葡萄更加健康。
5. 增强免疫力:通过适当施肥、保持土壤湿度等措施,增强葡萄的免疫力,降低病害发生的概率。
6. 坚持清洁:保持葡萄园的清洁,定期清除落叶、树枝等杂物,避免病菌隐藏和传播。
总之,预防和治疗葡萄灰霉病需要采取一系列措施,综合防治才能达到最好的效果。
- 1 -。
12种杀菌剂对葡萄灰霉病菌的毒力测定

12种杀菌剂对葡萄灰霉病菌的毒力测定作者:陈宏州杨敬辉肖婷等来源:《江苏农业科学》2015年第01期摘要:为探明不同杀菌剂对葡萄灰霉病菌的室内抑菌活性,采用菌丝生长速率法测定12种杀菌剂对葡萄灰霉病菌的室内毒力。
结果表明,乙霉威、环酰菌胺、嘧菌环胺、咪酰胺、速克灵、多菌灵、烯唑醇、异菌脲、嘧霉胺、啶酰菌胺、腈菌唑、吡唑醚菌酯对葡萄灰霉病菌的EC50值分别为0.092 8、0.094 0、0.098 1、0.117 4、0.420 4、0.491 8、0.591 7、0861 6、2.611 6、3.266 4、11.371 5、20.573 3 mg/L。
葡萄灰霉病菌对不同杀菌剂的敏感性差异较大,其中供试葡萄灰霉病菌对乙霉威最敏感。
关键词:葡萄灰霉病菌;杀菌剂;毒力;菌丝;生长速率法中图分类号: S436.631.1文献标志码: A文章编号:1002-1302(2015)01-0124-03收稿日期:2014-03-31基金项目:江苏省科技支撑计划(编号:BE2013407);江苏省镇江市农业科技支撑计划(编号:NY2013014)。
作者简介:陈宏州(1984—),男,壮族,广西宜州人,硕士,助理研究员,主要从事作物病害生物防治及杀菌剂抗药性研究。
E-mail:hongzc_2006@。
通信作者:庄义庆,博士,研究员,主要从事植物保护研究。
E-mail:yqzhuang@。
由灰葡萄孢菌(Botrytic cinerea Pers.)引起的葡萄灰霉病主要危害葡萄叶片、新鞘、花穗、果实,是世界葡萄生产上的主要病害[1]。
该病害不仅在田间为害,在产后贮藏期也是毁灭性病害,每年因灰霉病造成的葡萄产前、产后损失高达50%,一般损失在20%~30%[2]。
灰葡萄孢菌腐生性强,寄主范围广,能够侵染400余种植物,在各类作物资源中尚未发现抗病材料,很难培育出抗病品种[3]。
目前该病害的防治仍以化学防治为主,但由于灰葡萄孢菌具有遗传变异大、繁殖速率快、适合度高等特点,在连续多年单一使用某种杀菌剂后,极易使病原菌产生抗药性及交互抗性[4]。
不同生物杀菌剂对人参灰霉病的室内毒力及田间防效

不同生物杀菌剂对人参灰霉病的室内毒力及田间防效作者:魏晓兵等来源:《植物保护》2015年第05期摘要采用菌丝生长速率法测定了14种生物杀菌剂对人参灰霉病菌的室内毒力,并进行了7种生物杀菌剂对人参灰霉病的田间药效试验。
室内毒力测定结果表明:0.3%丁子香酚SL和2%蛇床子素EC对人参灰霉病菌毒力最强,其EC50分别为0.129、0.623 mg/L,2%春雷霉素AS 等5种生物杀菌剂对人参灰霉病菌也具有较好的抑制效果,其EC50在12.857~127.012 mg/L 之间。
田间试验结果表明:0.3%丁子香酚SL在田间对人参灰霉病表现较高的防效,2%春雷霉素AS 和3%中生菌素WP次之。
初步筛选出了对人参灰霉病具有较好防效的生物杀菌剂,为人参灰霉病的安全防控提供科学依据。
关键词人参灰霉病;生物杀菌剂;毒力测定;田间药效;Botrytis cinerea中图分类号:S 482.292文献标识码:BDOI:10.3969/j.issn.05291542.2015.05.042AbstractToxicities of 14 biofungicides against Botrytis cinerea were tested by mycelium growth rate method in laboratory, and field trials of 7 biofungicides against grey mold of panax were also conducted. Indoor bioassay showed that 0.3% eugenol SL and 2% osthole EC had the best toxicity against B.cinerea with EC50 values of 0.129 and 0.623 mg/L, respectively. 2% kasugamycin AS and other four biofungicides also had toxicity to B.cinerea with EC50 values ranged from 12.857 mg/L to 127.012 mg/L. Field trials demonstrated that 0.3% eugenol SL exhibited high control effect, 2% kasugamycin AS and 3% zhongshengmycin WP followed. Thus, the effective biofungicides were screened out for the disease control.Key wordsgrey mold of panax;biofungicides;toxicity test;field control effect;Botrytis cinerea人参为五加科多年生草本植物,是我国传统名贵中草药,主要分布在我国长白山地区,具有极高的经济价值和药用价值[1]。
葡萄灰霉病用什么药治?(葡萄灰霉病防治药剂)

葡萄灰霉病用什么药治?(葡萄灰霉病防治药剂)葡萄灰霉病症状:在我国,葡萄花期和成熟期是灰霉病发生的两个重要时期,在晚春和花期,叶片被侵染后会形成大的病斑,一的在叶片边缘、比较薄的地方,病斑为红褐色不规则形。
病菌可以侵染花序,造成腐烂或干枯而后脱落。
成熟期,灰霉病病有可以通过表皮和伤口直接侵入果实。
白色品种被侵,果粒变成褐色;有色品种被侵染,果粒变成红色。
葡萄灰霉病病原:有性型为富氏葡萄孢盘菌(Botryotinia***eliana).无性型为灰葡萄孢(BotrytiscinereaPers.),属真菌。
葡萄灰霉病发病规律:据资料记载,该病菌在有些地区以秋季在枝条上形成的菌核越冬,有些地区以菌丝在树皮和休眠芽上越冬一般两种越冬形式都存在,越冬后的菌核和菌丝,在春天产生分生孢子,作为春季的侵染源。
分生孢子萌发的最适合温度是18°C,但要求90%以上的湿度或有水分存在。
分生孢子萌发后,可以通过部分感病葡萄品种的表皮直接侵入。
如果有伤口存在,比如虫害、白粉病、冰雹、鸟害等造成的伤口,会加速和促进葡萄灰霉病的侵染和发病。
葡萄灰霉病防治方法:①搞好田间卫生,把病果粒、病果梗和穗轴、病枝条收集到一起,及时清理出田间,集中处理。
②选种抗病品种,增加葡萄园通透性,减少液态肥料喷淋对该病具有控制作用。
③药剂防治:防治灰霉病的关键期主要为花期前后、封穗期及转色后,常用的药剂有50%嘧菌酯,福美双可湿性粉剂1S00倍液、50%腐霉利可湿性粉剂600倍液、50%异菌脲可湿性粉剂500~600倍液。
耕种帮建议在葡萄果实采收前,可喷洒一些生物农药,如60%噻菌灵可湿性粉剂100倍液、10%多抗霉素可湿性粉剂600倍液等。
葡萄灰霉病的防治方法

葡萄灰霉病的防治方法
葡萄灰霉病可太让人头疼啦!那咋防治呢?首先得做好果园清洁,就像给葡萄树打扫房间一样,把病枝病叶啥的都清理掉,这能减少病菌来源,多重要哇!喷药也不能少,选对药就像给葡萄树穿上了防弹衣。
可不能乱喷药哦,得按照说明书来,不然那不是瞎折腾嘛!
防治过程安全不?只要你小心操作,肯定没问题呀!就跟走在平路上一样稳当。
稳定性也有保障,只要坚持防治,效果就杠杠的。
啥场景能用这方法呢?那当然是葡萄园啦!这就像给葡萄树请了个私人医生。
优势可不少呢,能让葡萄长得好,卖个好价钱,多棒呀!
有个葡萄园之前灰霉病可严重了,后来用了这些防治方法,哇塞,葡萄长得那叫一个好,就跟宝石似的。
这效果,简直绝了!
葡萄灰霉病得防好治好,让葡萄茁壮成长,咱果农才能开心赚钱。
葡萄灰霉病该怎么防治?12种葡萄灰霉病防治药剂

葡萄灰霉病该怎么防治?12种葡萄灰霉病防治药剂葡萄灰霉病该怎么防治?葡萄灰霉病有可以称为葡萄灰腐病,是葡萄种植过程中比较严重的病害之一,造成的损失也是最为严重的,因此今天小编就来说说防治葡萄灰霉病的12种防治药剂,希望对大家能有所帮助。
一、保护性杀菌剂1、硫磺硫磺在我们生活中也可以算是常见的一种保护性杀菌剂,有效成分为元素硫,具有杀菌、杀螨和杀虫作用。
2、代森锰锌代森锰锌可以有效防治子囊菌、卵菌、半知菌和担子菌引起的叶部病害。
3、百菌清百菌清可以有效防治半知菌、子囊菌、担子菌和卵菌病害,具有杀菌谱广、低毒等特点。
二、治疗性杀菌剂1、多菌灵多菌灵属于苯并咪唑类杀菌剂,能有效抑制病原菌菌丝的分隔和伸长,使微管蛋白在形成微管和其它网架结构时受阻,破坏细胞的有丝分裂和形态生成。
2、乙霉威乙霉威属于N-苯基氨基甲酸酯类杀菌剂,作用于病菌的微管蛋白,破坏其有丝分裂。
3、异菌脲异菌脲属于二甲酰亚胺类杀菌剂,可以有效干扰病原菌细胞核功能,影响细胞膜和细胞壁,使得膜渗透性细胞破裂。
4、嘧霉胺嘧霉胺苯胺基嘧啶类杀菌剂,能有效抑制病菌胞外蛋白酶的分泌。
5、嘧菌酯嘧菌酯属于N-苯基甲氧基丙烯酸酯类杀菌剂,作用机制是药剂与线粒体电子传递链中的复合物中的Cytb的Q0位点结合,阻断电子由Cythc1复合物流向Cytc。
6、咯菌腈咯菌腈是一种新型的苯基吡咯类杀菌剂,通过抑制与葡萄糖磷酰化有关的转运来抑制菌丝生长,使得病菌死亡。
7、氟啶胺氟啶胺属吡啶胺类杀菌剂,能影响线粒体呼吸作用的氧化磷酸化解偶联剂,抑制病原菌细胞线粒体膜内外电子传导。
8、啶菌噁唑啶菌噁唑能有效抑制病原菌细胞壁上麦角甾醇的生物合成,从而达到杀菌效果。
9、啶酰菌胺啶酰菌胺可以有效抑制线粒体琥珀酸酯脱氢酶,阻碍三羧酸循环,使氨基酸、糖缺乏,能量减少,同时还能干扰细胞分裂和生长,具有保护和治疗作用。
葡萄灰霉病,看完这些就够了

葡萄灰霉病,看完这些就够了最近走访很多葡萄园子发现,今年的灰霉病相当普遍而且还很难控制,所以今天就来跟大家探讨下葡萄的灰霉病。
葡萄灰霉病在世界上的任何葡萄园都可以发现。
葡萄灰霉病侵染葡萄,在产量和品质上都会造成影响,包括由于穗轴的干枯造成没有成熟的果穗或部分果穗的脱落,或干枯、缩水。
但是造成的危害因葡萄的用处不同而有差别。
对于鲜食葡萄,不但造成产量降低,而且在葡萄的贮藏、运输过程中继续腐烂,成为贮藏和运输过程中葡萄腐烂的罪魁祸首;对于酿酒葡萄主要是影响质量,混杂或含有灰霉病病果的葡萄酿造的葡萄酒,有怪味或味道欠佳,并且容易被氧化和被细菌感染,也不容易存放,影响葡萄的陈酿和年份。
一、症状在我国,灰霉病的发生危害包括花期、成熟期和贮藏期。
但冬季雨水多和春季多雨的地区,早春也侵染葡萄的幼芽、新梢和幼叶。
幼芽和新梢受害,成褐色病斑,导致干枯。
在晚春和花期,叶片上被侵染后会形成大的病斑,一般在叶片的边沿、比较薄的地方,病斑为不规则形状、红褐色在花帽脱落前(开花前至开花),病菌可以侵染花序,造成腐烂或干枯,而后脱落。
开花后期,病菌会频繁侵染逐渐萎篶的花帽、雌蕊和败育(或发育不完全)的幼果,这些花帽、雌蕊和败育的幼果如果遇到特殊气候,会黏贴在果穗或果粒上。
这样,病菌从这些黏贴的组织开始,侵染果梗和穗轴。
这些受感染的果梗和穗轴开始形成小型的褐色病斑,之后病斑颜色逐渐加重变为黑色。
在夏末,这些病斑发展成围绕果梗或穗轴一圈的病斑,导致果穗萎篶(有时脱落)(在气候干燥时),或产生霉成导致整个果穗的腐烂(气候湿润时)进入成熟期,灰霉病病菌可以通过表皮和伤口直接侵入果实。
比较紧的果穗,果实互相挤压,先通过相邻的果粒传染,然后霉层会逐渐侵染整个果穗。
白色品种被感染,果穗变成褐色,有色葡萄品种(户太八号葡萄)被感染,果穗变成红色。
如果气候干燥,被侵染的果粒干枯:如果气候湿润,果粒会破裂,并且在果实表面形成鼠灰色的霉层二、发病规律分生孢子在1~30℃都可以萌发(萌发的最适合温度是18℃),但要求有90%以上的湿度或有水分存在。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
13种杀菌剂对葡萄灰霉病病菌的室内毒力及田间防治效果范昆;曲健禄;付丽;张勇;武海斌;陶吉寒【摘要】筛选当前对葡萄灰霉病有明显防治效果的杀菌剂.采用菌丝生长速率法、悬滴法分别测定杀菌剂对葡萄灰霉病病菌的室内毒力,并进行田间防治试验研究.结果表明,啶酰菌胺、咪鲜胺、咯菌腈对孢子萌发的抑制作用最强,其EC50分别为0.1204、0.1396、0.1838μg/mL;嘧菌环胺、啶酰菌胺、啶菌唑、咯菌腈对菌丝生长的抑制作用最强,其EC50分别为0.2017、0.3266、0.4592、0.5585μg/mL.田间防治试验结果表明,50%嘧菌环胺水分散粒剂、50%啶酰菌胺水分散粒剂、50%咪鲜胺锰盐可湿性粉剂、50%咯菌腈可湿性粉剂的防治效果最好,在试验浓度范围内对葡萄安全无药害,是适合推广应用于防治葡萄灰霉病的杀菌剂品种.【期刊名称】《江苏农业科学》【年(卷),期】2017(045)024【总页数】4页(P95-98)【关键词】杀菌剂;葡萄灰霉病;毒力测定;田间药效;防治效果【作者】范昆;曲健禄;付丽;张勇;武海斌;陶吉寒【作者单位】山东省果树研究所,山东泰安271000;山东省果树研究所,山东泰安271000;山东省果树研究所,山东泰安271000;山东省果树研究所,山东泰安271000;山东省果树研究所,山东泰安271000;山东省果树研究所,山东泰安271000【正文语种】中文【中图分类】S482.2;S436.631.1+9葡萄灰霉病是由灰葡萄孢霉(Botrytis cinerea Pers.)引起的葡萄生产中危害最大的病害之一,年度损失20%左右,发病严重的果园病穗率可达50%以上。
葡萄灰霉病除在生长季危害果实外,产后的贮藏阶段也能引起毁灭性地损失[1]。
目前,生产上防治葡萄灰霉病仍以化学防治为主,由于灰霉病菌繁殖速度快、遗传变异大、适合度高,加之田间连续多年使用单一药剂防治,灰霉病菌对多菌灵、腐霉利、乙霉威等杀菌剂已产生了抗药性,甚至出现了多重抗药性[2-7]。
同时,由于群众防治观念落后、重治轻防、盲目用药、滥用农药的现象比较普遍,造成农残超标、果园生态环境受到破坏,严重影响了葡萄的产量和品质,对出口创汇也造成了较大的不良影响,产值大大降低。
为此,本研究选取多种低毒、低残留的杀菌剂于2014、2015年对葡萄灰霉病病菌进行室内毒力测定和田间药效试验,以期筛选出防治该病害的理想药剂,有效防治葡萄灰霉病,为葡萄优质高产提供科学依据。
1 材料与方法1.1 试验材料1.1.1 供试菌株从山东省泰安市岱岳区南王庄村葡萄园采集病果,参照方中达的组织分离法[8],从病果皮部病斑病健交界处切下3 mm×3 mm×1 mm的小块,放入70%乙醇溶液中消毒30 s,然后将其转入1%氯化汞溶液中消毒1 min,用无菌水清洗3遍后,置于马铃薯葡萄糖琼脂(PDA)培养基上。
在26 ℃条件下培养3 d后挑取菌落边缘的菌丝进行病原菌的初步纯化,将纯化后的菌株在PDA试管斜面中于4 ℃冰箱中保存,备用。
纯化后的菌丝培养5 d后镜检菌丝、孢子的形态,并进行病原菌鉴定[9-10]。
1.1.2 供试药剂供试原药:98%嘧菌环胺原药,购自瑞士先正达作物保护有限公司;98.5%腐霉利原药,购自江西禾益化工股份有限公司;96%啶酰菌胺原药、96%异菌脲原药、98%嘧霉胺原药、97%咪鲜胺原药、95%咯菌腈原药、98%吡唑醚菌酯原药,均购自山东潍坊润丰化工股份有限公司;97%啶氧菌酯原药,购自美国杜邦公司;90%啶菌唑原药,购自沈阳科创化学品有限公司;98%戊唑醇原药,购自江苏常隆化工有限公司;97%多菌灵原药、92%氟硅唑原药,均购自青岛瀚生生物科技股份有限公司。
供试制剂:50%嘧菌环胺水分散粒剂,购自安徽绩溪农华生物科技有限公司;50%腐霉利可湿性粉剂,购自四川国光农化股份有限公司;50%啶酰菌胺水分散粒剂,购自巴斯夫欧洲公司;500 g/L异菌脲悬浮剂、400 g/L嘧霉胺悬浮剂、430 g/L 戊唑醇悬浮剂,均购自拜耳作物科学(中国)公司;50%多菌灵可湿性粉剂,购自江苏省新沂农药有限公司;50%咪鲜胺锰盐可湿性粉剂,购自江苏辉丰农化股份有限公司;22.5%啶氧菌酯悬浮剂,购自美国杜邦公司;400 g/L氟硅唑乳油,购自山东省青岛瀚生生物科技股份有限公司;250 g/L吡唑醚菌酯乳油,购自巴斯夫欧洲公司;50%咯菌腈可湿性粉剂,购自先正达(苏州)作物保护有限公司;25%啶菌唑乳油,购自沈阳化工研究院(南通)化工科技发展有限公司。
1.2 试验方法1.2.1 含药培养基的配制及药剂浓度先将戊唑醇、腐霉利、异菌脲、吡唑醚菌酯、嘧菌环胺、咪鲜胺、啶酰菌胺、啶氧菌酯、咯菌腈、嘧霉胺的原药溶于丙酮中,啶菌唑用甲醇溶解,氟硅唑用环己酮溶解,多菌灵用质量分数为1%的盐酸溶液溶解,并配成10 000 μg/mL的母液,以0.2%的体积分数加入乳化剂Tween-80,于冰箱中4 ℃下贮藏备用,测定时,根据培养基的用量,用移液枪吸取一定量的药剂母液加入冷却至50 ℃ 左右的培养基中,充分摇匀配成含药剂系列浓度的含药培养基(戊唑醇的浓度分别为8.0、4.0、2.0、1.0、0.5 μg/mL;吡唑醚菌酯的浓度分别为10.000、5.000、2.500、1.250、0.625 μg/mL;氟硅唑的浓度分别为50.000、25.000、12.500、6.250、3.125 μg/mL;异菌脲的浓度分别为20.00、10.00、5.00、2.50、1.25 μg/mL;咯菌腈的浓度分别为2.000、1.000、0.500、0.250、0.125 μg/mL;嘧霉胺的浓度分别为60.00、30.00、15.00、7.50、3.75 μg/mL;咪鲜胺的浓度分别为2.000、1.000、0.500、0.250、0.125 μg/mL;多菌灵的浓度分别为10.000、5.000、2.500、1.250、0.625 μg/mL;啶酰菌胺的浓度分别为4.00、2.00、1.00、0.50、0.25 μg/mL;嘧菌环胺的浓度分别为2.000、1.000、0.500、0.250、0.125 μg/mL;腐霉利的浓度分别为40.0、20.0、10.0、5.0、2.5 μg/mL;啶氧菌酯的浓度分别为10.000、5.000、2.500、1.250、0.625 μg/mL;啶菌唑的浓度分别为 5.000、2.500、1.250、0.625、0.313μg/mL)。
1.2.2 杀菌剂对葡萄灰霉病病菌孢子萌发的影响采用悬滴法[11]测定杀菌剂对葡萄灰霉病病菌孢子萌发的抑制作用。
将灰霉病病菌置于26 ℃条件下黑暗培养3 d,促使其产孢。
待产孢后,用无菌去离子水将孢子洗脱并调节孢子悬浮液浓度至1×105个/mL,并加葡萄糖配制成含糖0.01%的孢子悬浮液。
将每个浓度的药液与100 μL孢子悬浮液等体积混合,分别将混合液按浓度从小到大滴1滴于凹玻片中的凹槽内,将凹玻片迅速翻转使液滴倒悬在凹玻片下表面,小心将凹玻片放于加水培养皿中,每个浓度设4个重复,以不加药者为对照。
置于26 ℃培养箱中,镜检孢子萌发情况。
当对照组孢子萌发率达到80%以上时即可镜检各处理组孢子的萌发情况,以孢子的芽管长度大于孢子短半径为萌发,计算孢子萌发抑制率。
试验重复2次。
采用机率值分析法求出各药剂对菌株孢子萌发的毒力回归方程、有效抑制中浓度(EC50)。
萌发率=萌发孢子数/检查孢子总数×100%;抑制率=(对照组孢子萌发率-处理组孢子萌发率)/对照组孢子萌发率×100%。
1.2.3 杀菌剂对葡萄灰霉病病菌菌丝生长的影响采用菌丝生长速率法[12],在PDA平板上培养(26 ℃,黑暗)3 d的菌落边缘打出直径为7 mm的菌饼,分别移到含药的培养基平板上,置于26 ℃暗培养3 d,测定菌落径向线性生长量,确定药剂对菌丝生长的抑制率。
每个处理重复4次,试验重复2次。
通过菌丝生长抑制概率值和药剂浓度对数值之间的线性回归分析,求出各药剂对菌株的有效抑制中浓度(EC50)[13]。
抑制生长率=[(对照菌落直径-处理菌落直径)/(对照菌落直径-菌饼直径)]×100%。
1.2.4 田间药效试验试验地设在山东省泰安市岱岳区南王庄葡萄园。
供试葡萄品种为巨峰,树龄14年,株距、行距分别为1.7、0.8 m。
葡萄灰霉病田间药效试验分别于2014、2015年的5—8月进行,分别于5月4日、5月14日、5月28日、6月5日进行喷药,共施药4次。
5月14日至5月27日为巨峰葡萄花期,试验喷药时间与开花时间刚好错开,花前花后各喷2次药剂。
6月5号第4次喷药后,待果穗药剂晾干后套果袋,当天套完果袋。
连同空白对照试验共设20个处理,即500、800 mg/kg 50%嘧菌环胺水分散粒剂,250、500 mg/kg 50%腐霉利可湿性粉剂,500、800 mg/kg 50%啶酰菌胺水分散粒剂,500 mg/kg 500 g/L异菌脲悬浮剂,400 mg/kg 400 g/L嘧霉胺悬浮剂,800 mg/kg 50%多菌灵可湿性粉剂,600、800 mg/kg 50%咪鲜胺锰盐可湿性粉剂,132 mg/kg 22.5%啶氧菌酯悬浮剂,44.4 mg/kg 400 g/L氟硅唑乳油,125、250 mg/kg 250 g/L吡唑醚菌酯乳油,143.3 mg/kg 430 g/L戊唑醇悬浮剂,100 mg/kg 50%咯菌腈可湿性粉剂,200、400 g/hm2 25%啶菌唑乳油,空白对照喷清水。
8株葡萄树为1个小区,重复4次,区组随机排列。
1.2.5 药效调查方法 5月4日第1次施药时调查发病基数。
因第1次施药时未发病,故发病基数为0。
6月5日(第3次施药8 d后)调查1次发病情况,调查完进行第4次喷药,药剂晾干后对果穗进行套袋。
果实采收期(8月5日)调查1次发病情况,共调查3次。
每个小区除边缘2株树外,调查其余6株树中、下部果穗,按5点取样法随机调查20个果穗,调查病果(穗)率及受害级别,计算病情指数及防治效果。
分级方法:0级,无病斑;1级,病果(穗)面积占整个果穗面积的5%及以下;3级,病果(穗)面积占整个果穗面积的6%~15%;5级,病果(穗)面积占整个果穗面积的16%~25%;7级,病果(穗)面积占整个果穗面积的26%~50%;9级,病果(穗)面积占整个果穗面积的51%及以上。
病果(穗)率=病果(穗)数/调查总果(穗)数×100%;病情指数=∑[(各级病果(穗)数×相对级数代表值)]/[调查总果(穗)数×9]×100;防治效果=(空白对照区病情指数-处理区病情指数)/空白对照区病情指数×100%。
