化工原理第09章05
化工原理第9章

反应速率的影响愈大;反应转化率愈高,反应混
合物中残余反应物浓度愈小,返混对反应速率的
影响也愈大。
5-2 以产率和选择性为优化目标
对于复杂反应以产率和选择性为优化目标, 应考虑物料返混对于反应产物分布的影响。 • 平行反应过程优化
• 串连反应过程优化
A R S
k1 k2
反应器选型
i 1
VR ,t VR ,t qV , 0 c A, 0
i 1 i 1
n
• 多釜串联反应器的总有效容积VR,t的逐级解析计算
过程也可以在坐标图上进行 。
§5 均相反应过程优化与反应器选择
5-1 以生产强度为优化目标
生产强度是指单位容积反应器的生产能力。 当处理物料量和要求达到的最终转化率一定时, 对于不同型式的反应器,所需容积的大小,也表 明了该反应器生产强度的大小。
• 活化能较大、反应温度较高的化学反应,对温度十分敏感, 为了强化传热,减少温差,宜采用全混流反应器。 • 当反应物浓度较高易发生剧烈反应时,宜采用全混流反应 器。 • 反应速率较慢、反应时间较长的化学反应,宜选用间歇操 作搅拌釜或连续操作搅拌釜反应器。 • 气相反应多采用管式反应器。 • 高压反应宜采用管式反应器(细长设备耐压高)。 • 在高温条件下进行的强吸热反应(如裂解),通常采用管 式反应器。
• 反应器有效容积VR:
日处理量 VR (t t ') 24
V VR
• 实际所需反应器体积
易起泡和在沸腾下操作的液体: =0.40.6; 不易起泡和不在沸腾条件下操作的液体: =0.70.85
§2 连续操作管式反应器
• 物料中的所有流体微元在反应器内以相同的速度、
化工原理第九章

cH=cg+cwH
(9-7
式中cH——湿空气的比热容,kJ/(kg绝干空气·℃
cg——绝干空气的比热容,kJ/(kg绝干空气·℃
cw——水汽的比热容,kJ/(kg水汽·℃)。
第二节 湿空气的性质及湿度图
在常用的温度范围内,cg、cw可按常数处理,cg=1.01kJ/(kg绝 干空气·℃),cw=1.88kJ/(kg水汽·℃)。将其代入式(9-7),得
化工原理
第九章 干 燥
概述 湿空气的性质及湿度图 干燥过程中的物料衡算和热量衡算 干燥过程中的平衡关系与速率关系 干燥设备
第九章 干 燥
知识目标
掌握湿空气各性质参数的定义及其计算,H-I图的结构 及应用;干燥系统水分蒸发量、空气消耗量、蒸气消耗量、 干燥产量以及干燥时间等的计算。理解湿物料中水分的性质; 干燥过程的机理及速率特征。了解各种干燥器的结构特点及 应用场合及干燥器的选型。
(3)按照传热的方式分类,干燥可分为传导干燥、对流干燥、辐射 干燥、介电加热干燥以及上述两种或两种以上方式组合而成的联合干燥。
第一节 概 述
工业上应用最多的是连续操作的对流干燥过程,即 加热后的干燥介质在流动的情况下以对流传热的方式将 热量传给湿物料,湿物料中的湿分汽化被干燥介质带走。 干燥介质可以是不饱和的热空气、惰性气体及烟道气, 其除去的湿分大都是水分。所以本章主要讨论以不饱和 热空气为干燥介质,湿分为水的干燥过程。
cH=1.01+1.88H
(9-7a)
பைடு நூலகம்
显然,比热容仅是湿度的函数。
第二节 湿空气的性质及湿度图
(五)离心泵的工作原理
当湿空气的温度为t,湿度为H时,1kg绝干空气和Hkg水汽的焓 之和为湿空气的焓值,以IH表示,即
化学工程基础(化工原理)第9章 课后答案【khdaw_lxywyl】

均相反应过程
设t1、t2分别为转化率达 90%、99%所需要的时间,
1 1 ln t 2 k 1 − 0.99 则: = =2 1 1 t1 ln k 1 − 0 .9
ww
w. kh d
t1 = (2)t2 = 0.99 = 1650 min 0.3 × 0.2 × (1 − 0.99)
1650 = 11 150 t 2 t1 =
2
t=
xA kc A,0 (1 − x A )
乙酸、丁醇和乙酸乙酯的摩尔质量Mr分别为 6.0×10−2、7.4×10−2和 0.116kg⋅mol−1 (1 × 6.0 + 4.97 × 7.4) × 10
ww
w. kh d
= 40.1min = 0.67h (2)计算反应器有效体积 每小时乙酸用量为:
同一反应, 当初始浓度CA,0、 反应温度、 转化率相同时, 在间歇操作搅拌釜反应器和PFR 中进行反应的时间相同,即也为 4.44min。 qV,0 =
q n ,o = 0.684 = 0.137 m 3 ⋅ min −1 5
3
c A ,0
aw
0.8 = 50 min
案
= 0.4m3 ⋅ kmol−1 ⋅ min−1 对于 CSTR,则有:
1
2、在间歇操作搅拌釜反应器中进行等温液相反应 A+B→R
k = 0.3L ⋅ mol −1 ⋅ min −1 , c A ,o = c B,O = 0.2mol ⋅ L−1 , 已知: (− rA ) = kc A c B mol ⋅ L−1 ⋅ min −1 ,
试计算反应物 A 的转化率分别达 90%和 99%所需要的时间,并作比较。 解: (1)因cA,0 = cB,0 故: (−rA) = kcA2 = kcA,02 (1 − xA)2,代入式(9-2)积分得: xA 0.9 = = 150 min kc A,0 (1 − x A ) 0.3 × 0.2 × (1 − 0.9)
华东理工大学化工原理第九章05
x D max = R( ye − xe ) + ye = 1.4 × ( 0.672 − 0.45) + 0.672 = 0.983
若按物料衡算求算, 计算, 若按物料衡算求算,按xW=0计算,
x D max Fx F 0.45 = = = 0. 9 D 0. 5
所以, 所以,主要受物料衡算限制 xDmax=0.9 注意:要两头兼顾, 注意:要两头兼顾,两头验算
对xD, xW的影响
D 调节, ①R调节, , q不变 F
R↑, 操作线向对角线靠拢 一定时, 当N一定时,xD↑, xW↓
D x F − xW = W x D − xF
D ② F 调节
D 不变, ⑴R, q不变, ↑ ,( V ↑ ) F L V +W W = = 1+ ↓ V V V x D ↓ , xW ↓ D 不变, ⑵ V , q不变,F ↑ ,(R↓) L 精馏段 ↓ V 提馏段 L = V + W = 1 + W ↓ V V V
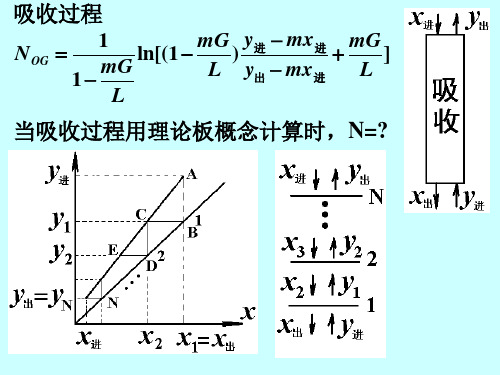
吸收过程
N OG 1 mG y进 − mx 进 mG ln[(1 − ) ] = + mG L y出 − mx 进 L 1− L
当吸收过程用理论板概念计算时, 当吸收过程用理论板概念计算时,N=?
ΔABC与ΔCDE为相似三角形
AB L CD 操作线的斜率; 操作线的斜率; = = m 平衡线的斜率 BC G BC AB L = =A 相似三角形的相似比 CD mG N y进 − mx出 = ( y出 − mx 进 ) A
xDmax、xWmin~R 线性关系 较大, ⑵R较大,物料衡算限制 xF xWmin =0, x D max = D / F < 1
《化工原理》第九章 萃取.

第一节 液-液萃取的基本原理
图9-1 组成在三角形相图上的表示方法
第一节 液-液萃取的基本原理
此外,M点的组成也可由ME线段读出萃取剂S的含量, MF线段读出溶质A的含量,原溶剂B的含量不直接从图上读 出,而是可方便地计算出,即:B=100-(S+A)。
直角等腰三角形可用普通直角坐标纸绘制。有时,也 采用不等腰直角三角形表示相组成,只有在各线密集不便 于绘制时,可根据需要将某直角边适当放大,使所标绘的 曲线展开,以方便使用。
第一节 液-液萃取的基本原理
1.三组分系统组成的表示法
液-液萃取过程也是以相际的平衡为极限。三组分系 统的相平衡关系常用三角形坐标图来表示。混合液的组成 以在等腰直角三角形坐标图上表示最方便,因此萃取计算 中常采用等腰直角三角形坐标图。
在图9-1中,三角形的三个顶点分别表示纯组分。习 惯上以顶点A表示溶质,顶点B表示原溶剂,顶点S表示萃 取剂。三角形任何一个边上的任一点代表一个二元混合物, 如AB边上的H点代表由A和B两组分组成的混合液,其中A的 质量分数为0.7,B为0.3。三角形内任一点代表一个三元 混合物,如图M中的点,过M点分别作三个边的平行线ED、 HG与KF,其中A的质量分数以线段MF表示, B的以线段MK表 示,S的以线段ME表示。由图可读得:WA =0.4,WE=0.3, WS=0.3。可见三个组分的质量分数之和等于1。
(3)萃取剂回收的难易与经济性 萃取剂通常需要回 收后循环使用,萃取剂回收的难易直接影响萃取的操作费 用。回收萃取剂所用的方法主要是蒸馏。若被萃取的溶质 是不挥发的,而物系中各组分的热稳定性又较好,可采用 蒸发操作回收萃取剂。
在一般萃取操作中,回收萃取剂往往是费用最多的环 节,有时某种萃取剂具有许多良好的性能,仅由于回收困 难而不能选用。
(完整版)化工原理各章节知识点总结

(完整版)化工原理各章节知识点总结第一章流体流动质点含有大量分子的流体微团,其尺寸远小于设备尺寸,但比起分子自由程却要大得多。
连续性假定假定流体是由大量质点组成的、彼此间没有间隙、完全充满所占空间的连续介质。
拉格朗日法选定一个流体质点,对其跟踪观察,描述其运动参数(如位移、速度等)与时间的关系。
欧拉法在固定空间位置上观察流体质点的运动情况,如空间各点的速度、压强、密度等,即直接描述各有关运动参数在空间各点的分布情况和随时间的变化。
定态流动流场中各点流体的速度u 、压强p 不随时间而变化。
轨线与流线轨线是同一流体质点在不同时间的位置连线,是拉格朗日法考察的结果。
流线是同一瞬间不同质点在速度方向上的连线,是欧拉法考察的结果。
系统与控制体系统是采用拉格朗日法考察流体的。
控制体是采用欧拉法考察流体的。
理想流体与实际流体的区别理想流体粘度为零,而实际流体粘度不为零。
粘性的物理本质分子间的引力和分子的热运动。
通常液体的粘度随温度增加而减小,因为液体分子间距离较小,以分子间的引力为主。
气体的粘度随温度上升而增大,因为气体分子间距离较大,以分子的热运动为主。
总势能流体的压强能与位能之和。
可压缩流体与不可压缩流体的区别流体的密度是否与压强有关。
有关的称为可压缩流体,无关的称为不可压缩流体。
伯努利方程的物理意义流体流动中的位能、压强能、动能之和保持不变。
平均流速流体的平均流速是以体积流量相同为原则的。
动能校正因子实际动能之平均值与平均速度之动能的比值。
均匀分布同一横截面上流体速度相同。
均匀流段各流线都是平行的直线并与截面垂直,在定态流动条件下该截面上的流体没有加速度, 故沿该截面势能分布应服从静力学原理。
层流与湍流的本质区别是否存在流体速度u、压强p的脉动性,即是否存在流体质点的脉动性。
稳定性与定态性稳定性是指系统对外界扰动的反应。
定态性是指有关运动参数随时间的变化情况。
边界层流动流体受固体壁面阻滞而造成速度梯度的区域。
化工原理第九章.

I2 I0 cg t2 t0 IV 2 H2 H0
2019/7/17
I2 I0 cg t2 t0 r0 c02t2 H2 H0
1.01t2 t0 2490 1.88t2 H2 H0
3、介电加热干燥
将需干燥的物料置于交频电场内,利用高频电场的交变作 用将湿物料加热,水分汽化,物料被干燥。 优点:干燥时间短,干燥产品均匀而洁净。 缺点:费用大。
2019/7/17
4、对流干燥
热能以对流给热的方式由热干燥介质(通常热空气)传给湿 物料,使物料中的水分汽化。物料内部的水分以气态或液态 形式扩散至物料表面,然后汽化的蒸汽从表面扩散至干燥介 质主体,再由介质带走的干燥过程称为对流干燥。 优点:受热均匀,所得产品的含水量均匀。
热能通过传热壁面以传导的方式传给湿物料 被干燥的物料与加热介质不直接接触,属间接干燥 优点:热能利用较多 缺点:与传热壁面接触的物料易局部过热而变质,受热不 均匀。
2、辐射干燥
热能以电磁波的形式由辐射器发射到湿物料表面,被物
2019/7/17
料吸收转化为热能,而将水分加热汽化。 优点:生产能力强,干燥产物均匀 缺点:能耗大
可见:向干燥系统输入的热量用于:加热空气;加热物料;
蒸发水分;热损失
cm cs Xc
2019/7/17
2、干燥系统的热效率
蒸发水分所需的热量
向干燥系统输入的总热量 100%
蒸发水分所需的热量为
QV W 2490 1.88t2 4.1871W
忽略物料中水分带入的焓
每蒸发1kg水分时,消耗的绝干空气数量l
2019/7/17
化工原理(陈敏恒)第九章

第九章液体精馏1 概述 1.1 蒸馏的目的和依据 (1)目的:分离液体混合物 (2)依据:混合液中各组分挥发度 的不同第九章液体精馏9.1 概述 9.1.1 蒸馏的目的和依据(1)目的:分离液体混合物 (2)依据:混合液中各组分挥发度的不同 挥发度——表征物质挥发程度的量。
pA pB 相平衡时: ν A = 、ν B = xA xBy A yB ν A >ν B ∴ > x A xByA > xAA—轻组分,B—重组分9.1.2 工业蒸馏过程 (1)平衡蒸馏(闪蒸)(2)简单蒸馏9.1.3 精馏操作的经济性 操作费用:加热、冷凝所消耗的费用 操作压强: 技术上:P↑,气、液平衡(饱和)温度↑,冷凝易, 汽化难。
z 对热敏性物质,常采用低压或真空操作。
z经济上:高压、真空精馏都将增加设备投资,应作优化 选择。
z9.2. 双组分溶液的气液相平衡9.2.1 理想物系气液相平衡(1)汽液两相平衡的自由度 相律:F = N–Φ + 2 双组分物系: 独立组分数N=2 相数Φ=2 自由度F=2 描述双组分平衡物系的参数:6个 温度-t,总压-P,两相组成-yA,yB,xA,xB。
双组分物系的组成满足: ¾归一关系: y A + y B = 1 ¾相平衡关系:y A = f ( xA )xA + xB = 1∴独立参数仅有:P,t,xA(yA)。
蒸馏操作中,P是选定的,因此温度与浓度必有一 一对应关系。
(2)双组分理想物系的液相组成-温度(泡点)关系式 理想溶液满足拉乌尔定律:0 p A = x A PA0 pB = x B PB总压: 组成: ∴P = PA + PBxB = 1 − xAPA0 x A + PB0 (1 − x A ) = P0 = f (t ) QPA AP − PB0 ∴x = 0 A PA − PB0P − f B (t ) ∴ xA = f A (t ) − f B (t )——泡点方程 —— x~t关系纯组分的饱和蒸汽压与温度的关系可用安托因方程描述: 安托因方程ln P 0 = A − B t+C(3)双组分理想物系的气相组成-温度(露点)关系0 p A PA xA Q yA = = P P——道尔顿分压定律 拉乌尔定律PA0 P − PB0 ∴ yA = 0 0 P PA − PB——露点方程0 0 PA P − PB f A (t ) P − fB (t ) yA = ⋅ 0 = ⋅ 0 P PA − PB P f A (t ) − fB (t )—— y~t关系(4)双组分物系的t~x(y)图和y~x图bta问题:a,b两点哪一个温度较高?(5) y~x的近似表达式与相对挥发度α定义:易挥发(轻)组分为A, 难挥发(重)组分为B, p 则: ν A = p A ν B = B xA xBPA PB > xA x BνA 相对挥发度:α = ν A >ν B νB yA yB 当气相服从道尔顿分压定律时,α = xA xBα= ∴ p A /x A P ⋅ y A /x A = p B /x B P ⋅ y B /x B yA x =α ⋅( A ) yB xB对于二元溶液,则:yA xA =α ⋅( ) 1 − yA 1 − xA∴ y=α⋅x 1 + (α − 1)x- 相平衡方程⋅∴=+−αxy 1(α1)x-相平衡方程讨论:z 上式反映了双组分物系平衡时两相浓度的关系。
化工原理-9章总结

精馏塔内自塔顶算起的任一第n块塔 板(非加料板),组成如图所示:
总物料衡算式:
Vn+1+Ln-1=Vn+Ln
轻组分衡算式:
Vn+1yn+1+Ln-1xn-1=Vnyn+Lnxn
2、 恒摩尔流假定
在精馏塔内,无中间加料或出 料的情况下,每层塔板的 ——上升蒸气摩尔流量相等
(恒摩尔气流)
——相平衡方程
9.3 平衡蒸馏与简单蒸馏
平衡蒸馏 简单蒸馏
塔顶产品 yA 加热器 原料液 减压阀 闪 蒸 罐 xA
冷凝器
y 原料液 蒸汽 x xD1 xD2 xD3
Q
塔底产品
9.4 精 馏
9.4.1 精馏过程 一、精馏概念:
多次进行部分气化或部分冷凝以后,可以在气相中得到较纯 的易挥发组分,而在液相中得到较纯的难挥发组分。
加入第三种组分,改变原物系的相对 挥发度。
9.8.1
恒沸精馏
1. 原理:一般在混合液中加入第三组分(称为挟带剂)
形成新的最低恒沸物。 2. 恒沸精馏挟带剂的选择
①挟带剂能与待分离组分之一(或两个)形成最低恒 沸物,并且希望与料液中含量较少的组分形成恒沸 物从塔顶蒸出,以减少操作的热能消耗。 ②新形成的恒沸物要容易分离,以回收其中的挟带剂。 ③恒沸物中挟带剂的相对含量少,这样操作较为经济。
——下降液体摩尔流量相等
(恒摩尔液流)
——本书以后介绍的精馏计算均是以恒摩尔流假设为前提
3. 塔板传质过程的简化——理论板和板效率 (1)理论板的概念
理论板是指离开该塔板的蒸气和液体
成平衡的塔板。不论进入理论板的气-液 两相组成如何,离开时两相温度相等,组 成互成平衡。 理论板是不存在的,但它可作为实际 板分离效率的依据和标准。
化工原理习题解第九章习题解

化⼯原理习题解第九章习题解第九章吸收9-1 总压为kPa 3.101、含3NH %5(体积分数)的混合⽓体,在C25下与浓度为3.71.1 m kmol 的氨⽔接触,试判别此过程的进⾏⽅向,并在c p 图上⽰意求取传质推动⼒的⽅法。
解氨—⽔平衡关系列在本章附录⼆中,需将题中组成化为其中的单位,以便⽐较。
⽓相氨分压 kPa p 065.505.03.101液相组成换算要⽤到密度,暂取3.990 m kg (参考例9-2,温度较⾼较⼩)。
对3.71.1 m kmol c 氨⽔,每⽴⽅⽶含氨kg 1.291771.1 ,含⽔kg 9.9601.29990 ;故kg 100⽔中含氨kg 03.3)9.960/1.26(100 。
与附录⼆⽐较,氨⽔组成为kg 3氨.1-100(⽔)kg ,C25下的平衡氨分压为kPa 13.3,⽐题给氨分压低,故知过程⽅向应为吸收。
(注:虽然氨⽔密度的估计稍有误差,但不影响过程⽅向。
作图从略)9-2 含%32CO (体积分数)的2CO —空⽓混合⽓,在填料塔中⽤⽔进⾏逆流吸收,操作压⼒为(绝)为kPa 200、温度为C 25,试求出塔的g 100⽔中最多可溶解多少克2CO ?其浓度⼜为多少?解出塔⽔的最⼤浓度系与逆流进塔的⽓体平衡,此时2CO 的分压kPa Py p 603.0200 ,查本章附录⼀,C 25下2CO 溶于⽔的亨利系数MPa E 166 。
按式(9-5),液相平衡组成为 153)(.1061.3101666 B A mol A mol E p x ⽽ 155max ).(1084.81061.3)1844()()(gS gA x M M x M M S A L A 即 123100.(1084.8 )g gCO浓度 335max .1001.2)1061.3()18/1000()(m kmol x M sCx c s9-3 总压kPa 3.101、含%62CO (体积分数)的空⽓,在C20下与2CO 浓度为3.3 m kmol 的⽔溶液接触,试判别其传质⽅向。
化工原理(第四版)谭天恩 第九章 吸收

32 2 3
(对双组分气体)
对双组分气体吸收,所有变量共4个: 温度T、总压P、气相组成、溶解度
c A f T , P , p A
c A f pA
----独立变量只有3个,例如:T、P、pA
在几个大气压以内、温度T一定条件下,
或 p A g c A
《化工原理》电子教案/第九章
《化工原理》电子教案/第九章
G
L
距离
CL z
16/100
双膜模型
二、吸收速率方程
pG p i N AG k G pG pi 1 kG ci c L N AL k L ci c L 1 kL
NAG= NAL
气膜 液膜
pG
组成
NAG
气相主体
pi Ci
NAL
15/100
相平衡常数,无量纲 E m P
《化工原理》电子教案/第九章
第三节 吸收过程模型及吸收速率方程
一、吸收过程模型
回忆:第八章的双膜模型 三个串联传质环节: 气体侧的对流传质 界面溶解 液体侧的对流传质
组成
气膜 液膜
pG
NAG
气相主体
pi Ci
NAL
传质方向 液相主体
NAG= NAL
对照: 间壁式换热器的传热机理
1 H kL kG
组成
气膜
液膜
pG pi
气相主体
传质方向 液相主体
Ci
K L kL
1 1 1 1 H 1 K x k x k y m K L kG k L
L
G
距离
CL z
22/100
双膜模型
《化工原理》电子教案/第九章
化工原理第九章液体精馏-精品文档

精馏操作的费用和操作压强 操作费用--液体气化需要热量(蒸汽),气体冷凝需要冷量(冷却 水); 设备费用--塔器的投资,由塔直径和塔板数(塔高)确定; 操作压强高—设备要求高,但对低沸点物质可用一般冷却介质; 操作压强低—需要真空设备,但适用高沸点和热敏性物质; 9.2 双组分溶液的气液相平衡 9.2.1 理想物系的气液相平衡 气液两相平衡共存时的自由度 N 2 2 2 2 2 相律 F 1)液相(或气相)组成与温度间一一对应关系; 2)气,液组成间的一一对应关系. 双组分理想物系的液相组成—温度(泡点)关系式 1)液相为理想液体(组分分子结构相似),服从拉乌尔定律; 2)气相为理想气体(低压气体),服从道尔顿分压定律.
1 2
量,得 y f (x) y
x 时, 1 ( 1 ) x
1
x1 1 x2 Ln Ln 1 x2 1 x1 W 1 x 1 W 2x (W 1 W 2 ) y W 2 ( x1 x 2 ) W1W2
气相产品混合组成: y x1
相平衡方程: 泡点方程: 联立可求解
y,x,泡点温度te。
9.3.2 简单蒸馏
设时刻
时,各类变量为
W , x, dw , dx ,则: dw dx W y x
d 时间后,变化了
Wx ydw ( W 小 相平衡方程 联立积分求解,当 W 得: Ln W
活度系数是温度和组成的函数可以通过活度系数关联式求得 , 各种关联式中的模型参数由实验数据拟合.
见图9-6,图9-7,图9-8,图9-9,图9-10
在中高压条件下, 需通过状态方程求取逸度系数.
总压对相平衡的影响 混合物的泡点越高,各组分挥发度的差异越小. 因此总压增高, 泡点上升, 相对挥发度减小,分离困难. 当压强大于轻组分的 临界压强时,气液共存区 缩小,分离只能在一定范 围内进行,不能得到轻组 分的高纯度产品。
09化工原理第九章习题答案

9-1、已知标准大气压下空气的干球温度为50℃,湿球温度为30℃。
求此空气的湿度、焓、相对湿度、露点、比热容及比体积。
(答:1kgkg 019.0−⋅, 1kg kJ 98−⋅,%25,24℃11K kg kJ 045.1−−⋅⋅,13kg m 925.0−⋅)解:由湿空气的H T −图查出C 50°=t ,C 30°=w t 时:1kg kg 019.0−⋅=H , 1kg kJ 98−⋅=H I ,%25=ϕ,C 24°=d t ,11K kg kJ 045.1−−⋅⋅=H C , 13kg m 925.0−⋅=H v 。
9-2、利用湿空气的性质图查出本题附表中空格项的数值,填充下表:湿空气总压强Pa100133.15×=P 序号干球温度℃湿球温度℃湿度1kg kg −⋅相对湿度%焓1kg kJ −⋅水汽分压2m kN −⋅露点℃⑴(20)(75)⑵(40)(25)⑶(35)(30)解:湿空气总压强Pa100133.15×=P 序号干球温度℃湿球温度℃湿度1kg kg −⋅相对湿度%焓1kg kJ −⋅水汽分压2m kN −⋅露点℃⑴(20)170.011(75)48 1.515.5⑵(40)28.50.0204292 3.2(25)⑶55(35)0.028271274.3(30)9-3、将温度为120℃,湿度为 1kg kg 150−⋅.的湿空气在kPa 3.101的恒定总压下加以冷却,试分别计算冷却至以下温度每kg 绝干空气所析出的水分(1)冷却到100℃;(2)冷却到50℃;(3)冷却到20℃。
(答:0,1kg kg 0638.0−⋅,1kg .1353kg 0−⋅)解:该空气在原来状态下的水汽分压为:kPa 68.1915.0622.015.03.101=+×=p ,⑴水在C 100°时的饱和蒸气压为01.3kPa 1,大于空气中水汽分压kPa 68.19,故将空气冷却到C 100°,空气仍未达到饱和状态,不会有液态水析出。
化工原理9

气液两相的接触方式
连续接触 (也称微分接触) :气、 液两相的浓度呈连续变化。如填 料塔。
溶剂 溶剂
气体
气体
规整填料 塑料丝网波纹填料
散装填料 塑料鲍尔环填料
a 微分接触
b 级式接触
图9-2 填料塔和板式塔
级式接触:气、液两相逐级接 触传质,两相的组成呈阶跃变 化。 如板式塔。
吸收过程的气液相平衡关系 气体在液体中的溶解度 气体吸收涉及到相际传质过程。
y y* y
y*=f(x)
R
o
x* x
x
结论:若系统气、液相浓度(y,x)处于平衡线上,则体系从宏 观上讲将不会发生相际间的传质,即系统处于平衡 状态。
传质过程的限度
y y P y*=f(x)
y* o
x
x* x
对吸收而言: 若保持液相浓度 x 不变,气相浓度 y 最低只能降到与之相 平衡的浓度 y*,即 ymin=y*; 若保持气相浓度 y 不变,则液相浓度 x 最高也只能升高到 与气相浓度 y 相平衡的浓度 x*,即 xmax=x*。
500
20 oC 30 oC 40 oC 50 oC
0
20
40
60 80 pNH3/kPa
100
120
20
100
120
在相同条件下,NH3 在水中的溶解度较 SO2 大得多。 用水作吸收剂时,称 NH3 为易溶气体,SO2为中等溶解气体, 溶解度更小的气体则为难溶气体(如O2 在 30℃ 和溶质的分 压为 40kPa 的条件下,1kg 水中溶解的质量仅为 0.014g)。
吸收质或溶质(solute):混合气体中的溶解组分,以A表示。 惰性气体(inert gas)或载体:不溶或难溶组分,以B表示。 吸收剂(absorbent):吸收操作中所用的溶剂,以S表示。 吸收液(strong liquor):吸收操作后得到的溶液,主要成分为 溶剂S和溶质A。 吸收尾气(dilute gas):吸收后排出的气体,主要成分为惰性 气体B和少量的溶质A。
化工原理第九章

9.5.4双组分精馏过程的其他类型 9.5.4双组分精馏过程的其他类型 1.直接蒸汽加热流程 . 适用范围:水溶液,且水是难挥发组分 与间接蒸汽加热流程相比: 与间接蒸汽加热流程相比: (1)全塔物料衡算式形式不同 ) F + S = D + W 直: FxF + S 0 = DxD +W xW F = D + W 间: W FxF = DxD + Wx
a
y
d f b b′ x*W xW xF x
xD R 精馏段: y = x+ 精馏段 R+1 R+1 W xW L' 提馏段: y = x 提馏段 V' V'
xD
根据恒摩尔流假定, 根据恒摩尔流假定,有:
乙醇乙醇-水精馏体系直接蒸汽加热
V '= S ,
L' = W
a
提馏段操作线过点 b′( x W ,0) ′ )
yA xA ( )1 = α 1α 2 ..........α n ( ) N yB xB
yA xA 当塔顶为全凝器时: 当塔顶为全凝器时: ( )1 = ( ) D yB xB
达到规定的分离要求时
xA xA ( )N ≤ ( )W xB xB
xA N xA ( ) D = α ( )W xB xB
(2)精, 提,q线方程形式相同 ) 线方程形式相同
乙醇乙醇-水精馏体系直接蒸汽加热
在相同条件(F,xF, q,D, 在相同条件( , , , xD,R 相同)下,直接蒸汽加 相同) 热与间接蒸汽加热相比, 热与间接蒸汽加热相比,操作 线不变, 线及 q 线不变, 但提馏段操作
′ 线需延长至 b′ xW ,0) Why? ( ) .
化工原理 第九章 干燥
三、对流干燥的传热传质过程
对流干燥中,传热和传质同时发生
非结合水 ------- 机械地附着在物料表面的水分,或物料堆积层 中大空隙中的水分 ps
特点:与固体相互结合力较弱,较易去除; 非结合水的性质与纯水的相同;
t
固相 水
结合水 ------- 结晶水、小毛细管内的水分、 细胞内的水分等。
特点:结合水的蒸气压低于同 温下水的饱和蒸气压; 借化学力或物理化学力 与固体相结合,较难去 除。
I v r0 cv t
6、干球温度t和湿球温度 t
1)干球温度
用普通温度计测得的湿空气的真实温度
2)湿球温度
湿球温度计在温度为t,湿度为H的不饱和空气流中,达
到平衡或稳定时所显示的温度。
t
tw
水
大量的 湿空气 t, H
表面水的分压高
水向空气 主体传递
蒸发时 需要吸热
自身降温
7、绝热饱和冷却温度 t as
绝热饱和塔示意图
8.露点td 在总压不变的条件下,将不饱和湿空气冷却,直至冷 凝出水珠为止,此时,湿空气的温度称为露点,用td表示。
特点:
p pd H Hd
d 100%
pd p H d H 0.622 0.622 P p P pd
ps , t d
H s,t d P 0.622 H s,t d
nw M w 湿空气中水汽的质量 H 湿空气中绝干空气的质量 n g M g
柴诚敬化工原理课后题答案(09)第九章 蒸馏

第九章 蒸馏1.在密闭容器中将A 、B 两组分的理想溶液升温至82 ℃,在该温度下,两组分的饱和蒸气压分别为*A p =107.6 kPa 及*B p =41.85 kPa ,取样测得液面上方气相中组分A 的摩尔分数为0.95。
试求平衡的液相组成及容器中液面上方总压。
解:本题可用露点及泡点方程求解。
()()()()95.085.416.10785.416.107总总*B*A 总*B 总*A A 总*AA =-=--==p p p p p p p p x p p y - 解得 76.99=总p kPa8808.085.416.10785.4176.99*B*A *B =--=--=p p p p x 总本题也可通过相对挥发度求解571.285.416.107*B *A ===p p α由气液平衡方程得()()8808.095.01571.295.095.01=-+=-+=y y y x α()()[]kPa 76.99kPa 8808.0185.418808.06.1071A *BA *A =-+⨯=-+x p x p p =总 2.试分别计算含苯0.4(摩尔分数)的苯—甲苯混合液在总压100 kPa 和10 kPa 的相对挥发度和平衡的气相组成。
苯(A )和甲苯(B )的饱和蒸气压和温度的关系为24.22035.1206032.6lg *A +-=t p58.21994.1343078.6lg *B +-=t p 式中p ﹡的单位为kPa ,t 的单位为℃。
苯—甲苯混合液可视为理想溶液。
(作为试差起点,100 kPa 和10 kPa 对应的泡点分别取94.6 ℃和31.5 ℃)解:本题需试差计算 (1)总压p 总=100 kPa 初设泡点为94.6℃,则191.224.2206.9435.1206032.6lg *A =+-=p 得 37.155*A =p kPa同理 80.158.2196.9494.1343078.6lg *B =+-=p 15.63*B =p kPa4.03996.015.6337.15515.63100A ≈=--=x或 ()kPa04.100kPa 15.636.037.1554.0=⨯+⨯=总p则 46.215.6337.155*B *A ===p p α6212.04.046.114.046.2)1(1=⨯+⨯=-+=x x y αα(2)总压为p 总=10 kPa通过试差,泡点为31.5℃,*A p =17.02kPa ,*B p =5.313kPa203.3313.502.17==α 681.04.0203.214.0203.3=⨯+⨯=y随压力降低,α增大,气相组成提高。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
看xW与xW’是否相等
②加料板位置一般不满足最佳加料位置 ③操作型计算必须xD, xW顶头顶脑用完N块板 (设计型往往不是正好用完N块)
xDmax、xWmin~R线性关系 ⑵R较大,物料衡算限制 xf D/F 0 xDmax=1,xW min
D 为提高产品纯度,R, F 调节,哪个更有效. D 思考: 的误差与高纯度产品关系? F
1 D/ F
例1 用精馏操作分离某双组分混合物,进料xF=0.45
D (轻组分摩尔分率), 泡点进料, 塔顶采出率 0.5, F
D 调节R, , q; xF变动, F
对xD, xW的影响
D ①R调节, , q不变 F
R↑, 操作线向对角线靠拢 当N一定时,xD↑, xW↓
D x f xW W xD x f
D ② F 调节
D ⑴R, q不变, ,( V ) F L V W W 1 V V V x D , xW D ⑵ V , q不变, ,(R↓) F L 精馏段 V 提馏段 L V W 1 W V V V
x D , xW
少而精,多而烂
D ③xF变化, , q, R不变 F x F , x D , xW
输出与输入关系
6.3 塔顶、塔底极限浓度所受限制 ①分离能力(α,N,R) ②物料衡算(xD≤1, xW≥0 ) 先分析N=∞时,xDmax=? xWmin=?
当R较小时,为(b)情况;为分离能力限制; 当R较大时出现(a)或(c)情况;为物料衡算限制。
⑵q=1, xe=xF=0.45, xe 2.5 0.45 ye 0.672 1 ( 1) xe 1 1.5 0.45
Rmin
⑶此时, 可取N=∞,以求算xDmax, 若按加料处出现挟点求算,则
x D ye 0.882 0.672 0.946 ye x e 0.672 0.45
D ①当 x f 时, F
⑴R较小,分离能力限制
L R x D max ye V R 1 x D max xe 得 xD max R( ye xe ) ye L RD qF ye xW min V ( R 1) D (1 q )F xe xW min RD qF 得x ( ye xe ) W min ye W
轻组分回收率η=0.98。已知物系α=2.5,试求: ⑴塔顶、塔底产物的浓度; ⑵最小回流比; ⑶若回流比取R=1.4;采出率不变,则塔顶产物理 论上可达到的最高浓度为多少?
Dx D F 0.98 0.45 0.882 , xD x f 解:⑴ Fx f D 0.5 Fx f Dx D 0.45 0.5 0.882 xW 0.018 FD 1 0.5
xD max R( ye xe ) ye 1.4 (0.672 0.45) 0.672 0.983
若按物料衡算求算,按xW=0计算,
x D max Fx f 0.45 0 .9 D 0 .5
所以,主要受物料衡算限制 xDmax=0.9 注意:要两头兼顾,两头验算
6.4 精馏塔的温度分布和灵敏板
灵敏板—板上液体温度对外界干扰因素的 反映最灵敏的塔板
本次讲课习题:
第九章 19,20, 21,22
பைடு நூலகம்
xD 先设xD=0.85,则 R 1 0.283 x f x D D / F 0.5 0.85 0.45 xW 0.214 1 D/ F 1 0.45
作图解, xD设得太小
xD 0 . 317 再设xD=0.95 ,则 R 1 x f x D D / F 0.5 0.95 0.45 xW 0.132 1 D/ F 1 0.45
xDmax、xWmin~R 线性关系 ⑵R较大,物料衡算限制 xf xWmin =0, x D max D / F 1
D ②当 x f 时, F
⑴R较小,分离能力限制
xD max R( ye xe ) ye RD qF xW min ye ( ye xe ) W
作图解, xD设得太大
xD 设xD=0.93,则 R 1 0.31 x f x D D / F 0.5 0.93 0.45 xW 0.148 1 D/ F 1 0.45
作图解,正好. ∴ xD=0.93, xW=0.148
6.2 操作参数对操作结果的影响
例题:已知某精馏塔具有8块理论板的分离能力。 加料为xF=0.5(摩尔分率)的苯-甲苯混合液,在第5 块理论板处进料。相对挥发度为2.5,进料为饱和
D 液体,操作回流比为2,采出率 0.45 。 F
求:塔顶、塔底浓度xD, xW
解:先作相平衡曲线 x=0.1 0.2 0.25 0.38 0.5 0.62 0.75 0.88 y=0.217,0.385,0.455,0.605,0.714,0.803,0.882,0.948 q=1,q线为垂直线,过(xF, xF)点
