2014年中国化学奥林匹克福建省赛区试题
2014年高考真题——理综化学(福建卷)含解析

2014年高考真题—化学学科(福建理综化学卷)解析版6. 下列有关物质的应用正确的是()A 生石灰用作食品的抗氧化剂B 盐类都可用做调味品C 铝罐可久盛食醋D 小苏打是面包发酵粉的主要成分之一【答案】:D【解析】生石灰具有吸水性,可用作食品干燥剂,本身不具有还原性,无法用作食品的抗氧化剂,A错;只有部分盐类可以作为调味品,B 错;铝罐容易受食醋中的醋酸腐蚀而破裂,无法久盛食醋,C错;D正确。
7.下列关于乙醇的说法不正确的是()A 可用纤维素的水解产物制取B 可由乙烯通过加成反应制取C 与乙醛互为同分异构体D 通过取代反应可以制取乙酸乙酯【答案】:C【解析】纤维素的水解产物为葡萄糖,葡萄糖在酶的作用下可以生成乙醇,A正确;乙烯与水加成可制取乙醇,B正确;乙醇与乙酸反应生成乙酸乙酯既是酯化反应,又是取代反应,D正确;乙醇与乙醛的组成元素相同,但各元素比例不同(化学式不同),两者不是互为同分异构体,C错误。
8. 下列实验能达到目的的是()A 只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液B 将NH4Cl溶液蒸干制取NH4Cl固体C 用萃取分液的方法除去酒精中的水D 用可见光束照射以区别溶液和胶体【答案】:D【解析】氨水与NaCl、Na2SO4两种溶液均不反应,与AlCl3、MgCl2反应均生成难溶物,无法通过现象来区别四种溶液,A错;NH4Cl受热易分解,B错;酒精与水能任意比混溶,无法用萃取分液的方法除去酒精中的水,C错;用可见光束照射以区别溶液和胶体,是利用胶体的丁达尔效应,D正确。
9. 常温下,下列各组物质中,Y既能与X反应又能与Z反应的是()【答案】:B【解析】②中的SiO2不能与浓盐酸反应,C、D错;常温下③中的N2与H2不反应,A错;B正确10. 下列关于0.10mol·L-1NaHCO3溶液的说法正确的是()A 溶质的电离方程式为NaHCO3 = Na+ + H+ +CO32-B 25℃时,加水稀释后,n(Na+)与n(OH-)的乘积变大C 离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-)D 温度升高,c(HCO3-)增大【答案】:B【解析】HCO3-是弱酸根离子,无法完全电离,A错;加水稀释,溶液中c(OH-)减小,但n(OH-)却增大,所以n(Na+)与n(OH-)的乘积变大,B正确;根据电荷守恒溶液中离子浓度关系应该为:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),C错;温度升高,促进HCO3-水解,则c(HCO3-)减小,D错误。
2014年高考福建卷化学精校版含解析汇报

实用标准文档文案大全2014年普通高等学校招生全国统一考试(福建卷)理科综合化学部分6.下列有关物质应用的说法正确的是A.生石灰用作食品抗氧剂 B.盐类都可作调味品C.铝罐可久盛食醋 D.小苏打是面包发酵粉的主要成分【答案】D【解析】生石灰用于做干燥剂,不能用作食品抗氧化剂,A错误;氯化钠可以用于调味品,B错误;铝与食醋反应,C错误;小苏打是面包发酵剂的主要成分之一,D正确。
7.下列关于乙醇的说法不正确的是A.可用纤维素的水解产物制取 B.可由乙烯通过加成反应制取C.与乙醛互为同分异构体 D.通过取代反应可制取乙酸乙酯【答案】C【解析】乙醇可以用纤维素的水解产物葡萄糖来制取,A正确;乙烯加成得乙醇,B正确;乙醇分子式为C2H6O,乙醛分子式为C2H4O,C 错误;乙醇和乙酸发生取代反应可制取乙酸乙酯,D正确。
8.下列实验能达到目的的是A.只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液B.将NH4Cl溶液蒸干制备NH4Cl固体C.用萃取分液的方法除去酒精中的水D.用可见光束照射以区别溶液和胶体【答案】D【解析】氨水与氯化镁氯化铝反应均生成白色沉淀,A错误;氯化铵溶液蒸干分解生成氨气和氯化氢,B错误;酒精和水互溶,C错误;区分胶体和溶液用丁达尔效应,D正确。
9.常温下,下列各组物质中,Y既能与X反应又能与Z反应的是XYZNaO溶Al(OKFeC溶Cu浓硝A.①③ B.①④ C.②④ D.②③【答案】B【解析】氢氧化铝既能与盐酸反应又能与氢氧化钠反应,①正确;二氧化硅不与盐酸反应,②错误;氮气与氧气和氢气常温下不反应,③错误;铜与氯化铁反应,与浓硝酸反实用标准文档文案大全应,④正确。
10.下列关于0.10 mol·L-1 NaHCO3溶液的说法正确的是A.溶质的电离方程式为NaHCO3=Na++ H++ CO32 -B.25 ℃时,加水稀释后,n(H+)与n(OH-)的乘积变大C.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32 -)D.温度升高,c(HCO3-)增大【答案】B【解析】碳酸氢钠电离出碳酸氢根,A错误;温度不变,Kw不变,但物质的量增加,B 正确;根据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32 -),C错误;温度升高,水解程度增大,D错误。
2011年中国化学奥林匹克福建省赛区试题答案及评分标准

2011年福建省高中学生化学竞赛预赛试题答案及评分标准第1题(11分) 1-1 (5分)黄丹粉Pb 3O 4 或者 2PbO ·PbO 2 (1分)检验:将松花蛋粉碎,加入稀HNO 3搅拌充分反应(也可加入浓HCl 加热充分反应),用稀碱调节pH 值到弱酸性,静置取上层清液,离心分离后,取出2滴清液,加入1滴稀HAc 酸化,加入0.1mol ·L -1 K 2CrO 4溶液,如有黄色沉淀,则示有铅。
(4分)【评分要点:加酸(稀HNO 3或浓HCl ) 1分, 调节pH 值 0.5分;稀HAc 酸化 0.5分,K 2CrO 4溶液 1分,黄色沉淀 1分 】 1-2 (6分)Pb 不易溶于稀HCl 、稀H 2SO 4 (1分) 因为反应的产物是微溶的PbCl 2和难溶的PbSO 4,阻止了反应的进行。
(2分) Pb 可溶热浓H 2SO 4、浓HCl 中。
(1分)Pb + 3 H 2SO 4(浓) == Pb(HSO 4)2+ SO 2↑+ 2 H 2O (1分)Pb + 4 HCl(浓) === H 2[PbCl 4] + H 2↑ (1分)第2题(8分) 2-1 (2分)第二种方法制得的NO 纯。
(1分) 因为先将NaNO 2酸化,可能发生下列反应:2 NO 2+2 H +NO + NO 2 + H 2O , 使 NO 中混有 NO 2 。
(1分)2-2 (2分)FeSO 4 + NO = [ Fe(NO)]SO 4 (2分) 2-3 (4分)N 处于第二周期,缺乏合适的空轨道接受水中氧的孤对电子,不能形成五配位的中间态。
因此,水分子负端攻击的是配位卤素原子,Cl 原子有空的d 轨道接受水分子中氧的孤对电子生成配位键,而F 原子则不能。
(2分)△△另一方面由于NF 3中F 的电负性特别大,N 上的孤对电子给予性弱于NCl 3,NCl 3中N 上的孤对电子可与H 2O 中的H 生成氢键。
2014年中国化学奥林匹克福建省赛区预赛试题答案及评分标准
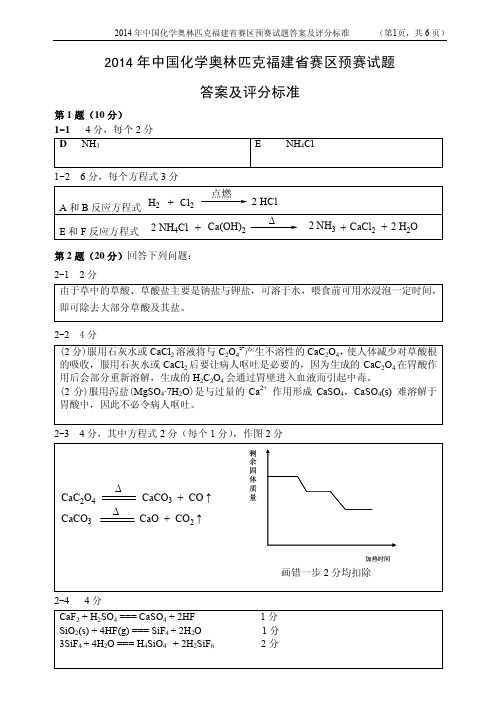
2014年中国化学奥林匹克福建省赛区预赛试题答案及评分标准第1题(10分)1-14分,每个2分D NH3E NH4Cl1-2 6分,每个方程式3分第2题(20分)回答下列问题:2-1 2分由于草中的草酸、草酸盐主要是钠盐与钾盐,可溶于水,喂食前可用水浸泡一定时间,即可除去大部分草酸及其盐。
2-2 4分(2分)服用石灰水或CaCl2溶液将与C2O42-产生不溶性的CaC2O4,使人体减少对草酸根的吸收,服用石灰水或CaCl2后要让病人呕吐是必要的,因为生成的CaC2O4在胃酸作用后会部分重新溶解,生成的H2C2O4会通过胃壁进入血液而引起中毒。
(2分)服用泻盐(MgSO4·7H2O)是与过量的Ca2+ 作用形成CaSO4,CaSO4(s) 难溶解于胃酸中,因此不必令病人呕吐。
2-3 4分,其中方程式2分(每个1分),作图2分2-4 4分CaF2 + H2SO4 === CaSO4 + 2HF 1分SiO2(s) + 4HF(g) === SiF4 + 2H2O 1分3SiF4 + 4H2O === H4SiO4 + 2H2SiF6 2分2-5 6分SiO 2 + 2Mg =====2MgO + Si 1分 Si + 2Mg =====Mg 2Si1分 Mg 2Si + 4HCl =====SiH 4 + 2MgCl 2 2分 SiH 4 + 2O 2 =====SiO 2 + 2H 2O 2分△自燃第3题(10分)3-1 6分,每个空格1分。
KAl(SO 4)2·12H 2O 没写结晶水不给分3-2 4分,以下三种解法答对一种即可。
第4题(10分)4-1 5分,每个1分A RbB TiC ZnD BrE H4-2 3分E与A形成RbH,属于离子型氢化物;1分E与B形成TiH x属于金属型氢化物,H以原子形式存在于Ti的金属晶格的间隙中,主要用作储氢合金。
2分4-32分,各1分F为Cr价电子构型为:3d54s1第5题(10分)第6题(10分)6-1 5分Li2+离子为单电子离子,3p轨道与3s、3d轨道能量简并,为-R。
第36届中国化学奥林匹克决赛试题

第36届中国化学奥林匹克决赛试题第36届中国化学奥林匹克决赛试题一、单选题1. 化学测试用来测定某种化学物质的含量,下列哪一种是错误的?A. 弹性现象B. 反应速率C. 电离平衡D. 熔点2. 下列物质属于碱性物质的是?A. 氢气B. 氯化钠C. 硫酸D. 硝酸3. 在硝酸中溶解固体金属铝,不可能得到下列何种反应?A. 氯化铝B. 氯化氢C. 氧化铝D. 氢氧化铝4. 在溶解完全的混合物中,物质的浓度最接近什么?A. 偏压B. 饱和度C. 消减系数D. 活化能5. 香草醛与亚磷酸钠发生反应,反应完成形成的哪种化学物质?A. 水B. 乙二醇C. 乙酰葡萄糖D. 氢氧化钾二、多选题1. 由金属钠发生的反应,不会产生下列哪些物质:A. 氢气B. 酸性氧化物C. 氧化物D. 氯化物2. 下列可用来确定实验结果是否准确的方法有:A. 收集试验数据B. 重复实验C. 将数据与理论结论比较D. 将得到的溶液用分析仪器进行测定3. 锂的氧化物的实验法可以分为:A. 水解法B. 气相氧化法C. 液相氧化法D. 蒸馏法4. 在化学实验中,使用比色计可以用来:A. 测定氧化还原反应的速率B. 判断溶液的温度C. 判断溶液的酸碱性D. 测定溶液电导率三、填空题1. 可以用使强酸强碱反应产生气体的温度为_ _100℃_ _ 。
2. 在室温下,盐酸发生精细化反应的反应物是 _ _铝_ _ 。
3. 电解质溶液中所含物质的电荷和数目之比为_ _全电荷:数目=1:2_ _ 。
4. 下列物质都是弱酸,包括 __乙酸、硫酸钠、硝酸钠__ 。
四、问答题1. 下列哪种是解离热的计算方法?答:解离热的计算方法是按照电解质的溶解度来确定的,一般采用的方法有牛顿-拉维克梯度法,用它来计算溶液的温度和溶解度之间的关系,从而确定溶解时的解离热。
第二十八届国化学奥林匹克福建赛区竞赛

林欣颖
安溪第一中学
黄福恭唐炳坤
朱明权
泉州市第七中学
郑木炎肖衡
郑南龙
龙岩第一中学
李元华
余标
龙岩第一中学
李元华
张芸祯
宁德第一中学
左友松
陈龙富
龙岩第一中学
童万兴
王扬齐
武平县第一中学
饶永祥
程圣
福建师范大学附属中学
陈雷吴俊杰
廖奕铭
武平县第一中学
饶永祥兰荣
石舜达
泉州市第七中学
林志鹏杨培州
谢晶妮
龙岩第一中学
童万兴
骆英豪
厦门第一中学
赖德贵陈辉明
杨元鑫
泉州市第七中学
林志鹏危云红
康韶宇
龙海第一中学
洪耀辉
杨钧麟
厦门第一中学
杨伏勇梁弘文
蒋扬天
厦门第一中学
杨伏勇朱磊
许祺航
龙海第一中学
洪耀辉
陈演鹏
厦门双十中学
陈荣地
刘启明
厦门外国语学校
朱加贤盛景云
邱赞霖
厦门第六中学
叶捷生韩晓
张传铭
泉州市第七中学
林志鹏赵明月
马建楠
宁德第一中学
左友松
钟靖
龙岩第一中学
童万兴
钟宇涛
武平县第一中学
饶永祥兰荣
吴春松
泉州市第七中学
郑木炎肖衡
梁晨
厦门第一中学
杨伏勇李玉炫
戴森源
泉州市第七中学
林志鹏庄园满
一
等
奖
黄威文
厦门第一中学
杨伏勇李杰辉
郭泓霖
泉州第一中学
杨伟清林三保
李智豪
漳平第一中学
第24届中国化学奥林匹克(初赛)试题及答案

中国化学会第 24 届全国高中学生化学竞赛(省级赛区)试卷届全国高中学生化学竞赛(省级赛区)试卷届全国高中学生化学竞赛(省级赛区)试卷 2010 年 9 月 12 日 共 8 页 1 中国化学会第中国化学会第 24 届全国高中学生化学竞赛(省级赛区)试卷届全国高中学生化学竞赛(省级赛区)试卷(2010 年 9 月 12 日)日)题号题号 1 2 3 4 5 6 7 8 9 10 11 总分总分满分满分 15 5 7 8 11 8 13 6 11 7 9 100 得分得分 阅 卷人 签名签名l 竞赛时间竞赛时间 3小时。
迟到超过半小时者不能进考场。
开始考试后小时。
迟到超过半小时者不能进考场。
开始考试后 1小时内不得离场。
时间到,把试卷(背 面朝上面朝上))放在桌面上,立即起立撤离考场。
放在桌面上,立即起立撤离考场。
l 试卷装订成册,不得拆散。
所有解答必须写在指定的位置,用铅笔解答无效(包括作图包括作图))。
草稿纸在最后。
草稿纸在最后一页。
不得将任何纸张带入考场。
一页。
不得将任何纸张带入考场。
l 凡要求计算者,须给出计算过程,没有计算过程无效。
凡要求计算者,须给出计算过程,没有计算过程无效。
l 姓名、报名号和所属学校等必须写在首页左侧指定位置,写于其他地方者按废卷论处。
l 用涂改液涂改的解答无效。
用涂改液涂改的解答无效。
l 允许使用非编程计算器以及直尺等文具。
允许使用非编程计算器以及直尺等文具。
元素周期表元素周期表H He 1.008 4.003 Li Be B C N O F 6.941 9.012 14.01 14.01 16.00 19.00 16.00 19.00 Ne 10.81 12.01 20.18 Na Mg Al Si P S Cl 22.99 24.31 26.98 28.09 30.97 32.07 35.45 Ar 39.95 K Ca Sc T i V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br 39.10 40.08 44.96 47.88 50.94 52.00 52.00 54.94 55.85 58.93 58.69 63.55 54.94 55.85 58.93 58.69 63.55 65.39 Kr 69.72 69.72 72.61 74.92 78.96 79.90 83.80 72.61 74.92 78.96 79.90 83.80 Rb Sr Y Zr Nb Mo T c Ru Rh Pd Ag Cd In Sn Sb T e I Xe 85.47 87.62 88.91 91.22 92.91 95.94 98.91 101.1 102.9 106.4 107.9 118.7 118.7 121.8 121.8 131.3 112.4 112.4 114.8 114.8 127.6 127.6 126.9 126.9 Cs Hf T a W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn Ba La -Lu 132.9 137.3 186.2 190.2 192.2 195.1 197.0 178.5 180.9 183.9 200.6 200.6 204.4 207.2 209.0 204.4 207.2 209.0 [210] [210] ] ] [222] [222] Fr Ra Ds Rg Cn Unt Uuq Uup Uuh Uus Uuo Rf Db Sg Bh Hs Mt [223] [223] [226] [226] Ac-Lr La Ce Pr Nd P m S m Eu Gd Tb Dy Ho Er T m Yb Lu Ac Th Pa U Np Pu A m C m Bk Bk Cf Es Es F m M d No Lr气体常数气体常数 R =8.31447 J K 1 mol -1 法拉第常数法拉第常数F =96485 C mol 1 阿佛加德罗常数阿佛加德罗常数 N 23 mol1 A =6.022142×6.022142×10 10 第 1 题 (15 分) 1-1 2009 年 10 月合成了第月合成了第 117 号元素,从此填满了周期表第七周期所有空格,是元素周期系发展的一个里程号元素,从此填满了周期表第七周期所有空格,是元素周期系发展的一个里程 碑。
2014年中国化学奥林匹克福建赛区试题

2014年中国化学奥林匹克福建省赛区试题————————————————————————————————作者:————————————————————————————————日期:2014年中国化学奥林匹克福建省赛区试题第1题(10分)A-H分别代表单质或化合物,它们之间的转换关系如下图所示,其中A、B、C、D为气体,E、F为固体,G是氯化钙。
1-1写出D、E的化学式(分子式)D E1-2分别写出A和B反应生成C;E和F反应生成D、G和H的反应方程式。
A和B的反应方程式E和F的反应方程式第2题(20分)回答下列问题:2-1稻草及水稻收获后的再生稻制成的干草中均含有较多量的草酸盐(以钠盐、钾盐为主),草酸及草酸盐可显着降低动物对矿物质元素的利用率,并能对很多器官造成损害,引起中毒。
使少用该类饲料喂食动物需要降低生命体对草酸盐的摄入,提出1种最简单的方式。
2-2人误吞食草酸及草酸盐进入人体内会中毒,通常的处理办法是:尽快服用一杯石灰水或1%CaCl2溶液,随即让病人呕吐几次,然后再用10~30g的泻盐溶于水中让病人服用,服用后不必再让人呕吐,试解释这种处理方法的原因。
2-3草酸钙加热易分解,取取草酸钙固体加热到1000℃,写出反应方程式,并绘出草酸钙固体在加热的条件下剩余固体物质的质量随时间变化图。
2-4玻璃画有很好的装饰效果,通常将玻璃涂上石蜡,石蜡上刻出花纹,使用萤石粉和浓硫酸1:1配成糊状,涂抹在刻好花纹的玻璃上,过一十几分钟洗去,刮掉石蜡,即可形成玻璃画。
写出反应方程式。
2-5把研细的石英粉和重得多的镁粉混合均匀后放在铁坩埚中,将擦净的镁条插入混台物中央,引燃镁条后激发反应,生成固体。
冷却后用6mol·dm-3盐酸洗坩埚中物质时,有火光出现。
写出相应的反应方程式。
第3题(10分)铝在生活中有很多应用,回答下列问题:3-1生活中有不少饮料是采用易拉罐包装,易拉罐可进行回收利用。
以下是某学生设计的用废旧易拉罐制备净水剂明矾的简单流程图,用物质的分子式或者某种化学操作填写流程图中空格部分。
中国化学会全国高中学生化学竞赛省级赛区试题及答案

第27届中国化学奥林匹克(初赛)试题、解答、评分标准及评分细则第1题(12分) 写出下列化学反应的方程式1-1 加热时,三氧化二锰与一氧化碳反应产生四氧化三锰。
1-2 将KCN 加入到过量的CuSO 4水溶液中。
1-3 在碱性溶液中,Cr 2O 3和K 3Fe(CN)6反应。
1-4 在碱性条件下,Zn(CN)42?和甲醛反应。
1-5 Fe(OH)2在常温无氧条件下转化为Fe 3O 4。
1-6 将NaNO 3粉末小心加到熔融的NaNH 2中,生成NaN 3(没有水生成)。
1-1 3Mn 2O 3+CO =2Mn 3O 4+CO 2 2分 1-2 4CN ?+2Cu 2+=2CuCN +(CN)2 2分 1-3 Cr 2O 3+6Fe(CN)63?+10OH ? =2CrO 42?+6Fe(CN)64?+5H 2O 2分 1-4 Zn(CN)42?+4H 2CO +4H 2O =4 HOCH 2CN +Zn(OH) 42?? 2分 1-5 3Fe(OH)2=Fe 3O 4+H 2+2H 2O 2分 1-6 NaNO 3+3NaNH 2=NaN 3+NH 3+3NaOH 2分 1方程式正确才能得满分。
2若全部物质皆写对而未配平,可得1分。
第2题(23分) 简要回答或计算2-1 Bi 2Cl 82-离子中铋原子的配位数为5,配体呈四角锥型分布,画出该离子的结构并指出Bi 原子的杂化轨道类型。
Bi 2Cl 82-的结构:ClClBiClClCl2-或ClClClClCl2- 2分.......未画成楔形键不扣分;不画电子对不扣分;若画了电子对且画成如上图(蓝)所示的连线,则与电子对相连的线不画成虚线(左)、虽画成虚线但远离Bi 原子,扣0.5分杂化轨道类型:sp 3d 2 1分2-2在液氨中,E θ(Na +/Na)=-1.89V ,E θ(Mg 2+/Mg)=-1.74V ,但可以发生Mg 置换Na 的反应:Mg +2NaI =MgI 2+2Na ,指出原因。
第34届中国化学奥林匹克竞赛决赛试题

第34届中国化学奥林匹克竞赛决赛试题选择题(10道):
在下列元素中,哪个元素的原子半径最大?
a) 氧 (O)
b) 氮 (N)
c) 硫 (S)
d) 磷 (P)
下列哪个化合物是无机酸?
a) 乙醇 (C2H5OH)
b) 硝酸 (HNO3)
c) 乙酸 (CH3COOH)
d) 甲烷 (CH4)
下列哪个化学方程式代表了一种氧化反应?
a) 2H2 + O2 → 2H2O
b) 2Na + Cl2 → 2NaCl
c) 2H2O → 2H2 + O2
d) 2HCl + NaOH → NaCl + H2O
填空题(5道):
氨气的化学式是______。
铁的化学符号是______。
水的化学式是______。
氧气的化学式是______。
氯气的化学式是______。
解答题(6道):
解释什么是酸碱中和反应。
举例说明氧化还原反应。
解释什么是共价键和离子键。
解释什么是化学平衡。
举例说明酸的性质。
解释什么是化学键能。
2008全国高中化学奥林匹克(省级赛区)试题及答案

为什么选取冰和二水合石膏作对比?实验结果说明什么? 圣才学习网
N
N
N N
N N
N N
也得 2 分。 但画成
只得 1 分。
gypsum
圣才学习网
Ikaite 在冷水中形成,而且含有大量结晶水,分解温度又接近冰的熔点,可能与冰的 结构有相似性,故选取冰作参比物; (0.5 分) 石膏是带结晶水的钙的含氧酸盐,而且钙的配位数也是 8,可能与 ikaite 结构相似, 故选取石膏作参比物。 (0.5 分) 实验结果说明 ikaite 的结构跟冰相似。 (1 分) 实验结果,说明含水的摩尔分数越大膨胀越大, 可以得 0.5 分。 5-3 这种晶体属于哪种类型的晶体?简述理由。 分子晶体。 (0.5 分) 答混合型晶体不得分。 晶体分解温度接近冰的熔点,体积随温度的变化趋势也接近冰,可认为晶体中的化学 微粒是 CaCO3 6H2O,它们以分子间作用力(氢键和范德华力)构成晶体。(0.5 分)
圣才学习网
中国化学会第 22 届全国高中学生化学竞赛(省级赛区) 试题、标准答案及评分细则 2008 年 9 月 18 日 题号 满分 1 14 2 5 3 4 4 10 5 5 6 11 7 14 8 9 9 7 10 11 11 10 总分 100
评分通则:1.凡要求计算的,没有计算过程,即使结果正确也不得分。 2 有效数字错误,扣 0.5 分,但每大题只扣 1 次。 3 单位不写或表达错误,扣 0.5 分,但每大题只扣 1 次。 4 只要求 1 个答案、而给出多个答案,其中有错误的,不得分。 5 方程式不配平不得分。 6 不包括在此标准答案的 0.5 分的题,可由评分组讨论决定是否给分。 第 1 题 (14 分) 1-1 EDTA 是乙二胺四乙酸的英文名称的缩写,市售试剂是其二水合二钠盐。 (1)画出 EDTA 二钠盐水溶液中浓度最高的阴离子的结构简式。
2016年中国化学奥林匹克(初赛)试题、答案、评分标准与细则

第30届中国化学奥林匹克(初赛)试题、答案及评分标准第1题(8分)1-1离子化合物A2B由四种元素组成,一种为氢,另三种为第二周期元素。
正、负离子皆由两种原子构成且2242年才被用作牙膏的添加剂和补牙填充剂成分。
A是离子晶体,由NaF和NaPO3在熔融状态下反应得到。
它易溶于水,阴离子水解产生氟离子和对人体无毒的另一种离子。
1-4-1写出合成A的反应方程式。
第2题(9分)鉴定NO3–离子的方法之一是利用“棕色环”现象:将含有NO3–的溶液放入试管,加入FeSO4,混匀,然后顺着管壁加入浓H2SO4,在溶液的界面上出现“棕色环”。
分离出棕色物质,研究发现其化学式为[Fe(NO)(H2O)5]SO4。
该物质显顺磁性,磁矩为3.8 μB (玻尔磁子),未成对电子分布在中心离子周围。
2-1写出形成“棕色环”的反应方程式。
2-2推出中心离子的价电子组态、自旋态(高或低)和氧化态。
第3题(13分)3-1好奇心是科学发展的内在动力之一。
P2O3和P2O5是两种经典的化合物,其分子结构已经确定。
自然而然会有如下问题:是否存在磷氧原子比介于二者之间的化合物?由此出发,化学家合成并证实了这些中间化合物的存在。
3-1-1写出这些中间化合物的分子式。
3-1-2 画出其中具有2重旋转轴的分子的结构图。
根据键长不同,将P-O键分组并用阿拉伯数字标出(键长相同的用同一个数字标识)。
比较键角∠O-P(V)-O和∠O-P(III)-O的大小。
3-2NH3分子独立存在时H-N-H键角为106.7o。
右图是[Zn(NH3)6]2+离子的部分结构以及H-N-H键角的测量值。
解释配合物中H-N-H键角变为109.5o的原因。
3-3 量子化学计算预测未知化合物是现代化学发展的途径之一。
2016年2月有人通过计算预言铁也存在四氧化物,其分子构型是四面体,但该分子中铁的氧化态是+6而不是+8。
3-3-1 写出该分子中铁的价电子组态。
正确画出四个氧原子围绕中心铁原子形成四面体分布且示出两个氧之间的过氧键,得满分;若正确画出四面体分布但未示出过氧键,得2分;其他答案不得分。
第35届中国化学奥林匹克竞赛初赛试题(福建卷)

第 35 届中国化学奥林匹克(初赛)试题福建卷第 1 题(23 分)氟及化合物1-1德国人斯瓦恩哈德是从事玻璃加工的一名工人。
1670 年,他无意中将萤石与浓硫酸 1 : 1 混合在一起,结果产生了一种具有刺激性气味的烟雾,他发现这种气体能腐蚀玻璃,从而研究出一种不用金刚石或其他磨料也可以在玻璃上刻蚀图案的方法。
利用这种方法,斯瓦恩哈德制成了许多玻璃艺术品,成为有名的玻璃雕刻艺术家。
写出上述化学反应方程式。
1-2单质氟的制备是化学史上一段悲壮的历史,有多位化学家中毒,甚至付出生命,但是化学家们不畏艰难、前仆后继。
终于,1886 年法国化学家莫瓦桑在总结前人经验与教训的基础上,在低温下电解熔融的氟化氢钾制得单质氟,这距离氢氟酸的发现已经过去一百多年之久。
写出电解制备单质氟的反应方程式。
1-3又过了整整一百年,化学方法制取 F2 获得成功。
其步骤如下:在 HF、KF 存在下,用KMnO4 氧化 H2O2;SbCl5 和 HF 反应;K2MnF6 和 SbF5 反应。
写出各步的化学反应方程式。
1-4氟单质的反应性非常强,可与稀有气体氙发生反应。
已知:Xe(g) + 2F2(g) = XeF4(g) K p = 1.07 × 108(523 K),K p = 1.98 × 103(673 K)Xe(g) + 3F2(g) = XeF6(g) K p = 1.01 × 108(523 K),K p = 36.0(673 K)XeF6 的立方晶型中有四聚体单元,Xe 与其中 5 个 F 的键长为 184 pm,与第 6 个 F 的键长为223 pm。
1-4-1在满足反应速率的前题下,应如何控制温度才有利于 XeF6 的生成。
1-4-2若在523 K 下以Xe 和F2 制取XeF6,并使产物中 XeF6/XeF4 > 10,计算说明 F2 的平衡分压至少应保持在标准压力的多少倍(精确到小数点后第一位)?1-4-3指出XeF6 气体的分子构型。
2015年中国化学奥林匹克福建省赛区预赛试题答案及评分标准

CH3 CH3
2015 年中国化学奥林匹克福建省赛区预赛试题答案及评分标准
(第6页,共 7 页)
10-2 (2 分, 每个 0.5 分, 写出这 4 个答案以外者每个倒扣 0.5 分, 但最高扣分不超过 2 分。 )
CH2CH2OH
H OH
OH H
CH2OCH3
10-3 (3 分, 每个 0.5 分, 写出这 6 个答案以外者每个倒扣 0.5 分, 但最高扣分不超过 3 分。 )
x=
2.000 -25.941 0.0173 151.915-25.941
= 0.0123 mol
LiPF6的百分含量 =
0.0123 151.915 100 % 2.000
其他计算方法只要合理,列式、结果正确也得分。
第 3 题(11 分) 3-1 (2 分) 基本形状对即可给分。
·· ·· · · · ·Cl ·Cl · ·· ··
淀粉 KI 试纸变蓝 Cl2+2Br ===Br2+2Cl
- -
确认 C 的黄色溶液中无 Cl2,排除 Cl2 对溴置换碘实验的干扰
操作(2 分) 打开活塞 b,将少量 C 中溶液滴入 D 中,关 闭活塞 b,取下 D 振荡。 1 - 6 (1 分) 原子半径逐渐增大
3-2
(2 分)
TenS8-n 更不稳定;由于碲原子和硫原子半径相差较大,碲原子不易嵌入 S8 环中,因此生成 的环状化合物稳定性差。 3-3 (2 分) 酸性: H2S<H2Se<H2Te;因为硒、碲离子的半径大,与氢直接相连的原子电子云减低,与氢 离子之间的引力逐渐减弱,电离度逐渐增大。 3-4 (1 分) 硒酸的氧化性强于硫酸。 3-5 (4 分,每个方程式 2 分) 2HCl+H2SeO4===H2SeO3+H2O+Cl2↑ H2SeO3+2SO2 +H2O === 2H2SO4+Se 第 4 题(10 分) 4-1 N2O (4 分) NO NO2 N2O3 N2O5 N2O4 NO3 (1 分,写出前六种 0.5 ,写出 NO3 0.5 )
2014年福建省高考化学试卷答案与解析

2014年福建省高考化学试卷参考答案与试题解析一、选择题(共7小题,每小题6分,满分42分)6OX反应又能与Z反应的是()﹣111.(6分)(2014•福建)某电源装置如图所示,电池总反应为2Ag+Cl2═2AgCl.下列说法正确的是()(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)B二、解答题24.(15分)(2014•福建)元素周期表中第ⅦA 族元素的单质及其化合物的用途广泛.(1)与氯元素同族的短周期元素的原子结构示意图为 .(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是 bc (填序号)a .Cl 2、Br 2、I 2的熔点b .Cl 2、Br 2、I 2的氧化性c .HCl 、HBr 、HI 的热稳定性d .HCl 、HBr 、HI 的酸性(3)工业上,通过如下转化可制得KClO 3晶体:NaCl 溶液NaClO 3溶液KClO 3晶体①完成Ⅰ中反应的总化学方程式: 1 NaCl+ 3 H 2O ═ 1 NaClO 3+ 3 H 2↑ . ②Ⅱ中转化的基本反应类型是 复分解反应 ,该反应过程能析出KClO 3晶体而无其他晶体析出的原因是 室温下KClO 3在水中的溶解度明显小于其它晶体 .(4)一定条件下,在水溶液中1mol Cl 、ClO x (x=1,2,3,4)的能量(kJ )相对大小如图所示.①D是ClO4﹣(填离子符号).②B→A+C反应的热化学方程式为3ClO﹣(aq)=ClO3﹣(aq)+2Cl﹣(aq)△H=﹣117kJ/mol (用离子符号表示).的原子结构示意图为25.(15分)(2014•福建)铁及其化合物与生产、生活关系密切.(1)如图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图.①该电化腐蚀称为吸氧腐蚀.②图中A、B、C、D、四个区域,生成铁锈最多的是B(填字母).(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:①步骤Ⅰ若温度过高,将导致硝酸分解.硝酸分解的化学方程式为4HNO34NO2↑+O2↑+2H2O.②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O═2Fe2O3•nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为4Fe+10HNO3═4Fe (NO3)2+NH4NO3+3H2O.③上述生产流程中,能体现“绿色化学”思想的是氮氧化物排放少(任写一项).(3)已知t℃时,反应FeO(s)+CO(g)⇌Fe(s)+CO2(g)的平衡常数K=0.25.①t℃时,反应达到平衡时n(CO):n(CO2)=4:1.②若在1 L密闭容器中加入0.02mol FeO(s),并通入x mol CO,t℃时反应达到平衡.此时FeO(s)转化率为50%,则x=0.05.K=34NO 34NOK==K=26.(2014•福建)焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一.某研究小组进行如下实验:实验一焦亚硫酸钠的制取采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5.装置Ⅱ中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2═Na2S2O5(1)装置Ⅰ中产生气体的化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是过滤.(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹时仪器已略去)为d(填序号)实验二焦亚硫酸钠的性质Na2S2O5溶于水即生成NaHSO3.(4)证明NaHSO3溶液中HSO3﹣的电离程度大于水解程度,可采用的实验方法是ae.a.测定溶液的pH b.加入Ba(OH)2溶液c.加入盐酸d.加入品红溶液e.用蓝色石蕊试纸检测(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是取少量Na2S2O5晶体于试管中,加入适量水溶解,滴加盐酸,振荡,再滴加氯化钡溶液,有白色沉淀生成.实验三葡萄酒中抗氧化剂残留量的测定(6)葡萄酒常用Na2S2O5作抗氧化剂.测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:(已知:滴定时反应的化学方程式为SO2+I2+2H2O═H2SO4+2HI)①按上述方案实验,消耗标准I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为0.16g•L﹣1.②在上述实验过程中,若有部分HI被空气氧化,则测定结果偏低(填“偏高”“偏低”或“不变”).计算)为=0.16 g/L[化学-物质结构与性质]34.(13分)(2014•福建)氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.(1)基态硼原子的电子排布式为1s22s22p1.(2)关于这两种晶体的说法,正确的是bc(填序号).a.立方相氮化硼含有σ键和π键,所以硬度大b.六方相氮化硼层间作用力小,所以质地软c.两种晶体中的B﹣N键均为共价键d.两种晶体均为分子晶体(3)六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为平面三角形,其结构与石墨相似却不导电,原因是层状结构中没有自由移动的电子.(4)立方相氮化硼晶体中,硼原子的杂化轨道类型为sp3.该晶体的天然矿物在青藏高原地下约300km的古地壳中被发现.根据这一个矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是高温高压.(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一.1molNH4BF4含有2mol 配位键.[化学-有机化学基础]35.(13分)(2014•福建)叶酸是维生素B族之一,可以由下列甲、乙、丙三种物质合成.(1)甲中显酸性的官能团是羧基(填名称).(2)下列关于乙的说法正确的是ac(填序号)a.分子中碳原子与氮原子的个数比是7:5b.属于芳香族化合物c.既能与盐酸又能与氢氧化钠溶液反应d.属于苯酚的同系物(3)丁是丙的同分异构体,且满足下列两个条件,丁的结构简式为.a.含有b.在稀硫酸中水解有乙酸生成(4)甲可以通过下列路线合成(分离方法和其他产物已经略去)①步骤Ⅰ的反应类型是取代反应.②步骤Ⅰ和Ⅳ在合成甲过程中的目的是保护氨基.③步骤Ⅳ反应的化学方程式为.)丙的同分异构体丁中含有、在稀硫酸中水解有乙酸生成,说明发生取代反应生成,,戊发生水解反应生成甲.)丙的同分异构体丁中含有、在稀硫酸中水解有乙酸生成,说明故答案为:发生取代反应生成,,和银氨溶液发生氧化反应然后酸化得到戊,戊,戊发生水解反应生成甲;。
2014年第28届中国化学奥林匹克(初赛)省一等奖获奖名单(福建赛区)
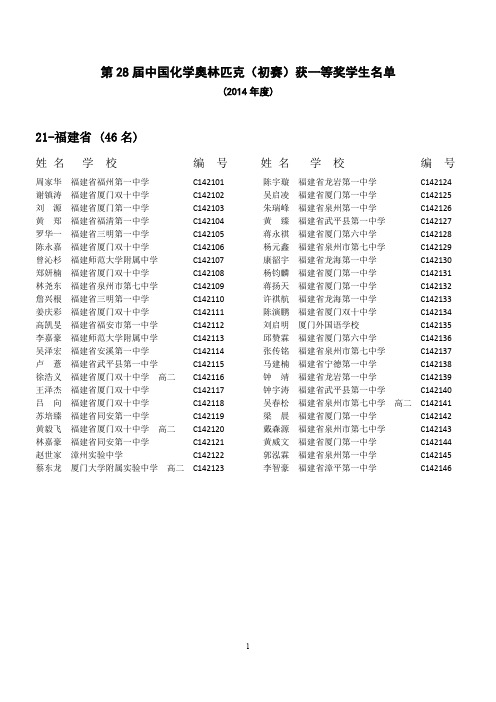
第28届中国化学奥林匹克(初赛)获一等奖学生名单(2014年度)21-福建省 (46名)姓名学校编号姓名学校编号周家华福建省福州第一中学C142101 谢镇涛福建省厦门双十中学C142102 刘源福建省厦门第一中学C142103 黄郑福建省福清第一中学C142104 罗华一福建省三明第一中学C142105 陈永嘉福建省厦门双十中学C142106 曾沁杉福建师范大学附属中学C142107 郑妍楠福建省厦门双十中学C142108 林尧东福建省泉州市第七中学C142109 詹兴根福建省三明第一中学C142110 姜庆彩福建省厦门双十中学C142111 高凯旻福建省福安市第一中学C142112 李嘉豪福建师范大学附属中学C142113 吴泽宏福建省安溪第一中学C142114 卢薏福建省武平县第一中学C142115 徐浩义福建省厦门双十中学高二C142116 王泽杰福建省厦门双十中学C142117 吕向福建省厦门双十中学C142118 苏培臻福建省同安第一中学C142119 黄毅飞福建省厦门双十中学高二C142120 林嘉豪福建省同安第一中学C142121 赵世家漳州实验中学C142122 蔡东龙厦门大学附属实验中学高二C142123陈宇璇福建省龙岩第一中学C142124 吴启凌福建省厦门第一中学C142125 朱瑞峰福建省泉州第一中学C142126 黄臻福建省武平县第一中学C142127 蒋永祺福建省厦门第六中学C142128 杨元鑫福建省泉州市第七中学C142129 康韶宇福建省龙海第一中学C142130 杨钧麟福建省厦门第一中学C142131 蒋扬天福建省厦门第一中学C142132 许祺航福建省龙海第一中学C142133 陈演鹏福建省厦门双十中学C142134 刘启明厦门外国语学校C142135 邱赞霖福建省厦门第六中学C142136 张传铭福建省泉州市第七中学C142137 马建楠福建省宁德第一中学C142138 钟靖福建省龙岩第一中学C142139 钟宇涛福建省武平县第一中学C142140 吴春松福建省泉州市第七中学高二C142141 梁晨福建省厦门第一中学C142142 戴森源福建省泉州市第七中学C142143 黄威文福建省厦门第一中学C142144 郭泓霖福建省泉州第一中学C142145 李智豪福建省漳平第一中学C1421461。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2014年中国化学奥林匹克福建省赛区试题
第1题(10分)A-H分别代表单质或化合物,它们之间的转换关系如下图所示,其中A、B、C、D 为气体,E、F为固体,G是氯化钙。
第2题(20分)回答下列问题:
2-1稻草及水稻收获后的再生稻制成的干草中均含有较多量的草酸盐(以钠盐、钾盐为主),草酸及草酸盐可显着降低动物对矿物质元素的利用率,并能对很多器官造成损害,引起中毒。
使少用该类饲料喂食动物需要降低生命体对草酸盐的摄入,提出1种最简单的方式。
2-2人误吞食草酸及草酸盐进入人体内会中毒,通常的处理办法是:尽快服用一杯石灰水或1%CaCl2溶液,随即让病人呕吐几次,然后再用10~30g的泻盐溶于水中让病人服用,服用后不必再让人呕吐,试解释这种处理方法的原因。
2-3草酸钙加热易分解,取取草酸钙固体加热到1000℃,写出反应方程式,并绘出草酸钙固体在加热的条件下剩余固体物质的质量随时间变化图。
2-4玻璃画有很好的装饰效果,通常将玻璃涂上石蜡,石蜡上刻出花纹,使用萤石粉和浓硫酸1:1配成糊状,涂抹在刻好花纹的玻璃上,过一十几分钟洗去,刮掉石蜡,即可形成玻璃画。
写出反应方程式。
2-5把研细的石英粉和重得多的镁粉混合均匀后放在铁坩埚中,将擦净的镁条插入混台物中央,引燃镁条后激发反应,生成固体。
冷却后用6mol·dm-3盐酸洗坩埚中物质时,有火光出现。
写出相应的反应方程式。
第3题(10分)铝在生活中有很多应用,回答下列问题:
3-1生活中有不少饮料是采用易拉罐包装,易拉罐可进行回收利用。
以下是某学生设计的用废旧易拉罐制备净水剂明矾的简单流程图,用物质的分子式或者某种化学操作填写流程图中空格部分。
3-2铝粉和NH4CI04和混合可制成固体推进剂,估算高氯酸按和铝粉的质质量比为多少较好。
(相对原子质量:N 14,Cl 35.5,AI 27.0)
第4题(10分)元素周期表是学习化学的导航图,回答下列问题:
4-1A、B、C、D、E五种元素,A是IA族第五周期元素,B是第四周期元素,E是第一周期元素,B、C、D、E的价电子分别为4、2、7和1个,五个元素的原子序数从小到大的顺序依次是E、B、C、D、
4-2元素E与B形成的化合物从成键方面与元素E与A形成的化合物有什么不同?元素E与B的化合物重要用途是什么?
4-3元素F的+6价含氧酸盐在酸性介质中是强氧化剂,而该元素的+3价氧化物具有两性。
写出F的元素符号和其价的电子构型。
第5题(10分)pθ25℃时,丙烯晴(CH2=CH-CN)、石墨和氢气的燃烧热分别为-1758,-393和-285.9kj▪mol-1;HCN(g)的生成焓分别为129.7和226.7kJ▪mol-1。
已知pθ下CH2=CH-CN的凝固点为-82℃,沸点为78.5℃,在25℃时汽化热为32.84 kj▪mol-1。
求25℃及pθ下,反应C2H2(g)+HCN(g)
CH2=CH-CN(g)的Δr H θ
(298k)。
第6题(10分)根据结构化学的知识,回答下列问题:
6-1已知类氢离子的原子轨道能量为即轨道能量与核电荷数的平方成正比,与主量子数平方成
反比,R为比例常数;而多电子原子的轨道能量可用一个经验公式表示:σ为屏蔽常数。
试比较Li2+与Li原子的3p轨道能量高低,简要说明理由。
请说明3p轨道的图形有几个节面,在何处?
6-2氧气是大气组成中与生命相关的气体,请写出O2分子基态的分子轨道表达式(电子组态),并指出分子所属的对称点群。
第7题(10分)在酸性介质中,用一定体积(mL)的KMnO4标准溶液恰能氧化一定质量的
KHC2O4▪H2C2O4▪2H2O试样:同样质量的KHC2O4▪H2C2O4▪2H2O试样又恰能被所需KMnO4体积(mL)两倍的0.2000mol/L NaOH标准溶液所中和。
[提示:5C2O42-+2MnO4-+16H+ =10CO2+2Mn2++8H2O]
7-1写出相关中和反应的化学反应方程式。
7-2计算KMnO4标准溶液的浓度。
7-3指出NaOH滴定KHC2O4▪H2C2O4▪2H2O溶液所使用的指示剂及终点颜色变化。
第8题(10分)制备溴苯的实验装置如下图,将液溴从恒压滴液漏斗慢慢滴入盛有苯和铁粉的烧瓶A。
反应结束后,向A中加入少量水,过滤除去铁粉,滤液转移到盛有氢氧化钠溶液的分液漏斗D中,充分震荡后分去水层,有机层在经水洗、干燥、蒸馏后得到溴苯。
8-1写出A中的化学反应方程式。
8-2滤液在D中与氢氧化钠溶液充分振荡的目的是什么?振荡后有红褐色沉淀生成,该沉淀是什么?写出在D发生的有关化学反应化学方程式。
8-3 B中盛放的CCl4的作用是什么
8-4为证明苯和液溴发生的是取代反应而不是加成反应,可向C中加入试剂E若有淡黄色沉淀生成,则可证明发生了取代反应,请写出试剂E的名称。
若反应时C中的液体改用氢氧化钠溶液,应如何证明发生了取代反应?
第9题(10分)某化合物A的结构式如下:
9-2 A分别与24(过量)、3、反应,所得主要产物分别为B、C、D,请写出其结构简式。
9-3 A在硫酸水溶液中加热,得到分子式为C24H34ClNO2的产物E,请写出其结构简式。
9-4 D与过量的氢气在Pd/C催化剂存在下加热、加压反应,得到分子式为C25 H46N2O的产物F,请
个应用实例:
10-1写出上述合成路线中G—N、P—R的结构简式并用系统命名法命名化合物O。
(本体忽略各产物的立体异构体)。
10-2请分别指出反应G→I,J→K,L→P,M→O所属的反应类型。
某未知化合物S,既不溶于稀酸,也不溶于稀碱溶液。
请根据下列反应结果写出化合物S—W的结构简式。
