教学案例库(重金属-镉检测).doc
(完整word版)镉的测定

1主题内容与合用范围本标准规定了各种食品中镉的测定方法。
本标准合用于各种食品中镉的测定。
最低检出浓度:石墨炉原子化法为μg/kg;火焰原子化法为μg/kg;比色法为 50μg/kg。
第一篇石墨炉原子汲取光谱法(第一法 )2原理样品经灰化或酸消解后,注入原子汲取分光光度计石墨炉中,电热原子化后汲取 228.8nm 共振线,在必定浓度范围,其汲取值与镉含量成正比,与标准系列比较定量。
3试剂剖析过程中所有用水均使用去离子水(电阻率在 8×10<SUP>5</SUP>Ω以上 ),所使用的化学试剂均为优级纯以硝酸。
硫酸。
过氧化氢 (30%)。
高氯酸。
硝酸 (1+1):取 50mL 硝酸,慢慢加入 50mL 水中。
硝酸 (0.5mol/L) :取硝酸,加入 50mL 水中,稀释至100mL。
盐酸 (1+1):取 50mL 盐酸,慢慢加入 50mL 水中。
磷酸铵溶液 (20g/L) :称取 2.0g 磷酸铵,以水溶解稀释至100mL。
混淆酸:硝酸十高氯酸(4+1)。
取4份硝酸与1份高氯酸混淆。
3.10 镉标准贮备液:正确称取 1.000g 金属镉 (99.99%),分次加 20mL 盐酸 (1+ 1)溶解,加 2 滴硝酸,移入 1000mL 容量瓶,加水至刻度。
混均。
此溶液每毫升含 1.0mg 镉。
镉标准使用液:每次汲取镉标准贮备液10.0mL 于100mL 容量瓶中,加硝酸 (0.5mol/L) 至刻度。
这样经多次稀释成每毫升含镉的标准使用液。
4仪器所用玻璃仪器均需以硝酸(1+5)浸泡留宿,用水频频冲刷,最后用去离子水冲冼洁净。
原子汲取分光光度计(附石墨炉及铅空心阴极灯)。
马弗炉。
恒温干燥箱。
瓷坩埚。
压力消解器、压力消解罐或压力溶弹。
可调式电热板、可调式电炉。
5剖析步骤样品预办理在采样和制备过程中,应注意不使样品污染。
粮食、豆类去杂质后,磨碎,过20 目筛,储于塑料瓶中,保留备用。
本科毕业论文答辩四种地黄丸中重金属元素铅和镉的测定课件

前言 重金属的危害
➢的威胁。
➢ 重金属对人体的危害,一方面通过直接饮用造 成重金属中毒而损害人体健康;另一方面,间 接污染农产品或水产品,通过食物链对人体健 康构成威胁。
➢ 重金属能抑制人体化学反应酶的活动,使细胞 质中毒,从而伤害神经组织,还可导致直接的 组织中毒,损害人体解毒功能的关键器官—肝、 肾等组织。
前言
选题目的 中医药治疗效果取决于中药材的质量,中药材
是中成药的重要原料,中药材中的重金属是中成药 中重金属的主要来源。我国的重金属残留量的测定 不是很完善,采用石墨炉原子吸收光谱法,对中医 残留的重金属元素铅和镉的测定,并为中成药的生 产提供的参考资料。
实验部分
研究方法
本文以六味地黄丸、杞菊地黄丸、知柏地黄丸、桂附地黄丸为原料, 四种地黄丸经微波消解后,采用石墨炉原子吸收光谱法,测定四种地 黄丸中铅和镉元素的残留量。
本论文主要内容
一、前言 二、实验部分 三、结果与讨论 四、结论 五、致谢
前言 重金属污染
重金属:重金属目前尚无统一的定义,但一般认 为金属的比重大于5(或4以上)者为重金属。
从污染方面所讲的重金属,实际上就是铅、铬、 镉以及类金属砷等具有很大毒性的元素就是在环 境污染研究中所指的重金属。当然也包含一些如 铜、锌、钴、镍等具备一定毒性的重金属。
研究路线
查阅文献
确定研究方案
装置仪器
得出结论
分析实验结果
反复进行实验
实验部分 实验装置
实验部分 样品的预处理
精确称取四种地黄丸粗粉0.5000g放于聚四 氟乙烯消解罐内,加硝酸4.00mL,混合均 匀,浸泡过夜,盖好内盖,旋紧外套,放 入适合的微波消解炉内,进行消解。完全 消解后,取消解內罐置加热仪上慢慢加热 直至红棕色蒸气挥发完全,并继续慢慢浓 缩至2~3mL,放冷却机上放冷,用去离子 水转入25mL容量瓶中,并用去离子水定容 至刻度线,混匀,得到样品溶液。同法同 时制备试剂空白溶液 。
水中重金属镉(cd)的检测(pdf)

镉天然水中镉含量甚微,一般均低于10μg/L。
水中镉可用原子吸收法及双硫腙分光光度法。
原子吸收法快速简便。
双硫腙法也可得到满意结果,但手续繁琐。
一、原子吸收分光光度法参阅铜进行。
1、精密度与准确度有18个实验室用本法测定含镉27μg/L的合成水样,其他离子浓度(μg/L)为:汞,4.4;锌,26;铜,37;铁,7.8;锰,47。
测定镉的相对标准差为4.6%,相对误差为3.7%。
二、双硫腙分光光度法1、应用范围1.1 本法适用于测定饮用水及其水源水中镉的含量。
1.2 水中多种金属离子的干扰可用控制酸碱度和加入酒石酸钾钠、氰化钠等络合剂掩蔽的方法消除。
在本法测定条件下,水中存在下列浓度金属离子不干扰测定:铅,240mg/L;锌,120mg/L;铜,40mg/L;铁,4mg/L;锰,4mg/L。
镁离子浓度达40mg/L时需多加酒石酸钾钠。
水样被大量有机物污染时将影响比色测定,需预先将水样消化。
1.3 本法最低检测量为0.25μg镉。
若取25ml水样测定,则最低检测浓度为0.01mg/L。
2、原理在强碱性溶液中,镉离子与双硫腙生成红色螯合物,用氯仿萃取后比色定量。
3、仪器、所用玻璃仪器均须用1+9硝酸浸泡过夜,然后用自来水、纯水冲洗洁净。
3.1 125ml分液漏斗。
3.2 10ml具塞比色管。
3.3 分光光度计。
4、试剂配制试剂和稀释水样时,所用纯水均应无镉。
4.1 0.100mg/ml镉标准贮备溶液:称取0.1000g金属镉(镉含量99.9%以上),加入30ml 1+9硝酸,使金属镉溶解,然后加热煮沸,最后用纯水定容至1000ml。
如无金属镉,可称取0.2371g乙酸镉〔Cd(CH3COO)2·2H2O〕溶于纯水中,加10ml 浓盐酸,并用纯水定容至1000ml。
此贮备溶液1.00ml含0.100mg镉。
4.2 1.00μg/ml镉标准溶液:取镉标准贮备溶液10.00ml于1000ml于1000ml容量瓶中,再加入10ml浓盐酸,用纯水稀释至刻度,则1.00ml含1.00μg镉。
镉测定实验报告

一、实验目的1. 了解镉的化学性质及其在水体中的存在形态。
2. 掌握使用原子吸收光谱法测定水体中镉含量的方法。
3. 培养实验操作技能,提高分析问题、解决问题的能力。
二、实验原理镉(Cd)是一种重金属元素,具有剧毒。
水体中的镉主要以Cd2+形式存在,可通过原子吸收光谱法(AAS)进行测定。
实验中,镉元素在特定条件下被激发,产生特定波长的吸收光谱,通过测定该波长下的吸光度,可以计算出镉的浓度。
三、实验仪器与试剂1. 仪器:原子吸收光谱仪、石英炉、电子天平、移液器、容量瓶、比色皿等。
2. 试剂:镉标准溶液(1000μg/mL)、硝酸、盐酸、氢氧化钠、去离子水等。
四、实验步骤1. 标准溶液的配制(1)准确移取1.00mL镉标准溶液于100mL容量瓶中,加入少量去离子水,振荡混合。
(2)用去离子水定容至刻度,摇匀。
得到浓度为10μg/mL的镉标准溶液。
(3)依次配制浓度为1.0μg/mL、2.0μg/mL、3.0μg/mL、4.0μg/mL、5.0μg/mL的镉标准溶液。
2. 样品前处理(1)准确移取一定体积的样品于烧杯中,加入适量硝酸和盐酸,加热至溶液呈无色透明。
(2)冷却后,转移至100mL容量瓶中,用去离子水定容至刻度,摇匀。
3. 样品测定(1)将样品溶液和标准溶液依次注入原子吸收光谱仪中,选择镉的特定波长进行测定。
(2)记录吸光度,根据标准曲线计算出样品中镉的浓度。
4. 数据处理(1)以镉浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
(2)根据样品的吸光度,从标准曲线上查出相应的镉浓度。
五、实验结果与分析1. 标准曲线绘制根据实验数据,绘制镉的标准曲线,相关系数R²=0.999。
2. 样品测定结果本次实验测定了5个样品中的镉含量,结果如下:样品1:镉含量为0.50μg/L样品2:镉含量为1.20μg/L样品3:镉含量为1.80μg/L样品4:镉含量为2.40μg/L样品5:镉含量为3.00μg/L3. 结果分析本次实验测定结果表明,样品中的镉含量在0.50μg/L至3.00μg/L之间。
重金属镉的检测方法

重金属镉的检测方法
重金属镉的检测方法主要有:吸附分析法、电感耦合等离子体质谱法、原子吸收光谱法、X射线荧光光谱法、氢核磁共振光谱法等。
1. 吸附分析法:采用吸附剂对样品进行处理,使镉完全吸附在吸附剂上,然后采用Atomic Absorption Spectrophotometry (AAS)或Inductively Coupled Plasma-Atomic Emission Spectroscopy (ICP-AES)进行定量分析。
2. 电感耦合等离子体质谱法:采用Inductively Coupled Plasma-Mass Spectrometry (ICP-MS)对样品中的镉进行定量分析。
3. 原子吸收光谱法:采用Atomic Absorption Spectrophotometry (AAS)对样品中的镉进行定量分析。
4. X射线荧光光谱法:采用X-Ray Fluorescence Spectrometry (XRF)对样品中的镉进行定量分析。
5. 氢核磁共振光谱法:采用Hydrogen Nuclear Magnetic Resonance Spectroscopy (HNMR)对样品中的镉进行定量分析。
教学案例库(重金属-铅检测).docx

教学案例库——重金属检测部分教学案例一铅的测定教学案例名称:食品中铅的测定教学案例描述:该案例主要讲解食品中铅检测的方法,适用于进行该项目检测的食品企业,以及食品相关专业的高职学校。
主要内容:1)食品中铅的检测意义2)食品中铅的检测方法3)检测报告的出具教学目标:1、知识目标1)明确食品中铅的检测意义2)熟悉食品中铅检测方法3)熟悉检测报告出具2、能力目标1)正确进行溶液的配制2)正确进行采样3)熟练进行样品前处理4)正确使用原子吸收分光光度计5)正确书写检测报告知识准备:(一)铅的危害铅是一种金属元素,铅和其化合物对人体各组织均有毒性,中毒途经可由呼吸道吸入其蒸气或粉尘,然后呼吸道中吞噬细胞将其迅速带至血液;或经消化道吸收,进入血循环而发生中毒。
中毒者一般有铅及铅化物接触史。
口服2-3克可致中毒,50克可致死。
临床铅中毒很少见。
它在人体内没有任何生理功能,所以,血铅的理想水平应该为零。
然而,由于受环境等多种因素的影响,多数人体内或多或少都有铅的存在。
成人铅中毒临床表现表现: 1.腹痛、腹泻、呕吐、大便呈黑色;2.头痛、头晕、失眠、甚至烦躁、昏迷;3.心悸、面色苍白、贫血;4.血管痉挛,肝肾损害;儿童发生铅中毒的概率是成年人的30多倍!其原因与儿童正处在生长发育阶段,许多器官尚不成熟,解毒功能不完善,对铅较敏感,以及接触机会较多有关。
2007年3月24日北京儿科研究所报告,由世界卫生组织儿童卫生合作中心牵头,历时3年的中国部分城市儿童铅中毒调查结果显示,中国6岁儿童的血铅值位居各年龄组儿童之首,北京7%的孩子血铅含量超标。
国际上普遍认为儿童血铅达到或超过100微克/升为血铅偏高。
铅超标会影响儿童的智力,包括说话能力、记忆力和注意力等。
孩子血铅超标告一般不会有明显的症状,主要表现为注意力不集中,会有攻击性,有时肚子会疼。
由于这些症状不具有特异性,因此往往会被家长忽略。
(二)铅污染的来源及预防日常生活中,人们需要在以下六个方面加强对铅中毒的预防。
镉的测定

水样中镉的测定1、方法原理将水样过滤或经消解的水样直接吸入火焰或注入石墨炉,火焰中形成的原子蒸汽或蒸发离解形成的原子蒸汽对光源发射的特征电磁辐射产生吸收,将测得水样的吸光度和标准溶液的吸光度进行比较,确定样品中被测元素的含量。
2、试剂2.1试验所用水均需二次蒸馏;2.2硝酸(ρ1.42g/mL)优级纯;2.3氢氟酸(ρ1.13 g/mL)分析纯;2.4高氯酸(ρ1.68 g/mL)优级纯;2.5镉标准贮存溶液:1000mg/mL;2.6 镉标准溶液:10mg/mL;3、仪器3.1原子吸收光谱仪或石墨炉。
3.2镉空心阴极灯。
4、分析步骤4.1 水样独立地进行两次测定,取其平均值。
4.2 空白试验随同试料做空白试验。
4.3 测定量取水样100mL于200mL烧杯中,加入10.0mL硝酸,在电热板加热溶解(不要沸腾),蒸至20mL左右,取下冷却,移入100mL容量瓶中,用水稀释至刻度,混匀。
5、标准曲线的绘制移取0.00、0.50、1.00、2.00、5.00、10mL镉标准溶液(10 mg/mL)于一组100mL容量瓶,加入1.0mL硝酸,用水稀释至刻度,混匀。
以镉的吸光度平均值为纵坐标,以浓度(μg/m l)为横坐标,绘制标准曲线。
6、分析结果的计算mCd(mg/L、μg/L)=v式中:m—从标准曲线上查出或仪器直接读出的镉的含量(mg/L、μg/L); V—分析用的水样体积(ml)。
注意事项:1、分析水样时,水样至少需要定置半小时。
2、水样定置后,清亮的水样直接分析,混浊的水样需过滤后消解。
3、操作中所用的玻璃仪器都要用二次蒸馏水冲洗。
泥样中镉的测定1、方法原理泥样以硝酸、氢氟酸、高氯酸分解后,直接吸入火焰或注入石墨炉,火焰中形成的原子蒸汽或蒸发离解形成的原子蒸汽对光源发射的特征电磁辐射产生吸收,将测得水样的吸光度和标准溶液的吸光度进行比较,确定样品中被测元素的含量。
2、试剂2.1试验所用水均需二次蒸馏;2.2硝酸(ρ1.42g/mL)优级纯;2.3氢氟酸(ρ1.13 g/mL)分析纯;2.4高氯酸(ρ1.68 g/mL)优级纯;2.5镉标准贮存溶液:1000mg/mL;2.6镉标准溶液:10mg/mL;3、仪器3.1原子吸收光谱仪或石墨炉。
水质检测实操原始记录镉

水质检测实操原始记录镉I. 试验目的本次实操旨在通过水质检测,了解水体中镉元素的含量,进一步监测镉对环境和人体健康的潜在影响。
II. 试验材料1. 水样收集器具:玻璃瓶、注射器、蒸馏水、塑料袋等。
2. 试验设备:高精度电子天平、离心机、电磁搅拌器等。
3. 试剂:镉标准溶液、酸性亚硫酸钠溶液、硝酸铵溶液等。
III. 试验步骤1. 采样准备(1) 选定实验地点,确保采样点水体具有代表性。
(2) 选择合适容量的玻璃瓶,并事先用蒸馏水清洗干净,晾干备用。
2. 水样采集(1) 戴手套,用注射器将要采集的水样缓慢吸入玻璃瓶中,确保水样不接触到空气。
(2) 将采集的水样封闭在玻璃瓶中,迅速封口,并用塑料袋包裹,防止外界污染。
3. 试剂配制(1) 将镉标准溶液按照要求稀释到合适的浓度。
(2) 酸性亚硫酸钠溶液和硝酸铵溶液在实验室条件下制备。
4. 实验操作(1) 取适量的采集水样,使用天平测量准确的样品质量。
(2) 将水样加入容器中,加入均匀的酸性亚硫酸钠溶液,并用电磁搅拌器搅拌均匀。
(3) 逐滴加入硝酸铵溶液,直到溶液呈现明显的黄色。
继续搅拌5分钟,使反应完全进行。
(4) 将样品离心,去除上层溶液,留下沉淀。
5. 结果计算(1) 用蒸馏水洗涤沉淀3次,去除杂质。
(2) 将洗涤后的沉淀转移至高温烘箱干燥。
(3) 沉淀完全干燥后,使用天平测量干燥后的沉淀质量。
(4) 根据标准曲线,计算出水样中镉元素的含量。
IV. 实验结果经过实验操作和计算,我们得出了水样中镉元素的含量为Xmg/L。
V. 结论与讨论根据我们的实验结果,水样中的镉元素含量为Xmg/L,超过了国家相关标准的限定值。
因此,我们需要进一步关注和控制该水体的污染源。
镉是一种常见的重金属污染物,对生态环境和人体健康具有较高的危害性。
其长期积累和摄入可能导致各种慢性疾病,甚至增加癌症的风险。
因此,在日常的环境监测中,对水体中镉元素的检测显得非常重要。
通过本次实操,我们掌握了水质检测中有关镉元素的实验操作方法和数据处理技巧。
重金属残留检测实验方法

原子吸收分光光度法测定重金属残留铅、镉测定法(石墨炉法)供试品溶液制备:取供试品粗粉(过2号筛)0.5~1.0g,精密称定,置消化瓶中加硝酸-高氯酸(4:1)混合溶液10mL,混匀,瓶口加一小漏斗,浸泡过夜。
置消化炉上,加热消解,保持微沸,至棕色烟散尽后,加温继续加热直至白烟散尽,消解液呈无色或略带黄色,放冷,转入50mL量瓶中,用2%硝酸定容至刻度,摇匀,即的。
同法同时制备试剂空白溶液。
铜测定法(火焰法)供试品溶液制备同铅测定下供试品溶液制备。
砷测定法(氢化物法)供试品溶液制备:取供试品粗粉(过2号筛)0.5~1.0g,精密称定,置消化瓶中加硝酸-高氯酸(4:1)混合溶液10mL,混匀,瓶口加一小漏斗,浸泡过夜。
置消化炉上,加热消解,保持微沸,至棕色烟散尽后,加温继续加热直至白烟散尽,消解液呈无色或略带黄色,放冷,转入50mL量瓶中,用2%硝酸定容至刻度,摇匀,即的。
精密量取10mL,置25mL量瓶中,加25%碘化钾(临用前配置)1mL,摇匀,加10%抗坏血酸(临用前配置)1mL,摇匀,用20%盐酸定容,摇匀,密塞,置80度水浴中加热3min,取出放冷。
取适量吸入氢化物发生装置,测定吸收值。
同法同时制备试剂空白溶液。
汞测定法(冷吸收法)供试品溶液制备:取供试品粗粉(过2号筛)0.5~1.0g,精密称定,置消化瓶中加硝酸-高氯酸(4:1)混合溶液10mL,混匀,瓶口加一小漏斗,浸泡过夜。
置消化炉上,加热消解,保持微沸,至棕色烟散尽后,加温继续加热直至白烟散尽,消解液呈无色或略带黄色,放冷,加4%硫酸溶液适量、5%高锰酸钾溶液0.5mL,摇匀,滴加5%盐酸羟胺溶液至紫红色恰消失,转入25mL量瓶中,用4%硫酸定容至刻度,摇匀,即得。
同法同时制备试剂空白溶液。
注意事项:1、视实际消化情况称取供试品,一般是取1.0g,有些量多就称取少些比如菟丝子只能是0.5g,否则消化不完,有残渣。
因瓶壁上会沾有供试品,所以加硝酸-高氯酸(4:1)混合溶液时先冲洗瓶壁。
《食品中镉测定》课件

可能的干扰因素及对策
在进行镉测定实验时,可能 会出现各种干扰因素,需要 采取相应的对策进行校正。
结论与讨论
1
结果分析
根据测定结果,可以评估食品中镉的含量是否超标,进一步分析其对人体健康的 影响。
2
对镉污染问题的思考
应加强食品安全监管,控制食品中镉的含量,保护公众的健康。
3
今后可改进的点
提升检测方法的灵敏度、准确性和适用范围,以及解决实验中的干扰问题等。
数据处理
1 标准曲线的绘制
使用一系列不同浓度的标准溶液,通过测定得到各浓度对应的吸光度值,进而绘制标准 曲线。
2 计算样品中镉的含量
根据样品的吸光度值与标准曲线的关系,可以计算出样品中镉的浓度。
实验注意事项
安全操作
进行实验时需佩戴防护服、 手套等防护设备,注意安全。
储存与处理危险废物
对于实验中产生的含镉废物, 应进行妥善储存和处理,以 避免对环境造成污染。
食品中镉的来源
镉主要来自土壤、水源以及工业污染等多种渠道,容易进入人类食物链。
检测方法
1
原理
食品中镉的测定一般采用分析仪器,如电感耦合等离子体质谱仪,通过比对样品中的镉含量 来确定。
2ቤተ መጻሕፍቲ ባይዱ
设备与试剂
常用的设备有原子吸收光谱仪和分光光度计,试剂包括标准溶液、螯合剂等。
3
操作步骤
样品前处理、仪器操作、数据收集与分析是进行食品中镉测定的基本步骤。
《食品中镉测定》PPT课 件
# 食品中镉测定
镉及其含量的检测是食品安全领域的关键问题。本课件将介绍食品中镉的危 害,检测方法以及数据处理的步骤,以提高大家对食品安全的认识。
简介
什么是镉?
教学设计10——重金属检验

一、鳌合萃取原理(5分钟)金属离子先与鳌合剂生成金属鳌合物,然后利用与水不相溶的有机溶剂同试样一起振荡,金属鳌合物进入有机相,另一些组分仍留在水相中,从而达到提取分离的目的,这个方法称为液-液溶剂萃取法。
二、鳌合反应与亲水性1、鳌合物:金属离子与可提供2个或2个以上配位键的络合剂起反应,生成的2个或2个以上环状结构的络合物,称为鳌合物。
鳌合物的环通常为五元环或六元环,结构比较稳定。
如:Ni2+与丁二酮肟在碱性介质中起反应,生成4个环状结构的鳌合物,其中两个环为五元环,2个为六元环。
2、亲水性(1)亲水性:金属离子在未起鳌合反应之前,受水分子极性的作用,电离成为带电荷的亲水性离子,并进一步结合成为水合离子,如Al(H2O) 63+,Zn (H2O) 62+,Ni (H2O) 62+,Fe (H2O) Clˉ等,它们易溶于水而难溶于有机溶剂,这种性质称为亲水性。
选择适当的金属鳌合剂,可将金属离子变成疏水性的金属鳌合物。
(2)物质亲水性强弱的规律物质对氢键的作用能力或形成氢键的能力,是其亲水性强弱的重要标志。
①凡是离子都有亲水性。
②物质含亲水基团越多,其亲水性越强。
常见的亲水基团:—OH,—SO2H,—NH2,—NH等。
③物质含疏水基团越多,相对分子质量越大,其疏水性越强。
常见的疏水基团:烷基如—CH3、—C2H5等,卤代烷基,芳香基如苯基、萘基等。
三、萃取分离的基本原理(10分钟)(一)分配系数设物质A在萃取过程中分配在不互溶的水相和有机相中,在一定温度下,当分配达到平衡时,物质A在两相中活度比保持恒定,用下式表示:PD=аA,有 / а A,水式中:PD—分配系数浓度很稀时,可以用浓度[A]代替活度。
PD= [A]有 / [A]水(二)分配比溶质在有机相中的各存在形式的总浓度与在水相中的各种存在形式的总浓度之比,称为分配比,以D 表示。
D=c 有/c 水 (三)萃取百分率在实际工作中,也常用萃取百分率E 来表示萃取的完全程度。
镉检测作业指导书

食品中镉检测作业指导书第一法石墨炉原子吸收光谱法1.目的:规定了本中心食品中镉的测定方法。
用范围:适用于食品中镉的测定。
本方法检出限为μg/Kg。
3.编写依据:GB/T5009.15-2003《食品中镉的测定第一法》。
4.原理:试样经灰化或酸消解后,注入原子吸收分光光度计石墨炉中,电热原子化后吸收228.8nm 共振线,在一定浓度范围,其吸收值与镉含量成正比,与标准系列比较定量。
5.仪器和设备:电子分析天平(±)5.2 原子吸收分光光度计(德国耶拿700型,石墨炉及镉空心阴极灯)5.3 可调式电加热板5.4 容量瓶:100ml、50ml、 25ml5.5 移液管:1ml、5ml5.6 马弗炉所用玻璃仪器均需以硝酸(1+5)浸泡过夜,用水反复冲洗,最后用去离子水冲洗干净。
6.试剂及材料:6.1 硝酸(高级纯)6.2 硫酸(高级纯)6.3 高氯酸(高级纯)6.4 过氧化氢(30%)6.5 硝酸(1+1):取50mL硝酸慢慢加入50mL水中6.6 硝酸(0.5mol/L):取3.2mL硝酸加入50mL水中,稀释至100mL6.7 盐酸(1+1): 取50mL盐酸慢慢加入50mL水中6.8 混合酸:硝酸+高氯酸(4+1):取4份硝酸与1份高氯酸混合6.9 镉标准储备液:准确称取金属镉(99.99%)分次加入20mL盐酸(1+1)溶解,加2滴硝酸,移入1000mL容量瓶,加水至刻度,混匀。
此溶液每毫升含1.0mg镉。
6.10 镉标准使用液:每次吸取镉标准储备液10.0mL于100mL容量瓶中,加硝酸(0.5mol/L)至刻度。
如此经多次稀释成每毫升含100.0ng 镉的标准使用液。
以上试剂在试验时先进行一次试剂空白试验,如不干扰测定即可使用,否则需逐一进行重蒸7.操作步骤:7.1 试样预处理7.2 试样消解(干法灰化)称取~(根据镉含量而定)试样于瓷坩埚中,先小火在可调式电热板上炭化至无烟,移入马弗炉500℃灰化6h ~8h ,冷却。
镉金属含量检测方法指导书

镉金属含量检测方法指导书
1. 目的
测定镉金属于镉金属及氧化镉混合物之含量。
2. 原理
用EDTA 将镉化合物溶解﹐而镉金属则可经过滤后用重量法分析其含量。
3. 方法
3.1 操作程序
3.11先将过滤纸折好,然后用约200ml D.I. 水冲洗过滤纸。
再放入60 o C 焗炉,
待过滤纸烘干后,将过滤纸取出用水份测试仪蒸走残余水份,待水份测试仪
中电子磅所显示数据稳定后记录其重量即为干燥后过滤纸重量(W1)。
3.12 精密秤取 2 克试样于250 毫升烧杯中。
3.13 加入约10 克的EDTA晶体试剂,然后再加入约100 毫升 D.I. 水。
3.14加热并搅拌使所有镉化合物完全溶解(注:约三十分钟后,只余下灰色粒状
物团)。
3.15 在溶液冷却后进行过滤,并以 D.I. 水冲洗不溶物。
3.16过滤纸连同不溶物放入60 o C 焗炉,待过滤纸及不溶物被烘干后,将过滤纸
及不溶物取出用水份测试仪蒸走残余水份,待水份测试仪中电子磅所显示数
据稳定后记录其重量即为干燥后过滤纸及不溶物的总重量(W2)。
3.2 计算
W2 - W1
镉金属(%) = --------------* 100 %
W
W2:过滤纸加不溶物重量(克)
W1:过滤纸重量(克)
W :所秤取试样重量(克)
4.参考
4.1<水份含量的测定>
4.2<化工产品中水份含量的测定的通用方法---重量法>。
镉、铅的测定电子教案(精)
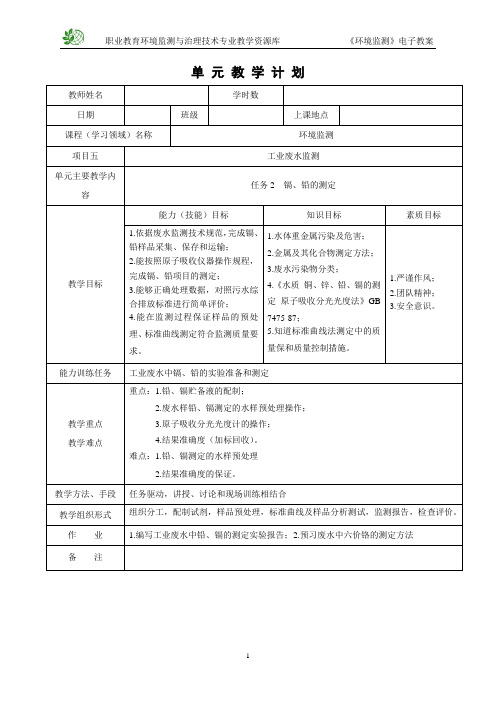
单元教学计划项目五工业废水监测任务2 镉、铅的测定1.水体重金属污染及危害1.1对环境的危害进入大气、水、土壤中,引起严重的环境污染。
比如土壤质量退化、镉稻米…….1.2对人类的危害重金属离子铅、镉、汞、铬、砷等,在生物体中富集,再通过食物链,在人体某些器官积蓄造成急、慢性中毒,危害人体健康。
镉的毒性很强,可在人体的肝、肾、骨骼等组织中积蓄,造成各内脏器官组织的损害,尤以对肾脏的损害最大。
还可以导致骨质疏松和软化。
如日本富山事件(骨痛病事件)。
绝大多数淡水的含镉量低于1ug/L,海水中镉的平均浓度为0.15μg/L。
镉的主要污染源是电镀、采矿、染料、电池和化学工业等排放的废水。
铅是可在人体和动植物组织中蓄积的有毒金属,其主要毒性效应是导致贫血、神经机能失调和肾损伤等。
铅对水生生物的安全浓度为0.16mg/L。
水体中,铅的浓度大于0.1ppm时,即可抑制水体的自净作用。
铅的主要污染源是蓄电池、冶炼、五金、机械、涂料和电镀工业部门的排放废水。
2.金属及其化合物测定方法测定水体中铅、镉的方法基本相同。
目前广泛采用原子吸收分光光度法和双硫腙分光光度法,也可以用阳极溶出伏安法和示波极谱法。
3.废水污染物分类3.1第一类污染物◆13项:总汞、烷基汞、总铅、总镉、总铬、六价铬、总砷、总镍、苯并a芘、总铍、总银、总α放射性、总β放射性。
◆取样位置:车间或车间处理设备的废水排放口或专门处理此类污染物的排口。
3.2二类污染物◆包括:悬浮物、硫化物、挥发酚、氰化物、有机磷化合物、石油类、铜、锌、氟、硝基苯类、苯胺类等。
◆取样位置:工厂废水总排放口。
4.废水中铅、镉的测定水质标准中的金属项目基本上都可用原子吸收分光光度法测定,实际工作中国标方法所推荐的也基本上都是原子吸收分光光度法。
用原子吸收分光光度法进行测定,关键在于试样处理,一般都是采用消解的方法来处理水样,由于相互干扰很少,可以在一份试样中同时测定多个项目。
下面以测定水样中的镉、铅为例来说明直接吸入火焰原子吸收分光光度法具体操作。
实验报告测定镉

一、实验目的1. 了解镉的性质和危害;2. 掌握测定镉含量的实验原理和方法;3. 培养实验操作技能,提高分析能力。
二、实验原理镉是一种重金属元素,具有较强的毒性。
在环境中,镉主要以Cd2+形式存在。
本实验采用原子吸收光谱法测定样品中的镉含量。
原子吸收光谱法是利用特定波长的光被样品中镉原子吸收,通过测量吸光度来计算样品中镉的含量。
三、实验材料与仪器1. 实验材料:- 样品:土壤、水、食品等;- 标准镉溶液:1000μg/mL;- 硝酸、盐酸、氢氧化钠等试剂。
2. 实验仪器:- 原子吸收光谱仪;- 电子天平;- 磁力搅拌器;- 容量瓶;- 试管等。
四、实验步骤1. 样品前处理:- 称取一定量的样品,置于烧杯中;- 加入适量的硝酸,加热溶解;- 冷却后,用盐酸调至pH=2;- 转移至容量瓶中,定容至刻度;- 过滤,备用。
2. 标准溶液配制:- 准确移取一定量的标准镉溶液,置于容量瓶中;- 加入适量的硝酸,加热溶解;- 冷却后,用盐酸调至pH=2;- 转移至容量瓶中,定容至刻度;- 混匀,备用。
3. 样品测定:- 启动原子吸收光谱仪,设定波长为228.8nm;- 分别测定标准溶液和样品溶液的吸光度;- 根据标准曲线计算样品中镉的含量。
五、实验结果与分析1. 标准曲线绘制:- 以标准溶液浓度为横坐标,吸光度为纵坐标,绘制标准曲线;- 标准曲线线性良好,相关系数R²>0.99。
2. 样品测定结果:- 样品中镉含量为X mg/kg(X为实验测得值)。
3. 结果分析:- 根据实验结果,样品中镉含量符合国家标准要求。
六、实验讨论1. 实验过程中,样品前处理是关键步骤。
在处理过程中,要注意样品的溶解、过滤等操作,确保样品溶液的澄清度;2. 实验过程中,标准溶液的配制要准确,避免误差;3. 实验过程中,原子吸收光谱仪的操作要规范,确保测定的准确性。
七、结论本实验采用原子吸收光谱法测定了样品中的镉含量,实验结果准确可靠。
原子分光光度法测定水中重金属镉的含量

原子分光光度法测定水中重金属镉的含量镉(Cd)是我国实施排放总量控制的指标之一。
它不是人体必须的元素,毒性很大,可通过食物链进入动物和人体,在体内蓄积,主要蓄积在肾脏,引起泌尿系统的功能变化,镉在人体内形成镉硫蛋白,它与含羟基、氨基、巯基的蛋白质分子结合,影响酶的功能,导致蛋白尿和糖尿等;镉还能影响维生素D3的活性,使骨质疏松、萎缩、变形等。
镉对植物的危害表现在其破坏叶绿素,从而降低光合作用,还能使花粉败育,影响植物生长、发育和繁殖。
水中含镉0.1mg/L时,可轻度抑制地表水的自净作用。
用含镉0.04mg/L的水进行农业灌溉时,土壤和稻米就会受到明显的污染。
镉的主要污染源有电镀、采矿、冶炼、燃料、电池和化学工业等排放的废水。
一实验目的1了解原子吸收分光光度法的原理。
2了解水样消解的过程,了解原子吸收分光光度计的使用方法。
二、实验原理:火焰原子吸收分光光度法是根据某元素的基态原子对该元素的特征谱线产生选择性吸收来进行测定的分析方法。
试样喷入火焰中,被测元素在火焰中离解形成原子蒸汽,空心阴极灯发射的被测元素的特征谱线通过原子蒸汽层时,被测元素的基态原子选择吸收特征谱线。
在一定条件下特征谱线光强的变化与试样中被测元素的浓度成比例。
通过测量自由基态原子对选用吸收线吸光度,确定试样中被测元素的浓度。
水样用HNO3-HF-HClO4或HCl- HNO3-HF-HClO4混酸体系消化后,消化液直接喷入空气-乙炔火焰,火焰中形成的Cd基态原子蒸汽吸收光源发射的特征谱线。
测得试液吸光度,并扣除空白吸光度,从标准曲线查得Cd含量。
计算土壤中Cd含量。
三、实验仪器及试剂1)原子吸收分光光度计,镉空心阴极灯;2)仪器工作条件测定波长228.8nm;通带宽度 1.3nm;灯电流7.5mA;火焰类型空气-乙炔火焰。
3)实验试剂盐酸:AR级;硝酸:AR级;氢氟酸:AR级;高氯酸:AR级;镉标准贮备液:1.0mg/ml;镉标准使用液:5.0μg/ml。
重金属镉。铬。铅的测定

重金属镉、铬、铅含量的测定1 材料与方法1.1 仪器CEM 微波消解仪( 美国CEM 公司) ,AFS-930型双道原子荧光光度计( 北京吉天仪器公司) ,AA800 原子吸收分光光度计( 美国PE 公司) ,BHW-09C 型智能控温电加热器( 上海博通) ,ELAN DRC-e 型电感耦合等离子体质谱仪( 美国PerkinElmer 公司) 。
1.2 试剂硝酸( HNO3) ,氢氟酸( HF) ,磷酸二氢铵( Pb、Cd基体改进剂) ,氯化铵( Cr 基体改进剂) ,所用酸为优级纯,As、Hg、Pb、Cd、Cr 单元素标准物质储备液1 000 μg /ml ( 国家标准物质研究中心) ,国家标准物质土壤标准参考样GBW-07408。
其他试剂为分析纯。
试验室用水为去离子水。
分别称取5 g 硫脲( 分析纯) 、5 g 抗坏血酸( 分析纯) ,溶于100 ml水中,得浓度5%硫脲-抗坏血酸溶液,用时现配。
1.3 处理方法准确称取经风干、粉碎过筛( 100 目) 的土壤样品0. 20 g 于微波消解罐中,用少量水润湿,加入消解试剂,混匀,旋紧消解罐盖后置于微波消解仪中,升温程序见表1。
消解完成后放入加热仪中140 ℃进行赶酸,以除去氮氧化物和氢氟酸。
当样品溶液蒸至近干时,停止赶酸。
表1 微波消解升温程序消解温度升温时间保温时间1 120 5 52 160 5 103 195 5 35待样品冷却,用水溶解,转移至100 ml 容量瓶中,加入3ml 盐酸、5 ml 5%硫脲-抗坏血酸溶液,用水稀释至刻度,摇匀放置20 min,测定As 含量; 待样品冷却,用浓度2%硝酸溶解,转移至25 ml 容量瓶中,用浓度2% 硝酸稀释至刻度,摇匀放置,测定Hg、Pb、Cd 含量; 待样品冷却,用浓度2%硝酸溶解,转移至25 ml 容量瓶中,同时加入5 ml 氯化铵溶液,用浓度2%硝酸稀释至刻度,摇匀放置,测定Cr 含量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
教学案例库——重金属检测部分
教学案例二大米中镉的测定
教学案例名称:大米中镉的测定
教学案例描述:该案例主要讲解食品中镉的测定方法,本案例中的样品选择了大米,适用于进行该项目检测的食品企业,以及食品相关专业的高职学校。
主要内容:
1)食品中镉的检测意义
2)镉的前处理方法
3)检测报告的出具
教学目标:
1、知识目标
1)明确食品中镉的检测意义
2)熟悉食品中镉的检测方法
3)熟悉检测报告出具
2、能力目标
1)正确配制试剂
2)正确的设置原子吸收分光光度计条件
3)熟练的使用马弗炉
4)熟练的准备供分析的样品
5)正确的分析并计算结果
6)正确书写检测报告
适用对象:高职学生
知识准备:
(一)镉简介
镉是银白色有光泽的金属,熔点320.9℃,沸点765℃,密度8650kg/m3。
有韧性和延展性。
镉在潮湿空气中缓慢氧化并失去金属光泽,加热时表面形成
棕色的氧化物层,若加热至沸点以上,则会产生剧毒的氧化镉烟雾。
高温下镉与卤素反应激烈,形成卤化镉。
也可与硫直接化合,生成硫化镉。
镉可溶于酸,但不溶于碱。
镉的氧化态为+1、+2。
氧化镉和氢氧化镉的溶解度都很小,它们溶于酸,但不溶于碱。
镉可形成多种配离子,如Cd(NH3)、Cd(CN)、CdCl等。
镉的毒性较大,被镉污染的空气和食物对人体危害严重,日本因镉中毒曾出现“痛痛病”。
可用多种方法从含镉的烟尘或镉渣(如煤或炭还原或硫酸浸出法和锌粉置换)中获得金属镉。
进一步提纯可用电解精炼和真空蒸馏。
镉主要用于钢、铁、铜、黄铜和其他金属的电镀,对碱性物质的防腐蚀能力强。
镉可用于制造体积小和电容量大的电池。
镉的化合物还大量用于生产颜料和荧光粉。
硫化镉、硒化镉、碲化镉用于制造光电池。
(二)镉的危害及检测意义
镉及其化合物均有一定的毒性。
吸入氧化镉的烟雾可产生急性中毒。
中毒早期表现咽痛、咳嗽、胸闷、气短、头晕、恶心、全身酸痛、无力、发热等症状,严重者可出现中毒性肺水肿或化学性肺炎,有明显的呼吸困难、胸痛、咯大量泡沫血色痰,可因急性呼吸衰竭而死亡。
用镀镉的器皿调制或存放酸性食物或饮料,饮食中可能含镉,误食后也可引起急性镉中毒。
潜伏期短,通常经10~20分钟后,即可发生恶心、呕吐、腹痛、腹泻等症状。
严重者伴有眩晕、大汗、虚脱、上肢感觉迟钝、甚至出现抽搐、休克。
一般需经3~5天才可恢复。
长期吸入镉可产生慢性中毒,引起肾脏损害,主要表现为尿中含大量低分子量蛋白质,肾小球的滤过功能虽多属正常,但肾小管的回收功能却减退,并且尿镉的排出增加。
镉作业工人的肺气肿、贫血及骨骼改变也有报道,但这些改变与镉接触的确切关系尚不能肯定。
国外也有报道接触氧化镉的工人前列腺癌发病率较高。
因此,为了预防重金属镉食品中毒,需要对食品进行检测。
教学实施过程
一、情境创设
某地区居民出现大量镉中毒的症状,经调查中毒居民大都吃了某粮厂生产的大米产品。
现需要对其大米产品进行检测,要求检测方法依据国家标准进行。
(一) 问题导入
引出:1、为什么大米中会出现镉? 2、镉的检测意义?
(二) 学生讨论
学生分组学习并讨论,得出问题答案。
(三) 任务描述
职责要求
科长:负责检验流程的监督及检测报告的审批;
组长:人员分工,各组工作的监督(摄像、照相),检测报告初审; 准备组:负责检验材料、试剂、设备等的准备工作; 操作组:负责镉检测操作;
数据组:负责样品信息的记录、检测结果的记录与分析、报告单出具; (四) 学生活动
发放学习资料单 “GB 5009.15-2014 食品安全国家标准
食品中镉的测
定”,分组学习及讨论。
(五)结果展示
让学生绘制工作内容流程图,进行展示。
表1 工作准备单3.硝酸高氯酸混合溶液(9+1)
表2 检测记录单
表3 检测报告单
三、检测结果分析与展示
1、展示各组填写的记录单及报告单,让学生进行对比及纠错;
2、展示各组的检测结果,强调镉方法及报告方法;
3、结合检测过程中的问题进行分析,填写问题分析表。
4、分析结果的表述
试样中镉含量按下式进行计算。
式中:
X ——试样中镉的含量, 单位为毫克每千克或毫克每升(mg/kg 或mg/L ); c 1——测定用试样中铅的含量,单位为纳克每毫升(ng/mL ); c 0——试剂空白液中铅的含量,单位为纳克每毫升(ng/mL ); m ——试样质量或体积,单位为克或毫升(g 或mL ); V ——试样消化液定容总体积,单位为毫升(mL ); 1000——换算系数。
以重复性条件下获得的两次独立测定结果的算术平均值表示,结果保留两位有效数字。
精密度:在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的20%。
表4问题分析表
1000
)(01⨯⨯-=
m V c c X
四、评价与反馈
(一)单项技能考核
表5 单项技能考核表
技能考核项目:食品中镉含量的检测
(二)综合评价
表6 综合评价表
年月日。
