第四章 炔烃和二烯烃
Ch.4 炔烃和二烯烃

第四章炔烃和二烯烃炔烃:定义、通式二烯烃:定义、通式烯炔:定义、通式第一节炔烃一、结构以乙炔为例根据已知事实,杂化轨道理论认为,每个处于激发态的C原子发生的是SP 杂化。
对-C≡C-必须认识到:①4个原子在一条直线上。
②C≡C是由1个σ键和2个π键组成的。
③C≡C及C-H键都比乙烯的短:原因: C C 间成键电子多,使两个核更靠近;SP杂化轨道比SP2轨道短。
④C≡C中的π键牢固,π电子云的流动性乙烯的小。
原因:C≡C较短,P轨道重迭较多,核对π电子的束缚力较大。
二、命名1.炔烃的系统命名法与烯烃的系统命名法相似,只须把烯字改为炔字即可。
2.炔烃的衍生物命名法以乙炔为母体,把其它炔烃看成是乙炔的H被取代后生成的衍生物。
3.烯炔的系统命名法在炔烃的系统命名法的基础上补充二点:①选择既含C≡C又含C=C的最长C链作主链(母体),称为烯炔,要分别标示C≡C和C=C的位次。
②编号使二个重键的位次符合最低(编码)系列原则,若C≡C和C=C的位置相当,应把最小位次给予C=C双键。
3-甲基-3-戊烯-1-炔 1-戊烯-4-炔三、物理性质(自习)物质状态:C2-C4(g)C5以上(l)更高级者(s)如1-十八碳炔m.p 22.5°Cb.p:随分子量的增加而升高。
比相应的烯烃高10-20°C,比相应的烷烃略高。
比重:比相应的烯烃大。
在水中的溶解度:比烷烃、烯烃都大些。
四、化学性质炔烃的化学性质与烯烃相似,也能发生加成、氧化、聚合等反应,但二者毕竟不完全相同,因此炔烃还有某些特有的性质。
1.加成反应⑴催化加氢如果使用的催化剂是Pt或Pd,反应难停留在第一步,主要产物是烷烃。
若使用经过降活处理的催化剂如林德拉催化剂(Lindlar cat.),可使炔烃只发生部分氢化,主要产物是顺式烯烃。
关于Lindlar cat.的成份问题:一种说法是P d-BaSO4 / 喹啉(题库);另一种说法是Pd(Pb)-CaCO3(教材与其它文献)。
炔烃和二烯烃

第四章炔烃和二烯烃(I )炔烃一、定义、通式和同分异构体定义:分子中含有碳碳叁键的不饱和烃。
通式:C n H 2n-2同分异构体:与烯烃相同。
二、结构在乙炔分子中,两个碳原子采用SP 杂化方式,即一个 2S 轨道与一个2P 轨道杂化, 组成两个等同的 SP 杂化轨道,SP 杂化轨道的形状与 SP 2、SP 3杂化轨道相似,两个SP 杂化 轨道的对称轴在一条直线上。
两个以SP 杂化的碳原子,各以一个杂化轨道相互结合形成碳碳6键,另一个杂化轨道各与一个氢原子结合,形成碳氢 6键,三个6键的键轴在一条直线上,即乙炔分子为直线型分子。
每个碳原子还有两个末参加杂化的P 轨道,它们的轴互相垂直。
当两个碳原子的两P轨道分别平行时,两两侧面重叠,形成两个相互垂直的 n 键。
三、命名炔烃的命名原则与烯烃相同,即选择包含叁键的最长碳链作主链,碳原子的编号从 距叁键最近的一端开始。
若分子中即含有双键又含有叁键时,则应选择含有双键和叁键的最长碳链为主链, 并将其命名为烯炔(烯在前、炔在后)。
编号时,应使烯、炔所在位次的和为最小。
例如:CfCfCHCHDHC 三 CH3-甲基-4-庚烯-1-炔CH 3但是,当双键和叁键处在相同的位次时,即烯、炔两碳原子编号之和相等时,则从 靠近双键一端开始编号。
如:Cf 二C 比三CH1-丁烯-3-炔四、 物理性质与烯烃相似,乙炔、丙炔和丁炔为气体,戊炔以上的低级炔烃为液体,高级炔烃为 固体。
简单炔烃的沸点、熔点和相对密度比相应的烯烃要高。
炔烃难溶于水而易溶于有机溶剂。
五、 化学性质 (一)加成反应1、催化加氢炔烃的催化加氢分两步进行,第一步加一个氢分子,生成烯烃;第二步再与一个氢分加成,生成烷烃。
催化剂HC 三 CH + H 2 —CH2、加卤素炔烃与卤素的加成也是分两步进行的。
先加一分子氯或溴,生成二卤代烯,在过量 的氯或溴的存在下,再进一步与一分子卤素加成,生成四卤代烷。
HC 三CH + Br2 -------- Br=CHBrCHB 广2CHB 2虽然炔烃比烯烃更不饱和,但炔烃进行亲电加成却比烯烃难。
4第四章 炔烃 二烯烃
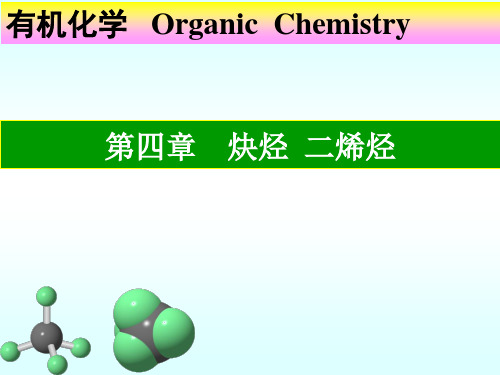
RCCR` KMnO4 RCOOH + R`COOH
H2O
(2) 缓慢氧化——二酮
OO
CH3(CH2)7CC(CH2)7COOH
KMnO4 H2O
CH3(CH2)7-C-C-(CH2)7COOH
pH=7.5
92%~96%
•利用炔烃的氧化反应,检验叁键的存在及位置
•这些反应产率较低,不宜制备羧酸或二酮.
有机化学 Organic Chemistry 第四章 炔烃 二烯烃
第四章 炔烃 二烯烃
(一) 炔烃
定义:分子中含有碳碳叁键的烃叫做炔烃,它的通式:
CnH2n-2 官能团为: -CC-
4.1 炔烃的异构和命名**
(1)异构体——从丁炔开始有异构体.
•同烯烃一样,由于碳链不同和叁键位置不同所引起的.由 于在碳链分支的地方不可能有叁键的存在,所以炔烃的 异构体比同碳原子数的烯烃要少. •由于叁键碳上只可能连有一个取代基,因此炔烃不存在 顺反异构现象.
炔烃和烯烃一样,也能和卤化氢、卤素等起亲电加成反
应,但炔的加成速度比烯慢
(A) 和卤素的加成
Br2
RC CR
Br
+
RC CR
Br-
反式加成
Br
R
CC
R
Br
卤素的活性F2>Cl2>Br2>I2
Br Br Br2 R C C R
这一反应可用于炔烃的鉴别。
Br Br
控制条件也可停止在一分子加成产物上.
❖加氯必须用FeCl3作催化剂。
•含有双键的炔烃在命名时,一般 先命名烯再命名炔 .
碳链编号以表示双键与叁键位置的两个数字之和最小
为原则。在同等的情况下,要使双键的位次最小。
广西师大有机化学第四章:炔烃和二烯烃

第十四章
第一章
第二章
第三章
第四章
第五章
第六章
第七章
第八章
可通过这两个反应来鉴别炔烃分子中三 键是在碳链的一端还是在碳链的中间,因为 只有三键在末端时才能连有氢,分子中其它 碳原子上的氢没有这种反应。 金属炔化物在干燥状态受热或撞击时, 则发生爆炸而生成金属和碳。所以进行这类 鉴别反应后生成的金属炔化物应加硝酸使其 分解,以免干燥后爆炸。 对于炔烃的性质,我们只介绍这么多, 可参考其它书籍,如聚合………。
第六章
第七章
第八章
第九章
第十章
第十一章
第十二章
第十三章
第十四章
第一章
第二章
第三章
第四章
第五章
第六章
第七章
第八章
实验同样证明乙炔为线型分子,碳 — 碳
三键的键长比碳—碳双键短,为0.120 nm, 键能为835kJ/mol,即比碳—碳双键及碳—碳 单键的键能都大。 随着碳原子杂化中s轨道成分的增加,键
第一章
第二章
第三章
第四章
第五章
第六章
第七章
第八章
2. 1,3-丁二烯的结构 在 1 , 3— 丁二烯分子中,所有碳原
子都是 sp2 杂化状态,它们彼此各以一个
sp2 杂化轨道结合形成 C—Cδ 键,其余的
sp2杂化轨道分别与氢原子结合。由于sp2
杂化轨道是平面分布的,所以分子中所有 的原子就有可能都处于同一平面上,每个 碳上余下的p轨道则相互平行,如图:
第五章
第六章
第七章
第八章
1. 加成反应
①催化加氢
H C
C H
H2
CH2 CH2
H2
炔烃与二烯烃

CH3CH2CCH2CH2CH3 O
CH3CH2C CCH2CH2CH3 H2O H / HgSO4
+
CH3CH2CCH2CH2CH2CH3 O CH3CH2CH2CCH2CH2CH3 O
几乎等量的混合物
2. 炔烃的还原
催化氢化
RC
CH + H2
Pt
RCH2CH3
R C H C H R
顺 式 加 成
酮式 Keto form
末端炔总是生成甲基酮。
Hg++催化下,叁键比双键易水合。
H2O, HgSO4 H2C CH C CH H2SO4
O H2C CH C CH3
炔烃的水合机理
H2O Hg++ OH2 C Hg OH CH
++
R
C
CH
R
R
C
CH Hg
+
-H+ R C CH Hg OH R C CH2 H+
对称二取代炔
酮
CH3CH2C
CH
H2O H2SO4 / HgSO4
CH3CH2CCH3 O
CCH3 O
C
CH
H2O H2SO4 / HgSO4
CH3CHCH2 C CH3
CH H2O CH3CHCH2CCH3 + H / HgSO4
CH3
O
CH3CH2C
CCH2CH3
H2O H / HgSO4
+
例:完成下列合成
HO HO CO2CH3 H
•反合成分析:
HO HO CO2CH3 H CO2CH3 H
CO2CH3 +
第四章 炔烃和二烯烃

4.1 炔烃
二、炔烃的命名 1. 衍生物命名法
衍生物命名法只适用于简单的炔烃。以乙炔为母体,将其它的炔 烃看作乙炔的衍生物。
例如:
4.1 炔烃
2. 系统命名法
与烯烃的命名类似 ① 要选择含有 C≡C 的最长碳链为主链; ② 编号从最距离叁键最近的一端开始,并用阿位伯数字表示叁键的 位置。例:
837KJ/mol 0.120nm
611KJ/mol 0.134nm 0.108nm
( 3x347=1041)
347KJ/mol
0.154nm 0.110nm
H C C H H2C CH H
H3C C H2 H
原因: ① -C≡C-中有1个σ和2个π键; ② sp 杂化轨道中的 s 成份多。(s 电子的特点就是离核近,即 s 电子
CNa CNa + 2CH3I
CH3C CC2H5 + NaBr
CH3C CCH3 + 2NaI
炔化物作为亲核试剂,也可以与醛酮 发生亲核加成反应,得到 羟基炔化合物:
4.1 炔烃
(3) 过渡金属炔化物的生成及炔烃的鉴定
CH CH + 2Ag(NH3)2NO3 CH CH + 2Cu(NH3)2Cl
4.1 炔烃
③分子中同时含有双键和参键时,先叫烯后叫炔,编号要使双键和
参键的位次和最小。
1 2 3 45
CH C-CH=CHCH3
3-戊烯-1-炔
6 54 3 2 1
CH C-CH=C-CH=CH2
3-乙基-1,3-己二烯-5-炔
CH2CH3
④若双键、叁键处于相同的位次供选择时,优先给双键以最低编号。
4.1 炔烃
第4章 炔烃、二烯烃
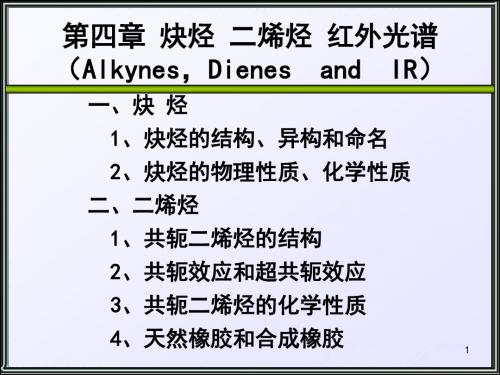
碳素酸的弱酸性
Na
+ 2 HC
+
HC
CH
CH
110℃
2 HC
CNa
+H
NH3
2
NaNH2
HC
CNa
+
13
R3C CH
Ka
R3C C
CH
+
44
H
+
物质名称
pKa
HOH
HC
H2 C
CH2
H3 C
CH3
15.7
25
50
端炔酸性的解释 端炔中的碳为sp杂化, 轨道中s成分较大, 核 对电子的束缚能力强, 电子云靠近碳原子, 使分子中的C-H键极性增加, 易断裂:
HC CH
+ 2 Ag(NH3)2NO3
+ 2 Cu(NH3)2Cl
AgC
CAg
+ 2 NH4NO3 + 2 NH3
乙炔银(白色)
HC CH
CuC
CCu
+ 2 NH4Cl + 2 NH3
乙炔亚铜(砖红色)
应用: 区别端炔与非端炔、端炔与烯烃。
RC CH
16
炔化物的生成
注意:炔化银或炔化亚铜在干燥状态下, 受热或震动容易爆炸。实验完毕后 加稀硝酸使其分解。
+
RC
CH2
> RCH
+
CH
22
炔烃的亲电加成
炔烃与烯烃反应活性比较: 炔烃的加成速度比烯烃慢。
加卤素
当化合物中同时含有双键和叁键时, 首先在双键上发生加成反应。
Br2 低温
Br Br
选择性加成
第4章炔烃

(Alkynes Diene IR )
分子中含有碳碳叁键“ C≡C ”的不饱和烃叫炔烃。 通式CnH2n-2,与同碳数二烯烃互为同分异构体。
第一节 炔 烃
4.1炔烃的命名
❖ 1.简单的炔,可用衍生物命名法命名。
以乙炔为母体,其它作为取代基。
❖ 如:
CH3CH2C≡CH CH3-C≡C-CH3 CH2=CH-C≡CH
❖ 二. 与Ag+、Cu+等重金属盐 反应——重金属炔化物的生 成
❖ 三. 炔氢弱酸性的解释
4.4.1 加成反应—催化加氢
❖ 炔烃催化加氢第一步生成烯,第二步继续加成为
饱和烃。常用催化剂有Pt、Pd、Ni等。
pKa 49
34
25
15.9
15.74
乙炔中的键电子云
H
H
❖ 每个键就不是孤立 的两块,它们形成分 布在C原子的上、下、 前、后的统一的筒状 电子云。
炔烃的异构
❖ 炔烃的异构可由碳链的结构及官能团位置变化引 起,但由于碳最高只有4价,叁键碳只能连有一个 烃基,所以炔烃不存在顺反异构体,炔烃的异构 体数因此较相应碳数烯烃的异构体要少。
两个碳链等长、不饱和键数目相同, 选含“双键”数最多的链为主碳链。
CH3C C CHCH2 CH CH2 CH CH2
4 _乙烯基 _ 1 _庚烯 _ 5 _ 炔 所含不饱和键数目相等,但碳链 不等长,选择较长的链为主碳链。
4.2 炔烃的结构
❖ 炔烃的结构特征是分子中含有“C≡C”,它与 “C=C”一样,是由键和键构成,下面以乙炔 为例说明叁键的形成及结构,乙炔为一直线型 分子,全部四个原子在同一直线上。
120.7pm
(Csp3-Csp3)
第四章炔烃和二烯烃全解

1
2
CH2
CH CH2 C CH
1-戊烯-4-炔
3
4
5
应命名为 3-戊烯-1-炔,而不命名为 2-戊烯-4-炔。
H3C C C CH2CHCH3
H3C C C C CH H H
5-乙基-1-庚烯-6-炔
not 3-乙基-6-庚烯-1-炔
(CH3)2CH C C H
H CH2C CH
(E)-6-甲基-4-庚烯-1-炔
CH3C CNa
HBr ROOR CH3CH2CH2Br
CH3C
CH
H2
Lindlar
CH3CH=CH2
CH3C
H2 Ni
CNa CH3C lig . NH3
CCH2CH2CH3
CH3CH2CH2CH2CH2CH3
3、与重金属盐的反应
♦ 1- 炔烃与银氨溶液反应,立即生成白色的炔化银沉 淀;与氯化亚铜氨溶液反应则生成砖红色的炔化亚 铜沉淀,只有端炔有此性质,是 区别端炔与非端炔 及烯烃的方法。
[Ag(NH3)2]
+
R C CH
R C CAg
炔化银
白色沉淀
HC
CH
[Cu(NH3)2]
+
CuC
CCu
砖红色沉淀
乙炔亚铜
区别乙烷、乙烯、乙炔
CH CH CH2=CH2 CH3CH3
Ag(NH3)2+
白色 ( ( ) )
(CH CH )
Br2/CCl4
褪色(CH2=CH2) ( -)
爆炸品——炔化银
炔烃的命名
炔烃的普通命名法是将其他炔烃看成乙炔 的衍生物命名。例如: (CH3)3C–C≡C–H 叔丁基乙炔 (CH3)3C–C≡C–C(CH3)3 二叔丁基乙炔 F3C–C≡C–H 三氟甲基乙炔 系统命名法与烯烃相似,只是将“烯”字 改为“炔”字。
第四章 炔烃和二烯烃 炔烃 二烯烃 共轭效应速度控制和平衡控制

H C=C H
R C=C H
(1)乙炔生成炔化银和炔化铜的反应
乙炔通入硝酸银的氨溶液或氯化亚铜的 氨溶液中,析出白色的乙炔银沉淀 或棕 红色的乙炔亚铜沉淀 。
RC CH + NaNH2 lig.NH3 RC C-Na+ + NH3
式烯烃。
C6H5 C6H5
C6H5-C≡C-C6 H5+H2 Lindlar Pd C=C
HH
(2)化学还原
在液氨中钠或锂还原炔烃主要得到反式 烯烃.
C3H7-C≡C-C3H7 +2Na+2NH3
C3H7
H
C==C + 2Na+NH-2
H
C3H7
(E)-4-辛烯 97%
化学还原过程:Na/lig NH3
更大. 乙炔的丙酮 溶液安定,乙炔在1.2MPa下压
入盛满丙酮浸润饱和的多孔物质的钢筒 中.
(1)乙炔的聚合反应
乙炔的聚合反应在不同的催化剂作用下, 发生二聚,三聚,四聚等低聚作用。与烯烃 的聚合反应不同,它一般不聚合成高聚 物。
在氯化亚铜-氯化铵的强酸溶液中,发生 线性型偶合而生成乙烯基乙炔。
碳叁键。
碳原子以SP杂化轨道 形成C-C键和C-H键。
每个碳原子以两个互相垂直的
未杂化的P轨道,两两互相侧面 重叠形成两个互相垂直的π键。
CC
乙炔分子的键参数:C≡C键长为0.12nm, 键能为835kJ/mol.
HC
CH
乙炔的π电子云
炔烃和二烯烃

烷基化的应用:生成的炔化钠可与卤代烷反应生成碳链增长的 炔烃
液态氨
RC≡C-Na+CH3X RC≡C-CH3
叁键碳上氢原子的活泼性
(a) 叁键的碳氢键由sp杂化轨道与氢原子参加组成s 共价键,叁键的电负性比较强,使C-H s键的电子 云更靠近碳原子. 这种 ≡C-H键的极化使炔烃易离 解为质子和比较稳定的炔基负离子 (-C≡C-). (即: 有利于炔C-H异裂形成H+.)
C—H 中的H具有微酸性
二、炔烃的化学性质
不饱和,可加成(亲电、亲核和还原加氢)
C
C
H
末端氢有弱酸性
1. 亲电加成 (1).加卤素
p键可被氧化
炔烃和烯烃一样,与卤素加成,得到反式加成产物。
RC≡CR′ +X2(Cl,Br) R
C
C
X
X2
X
R′
RCX2CX2R′
可以控制条件使反应停留在第一步,得反式加成产物。
与氯化亚铜的液氨溶液作用-- 炔化亚铜
(红色沉淀)
CH≡CH +Cu2Cl2+2NH4OHCuC≡CCu+2NH4Cl+2H2O RC≡CH +Cu2Cl2+2NH4OHRC≡CCu+ NH4Cl+H2O
AgC≡CAg +2HCl CH≡CH+2AgCl CuC≡CCu +2HCl CH≡CH+Cu2Cl2
R C CH + H2O
HgSO4 H2SO4
H2C
CH R OH
重排
CH3 C
R
O 甲基酮
=
3.氧化
(HC≡被氧化成CO2,其余三键碳被氧化成-COOH)
有机化学-炔烃和二烯烃

完成下列转化
1° R’ X
RC CR’
CH3C CH
CH3C CCH 2CH CH 2
CH3C CNa + XCH2C CH2
第五节、二烯烃
一、分类和命名
(一)分类
• 隔离二烯烃(isolated diene)
H2C CHCH2CH CH2
•累积二烯烃(cumulated diene)
H2C C CH2
双烯合成是共轭二烯烃的特性反应之一
四、聚集二烯烃
H H
CCC
H
H
丙二烯分子的中间碳原子为sp杂化,分别与两 边碳(sp2杂化)形成了两个互相垂直的π键。
H
H
CCC
H
H
丙二烯的两端碳原子连有不同取代基的化 合物有一对对映体。
a
a
CCC
b
b
手性分子
五、共轭体系和共轭效应
共轭体系── 是指能造成电子离 域的体系。
共轭二烯烃的特性
• 键长趋于平均化。
1,3-丁二烯分子中的双键键长(134pm),比 乙烯的(133pm)稍长,而C2 —C3 单键的键长 (146pm)比乙烷的C—C单键的键长(154pm) 短,而且围绕C2 —C3 键的旋转有一定的限制作 用,已观察到S-反式1,3-丁二烯是一个很占优势 的构象。
一、炔氢的酸性
CH CH+ Na 110℃ NaC CNa + H2
2RC CH+ 2Na △ 2 RC CNa + H2
乙炔的酸性不能使石蕊试纸变红,它的 酸性比水和醇小得多。
HC CNa+H2O
NaOH +CH CH
H2O > CH CH
第四章 炔烃和二烯烃

炔烃与HCl加成时,需用HgCl2催化,与HBr加成时, 也有过氧化物效应,生成反马氏规则的产物,烯炔加 卤化氢时,加成反应也是先在双键上进行。
③加水 将乙炔通入含HgSO4的稀H2SO4溶液中,可与一分子 水加成,生成乙醛。反应是先生成不稳定的乙烯醇, 再发生分子重排,生成乙醛的。这一反应称为库切洛 夫(Кучеров)反应。其他炔烃加水则生成酮。
林得勒催化剂,是沉淀在BaSO4或CaCO3上的Pd,并用 醋酸铅或喹啉降低其活性。 烯炔部分被氢化时,三键首先被氢化。烯烃和炔烃分别 加氢时,炔加氢的速度比烯慢,其他加成反应也是如此, 但烯烃和炔烃的混合物加氢时,炔烃更易吸附在催化剂 表面,所以三键先被氢化。
3 亲电加成
①加卤素 炔烃与卤素起加成反应时,先生成二卤化物,继续作用生 成四卤化物。烯炔加卤素时,首先加在双键上。原因:炔 烃的亲电加成反应要比烯烃的难些,是由于三键的π电子 比双键的难以极化,较难给出电子和亲电试剂作用。
H C≡ C H
180°
1.sp杂化轨道
2p 2s
激发
2p 2s
杂化 p
sp
杂化后形成两个sp杂化轨道(含1/2 S和1/2 P成分),
剩下两个杂化P的轨道。两个sp杂化轨道成1800分布,两个
未杂化的P(PY、PZ)轨道互相垂直,它们与中一碳的两个P轨 道两两互相侧面重叠形成两个互相垂直的键。
2-甲基-1,3-丁二烯
CH2 CHCH CHCH CH2
1,3,5-己三烯
多烯烃的顺反异构体的命名也和烯烃相似,碳原子编 号,从离双键最近的一端开始,若两端离双键等距时, 应从构型为Z的双键一端开始。
H
H
CC
H
CH3
CC
第4章-2 不饱和烃-炔烃及二烯烃

2. 还原反应
(1) 催化加氢反应
炔烃的还原反应可以还原到烯烃, 也可以还原到烷烃。
炔烃加氢反应也需要催化剂,可以加一分子氢,也可以加两分 子氢,实际应用中多数控制在加一分子氢。
如果使用钝化催化剂,可以得到顺式烯烃:
CH3CH2 CH3CH2C CCH2CH3 + H2 钝化催化剂 C C H H CH2CH3
H3 C C C CH3 HCI CI HCI H3 C C C H CH3 CI CH3 CH2C CH3 CI
乙炔与HCl加成需要有催化剂才能顺利反应,是合成氯乙烯 的工业方法: HgCI2/C + HCI HC CH H2C CHCI 溴化氢也能与炔烃加成:
CH3CH2CH2CH2C CH + HBr 无水 Fe
对称内炔烃 不对称内炔烃
例如: NaC
R1C
R C R1 C
+ R2
炔烃的重要合成方法之一
3.过渡金属炔化物的生成
乙炔、端炔烃能与硝酸银或氯化亚铜的氨溶液反应,生成白色 炔化银或砖红色炔化亚铜沉淀,可用来鉴定乙炔和端炔的存在:
白色 砖红色
乙炔 和 端炔 的特征反应
干燥的炔化银、炔化亚铜易爆炸。 20
(2)亲核加成反应的机理:
CH3OH + -OH HC CH + CH3O
以乙炔与甲醇在氢氧化钾催化下反应为例说明: CH3O + H2O
慢
快
HC C OCH3 H H2C C OCH3 + CH3O H
12
- HC C OCH + CH OH 3 3 H
4.6.2 氧化和还原反应
1. 氧化反应
炔烃经KMnO4或臭氧氧化后再水解,在叁键 处断裂,生成相应的酸:
炔烃和二烯烃

农业化学品
除草剂
01
炔烃和二烯烃可用于合成除草剂,如草甘膦、百草枯等,这些
除草剂在农业生产中有广泛应用。
杀虫剂
02
炔烃和二烯烃可用于合成杀虫剂,如滴滴涕、马拉硫磷等,这
些杀虫剂在防治农业害虫方面有重要作用。
植物生长调节剂
03
炔烃和二烯烃可用于合成植物生长调节剂,如赤霉素、细胞分
裂素等,这些调节剂可调节植物生长和发育。
05 炔烃和二烯烃的未来发展
新材料的开发
高性能聚合物
利用炔烃和二烯烃的特殊化学性质,开发出具有优异力学 性能、热性能和化学稳定性的新型聚合物材料,用于航空 航天、汽车、电子等领域。
功能性材料
通过炔烃和二烯烃的聚合反应,制备具有光、电、磁等功 能的材料,应用于传感器、光电转换器件、磁存储等领域。
生物医用材料
03 炔烃和二烯烃的反应
加成反应
01
碳碳双键和碳碳三键的加成反应
炔烃和二烯烃中的碳碳双键和碳碳三键容易发生加成反应,可以与氢气、
卤素、卤化氢等发生加成反应,生成相应的烷烃或卤代烃。
02
加成反应的催化剂
某些金属催化剂如铂、钯、镍等可以促进炔烃和二烯烃的加成反应。
03
加成反应的立体化学特征
加成反应可以遵循不同的立体化学规则,如顺式加成、反式加成和协同药物合成Leabharlann 1 2 3激素类药物
炔烃和二烯烃可用于合成激素类药物,如雌二醇、 睾酮等,这些药物在调节人体生理功能和治疗某 些疾病方面有重要作用。
抗生素类药物
炔烃和二烯烃可用于合成抗生素类药物,如青霉 素、头孢菌素等,这些药物在抗菌、消炎等方面 有广泛应用。
其他药物
炔烃和二烯烃还可用于合成其他药物,如抗癌药 物、镇痛药等。
有机化学第4章 炔烃和二烯烃

1、碳sp杂化轨道的电负性大于碳sp2杂化轨道的电负性,炔中 电子控制较牢。三键键长短,两个P轨道重叠程度大,稳定。
2、从反应形成的碳正离子的稳定性来看,炔加成形成的烯基
碳正离子中,C+与CSP2相连,SP2的电负性大,不利于正电荷 的分散,故稳定性不如烷基碳正离子。
R-C CH + E+ R-C CH2 + E+
98%
3-庚炔
(E)-3-庚烯
6、HCN、EtOH、CH3COOH等的亲核加成反应
定义:亲核试剂进攻炔烃的不饱和键而引起 的加成反应,称为炔烃的亲核加成。
常用的亲核试剂有: ROH(RO-)、HCN(-CN)、RCOOH(RCOO-)
碱,150-180oC
(1). CHCH + HOC2H5
聚合,催化剂
NH3(L) RC C Na
RC C Na + CH3X
RC C + CH3 X
RC CCH3
RC CCH3
(可看作是强碱与弱酸之间的盐的反应)
CH3CH2C≡CNa + CH3CH2CH2Br CH3CH2C≡CCH2CH2CH3 + NaBr ( R-X=1°RX)
乙炔基负离子、乙烯基负离子、乙基负离子的结构:
SP 乙炔基负离子
碱性: 酸性:
SP2 乙烯基负离子
SP3 乙基负离子
5、还原
1)催化加氢
R C C R' + H2
pd
R C
R' C
H2
H
H pd
RCH2CH2R'
Lindlar Cat. RC CR' + H2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
R C H C
H
R'
2、炔烃的氧化
KM nO4 OH R C C R' O3 H 2O O KM nO4 OH R C C H O3 R H 2O O C OH + HO O C H H+ R C OH + CO2 R H+ O C OH + HO O C R'
羧酸
羧酸
羧酸
甲酸
(二)亲电加成
1、炔烃与卤化氢的加成
CH 2 CHCH Br 80% C H 2 + C H 2C H Br 20% CHCH2 Br
-80OC B r
CH3 CH2 C CH C H 2 + B r2
CH3 CH2 Br C CH CH2 Br
2) 加 HX
CH2 CH CH CH2 HX CH3 CH X CH C H 2+ C H 2 H CH CH CH2 X
1. 由二元卤代烷脱卤化氢 2. 由炔化物的制备
Ⅲ
共轭二烯烃
一、共轭二烯烃的结构
1. 几种类型的二烯及命名
C
C
C n
共轭二烯 特点:单双键交替
累积二烯
孤立二烯
CH3 H 2C CH CH CH2 H 2C C CH CH2 H 2C C CH CH3
1, 3-丁二烯
甲基-1, 3-丁二烯
1, 2-丁二烯
HCl
HOAc 78% FeCl3 25%
22% 75%
HBr
-78OC > 80%
40OC 80% 主产物
CH C H 2+ C H 2 H CH CH CH2 H
3) 催化加氢
CH2 CH CH CH2 H2
-O-OCH3 CH H
Pt 为混合物; Na(NH3) 1,4-加成产物.
2. 环加成反应( Diels-Alder 反应)
(二)书写极限式时有一定的规则,不能随意书写。
1. 必须遵守价键理论,氢原子的外层电子数不能超
过2个,第二周期的元素最外层电子数不能超过8个,
H H 3C
σ, p - 超 共 轭 效 应
1)类型 p-p共扼 p-p共扼
CH2 CH2 CH CH CH CH CH2 O
1,3-丁二烯 丙烯醛 烯丙基自由基 烯丙基阳离子
CH2 CH2 CH2
CH CH2 CH CH2 CH CH2
CH Cl
烯丙基阴离子
氯乙烯 丙烯
n-p共扼 s-p共扼
CH2
同周期元素,电负性愈强,-C 效应愈大;
同族元素,从上到下,-C 效应变小。
四、共轭效应特点
1. 键长趋于平均化 2. 共轭二烯烃体系的能量低
3. 折射率高
五、共振式和共振论的简介
共振论的基本要点: (一) 当一个分子、离子或自由基按照价键理 论可以写出两个以上的经典结构式时,这些结 构式构成一个共振杂化体,只有共振杂化体才 能反映分子的真实结构。
亲核加成
a-炔基醇(炔丙型醇)
合成上应用举例
OH OH C C C CH3
例 1:
H
C
C
H
CH3
C CH3
CH3
反合成分析
OH CH
3
OH C C C CH3 CH3
O C CH3 + C C + CH3
O C CH3
C CH3
CH3
•合成路线
O
2 NaNH2
H C C H
2 H3
Na
C C
C
CH3
n
1,3-丁二烯的轨道示意图
四、共轭二烯的反应
1. 1,4-加成
2. 狄尔斯—阿尔德反应
1. 1,2-和1,4加成
1) 加卤素 1,2-加成
40OC C H 2 C H C H
Br Br 20%
1,4-加成
C H 2 + C H 2C H Br 80% CHCH2 Br
CH2
CHCH
C H 2 + B r2
Ⅱ 炔 烃
一、炔烃的结构
1. 碳原子的杂化:SP杂化
2. 炔键的立体构型:直线型
3. 炔键的键长:0.12nm 4. 炔键的键能:835kJ/mol
二、炔烃的命名
系统命名法 1. 选择含叁键的最长碳链为主链。 2. 使叁键的编号最小 3. 同时含有双键和叁键时,其位次的编号通
常使双键具有最小的位次。
26 25.5
16 15.7
HCCΘ (CH3)3CCΘ
CH3CH2OΘ HOΘ
C
C
Na
+
NH3
炔基钠
R C C H R C C M gX + R 'H
炔基Grignard试剂
R 'O N a
不生成负离子
炔基负离子的反应及在合成上的应用
R' L ( L = X, O Ts)
o
R
C
C
R'
+
L
普通催化剂
使用特殊催化剂(经钝化处理)还原炔烃至顺式烯烃
H2 Pd / PbO, CaC R C C R' O3 R C H C H R'
(Lindlar催化剂)
H2 Ni 2 B
主要产物 (P-2催化剂) 顺式
碱金属还原(还原剂 Na or Li / 液氨体系)
——制备反式烯烃
Na or Li R C C R' N H 3 (液 ) - 7 8oC
O O
C 6H 6, 1 0 0 oC +
O
5 h
O O
O
双烯体 亲双烯体
O
N S C C l3
克菌丹, 叶面杀菌剂
O
(1)反应机制 经环状过渡态,一步完成,即旧键断裂与新键形成同步。
+
反应条件:加热或光照。无催化剂。反应定量完成。 (2)反应立体专一、顺式加成
H + HOOC H COOH COOH H + H COOH H COOH COOH H
C H 3C H 2
H
1-戊炔
1 CH2
2 3 4 C H C H 2C
5 CH
1-戊烯-4-炔
1 H 2C 9
2 3 4 5 C H C H 2C H 2C H 8 7 6 5
6 7 8 C H C H 2C 4 3 2
9 CH 1
4, 8-壬二烯-1-炔
三、炔烃的物理性质
1. 随相对分子质量的增加而有规律性的变化。 2. 炔烃的沸点比相应的烯烃高10~20℃。 3. 相对密度比对应的烯烃稍大。 4. 在水里的溶解度也比烷烃和烯烃大些。
H 2O TM
Na
提示:注意与Na / NH3 还原体系区别
末端炔烃的特征反应
A g (N H 3 ) 2 + / O H R C C Ag
R
C
C
H C u (N H 3 ) 2 + / O H R
白色沉淀
C
C
Cu
红色沉淀 两者有爆炸性, 可用硝酸分解
五、乙炔
1. 制法 2. 性质
六、炔烃的制备
2、炔烃与卤素的加成
X R C CH X X R C C H X X X X R C X X C X H
较慢
反式为主
合成上应用: 合成二卤代烯烃(控制在第一步) 炔烃的保护和脱保护
Zn
R
C
CH
叁键的加成比双键难
Br
H 2C CH C CH
Br
H 2C Br CH Br C CH
3、炔烃与与H2O的加成(炔烃的水合反应)
(异戊二烯)
2、共轭二烯特性
(1)共轭二烯稳定性
氢化热比较
氢化热(kJ/mol)
CH2 CH CH3
平均每个双键 119.5 113.2
H 2C H 2C
CH CH
CH CH
238.9 226.4
较 稳 定
CH3 CH H 3C H 2C
CH2 CH2 CH CH2
125.2 126.8 254.4 127.2
炔烃的水合机理
H 2O Hg R C CH
++
OH2 C
R
d+
Hg
CH
++
R
C
CH Hg
+
亲电加成
p络合物 (汞化物)
-H
+
OH R C CH Hg
H+ R
+
OH C
H CH Hg
+
OH R C CH2 H+ R
OH -H C CH2 H
+
O R C CH3
烯醇式
酮式 酸性条件下烯醇式与酮式的互变机理
( R ': 1 烷 基 )
SN2
R C 或 C Na O (1 ) (2 ) M gX R' R
高级炔烃
OH C C C H 2C H R'
d
R C C
H 2O
SN2
b-炔基醇
炔基负离子 亲核试剂
O (1 ) (2 ) R' H 2O C R " (H ) R C C
OH C R' R " (H )
3、D-A反应是共扼二烯的特有反应. 亲双烯体中一般都带 有吸电子的基团.
O H + + O endo exo H O
3 0 0 oC + 高压釜
D-A反应特点: (1) 可逆; (2) endo体总是主产物.
