2015年中考化学复习精品课件+第17讲+溶液的形成+溶解度
中考化学总复习教案溶液的形成及溶解度

中考化学总复习教案——溶液的形成及溶解度教学目标:1. 理解溶液的概念,掌握溶液的形成过程。
2. 掌握溶解度的概念,了解溶解度曲线及其应用。
3. 能够运用溶液的形成及溶解度知识解决实际问题。
教学重点:1. 溶液的形成过程。
2. 溶解度的概念及溶解度曲线的应用。
教学难点:1. 溶液与悬浊液、乳浊液的区别。
2. 溶解度曲线的解读及应用。
教学准备:1. 教学PPT。
2. 溶解度曲线图。
3. 相关实际问题案例。
教学过程:第一章:溶液的概念及形成1.1 溶液的定义1. 引入溶液的概念。
2. 解释溶液的本质特征。
1.2 溶液的形成过程1. 讲解溶质与溶剂的相互作用。
2. 演示溶液的形成实验。
3. 分析溶液形成的过程。
第二章:溶液的性质及特点2.1 溶液的均一性1. 讲解溶液的均一性特点。
2. 进行实验验证。
2.2 溶液的稳定性1. 讲解溶液的稳定性特点。
2. 分析影响溶液稳定性的因素。
第三章:溶解度及溶解度曲线3.1 溶解度的概念1. 引入溶解度的概念。
2. 讲解溶解度的表示方法。
3.2 溶解度曲线及其意义1. 展示溶解度曲线图。
2. 讲解溶解度曲线的意义。
3. 分析溶解度曲线的变化规律。
第四章:溶解度曲线的应用4.1 溶解度曲线的解读1. 讲解溶解度曲线的解读方法。
2. 进行实例分析。
4.2 溶解度曲线的应用1. 讲解溶解度曲线在实际问题中的应用。
2. 分析实际问题案例。
第五章:溶液与生活5.1 溶液在日常生活中的应用1. 讲解溶液在日常生活中的应用实例。
2. 分析溶液的作用及优点。
5.2 溶液在工业中的应用1. 讲解溶液在工业中的应用实例。
2. 分析溶液在工业中的重要性。
教学评价:1. 课堂问答:检查学生对溶液概念、溶解度及溶解度曲线的理解。
2. 实验报告:评估学生在实验中对溶液形成及溶解度曲线的观察和分析能力。
3. 课后作业:检查学生对溶液性质、溶解度曲线应用的掌握。
教学反思:根据学生反馈和课堂表现,对教学内容和方法进行调整,以提高学生对溶液的形成及溶解度的理解和应用能力。
中考化学总复习教案溶液的形成及溶解度

中考化学总复习教案——溶液的形成及溶解度教学目标:1. 掌握溶液的概念及特点;2. 理解溶液的形成过程;3. 掌握溶解度的概念及影响因素;4. 学会运用溶解度曲线解决实际问题。
教学内容:一、溶液的概念及特点1. 溶液的定义2. 溶液的特点3. 溶液与悬浊液、乳浊液的区别二、溶液的形成过程1. 溶质的溶解过程2. 溶液的配制方法3. 溶液的稀释与浓缩三、溶解度1. 溶解度的定义2. 溶解度的四要素3. 溶解度曲线的意义四、影响溶解度的因素1. 温度对溶解度的影响2. 压力对溶解度的影响3. 溶剂的性质对溶解度的影响五、溶解度在实际应用中的例子1. 饱和溶液与不饱和溶液的判断与应用2. 溶解度曲线在溶解度预测中的应用3. 溶液的沸腾与蒸馏教学方法:1. 采用讲授法,讲解溶液的概念、特点、形成过程、溶解度及其影响因素;2. 利用实验演示,让学生直观地了解溶液的形成及溶解度现象;3. 运用案例分析法,分析实际应用中的溶液问题;4. 开展小组讨论,培养学生合作学习的能力。
教学评价:1. 课后作业:要求学生完成有关溶液的形成及溶解度的练习题,巩固所学知识;2. 课堂问答:教师提问,学生回答,检查学生对溶液概念、特点、形成过程、溶解度及其影响因素的理解程度;教学资源:1. 教材:《化学》;2. 实验器材:烧杯、玻璃棒、温度计等;3. 课件:溶液的形成及溶解度相关图片、视频等;4. 练习题及答案。
教学步骤:一、溶液的概念及特点(45分钟)1. 讲解溶液的定义,引导学生理解溶液的本质特征;2. 分析溶液的特点,如均一性、稳定性等;3. 比较溶液与悬浊液、乳浊液的区别,加深学生对溶液概念的理解。
二、溶液的形成过程(45分钟)1. 介绍溶质的溶解过程,如溶解、扩散、平衡等;2. 演示溶液的配制方法,如溶解、稀释等;3. 讲解溶液的稀释与浓缩原理,让学生学会运用。
三、溶解度(45分钟)1. 讲解溶解度的定义,明确溶解度的四要素;2. 绘制溶解度曲线,让学生了解溶解度曲线的意义;3. 分析溶解度与溶液浓度的关系。
中考化学总复习教案溶液的形成及溶解度

中考化学总复习教案——溶液的形成及溶解度一、教学目标:1. 让学生理解溶液的概念,掌握溶液的形成过程。
2. 使学生了解溶解度的概念,能够运用溶解度曲线分析溶液的组成。
3. 培养学生运用化学知识解决实际问题的能力。
二、教学内容:1. 溶液的形成(1)概念:一种或几种物质分散到另一种物质中,形成均一的、稳定的混合物。
(2)种类:均一性溶液、非均一性溶液。
2. 溶解度(1)概念:在一定温度下,某固体溶质在100g溶剂里达到饱和状态所溶解的溶质质量。
(2)溶解度曲线:表示在不同温度下,物质的溶解度变化情况。
3. 溶液的组成分析(1)利用溶解度曲线判断溶液的组成。
(2)运用饱和溶液与不饱和溶液的转化关系分析溶液的成分。
三、教学重点与难点:1. 教学重点:溶液的形成过程,溶解度的概念及应用。
2. 教学难点:溶解度曲线的解读,溶液组成分析。
四、教学方法:1. 采用问题驱动法,引导学生主动探究溶液的形成及溶解度。
2. 利用实验、动画等多媒体教学资源,增强学生对知识点的理解。
3. 开展小组讨论,培养学生合作学习的能力。
五、教学过程:1. 导入:通过生活中的实例,引导学生思考溶液的概念。
2. 新课导入:讲解溶液的形成过程,介绍溶液的种类。
3. 知识讲解:讲解溶解度的概念,引导学生理解溶解度曲线的意义。
4. 案例分析:利用溶解度曲线分析实际问题,如判断溶液的组成。
5. 课堂练习:设计相关练习题,巩固所学知识。
6. 总结与反思:对本节课内容进行总结,引导学生思考溶液在日常生活中的应用。
7. 课后作业:布置适量作业,巩固所学知识。
六、教学评价:1. 评价学生对溶液的概念、种类以及形成过程的掌握程度。
2. 评价学生对溶解度的理解,能否运用溶解度曲线分析问题。
3. 评价学生在实际问题中运用化学知识解决问题的能力。
七、教学反馈:1. 课堂练习的完成情况,学生对溶液组成分析的准确性。
2. 学生对溶解度曲线解读的熟练程度。
3. 学生对课后作业的完成情况,以及对知识点的巩固程度。
2015中考化学(人教版通用)总复习课件:第15讲 溶液的形成及溶解度

溶解时的吸热或放热现象 1.过程分析 向水中扩散 , 这是一个 ______ 吸收 热量 (1) 溶质分子 ( 或离子 )_____________ 的过程,属于物理变化。 水合分子 或 (2)溶质分子(或离子)与__________ 水分子 作用,形成__________( 水合离子 放出 热量的过程 , 属于化 _______________) , 这是一个 _______ 学变化。 2.溶解时的吸热或放热现象 下降 (1)扩散吸热>水合放热,溶液温度_________ ,如NH4NO3溶 解。 不变 ,如NaCl溶解。 (2)扩散吸热=水合放热,溶液温度______ 升高 , 如 NaOH 、 (3) 扩 散 吸 热 < 水 合 放 热 , 溶 液 温 度 ______ H2SO4溶解。
• ②外因:随温度升高而______,随压强增大而______。
物质结晶的两种方法 • 1.降温结晶法:适用于溶解度随温度变化 ______的物质。 较大 很小 • 2.蒸发溶剂法:适用于溶解度随温度变化 ______的物质。
• 【例 1】(2013 , 兰州 ) 下列关于溶液的说法 , 正确的是 ( ) • A.溶液都是无色透明的 • B.面粉与水混合可形成溶液 • C.饱和溶液不能再溶解任何物质 • D.硝酸铵溶解在水中,溶液温度会降低 [答案]D 解析:溶液不全是无色透明的,如硫酸铜溶液显
(2)饱和溶液和不饱和溶液相互转化的条件和方法: 不饱和溶液
增加溶质、改变温度或减少溶剂 增加溶剂或改变温度
饱和溶液
溶质 相对较多 • 2.浓溶液和稀溶液 溶质 相对较少 • (1)浓溶液:指________含量____________的溶液。
溶解度
• • • • • • • • 1.固体溶解度 一定温度 100g (1) 概念:在 _______________ 下 , 某固态物质在 __________ 溶剂里达到饱和状态时所 溶解的质量。 (2)影响因素 ①内因:溶质和溶剂的性质。 温度 ②外因:_______。
初中化学溶液的形成PPT课件

A、当溶液中有水存在时,不论水量的多 少,水都是溶剂。
注
B、两种液体互溶,溶液中无水存在时, 量多的一种叫溶剂,量少的叫溶质。
意 C、不指明溶剂的溶液,一般指的水溶液。
D、溶液不一定是无色的。
E、凡均一、透明、稳定的液体不一定 是溶液。
为深入学习习近平新时代中国特色社 会主义 思想和 党的十 九大精 神,贯彻 全国教 育大会 精神,充 分发挥 中小学 图书室 育人功 能
学完本课我知道了
1、认识了溶解现象,知道了溶液、 溶质、溶剂的概念。
2、溶液是一类重要的物质,在生产 和生活中有重要的应用。
3、知道一些常见的乳化现象。
4、溶质在溶解的过程中,有的放出 热量,有的吸收热量。
为深入学习习近平新时代中国特色社 会主义 思想和 党的十 九大精 神,贯彻 全国教 育大会 精神,充 分发挥 中小学 图书室 育人功 能
为深入学习习近平新时代中国特色社 会主义 思想和 党的十 九大精 神,贯彻 全国教 育大会 精神,充 分发挥 中小学 图书室 育人功 能
试管 编号
1 2
3 4
实验9-2
溶剂 溶质
现象
水 水 汽油 汽油
碘
碘几乎不溶于水 ,溶液呈浅黄色
高锰 酸钾
碘
高锰 酸钾
高锰酸钾溶解, 溶液呈紫红色
碘溶解,溶液 呈紫红色
者是溶剂,后者是溶质的一组是( C )
A 糖、水 C 酒精、碘
B 硫酸铜、水 D 氢氧化钠、水
7、下列各组物质中,前者是后者的溶质 的是(AD)
A、氯化氢、盐酸
B、生石灰、石灰水
C、二氧化碳、碳酸溶液 D、氯化钠、食盐水
为深入学习习近平新时代中国特色社 会主义 思想和 党的十 九大精 神,贯彻 全国教 育大会 精神,充 分发挥 中小学 图书室 育人功 能
鲁教版化学九年级《溶液》复习课件
【解析】本题考查用图像表示变化的能力,解答本题需明确 两点:(1)氢氧化钙溶解度与温度的关系;(2)生石灰放入溶 液后的变化情况。生石灰能与水反应生成氢氧化钙,溶剂质 量会减少,A错误;反应过程中放热使溶液的温度升高,致 使氢氧化钙的溶解度降低,B错误;因为饱和溶液中溶剂的 量减少,溶质的质量随之减少,温度升高溶解度降低,使得 溶质的质量也随之减少,温度恢复后,溶解度增大,溶质的 质量又会增大,但小于开始时的质量,C正确;温度不变, 溶解度不变,饱和溶液的溶质质量分数相等,D错误。 故选:C。
知识回顾
2.物质溶解时温度的变化 (1)物质溶解于水的过程中发生了两种变化:一是 溶质的分子(或离子)向水中扩散,这一过程_吸__收__ 热量;二是溶质的分子(或离子)和水分子作用,生 成水和分子(或水合离子),这一过程_放__出__热量。 (2)若吸热<放热,溶液温度__升__高___;若吸热=放 热,溶液温度不变;若吸热>放热,溶液温度 __降__低___。
例题解析
【解析】 (1)从标签中可以知道盐酸的体积为500mL,密度为 1.19g/cm3,可以据此求出盐酸的质量为: 1.19g/cm3×500mL=595g; (2)设需要这种浓盐酸的质量为x,根据稀释前后溶 质的质量不变可知: 148g×5%=x•37% 解得:x=20g;
例题解析
(3)根据题意可以知道氢氧化钠和盐酸恰好完全反应,所以盐 酸中溶质 的质量为:73g×5%=3.65g; 设氢氧化钠溶液中溶质的质量为x NaOH+HCl═NaCl+H2O 40 36.5
知识回顾
3.乳化现象: (1)含表面活性剂的物质可以使食用油等物质以 _细__小__的__液__滴___均匀分散在水中,形成不易分层、比较 稳定的混合物,这种现象叫做__乳__化__现__象___。 (2)乳化作用在生产生活中应用广泛,如利用 __洗__涤__剂____可以轻松去除衣物或餐具上的油污。
九年级化学下册 第九单元《溶液》 复习课件

固体溶解度的表示方法——溶解度曲线 横坐标表示温度,纵坐标表示溶解度
注:曲线下
方的点表示不 饱和溶液,其 纵坐标表示 100g溶剂中 实际溶解的溶 质质量,与溶 解度无关。
趋势、交点、分离、溶液状态
《溶液》复习课2
《溶液》复习课
提示:溶液部分内容是承接《金属》与 《酸碱盐》两部分核心内容的重要部分, 弄懂溶液部分就抓住了化学九下的关键!
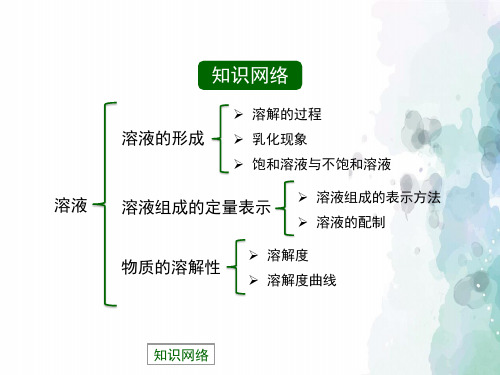
一、基本概念复习
溶液的形成:溶液、悬浊液、乳浊液、 乳化、溶解过程 、饱和与不饱和溶液、 溶解度、溶解度曲线、溶质的质量分数
• 一种或几种物质分散到另一种物质里, 形成均一的、稳定的混合物,叫做溶液。
三、饱和溶液、不饱和溶液与 浓溶液、稀溶液之关系
对于不同溶质的溶液 来说,浓溶液不一定 是饱和溶液,稀溶液 不一定是不饱和溶液。 对于同一种溶质来说, 在一定温度下,饱和 溶液比不饱和溶液浓。
四、溶解度
溶解性是指一种物质溶解在另一种 物质里的能力,而溶解度是溶解性 的定量表示方法。
20℃时,根据各物质在水中溶解度的大 小,可将物质的溶解性分为下列四类:
杂质的质量,所以还要减去杂质 的质量
(4)小华另设计了一个实验方案,即用 6g生铁粉与20%的硫酸铜溶液反应来分 析生铁中铁的含量。请你画出加入硫酸 铜溶液质量与固体质量变化关系的曲线。
(80,6.8)
• 悬浊液:固体小颗粒悬浮于液体里形成的 混合物.
• 乳浊液:小液滴分散到液体里形成的混合 物.
巩固练习一
1、把少量下列物质分别放入水中,充分 搅拌,可以得到溶液的是( BD )
A.面粉 B.氯化钠 C.汽油 D.蔗糖
溶液的形成及溶解度 公开课获奖课件

溶解度 1.固体溶解度
(1) 概念:在 __________ 100g 溶剂里达到饱和状态时 一定温度 下,某固态物质在 ______
所溶解的质量。 (2)影响因素 ①内因:溶质和溶剂的性质。 ②外因:______ 温度 。
a.大多数物质的溶解度随温度升高而______ 升高 ,如________ KNO3 。
1.(2015· 北京)下列饮品属于溶液的是( A ) A.蔗糖水 B.牛奶 C.果粒橙 D.豆浆 2.(2015· 邵阳)下列洗涤或除污过程利用乳化原理的是( A )
A.用洗洁精洗去餐具上的油污
B.用刷子刷去杯子上的污垢 C.用酒精除去衣服上的碘 D.用汽油除去衣服上的油污
3.(2015· 河南)下表是KCl和KNO3在不同温度时的溶解度。下
判断某种物质在一定条件下的溶解度;②饱和溶液与不饱和溶液的判断; ③根据溶解度曲线判断溶质的质量分数;④判断物质的溶解度受温度影响 变化的趋势;⑤根据溶解度曲线的升降情况判断物质结晶或提纯的方法。
【例4】(2015· 盐城)右图是甲、乙两固体物质的溶解度曲线,下列说 法错误的是( D )
A.10℃时,甲的溶解度小于乙的溶解度
前
言
高考状元是一个特殊的群体,在许多人的眼中,他 们就如浩瀚宇宙里璀璨夺目的星星那样遥不可及。但实 际上他们和我们每一个同学都一样平凡而普通,但他们 有是不平凡不普通的,他们的不平凡之处就是在学习方 面有一些独到的个性,又有着一些共性,而这些对在校 的同学尤其是将参加高考的同学都有一定的借鉴意义。
某KNO3样品中含有少量K2CO3,其提纯过程如下:
饱和 填“饱和”或“不饱和”)溶液; ①上图中溶液C是______( ②样品中钾元素的质量为______g 33 。(结果保留整数)
