重组质粒快速抽提的方法
质粒提取的原理、操作步骤、各溶液的作用

质粒提取的原理、操作步骤、各溶液的作用(2010-11-11 17:19:05)转载▼分类:Biology标签:质粒溶液无水乙醇大肠杆菌杂谈细菌质粒是一类双链、闭环的DNA,大小范围从1kb至200kb以上不等。
各种质粒都是存在于细胞质中、独立于细胞染色体之外的自主复制的遗传成份,通常情况下可持续稳定地处于染色体外的游离状态,但在一定条件下也会可逆地整合到寄主染色体上,随着染色体的复制而复制,并通过细胞分裂传递到后代。
质粒已成为目前最常用的基因克隆的载体分子,重要的条件是可获得大量纯化的质粒DNA分子。
目前已有许多方法可用于质粒DNA的提取,下面主要介绍碱裂解法提取质粒DNA的方法。
碱裂解法是一种应用最为广泛的制备质粒DNA的方法,其基本原理为:当菌体在NaOH和SDS溶液中裂解时,蛋白质与DNA发生变性,当加入中和液后,质粒DNA分子能够迅速复性,呈溶解状态,离心时留在上清中;蛋白质与染色体DNA不变性而呈絮状,离心时可沉淀下来。
纯化质粒DNA的方法通常是利用了质粒DNA相对较小及共价闭环两个性质。
例如,氯化铯-溴化乙锭梯度平衡离心、离子交换层析、凝胶过滤层析、聚乙二醇分级沉淀等方法,但这些方法相对昂贵或费时。
对于小量制备的质粒DNA,经过苯酚、氯仿抽提,RNA 酶消化和乙醇沉淀等简单步骤去除残余蛋白质和RNA,所得纯化的质粒DNA已可满足细菌转化、DNA片段的分离和酶切、常规亚克隆及探针标记等要求,故在分子生物学实验室中常用。
碱裂解法:此方法适用于小量质粒DNA的提取,提取的质粒DNA可直接用于酶切、PCR扩增、银染序列分析。
方法如下:1、接1%含质粒的大肠杆菌细胞于2ml LB培养基。
2、37℃振荡培养过夜。
3、取1.5ml菌体于Ep管,以4000rpm离心3min,弃上清液。
4、加0.lml溶液I(1%葡萄糖,50mM/L EDTA pH8.0,25mM/L Tris-HCl pH8.0)充分混合。
质粒提取步骤及原理

质粒提取是分子生物学中常用的实验技术,其目的是从细菌中提取出质粒DNA,用于后续的基因操作和分析。
下面是质粒提取的主要步骤和原理的详细解释。
一、质粒提取原理
质粒是细胞内的一种环状的小分子DNA,是进行DNA重组的常用载体。
作为一个具有自身复制起点的复制单位独立于细胞的主染色体之外,质粒DNA上携带了部分的基因信息,经过基因表达后使其宿主细胞表现相应的性状。
在DNA重组中,质粒或经过改造后的质粒载体可通过连接外源基因构成重组体。
从宿主细胞中提取质粒DNA,是DNA重组技术中最基础的实验技能。
二、质粒提取步骤
培养细菌使质粒扩增:将含有目标质粒的细菌接种在适当的培养基上,提供适当的条件(如温度、湿度和营养)使细菌生长和繁殖,从而使质粒得到扩增。
收集和裂解细菌:通过离心等方法收集培养好的细菌,然后使用适当的裂解液裂解细菌,使细菌的细胞壁和细胞膜破裂,释放出内部的质粒DNA。
分离和纯化质粒DNA:通过离心、过滤或层析等方法,将裂解液中的蛋白质、细胞碎片等杂质去除,得到相对纯净的质粒DNA。
这个过程中可能需要使用一些特殊的试剂或柱子来提高分离和纯化的效率。
通过以上步骤,我们可以从细菌中提取出高质量的质粒DNA,用于后续的基因操作和分析。
提取质粒的方法

提取质粒的方法提取质粒是分子生物学实验中的常见步骤之一,其目的是将细菌中的质粒分离出来,以进行后续的实验操作。
提取质粒有多种方法,本文将介绍其中的几种常用方法及其优缺点。
一、CACl2热激转化法CACl2热激转化法是经典的提取质粒方法之一。
其过程如下:1. 将含有目的质粒的细菌培养物进行扩增,使细菌数达到一定程度。
2. 离心将细菌沉淀下来,将培养液中的菌落去除。
3. 用无菌水洗涤细菌沉淀,用CACl2溶液缓慢重悬细菌,使CACl2浓度达到0.1M。
4. 加入pH 6.5的冷缓冲液,浸泡在冰上15分钟。
5. 在热水浴中40-45℃,热激转化。
6. 加入含有抗生素的琼脂糖平板上进行筛选。
该方法的优点是操作简单,不需要特殊设备,且质粒提取量较大。
但其缺点也显而易见,即有毒化学物质CACl2使用,对质粒构建的影响较大,在序列克隆等需要高质量的质粒时不适用。
二、碱裂解法碱裂解法是一种有效的质粒提取方法,是利用质粒DNA与蛋白质的不同耐碱性,将质粒分离出来的方法。
其操作流程如下:1. 将细菌沉淀用含50mM Tris-HCl(pH 8.0)的盐水洗涤。
2. 加入含50mM Tris-HCl(pH 8.0)、25mM EDTA和1%SDS的Lysis Buffer(血浆蛋白)溶液,充分振荡混合,放在65℃水浴中加热,使细胞破裂并释放DNA和蛋白质。
3. 加入冷异丙醇,低温离心,使DNA和蛋白质分开。
注意此步骤中异丙醇的体积比例对DNA的提取量有较大影响,需根据实验需要酌情设置。
4. 倒出上清液,将沉淀用50%异丙醇洗涤。
5. 将洗涤后的沉淀用无菌水重悬,进行后续实验操作。
碱裂解法优点较多,其操作简单、快捷,可以得到较纯的质粒DNA,适用于后续实验需要高质量的DNA。
三、亲水性亲油性法亲水性亲油性法又称酚-氯仿法,其原理是利用亲油性有机溶剂和亲水性酚盐在酚-氯仿-异丙醇三相体系中分离质粒和其它细胞成分。
其操作流程如下:1. 培养含有质粒的细菌,并进行扩增。
抽取质粒的基本原理

抽取质粒的基本原理
抽取质粒的基本原理是利用纯化和分离的方法从细胞中提取质粒DNA。
质粒是细菌或酵母等微生物细胞内自主复制的环状DNA分子。
抽取质粒的基本步骤如下:
1. 培养细胞:首先,需要培养含有目标质粒的细菌或酵母菌株。
这可以通过选择性培养基以及加入适当浓度的抗生素来实现,使只有含有目标质粒的细胞能够生长和存活。
2. 收获细胞:将培养好的细胞离心,以去除培养基和细胞代谢产物。
3. 细胞裂解:将细胞用适当的裂解剂(如SDS、尿素等)处理,以破坏细胞壁和细胞膜,使细胞内容物释放出来。
此时,目标质粒DNA也被释放出来。
4. 质粒分离:通过高速离心,将裂解后的细胞内容物离心分离,将含有目标质粒DNA的上清液分离。
5. DNA纯化:将分离得到的上清液经过一系列的纯化步骤,如酚/氯仿提取、等渗乙醇沉淀等,将目标质粒DNA纯化。
6. 检测和测定:最后,对纯化得到的质粒DNA进行质量和浓度的检测和测定,
以便后续实验的使用。
需要注意的是,抽取质粒的详细步骤可能因实验目的和使用的技术方法而有所不同,但上述基本原理是大致相同的。
6分钟提取质粒

6分钟提取质粒
"6分钟提取质粒" 通常指的是在分子生物学实验中,从细菌中提取质粒的过程,该过程可以在相对较短的时间内完成。
提取质粒是为了获取质粒中的目标基因、DNA片段或其他重要的遗传物质。
以下是一般的质粒提取步骤,这个过程可以在大约6分钟内完成:
1. 培养菌株:
- 开始前,先在培养基中培养含有目标质粒的大肠杆菌(E. coli)菌株。
2. 离心:
- 将培养好的菌液进行离心,将菌体沉淀。
3. 去除培养基:
- 弃去上清液,保留含有大肠杆菌的菌体沉淀。
4. 溶解:
- 使用缓冲液溶解菌体,使DNA释放。
5. 加入溶解剂:
- 加入一些溶解剂,如碱性SDS(十二烷基硫酸钠),破坏膜脂,释放DNA。
6. 快速离心:
- 进行瞬时离心,将膜脂等杂质快速沉淀。
7. 取上清:
- 取上清液中含有的质粒DNA。
8. 沉淀:
- 加入醋酸等溶液,使DNA沉淀。
9. 洗涤:
- 对DNA沉淀进行洗涤,去除残余的盐和其他污染物。
10. 溶解:
- 最后,用适当的缓冲液溶解沉淀的质粒DNA。
这样的质粒提取方法通常使用快速、高效的离心和溶解步骤,使得整个过程可以在相对较短的时间内完成。
实际提取时间可能因具体实验方案和使用的提取试剂盒而有所不同。
质 粒 提 取 原理及步骤

质粒提取原理及步骤一、导论已经提出过许多方法用于从细菌中提纯质粒DNA,这些方法都含有以下3个步骤:1. 细菌培养物的生长。
2. 细菌的收获和裂解3. 质粒DNA的纯化。
(一)细菌培养物的生长从琼脂平板上挑取一个单菌落,接种到培养物中(有含有行当抗生素的液体培养基中生长),然后从中纯化质粒,质粒的提纯几乎总是如此。
现在使用的许多质粒载体(如pUC系列)都能复制到很高的拷贝数,惟致只要将培养物放在标准LB 培养基中生长到对数晚期,就可以大量提纯质粒。
此时,不必造反性地扩增质粒DNA。
然而,较长一代的载体(如pB R322)由于不能如此自由地复制,所以需要在得到部分生长的细菌培养物中加入氯霉素继续培养若干小时,以便对质粒进行性扩增。
氯霉素可抑制宿主的蛋白质合成,结果阻止了细菌染色体的复制,然而,松弛型质粒仍可继续复制,在若干小时内,其拷贝数持续递增。
这样,像pBR322-类的质粒,从经氯霉素处理和未经处理的培养物中提取质粒的产量迥然不同,前者大为增高。
多年来,加入足以完全抑制蛋白质合成的氯霉素μg/ml)已成为标准的操作、用该方法提取的质粒DNA量,对于分子克隆中几乎所有想象到的工作任务。
(二)细菌的收获和裂解细菌的收获可通过离心来进行,而细菌的裂解则可以采用多种方法中的任意一种,这些方法包括用非离子型或离子型去污剂、有机溶剂或碱进行处理及用加热处理等。
选择哪一种方法取决于3个因素:质粒的大小、小肠杆菌菌株及裂解后用于纯化质粒DNA的技术。
尽管针对质粒和宿主的每一种组合分别提出精确的裂解条件不切实际,但仍可据下述一般准则来选择适当方法,以取得满意的结果。
1)大质粒(大于15kb)容易受损,故应采用漫和裂解法从细胞中释放出来。
将细菌悬于蔗糖等渗溶液中,然后用溶菌酶和EDTA进生处理,破坏细胞壁和细胞外膜,再加入SDS一类去污剂溶解球形体。
这种方法最大限度地减小了从具有正压的细菌内部把质粒释放出来所需要的作用力。
质粒提取方法详解

第一节概述把一个有用的目的DNA片段通过重组DNA技术,送进受体细胞中去进行繁殖和表达的工具叫载体(Vector)。
细菌质粒是重组DNA技术中常用的载体。
质粒(Plasmid)是一种染色体外的稳定遗传因子,大小从1-200kb不等,为双链、闭环的DNA分子,并以超螺旋状态存在于宿主细胞中。
质粒主要发现于细菌、放线菌和真菌细胞中,它具有自主复制和转录能力,能在子代细胞中保持恒定的拷贝数,并表达所携带的遗传信息。
质粒的复制和转录要依赖于宿主细胞编码的某些酶和蛋白质,如离开宿主细胞则不能存活,而宿主即使没有它们也可以正常存活。
质粒的存在使宿主具有一些额外的特性,缍钥股氐目剐缘取质粒(又称F因子或性质粒)、R质粒(抗药性因子)和Col质粒(产大肠杆菌素因子)等都是常见的天然质粒。
质粒在细胞内的复制一般有两种类型:紧密控制型(Stringent control)和松驰控制型(Relaxed cont rol)。
前者只在细胞周期的一定阶段进行复制,当染色体不复制时,它也不能复制,通常每个细胞内只含有1个或几个质粒分子,如F因子。
后者的质粒在整个细胞周期中随时可以复制,在每个细胞中有许多拷贝,一般在20个以上,如Col E1质粒。
在使用蛋白质合成抑制剂-氯霉素时,细胞内蛋白质合成、染色体DNA复制和细胞分裂均受到抑制,紧密型质粒复制停止,而松驰型质粒继续复制,质粒拷贝数可由原来20多个扩增至1000-3000个,此时质粒DNA占总DNA的含量可由原来的2%增加至40-50%.第二节利用同一复制系统的不同质粒不能在同一宿主细胞中共同存在,当两种质粒同时导入同一细胞时,它们在复制及随后分配到子细胞的过程中彼此竞争,在一些细胞中,一种质粒占优势,而在另一些细胞中另一种质粒却占上风。
当细胞生长几代后,占少数的质粒将会丢失,因而在细胞后代中只有两种质粒的一种,这种现象称质粒的不相容性(Incompatibility)。
质粒的提取

质粒DNA提取细菌质粒是一类双链、闭环的DNA,大小范围从1kb至200kb以上不等。
各种质粒都是存在于细胞质中、独立于细胞染色体之外的自主复制的遗传成份,通常情况下可持续稳定地处于染色体外的游离状态,但在一定条件下也会可逆地整合到寄主染色体上,随着染色体的复制而复制,并通过细胞分裂传递到后代。
质粒已成为目前最常用的基因克隆的载体分子,重要的条件是可获得大量纯化的质粒DNA分子。
目前已有许多方法可用于质粒DNA的提取,碱裂解法是最为常用的提取方法。
其优点是收获率高,适于多数的菌株,所得产物经纯化后可满足多数的DNA重组操作。
原理:用SDS和NaOH处理细菌后,会导致细菌细胞破裂,释放出质粒DNA 和染色体DNA,两种DNA在强碱环境都会变性。
由于质粒和主染色体的拓扑结构不同,变性时前者虽然两条链分离,却仍然缠绕在一起不分开;但后者完全变性甚至出现断裂,因此,当加入pH4.8的酸性乙酸钾降低溶液pH值,使溶液pH 值恢复较低的近中性水平时,质粒的两条小分子单链可迅速复性恢复双链结构,但是主染色体DNA则难以复性。
十二烷基磺酸钠(SDS)是一种阴离子表面活性剂,它既能使细菌细胞裂解,又能使一些蛋白质变性。
在离心时,大部分主染色体与细胞碎片,杂质等缠绕一起被沉淀,而可溶性的质粒DNA留在上清夜中。
再由苯酚/氯仿 /异戊醇沉淀、乙醇洗涤,可得到纯化的质粒DNA。
碱裂解法提取的质粒DNA可直接用于酶切、PCR扩增、银染序列分析等。
试剂配制及作用机理1. 溶液ⅠpH 8.0: 50mM葡萄糖,25mM Tris-HCl,10mM EDTA。
葡萄糖的作用是使悬浮后的大肠杆菌不会很快沉积到管子的底部,增加溶液的粘度,维持渗透压及防止DNA受机械剪切力作用而降解。
EDTA是Ca2+和Mg2 +等二价金属离子的螯合剂,在溶液I中加入EDTA,是要把大肠杆菌细胞中的二价金属离子都螯合掉。
从而起到抑制DNase对DNA的降解和抑制微生物生长的作用。
质粒抽提的8大窍门

质粒抽提的8大窍门时间:2010-02-04 09:42:01 来源:作者:点击:480次1、摇菌时间过夜培养是一个普遍接受的概念,而且适合大部分情况。
如果出现了问题,调整培养时间会有帮助:Nick 多,则增加培养时间;酶切出现问题,则减少培养时间。
2、起始菌体量大家习惯说“从多少 ml 菌液中抽提质粒”,但一定要养成每次都观察菌体量的习惯,因为质粒毕竟是在菌体中,而且,抽提质粒所用的试剂量,都只与菌体量有关。
3、菌体的彻底悬浮如果没有彻底悬浮菌体,则残留的菌体团块在溶液 II 加入后,变成一个外围几乎彻底裂解,往里不完全裂解,中间没有裂解的团块。
这个团块在溶液 III 加入后,会有一部分蛋白质继续存在于溶液中,成为蛋白质残留的最大根源。
4、使用相对过量的试剂这是适合所有核酸抽提的建议。
试剂相对过量的好处是:稳定性好,纯度高,操作更简单。
如果认为这样不经济,就少用一点菌体。
5、裂解时间加入溶液 II 后,混匀,体系最好能立即变得清澈。
体系如果变得清澈了,马上加入溶液 III 中和。
如果体系不马上变清澈,下次少用一点菌液,或者多用一点溶液。
如今的质粒设计得越来越复杂了,奇怪的现象也越来越多,而所有的奇怪现象,多与裂解时间有关。
6、中和的操作在1.5ml离心管中加入溶液 III 后,先颠倒两次,使管底朝上,用指头弹击管底数次,再颠倒混匀。
效果非常好。
7、中和后的离心去蛋白一定要将蛋白质彻底离心下去。
如果发现离心后仍然有蛋白质漂浮在液面,继续离心的效果并不好;而将上清倒入另外一个离心管中,再离心,效果要好许多。
【降低 RNA 残留的方法】RNA的去除,首先是使用 RNase 消化。
在溶液 I 中加入高浓度的 RNase A (100ug/ml),或者用含 25ug RNase A/ml TE 溶解抽提好的质粒,都可以降低 RNA残留,但都不能彻底去除。
幸运的是,RNA 的残留并不影响酶切等最常用的用途。
质粒大量提取、纯化方法及相关溶剂的详细配方

PEG8000沉淀法大量制备和纯化质粒1质粒提取纯化步骤1.1 质粒提取步骤1) 在超净工作台上,将甘油管保种的质粒菌自然解冻后接种到含200 mL 液体LB(含100 μg/mL Kan)培养基的三角瓶中;2) 置于恒温摇床中,37℃、180 rpm条件下振荡培养16个小时;3) 用50 mL离心管在12,000 rpm、2 min条件下离心菌液,弃上清;4)重复步骤3,将200 mL菌体合并到2个50 mL离心管中;5) 菌泥重悬于3.6 mL 溶液I,加入400 μL新配的溶菌酶(10 mg/mL),涡旋震荡混匀,室温放置15-20 min,中间晃动2-3次;6) 加入8 mL现配的溶液II,盖紧管盖后轻柔颠倒10次混匀至溶液呈透明粘稠状;7) 加入4 mL预冷的溶液III,盖紧管盖后颠倒10次混匀至白色絮状沉淀呈均匀分散状;8) 12,000 rpm离心10 min,用尼龙滤膜过滤将上清液转移至新的50 mL离心管中;9) 加入0.6倍体积的异丙醇(9.6 mL),充分混匀后室温放置30 min;10) 12,000 rpm离心5 min,弃上清,加入5 mL 70%乙醇洗涤沉淀,12,000 rpm 离心2 min;11) 弃乙醇,晾干后加400 μL TE(pH 8.0)溶解核酸,转入10 mL离心管中,再加200 μL TE洗管,合并后共600 μL于4℃保存。
(如果提取量较多,合并后TE应少于2.5 mL)1.2 大提质粒的纯化1) 在上述保存的每管中加等体积(600 μL)预冷的5 M LiCl,充分混匀后冰浴10 min,12,000 rpm离心10 min;2) 取上清加等体积(1.2 mL)异丙醇,充分混匀后放置20 min,12,000 rpm 离心10 min,弃上清;3) 70%乙醇洗涤,12,000 rpm离心2 min弃上清,晾干后加700 μL TE 溶解于1.5 mL离心管中,加10 μL RNaseA(10 mg/mL),37 ℃消化30 min;4) 加入0.5体积(350 μL)的含30 mM MgCl2的40% PEG8000,倒置混匀数次可观察到蛋清色絮状沉淀,静置20 min,12,000 rpm离心20 min,弃上清;5) 70%乙醇洗涤,12000 rpm离心2 min弃上清,晾干后加700 μL TE 溶解于1.5 mL离心管中;6) 加等体积(酚350 μL,氯仿/异戊醇350 μL)的酚/氯仿/异戊醇(25:24:1)混匀5 min,12,000 rpm离心10 min,取上清再次用酚/氯仿/异戊醇抽提一次;7) 取上清,加入等体积(650 μL)氯仿/异戊醇(24:1)混匀5 min,12,000rpm离心10 min;8) 取上清600 μL于2 mL离心管中,加约1/10体积(60 μL)NaAc(3 M,pH 5.2),加2倍体积(1.2 mL)无水乙醇混匀,室温放置20 min。
动物分子生物学实验6重组质粒DNA的提取及插入DNA的酶切鉴定

125
四、实验步骤
接含质粒的单菌落于3ml LB Amp+液体培养基中 370C,190rpm振荡培养过夜
取1.5ml菌液入1.5ml的dorf管中 6000rpm、离心2min,弃上清,收集菌体 100uL溶液I悬浮菌体(充分振荡),室温(或冰浴)
10min 加入200uL溶液II(轻轻混匀),冰上静置5min裂解菌体
3 将细菌沉淀悬浮于100μL溶液Ⅰ中,充分混匀,室 温放置10 min。
4 加200μL溶液Ⅱ(新鲜配制),盖紧管盖,混匀内 容物,将离心管放冰上5 min。
5 加入150μL溶液Ⅲ(冰上预冷),盖紧管口,颠倒数 次使混匀。冰上放置15min。
6 12 000r/min,离心10 min,将上清转至另一离心管中。 向上清中加入等体积酚:氯仿 (1:1)(去蛋白),反复 混匀,12 000r/min,离心5 min,将上清转至另一离心 管中。转移时小心!(total volume: 400 μL)
- 原核细胞 - 繁殖力强, 2-30 分细胞分裂、加倍
DNA
基因组107bp, 编码约2000种蛋白质
质粒(plasmid)
- 染色体外的稳定遗传因子
- 双链、闭环的DNA分子,大小1-200 kb 不等 - 存在于细菌、放线菌和真菌细胞中
- 具有自主复制和转录能力,并表达所携带的遗传信息
DNA
*溶液II 0.2mol/L溶液(3M, pH=4.8):
60mL的5mol/L KAc, 11.5ml冰醋酸, 28.5mL H2O
*饱和酚(pH8.0 Tris-HCl饱和) *氯仿 *3M乙酸钠溶液(pH5.2) * TE缓冲液:
10mmol/L,Tris-HCl, 1mmol/L,EDTA , pH8.0, * 100%乙醇与70%乙醇
质粒的快速抽提
每管加入1.5ul试剂3(4M KCL)和0.5ul试剂4(0.4%溴酚 蓝溶液),震荡30秒,冰浴5分钟.4度12000g离心3分钟.
6 制备0.7%琼脂糖凝胶(含0.5ug/ml EB)
7 电泳
取上清50ul上样于样品槽,电泳(电压5-10V/cm胶),待染 料迁移至全胶长度2/3-3/4时,停止电泳,紫外检测电泳 结果.
2 收集细菌 每个Eppendorf管收集1ml菌液,12000g离心后去 除上清.
以上步骤由教师完成,学生从第三步开始做.
3 重悬
每一Eppendorf管中加入50ul试剂1 (10 mM EDTA pH 8.0),在涡流震荡器上震荡30秒重悬细菌.
4 裂解细菌
每一Eppendorf管加入50ul新鲜配制的试剂2(0.2M NaOH,0.5% SDS,20% 蔗糖),震荡30秒.70度水浴5分钟.
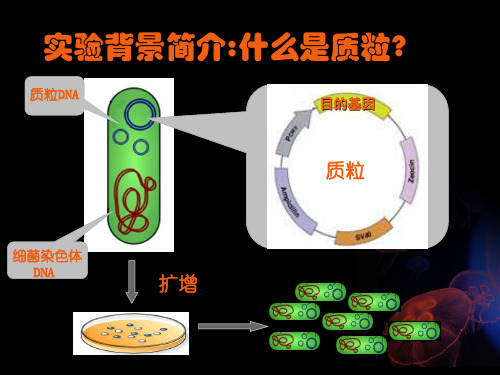
实验背景简介:什么是质粒?
质粒DNA
目的基因
质粒
细菌染色体 DNA
扩增
实验原理
1 碱裂解细菌 NaOH 染色体DNA变性 SDS 蛋白质变性
2 低温下用KCL沉淀变性的蛋白质和 染色体DNA
3 离心后从上清中分离出质粒DNA
实验原理
裂解
沉淀 离心
实验步骤
1 细菌扩增 在原始平板上挑取待筛选菌落,接种到含AMP的LB 液体培养基中,置于37度恒温摇床以200bpm的速 度振荡培养过夜.
1 双链DNA分子在凝胶迁移的 速率与其碱基对数的常用 对数成反比:分子越大,迁 移越慢
2 超螺旋环状(SC)、切口 环状(OC)和线状(L) DNA在琼脂糖凝胶中以不 同速率迁移。
配制琼脂糖凝胶的注意事项
提取质粒的步骤

提取质粒的步骤
嘿,朋友们!今天咱来聊聊提取质粒这档子事儿。
这可真是个精细活儿,就好像是在一堆宝藏里准确地找出那颗最闪亮的宝石一样。
先说说准备工作吧,那可得像准备一场盛宴一样精心。
各种试剂、仪器都得妥妥当当的,这就好比战士上战场,武器可不能少。
然后就开始行动啦!第一步,得把含有质粒的细胞培养得好好的,就像照顾小宝贝一样,给它合适的环境,让它茁壮成长。
这细胞啊,就是我们要挖掘宝藏的宝库呢!
接下来,把细胞收集起来,这感觉就像是把一群小伙伴聚集起来准备玩游戏。
然后,用一些特殊的方法把细胞打破,让里面的质粒释放出来,这就好像是打开了宝库的大门。
再之后呢,就是要把其他杂质啥的都去除掉,只留下我们心心念念的质粒。
这可不容易啊,就像在沙滩上捡贝壳,得仔细挑拣,把那些不好的、不是我们想要的都扔掉。
这过程中,每一步都得小心翼翼,不能有丝毫马虎。
稍有不慎,可能就前功尽弃啦!就像走钢丝一样,得稳稳当当的。
你说提取质粒难不难?当然难啦!但咱可不能被这点困难吓倒。
就好比爬山,虽然过程辛苦,但当你爬到山顶,看到那美丽的风景时,一切都值了呀!
提取质粒也是这样,当你最终成功拿到那纯净的质粒时,那种成就感,真的是无法用言语来形容。
这就是科学的魅力呀,让人欲罢不能。
在这个过程中,我们需要耐心,需要细心,还需要那一点点的运气。
但只要我们认真去做,就一定能成功。
所以啊,朋友们,别害怕挑战,别害怕困难。
提取质粒虽然不容易,但只要我们有决心,有毅力,就一定能做到!让我们一起加油,去探
索这个神奇的科学世界吧!。
质粒抽提详细步骤

质粒提取实验步骤摇菌:(先倒入锥形瓶再消毒)1 将配好的LB培养液高温消毒后,放入40C冰箱,冷却;2 在酒精灯旁操作,向锥形瓶中加入100mlLB,加入150ul氨苄(看抗性);3 再向锥形瓶中挑入少量菌(液体:60~80ul;固体:绿豆大小);4 放入摇床,摇一夜。
LB培养液的配方1)胰化蛋白胨()10g/L(tryptone)2)酵母提取物5g/L(yeast extract)3)Nacl 10g/L4)去离子水(双蒸水)950ml 终体积为1000ml5)配好后,需高温消毒(纱布或报纸包)质粒提取:QIAGEN plasmid Midi kit(25)试剂盒准备2个50mlEP管,提2个质粒一共要6个50mlEP管。
使用前注意事项:1)P1在使用前要加入RNAase,终浓度为100ug/ml,P1一直放40C。
2)事先溶解P2(天冷时P2会出现沉淀,应放37 0C水浴溶解)。
3)预冷至P1、P3(P2作用为裂解细胞)至4 0C。
4)提质粒前一天消毒50ml,20ml管子及2mlEP管及LB,干燥待用。
5)摇菌和保菌都要开酒精灯,尽量保持无菌,用酒精灯擦桌子和瓶口,不能讲话或者戴口罩。
步骤:1 摇菌100ml过夜(100ml菌分两次离心,锥形瓶中剩余的菌留作保菌用);2 酒精灯旁操作,倒入50ml管子,6000g、15min(离心力/RCF)、40C(配平及记得更换转子/Rootor),离心完后弃去上清收集细菌;3 用3ml P1重悬细菌沉淀物(充分溶解,沉淀可通过枪反复上下吸打混匀)分两管离心,各加3ml P1,后再混合为一管,保证100ml菌液用了3ml P1重悬。
4 加3ml P2(P2比较粘稠,用之前要晃匀),充分混匀到整个液体都变蓝(上下轻柔颠倒4~6次),室温放置5min(混匀时不可过猛,以免弄断genemic DNA;裂解物是粘性的,溶解时间切勿超过5min,一旦加入P2就应立即将管子盖上,以防酸化);5 加入预冷的P3 3ml,立即温和的混匀至蓝色消失(上下轻柔颠倒4~6次),放置冰上避光孵育15~20分钟P3后,产生蓬松白色物质,沉淀物变得不粘(沉淀物包括genemic DNA、蛋白质、细胞碎片、SDS);6 4 0C、≥20000g、30min离心,将上清液放入另一10ml的EP管(注意移动时不能晃,以免将沉淀转入),直接在离心室加,加完一个扔一个,注意一点沉淀都不能吸进去,吸时用双枪头,黄枪头套在蓝枪头外,减少冲击;7 离心同时,用4mlQBT润洗QIAGEN-tip100(平衡膜),弃去脱下上液;8 用2×10mlQC洗QIAGEN-tip100两次,弃去滴下的液体(注意滤膜不要干燥,管中液体满了就弃去,液面不要触及TIP下部,如果触及则用双蒸水冲洗),加入离心后并经过萃取的上清液,萃取步骤如下图;20000g、15min、4 0C离心把离心后的上清液直接加到TIP中过滤(TIP标记);9 待液体差不多滤过时,用5ml的QF洗脱膜上的DNA,用10mlEP管收集洗脱物(最先流出来的3~4滴弃去),收集后混匀,可用摇床10min;10 每管用3.5ml的室温异丙醇沉淀DNA,混匀10min,然后4 0C、≥15000g、离心30min,沉淀在管底的异丙醇沉淀物有玻璃样外观,非常松软,弃去上清时小心;11 先加1ml的70%乙醇洗DNA沉淀,移入1.5ml的EP管(把沉淀打散后再移入,能不用2mlEP尽量不用,TIP的架子要回收),15000g离心10分钟,倒去上液,不要触及沉淀,重复洗一次(把沉淀吹打到液体中,轻柔);12 空气中干燥沉淀5~10分钟,待干燥后(无色透明)用合适体积(50ul)的AE溶解沉淀(560C水浴10min,加快溶解),放入4 0C冰箱过夜;13 第二天测浓度(DNA),稀释到1ug/ul,待转染用。
质粒抽提原理及详细操作步骤

质粒抽提,实验室必备技能之一质粒质粒存在于许多细菌以及酵母菌等生物中,是细胞染色体外能够自主复制的很小的环状DNA分子。
质粒抽提从细菌中分离质粒DNA的方法包括3个基本步骤:培养细菌使质粒扩增;收集和裂解细菌;分离和纯化质粒DNA。
采用强碱液、加热或溶菌酶(主要针对革兰氏阳性细菌)可以破坏菌体细胞壁,十二烷基磺酸钠(SDS)和TritonX-100(一般很少使用)可使细胞膜裂解。
经溶菌酶和SDS或Triton X-100处理后,细菌染色体DNA会缠绕附着在细胞碎片上,同时由于细菌染色体DNA比质粒大得多,易受机械力和核酸酶等的作用而被切断成不同大小的线性片段。
当用强热或酸、碱处理时,细菌的线性染色体DNA变性,而共价闭合环状DNA(Covalently closed circular DNA,简称cccDNA)的两条链不会相互分开。
当外界条件恢复正常时,线状染色体DNA片段难以复性,而是与变性的蛋白质和细胞碎片缠绕在一起,而质粒DNA双链又恢复原状,重新形成天然的超螺旋分子,并以溶解状态存在于液相中。
质粒抽提最常用的方法是碱裂解法,它具有得率高、适用面广、快速和纯度高等特点。
当然,碱裂解法也有缺陷:容易导致不可逆的变性。
要降低不可逆的变性,就要控制好碱裂解的时间。
碱裂解法抽提质粒需要用到以下三种溶液溶液Ⅰ50 mmol/L 葡萄糖,25 mmol/L Tris-Cl(pH 8.0),10 mmol/L EDTA(pH 8.0),在15 psi 压力下蒸汽灭菌15 min,4℃保存。
溶液Ⅱ0.2 mmol/L NaOH(从10 mmol/L 贮存液中现用现稀释),10 g/L SDS(室温保存)。
溶液Ⅲ5 mol/L乙酸钾60.0 mL,冰乙酸11.5 mL,无菌水28.5 mL, 4℃保存,使用时置于冰浴中。
下面介绍一下碱裂解法小提质粒的具体操作:01柱平衡:向吸附柱中加入500 μl平衡Buffer,12000 rpm离心30-60 s,倒掉收集管中的废液;注意:吸附柱平衡后可最大限度激活硅基质膜,提高质粒的得率;吸附柱平衡后应立即使用,长时间放置会影响其吸附效果。
质粒提取原理和方法

质粒DNA提取的原理及方法碱裂解法质粒DNA提取原理质粒DNA提取主要包括以下几个方面:如何将细胞裂解释放质粒DNA,如何将质粒DNA和基因组DNA分离开来,如何去除RNA污染,如何去除蛋白质和其它杂质。
质粒提取方法中,最常用的方法是碱裂解法,它具有得率高,适用面广,快速,纯度高等特点.其原理是:强碱性条件下,质粒DNA和基因组DNA同时从细胞中释放出来,并发生变性.在pH中性,并有高盐浓度存在的条件下,质粒DNA会迅速发生复性,仍为可溶性状态,染色体DNA之间交联形成不溶性网状结构,在去垢剂SDS作用下,染色体DNA与变性蛋白质和细胞碎片结合形成沉淀,通过离心去除沉淀后,再用酚氯仿抽提进一步纯化质粒DNA,用异丙醇或乙醇沉淀可将之纯化出来。
BIOMIGA公司质粒DNA纯化系列试剂盒,采用碱裂解法质粒提取原理,在高盐环境下,采用硅胶膜特异性的吸附质粒DNA,而蛋白质不被吸附,最后用低盐洗脱液将DNA从膜上洗脱下来,方法简单,快速,质量好,收获量高。
影响质粒提取的因素影响质粒提取的因素有很多种,如质粒拷贝数,宿主菌株的种类,细菌的培养时间、培养基种类、培养条件等等。
质粒拷贝数质粒DNA最终收获量取决于质粒的拷贝数和质粒的大小。
BIOMIGA 公司质粒DNA提取系列试剂盒,操作步骤适用于高拷贝数质粒的纯化,对于低拷贝质粒纯化提取,应加大起始菌液量的体积,并且相应地增加各种缓冲液的用量。
下表给出一些常用质粒载体的拷贝数:质粒种类复制起点拷贝数1 mL菌液质粒DNA收获量(µg)pSC101pSC10150.1—0.2pACYCP15A10—120。
4-0。
6pSuperCospMB110—200.4—1pBR322pMB115—200.6-1pGEMRMuted pMB1300—4006-7pBluescriptRColE1300-5006-8pUCMuted pMB1500—7008-12宿主菌株宿主菌株的种类将会影响质粒的收获量。
重组质粒快检的具体方法

重组质粒快检的具体方法方法一:快检就是直接用摇起的菌液取100uL,加50uL的苯酚和50uL的氯仿涡旋离心,取上清跑胶,对照上个空载体,就是没有连片段前的质粒(环合的哈),或者和你载体差不多大小的质粒也可,一般连进去的重组质粒会跑得慢点,凭这个就能鉴定哪些连进去了,然后再提质粒酶切就好了;快检就是直接比较质粒大小用酚氯仿破菌后,离心后DNA和RNA都在上层水相里,跑胶一般情况下能看见五条带,最上面是大肠杆菌的总DNA,第二条就是你的超螺旋的质粒,下面三条小的就是RNA,连进去的重组质粒和你的空载体大小有差别,大的跑胶跑得慢,空载体跑得快,电泳一看就一目了然了。
方法二:实验室一个师兄按照分子生物学手册上的配方配了一个快速裂解液,好像有甘油,溴酚蓝,SDS之类的。
转化子长好后,取1ml菌液,离心弃上清,加入50μl上述裂解液,重悬后37℃保温半小时,之后离心,上清直接上样就可以了,一定记得加marker和空载体。
在电泳图上你可以同时看到RNA(如果没加RNAase的话),质粒,基因组。
这个方法快速,简单,便宜,大家可以尝试一下。
节决定实验的成败,有些往往是我们一些小的疏忽导致实验的失败。
追其原因我总结了以下几点经验,与大家分享:1跑page胶的时候,小电压跑会避免高电压产生的热量尔导致的胶层变形。
低电压泳道会比大电压泳道跑的直一些,且分离效果更高,有利于分子量相差不大的蛋白分离。
2. 提取质粒的时候,最后一步的酒精挥发很关键,基本上是其后续的酶切反应的决定性因素。
所以这一步尽量挥发长一点时间,最好是空调吹热风,或是37度温箱放长一点的时间,我试过室温过夜,酶切很好。
3. 做WESTERN BLOT 的时候,大家往往会摸索一抗、二抗的浓度,封闭时间,曝光时间等等,而每次变换其中的一个条件就需要从新跑胶、转膜,甚至重新提蛋白,这样会浪费大量的时间。
其实完全没有必要这样。
一次转膜后,将PVDF膜晾干,裁减成小块,保存起来,用的时候取出一块,没有任何影响。
(完整)质粒提取方法及步骤(精)

(完整)质粒提取方法及步骤(精)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((完整)质粒提取方法及步骤(精))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(完整)质粒提取方法及步骤(精)的全部内容。
质粒提取方法及步骤碱裂解法从大肠杆菌制备质粒,是从事分子生物学研究的实验室每天都要用的常规技术可是我收研究生十几年了,几乎毫无例外的是我那些给人感觉什么都知道的优秀学生却对碱法质粒抽提的原理知之甚少追其原因,我想大概是因为分子克隆里面只讲实验操作步骤,而没有对原理进行详细的论述这是导致我的学生误入歧途的主要原因后来我发现其实是整个中国的相关领域的研究生水平都差不多,甚至有很多老师也是这个状态这就不得不让人感到悲哀了我想这恐怕和我们的文化有点关系中国人崇尚读书,学而优则仕的观念深入人心经常听到的是父母对他们的独苗说,你只要专心读好书就可以了所以这读书的定义就是将教课书上的东西记住,考试的时候能拿高分这就是现代科学没有在中国萌发的根本原因如果中国文化在这一点上不发生变化,那么科学是不能在中国真正扎根的,它只能蜕化成新的八股学生命科学是实验科学,它讲究动手如果实验科学只要看看书就可以了,那我想问有那位神仙看看书就会骑自行车了?或者听听体育老师的讲解就会滑冰了?可是光动手不思考,不就成了一个工匠?一个合格的生命科学研究者,需要在这两方面完善自己一个杰出的科学工作者,是一个熟知科学原理并善于应用的艺术家每个曾经用碱法抽提过质粒的同学,希望你看本文后能有所思考,让中国的未来有希望为了方便理解,这里罗列一下碱法质粒抽提用到三种溶液:溶液I ,50 mM葡萄糖 / 25 mM Tris-Cl / 10 mM EDTA,pH 8.0;溶液II ,0。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
重组质粒DNA的小量快速制备方法
(一) Lysis Trition 发抽提方法
1.在LB肉汤中(含适量抗生素)接种适量的菌种,37℃振荡培养过夜。
2.将培养物倒入离心管,2000~2500rpm离心10分钟,尽弃上清夜,收集沉淀。
3.加入Lysis Sucrose 液250ul,旋涡器上振荡使沉淀分散均匀,冰浴10分钟。
4.加入Lysozyme液(10mg/ml)25ul,旋涡器上振荡混匀,冰浴5分钟。
5.加入0.25M EDTA液25ul,旋涡器上振荡振荡混匀,冰浴5分钟。
6.加入Lysis Trition液125ul,轻摇混匀,室温下作用2~15分钟,待裂解后,13,000rpm, 4℃离心15分钟,取上清。
7.在上清液中加入饱和酚150ul,来回颠倒数分钟,12,000rpm,4℃离心5分钟,取上清
液。
8.在上清液中加入饱和酚、氯仿各150ul,来回颠倒数分钟,12,000rpm,4℃离心5分钟,
取上清液。
9.在上清液中加入氯仿150ul,来回颠倒数分钟,12,000rpm,4℃离心5分钟,取上清液。
10.在上清液中加入2倍量的异丙醇或95%的乙醇(-20℃预冷),作用一定时间后,
12,000rpm, 4℃离心20~25分钟,弃上清液。
11.干燥沉淀。
12.加入1ml70%乙醇,来回颠倒数次,12,000rpm,4℃离心5分钟,弃上清液
13.真空干燥沉淀。
加入TE(ph8.0)20~50ul溶解沉淀,4℃或-20℃保存。
附:小量快速抽提中的注意事项:
1.TritonX-100 溶解细菌的脂质层,在细菌脂质上打孔呈蜂窝状。
EDTA 络合DNA酶的络合剂。
蔗糖提供了酶作用的环境。
溶菌酶用以溶解细菌的膜。
2.溶解时,若溶解过头用酚/氯仿进行纯化DNA时不易抽出蛋白质。
大量制备时常用碱裂解法。
3.酚使蛋白质变性,用氯仿萃取蛋白质,每次吸取上清时要注意不要吸入蛋白质、酚、
氯仿,否则会影酶切效果。
4.本实验中用的氯仿系氯仿与异戊醇的混合物(24:1)。
5.最后进行干燥,可以用自然干燥,也可抽滤干燥(约30分钟)但必须充分干燥,否则不易于被TE所溶解和酶切。
6.实验前准备中将转染了质粒的大肠杆菌接种于LB肉汤时,铂耳不宜太烫,每次最后接种环在试管壁轻轻敲打数次,以保证有效接种,摇振培养时试管的倾斜率、水位、温度都要作适当的选择,否则不宜培养。
(二)碱裂解法
1.将2ml含相应抗生素的LB加入到容量为1.5ml并且通风良好(不盖紧)的试管中,然后接种入一单个菌落,于37℃振荡培养过夜。
2.将1.5ml培养物倒入微量离心管中,用微量离心机于4℃以12,000rmp 离心30秒,将剩余的培养物贮存于4℃。
3.吸去培养液,使细菌沉淀尽可能干燥。
备注:除去上清的简便方法是用一次性使用的吸头与真空管道相连,轻缓抽吸,并用吸头接触液面,当液体从管中吸出时,尽可能使吸头远离细菌沉淀,然后继续用吸头通过抽真空去附于管壁上的液滴。
4.将细菌沉淀重悬于100ul用冰预冷的溶液1中,剧烈振荡。
溶液1:50mMol/L葡萄糖,25mM Tris.HCl(pH8.0),10mM EDTA(pH8.0)。
可以成批地配制,每瓶约100ml,在10磅高压灭菌15分钟,贮存于4℃。
须使细菌沉淀在溶液1中完全分散,将两个微量离心管的底部互相接触同时进行振荡,可使沉淀迅速分散。
5.加入200ul新配制的溶液2,盖紧管口,快速颠倒离心管5次,以混合内容物,应确保离心管的整个内表面与溶液2接触,不要振荡,将其置于冰上。
溶液2:0.2Mol/L NaOH(临用时用10Mol/L的贮存液现配)1%SDS。
6.加150ul用冰预冷的溶液3,(溶液3:5Mol/L 乙酸钾 60ml,冰醋酸11.5ml,水28.5ml
配成溶液对K+ 3M,对乙酸根是5Mol)盖紧管口,将管倒置后温和地振荡10秒钟使溶液3在粘
稠的细菌裂解物中分散均匀之后将管倒置于冰上3~5分钟。
7.用微型离心机4℃12,000rmp,离心5分钟,将上清转移到另一离心管中。
8.可做可不做,加等量酚:氯仿,振荡混匀,用微量离心机于4℃12,000rmp,离心2分钟,将上清转移到另一离心管中。
9.用2倍体积的乙醇于室温沉淀DNA,振荡混合,于室温放置2分钟。
10.用微量离心机4℃,12,000rmp,离心5分钟。
11.小心吸去上清,ᰆ㦻ῃ㮡ᰆ置于纸巾上,以使所有液体流出,再将吸附于管壁的液滴除尽。
12.用1ml70% 乙醇于4℃洗涤双链DNA沉淀,按步骤8所示方法去掉上清,在空气中使核酸沉淀干燥10分钟。
13.用50ul含无DNA酶的胰RNA酶(20ug/ml)的TE重新溶解核酸,振荡,贮存于-20℃。
(三)煮沸法制备质粒DNA
试剂:TETS溶液:Tris-Hcl 10mM, TritonX-100 0.5%,EDTA 50mM,蔗糖8%。
溶菌酶溶液:Tris-Hcl 10Mm(Ph8.0),溶菌酶10mg/ml。
Rnase-A溶液:用前80℃处理10分钟,Tris-Hcl 10mM,EDTA 1mM(Ph8.0),Rnase-A 50ug/ml。
方法:1.将没一个菌种接种于5mlLB肉汤中,并加入合适的抗生素(根据重组质粒的抗性)于37℃振荡培养过夜。
2.取1.5ml上述液至Eppendorf管中(剩余4℃保存),8000rpm离心5分钟,弃上清。
3.沉淀重悬于0.35mlTETS溶液中,加入25ul新配制的溶菌,混匀3秒钟以后将Eppendorf管放入沸水40秒。
4.1800rmp离心10分钟,取上清至Eppendorf管中,加420ul异丙醇和40ul的醋酸钠溶液,混匀并于乙醇干冰浴中15分钟,4℃,18000rmp离心15分钟。
5.弃上清,加入50ul Rnase-A溶液,37℃作用10分钟。
6.取10ul制品加入干净的Eppendorf管中,在加1.2ul合适的10×酶缓冲溶液,再加入1~2单位的限制性内切酶,电泳,观察。
7.剩余样品-20℃保存。
