2004 化院本科生B卷
西安理工大学物化试卷答案(2004春B)

2004年春季学期《物理化学》试卷(B)命题教师余中系主任审核考试形式闭卷考试类型学位课√非学位课(请打√选择)考试班级材料学院02级考试日期2004 年7月 5 日考试时间2小时班级姓名学号成绩注意:1.命题时请适当留答题位置。
请用深蓝色墨水书写,字、图清晰,书写不出边框。
2.答题演草时不许使用附加纸,试卷背面可用于演草。
试卷不得拆开。
一、判断题:(请将答案填入下表,否则无效。
每小题1分,共20分.正确填√, 错误填 X )1 2 3 4 5 6 7 8 9 10⨯√⨯√√⨯⨯⨯⨯⨯11 12 13 14 15 16 17 18 19 20√√√⨯√√√⨯√⨯(1).反应级数不可能为负值(2).隔离系统的内能是守恒的(3).理想气体反应的平衡常数K P不只是温度的函数(4).理想气体反应,等温等容下添加惰性组分时平衡不移动(5).热平衡时系统的各个部分和环境的温度均相等(6).对二级反应来说,反应物转化同—百分数时,若开始浓度愈低,则所需时间愈短(7).对于基元反应,反应级数和反应分子数不一定是一致的(8). 液体表面张力的方向总是与液面垂直(9).化学吸附是放热的,所以低温能加快其吸附速率和吸附量教务处印制共 4 页(第 1 页)(C) K +和Cl -离子运动速度相近 (D) K +和Cl - 原子核半径小 (4). 在等温条件下,气体被固体吸附,气体在该过程的熵变化是(A) 减小 (B) 增大 (c) 不变 (D )无法确定(5).糖可以顺利溶解在水中,这说明固体糖的化学势比糖水中糖的化学势(A) 高 (B) 低 (c) 相等 (D )不可比较(6). 毛细管里装入润湿性液体,当毛细管右端加热时,管内液体将(A) 向右移动 (B) 向左移动 (C) 不移动 (D) 因失去平衡而左右来回移动 (7). 某反应的反应物消耗掉3/4的时间是其半衰期的2倍,则该反应的级数为 (A) 零 级 (B) 一 级 (C) 二 级 (D) 三 级 (8). 盐碱地的农作物长势不良,甚至枯萎,其主要原因是什么 (A) 天气太热 (B).很少下雨 (C) 肥料不足 (D) 水分倒流 (9). 憎液固体,其表面不能为液体所润湿,其相应的接触角θ是(A ) θ = 0˚ (B) θ < 90˚ (C) θ > 90˚ (D) θ可为任意角 (10). 下列几种水,哪种表面张力最大(A )雨 水 (B) 长江水 (C) 普通井水 (D) 海 水 (11). 基元反应:Cl HCl Cl H 2+→+ 的反应分子数是(A) 单分子反应 (B) 双分子反应 (C) 三分子反应 (D )四分子反应(12) 100˚C ,101325 Pa 时H 2O ( l )变为同温同压下的H 2O ( g ),该过程的ΔG 为(A) ΔG > 0 (B) ΔG < 0 (C) ΔG = 0 (D) 无法判断(13). 反应: )g (CO 2)g (O )g (CO 222=+,符合 )CO (C k ⋅=ν,则该反应级数是 (A) 四级 (B) 三 级 (C) 二级 (D) 一级(14).某反应在一定条件下的平衡转化率为30.6%,当有催化剂存在时,其转化率应当是教务处印制共 4 页(第 2 页)教务处印制共 4 页(第 3 页)。
2004全国统一考试英语B卷解析[原创]
![2004全国统一考试英语B卷解析[原创]](https://img.taocdn.com/s3/m/83d3debf51e79b89680226ce.png)
2004年普通高等学校招生全国统一考试英语B卷试题答案与解析第一部分:听力部分1--5 ABCBA 6--10 CBCAC 11--15 ACABB 16--20 CBAAB解析(略)第二部分第一节:单项填空答案21-25 DBADC 26-30 BDACA 31-35 CDBAC解析21.本题考查交际英语的有关知识。
D选项Take your time译为“不急”“慢慢来”符合上文语境。
22.本题考查非谓语动词的用法。
题干中的语意是: 产品首次投放市场时,即获得成功。
产品是被引进市场的,强调的是被动语意,选项A introducing和选项C introduce 不表示被动,可排除;选项D being introduced表示“正在被引进”和题干语意不符;选项B introduced 表示“被引进”符合题意。
补充:连词+分词(短语)有时为使分词短语与主句关系更清楚,可在分词前加连词。
连词有:when,while,if though,after, before, as.但分词的主语和主句的主语必须为同一个。
例如:While waiting there, he saw two pretty girls come out of thebuilding.等在那儿时,他看见两个靓妹走出大楼。
(waiting 和saw 的主语相同)23.本题考查定语从句的用法。
题干中定语从句缺少表示地点的关系副词,A选项中where作为关系副词引导定语从句,指代“在裤子上”.符合题意要求。
补充:判断关系代词与关系副词方法一:用关系代词,还是关系副词完全取决于从句中的谓语动及物动词后面无宾语,就必须要求用关系代词;而不及物动词则要用关系副词。
例如:This is the mountain village where I stayed last year. 这是我去年呆过的山村。
I'll never forget the days when I worked together with you.我永远不会忘记与你共事的日子。
2004级试题-期末考试标准答案及评分标准B

四川大学期末考试试题(B)标准答案及评分标准(2005 ——2006 学年第下学期)课程号:30014530 课序号:0-3 课程名称:材料科学与工程基础适用专业年级:高分子材料与工程2004级学生人数:326 印题份数:340一、判断下列说法是否正确,如果你认为是正确的,请在括号内填(T),反之,则填(F)。
(15分)计分方法每题1分1. 电介质材料在低频下的介电常数低于在高频下的介电常数。
(F)2. 碳钢中含碳量越大,则其屈服强度越高。
( F )3. 材料的刚性越大,材料就越脆。
( F )4. 疲劳破坏是由于裂纹扩展引起的。
( T )5. 在同样的加热条件下,材料的热容量越大,材料的温度上升得越慢。
( T )6. PTFE的摩擦系数很小,所以磨耗也小。
( F )7. 聚氯乙烯可以用作高频绝缘材料。
(F )8. 玻璃化转变温度是橡胶使用的上限温度(F)9. 一般情况下,非晶态材料比晶态材料的强度低、硬度小、导电性差。
(T)10. 键能越高硬度越大,高分子是由共价键连接的,所以高分子材料硬度大。
(F)11. 金属的导电性随着金属中的杂质的增加而下降。
(T)12. 随着离子电荷量增加离子性固体的电导率增加。
(F)13. 软磁材料被外磁场磁化后,去掉外磁场仍然保持较强剩磁。
(F)14. For pure metals, heat is only transported by free electrons. (F)15.n型半导体指在Si、Ge等四价元素中掺入少量五价元素P、Sb、Bi、As (T)二、多选题(15分)计分方法每题1分1.金属材料的弹性模量随温度的升高而(B)。
A. 上升;B. 降低;C. 不变。
2、在面心立方晶体中,塑性形变的滑移面为(B)A、(110)晶面B、(111)晶面C、(010)晶面3、格列菲斯公式a c =2Eγ s / (π.σc 2 ) 中,a c 是( B )A 裂纹失稳状态的临界应力;B 临界半裂纹长度;C 裂纹失稳状态的临界半应力4、决定材料硬度的三个主要影响因素是(B)A、键能、温度、测试方法、B、键能、密度、温度、C、电子结构、密度、温度、5、以下关于腐蚀的哪种说法是错误的。
2004高考有机试题及答案汇编

2004年高考有机化学部分2004年理综(北京卷)化学部分6. 糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质。
以下叙述正确的是 A. 植物油不能使溴的四氯化碳溶液褪色 B. 淀粉水解的最终产物是葡萄糖 C. 葡萄糖能发生氧化反应和水解反应D. 蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水 26. (16分)(1)化合物A (O H C 104)是一种有机溶剂。
A 可以发生以下变化:Na Cl 2 光浓H 2SO 4Br 2 CCl 4△BA DEC<1>A 分子中的官能团名称是___________;<2>A 只有一种一氯取代物B 。
写出由A 转化为B 的化学方程式___________________________________________________________;<3>A 的同分异构体F 也可以有框图内A 的各种变化,且F 的一氯取代物有三种。
F 的结构简式是_____________________________________________。
(2)化合物“HQ ”(266O H C )可用作显影剂,“HQ ”可以与三氯化铁溶液发生显色反应。
“HQ ”还能发生的反应是(选填序号)_______________。
<1>加成反应 <2>氧化反应 <3>加聚反应 <4>水解反应“HQ ”的一硝基取代物只有一种。
“HQ ”的结构简式是__________。
(3)A 与“HQ ”在一定条件下相互作用形成水与一种食品抗氧化剂“TBHQ ”。
“TBHQ ”与氢氧化钠溶液作用得到化学式为221210Na O H C 的化合物。
“TBHQ ”的结构简式是_____________________________。
【参考答案】 6. B26. (16分) (1)①羟基②HCl OH CH CH C ClCH Cl OH C CH +--−→−+-332233||)(光③OH CH H CH C CH 233|--(2)①②HO - OH(3)OHOH C(CH 3)32004年(福建·浙江)理综化学部分26、(15分)某有机化合物A 的结构简式如下:(1)A 分子式是 ;(2)A 在NaOH 水溶液中加热反应得到B 和C ,C 是芳香化合物。
2004级期末考试试卷答案[1]
![2004级期末考试试卷答案[1]](https://img.taocdn.com/s3/m/36f9c65dcc22bcd126ff0ce0.png)
天津大学试卷专用纸学院化工学院专业班年级学号姓名共5页第1页B一、填空题(共30分,每小题3分)1. 纯物质p-V图上临界等温线在临界点处的斜率等于零,曲率等于零。
2. 第二Virial系数的物理意义为B仅与两分子间的相互作用力有关;B的大小是温度的函数。
普遍化Virial方程的适用条件是,对比体积V r > 2。
3. 高压下,理想混合气体的?=①,理想混合液体的Y= 1。
正偏差物系的特点是异类分子间作用力—小于—同类分子间的作用力。
4. 损失功是指当完全可逆过程和实际过程经历同样的始末态时,由于可逆程度的差别,导致这两种过程所表现出的功之间存在差值。
5. 某压缩制冷装置的制冷剂在原冷凝器的出口温度、压力为T (p下的饱和温度)、p,现T比原冷凝器压力下的饱和温度低了5C,其它条件不变,则制冷循环的制冷量增加,压缩机功耗不变_ 。
x i d In M +x2d In L dpRT2RT(二乙胺-水)的液液平衡体系中,水在胺相中的摩尔分率为0.35,胺在水相中为0.00009,水在胺相中的活度系数为2.—,水在水相中的活度系数为」_。
8.制冷剂的汽化潜热要尽可能的大,是因为潜热大,可增加单位质量工质的制冷能力,使制冷剂的循环量减少。
二、简答题(共20分,每小题5分)1. 无热溶液和正规混合物的基本假设分别是什么?答:无热溶液:无热溶液理论假定由纯物质形成溶液时,其混合热基本为零,溶液非理想性的原因主要来自超额熵不等于零,即H E= O,G E=_TS E正规溶液:是指超额体积为零且混合熵变等于理想混合熵变的溶液,即v E = 0 ,S^0但正规溶液的混合热不等于零。
根据正规溶液的特点,超额Gibbs自由能可写成G E=H E=U E2. 空气在膨胀机中由温度T1=230 K压力p1=10.13 MPa绝热可逆膨胀至压力p2=0.1013MPa,如何得到空气膨胀后的最终温度T2值?答:由T-S图上的状态1点(T1=230K、p1=10.13MPa)沿等熵线(即垂直线)向下至状态2点(P2=0.1013MP),该点的纵坐标值就是T2。
广东省_2004年_高考理科化学真题(附答案)_历年历届试题

2004年全国普通高等学校招生全国统一考试化学(广东卷)本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分;第Ⅰ部分(选择题共72分)可能用到的原子量:H 1 C 12 N 14 O 16 Cu 64一、选择题(本题包括9小题,每小题4分,共36分。
每小题只有一个....选项符合题意。
)1.下列各组物质中,互为同位素的是()A.重氢、超重氢B.氧、臭氧C.红磷、白磷D.乙酸、丙酸2.上世纪80年代后期人们逐渐认识到,NO在人体内起着多方面的重要生理作用。
下列关于NO的说法不正确...的是()A.NO分子中有极性共价键B.NO是造成光化学烟雾的因素之一C.NO是汽车尾气的有害成分之一D.NO分子所含电子总数为偶数3.pH相同的盐酸和醋酸两种溶液中,它们的()A.H+的物质的量相同B.物质的量浓度相同C.H+的物质的量浓度不同D.H+的物质的量浓度相同全部转化成BaSO4沉淀,此时铝元素的主要存4.把Ba(OH)2溶液滴入明矾溶液中,使SO-24在形式是()D.Al3+和Al(OH)3 A.Al3+ B.Al(OH)3C.AlO-25.在恒温时,一固定容积的容器内发生如下反应:2NO2(g) N2O4(g) 达平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数()A.不变B.增大C.减小D.无法判断6.下列有关溶液性质的叙述,正确的是()A.室温时饱和的二氧化碳水溶液,冷却到0℃时会放出一些二氧化碳气体B.20℃,100g水可溶解34.2g KCl,此时KCl 饱和溶液的质量分数为34.2%C.强电解质在水中溶解度一定大于弱电解质D.相同温度下,把水面上的空气换成相同压力的纯氧,100g水中溶入氧气的质量增加7.分子式为C4H9Cl的同分异构体有()A.1种B.2种C.3种D.4种8.下列叙述正确的是()A.发生化学反应时失去电子越多的金属原子,还原能力越强B.金属阳离子被还原后,一定得到该元素的单质C.核外电子总数相同的原子,一定是同种元素的原子D.能与酸反应的氧化物,一定是碱性氧化物9.一定温度下,反应2SO2+O2 2SO3,达到平衡时,n(SO2):n(O2):n(SO3)=2:3:4。
2023年教师资格之中学综合素质能力检测试卷B卷附答案

2023年教师资格之中学综合素质能力检测试卷B卷附答案单选题(共50题)1、吴老师在指导青年教师时说道:"我们是生物老师,自己就知道生物的多样性和保护这种多样性的重要,所以对各有所长的学生,我们可不能做一个把学生修剪得整整齐齐的园丁。
"这种说法表明教师劳动具有()A.差异性B.协作性C.复杂性D.示范性【答案】 C2、中国医生发明了一种以毒攻毒的预防方法,这种方法于十八世纪初传到欧洲,后来英国医生金纳应用牛痘接种法原理,预防了今日世界各国的()。
A.艾滋病B.肺结核C.鼠疫D.天花【答案】 D3、被誉为“万园之园”的圆明园被焚毁于( )A.鸦片战争期间B.第二次鸦片战争期间C.甲午中日战争期间D.八国联军侵华战争期间【答案】 B4、余某,现年35岁,2004年药学专业大学本科毕业,到某市人民医院药剂科工作。
2010年经国家执业药师资格考试取得执业药师资格。
2011年,碍于情面利用自己的证件替亲戚李某办理《药品经营许可证》《执业药师注册证》,并担任药店负责人,但不参与实际经营。
2013年因为酒后驾车被罚款,并暂扣驾驶证1个月。
2015年3月该药店因故意销售假药“筋骨丹”300瓶和“喘立消丸”400瓶,被市食品药品监督管理局查获并移送公安机关处理。
A.担任药店负责人但不参与药品质量管理B.替亲戚办理《药品经营许可证》,并担任药店负责人C.作为医疗机构药剂人员参加考试并取得执业药师资格证书D.在担任医疗机构药剂人员的同时,在药店挂证担任执业药师【答案】 C5、夏老师工作很努力,教学能力强,业余时间经常自学教育教学理论和专业知识,但他对教学能力差的同事不屑一顾,致使一些老师不愿意搭理他。
夏老师应该()。
A.置之不理,继续提高自己的教学水平B.反思自己,想办法改善与同事的关系C.团结同事,降低自身专业发展要求D.减少往来,避免与同事发生正面冲突【答案】 B6、在太阳系的八大行星中,质量最大和最小的行星分别是( )。
2004级物理化学I-2期末试题-B正式
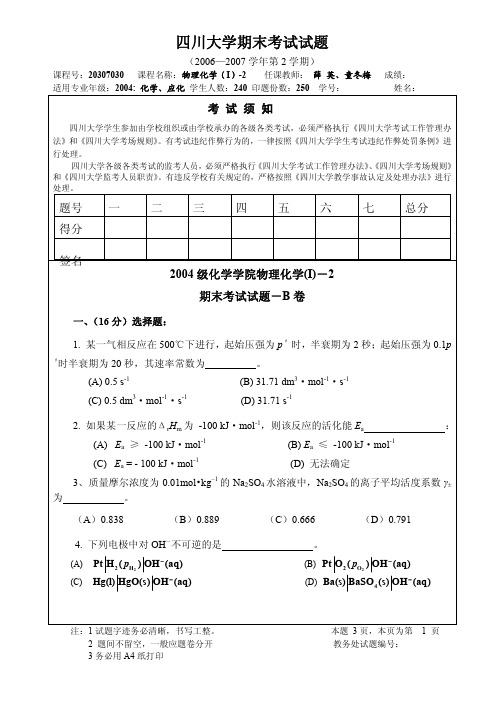
1、恒温恒压下可逆地将水分散为微小水滴,分散过程体系的 S 0,U 0,G 0, V 0。 (填 >, < 或=) 。
2.同一电导池测定 0.001moldm-3 和 0.01 moldm-3 的 MA 溶液的电阻分别为 25 和 2.5,两溶液的摩尔电导率之比为 3. 某气相反应 A+B
0.411 ,试求: 2.303
(1)脂肪酸的表面吸附量 Γ 与活度 a 的关系式; (2)当表面形成紧密的单分子层吸附时(a >> A ),每个脂肪酸分子所占据的面积。
本题 3 页,本页为第 教务处试题编号: 3 页
1. 写出电极反应和电池反应; 2.
计算该电池反应的平衡常数;
3. 求算 298K 时 Ag2O 的标准摩尔生成热 fHθm(Ag2O, s), 已知 298 K 时 fHθm(H2O, l)= - 285.85 kJmol-1。
六、(12分)291K,各种饱和脂肪酸水溶液的表面张力 γ 与活度a 的关系式可以表示 为: γ / γ 0 = 1 + b ln(a / A + 1) , γ 0 是纯水的表面张力( γ 0 = 0.07286 N.m -1 ),常数 A 因 不同酸而异, b =
。 Ag | Ag+ || I - | AgI(s) | Ag Ag | AgI | Pt
6、25℃某丁酸稀水溶液的表面张力 γ 与纯水的表面张力 γ0 间的关系为源自γ = 0.88 ,将 γ0
。
同一根毛细管插入纯水中,毛细管升高 1.8cm,若插入该溶液,毛细管升高为 (A)1.58cm (B)2.80cm (C)1.8cm (D)0.22cm
电解质中的正离子
2004年普通高等学校招生全国统一考试 理综化学部分

2004年普通高等学校招生全国统一考试(北京卷)理科综合能力测试化学部分6.糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质。
以下叙述正确的是A.植物油不能使溴的四氯化碳溶液褪色B.淀粉水解的最终产物是葡萄糖C.葡萄糖能发生氧化反应和水解反应D.蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水7.近期《美国化学会志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在470℃、80MPa下合成出金刚石,具有深远意义。
下列说法不正确...的是A.由二氧化碳合成金刚石是化学变化B.金刚石是碳的一种同位素C.钠被氧化最终生成碳酸钠D.金刚石中只含有非极性共价键8.下列指定微粒的个数比为2:1的是A.Be2+离子中的质子和中子B.12H原子中的质子和中子C.NaHCO3晶体中的阳离子和阴离子D.BaO2(过氧化钠)固体中的阴离子和阳离子9.用N A表示阿伏加德罗常数,下列叙述中正确的是A.0.1 mol·L-1稀硫酸100 mL中含有硫酸根个数为0.1 N AB.1 mol CH3+(碳正离子)中含有电子数为10 N AC.2.4 g金属镁与足量的盐酸反应,转移电子数为2N AD.12.4 g白磷中含有磷原子数为0.4N A10.为确定下列置于空气中的物质是否变质,所选检验试剂(括号内物质)不能..达到目的的是A.Na2SO3溶液(BaCl2)B.FeCl2溶液(KSCN)C.KI(淀粉溶液)D.HCHO溶液(石蕊试剂)11.已知0.1 mol·L-1的二元酸H2A溶液的pH=4.0,则下列说法中正确的是A.在Na2A、NaHA两溶液中,离子种类不相同B.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等C.在NaHA溶液中一定有:[Na+]+[H+]=[HA-]+[OH-]+2[A2-]D.在Na2A溶液中一定有:[Na+]>[A2-]>[H+]>[OH-]12.从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2O===7Cu2S+5FeSO4+12H2SO4,下列说法正确的是A.Cu2S既是氧化产物又是还原产物B.5 mol FeS2发生反应,有10 mol电子转移C.产物中的SO42-离子有一部分是氧化产物D.FeS2只作还原剂13.20℃时,饱和KCl溶液的密度1.174g·cm-3,物质的量的浓度为4.0 mol·L-1,则下列说法中不正确...的是A.25℃时,饱和KCl溶液的浓度大于4.0 mol·L-1B.此溶液中KCl的质量分数为C.20℃时,密度小于1.174g·cm-3的KCl溶液是不饱和溶液D.将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174g·cm-314.在一定温度下,一定体积的的密闭容器中有如下平衡:H 2(气)+I2(气)2HI(气)。
2004年江苏省高考化学试卷及答案

2004年普通高等学校统一招生江苏高考化学试题第一卷 (选择题共74分)可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Al 27 S 32 C1 35.5 Mn 55 Fe 56 Zn 65 Ag 108 Ba 137一、选择题(本题包括8小题,每小题4分,共32分。
每小题只有一个....选项符合题意) 1.我国的“神舟五号”载人飞船已发射成功,“嫦娥”探月工程也已正式启动。
据科学家预测,月球的土壤中吸附着数百万吨的He 32,每百吨He 32核聚变所释放出的能量相当于目前人类一年消耗的能量。
在地球上,氮元素主要以He 42的形式存在。
下列说法正确的是A .He 42原子核内含有4个质子 D .He 32和He 42互为同位素C .He 32原子核内含有3个中子D .He 42的最外层电子数为2,所以He 42具有较强的金属性2.下列各项中表达正确的是 A .F —的结构示意图:B .CO 2的分子模型示意图:C .NaCl 的电子式:D .N 2的结构式: :N ≡N: 3.2004年4月22日是第35个“世界地球日”,我国确定的主题是“善待地球——科学发展”。
下列行为中不符合...这一主题的是 A .采用“绿色化学”工艺,使原料尽可能转化为所需要的物质B .大量开采地下水,以满足社会对水的需求C .减少直至不使用对大气臭氧层起破坏作用的氟氯烃D .节约能源,提高能源利用率4.下列关于浓硫酸的叙述正确的是A .浓硫酸具有吸水性,因而能使蔗糖炭化B .浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体c .浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 D .浓硫酸在常温下能够使铁、铝等金属钝化5.向一种溶液中滴加另一种溶液后,溶液的颜色不发生变化的是A .碳酸氢钠溶液中滴加稀盐酸B .硫酸铁溶液中滴加硫氰化钾溶液C .碘水中滴加淀粉碘化钾溶液D .高锰酸钾酸性溶液中滴加亚硫酸钠溶液6.X 、Y 是元素周期表ⅦA 族中的两种元素。
北京化工大学2004物化真题

VapHm
为:
8. 由2molA和2molB形成理想液态混合物,己知某温度下 pA =90kPa, pB =30kPa。则平衡气相摩 尔分数之比yA∶yB为∶ B. 3∶1 B. 4∶1 C. 6∶1 D. 8∶1 9. 由水(1)和甲醇(2)组成的二元溶液,下列各式不是甲醇在此溶液中的化学势的是:
0.4
Ksp
为:
23. 有恒温、恒容下的某气相反应A(g)+B(g)→C(g),若用反应物A的分压 pA 对时间t作图为一直 线,则该反应的反应级数为: A. 0.4 B. 0.6 C. 1.4 D. 1.6 24. 有下列反应: 式中k1,k2分别是正向、逆向基元反应的速率常数,298K时其值分别为:3.33×10-3S-1,6.67 ×10-7(S· p )-1。上述对行反应在298K时的平衡常数Kp: A. 5.0×10-3 p B. 2.0×104 p C. 5.0×103 p D. 2.0×10-4 p 25. 己知一平行反应,由两个基元反应构成:A→B的速率常数为k1,A→C的速率常数为k2,则 该平行反应的总反应速率常数k为: A. k1+k2 B. k1/k2 C. k2 /k1 D. = k1 26. 293K时,乙醚—水、汞—乙醚、汞—水的界面张力为0.0107,0.379,0.375 N·m-1,在乙醚 与汞的界面上滴一滴水,其接触角 为: A. 68o B. 112o C. 168o D. 22o 27. 473.2 K时测定氧在某催化剂上的吸附作用,其吸附量满足如下方程:
B.
A
=0
>-514.2 kJ·mol-1
A
<-514.2 kJ·mol-1
G p 6. 对于纯物质、单相、只做体积功的封闭系统, T 的值: A. 大于零 B. 小于零 C. 等于零 D. 无法确定
物化04级本科试题(下)
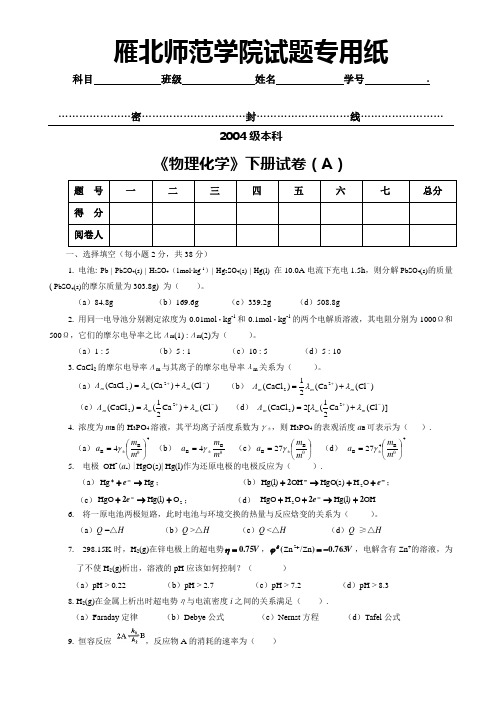
…………………密…………………………封………………………线……………………2004级本科《物理化学》下册试卷(A )一、选择填空(每小题2分,共38分)1. 电池: Pb | PbSO 4(s) | H 2SO 4(1mol·kg -1)| Hg 2SO 4(s) | Hg(l) 在10.0A 电流下充电1.5h ,则分解PbSO 4(s)的质量( PbSO 4(s)的摩尔质量为303.8g) 为( )。
(a )84.8g (b )169.6g (c )339.2g (d )508.8g2. 用同一电导池分别测定浓度为0.01mol ·kg -1和0.1mol ·kg -1的两个电解质溶液,其电阻分别为1000Ω和500Ω,它们的摩尔电导率之比Λm (1) :Λm (2)为( )。
(a )1 : 5 (b )5 : 1 (c )10 : 5 (d )5 : 10 3. CaCl 2的摩尔电导率Λm 与其离子的摩尔电导率λm 关系为()。
(a ))Cl ()Ca ()CaCl (22-++=m m m Λλλ (b ) )Cl ()Ca (21)CaCl (22-++=m m m Λλλ (c ))Cl ()Ca 21()CaCl (22-++=m m m Λλλ (d ) )]Cl ()Ca 21([2)CaCl (22-++=m m m Λλλ4. 浓度为m B 的H 3PO 4溶液,其平均离子活度系数为γ±,则H 3PO 4的表观活度a B 可表示为( ).(a )4θB B 4⎪⎭⎫ ⎝⎛=±m m a γ (b ) θB B 4m m a ±=γ (c )⎪⎭⎫ ⎝⎛=±θB B 27m m a γ (d ) 4θB 4B 27⎪⎭⎫ ⎝⎛=±m m a γ 5. 电极 OH -(a -)|HgO(s)| Hg(l)作为还原电极的电极反应为( ).(a )Hg Hg →+-+e ; (b )--++→+e O H HgO(s)OH Hg(l)22; (c )2O Hg(l)HgO +→+-e 2; (d ) -2OH Hg(l)O H HgO 22+→++-e 6. 将一原电池两极短路,此时电池与环境交换的热量与反应焓变的关系为( )。
2008_化院本科生B卷答案-final

姓名:__________大连理工大学学号:__________课程名称:生物化学试卷:B 考试形式:闭卷院系:__________授课院(系):环境与生命学院考试日期:2009年1月8日试卷共9 页_____ 级_____ 班装订线一、判断是非题(正确的写“√”,错误的写“X”;每题1分,总分10分)1.[√ ]酶原激活过程实际是酶活性中心形成或暴露的过程。
2.[ X ]原核生物一个mRNA分子只含有一条多肽链的信息。
3.[ X ]溶液的pH值可以影响氨基酸的pI值。
4.[√ ]大多数辅酶的前体是维生素B族的衍生物。
5.[ X ]等电点聚焦电泳常用来分析蛋白质的纯度和测定蛋白质的分子量。
6.[ X ]天然氨基酸都具有一个不对称α-碳原子。
7.[√ ]线粒体内存在一定量的DNA。
8.[ X ]蛋白质分子在260nm处有紫外光特征吸收,可用于定量测定。
9.[ X ]丙酮酸脱氢酶系催化底物脱下的氢,最终是交给FAD生成FADH2。
10.[ X ]RNA分子组成中,通常A等于T,G等于C。
二、选择题(将正确答案写在题号后的括号内,每题1分,总分15分)1. [ D ]体内转运氨的形式有A 丙氨酸;B 谷氨酰胺;C 谷氨酸;D 谷氨酰胺和丙氨酸2. [ D ]糖异生作用中哪一种酶代替了糖酵解的己糖激酶A 磷酸烯醇式丙酮酸羧激酶;B 丙酮酸羧化酶;C 果糖二磷酸酶;D 6-磷酸葡萄糖酶B 第1 页共9 页3. [B ]DNA的戊糖在哪个位置的碳上脱氧A 1ˊ;B 2ˊ;C 3ˊ;D 4ˊ4. [ D ]下列哪项对蛋白质变性的描述是正确的A 蛋白质变性后分子量下降;B 蛋白质变性后不易被蛋白酶水解;C 蛋白质变性后理化性质不变;D 蛋白质变性后丧失原有的生物活性5. [ B ]底物水平磷酸化指A ATP水解为ADP和Pi;B 底物经分子重排后形成高能磷酸键水解后使ADP磷酸化为ATP分子;C 呼吸链上H+传递过程中释放能量使ADP磷酸化为ATP分子;D 使底物分子加上一个磷酸根6. [ A ]下列几种不同碱基组成比例的DNA分子,Tm值最高的是A A+T=15%;B G+C=25%;C G+C=40%;D A+T=80%7. [ C ]在脱氨基作用中,体内最常见的方式是A 氧化脱氨基作用;B 转氨基作用;C 联合脱氨基作用;D 嘌呤核苷酸循环8. [ B ]天冬氨酸的pK1=2.09,pK2=3.86,pK3=9.82,则其等电点为A 2.09;B 2.97;C 3.86;D 6.84B 第2页共9 页9. [ B ]近年来关于氧化磷酸化的机制是通过下列哪个学说被阐述的A巴士德效应;B化学渗透学说;C诱导契合学说;D共价催化理论10.[ C ]非竞争性抑制作用引起酶促反应动力学的变化是A Km值不变,Vm变大;B Km值减小,Vm变小;C Km值不变,Vm变小;D Km值变大,Vm不变11.[ B ]在pH6.0时,带正电荷的氨基酸为A 谷氨酸;B 精氨酸;C 亮氨酸;D 色氨酸12. [ A ]尿素的生物合成主要是在哪里进行的A 肝;B 肾;C 肺;D 肾上腺13.[ C ]下面关于酶的叙述哪一项是错误的A 酶的最适温度不一定是37°C;B Km是酶的特征性常数;C 酶催化的反应都是可逆的;D 酶不一定都是结合蛋白质14.[ D ]下列哪组氨基酸都不能在人体内合成A 谷氨酸、赖氨酸、精氨酸;B 色氨酸、天冬氨酸、甘氨酸C 丝氨酸、丙氨酸、亮氨酸;D 苏氨酸、缬氨酸、异亮氨酸15.[ A ]三羧酸循环的第一步反应产物是A 柠檬酸;B 草酰乙酸;C 乙酰辅酶A;D 二氧化碳B 第3页共9 页三、填空题(每空1分,总分15分)1.磷酸戊糖途径的重要意义在于提供5-磷酸核糖和NADPH。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
大 连 理 工 大 学
2004年 限选课考试试卷 课 程 名 称:《生物化学》 试 卷:B 授课院(系)
: 化工学院 考试日期:2005年 1月11日 试卷共7页 一 二 三 四 总成绩 标准分
10 40 20 30 100 得 分
一、判断题(在括号中正确的写“√”,错误的写“×”。
每小题1分,共
10分)
( )1. 乳糖是由葡萄糖和半乳糖通过β-1,4糖苷键组成的二糖。
( )2. 三羧酸循环是糖、脂肪和氨基酸氧化生能的最终共同通路。
( )3. 在蛋白质和多肽分子中,只有一种连接氨基酸残基的共价键—
肽键。
( )4. 糖类在膜上的分布是不对称的,全部都处于细胞膜的外侧。
( )5. 非竞争性抑制剂不影响酶对底物的K m 。
( )6. 血红蛋白由四个亚基组成,因此提高了它与氧的结合能力,从
而增加了输氧的功能。
( )7. DNA 分子中的G-C 含量越高,其熔点(T m )值越小,两者呈反比
关系。
( )8. 在厌氧条件下,乳酸会在酵母中积累。
( )9. 三碳植物叶肉细胞所含的酶对CO 2有很强的亲和力,所以是高产
型植物。
( )10. 天冬氨酸可经转氨基作用生成草酰乙酸。
二、选择题(在正确的选择上写“√”,每小题2分,共40分)
1. 遗传信息传递的中心法则是 。
姓名:
学号: 院系:
级 班
装 订 线
A. DNA-->RNA-->蛋白质
B. RNA-->DNA-->蛋白质
C. 蛋白质-->DNA-->RNA
D. DNA-->蛋白质-->RNA
2. 请指出①肌红蛋白(MW:16900)、②过氧化氢酶(MW:247500)、
③细胞色素c(MW:13370)和④糜蛋白酶原(MW:23240)在凝胶过滤柱上洗脱出来的先后顺序_________。
A. ①-③-②-④
B. ③-①-④-②
C. ②-④-①-③
D. ④-③-①-②
3. 1 mol葡萄糖分解代谢产生ATP数量。
A. 12 mol
B. 24 mol
C. 36 mol
D. 38 mol
4. 葡萄糖与甘油之间的代谢中间产物是。
A. 丙酮酸
B. 3-磷酸甘油酸
C. 磷酸二羟丙酮
D. 磷酸稀醇式丙酮酸
G A C T
5. 一个DNA片段按末端终止法测定序列的
部分图谱如右图,该DNA的序列是。
A. …AGCTCAG…
B. …ACTTCGA…
C. …TGAAGCT…
D. …TCGAAGT…
6. 由葡萄糖合成糖原的过程是在中进行的。
A. 胞液
B. 内质网
C. 线粒体
D. 细胞核
7. 酶共价调节的主要方式是_____________。
A.甲基化与去甲基化
B. 乙酰化与去乙酰化
C. 磷酸化与去磷酸化
D. 酶蛋白合成与酶蛋白降解
8. 尿素合成的中间物是氨基甲酰磷酸,其合成的细胞器是。
A. 胞液
B. 内质网
C. 线粒体
D. 细胞核
9. 下列_______的蛋白质在pH = 7的溶液中带正电荷。
A. pI = 4.5
B. pI = 5.5
C. pI = 6.5
D. pI = 7.5
10. 某一酶促反应的速度为最大反应速度的40%时,Km等于
A. [S]
B. 1/2[S]
C. 3/2[S]
D.2/3[S]
11. 关于pH对酶活性的影响,项不对。
A. 影响必需基团解离状态
B. 也能影响底物的解离状态
C. 酶蛋白在一定的pH范围内发挥最高活性
D. 破坏蛋白质的一级结构
12. 关于tRNA的叙述项是错误的。
A. tRNA二级结构呈三叶草形
B. tRNA分子中含有稀有碱基
C. 反密码环上有CCA三个碱基组成的反密码子
D. tRNA中有一个额外环
13. 在尿素合成过程中,下列步反应需要ATP。
A. 鸟氨酸+氨甲酰磷酸------>瓜氨酸+磷酸
B. 瓜氨酸+天冬氨酸------>精氨琥珀酸
C. 精氨琥珀酸------>精氨酸+延胡索酸
D. 精氨酸------>鸟氨酸+尿素
14. 体内转运氨的形式有。
A. 丙氨酸
B. 谷氨酰胺
C. 谷氨酰胺和丙氨酸
D. 谷氨酸
15. 脂肪酸彻底氧化的产物是。
A. 乙酰CoA
B. 乙酰CoA、FADH2及NADH + H+
C. 水和二氧化碳
D. 水、二氧化碳和释放出能量
16. 糖酵解中催化的反应不是限速反应。
A. 丙酮酸激酶
B. 磷酸果糖激酶
C. 己糖激酶
D. 磷酸丙糖异构酶
17. 蛋白质沉淀、变性和凝固的关系,下面叙述正确的是。
A. 蛋白质沉淀后必然变性
B. 蛋白质凝固后一定会变性
C. 变性蛋白一定要凝固
D. 变性就是沉淀,沉淀就是变性
18. 各种细胞色素在呼吸链中传递电子的顺序是。
A. a,a3,b,c1,c,1/2 O2
B. b,c1,c,a,a3,1/2 O2
C. c1,c,b,a,a3,1/2 O2
D. b,a,a3,c1,c,1/2 O2
19. 转氨酶的辅酶为。
A. 磷酸吡哆醛
B. FAD
C. NAD+
D. NADP+
20. DNA具有的两个重要功能是。
A. 遗传信息的分配和保存
B. 遗传信息的表达和复制
C. 遗传信息的调节和突变
D. 遗传信息的保存和进化
三、填空题(每空1分,共20分)
1. 葡萄糖经糖酵解的终产物是。
2. 在生物膜上的都与脂质或蛋白质共价连接。
3. 为酶蛋白编码的一段DNA,至少包含三个区域是,
和。
4. 用PCR方法扩增DNA片段,在反应中除了用该DNA片段为模板外,尚需加入,和。
5. 米氏常数Km的单位是。
6. 一种蛋白质在用二硫苏糖醇(一种含有二硫键的糖)处理后,它的SDS- 凝胶电泳谱带位置比原来变_________。
7. 脂肪酸合成过程中,乙酰CoA来源于或,
NADPH来源于。
8. G-蛋白是一种生物调控信号结合蛋白,其作用是调控的合成。
9. 生物能的化学本质是存储于ATP分子中的化学能。
10. 尿素循环中,尿素分子的两个N原子来自是和。
11. 已知一氨基酸的pK1、pK2和pK3分别是1.82、9.17和6.00,它的pI值
是。
12.酶浓度调节的化学本质是。
13. 人小便中嘌呤代谢的最终产物主要是。
四、简答题(6道题,每小题5分,总分30分)
1. 简述DNA复制的要点。
2. 计算1mol 14碳原子的饱和脂肪酸完全氧化为H2O和CO2时可产生多少mol ATP?
3. 在人的膳食中严重缺乏糖时(禁食减肥),为什么易发生酸中毒?酸中
毒对人体有哪些危害?
4. 已知一蛋白水解酶,可以作用于多种人工合成底物,怎样才能证明这些不同的底物和酶亲和力的差异?
5. 已知一蛋白质有-Trp-Met-Asp- Trp-Gly-序列,为了合成探针,用于检测该蛋白质的基因,由上述序列推测:
(1)该蛋白质的mRNA序列;
(2)该蛋白质的负链DNA序列(转录成mRNA的DNA序列);
(3)该蛋白质的正链DNA序列。
(注:序列要标明5’端和3’端。
氨基酸信息三联密码子为Trp:色氨酸UGG; Met:甲硫氨酸AUG; Asp:天冬氨酸GAU; Gly:甘氨酸GGU)
6. 根据蛋白质的一级结构氨基酸的序列可以预测蛋白质的空间结构,假设有下列19 个氨基酸残基序列:
1 2 3 4 5 6 7 8
组氨酸-酪氨酸-甘氨酸-脯氨酸-苯丙氨酸-谷氨酸-丙氨酸-甲硫氨酸-
9 10 11 12 13 14 15 16
半胱氨酸-酪氨酸-谷氨酸-丙氨酸-谷氨酰胺-脯氨酸-甲硫氨酸-组氨酸-
17 18 19
半胱氨酸-苯丙氨酸-精氨酸
(1)预测在该序列的哪一部位可能会出弯或β-转角?
(2)何处可能形成链内二硫键?
(3)假设该序列只是大的球蛋白的一部分,下面氨基酸残基中哪些可能
分布在蛋白的外表面?哪些分布在内部?
天冬氨酸、亮氨酸、丝氨酸、缬氨酸、谷氨酰胺、赖氨酸。
