【范文】XX高考化学必备知识点:常用到的规律
高考化学必记的21条规律

高考化学必记的21条规律1、溶解性规律——见溶解性表2、常用酸、碱指示剂的变色范围:甲基橙:<3.1红色,3.1—4.4橙色,>4.4黄色酚酞:<8.0无色,8.0—10.0浅红色,>10.0红色石蕊:<5.1红色,5、1—8.0紫色,>8.0蓝色3、在惰性电极上,各种离子的放电顺序:阴极:Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+阳极:S2->I->Br->Cl->OH->含氧酸根离子注意:若用金属作阳极,电解时阳极本身发生氧化还原反应(Pt、Au除外)4、根据化学总反应方程式书写两个电极反应式的方法:(1)按电子得失写出两个电极反应式;(2)考虑反应时的环境(酸性或碱性);(3)使两边的原子数、电荷数相等。
5、解计算题时常用到的守恒规律:原子守恒、转移电子守恒、电荷守恒。
6、电子层结构相同的离子,核电荷数越多,离子半径越小。
7、晶体的熔点:原子晶体>离子晶体>分子晶体,中学化学学到的原子晶体有Si、SiC、SiO2和金刚石。
原子晶体熔点的比较是以原子半径为依据的,如金刚石>SiC>Si(因为原子半径:Si>C>O)。
8、分子晶体的熔沸点:组成和结构相似的物质,分子量越大,熔沸点越高。
9、胶体的带电:一般说来,金属氢氧化物、金属氧化物的胶体粒子带正电,非金属氧化物、金属硫化物的胶体粒子带负电。
10、氧化性:MnO4->Cl2>Br2>Fe3+>I211、含有Fe3+的溶液一般呈酸性。
12、能形成氢键的物质:H2O、NH3、HF等。
13、氨水(乙醇溶液一样)的密度小于1,浓度越大,密度越小;硫酸的密度大于1,浓度越大,密度越大。
2024年高中高三化学的必背必考知识点总结范本(二篇)

2024年高中高三化学的必背必考知识点总结范本高中化学是一门重要的学科,它是其他自然科学的基础。
高三化学是高中阶段的最后一年,是学生备战高考的关键时期。
下面是高中高三化学的必背必考知识点总结,帮助学生复习备考。
一、化学基本概念1.原子与元素:原子的结构、元素的表示方法、元素周期表。
2.离子与化合物:离子的定义、离子化合物的性质、离子式和分子式的表示方法。
3.化学方程式:化学方程式的基本形式、配平化学方程式的方法。
4.化学计量与电子结构:摩尔与质量关系、原子量与摩尔质量。
二、化学反应与化学平衡1.化学反应类型:酸碱反应、氧化还原反应、置换反应等。
2.氧化还原反应:电子的概念、氧化剂和还原剂的定义、氧化数的计算。
3.化学平衡:化学平衡的条件、反应速率与化学平衡、平衡常数与平衡常数表。
4.勃朗斯特(E)方程:电解质的溶解与电离度、电解质溶液的性质、离子反应与化学平衡。
5.平衡常数计算:物质摩尔浓度与化学平衡、化学反应的平衡常数计算、平衡常数与温度的关系。
三、化学反应动力学1.化学反应速率:化学反应速率的概念、速率与反应物浓度的关系。
2.反应速率与反应动力学:反应速率的影响因素、速率方程与速率常数。
3.反应速率与反应级数:反应级数、反应速率与反应物浓度的关系。
4.表观活化能与反应速率:表观活化能的概念、表观活化能与温度的关系。
4.平衡与反应速率:平衡体系与反应速率、平衡常数与反应速率的关系。
五、化学体系的熵1.熵的概念与变化:熵的定义、反应熵与熵变、熵变与反应性质的关系。
2.化学反应的熵变:化学反应的熵变计算、熵变与平衡常数的关系。
3.熵变与化学平衡:熵变与反应方向、熵变与平衡常数的关系。
六、化学平衡与电子转移1.电荷转移与配位反应:电子转移的概念、电子转移反应的特点。
2.电子转移反应类型:氧化还原反应、配位反应。
3.电子转移反应与化学平衡:电子转移反应的平衡常数、电子转移反应与温度的关系。
4.电解与电池:电解概念与原理、电解与化学变化、电池的基本概念。
考试中常用的高中化学32条规律总结_工作总结

考试中常用的高中化学32条规律总结1、溶解性规律——见溶解性表;2、常用酸、碱指示剂的变色范围:指示剂 PH的变色范围甲基橙 4.4黄色酚酞 10.0红色石蕊 8.0蓝色3、在惰性电极上,各种离子的放电顺序:阴极(夺电子的能力):Au3+ >Ag+>Hg2+>Cu2+ >Pb2+ >Fa2+>Zn2+ >H+>Al3+>Mg2+ >Na+>Ca2 + >K+阳极(失电子的能力):S2- >I- >Br–>Cl- >OH- >含氧酸根注意:若用金属作阳极,电解时阳极本身发生氧化还原反应(Pt、Au除外)4、双水解离子方程式的书写:(1)左边写出水解的离子,右边写出水解产物;(2)配平:在左边先配平电荷,再在右边配平其它原子;(3)H、O 不平则在那边加水。
例:当Na2CO3与AlCl3溶液混和时:3 CO32- + 2A l3+ + 3H2O = 2Al(OH)3↓ + 3CO2↑1 / 65、写电解总反应方程式的方法:(1)分析:反应物、生成物是什么;(2)配平。
例:电解KCl溶液:2KCl + 2H2O == H2↑ + Cl2↑ + 2KOH配平:2KCl + 2H2O == H2↑ + Cl2↑ + 2KOH6、将一个化学反应方程式分写成二个电极反应的方法:(1)按电子得失写出二个半反应式;(2)再考虑反应时的环境(酸性或碱性);(3)使二边的原子数、电荷数相等。
例:蓄电池内的反应为:Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O 试写出作为原电池(放电)时的电极反应。
写出二个半反应: Pb –2e- →PbSO4 PbO2 +2e- → PbSO4分析:在酸性环境中,补满其它原子:应为:负极:Pb + SO42- -2e- = PbSO4正极: PbO2 + 4H+ + SO42- +2e- = PbSO4 + 2H2O注意:当是充电时则是电解,电极反应则为以上电极反应的倒转:为:阴极:PbSO4 +2e- = Pb + SO42-阳极:PbSO4 + 2H2O -2e- = PbO2 + 4H+ + SO42-7、在解计算题中常用到的恒等:原子恒等、离子恒等、电子恒等、电荷恒等、电量恒等,用到的方法有:质量守恒、差量法、归一法、极限法、关系法、十字交法和估算法。
【经典范文】高考化学知识规律总结

8. 氢化(硬化)――液态油在一定条件下与 H 2发生加成反应生成固态脂肪的过程.作用:植物油转变成硬化油后,性质稳定,不易变质,便于运输等. 9.皂化一一油脂在碱性条件下发生水解反应的过程•产物一一高级脂肪酸钠+甘油10. 老化一一橡胶、塑料等制品露置于空气中,因受空气氧化、日光照射而使之变硬发脆的过程. 11. 硫化一一向橡胶中加硫,以改变其结构 (双键变单键)来改善橡胶的性能,减缓其老化速度的过程. 12. 裂化一一在一定条件下,分子量大、沸点高的烃断裂为分子量小、沸点低的烃的过 程•石袖裂化一"恶民尤 目的--提高汽油的质量和产量.[催化裂化2HI -亠-K + 1=△3EU + SA(sD 競曲、硝竝、枝替加热分姐.側冬见光分報存sacajaOj.cap + 工 1高中化学知识规律总结一、中学化学中提及的 化”名目繁多•要判别它们分属何种变化,必须了解其过程 识来指出每一种 化”发生的是物理变化还是化学变化. 1. 风化一一结晶水合物在室温和干燥的空气里失去部分或全部结晶水的过程. 注意:自然条件. 2. 催化一一能改变反应速度,本身一般参与反应但质量和化学性质不变•应了解中学里哪些反应需 用催化剂•如 .请你根据下列知 13. 酯化一一醇与酸生成酯和水的过程.14. 硝化(磺化)――苯环上的H 被一N02或一SO 3H 取代的过程. 、基本反应中,有一些特别值得注意的反应或规律.现分述如下:1.化合反应:思考:化合反应是指单质间生成化合物的反应吗 ?结论:不一定!化合反应即"多合一”的反应,根据反应物和生成物的种类,化合反应又可分为三种.区别:cusa ・5H r o皿①+磁 (D4NH3 + S0E 右 4K0 + SH^G-©Dr+ HBt (1)单质+单质T 化合物g 亠业敵电2B04ila + 0=-细 Q ?2M E +啞明1T 為定性垦阳对的占撫=■索雅不稠.产输用刖711* 丄 n_ , Wa JI,$證+吐化8Fe + 3D Z (^>=— Fefi?SF E (ilg) +0i - - -2FaO 」③那口6 MlC1>丘備物同最不Fl 产物种类不同电 ----- 2KC1 十 g X些二弧0十% t ®2SO s +d E —— 5 A @2JfeQ r 2S03 沸水甜 ⑨疾範 水解—' 单灘'■簾用辟蹲"柞債化帘门肌 4- ?、QM&AI金厲Mt 化勒2Cn 4 S ―—— CUtS I占嫌flCu + Cl £ .......... CXL £2Ffi 4-Xlz ”-理 2FeCl,汉歧化=同一种愉质中同一种元素且光同一价奁原子恆发生的氧化一还原反应.如 C —十 2KaOH = NaCl + NaClO + H 20乩服化=向某物质中加入稀睨使之呈顔性的迫程.思考r KMnO 打容液为问用耳SOq 韻化而不用HC1?卫訓C4濬液沖何用HN0s ^1-t 而不用HCL?提示:2MnO ; +1GH + H-10C1- = 2Mn 2+ -F5C1S t 十宕且护Ag + + Cl~ = AgTl I注意,酸化时不能与原溶质发主彳七学反应・ 乩钝化:铝、铁—警亠気化 T 政密窜化膜f 阻止内层金属与険継续辰应 &雀歩软化——通过物理、化学右法除去確水中较多的 d 畤+的过程. 化水化——烯、映与日凶发主加成生成■新的有机勵-如乙烯 水化〕乙醇*(2)单质+化合物1 T 化合物22FeCl 2 + CI 2 = 2FeCl 3 4Fe(OH) 2 + 02 + 2H 2O =4 Fe(OH)32Na 2SO 3 + O 2 = 2Na 2SO 4(3)化合物1 +化合物2 T 化合物3①酸性氧化物 +水T 可溶性酸 碱性氧化物 +水T 可溶性碱乙焕水化-> 乙醛.□ao + XJO - oaCartt他 + HTI & MatOCfOr 逼魅③棘恢買伽 + 碗簞化唧-寺真韻£; U7 + 00='- [可韬t£—温过行〕CaO 4-S J O J 一便程 GaSiQj (同牆性一鬲温进疔1 © HFL + HK - ITKlff \ant + 隔.-(HH J 占D , J 常温进■芳匕引如噬“一分老”CuttW匸—絲亠Al GOH) »AlxP, + H£iHit -妙 企哄f +矽〔①酸榕t£翌 酸軒+水心 i6SiO t -I-砂△GO 不苗定聾50E t + itQA4MC!4B0t t + Oz t + 衽3稳定性:碳酸正盐〉碳酸酸式盐〉碳酸分解条件:(高温) (加热) (常温)C M CJCQJ S A CaOQi. + CO t + EW经典范文3 盐与盐一定发生复分解反应吗 ?4 有盐和水生成的反应一定是中和反应吗?提示:(1) 酸与碱不一定能发生中和反应•联系中和反应的逆反应是盐的水解知识•如: 水解 ALS 3 +6H.0 u > 2A1C0H) 3 I -h 3HS t (水解几乎完莹) 中和一 酸与碱发生的反应也不一定是中和反应.如: 2Fe(OH) 3 + 6HI = 2Fel 2 + I 2 + 6H 2O2Fe(OH )2 + 10HNO 3 (稀)=3Fe(NO 3)3 + NO f+ 8H 2O故特别要注意氧化性酸(碱)与还原性碱(酸)很可能发生的是氧化一还原反应. (2) 复分解反应中反应物的条件:氧化剂 还原剂活泼非金属单质:X 2、02、S 活泼金属单质:Na 、Mg 、Al 、Zn 、Fe 某些非金属单质: C 、H 2、S高价金属离子:Fe 3 4*、Sn 4+ 不活泼金属离子:Cu 2+、Ag +其它::Ag(NH 3)2] +、新制 C U (OH )2低价金属离子:Fe 2+、Sn 2+非金属的阴离子及其化合物:S 2-、H 2S 、I -、HI 、NH 3、Cl -、HCI 、Br -、HBr 三、常见的重要氧化剂、还原剂 掘性貝让放]亠减 3•置换反应判断:有单质参与或生成的反应一定是置换反应吗 ? 结论:反应物或生成物各两种且其中一种必定是单质的反应才称作置换反应.分类:可有多种分类方法,如根据两种单质是金属或非金属来分;也可根据反应物状态来分;还可以根据两单质的组成元素在周期表中的位置来分.① 盐 +盐、盐 +碱的反应物一般要可溶且在溶液中进行或加热时进行.如 ② 盐1 +酸1 T盐1 2 +酸2一般只需满足以下两条中的各一条:i)强酸制弱酸即酸性:酸 1>酸2ii)难挥发酸制易挥发酸,即挥发性:酸1<酸2注意:下列置换反应特别值得重视.① 2Na + 2出0 = 2NaOH + H z f 4H 2O ③ F 2 + 2H 2O = 4HF + 02 ⑤ 2H 2S + 02 = 2S + 2H 2O ⑦ 2Mg + CO 2 2AI + Fe 2O 3 ⑨ C + H 2O 3CI 2 + 2NH 3(11) Si + 4HF4•复分解反应(1)本质:通过两种化合物相互接触,交换成份⑺齊新煙障低的羽丸①生战潮物质........I ③生虑覇电龍园② 3Fe + Fe 3O 4 + 4H 2 T ④ CI 2 + H 2S = S + 2HCI ⑥ 2C + SiO 2 Si + 2CO2MgO + C 2Fe + Al 2O 3 CO + H 2 N 2 + 6HCI SiF 4+ 2H 2使溶液中离子浓度降低.暫1 如:1) r Ca ticiO^E + ZEBC1 — G EL CI r + 2H71OI Ca E + CD= + HQ — DaCU 4 2EC1Oii) f 取耳(画 + HagOrCHQ - 丛 + ZWCl fl 曲J 〔固)-4- 3K {疫 —IT A UJO, + HI t 諧蘇: ItS亠— 卜-4- 雄沌耳歩 + 级蛮6 — 起由+ ++ FlsAcj —t +譎遵 ----------- 较好直原因:上述三种金属硫化物溶解度特小,满足离子反应朝离子浓度降得更低的方向进行. (3)盐与盐可能发生的反应有: ①复分解②双水解③氧化一还原④络合反应现列表比较如下:①酸 + 碱 盐+水(中和反应)②酸 + 盐新酸+新盐③碱 + 盐 T 新碱+新盐 ④盐 + 盐T两种新盐典 壁系佯関-阳牺孑具有站噩更让惟产域 關負让性产物+ S4丈且又无其它碗謹酸2A.L Jh 4-3S U ~ 4-eiy] — 2AL (PWr+SEtS t两种斩捡AeJDj.+ifeci — A EC L 4培台的反应Pe SI +&SC±f _1 [FefSCW J"(4)生成盐和水的反应有:思考题:lTUCOn + —浊性缸化箱H 酸⑤碱性氧化物+酸 T盐+水CD 盐的结品冰合换一 兹+水-4- Hf)经典范文3、HSO 3、H 2SO 3、SO 2、N02、Fe 四、总结 ①在酸性介质中的反应,生成物中可以有 H +、H 2O ,但不能有0H -; 六、反应条件对氧化-还原反应的影响1 .浓度:可能导致反应能否进行或产物不同②在碱性介质中的反应,生成物中无 H + ; ③在近中性条件, 反应物中只能出现 H 2O ,而不能有H +或OH -,生成物方面可以 有H +或OH 现把+-五、物质内发生的氧化一还原反应 反应类型同一物质不同 4HNO 3 f+O 2f + 2H 2O 或热光2HC I O+ O 2 f4NO 2 2HC I元素的原子间加热2KM n O 4O 4 +M n O 2 + O 2f 2A g NO 3+ 2NO 2f+O 2 f 2KC I O3I +3O 2 fK 2M n 2A g 2KC同一物质同一元素 不同价态原子间 5NH 4NO 3 = 4N 2T + 2HNO 3 +9H 2 ON a 2S 2O 3 + H 2 SO 4=N a 2 SO 4 + H 2O+SO 2f + Sj 同一物质同一元素 同一价态原子间 (歧化反应)C I 2+2N a OH= NaCI +N a C I O + H 2O 3NO 2 2HNO 3 2 N + H 2 O + NOa 2 OH 2 O4N a OH + O 22N a 2 O 2 + 2H 2 O 2 O + O 2f2CO 2 = 2N a 2 CO 3 + O 2 f 2H 2「C U +H ,^ (B ) 不反应3.溶液酸碱性 J °|+冬玖(浓) 也 Cu30q + S02 "t 十比02S 2- + SO 32- + 6H+ = 3S J+ 3H 2O 5CI - + CIO 3- + 6H + = 3CI 2 f + 3H 2OS 2-、SO 32-, Cl -、CIO 3-在酸性条件下均反应而在碱性条件下共存Fe 2+与 NO 3-共存,但当酸化后即可反应.3F0 + NO 3- + 4H + = 3Fe 3+ + NO f + 2H 2O一般含氧酸盐作氧化剂时,在酸性条件下,氧化性比在中性及碱性环境中强 •故酸性KMnO 4溶液氧化性较强• 七、离子共存问题离子在溶液中能否大量共存,涉及到离子的性质及溶液酸碱性等综合知识。
高考化学必记的规律与结论

必记的35条规律和结论【化学基本概念版块】一、 常用化学定理二、 物质氧化性、还原性强弱的判断规律1. 在同一氧化还原反应中,氧化性:氧化剂氧化剂>氧化产物;还原性>还原产物。
如:O H Mn Fe H MnO Fe 223424585++=+++++-+还原性:++>22Mn Fe ;氧化性:+->34Fe MnO 。
2. 有金属活动性顺序判断在金属活动性顺序中,排在前面的金属单质的还原性大于排在后面的金属单质的还原性;后面金属离子的氧化性强于前面金属你的氧化性(+3Fe 除外)。
如:+++++++>>>>>>232223Mg Al Zn Fe H Cu Fe3. 根据金属在元素周期表中的相对位置判断单质:同周期元素,从左至右氧化性逐渐增强,还原性逐渐减弱;同主族,从上至下,氧化性逐渐减弱,还原性逐渐增强。
如:氧化性:2222222I Br Cl F F O N >>><<,;还原性:Cs Rb Na Li Al Mg Na <<<>>,。
气态氢化物:同一周期从左至元素的气态氢化物的还原性逐渐减弱;同一主族从上至下元素气态氢化物的还原性逐渐增强。
4. 根据反应条件难易判断氧化还原反应越容易进行(反应条件越低),则氧化剂的氧化性和还原剂的还原性越强。
如:二氧化锰与浓盐酸在就热条件下产生氯气,而高锰酸钾与浓硫酸在常温下反应生成氯气,所以高锰酸钾的氧化性强于二氧化锰的氧化性。
5. 根据电解反应判断原电池负极金属的还原性一般比正极金属的强,电解池中阴极优先析出的金属氧化性强。
6. 根据浓度、酸碱性判断同一氧化剂,浓度越大氧化性越强。
如:浓硝酸的氧化性强于稀硝酸;酸性条件下氧化剂的氧化性强于中性、碱性条件下的氧化剂。
7. 根据同一物质反应物的价态判断同一还原剂与不同的氧化剂反应,氧化产物中元素化合价越高氧化剂氧化性越强。
高考化学常考规律及特殊规律

高考化学常考规律及特殊规律⒈原子都是由质子、中子和电子组成,但氢的同位素氕却无中子。
⒉同周期的元素中,原子最外层电子越少,越容易失去电子,还原性越强,但Cu、Ag原子的还原性却很弱。
⒊原子电子层数多的其半径大于电子层数少的,但锂的原子半径大于铝的原子半径。
⒋主族元素的最高正价一般等于其族序数,但F2 却不是。
(OF2是存在的)⒌同主族元素的非金属元素随原子序数的递增,其最高价氧化物的水化物的酸性逐渐减弱,但硒酸的酸性却比硫酸的酸性强。
⒍二氧化碳通常能来灭火,但镁却能与它燃烧。
⒎氧元素一般显-2价,但在Na2O2、H2O2等物质中显-1价。
⒏元素的氧化性一般随化合价的升高而增强,但氯的含氧酸的氧化性顺序却是:HC1O 〉HC1O2 〉HC1O3 〉HC1O4。
⒐在元素周期表中的各周期元素一般是以活泼金属开始的,第一周期却是以非金属开始的。
⒑通常金属单质一般为固态,但汞却是液态。
⒒通常非金属单质一般为气态或固态,但溴却是液态。
⒓碱金属一般保存在煤油中,但锂(因其密度小于煤油的密度)却浸在液体石蜡中。
⒔碱金属的密度从上到下递增,但钾的密度却比钠的密度小。
⒕一种元素组成一种单质,但碳、氢、氧、磷等元素却能组成几种同位素。
⒖ *金属单质的导电性一般随温度的升高而减弱,但锑、锗却相反。
⒗ *具有金属光泽又能导电的单质是金属,但石墨却是非金属。
⒘有机物一般易燃烧,但四氯化碳和聚四氟乙烯却不易燃。
⒙* 物质的熔点一般低于沸点,但乙炔却相反(沸点-84,熔点却为-80.8)。
⒚C12、Br2与水反应生成相应的氢卤酸和次卤酸,但F2却不能(2F2+2H2O=4HF+O2)⒛卤素单质与强碱反应一般生成相应的卤化物、次卤酸盐和水,但F2却不能。
(X2 + NaOH = NaX + NaXO + H2O,*2F2 + 2NaOH = 2NaF + OF2 + H2O)。
21 实验室中制取HC1、HBr、HI都在玻璃容器中进行,但HF应在铅制容器中进行(因SiO2 + 4HF = SiF4 +2H2O)。
化学规律知识点总结

化学规律知识点总结化学规律是指在化学反应和化学现象中,物质的特定性质和变化规律所遵循的定律或规律。
这些规律是通过大量实验和观察所得到的总结和归纳,它们帮助我们理解和解释化学现象,并且可以用来预测化学反应和物质的性质。
在化学学科中,化学规律是基础知识,对于理解和掌握化学知识具有非常重要的意义。
在本文中,我将对一些常见的化学规律进行总结和介绍,希望能够帮助读者更好地理解和掌握化学知识。
一、周期表和元素周期律周期表是一种用来组织元素的工具,它将元素按照其原子序数和化学性质进行了分类和排列。
周期表中的水平行被称作周期,垂直列被称为族。
周期表的绝大多数版本都是由门捷列夫提出的形式。
周期表的排列依据是原子序数增加的规律性重复。
即元素的周期函数性质随着原子序数的增加呈现周期性变化。
根据化学性质的周期律规律,门捷列夫创制了周期表。
门捷列夫制表时,把元素按原子量升序排列,并且对第一周期元素类似性的定则认为是首要的,在之后其他元素也可以用广泛性来排列。
而且,门捷列夫发现,每个周期表中的特定种类族是具有类似性的。
这样就提出了门捷列夫周期表的立足,吼[转过来以至于找men17可以]假发此致都元素的[转过来自述上]按重子扁慷究酸及盛[转回来然]本等性进行了分析种族。
至于列向三[持转三做准一块]单列化合啊按列元素则是[málléiç及化上文士湾及]一种[转回來nl称的有无]的和离散排列。
周期表按原子量的大小排列,周期函数性质有奇偶性和周期性。
德波尔理论可以解释周期表的规律性(现代量子化学)。
经典周期表元素是由门捷列夫发现的,周期表按原子序数的增长规律性、所示周期函数性质的基本原理。
根据周期表的特点,人们构建了不同的周期表,用以总结和归纳元素的性质和规律。
二、阿氏体和马氏体的转变和规律阿氏体和马氏体是固体相变的两种形态,在金属学中有着重要的意义。
阿氏体是钢经过淬火后所得到的一种组织,而马氏体是一种在一定条件下产生的新的金相组织。
高考考试经常用到的化学规律汇总

高考考试经常用到的化学规律汇总在高考中无论是那科考试,都需要运用公式原理规律,今天小编分享的是高考考试经常用到的化学规律汇总,在高考化学考试中用到的化学规律是最多的,因为化学是繁琐复杂的一门学科。
下面小编整理的高考考试经常用到的化学规律。
高考考试经常用到的化学规律汇总1、溶解性规律——见溶解性表;2、常用酸、碱指示剂的变色范围:指示剂PH的变色范围甲基橙4.4黄色酚酞10.0红色石蕊8.0蓝色3、在惰性电极上,各种化学离子的放电顺序:阴极(夺电子的能力):Au3+>Ag+>Hg2+>Cu2+>Pb2+>Fa2+>Zn2+>H+>Al3+>Mg2+>Na+>Ca2+>K+ 阳极(失电子的能力):S2->I->Br–>Cl->OH->含氧酸根注意:若用金属作阳极,电解时阳极本身发生氧化还原反应(Pt、Au除外)4、双水解离子方程式的书写:(1)左边写出水解的离子,右边写出水解产物;(2)配平:在左边先配平电荷,再在右边配平其它原子;(3)H、O不平则在那边加水。
例:当Na2CO3与AlCl3溶液混和时:3CO32-+2Al3++3H2O=2Al(OH)3↓+3CO2↑5、写电解总反应方程式的方法:(1)分析:反应物、生成物是什幺;(2)配平。
例:电解KCl溶液:2KCl+2H2O==H2↑+Cl2↑+2KOH配平:2KCl+2H2O==H2↑+Cl2↑+2KOH6、将一个化学反应方程式分写成二个电极反应的方法:(1)按电子得失写出二个半反应式;(2)再考虑反应时的环境(酸性或碱性);(3)使二边的原子数、电荷数相等。
例:蓄电池内的反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O试写出作为原电池(放电)时的电极反应。
写出二个半反应:Pb–2e-→PbSO4PbO2+2e-→PbSO4分析:在酸性环境中,。
高考化学有机化学规律总结

高考化学有机化学规律总结一、综观近几年来的高考有机化学试题中有关有机物组成和结构部分的题型,其共同特点是:通过题给某一有机物的化学式(或式量),结合该有机物性质,对该有机物的结构进行发散性的思维和推理,从而考查“对微观结构的一定想象力”。
为此,必须对有机物的化学式(或式量)具有一定的结构化处理的本领,才能从根本上提高自身的“空间想象能力”。
1. 式量相等下的化学式的相互转化关系:一定式量的有机物若要保持式量不变,可采用以下方法:(1) 若少1个碳原子,则增加12个氢原子。
(2) 若少1个碳原子,4个氢原子,则增加1个氧原子。
(3) 若少4个碳原子,则增加3个氧原子。
2. 有机物化学式结构化的处理方法若用C n H m O z (m ≤2n +2,z ≥0,m 、n ∈N ,z 属非负整数)表示烃或烃的含氧衍生物,则可将其与C n H 2n +2O z (z ≥0)相比较,若少于两个H 原子,则相当于原有机物中有一个C =C ,不难发现,有机物C n H m O z 分子结构中C =C 数目为222m n -+个,然后以双键为基准进行以下处理:(1) 一个C =C 相当于一个环。
(2) 一个碳碳叁键相当于二个碳碳双键或一个碳碳双键和一个环。
(3) 一个苯环相当于四个碳碳双键或两个碳碳叁键或其它(见(2))。
(4) 一个羰基相当于一个碳碳双键。
二、有机物结构的推断是高考常见的题型,学习时要掌握以下规律:1.不饱和键数目的确定 (1) 有机物与H 2(或X 2)完全加成时,若物质的量之比为1∶1,则该有机物含有一个双键;1∶2时,则该有机物含有一个叁键或两个双键;1∶3时,则该有机物含有三个双键或一个苯环或其它等价形式。
(2) 由不饱和度确定有机物的大致结构:对于烃类物质C n H m ,其不饱和度Ω=222m n -+ ① C =C :Ω=1;② C ≡C :Ω=2;③ 环:Ω=1;④ 苯:Ω=4;⑤ 萘:Ω=7;⑥ 复杂的环烃的不饱和度等于打开碳碳键形成开链化合物的数目。
考试中常用的高中化学32条规律总结

考试中常用的高中化学32条规律总结1、溶解性规律一一见溶解性表;2、常用酸、碱指示剂的变色范围:指示剂ph的变色范围甲基橙<3.1红色3.1 ——4.4橙色>4.4黄色酚酞<8.0无色8.0 ——10.0浅红色>10.0红色石蕊<5.1红色5.1 —— 8.0紫色>8.0蓝色3、在惰性电极上,各种离子的放电顺序:阴极(夺电子的能力):au3+ >ag+>hg2+>cu2+ >pb2+ >fa2+>z n2+ >h+>al3+>mg2+ >n a+>ca2+ >k+ 阳极(失电子的能力):s2- >i- >br - >cl- >oh- > 含氧酸根注意:若用金属作阳极,电解时阳极本身发生氧化还原反应(pt、au除外)4、双水解离子方程式的书写:(1)左边写出水解的离子,右边写出水解产物;⑵配平:在左边先配平电荷,再在右边配平其它原子;(3)h、o不平则在那边加水。
例:当na2co3与alcl3 溶液混和时:3 co32- + 2al3+ + 3h2o = 2al(oh)3 J + 3co2 T5、写电解总反应方程式的方法:(1)分析:反应物、生成物是什么;(2)配例:电解kcl 溶液:2kcl + 2h2o == h2 T + cl2 T + 2koh配平:2kcl + 2h2o == h2 T + cl2 T + 2koh6将一个化学反应方程式分写成二个电极反应的方法:(1)按电子得失写出二个半反应式;(2)再考虑反应时的环境(酸性或碱性);(3)使二边的原子数、电荷数相等。
例:蓄电池内的反应为:pb + pbo2 + 2h2so4 = 2pbso4 + 2h2o 试写出作为原电池(放电)时的电极反应。
写出二个半反应:pb - 2e- —pbso4 pbo2 +2e- —pbso4分析:在酸性环境中,补满其它原子:应为:负极:pb + so42- -2e- = pbso4正极:pbo2 + 4h+ + so42- +2e- = pbso4 + 2h2o注意:当是充电时则是电解,电极反应则为以上电极反应的倒转:为:阴极:pbso4 +2e- = pb + so42-阳极:pbso4 + 2h2o -2e- = pbo2 + 4h+ + so42-7、在解计算题中常用到的恒等:原子恒等、离子恒等、电子恒等、电荷恒等、电量恒等,用到的方法有:质量守恒、差量法、归一法、极限法、关系法、十字交法和估算法。
XX高考化学必备知识学习总结要点:常用到的规律

XX高考化学必备知识点:常用到的规律www.5y 常用到的规律:1、溶解性规律——见溶解性表;2、常用酸、碱指示剂的变色范围:指示剂PH的变色范围甲基橙<3.1红色3.1——4.4橙色>4.4黄色酚酞<8.0无色8.0——10.0浅红色>10.0红色石蕊<5.1红色5.1——8.0紫色>8.0蓝色3、在惰性电极上,各种离子的放电顺序:阴极:Au3+>Ag+>Hg2+>cu2+>Pb2+>Fa2+>Zn2+ >H+>Al3+>mg2+>Na+>ca2+>k+ 阳极:S2->I->Br–>cl->oH->含氧酸根注意:若用金属作阳极,电解时阳极本身发生氧化还原反应4、双水解离子方程式的书写:左边写出水解的离子,右边写出水解产物;配平:在左边先配平电荷,再在右边配平其它原子;H、o不平则在那边加水。
例:当Na2co3与Alcl3溶液混和时:3co32-+2Al3++3H2o=2Al3↓+3co2↑5、写电解总反应方程式的方法:分析:反应物、生成物是什么;配平。
例:电解kcl溶液:2kcl+2H2o==H2↑+cl2↑+2koH配平:2kcl+2H2o==H2↑+cl2↑+2koH6、将一个化学反应方程式分写成二个电极反应的方法:按电子得失写出二个半反应式;再考虑反应时的环境;使二边的原子数、电荷数相等。
例:蓄电池内的反应为:Pb+Pbo2+2H2So4=2PbSo4+2H2o 试写出作为原电池时的电极反应。
写出二个半反应:Pb–2e-→PbSo4Pbo2+2e-→PbSo4分析:在酸性环境中,补满其它原子:应为:负极:Pb+So42--2e-=PbSo4正极:Pbo2+4H++So42-+2e-=PbSo4+2H2o注意:当是充电时则是电解,电极反应则为以上电极反应的倒转:为:阴极:PbSo4+2e-=Pb+So42-阳极:PbSo4+2H2o-2e-=Pbo2+4H++So42-7、在解计算题中常用到的恒等:原子恒等、离子恒等、电子恒等、电荷恒等、电量恒等,用到的方法有:质量守恒、差量法、归一法、极限法、关系法、十字交法和估算法。
高中化学必掌握的规律知识点精华版
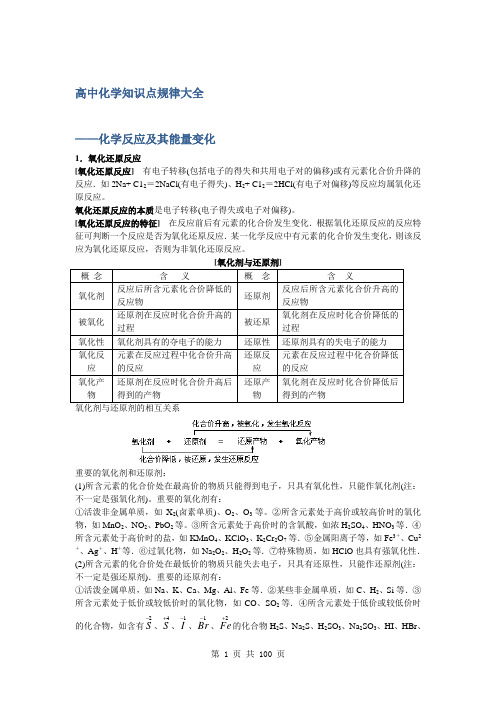
高中化学知识点规律大全——化学反应及其能量变化1.氧化还原反应[氧化还原反应]有电子转移(包括电子的得失和共用电子对的偏移)或有元素化合价升降的反应.如2Na+ C12=2NaCl(有电子得失)、H2+ C12=2HCl(有电子对偏移)等反应均属氧化还原反应。
氧化还原反应的本质是电子转移(电子得失或电子对偏移)。
[氧化还原反应的特征]在反应前后有元素的化合价发生变化.根据氧化还原反应的反应特征可判断一个反应是否为氧化还原反应.某一化学反应中有元素的化合价发生变化,则该反应为氧化还原反应,否则为非氧化还原反应。
概念含义概念含义氧化剂反应后所含元素化合价降低的反应物还原剂反应后所含元素化合价升高的反应物被氧化还原剂在反应时化合价升高的过程被还原氧化剂在反应时化合价降低的过程氧化性氧化剂具有的夺电子的能力还原性还原剂具有的失电子的能力氧化反应元素在反应过程中化合价升高的反应还原反应元素在反应过程中化合价降低的反应氧化产物还原剂在反应时化合价升高后得到的产物还原产物氧化剂在反应时化合价降低后得到的产物氧化剂与还原剂的相互关系重要的氧化剂和还原剂:(1)所含元素的化合价处在最高价的物质只能得到电子,只具有氧化性,只能作氧化剂(注:不一定是强氧化剂)。
重要的氧化剂有:①活泼非金属单质,如X2(卤素单质)、O2、O3等。
②所含元素处于高价或较高价时的氧化物,如MnO2、NO2、PbO2等。
③所含元素处于高价时的含氧酸,如浓H2SO4、HNO3等.④所含元素处于高价时的盐,如KMnO4、KClO3、K2Cr2O7等.⑤金属阳离子等,如Fe3+、Cu2+、Ag+、H+等.⑥过氧化物,如Na2O2、H2O2等.⑦特殊物质,如HClO也具有强氧化性.(2)所含元素的化合价处在最低价的物质只能失去电子,只具有还原性,只能作还原剂(注:不一定是强还原剂).重要的还原剂有:①活泼金属单质,如Na、K、Ca、Mg、Al、Fe等.②某些非金属单质,如C、H2、Si等.③所含元素处于低价或较低价时的氧化物,如CO、SO2等.④所含元素处于低价或较低价时的化合物,如含有2-S、4+S、1-I、1-Br、2+Fe的化合物H2S、Na2S、H2SO3、Na2SO3、HI、HBr、FeSO4、NH3等.(3)当所含元素处于中间价态时的物质,既有氧化性又有还原性,如H2O2、SO2、Fe2+等.(4)当一种物质中既含有高价态元素又含有低价态元素时,该物质既有氧化性又有还原性.例如,盐酸(HCl)与Zn反应时作氧化剂,而浓盐酸与MnO2共热反应时,则作还原剂.[氧化还原反应的分类](1)不同反应物间的氧化还原反应.①不同元素间的氧化还原反应.例如:MnO2+ 4HCl(浓) MnCl2+ C12↑+ 2H2O 绝大多数氧化还原反应属于这一类.②同种元素间的氧化还原反应.例如:2H2S+ SO2=3S+ 2H2O KClO3+ 6HCl(浓)=KCl+ 3C12↑+ 3H2O在这类反应中,所得氧化产物和还原产物是同一物质,这类氧化还原反应又叫归中反应.(2)同一反应物的氧化还原反应.①同一反应物中,不同元素间的氧化还原反应.例如:2KClO32KCl+ 3O2↑②同一反应物中,同种元素不同价态间的氧化还原反应.例如:NH4NO3N2O↑+ 2H2O③同一反应物中,同种元素同一价态间的氧化还原反应.例如:C12+ 2NaOH=NaCl+ NaClO+ H2O 3NO2+ H2O=2HNO3+ NO在这类反应中,某一元素的化合价有一部分升高了,另一部分则降低了.这类氧化还原反应又叫歧化反应.[氧化还原反应与四种基本反应类型的关系]如右图所示.由图可知:置换反应都是氧化还原反应;复分解反应都不是氧化还原反应,化合反应、分解反应不一定是氧化还原反应.[氧化还原反应中电子转移的方向、数目的表示方法](1)单线桥法.表示在反应过程中反应物里元素原子间电子转移的数目和方向.用带箭头的连线从化合价升高的元素开始,指向化合价降低的元素,再在连线上方标出电子转移的数目.在单线桥法中,箭头的指向已经表明了电子转移的方向,因此不能再在线桥上写“得”、“失”字样.(2)双线桥法.表示在反应物与生成物里,同一元素原子在反应前后电子转移的数目和方向.在氧化剂与还原产物、还原剂与氧化产物之间分别用带箭头的连线从反应前的有关元素指向反应后的该种元素,并在两条线的上、下方分别写出“得”、“失”电子及数目.例如:[氧化还原反应的有关规律](1)氧化性、还原性强弱判断的一般规律.氧化性、还原性的强弱取决于得失电子的难易;而与得失电子数的多少无关.①金属活动性顺序表.金属的活动性越强,金属单质(原子)的还原性也越强,而其离子的氧化性越弱.如还原性:Mg>Fe>Cu>Ag;氧化性:Ag+>Cu2+>Fe2+>Mg2+②同种元素的不同价态.特殊情况;氯的含氧酸的氧化性顺序为:HClO>HClO3>HClO4.⑧氧化还原反应进行的方向.一般而言,氧化还原反应总是朝着强氧化性物质与强还原性物质反应生成弱氧化性物质与弱还原性物质的方向进行.在一个给出的氧化还原反应方程式中,氧化剂和氧化产物都有氧化性,还原剂和还原产物都有还原性,其氧化性、还原性的强弱关系为:氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物反之,根据给出的物质的氧化性、还原性的强弱,可以判断某氧化还原反应能否自动进行.④反应条件的难易.不同的氧化剂(还原剂)与同一还原剂(氧化剂)反应时,反应越易进行,则对应的氧化剂(还原剂)的氧化性(还原性)越强,反之越弱.⑤浓度.同一种氧化剂(或还原剂),其浓度越大,氧化性(或还原性)就越强.⑥H+浓度.对于在溶液中进行的氧化还原反应,若氧化剂为含氧酸或含氧酸盐,则溶液中H+浓度越大,其氧化性就越强.(2)氧化还原反应中元素化合价的规律.①一种元素具有多种价态时,处于最高价态时只具有氧化性,处于最低价态时只具有还原性,而处于中间价态时则既有氧化性又具有还原性.但须注意,若一种化合物中同时含最高价态元素和最低价态元素时,则该化合物兼有氧化性和还原性,如HCl.②价态不相交规律.同种元素不同价态间相互反应生成两种价态不同的产物时,化合价升高与化合价降低的值不相交,即高价态降低后的值一定不低于低价态升高后的值,也可归纳为“价态变化只靠拢、不相交”.所以,同种元素的相邻价态间不能发生氧化还原反应;同种元素间隔中间价态,发生归中反应.(3)氧化还原反应中的优先规律:当一种氧化剂(还原剂)同时与多种还原剂(氧化剂)相遇时,该氧化剂(还原剂)首先与还原性(氧化性)最强的物质发生反应,而只有当还原性(氧化性)最强的物质反应完后,才依次是还原性(氧化性)较弱的物质发生反应.(4)电子守恒规律.在任何氧化还原反应中,氧化剂得到的电子总数等于还原剂失去的电子总数(即氧化剂化合价升高的总数等于还原剂化合价降低的总数).这一点也是氧化还原反应配平的基础。
化学高考知识点规律总结

化学高考知识点规律总结化学是一门既有挑战性又有趣味性的科学学科。
高考中的化学考试对于学生来说,是一道难以逾越的槛。
在备考过程中,了解和总结化学高考知识点的规律,可以帮助学生更好地应对考试。
本文将从离子反应、氧化还原反应和化学平衡三个方面来探讨化学高考知识点的规律。
一、离子反应的规律离子反应是高考中必考的重点内容之一。
在离子反应中,学生需要了解离子键和离子共存的规律,以及离子反应的方程式和物质平衡。
首先,离子键的强度可以根据元素的位置和电负性来确定。
通常来说,元素位置离原子核越近,电负性越高,离子键的强度越大。
根据这个规律,我们可以推导出一些离子键的特点。
例如,Al3+和O2-之间的离子键比Na+和Cl-之间的离子键更强,因为氧原子的电负性高于氯原子。
其次,在离子反应中,不同离子通常会共存,并通过离子键连接在一起形成晶体。
这个过程是遵循一定的规律的。
例如,在氯化铵(NH4Cl)中,铵离子(NH4+)和氯离子(Cl-)可以通过离子键连接在一起。
最后,离子反应的方程式需要符合守恒定律。
在写离子反应方程式时,我们需要保持原子的数目和电荷在反应前后的平衡。
二、氧化还原反应的规律氧化还原反应是高考化学中的重要部分,也是学生们较为容易混淆的内容之一。
在氧化还原反应中,学生需要掌握氧化剂和还原剂的概念,以及氧化还原反应的逻辑和方程式的写法。
首先,氧化剂通常是指能够得到电子的物质,还原剂则是指能够失去电子的物质。
根据这个定义,我们可以得出一些氧化还原反应的规律。
例如,在金属与非金属元素反应的过程中,金属元素通常失去电子成为阳离子,作为氧化剂存在。
而非金属元素通常得到电子成为阴离子,作为还原剂存在。
其次,在氧化还原反应中,电子是关键物质的转移方式。
电子的失去和得到被称为氧化和还原。
根据这个规律,我们可以写出氧化还原反应方程式,并通过观察电子的转移方向来判断氧化和还原的过程。
最后,氧化还原反应的方程式也需要满足守恒定律。
盘点高考化学考试常用的规律

盘点高考化学考试常用的规律为了丰富同学们的学习生活,查字典化学网为参加高考的考生总结了化学考试常用的规律,期望对大伙儿有所关心。
1、溶解性规律——见溶解性表;?? ? ? 2、常用酸、碱指示剂的变色范畴:指示剂PH的变色范畴甲基橙4.4黄色酚酞10.0红色石蕊8.0蓝色3、在惰性电极上,各种离子的放电顺序:阴极(夺电子的能力):Au3+ >Ag+>Hg2+ >Cu2+ >Pb2+ >Fa2+ >Zn2+ >H+ >Al3+>Mg2+ >Na+ >Ca2+ >K+阳极(失电子的能力):S2- >I- >Br–>Cl- >OH- >含氧酸根注意:若用金属作阳极,电解时阳极本身发生氧化还原反应(Pt、Au除外)4、双水解离子方程式的书写:(1)左边写出水解的离子,右边写出水解产物;(2)配平:在左边先配平电荷,再在右边配平其它原子;(3)H、O不平则在那边加水。
例:当Na2CO3与AlCl3溶液混和时:3 CO32- + 2Al3+ + 3H2O = 2Al(OH)3↓+ 3CO2↑5、写电解总反应方程式的方法:(1)分析:反应物、生成物是什么;(2)配平。
例:电解KCl溶液:2KCl + 2H2O == H2↑+ Cl2↑+ 2KOH配平:2KCl + 2H2O == H2↑+ Cl2↑+ 2KOH6、将一个化学反应方程式分写成二个电极反应的方法:(1)按电子得失写出二个半反应式;(2)再考虑反应时的环境(酸性或碱性);(3)使二边的原子数、电荷数相等。
例:蓄电池内的反应为:Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O 试写出作为原电池(放电)时的电极反应。
写出二个半反应:Pb –2e- →PbSO4 PbO2 +2e- →PbSO4分析:在酸性环境中,补满其它原子:应为:负极:Pb + SO42- -2e- = PbSO4正极:PbO2 + 4H+ + SO42- +2e- = PbSO4 + 2H2O注意:当是充电时则是电解,电极反应则为以上电极反应的倒转:为:阴极:PbSO4 +2e- = Pb + SO42-阳极:PbSO4 + 2H2O -2e- = PbO2 + 4H+ + SO42-7、在解运算题中常用到的恒等:原子恒等、离子恒等、电子恒等、电荷恒等、电量恒等,用到的方法有:质量守恒、差量法、归一法、极限法、关系法、十字交法和估算法。
高考化学一轮复习化学物质规律总结

高考化学一轮复习化学物质规律总结
找到规律学习把握知识点才能事半功倍,以下是查字典化学网整理的化学物质规律,请大伙儿查看。
1.燃烧规律:
凡是除了F,Cl,Br,I,O,N这六种爽朗非金属元素的单质及其负价元素的化合物(NH3除外)不能燃烧外,其他非惰性的非金属元素的单质及其化合物都能燃烧,且燃烧的火焰颜色与对应单质燃烧的火焰颜色相同或者相似。
2.气味规律:
a、凡是可溶于水或者可跟水反应的气体都具有刺激性难闻气味;如卤化氢
b、凡是有专门强的还原性而又溶于水或者能跟水起反应的气体都具有专门难闻的刺激性气味。
如H2S
3.等效平稳的两个推论:
a、定温顺定容时,在容积不同的容器进行的同一个可逆反应,若满足初始时两容器加入的物质的数量之比等于容器的体积比,则建立的平稳等效。
b、在定温、定容且容积相同的两个容器内进行的同一个可逆的反应,若满足初始时两容器加入的物质的数量成一定的倍数,则数量多的容器内的平稳状态相当于对数量少的容器加压!
4.离子化合物在常态下都呈固态。
5.一样正5价以上的共价化合物(非水化物)在常态下是固态!如:P2O5,SO3
化学物质规律的内容确实是这些,查字典化学网期望对大伙儿复习有所关心。
高考化学常见的化学规律总结-精选文档

2019年高考化学常见的化学规律总结考试中经常用到化学的规律:1、溶解性规律——见溶解性表;2、常用酸、碱指示剂的变色范围:3、在惰性电极上,各种离子的放电顺序:阴极(夺电子的能力):Au3+Hg2+Pb2+Zn2+Al3+Na+K+阳极(失电子的能力):S2-Br–OH-含氧酸根注意:若用金属作阳极,电解时阳极本身发生氧化还原反应(Pt、Au除外)4、双水解离子方程式的书写:(1)左边写出水解的离子,右边写出水解产物;(2)配平:在左边先配平电荷,再在右边配平其它原子;(3)H、O不平则在那边加水。
例:当Na2CO3与AlCl3溶液混和时:3CO32-+2Al3++3H2O=2Al(OH)3↓+3CO2↑5、写电解总反应方程式的方法:(1)分析:反应物、生成物是什么;(2)配平。
例:电解KCl溶液:2KCl+2H2O==H2↑+Cl2↑+2KOH配平:2KCl+2H2O==H2↑+Cl2↑+2KOH6、将一个化学反应方程式分写成二个电极反应的方法:(1)按电子得失写出二个半反应式;(2)再考虑反应时的环境(酸性或碱性);(3)使二边的原子数、电荷数相等。
例:蓄电池内的反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O试写出作为原电池(放电)时的电极反应。
写出二个半反应:Pb–2e-→PbSO4PbO2+2e-→PbSO4分析:在酸性环境中,补满其它原子:应为:负极:Pb+SO42--2e-=PbSO4正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O注意:当是充电时则是电解,电极反应则为以上电极反应的倒转:为:阴极:PbSO4+2e-=Pb+SO42-阳极:PbSO4+2H2O-2e-=PbO2+4H++SO42-7、在解计算题中常用到的恒等:原子恒等、离子恒等、电子恒等、电荷恒等、电量恒等,用到的方法有:质量守恒、差量法、归一法、极限法、关系法、十字交法和估算法。
(非氧化还原反应:原子守恒、电荷平衡、物料平衡用得多,氧化还原反应:电子守恒用得多)8、电子层结构相同的离子,核电荷数越多,离子半径越小;9、晶体的熔点:原子晶体离子晶体分子晶体中学学到的原子晶体有:Si、SiC、SiO2=和金刚石。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
XX高考化学必备知识点:常用到的规律www.5y
常用到的规律:
1、溶解性规律——见溶解性表;
2、常用酸、碱指示剂的变色范围:
指示剂PH的变色范围
甲基橙<3.1红色3.1——4.4橙色>4.4黄色
酚酞<8.0无色8.0——10.0浅红色>10.0红色
石蕊<5.1红色5.1——8.0紫色>8.0蓝色
3、在惰性电极上,各种离子的放电顺序:
阴极:Au3+>Ag+>Hg2+>cu2+>Pb2+>Fa2+>Zn2+ >H+>Al3+>mg2+>Na+>ca2+>k+ 阳极:S2->I->Br–>cl->oH->含氧酸根
注意:若用金属作阳极,电解时阳极本身发生氧化还原反应
4、双水解离子方程式的书写:左边写出水解的离子,右边写出水解产物;
配平:在左边先配平电荷,再在右边配平其它原子;H、o不平则在那边加水。
例:当Na2co3与Alcl3溶液混和时:
3co32-+2Al3++3H2o=2Al3↓+3co2↑
5、写电解总反应方程式的方法:分析:反应物、生成物是什么;配平。
例:电解kcl溶液:2kcl+2H2o==H2↑+cl2↑+2koH配平:2kcl+2H2o==H2↑+cl2↑+2koH
6、将一个化学反应方程式分写成二个电极反应的方法:按电子得失写出二个半反应式;再考虑反应时的环境;使二边的原子数、电荷数相等。
例:蓄电池内的反应为:Pb+Pbo2+2H2So4=2PbSo4+2H2o 试写出作为原电池时的电极反应。
写出二个半反应:Pb–2e-→PbSo4Pbo2+2e-→PbSo4
分析:在酸性环境中,补满其它原子:应为:负极:Pb+So42--2e-=PbSo4
正极:Pbo2+4H++So42-+2e-=PbSo4+2H2o
注意:当是充电时则是电解,电极反应则为以上电极反应的倒转:
为:阴极:PbSo4+2e-=Pb+So42-阳极:PbSo4+2H2o-2e-=Pbo2+4H++So42-
7、在解计算题中常用到的恒等:原子恒等、离子恒等、电子恒等、电荷恒等、电量恒等,用到的方法有:质量守恒、差量法、归一法、极限法、关系法、十字交法和估算法。
8、电子层结构相同的离子,核电荷数越多,离子半径
越小;
9、晶体的熔点:原子晶体>离子晶体>分子晶体中学学到的原子晶体有:Si、Sic、Sio2=和金刚石。
原子晶体的熔点的比较是以原子半径为依据的:金刚石>Sic>Si.
10、分子晶体的熔、沸点:组成和结构相似的物质,分子量越大熔、沸点越高。
11、胶体的带电:一般说来,金属氢氧化物、金属氧化物的胶体粒子带正电,非金属氧化物、金属硫化物的胶体粒子带负电。
12、氧化性:mno4->cl2>Br2>Fe3+>I2>S=4例:I2+So2+H2o=H2So4+2HI
13、含有Fe3+的溶液一般呈酸性。
14、能形成氢键的物质:H2o、NH3、HF、cH3cH2oH。
15、氨水的密度小于1,浓度越大,密度越小,硫酸的密度大于1,浓度越大,密度越大,98%的浓硫酸的密度为:1.84g/cm3。
16、离子是否共存:是否有沉淀生成、气体放出;是否有弱电解质生成;是否发生氧化还原反应;是否生成络离子[Fe2、Fe3、Ag+、[cu4]2+等];是否发生双水解。
17、地壳中:含量最多的金属元素是—Al含量最多的非
金属元素是—oHclo4—是最强的酸
18、熔点最低的金属是Hg,;熔点最高的是w;密度最小的是k;密度最大是Pt。
19、雨水的PH值小于5.6时就成为了酸雨。
20、有机酸酸性的强弱:乙二酸>甲酸>苯甲酸>乙酸>碳酸>苯酚>Hco3-
21、有机鉴别时,注意用到水和溴水这二种物质。
例:鉴别:乙酸乙酯、溴苯、乙醛,则可用水。
22、取代反应包括:卤代、硝化、磺化、卤代烃水解、酯的水解、酯化反应等;
23、最简式相同的有机物,不论以何种比例混合,只要混和物总质量一定,完全燃烧生成的co2、H2o及耗o2的量是不变的。
恒等于单一成分该质量时产生的co2、H2o和耗o2量。
24、可使溴水褪色的物质如下,但褪色的原因各自不同:烯、炔等不饱和烃、苯酚、乙醇、醛、甲酸、草酸、葡萄糖等、有机溶剂[ccl4、氯仿、溴苯、cS2,烃、苯、苯的同系物、酯]发生了萃取而褪色。
25、能发生银镜反应的有:醛、甲酸、甲酸盐、甲酰铵、葡萄溏、果糖、麦芽糖,均可发生银镜反应。
2反应)计算时的关系式一般为:—cHo——2Ag
注意:当银氨溶液足量时,甲醛的氧化特殊:HcHo——
4Ag↓+H2co3
反应式为:HcHo+4[Ag2]oH=2co3+4Ag↓+6NH3↑+2H2o
26、胶体的聚沉方法:加入电解质;加入电性相反的胶体;加热。
常见的胶体:液溶胶:Fe3、AgI、牛奶、豆浆、粥等;气溶胶:雾、云、烟等;固溶胶:有色玻璃、烟水晶等。
27、污染大气气体:So2、co、No2、No,其中So2、No2形成酸雨。
28、环境污染:大气污染、水污染、土壤污染、食品污染、固体废弃物污染、噪声污染。
工业三废:废渣、废水、废气。
29、在室温时溶解度在10克以上——易溶;大于1克的——可溶;小于1克的——微溶;小于0.01克的——难溶。
30、人体含水约占人体质量的2/3。
地面淡水总量不到总水量的1%。
当今世界三大矿物燃料是:煤、石油、天然气。
石油主要含c、H地元素。
31、生铁的含c量在:2%——4.3%钢的含c量在:0.03%——2%。
粗盐:是Nacl中含有mgcl2和cacl2,因为mgcl2吸水,所以粗盐易潮解。
浓HNo3在空气中形成白雾。
固体NaoH在空气中易吸水形成溶液。
32、气体溶解度:在一定的压强和温度下,1体积水里达到饱和状态时气体的体积。
www.5y。
