药物合成反应(第三版_闻韧)第五章重排反应
药物合成反应 第三版 闻韧
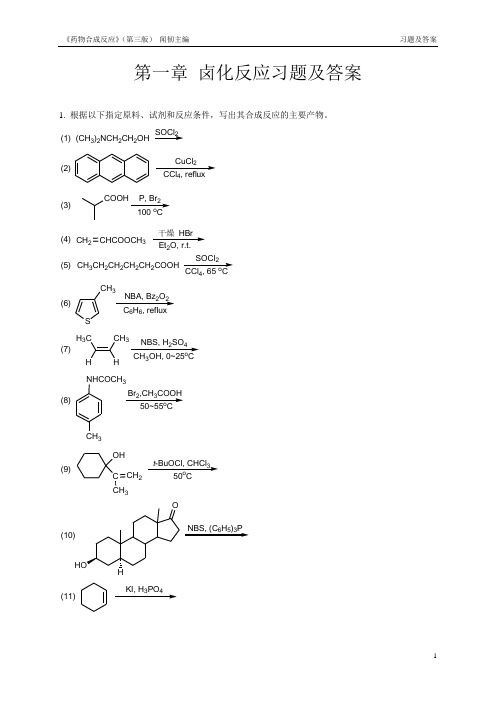
2.在下列指定原料和产物的反应式中分别填入必需的化学试剂(或反应物)和反应条件。(参考答案)
题号
答案
注释
(1)
NBS/(PhCO)2O, CCl4,△
(2)
Br2/HgO/tetrachloroethane
(3)
1. NaNO2, HCl,H2O;2.HPF6;3.△(168℃)
(4)
Ph3P,Br2,CH3CN,△(200-340℃)
第一章卤化反应习题及答案
1.根据以下指定原料、试剂和反应条件,写出其合成反应的主要产物。
SOCl2
(1)(CH3)2NCH2CH2OH
(2)
CuCl2
CCl4,reflux
(3)
COOHP,Br2
100oC
(4)CH2CHCOOCH3
干燥HBr
Et2O,r.t.
SOCl2
(5)CH3CH2CH2CH2CH2COOH
H
KI,H3PO4
(12)
C6H5H
Br2,Cl4
10~20oC
HCOCH3
(13)CH3CHCHCH3
Ca(ClO)2
CHCOOH,HO
32
(14)(CH3)3CCH2OH
HBr
100oC,封管
(15)
P
OOBr2,△
(16)
NBS, Et3N·3HF
CH2Cl2,20oC
(17)
O
EtO
O
HBr2
(11)
I
(12)
BrO
PhCH3
Br
In darkstate.
(13)
Cl
OH
WilsonC.E.J.Am.Chem.Soc.,
《药物合成反应(闻韧主编第三版)》人名反应整理

《药物合成反应(闻韧主编第三版)》人名反应整理一、卤化反应1、Hunsdriecke反应(汉斯狄克反应):羧酸银盐和溴或碘反应,脱去二氧化碳,生成比原反应物少一个碳原子的卤代烃。
2、Sandmeyer反应(桑德迈尔反应):用氯化亚铜或溴化亚铜在相应的氢卤酸存在下,将芳香重氮盐转化成卤代芳烃。
3、Gattermann反应(加特曼反应):将Sandmeyer反应条件改为铜粉和氢卤酸。
4、Schiemann反应(席曼反应):将芳香重氮盐转化成不溶性的重氮氟硼酸盐或氟磷酸盐,或将芳胺直接用亚硝酸钠和氟硼酸进行重氮化,此重氦盐再经热分解(有时在氟化钠或铜盐存在下加热),就可以制得较好收率的氟代芳烃。
二、烃化反应5、Willamson合成(威廉姆森合成):醇在碱(钠,氢氧化钠,氢氧化钾等) 存在下与卤代烃反应生成醚的反应。
6、Gabriel合成(盖布瑞尔合成):将氨先制备成邻苯二甲酰亚胺,利用氮上氢的酸性,先与氢氧化钾形成钾盐,然后与卤代烃作用,得N-烃基邻苯二甲酰亚胺,肼解或酸水解即可得纯伯胺。
7、Delepine反应(德勒频反应):用卤代烃与环六亚甲基四胺(乌洛托品Methenamine)反应得季铵盐,然后水解可得伯胺。
8、Leuckart-Wallach反应(鲁卡特-瓦拉赫反应):用甲酸及其铵盐可以对醛酮进行还原烃化,得各类胺。
9、Ullmann反应(沃尔曼反应):卤代芳烃与芳香伯胺在铜或碘化铜及碳酸钾存在并加热的条件下可得二苯胺及其同系物。
三、酰化反应10、Friedel-Crafts反应(傅列德尔-克拉夫茨反应,也称傅-克酰基化反应):羧酸及羧酸衍生物在质子酸或Lewis酸的催化下,对芳烃进行亲电取代生成芳酮的反应。
11、Hoesch反应(赫施):腈类化合物与氯化氢在Lewis 酸催化剂ZnCl2的存在下与烃基或烷氧基取代的芳烃进行反应可生成相应的酮亚胺,再经水解则羟基或烷氧基取代的芳香酮。
12、Gattemann反应(伽特曼反应):将羟基或烷氧基取代的芳烃在AlCl3、ZnCl2催化下与氰化氢及氯化氢反应生成牙胺盐酸盐,再经水解生成相应芳香醛的反应。
药物合成反应重要人名反应

药物合成反应重要人名反应Revised by BLUE on the afternoon of December 12,2020.反应:羧酸银盐和溴或碘反应,脱去二氧化碳,生成比原反应物少一个碳原子的卤代烃。
反应:用氯化亚铜或溴化亚铜在相应的氢卤酸存在下,将芳香重氮盐转化成卤代芳烃。
反应:将上面改为铜粉和氢卤酸。
反应:将芳香重氮盐转化成不溶性的重氮氟硼酸盐或氟磷酸盐,或芳胺直接用亚硝酸纳和氟硼酸进行重氮化,此重氮盐再经热分解(有时在氟化钠或铜盐存在下加热),就可以制得较好收率的氟代芳烃。
合成:醇在碱(钠,氢氧化钠,氢氧化钾)存在下与卤代烃反应生成醚。
合成:将氨先制备成邻苯二甲酰亚胺,利用氮上氢的酸性,先与氢氧化钾生成钾盐,然后与卤代烃作用,得N-烃基邻苯二甲酰亚胺,肼解或酸水解即可得纯伯胺。
反应:用卤代烃与环六亚甲基四胺(乌洛托品)反应得季铵盐,然后水解可得伯胺。
反应:用甲酸及其铵盐可以对醛酮进行还原烃化,得各类胺。
反应:卤代芳烃与芳香伯胺在铜或碘化铜及碳酸钾存在并加热的条件下可得二苯胺及其同系物。
反应:在三氯化铝催化下,卤代烃及酰卤与芳香族化合物反应,再环上引入烃基及酰基。
芳基化反应:芳基自由基可与烯反应,引致烯键的碳原子上。
反应:芳香自由基与过量存在的另一芳香族化合物发生取代反应,得到联苯。
方向自由基的来源主要有三种:最常用重氮离子的分解;其次为N-亚硝基乙酰苯胺类及芳酰过氧化物的分解反应:腈类化合物与氯化氢在Lewis酸催化剂ZnCl2的存在下与具有烃基或烷氧基的芳烃进行反应可生成相应的酮亚胺,在经水解则得具有羟基或烷氧基的芳香酮。
反应:将具有羟基或烷氧基的芳烃在三氯化铝或氯化锌催化下与氰化氢及氯化氢作用生成相应芳香醛的反应。
反应:以N-取代的甲酰胺化试剂在氧氯化磷作用下,在芳核或杂环上引入甲酰基。
反应:将酚及某些杂环化合物与碱金属的氢氧化物溶液和过量的氯仿一起加热形成芳醛的反应。
反应和Dieckmann反应:羧酸酯与另一分子具有α-活泼氢的酯进行缩合的反映称为Claisen缩合。
药物合成反应 第五章 重排反应

反应机理
O R-C-R'
+
H+
OH
OH R-C-R'
+
-H
+
OH R-C-R' O-OCR" O
R-C-R'
O R"COO-H
R R' C O
O
H O
R´重排 O-O键断裂 -H+
O R-C-OR'
O
C R"
-R´´COO- ,
R3C- > R2CH- ,
>
CH 2
>
>RCH2- > CH3-
3. 从杂原子到碳原子的重排
CH3
Cl
Cl
-
Cl
Cl
OH H+
+
+
2013-7-14
• (2)卤代烃的Wagner-Meerwein重排
CH3 CH3 C CHCH3 SN1 CH3 C CHCH3 CH3 Br CH3
CH3 C CHCH3 CH3 CH3
Stable cation
> CH2=CH
> R2CH > CH3
• (3)胺类化合物的Wagner-Meerwein重排
CH3
CH3 C CH3 CH2NH2
HNO2 - N2
CH3
CH3 C CH3 CH2
CH3
C CH3
CH2CH3
H2O -H
CH3
OH C CH2CH3 CH3
2013-7-14
CH2OH
OH
CH2NH2
(1)Claisen重排 (2)Cope重排 (3)Fischer吲哚合成
药物合成反应_第五章_重排反应

重 排
1
(CH3)3C-CH2OH
③烯烃+氢离子
-H2O H+
(CH3)3C-CH2
Wagner-Meerwein
(CH3)3C-CH=CH 2 +
Ag
(CH3)3C-CH-CH3
OCH3
H3C
Cl
④重氮盐放氮 H3C C CH2Cl (CH3)3 C-CH 3NH2 CH 3
重排的顺序:
∨
∨
CH3 CH3
CH2 CH2
莰烯
CH2
TsOH C6H6 H3C
CH3
CH3
CH3
CH2
CH3
CH3
反应机理:
重 排
1
Pinacol
邻二醇类化合物在酸催化下,失去一分子水重排生成醛或酮的反应,称为Pinacol重排。
反应机理:
R1
R2 R3 H C C R4 OHOH
R1
R2 R3 R3 1,2-迁移 C C R4 R1 C C R4 - H OH OHR2
O O OR Br Br Br Br O O O OR
重 排
4
Wolff/Arndt-Eistert
α-重氮酮在银、银盐或铜存在条件下,或用光照射或热分解都消除氮分子而重排为烯酮,
生成的烯酮进一步与羟基或胺类化合物作用得到酯类、酰胺或羧酸的反应称为Wolff重排。
反应机理:
R' C C N N O R
Ph CH3 Ph
Ph CH3 Ph C C CH3
Ac2O/ZnCl2
CH3 C O C Ph
CH3 Ph C O C Ph CH3
C
C
CH3
《药物合成反应》第5章重排反应

(CH3)3C-CH2
(c)-OH, 加 H+ (-H2O)
(CH3)3C-CH2OH (CH3)3C-CH2=CH2
H+ -H2 O H+
(CH3)3C-CH2 (CH3)3C-CH-CH3
第一节 从碳原子到碳原子的重排一Wangner-Meerwein重排
2 迁移基团迁移顺序
OCH3 Cl
>
Hofmann重排
酰胺在次卤酸盐(如Br2/NaOH)的作用下,重排后继而水解 生成少一个碳原子的伯胺。又叫霍夫曼降级。
O R C NH2
NaOX or X2/NaOH
Ar C Ar C OR
②酮的结构
O O C C G G为吸电子基时,G所在的芳环迁移(实际产物为混合物)
O O C C G OH
第一节 从碳原子到碳原子的重排
三、二苯基乙二酮-二苯乙醇酸型重排
应用实例:
OCH3 C C O O OCH3 KOH/n-BuOH/H2O 回流 OCH3 OH C COOH
COOEt
Br O
H3C Br CH 3 Br O EtO
H3C Br CH 3 O EtO
H3C Br CH 3 O OEt
H3C
Br
CH3 O COEt
H3C
C
CH3 O
COEt
第一节 从碳原子到碳原子的重排
五 Wolff重排 和 Arndt-Eistert
五 Wolff(沃尔夫)重排 Arndt-Eistert α -重氮酮重排成乙烯酮
R R R C C R OH
O Cl
R C C R
HNO2 H Cl C C Ph Ph NH2
H C C Ph
药物合成反应第五章 重排反应

重排反应中键的裂解和形成方式: 异裂(离子型) 均裂(游离基型) 环状过渡态(σ键迁移型)
离子型重排反应: 1.阴离子型重排(亲核重排)
C— A— Y Z -Y C— A Z C— A — Z
2.阳离子型重排(亲电重排)
X— B— C Y -Y X— B— C B— C X
3.游离基型重排反应: 重排反应中间体呈游离基状态
O
O COEt
*
5 0%
COEt
+ *
5 0%
*
O Ar X R
M eO Ar M eO H
OR X
-X
-
OAr R
O M eO Ar R
-
R Ar C O 2M e
M eO H
R Ar C O 2M e
• 碳负离子缺少共振稳定时 • 卤代酮羰基无可烯醇化的氢时 • 二卤代酮时
五 、Wolff(沃尔夫)重排 和Arndt-Eistert (阿恩特-埃斯特尔特)
例:
C 2H 5 C C 2H 5 Br CONH2 N a O Br H 2O
C 2H 5 C 2H 5 C O
(3)构型保持
Ph H2 H * C O N H B r 2 /N a O H C C 2 CH3 Ph H2 H * C C NH2 CH3
(4)当酰胺分子的适当位置有羟基、氨基存在时, 可以分子内成环。
HO HNO2
CH2 O
O HBr Cl C Ph C H Ph
A g N O 2 /E tO H Cl
O C
H C
Ph Ph
HO
Ph SPh
O Ph
HO O
CH3 Ph
Ph
O CH3
最新《药物合成反应(闻韧主编第三版)》人名反应整理资料

《药物合成反应(闻韧主编第三版)》人名反应整理一、卤化反应1、Hunsdriecke反应(汉斯狄克反应):羧酸银盐和溴或碘反应,脱去二氧化碳,生成比原反应物少一个碳原子的卤代烃。
2、Sandmeyer反应(桑德迈尔反应):用氯化亚铜或溴化亚铜在相应的氢卤酸存在下,将芳香重氮盐转化成卤代芳烃。
3、Gattermann反应(加特曼反应):将Sandmeyer反应条件改为铜粉和氢卤酸。
4、Schiemann反应(席曼反应):将芳香重氮盐转化成不溶性的重氮氟硼酸盐或氟磷酸盐,或将芳胺直接用亚硝酸钠和氟硼酸进行重氮化,此重氦盐再经热分解(有时在氟化钠或铜盐存在下加热),就可以制得较好收率的氟代芳烃。
二、烃化反应5、Willamson合成(威廉姆森合成):醇在碱(钠,氢氧化钠,氢氧化钾等) 存在下与卤代烃反应生成醚的反应。
6、Gabriel合成(盖布瑞尔合成):将氨先制备成邻苯二甲酰亚胺,利用氮上氢的酸性,先与氢氧化钾形成钾盐,然后与卤代烃作用,得N-烃基邻苯二甲酰亚胺,肼解或酸水解即可得纯伯胺。
7、Delepine反应(德勒频反应):用卤代烃与环六亚甲基四胺(乌洛托品Methenamine)反应得季铵盐,然后水解可得伯胺。
8、Leuckart-Wallach反应(鲁卡特-瓦拉赫反应):用甲酸及其铵盐可以对醛酮进行还原烃化,得各类胺。
9、Ullmann反应(沃尔曼反应):卤代芳烃与芳香伯胺在铜或碘化铜及碳酸钾存在并加热的条件下可得二苯胺及其同系物。
三、酰化反应10、Friedel-Crafts反应(傅列德尔-克拉夫茨反应,也称傅-克酰基化反应):羧酸及羧酸衍生物在质子酸或Lewis酸的催化下,对芳烃进行亲电取代生成芳酮的反应。
11、Hoesch反应(赫施):腈类化合物与氯化氢在Lewis 酸催化剂ZnCl2的存在下与烃基或烷氧基取代的芳烃进行反应可生成相应的酮亚胺,再经水解则羟基或烷氧基取代的芳香酮。
12、Gattemann反应(伽特曼反应):将羟基或烷氧基取代的芳烃在AlCl3、ZnCl2催化下与氰化氢及氯化氢反应生成牙胺盐酸盐,再经水解生成相应芳香醛的反应。
《药物合成反应(闻韧主编第三版)》人名反应整理(新)

《药物合成反应(闻韧主编第三版)》人名反应整理一、卤化反应1、Hunsdriecke反应(汉斯狄克反应):羧酸银盐和溴或碘反应,脱去二氧化碳,生成比原反应物少一个碳原子的卤代烃。
☆☆☆☆☆2、Sandmeyer反应(桑德迈尔反应):用氯化亚铜或溴化亚铜在相应的氢卤酸存在下,将芳香重氮盐转化成卤代芳烃。
☆☆3、Gattermann反应(加特曼反应):将Sandmeyer反应条件改为铜粉和氢卤酸。
☆☆4、Schiemann反应(席曼反应):将芳香重氮盐转化成不溶性的重氮氟硼酸盐或氟磷酸盐,或直接将芳胺用亚硝酸钠和氟硼酸进行重氮化,此重氮盐再经热分解(有时在氟化钠或铜盐存在下加热),就可以制得较好收率的氟代芳烃。
☆二、烃化反应5、Willamson合成(威廉姆森合成):醇在碱(钠、氢氧化钠、氢氧化钾等)存在下与卤代烃反应生成醚的反应。
☆☆☆☆6、Gabriel合成(盖布瑞尔合成):将氨先制备成邻苯二甲酰亚胺,利用氮上氢的酸性,先与氢氧化钾形成钾盐,然后与卤代烃作用,得N-烃基邻苯二甲酰亚胺,再经过肼解或酸水解即可得纯伯胺。
☆☆☆☆☆7、Delepine反应(德勒频反应):用卤代烃与环六亚甲基四胺(乌洛托品Methenamine)反应得季铵盐,然后水解即可得伯胺。
8、Leuckart-Wallach反应(鲁卡特-瓦拉赫反应):用甲酸及其铵盐可对醛酮进行还原烃化,得各类胺。
☆9、Ullmann反应(沃尔曼反应):卤代芳烃与芳香伯胺在铜或碘化铜及碳酸钾存在并加热的条件下可得二苯胺及其同系物。
三、酰化反应10、Friedel-Crafts反应(傅列德尔-克拉夫茨反应,也称傅-克酰基化反应):羧酸及羧酸衍生物在质子酸或Lewis酸的催化下,对芳烃进行亲电取代生成芳酮的反应。
☆☆☆☆☆11、Hoesch反应(赫施反应):腈类化合物与氯化氢在Lewis酸催化剂ZnCl2等的存在下与烃基或烷氧基取代的芳烃进行反应可生成相应的酮亚胺,再经水解则得到羟基或烷氧基取代的芳香酮。
药物合成重排反应
RR H+
RCCR
R R C CR
OH OH
OR
机理:
RR R C C R H+
OH OH
RR R C CR
OH
R R C CR
OH R
H+
R
-H+
R
R CCR
R CCR
OH R
OR
第一节 从碳原子到碳原子的重排
▲二 频纳醇重排(Pinacol)
Pinacol重排-----碳正离子1,2-迁移的立体化学
迁移基团 相同位相,同面迁移保留构型为主
终点碳原子 ①迁移基团在离去基团离子之前发生迁移构型反转
②迁移基团与离去基团邻位交叉,且碳正离子寿命很 短构型保留。
1 四取代乙二醇:
第一节 从碳原子到碳原子的重排
▲二 频纳醇重排(Pinacol)
NHTs
NHTs
NHTs
OH H
异冰片
-H
CH2
莰烯 CH2
反应实例:
第一节 从碳原子到碳原子的重排
▲一、 Wangner-Meerwein重排
Ph
CH3 OTs C CH CH3
PhH
CH3 *
H3C C C* Ph CH3 CH3
CH3 Ph C C*H CH2
H
CH3
Ph C C* CH3 CH3 CH3 +
R2
R1 R4 C C R5
H+(-H2O)
R3 OH
R1 R4 R2 C C R5
R3
重排
药物合成反应(第三版_闻韧)第五章 重排反应ppt课件

COEt * 50%
Organic Reactions for Drug Synthesis
H2 O C C CH2
R'
COOEt
H
R
H2 H CC
R'
COO Et
Organic Reactions for Drug Synthesis
b) R
H C
H C
R'
E tO O C H
R
H C
H2 C
R'
COOEt
O EtONa *
Cl -H+
OEt
O *
O -Cl *
Cl
O EtONa *
O
O
* COEt +
50%
O ref.
COOH OH
Organic Reactions for Drug Synthesis
O O
KOH
O HO
O
O HO O
HO
OH
H+
O
Organic Reactions for Drug Synthesis
OH O O
C 8H17
O
K O H /C 3H 7O H .H 2 O
C 8H17
自由基重排 周环机理重排(σ-键迁移重排)
Organic Reactions for Drug Synthesis
从碳原子到碳原子的重排 从碳原子到杂原子的重排 从杂原子到碳原子的重排 -键迁移重排
Organic Reactions for Drug Synthesis
重排反应的应用
形成C-C、C-N、C-O键 定向引入官能团 形成环状化合物
药物合成讲稿重排反应
Me COOH OH
H
H
60-70%
27
b. 碱及溶剂
所用的碱通常为KOH, NaOH等无机碱,溶剂为水或含水乙 醇。如用醇的碱金属盐为碱,反应产物为酯。
28
在药物合成中的应用
抗癫痫药苯妥英钠
29
四. Beckmann 重排 定义:醛肟(Oxime)或酮肟在酸性催化剂作用下重排 成取代酰胺的反应称Beckmann 重排。
7
Mechanism
8
反应影响因素 a. 反应物结构:凡能生成正碳离子的化合物,如醇、卤 烃、 烯烃、胺及环氧化物等
OH NHTs PPh 3 DEAD ArCO2 NHTs OPPh3 NHTs
NHTs H
ArCO2-
9பைடு நூலகம்
CH3 CH3 CH3 TsOH
CH3
CH3 CH3 H3C
CH3 CH3
Chapter 5
重排反应 (Rearrangement RXN)
By Xioawen Xue
China Pharmaceutical University 定义:指在同一分子内, 某一原子或基团从一个原子迁移 至另一个原子而形成新分子的反应。
MG A
B
A
MG B
MG(Migrating Group): 迁移基团;A及B为迁移的起点 和终点原子
1
2
分类: 根据迁移起点及终点原子之间的位置,可分为1, 2-迁 移、1, 3-迁移…… 根据迁移起点及终点原子的种类,可分为从碳原子到碳 原子的重排、从碳原子到杂原子的重排以及从杂原子到 碳原子的重排。 根据反应机理, 可分为亲核重排、亲电重排、自由基 重排及协同反应(s迁移重排)。
