高考化学大一轮复习 第八章 水溶液中的离子平衡 第28讲 水的电离和溶液的pH课件 鲁科版
高考化学一轮复习第八章 水溶液中的离子平衡

高考总复习 · 课标版 化学
课前自主回顾
课堂互动探究
课时作业
与名师对话
高考总复习 · 课标版 化学
考纲要求
考情分析
命题趋势
预计在今后的高考中, 高考对本部分知识的考 外界条件对水的电离平 1.了解水的电 查主要有两方面:①水 衡的影响仍是命题的重 离、离子积 的电离平衡及影响因素。 点。关于溶液pH的计算, 如2012年高考新课标理 常数。 题设条件可千变万化。 2.了解溶液 综11题,上海化学7题 运用正向、逆向思维, pH的定义; 等;②溶液的pH及pH 与生物酸碱平衡相结合 了解测定溶 计算,如2012年高考广 或运用数学工具(图表)进 液pH的方法, 东理综23题,浙江理综 行推理等试题在2014年 能进行pH的 12题,海南化学11题等。 高考中出现的可能性较 简单计算。 题型以选择题为主,难 大,推理性可能会有所 度适中。 增强,应予以重视。
课前自主回顾
课堂互动探究
课时作业
与名师对话
高考总复习 · 课标版 化学
(2012 年上海化学)水中加入下列溶液对水的电离平衡不产 生影响的是 A. NaHSO4 溶液 C.KAl(SO4)2 溶液 B.KF 溶液 D.NaI 溶液 ( )
课前自主回顾
课堂互动探究
课时作业
与名师对话
高考总复习 · 课标版 化学
课堂互动探究
课时作业
与名师对话
高考总复习 · 课标版 化学
2.实验操作(以标准盐酸滴定待测 NaOH 溶液为例) (1)滴定前的准备 ①滴定管:查漏 →洗涤→ 润洗 →装液→调液面→记录。 ②锥形瓶:注碱液→记读数→加指示剂。
课前自主回顾
课堂互动探究
课时作业
高考化学一轮复习第八章水溶液中的离子平衡第二节水的电离和溶液的酸碱性学案新人教版

高考化学一轮复习:第二节水的电离和溶液的酸碱性最新考纲:1.了解水的电离和水的离子积常数。
2.了解溶液pH的定义。
3.了解测定溶液pH的方法,能进行pH的简单计算。
核心素养:1.变化观念与平衡思想:认识水的电离有一定限度,是可以调控的。
能多角度、动态地分析水的电离,运用平衡移动原理解决实际问题。
2.科学探究与创新意识:能发现和提出酸碱中和滴定中有探究价值的问题;能从问题和假设出发,确定探究目的,设计探究方案,进行实验探究;在探究中学会合作,面对“异常”现象敢于提出自己的见解,进行误差分析。
知识点一水的电离1.水的电离水的电离方程式为H2O+H2O H3O++OH-,简写为H2O H++OH-。
25 ℃时,纯水中c(H+)=c(OH-)=1×10-7_mol·L-1。
任何水溶液中,由水电离出来的c(H+)与c(OH-)都相等。
2.水的离子积常数(1)水的离子积常数:K w=c(H+)·c(OH-)。
25 ℃时,K w=1×10-14,100 ℃时,K w=1×10-12。
(2)影响因素:只与温度有关,升高温度,K w增大。
(3)适用范围:K w不仅适用于纯水,也适用于酸、碱、盐的稀溶液。
(4)K w揭示了在任何水溶液中存在H+和OH-,只要温度不变,K w不变。
3.影响水电离平衡的因素(续表)判断正误(正确的打“√”,错误的打“×”)1.在蒸馏水中滴加稀硫酸和浓H2SO4,K w不变( ×)提示:滴浓硫酸时温度升高,K w增大。
2.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同( ×)提示:醋酸铵促进水的电离。
3.K w=1×10-14( ×)提示:常温时才有K w=1×10-14。
4.25 ℃时NH4Cl溶液的K w大于1×10-14( ×)提示:常温时纯水或稀溶液的K w均为1×10-14。
(全国)高考化学一轮复习第8章水溶液中的离子平衡第28讲水的电离和溶液的pH讲义新人教版
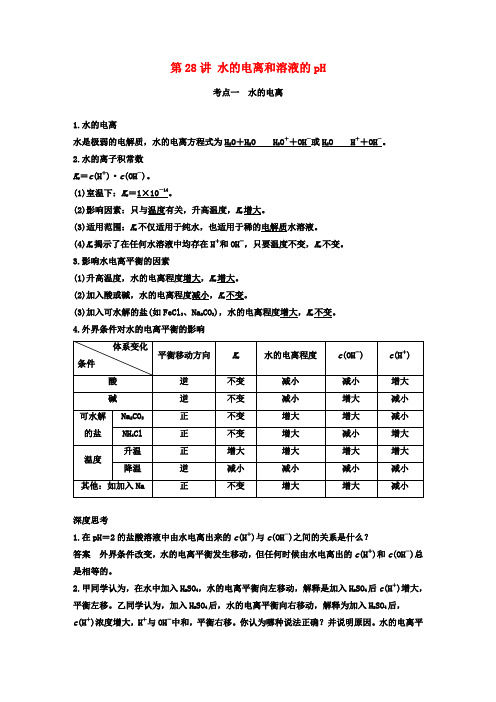
第28讲水的电离和溶液的pH考点一水的电离1.水的电离水是极弱的电解质,水的电离方程式为H2O+H2O H3O++OH-或H2O H++OH-。
2.水的离子积常数K w=c(H+)·c(OH-)。
(1)室温下:K w=1×10-14。
(2)影响因素:只与温度有关,升高温度,K w增大。
(3)适用范围:K w不仅适用于纯水,也适用于稀的电解质水溶液。
(4)K w揭示了在任何水溶液中均存在H+和OH-,只要温度不变,K w不变。
3.影响水电离平衡的因素(1)升高温度,水的电离程度增大,K w增大。
(2)加入酸或碱,水的电离程度减小,K w不变。
(3)加入可水解的盐(如FeCl3、Na2CO3),水的电离程度增大,K w不变。
4.外界条件对水的电离平衡的影响体系变化条件平衡移动方向K w水的电离程度c(OH-) c(H+) 酸逆不变减小减小增大碱逆不变减小增大减小可水解的盐Na2CO3正不变增大增大减小NH4Cl 正不变增大减小增大温度升温正增大增大增大增大降温逆减小减小减小减小其他:如加入Na 正不变增大增大减小深度思考1.在pH=2的盐酸溶液中由水电离出来的c(H+)与c(OH-)之间的关系是什么?答案外界条件改变,水的电离平衡发生移动,但任何时候由水电离出的c(H+)和c(OH-)总是相等的。
2.甲同学认为,在水中加入H2SO4,水的电离平衡向左移动,解释是加入H2SO4后c(H+)增大,平衡左移。
乙同学认为,加入H2SO4后,水的电离平衡向右移动,解释为加入H2SO4后,c(H+)浓度增大,H+与OH-中和,平衡右移。
你认为哪种说法正确?并说明原因。
水的电离平衡移动后,溶液中c(H+)·c(OH-)是增大还是减小?答案甲正确,温度不变,K w是常数,加入H2SO4,c(H+)增大,c(H+)·c(OH-)>K w,平衡左移。
c(H+)·c(OH-)不变,因为K w仅与温度有关,温度不变,则K w不变,与外加酸、碱、盐无关。
2022届《三维设计》高考一轮复习化学(人教版)精美word书稿 第八章 水溶液中的离子平衡

第八章水溶液中的离子平衡考点一| 弱电解质的电离平衡[教材学问层面]1.电离平衡的建立在确定条件下(如温度、压强等),当弱电解质电离的速率和离子结合成分子的速率相等时,电离过程达到了平衡。
2.电离平衡的特征3.外界条件对电离平衡的影响(1)内因:弱电解质本身的性质。
(2)外因:①温度:上升温度,电离平衡向右移动,电离程度增大。
②浓度:稀释溶液,电离平衡向右移动,电离程度增大。
③相同离子:加入与弱电解质具有相同离子的强电解质,电离平衡向左移动,电离程度减小。
④加入能与离子反应的物质:电离平衡向右移动,电离程度增大。
[高考考查层面]命题点1电离平衡的特点1.下列有关电离平衡的叙述正确的是()A.电离平衡是相对的、临时的,外界条件转变时,平衡就可能发生移动B.电离平衡时,由于分子和离子的浓度不断发生变化,所以说电离平衡是动态平衡C.电解质在溶液里达到电离平衡时,分子的浓度和离子的浓度相等D.电解质达到电离平衡后,各种离子的浓度相等解析:选A电离平衡是化学平衡的一种,平衡时,电离过程和离子结合成分子的过程仍在进行,分子电离成离子的速率和离子结合成分子的速率相等,各分子和离子的浓度不再变化,与分子和离子浓度是否相等没有关系,所以只有A正确。
2.在醋酸溶液中,CH3COOH的电离达到平衡的标志是()A.溶液显电中性B.溶液中无CH3COOH分子C.氢离子浓度恒定不变D.c(H+)=c(CH3COO-)解析:选C溶液中存在的电离平衡有:CH3COOH CH3COO-+H+,H2O H++OH-,阴离子所带负电荷总数与阳离子所带正电荷总数永久相等,与是否达到电离平衡无关,A错;CH3COOH是弱电解质,溶液中确定存在CH3COOH分子,B错;依据电离方程式,不管是否达到平衡,都有c(H+)>c(CH3COO-),所以D错;氢离子浓度恒定不变,电离达到平衡,所以C对。
命题点2外界条件对电离平衡移动的影响电离过程是可逆过程,可直接用化学平衡移动原理去分析电离平衡。
高中化学第八章水溶液中的离子反应与平衡第二节水的电离和溶液的pH教学课件

当滴入[16]__________标准液,溶液变色,且[17]________内不恢复原色,视为滴定达到终点并记录消耗标准液的体积。读数时,视线要[18]____________________。
(4)数据处理按上述操作重复[19]______次,求出用去标准盐酸体积的平均值,根据 _____________计算。
酸碱恰好中和时溶液不一定呈中性,最终溶液的酸碱性取决于生成的盐的性质,强酸强碱盐的溶液呈中性,强碱弱酸盐的溶液呈碱性,强酸弱碱盐的溶液呈酸性。
2.实验用品
(1)主要仪器和试剂
试剂:标准液、待测液、指示剂、蒸馏水。
(2)滴定管的使用①酸式滴定管下端为玻璃活塞,能耐酸和氧化剂的腐蚀,可用于盛装酸性或氧化性溶液,但不能盛装碱性溶液。②碱式滴定管下端为橡胶管和玻璃珠,橡胶易被酸性或氧化性溶液腐蚀,所以碱式滴定管一般盛装碱性溶液。
除 外,常见的还有 、 、 等。
3.溶液 的测定
(1) 试纸测定溶液 时,试纸不能润湿。
(2)若某溶液具有漂白性或强氧化性,则不能用 试纸测定其 。如氯水、双氧水、浓硫酸等。
技巧点拨溶液酸碱性的判断方法
1.根据 、 、 进行判断: ,溶液呈酸性; ,溶液呈中性; ,溶液呈碱性。其中: , , 。
最后半滴
半分钟
与凹液面最低处相切
(3)终点判断、读数
教材素材变式
1. 实验室用基准Na2CO3配制标准溶液并标定盐酸浓度,应选甲基橙为指示剂,并以盐酸滴定Na2CO3标准溶液。下列说法错误的是A.可用量筒量取25.00 mL Na2CO3标准溶液置于锥形瓶中B.应选用配带塑料塞的容量瓶配制Na2CO3标准溶液C.应选用烧杯而非称量纸称量Na2CO3固体D.达到滴定终点时溶液显橙色
2021版高考化学一轮复习第八章水溶液中的离子平衡2水的电离和溶液的酸碱性课件新人教版

变小
偏低
变大
偏高
无法判断
增大
c(OH-) 增大 减小 增大 增大
减小
Kw 增大 不变 不变 不变
不变
2.Ka有关计算 (1)先确定温度,常温下Kw=1×10-14。 (2)再确定溶液中H+或OH-的来源。 ①酸抑制水的电离,OH-全部来自水的电离,水电离产生的c(H+)=c(OH-)。 如0.1 mol·L-1的盐酸中c(H+)= 0.1 mol·L-1,c(OH-)=10-13 mol·L-1, 由水电离出的c(H+)= c(OH-)=10-13 mol·L-1。
3.误差分析 依据原理c(标准)·V(标准)=c(待测)·V(待测),所以
c(标准)V(标准)
c(待测)= V(待测) ,因为c(标准)与V(待测)
已确定,所以只要分析出不正确操作引起V(标准)的变化,即可分析出结果。
以标准液盐酸滴定未知浓度的NaOH溶液(酚酞为指示剂)为例,分析如下:
步骤 洗涤 取液
(3)混合型(多种溶液混合)
①酸酸混合:直接算 c(H+),再求pH 。
c (H+)混=
c1 H V1 c2 H V2 V1 V2
②碱碱混合:先算c(OH-)后转化为c(H+),再求pH
。c
(OH-)混= c1
OH
V1 c2 OH V1 V2
V2
③酸碱混合:要先看谁过量,若酸过量,求c(H+),再求pH;若碱过量,先求c(OH-),
考向二 溶液pH的计算 【考点精析】 1.定义法:pH=-lg c(H+),溶液的pH计算的核心是确定溶液中的c(H+)的大小。 具体地,酸性溶液必先确定溶液中的c(H+);碱性溶液必先确定c(OH-), 再由c(OH-)·c(H+)=Kw换算成c(H&一溶液pH的计算 ①强酸溶液 强酸溶液的pH计算方法是:根据酸的浓度先求出强酸溶液中的c(H+)然后对其取负 对数就可求得pH。 ②强碱溶液 强酸溶液的pH计算方法是:根据碱的浓度先求出强碱溶液中的c(OH-)然后利用该 温度下的Kw求出c(H+)然后求pH。
高考化学一轮复习 第8章 水溶液中的离子平衡 第2讲 水的电离和溶液的酸碱性 新人教版

5.如图表示水中c(H+)和c(OH-)的关系,下列判 断错误的是( )
A.两条曲线间任意点均有c(H+)×c(OH-)=Kw B.M区域内任意点均有c(H+)<c(OH-) C.图中T1<T2 D.XZ线上任意点均有pH=7
解析 由水的离子积的定义知两条曲线间任意点均有c(H+)×c(OH -)=Kw,A项正确;由图中纵横轴的大小可知M区域内任意点均有c(H +)<c(OH-),B项正确;温度越高,水的电离程度越大,电离出的c(H +)与c(OH-)越大,所以T2>T1,C项正确;XZ线上任意点都有c(H+)= c(OH-),只有当c(H+)=10-7 mol·L-1时,才有pH=7,D项错误。
__不__变____
__不__变____ __增__大____ __减__小____ __不__变____
水的电离 程度
__减__小____ __减__小____
___增__大___
__增__大____ __增__大____ ___减__小___
__增__大____
c(OH-)
__减__小____ __增__大____
解析 有关水的电离的题目只要牢记以下三点就能完全解决:①水 是一种极弱电解质;②水的离子积常数只与温度有关;③在任何情况中 由水电离产生的 H+和 OH-的数目一定相等。水电离出等量的 H+和 OH -,故水呈中性,A 项错;水的离子积常数是温度的函数,随着温度的 升高而增大,故 B 项错;25 ℃时无论是纯水还是稀酸和稀碱溶液中都有: c(H+)·c(OH-)=10-14,C 项错;H2O H++OH-是一吸热反应,所以 温度升高,平衡向电离方向移动,Kw=c(H+)×c(OH-),所以 Kw 增大。
高考化学一轮复习 第8章 水溶液中的离子平衡章末专题复习讲座 新人教版

表示。
(2)表达式:对于一般的可逆反应 mA(g)+nB(g) 在定温度下达到平衡时,K=ccmpCA··ccqnDB。
pC(g)+qD(g),
(3)影响因素:温度。
(4)常考题型
①平衡常数表达式的书写。
②应用平衡常数 K 判断平衡移动的方向(或放热、吸热)。
③有关计算[计算 K、转化率(或产率)、浓度]。
=60%,v(CO2)=ΔcΔCtO2=0.0160mmoiln·L-1=0.006 mol·L-1·min-1。
(3)根据勒夏特列原理,A、B、E、F 四项的条件改变不影响平衡
移动,D 项升温平衡向左移动,CO 的转化率降低,故选 C。
2.弱电解质的电离常数
(1)定义:在一定条件下达到电离平衡时,弱电解质电离形成的各
酸 HClO4
H2SO4
HCl
HNO3
Ka 1.6×10-5 6.3×10-9 1.6×10-9 4.2×10-10
从表格中判断以下说法中不正确的是( )
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中最强的酸 C.在冰醋酸中硫酸的电离方程式为 H2SO4===2H++SO24- D.水对于这四种酸的强弱没有区分能力,但醋酸可以区别这四
明平衡向左移动,故 ΔH<0。
(2)
13Fe2O3(s)+CO(g)
23Fe(s)+CO2(g)
起始/mol·L-1 0.1
0.1
转化/mol·L-1 x
x
平衡/mol·L-1 0.1-x
0.1+x
由题意得 K=00..11+ -xx=4.0,解得 x=0.06。所以 α(CO)=00..016×100%
种离子的浓度的乘积与溶液中未电离的分子的浓度之比是一个常数。
2019版高考化学一轮复习第八章水溶液中的离子平衡第28讲盐类水解课件

答案
R -+H2O (6)对于易溶于水的正盐MnRm溶液,若pH>7,其原因是_______________
知识梳理
1.定义 弱电解质 在溶液中盐电离出来的离子跟水电离产生的H+或OH-结合生成________ 的反应。
2.实质
+ H 弱酸的阴离子 ― → 结合 ― 盐电离― → → - →结合 OH 弱碱的阳离子―
增大 破坏了 水的电离平衡 ―→水的电离程度 中性
―→溶液呈碱性、酸性或
变红色的为氯化铵溶液,变蓝色的为碳酸钠溶液。
2.(1)现有0.1 mol· L-1的纯碱溶液,用 pH试纸测定溶液的 pH,其正确的
把一小块pH试纸放在洁净的表面皿(或玻璃片)上,用蘸有待测 操作是________________________________________________________
答案
解题探究
题组一 水解离子方程式的书写
1.按要求书写+ Al + 3H O Al(OH) + 3H ___________________________ 。 2 3
(2)Na2CO3溶液呈碱性
2- - - - - CO + H O HCO + OH HCO + H O H CO + OH 3 2 3 3 2 2 3 __________________________、___________________________ 。
3.特点
4.规律 有弱才水解,越弱越水解;谁强显谁性,同强显中性。 盐的类型 强酸 强碱盐 强酸 弱碱盐 弱酸 强碱盐 实例 是否水解 水解的离子 溶液的酸碱性 溶液的pH 否 ___ 是 ___
高考化学大一轮复习 第八章 水溶液中的离子平衡课件

【考情分析(fēnxī)】
电离平衡是化学平衡理论应用的范例,在化学中占有重要 的地位在历年高考(ɡāo kǎo)均受到重视,近五年的高考(ɡāo kǎo)题也承继了这个传统。
【命题(mìng tí) 角1、度根】据比较某些物质导电性强弱;
2、外界条件对弱电解质电离平衡的影响; 3、依据电离平衡移动理论,解释某些问题。
【针对(zhēnduì) 训练】
第十五页,共46页。
命题角度二
【典型 (diǎnxíng)例 题】
溶液(róngyè)酸碱性与pH的计算
第十六页,共46页。
【总结(zǒngjié) 提升】
第十七页,共46页。
【针对 (zhēnduì)训练】
第十八页,共46页。
第十九页,共46页。
第三节 盐类的水解 (shuǐjiě)
【典型 (diǎnxíng)例 题】
盐类的水解及影响因素
第二十二页,共46页。
第二十三页,共46页。
【总结(zǒngjié) 提升】
第二十四页,共46页。
【针对 (zhēnduì)训练】
第二十五页,共46页。
命题角度二
【典型 (diǎnxíng)例 题】
盐类的水解(shuǐjiě)的应用
第二十六页,共46页。
4、同浓度(或PH)强弱电解质的比较,如氢离子浓
度大小,起始反应速率,中和碱的能力、稀释后
的PH的变化等。
第三页,共46页。
命题(mìng tí)角度一 弱电解质的电离平衡 【典型 (diǎnxíng)例 题】
第四页,共46页。
【总结(zǒngjié) 提升】 1、电离(diànlí)平衡的
特征
第四十二页,共46页。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
D.1∶10∶104∶109
返回
【解析】
题号 1 2 3 考4纲要求
④中水电离出的c(H+)=1.0×10-5 mol·L-1,可得发生电离的水的物
质的量之比为:1.0×10-14∶1.0×10-13∶1.0×10-4∶1.0×10-5 =1∶10∶1010∶109。
返回
题号 1 2 3 考4纲要求
√ (1)在pH=2的盐酸溶液中由水电离出c(H+)和c(OH-)总是相等的( ) × (2)在蒸馏水中滴加浓H2SO4,KW不变( )
(3)NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相
同( ×)
(4)室温下,0.1 mol·L-1的HCl溶液与0.1 mol·L-1 的NaOH溶液中水的
25 ℃时水电离出的c(H+)或c(OH-)的5种类型的计算方法
(1)中性溶液:c(H+)=c(OH-)=1.0×10-7 mol/L (2)溶质为酸的溶液:H+来源于酸电离和水电离,而OH-只来源于 水,故有c(OH-)水=c(H+)水=c(OH-)溶液。 (3)溶质为碱的溶液:OH-来源于碱电离和水电离,而H+只来源于 水,故有c(H+)水=c(OH-)水=c(H+)溶液。 (4)水解呈酸性的盐溶液:c(H+)水=c(H+)溶液。 (5)水解呈碱性的盐溶液:c(OH-)水=c(OH-)溶液。
题号 1 2 3 考4纲要求
题组三 水电离出的c(H+)或c(OH-)的计算 3.求算下列溶液中H2O电离的c(H+)和c(OH-)。
(1)pH=2的H2SO4溶液:
c(H+)=__1_0_-__1_2_m__o__l·_L_-__1_,c(OH-)=__1_0__-_1_2_m__o_l_·L__-_1___。
___④___>__①__>__②___>__③_____。
(2)物质的量浓度相同的NaOH溶液与盐酸溶液中,水的电离程度 ___相__同_____;常温下,pH=5的NH4Cl溶液与pH=9的CH3COONa溶 液中,水的电离程度___相__同_____。(均填“前者大”“后者大”或“相 同”)
返回
(2)pH=10的NaOH溶液:
c(H+)=_1_0_-__1_0_m__o__l·_L_-__1_,c(OH-)=_1__0_-__10__m__o__l·_L_-_1___。 (3)pH=2的NH4Cl溶液: c(H+)=___1__0_-__2_m__o__l·_L_-_1___。 (4)pH=10的Na2CO3溶液: c(OH-)=___1__0_-_4__m__o_l_·_L_-_1__。
到达d点,D项错误。
返回
题号 1 2 3 考4纲要求
外界条件对水电离的影响
返回
题号 1 2 3 考4纲要求
题组二 水电离出的c(H+)或c(OH-)的定性比较
2.(1)25 ℃时,相同物质的量浓度的下列溶液中:①NaCl ②NaOH ③H2SO4 ④(NH4)2SO4,其中水的电离程度按由大到小的顺序
返回
题号 1 2 3 考4纲要求
4.25 ℃时,在等体积的①pH=0的H2SO4溶液、②0.05 mol/L的 Ba(OH)2溶液、③pH=10的Na2S溶液、④pH=5的NH4NO3溶液中, 发生电离的水的物质的量之比是( A )
A.1∶10∶1010∶109
B.1∶5∶5×109∶5×108
C.1∶20∶1010∶109
返回
考纲要求
考点二 溶液的酸碱性和pH
基础小练·多维思考 题组训练·解题探究
返回
题号 考1 纲2要求
1.判断下列溶液在常温下的酸、碱性(在括号中填“酸性”“碱性”或 “中性”)
(1)相同浓度的HCl和NaOH溶液等体积混合(中性 ) (2)相同浓度的CH3COOH和NaOH溶液等体积混合( 碱性 ) (3)相同浓度的NH3·H2O和HCl溶液等体积混合( 酸性 ) (4)pH=2的HCl和pH=12的NaOH溶液等体积混合( 中性 ) (5)pH=3的HCl和pH=10的NaOH溶液等体积混合( 酸性 ) (6)pH=3的HCl和pH=12的NaOH溶液等体积混合( 碱性 ) (7)pH=2的CH3COOH和pH=12的NaOH溶液等体积混合( 酸性 ) (8)pH=2的HCl和pH=12的NH3·H2O等体积混合( 碱性 )
返回
题号 1 2 3 考4纲要求
【解析】升温促进水的电离,升温后溶液不能由碱性变为中性,A项错误;
根据c(H+)和c(OH-)可求出KW=1.0×10-14,B项错误;
加入FeCl3,Fe3+水解溶液呈酸性,可引起由b向a的变化,C项正确;
温度不变,稀释后c(OH-)减小,c(H+)增大,但仍在该曲线上,不可能
返回
题号 考1 纲要2 求
3.甲同学认为在水中加入H2SO4,水的电离平衡向左移动,解释是加
入H2SO4后c(H+)增大,平衡左移。乙同学认为加入H2SO4后,水的电离 平衡向右移动,解释为加入H2SO4后,c(H+)浓度增大,H+与OH-中和,
平衡右移。你认为哪种说法正确?说明原因。
答案: 甲正确;温度不变,KW是常数,加入H2SO4,c(H+)增大, c(H+)·c(OH-)>KW,平衡左移。
电离程度相同( √)
返回
题号 考1 纲要2 求
(5)25 ℃和60 ℃的水的pH,前者大于后者,但都显中性( √)
(6)室温下,pH值相同的NaOH溶液与CH3COONa溶液,水的电离程
度后者大( √ )
(7)常温下,pH=5的NH4Cl溶液与pH=9的CH3COONa溶液中,水
的电离程度相同( √)
考纲要求
第28讲 水的电离和溶液的pH
考纲要求
1. 了解水的电离,离子积常数。 2.了解溶液pH的定义。了解测定溶液pH的方法。能进行pH的 简单计算。
考点一
考点二
考点三
微课28
探究高考·提升考能
考纲要求
考点一 水的电离
基础小练·多维思考 题组训练·解题探究
返回
题号 考1 纲要2 求
1.判断下列溶液在常温下的酸碱性(在括号中填“酸性”“碱性”或 “中性”)。
返回
2.填写下表:
体系变化 平衡移
ห้องสมุดไป่ตู้
条件
动方向
酸
逆
碱
逆
可水解 Na2CO3 正
的盐 NH4Cl
正
升温
正
温度
降温
逆
其他:如加入Na 正
KW
不变 不变 不变 不变 增大 减小 不变
题号 考1 纲要2 求
水的电离 程度
c(OH-)
减小
减小
减小
增大
增大
增大
增大
减小
增大
增大
减小
减小
增大
增大
c(H+)
增大 减小 减小 增大 增大 减小 减小
返回
题号 1 2 3 考4纲要求
题组一 水的电离平衡 1.一定温度下,水溶液中H+和OH-的浓度变化曲线如图。下列说法 正确的是( C ) A.升高温度,可能引起由c向b的 变化 B.该温度下,水的离子积常数为 1.0×10-13 C.该温度下,加入FeCl3可能引起由b向a的变化 D.该温度下,稀释溶液可能引起由c向d的变化
