各类化合物的合成
有机化合物的合成方法

有机化合物的合成方法有机化合物是由碳元素构成的化合物,是生命体系中的基础分子,也是合成其他有机化学物质的起始原料。
合成有机化合物的方法多种多样,下面将介绍几种常见的合成方法。
1. 双取代反应双取代反应是一种常见的合成有机化合物的方法。
该方法通过一个分子的两个官能团被另一个分子的两个官能团取代,从而合成新的有机化合物。
例如,烷烃可以通过取代反应,引入新的官能团,合成醇、酮等化合物。
2. 缩合反应缩合反应是指两个或多个分子结合形成一个较大的分子的过程。
这种反应常用于合成多环化合物或高分子化合物。
例如,通过酯的缩合反应可以合成酸酐;通过芳香醛的缩合反应可以合成苯环;通过腺苷酸的缩合反应可以合成RNA和DNA等。
3. 加成反应加成反应是将两个或多个分子的化学键破裂,形成新的化学键的过程。
这种反应常用于合成碳碳键或碳氮键。
例如,烯烃可以与氢气加成,形成烷烃;烯烃也可以与卤代烷加成,形成双官能团化合物。
4. 还原反应还原反应是指有机化合物中的氧原子被氢原子取代的反应。
这种反应可以将含氧官能团的有机化合物还原为相应的烃或醇。
例如,醛和酮可以通过还原反应生成醇;酸酐也可以通过还原反应生成醇。
5. 氧化反应氧化反应是指有机化合物中的氢原子被氧原子取代的反应。
这种反应可以将有机化合物氧化为相应的酸、醛或酮。
例如,醇可以通过氧化反应生成醛或酸;烷烃也可以通过氧化反应生成醛或酸。
6. 脱水反应脱水反应是指有机化合物中的水分子被去除的反应。
这种反应常用于合成醚或酯等化合物。
例如,醇可以通过脱水反应生成醚;酸和醇可以通过脱水反应生成酯。
7. 制备卤代烃的方法卤代烃是有机化合物中常见的一类化合物,可以通过多种方法制备。
其中一种常用的方法是通过烷烃与溴或氯发生取代反应形成卤代烃。
另一种方法是将醇与盐酸或溴化氢反应,生成相应的卤代烃。
综上所述,有机化合物的合成方法有很多种。
每种合成方法都有其特定的适用范围和反应条件。
在有机化学研究和应用中,选择合适的合成方法非常重要,能够高效合成目标化合物,并满足实际需求。
有机化合物的合成与分离

有机化合物的合成与分离有机化合物是指含有碳元素的化合物,是生命活动中必不可少的基础物质。
由于有机化合物种类繁多,所以其合成与分离技术也有很多种。
常见的有机化合物合成方式有以下几种:一、脱水缩合法脱水缩合法是指通过脱水反应使能够发生缩合的化合物发生缩合,从而得到目标化合物。
这种方法一般适用于合成酮、醛、酸、酰胺、酰脲等。
二、卤代烷和咪唑的缩合反应卤代烷和咪唑的缩合反应也是一种有机合成方法,得到的产物一般是咪唑类化合物,如咪唑类药物。
三、溴化烷和苯酚的缩合反应溴化烷和苯酚的缩合反应是有机合成中经常用到的一种方法,可以制备出苯基溴乙烷、苯基氢氧乙酮等化合物。
四、醇酸缩合法醇酸缩合法是指通过缩合反应合成酯类化合物。
将醇和酸按一定的量比在酸催化下加热,就能够得到对应的酯类产物。
这种方法是制备香料、染料等中间体的重要方法。
以上几种合成方法只是其中的一部分,每种方法都有其特殊的应用范围和适用条件,根据需要选择不同的方法进行合成。
有机化合物的分离方法主要有以下几种:一、蒸馏法蒸馏法是有机化合物分离的重要方法之一。
在蒸馏过程中,将混合产物加热,利用不同挥发度的有机化合物在一定温度下分离出来。
二、萃取法萃取法是通过对混合产物的溶解度不同进行分离的方法。
在萃取过程中,通过不同溶剂与分离物的相互作用力的差异,使其被分离。
三、结晶法结晶法是通过溶解混合产物后冷却结晶的方法进行分离。
通过调整温度和溶液浓度等条件能够使目标物质结晶出来,然后通过过滤分离出来。
总体来说,有机化合物的合成与分离需要具备较高的化学素养和实验技术,同时也需要根据实际需要选择不同的方法进行实验操作。
有机化合物在生命活动中扮演着重要的角色,其研究对于化学、生物学、医学等学科领域都具有重要的意义。
有机化学中的化合物合成方法

有机化学中的化合物合成方法有机化学是一门较为复杂的科学,其中涉及到许多基本化合物的合成方法。
化合物是由两种或多种元素以共价键或离子键相互联结而形成的,默认为由分子或离子组成。
下面我们将讨论有机化学中的化合物合成方法。
一、置换反应置换反应是一种较为广泛使用的反应,它可以将一个官能团替换成另一种官能团。
这种方法常见的应用是在卤代烃中使用,例如在溴代苯中引入一个氨基团,这种反应叫做芳香氨基化反应。
还有其他置换反应,比如称为烯酮化反应,就是使用一种化合物中的烷基团来取代酮中的一个生成物的反应。
二、加成反应加成反应是一种寻找化合物中可以进行加成反应的官能团。
一般可选用的有烯烃、炔烃和对芳烃等。
以有多重键的烯烃为例,它可以在碰上一些现有官能团时进行加成反应。
例如,烯烃与苯或水反应时,可以生成芳香族化合物或醇等。
三、还原反应还原反应是一种将酮或醛还原成醇或饱和碳氢化合物的方法。
还原反应通过还原剂来进行,这些还原剂包括氢气、金属碱金属联合体、铝格氏试剂等。
还原反应可用于用醇替代环状化合物的酮或醛官能团。
四、重排反应重排反应是有机化学中的一个重要反应,也是许多有机化合物的合成方法之一。
在发生重排反应时,发生了新键的建立和原来的分子结构的重排。
重排反应分为分子内重排和分子间重排。
分子内重排是指一个分子内发生的重排反应,而分子间重排则是指分子之间发生的重排反应。
五、缩合反应缩合反应是一种当两个碳杂环之间有一个甲烷相连时发生的反应。
在这样的缩合中,相邻的碳原子通过甲基相互连接,并且形成一个局部双键,从而导致它们的电性发生了改变。
缩合反应具有反向性极强的特征,这就意味着通常需要在一定的催化条件下才能实现。
在有机化学中,以上这些反应是构建化合物的可靠方法,化合物的结构是由中心原子与其周围的原子之间的共价键来决定。
因此,有机化学是以分子间共价键的构成和排列方式为基础的。
通过上述反应,我们可以成功地合成出许多有机化合物,帮助人类在各个领域得以更好地实践应用。
化学中的有机化合物合成方法

化学中的有机化合物合成方法有机化合物合成是化学领域的一个重要研究方向,也是有机化学家们努力探索的对象。
在这篇文章中,我将为大家介绍几种常见的有机化合物合成方法,希望能给读者带来一些启发和帮助。
一、加成反应合成法加成反应是有机化学中最常见的合成方法之一。
在加成反应中,两个或多个有机物分子通过化学键的形成而相互结合,形成新的有机化合物。
这种方法通常需要在适当的温度和条件下进行,并且需要特定的催化剂参与。
二、取代反应合成法取代反应也是有机化学中非常常见的一种合成方法。
这种反应是通过将一个原子或官能团从一个有机分子上取代下来,然后加入另一个原子或官能团,从而形成新的有机化合物。
取代反应的条件和催化剂种类各不相同,需要根据具体反应的要求进行选择。
三、酮缩反应合成法酮缩反应是有机化学中的一种重要合成方法,常用于合成具有酮官能团的有机化合物。
在酮缩反应中,一个酮官能团与一个醛官能团反应,经过缩合生成一个醇官能团,从而形成新的有机化合物。
酮缩反应通常需要催化剂参与,并且需要在适当的温度和反应条件下进行。
四、自由基反应合成法自由基反应是有机合成中的另一种常见方法,该方法常用于生成具有自由基性质的有机化合物。
在自由基反应中,自由基与其他分子反应,通过碳碳键的形成来合成新的有机化合物。
自由基反应通常需要特殊的反应条件和催化剂来控制反应的选择性和效率。
五、氧化还原反应合成法氧化还原反应是有机合成中经常使用的一种方法。
在这种反应中,一个有机分子的氧化态和还原态之间的转换可以用来合成新的有机化合物。
氧化还原反应需要特定的氧化剂或还原剂参与,并且需要在适当的条件下进行,例如温度和pH值等。
综上所述,有机化合物的合成方法有很多种,每一种方法都有其特定的适用范围和条件。
有机化学家们通过不断地研究和探索,不断发展出新的合成方法,为有机化合物的合成提供了更多的选择。
相信随着科学技术的不断进步,我们对有机合成方法的理解和应用将进一步提高,为人类社会的发展带来更大的贡献。
了解有机化合物的合成方法

了解有机化合物的合成方法有机化合物是由碳元素与氢元素及其他非金属元素的原子通过共价键相互连接而成的化合物。
在化学合成的过程中,有机化合物的合成方法至关重要。
了解不同的合成方法可以帮助化学家们有效地合成所需的有机化合物。
一、通过碳碳键的形成来合成有机化合物1. 双键加成反应(Addition Reaction)双键加成反应是指在有机化合物的双键上加入其他原子或原团,形成新的单键。
例如,乙烯与氢气发生双键加成反应会得到乙烷。
C2H4 + H2 -> C2H62. 亲电加成反应(Electrophilic Addition Reaction)亲电加成反应是指在有机化合物的双键上加入亲电试剂,形成新的化学键。
例如,苯与溴反应发生亲电加成反应会得到溴代苯。
C6H6 + Br2 -> C6H5Br + HBr3. α,β-不饱和羰基化合物的加成反应(Addition Reaction of α,β-Unsaturated Carbonyl Compounds)α,β-不饱和羰基化合物是指一个羰基官能团与一个烯烃官能团相连的化合物。
它们可以通过加成反应来合成其他有机化合物。
例如,巴耳相合成法(Baylis-Hillman Reaction)可以将α,β-不饱和醛与烯烃反应,生成β-羟基醛。
R2C=CR'COH + R''CH=CH2 -> R2C=CR'COR''CH2OH二、通过碳氢键的取代反应来合成有机化合物1. 氢的取代反应(Substitution Reaction)氢的取代反应是指有机化合物中的氢原子被其他原子或原团取代,形成新的化学键。
例如,甲烷与氯反应发生氢的取代反应会得到氯代甲烷。
CH4 + Cl2 -> CH3Cl + HCl2. 氧的取代反应(Substitution Reaction)氧的取代反应是指有机化合物中的氧原子被其他原子或原团取代,形成新的化学键。
无机化合物的合成方法

无机化合物的合成方法无机化合物是由无机物质构成的化合物,它们在日常生活和工业生产中起着重要的作用。
为了合成特定的无机化合物,科学家们利用了多种方法和技术。
本文将介绍一些常见的无机化合物合成方法。
1. 直接合成法直接合成法是最常用的无机化合物合成方法之一。
它是通过将适当的原料直接反应而形成目标化合物。
这种方法通常适用于具有高反应活性的原料或条件温和的反应。
例如,氯化钠和硫酸反应可以得到硫酸钠。
反应方程式如下:NaCl + H2SO4 -> Na2SO4 + HCl2. 氧化还原法氧化还原法是合成无机化合物的重要方法之一。
这种方法涉及到氧化剂和还原剂之间的反应,通过转移电子来形成化合物。
例如,二氧化锰和氢气反应可以得到水合氧化锰:MnO2 + H2 -> Mn(OH)23. 沉淀法沉淀法常用于合成固体无机化合物。
它通过反应产生的不溶性沉淀物形成化合物。
例如,硫酸铜和氯化钠反应可以产生氯化铜的沉淀:CuSO4 + 2NaCl -> CuCl2 + Na2SO44. 气相合成法气相合成法用于合成无机化合物的气体形式。
它通常涉及到高温和低压条件下的气体反应。
例如,氧气和氮气在高温下反应可以形成二氧化氮:2NO2 -> 2NO + O25. 溶液法溶液法是一种重要的合成无机化合物的方法,它涉及到在溶液中进行反应。
例如,硝酸钠和硫酸铜溶液反应可以产生硫酸钠和硝酸铜:NaNO3 + CuSO4 -> Na2SO4 + Cu(NO3)2总结:无机化合物的合成方法包括直接合成法、氧化还原法、沉淀法、气相合成法和溶液法等。
不同的合成方法适用于不同的化合物和反应条件。
科学家们通过这些方法不断探索和发展新的合成技术,为我们提供了丰富多样的无机化合物。
有机化学基本技能化合物的合成与表征

有机化学基本技能化合物的合成与表征有机化学是研究有机物的合成、结构、性质和反应等方面的学科。
在有机化学中,合成和表征是基本且重要的技能。
通过合成化合物,化学家可以探索新的化学反应途径,并将其应用于药物、塑料、材料科学等领域。
本文将介绍有机化学中常用的合成方法和化合物的表征技术。
一、合成方法1.1 炔烃的合成炔烃是一类重要的有机化合物,常用于有机合成和有机反应中。
炔烃的合成方法有多种,常见的包括:(1)卡宾反应:通过酸碱反应或烯烃的加成反应合成炔烃。
例如,利用活泼的亲电试剂如酮、醛或卤代烃与碱性条件下的碱金属或碱土金属生成的卡宾结合,可合成炔烃。
(2)炔基化反应:通过卤代烃与碱金属或溴化氢发生反应,生成炔烃。
1.2 脂肪醇的合成脂肪醇是一类重要的有机化合物,广泛应用于食品工业、医药工业和化妆品工业等领域。
脂肪醇的合成方法有多种,常见的包括:(1)加氢还原反应:通过氢气在催化剂的存在下对脂肪酸或酮进行加氢还原反应,生成脂肪醇。
(2)醇化反应:通过醛或酮与醇进行醇化反应,生成脂肪醇。
二、表征技术2.1 红外光谱法红外光谱法是一种常用的有机化合物表征技术,基于化合物分子与红外光的相互作用。
通过检测有机化合物在红外光谱中的吸收峰,可以确定有机化合物的结构和官能团的存在。
2.2 质谱法质谱法是一种用于有机化合物分析和表征的重要技术,通过分析化合物分子中的离子化产物来确定其分子结构和分子量。
常用的质谱技术有质谱仪和质谱图谱分析。
2.3 核磁共振法核磁共振法是通过核磁共振现象探测有机化合物的结构和官能团的存在。
通过核磁共振仪器的操作和分析,可以获得核磁共振谱图,进而确定有机化合物的结构。
三、实验操作注意事项在进行有机化合物的合成和表征实验时,需要注意以下几点:3.1 安全操作有机合成和表征涉及到有机溶剂和试剂的使用,因此需要严格遵守实验室的安全操作规程,佩戴适当的防护设备,并注意化学品的储存和处置。
3.2 实验条件在合成有机化合物时,需要注意适当的反应条件,如温度、反应时间和反应物的比例等。
化学物质的合成与制备方法

化学物质的合成与制备方法在现代化学领域,合成和制备化学物质是一个关键的研究方向。
无论是工业生产还是科学研究,都需要掌握合成和制备方法来获取所需的化学物质。
本文将介绍一些常见的化学物质合成和制备方法。
一、无机物的合成与制备方法1.溶液法溶液法是合成无机物的常用方法之一。
通过在溶液中加入适量的离子,控制温度和pH值等条件,使其发生反应生成所需产物。
例如,利用溶液法可以合成氢氧化钠、硫酸铜等无机物。
2.沉淀法沉淀法也是一种常用的无机物合成方法。
通过两种溶液中的离子发生反应形成沉淀,沉淀可以通过过滤、沉淀或离心等方式分离出来。
例如,可以通过沉淀法合成氯化铜、碘化铅等。
3.燃烧法燃烧法是合成无机物的一种重要方法。
通过将金属或者非金属元素置于氧气中进行燃烧反应,生成相应的无机物。
例如,将镁粉与氧气反应可以得到氧化镁。
二、有机物的合成与制备方法1.取代反应有机物的取代反应是合成有机物的常用方法之一。
通过将活泼的反应物(如卤代烃)与一些活泼的化合物(如碱或金属)反应,可以实现原子或者官能团之间的取代反应,从而合成目标有机物。
2.缩合反应缩合反应是一种将两个或者多个有机化合物结合成一个大分子的方法。
缩合反应通常发生在两个或者多个反应物之间的官能团上。
例如,通过缩合反应可以将酮类与胺类反应得到相应的胺类化合物。
3.氧化反应氧化反应是合成有机物的重要手段之一。
通过氧化反应,可以在有机分子中引入氧原子或者其他氧化物基团。
例如,可以通过氧化反应将醇氧化成醛或酮,将烷基化合物氧化成羧酸。
三、特殊化学物质的合成与制备方法1.高分子材料的合成高分子材料合成通常采用聚合反应,通过将单体分子进行聚合,类似于有机合成的缩合反应。
常见的高分子材料合成方法有自由基聚合、阴离子聚合和阳离子聚合等。
2.无机纳米材料的制备无机纳米材料的制备通常采用溶剂热法、溶液法等方法。
例如,通过溶剂热法可以制备金属氧化物纳米材料,通过溶液法可以制备金属纳米颗粒。
有机物的合成

有机物的合成有机物的合成是有机化学领域中的重要研究内容之一。
有机化合物是由碳原子构成的化合物,其合成方法多种多样。
本文将介绍有机物合成的一些常用方法和技术。
一、取代反应取代反应是有机物合成中常用的方法之一。
取代反应通过替换有机物中的某个官能团或原子基团来合成新的有机化合物。
常见的取代反应有醇的取代反应、卤代烃的取代反应等。
例如,醇的取代反应可以通过加入酸类催化剂使醇中的羟基(-OH)与其他反应物发生反应,从而得到新的有机化合物。
二、缩合反应缩合反应是一种将两个或多个有机物分子结合起来形成新的有机化合物的反应。
常见的缩合反应包括酯的缩合反应、醛缩合反应等。
酯的缩合反应可以通过酸催化或酶催化来实现,反应条件温和,适用于合成多种有机物。
醛缩合反应则是通过醛与缩合试剂(如胺类化合物)反应形成醛缩合物。
三、氧化还原反应氧化还原反应是有机物合成中常用的重要手段之一。
氧化反应是通过氧化剂使有机物中的某个官能团氧化生成新的有机化合物,还原反应则是通过还原剂使有机物中的某个官能团还原生成新的有机化合物。
常见的氧化还原反应有醇的氧化、醛的还原等。
氧化还原反应具有反应条件温和、产率高的特点,在有机物的合成中具有重要的应用价值。
四、环化反应环化反应是将直链有机化合物通过内部原子或官能团的连接而形成环状结构的反应。
环化反应是有机化学中非常重要的反应类型,常用来合成环状有机化合物。
例如,烯烃的环化反应可以通过加热或催化剂的存在使烯烃中的碳碳双键发生“内部反应”,从而生成环状化合物。
环化反应的研究和应用在有机物合成领域具有重要的意义。
五、催化反应催化反应是指在反应过程中存在催化剂参与的反应。
催化剂可以加速反应的进行,减少反应所需要的能量,提高反应的产率和选择性。
常见的催化反应包括氢化反应、醇醚化反应等。
氢化反应是通过氢气在催化剂的作用下与有机物反应生成相应的氢化产物,催化剂可以是金属催化剂如铂、钯等。
醇醚化反应是通过催化剂的存在使醇与醚反应生成醚类化合物。
专题1 有机化合物的合成
例1、设计的合成路线。
例2、设计的合成路线
例3、设计的合成路线
例5、设计 的合成路线。
例6、由苯酚合成
例7、设计 的合成路线
例8、用C3化合物合成
例9、由苯合成对溴乙苯
例10、由苯合成对硝基苯甲酸。
例11、由苯合成间硝基苯乙酮。
例12、由C2化合物合成叶醇
练习题
1、由指定原料及其他必要的无机及有机试剂合成下列化合物:
CH3(CH2)5CH2C≡CCH2OHCH3(CH2)5CH2C≡CCH2C≡CCH2OH
B C
CH3(CH2)11CH2OH
D E
(1)用反应式表示由电石和甲醛以及必要的无机试剂为原料制备A的各步反应,并注明必要的反应条件。
(2)用系统命名法命名化合物B,C,D。
(3)以乙烯、丙烯、乙炔、化合物A以及必要的无机试剂为原料合成B和C,以反应式表示。
(2)引入一种基团,这种基团具有一定的定位作用,待第二基团引入后,再除去这种基团,例如由苯合成间二溴苯。
(3)当用取代苯作为起始物时,可通过改变起始物取代基转化的先后顺序来决定最终产物分子中基团的相对位置,例如由甲苯合成硝基苯甲酸。
在将两个基团引入到苯环上时,应考虑以下两个问题:
(1)在有选择余地时,首先引入最强的致活基团或最弱的致钝基团进入苯环。
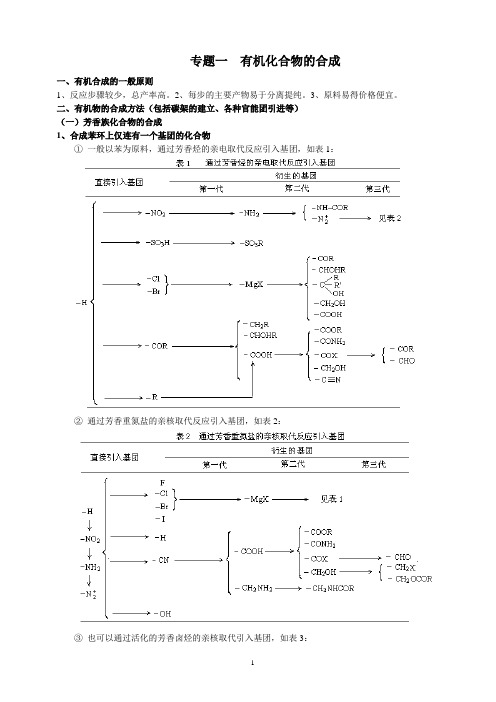
专题一有机化合物的合成
一、有机合成的一般原则
1、反应步骤较少,总产率高。2、每步的主要产物易于分离提纯。3、原料易得价格便宜。
二、有机物的合成方法(包括碳架的建立、各种官能团引进等)
(一)芳香族化合物的合成
1、合成苯环上仅连有一个基团的化合物
①一般以苯为原料,通过芳香烃的亲电取代反应引入基团,如表1:
典型化合物的合成与表征方法

典型化合物的合成与表征方法合成化学是现代化学研究的重要分支,它致力于合成各种化合物以满足人类社会的需求。
典型化合物是指具有一定特征的化合物,通常是某个领域研究的典型代表。
本文将讨论典型化合物的合成与表征方法。
一、合成方法合成化合物的基本原则是通过化学反应,将不同的化学物质以特定的方式结合在一起形成新的化合物。
合成方法可以分为几种常见的类型。
1.1 氧化还原反应氧化还原反应是一类非常常见的反应类型,常用于合成各种化合物。
其中,还原剂将氧化剂与某个物质反应,将其氧化为目标产物。
例如,合成过氧化氢时,氢氧化钠与过氧化氢反应,生成目标产物过氧化氢。
1.2 酸碱反应酸碱反应是指酸和碱互相中和产生盐和水的反应。
酸和碱在化合物合成中起着重要作用,常用于合成盐类化合物。
例如,将硝酸和氢氧化钠反应,生成硝酸钠和水。
1.3 置换反应置换反应是指化合物中一个原子或基团被另一个原子或基团取代的反应。
置换反应是合成有机化合物的常见方法。
例如,利用取代反应可以合成醋酸乙酯,乙醇和醋酸反应生成目标产物醋酸乙酯。
二、表征方法合成化合物后,需通过一系列方法对其进行表征以确定其结构和性质。
下面介绍几种常见的表征方法。
2.1 元素分析元素分析是一种定性和定量分析化合物中元素成分的方法。
通过测量样品中各个元素的质量变化,可以确定元素的含量。
例如,通过元素分析可以确定合成的有机化合物中碳、氢、氮、氧等元素的含量。
2.2 红外光谱红外光谱是一种分析化合物结构的方法。
化合物吸收特定波长的红外辐射,产生特征的吸收峰。
通过分析这些吸收峰的位置和强度,可以确定化合物的结构。
例如,利用红外光谱可以确定有机化合物中的官能团,如羟基、羰基等。
2.3 核磁共振核磁共振是一种用于确定化合物结构的重要方法。
通过测量样品中原子核在外加磁场下的共振现象,可以获得关于化合物中原子核位置和环境的信息。
例如,通过核磁共振可以确定有机化合物的碳谱和氢谱,以及它们与周围基团的关系。
化合物的制备方法

化合物的制备方法化合物的制备方法包括物理方法和化学方法两种。
物理方法主要是通过物质的物理性质来制备化合物。
例如固体混合物可以通过重力分离、筛选、浮选等方法分离出其中的组分;气体混合物则可以通过分离漏斗、冷凝、蒸馏等方法得到纯净气体。
此外,还可以通过沉淀、溶解、沉淀回收等方法制备晶体。
化学方法主要是通过化学反应来制备化合物。
常见的化学反应包括酸碱中和反应、氧化还原反应、置换反应、加成反应等。
具体的制备方法与所要制备的化合物有关,下面以几种常见的化合物为例进行讨论。
首先,以氢氧化钠(NaOH)为例。
氢氧化钠可以通过氢氧化钠的固体与水反应得到。
反应式为:NaOH(s) + H2O(l) →Na+(aq) + OH-(aq)。
此反应是一个化学反应,产生的是水溶液。
其次,以醋酸(CH3COOH)为例。
醋酸可以通过碳酸钠(Na2CO3)和醋酸的酸碱中和反应制备。
反应式为:Na2CO3(aq) + 2CH3COOH(aq) →2CH3COONa(aq) + CO2(g) + H2O(l)。
此反应是一个酸碱中和反应,产生的是水溶液和气体。
再次,以二氧化硫(SO2)为例。
二氧化硫可以通过硫和氧的氧化还原反应得到。
反应式为:S(s) + O2(g) →SO2(g)。
此反应是一个氧化还原反应,产生的是气体。
此外,还有很多其他的化合物制备方法。
例如,可以通过氧化铜(CuO)和氢气(H2)的加热反应制备金属铜(Cu):CuO(s) + H2(g) →Cu(s) + H2O(g)。
可以通过乙烯(C2H4)和溴(Br2)的加成反应制备1,2-二溴乙烷(C2H4Br2):C2H4(g) + Br2(l) →C2H4Br2(l)。
可以通过氢氟酸(HF)和氟化钠(NaF)的置换反应制备氟化氢(HF):HF(aq) + NaF(aq) →HFP(aq) + NaF(aq)。
当然,这里只是举了几个例子,实际上化学反应的种类和方法非常多,每种反应都有其特定的条件和适用范围。
有机化学中的化合物合成

有机化学中的化合物合成有机化学是研究碳和其它元素组成的化合物的学科,是化学中的重要分支。
有机化学中的合成化学是一种重要的实验方法。
化合物的合成,既是化学研究的基础,也是制备新型化合物的关键。
在合成化学中,合成新化合物的方法和工艺,计算机辅助设计成为了一种常用的工具。
今天,我们就来介绍一下有机化学中的化合物合成。
一、碳-碳键形成的方法碳-碳键的形成是有机合成中非常重要的一部分。
常用方法有三种:格氏反应、Michael加合反应、Wittig反应,下面分别来介绍。
1.格氏反应格氏反应是碳-碳键形成的一种方法。
格氏反应通过酮肟/烯醇肟生成中间体,再与醛/酮发生缩合反应,生成稠环或杂环化合物。
由于格氏反应方式选择多、反应适合性广、合成成本低,使得目前格氏反应在有机合成中得到大量应用。
2.Michael加合反应Michael加合反应是利用质子酸催化剂或光引发剂的钯催化下的Michael加合反应。
Michael加合反应可以以酰亚胺、酸、酯等形式发生;另外,Michael加合反应也可以以具有羰基的化合物为受体,以含有双键的活性丙烯酸酯作为供体,在卤代烷-碱-催化剂体系中进行。
Michael加合反应简单、反应条件温和、通过基底和电子控制选择地生成包含杂环分子的多样性化合物。
3.Wittig反应Wittig反应是利用含有烷基或芳香基的膦化合物与醛/酮反应生成油状物。
这种反应方式特别是在前期合成耐心罕见的具有生物活性(如广谱发展抑制剂和丝裂原抑制剂等)的天然物质或具注射性的分子时,受到了极大的关注。
二、取代反应取代反应是有机化学中常见的化合物合成方法。
取代反应常用于产生一种新的化合物以改善原有化合物的性质,比如增加某些功能基团或改变某些基团的位置。
取代反应有许多种,以下介绍两种:亲核取代和电子亲加反应。
1.亲核取代反应亲核取代反应是指由亲核试剂引发的取代反应。
亲核试剂多是具有阴离子性和非电子亲和力的化合物(例如氨、水等)。
化学物质的合成方法

化学物质的合成方法化学物质的合成方法是化学研究的重要组成部分,通过各种实验和反应过程,人们可以合成出各种有用的化合物和材料。
本文将介绍几种常见的化学物质合成方法。
一、酸碱中和法酸碱中和法是一种常见的合成方法,通过酸与碱之间的反应生成盐和水。
这种方法常用于合成无机盐类,例如氯化钠、硫酸铜等。
举例来说,要合成氯化钠,可以将氯气通入含有氢氧化钠的溶液中,反应生成氯化钠和水。
二、氧化还原法氧化还原法是合成化学物质的重要手段,其中涉及电子的转移。
在这种反应中,氧化剂会从反应物中接收电子,而还原剂则会向反应物中释放电子。
氧化还原反应可以合成各种有机化合物和无机盐。
例如,过氧化氢可以与氯化银反应,生成氯化银和水。
三、酯化反应酯化反应是有机合成中常见的一种方法,通过酸和醇之间的反应生成酯。
这种反应通常需要使用催化剂,例如硫酸或者盐酸。
举个例子,若要合成甲酸甲酯,可以将甲酸和甲醇加入反应瓶中,加入少量硫酸作为催化剂,经过适当的反应条件,即可得到甲酸甲酯。
四、置换反应置换反应是一种将官能团A置换为官能团B的反应,这在有机合成中非常常见。
常用的置换反应包括氯代烷烃的取代反应、芳香化合物的硝基取代反应等。
例如,若要合成硝基苯,可以将苯溶于硝酸中加热,反应生成硝基苯和水。
五、加成反应加成反应是有机合成中的重要手段之一,常用于合成烯烃、炔烃等有机化合物。
在此类反应中,通常通过向烯烃或炔烃中加入其他反应物,将其转化为更复杂的化合物。
例如,若要合成乙烯醇,可以将乙烯与水加热至高温,反应生成乙烯醇。
综上所述,化学物质的合成方法多种多样,每种方法都有其适用的反应条件和催化剂。
化学研究者们通过这些方法可以合成出各种有机化合物、无机盐和材料,为科学研究和工业生产做出了巨大贡献。
随着科学技术的不断发展,相信将会有更多高效、环保的合成方法被开发出来,推动化学领域的进一步发展。
大学化学有机化合物的合成方法

大学化学有机化合物的合成方法随着化学科学的发展,有机化合物的合成方法也日益多样化和精细化。
本文将介绍大学化学中常见的有机化合物合成方法,帮助读者深入了解并掌握这一领域的知识。
一、羰基化合物的合成方法羰基化合物是一类具有碳氧双键的有机化合物,常见的代表有酮和醛。
羰基化合物的合成方法主要有以下几种:1. 氧化法:通过氧化反应,将含有亲电性碳原子的化合物氧化为相应的羰基化合物。
常用的氧化剂有酸性高锰酸钾(KMnO4)、过氧化氢(H2O2)等。
2. 衍生化法:通过对其他含羰基的化合物进行衍生反应,得到所需的羰基化合物。
常见的衍生化反应有酯化反应、醛酮反应等。
3. 华夫曼反应:通过华夫曼重排反应,将酰胺转化为相应的醛或酮。
此反应常用于合成芳香酮化合物。
4. 化学还原法:通过化学还原反应,将酸酐或酰氯还原为醛或醇。
常用的还原剂有亚硫酸盐(如NaHSO3)、硼氢化钠(NaBH4)等。
二、取代反应合成方法取代反应是有机化学中常见的一类合成方法,通过取代反应可以引入特定的官能团到有机分子中。
常见的取代反应有以下几种:1. 卤代烷的取代:将卤代烷与亲核试剂反应,发生亲核取代反应,引入不同的官能团。
常见的亲核试剂有氰化物、水、醇等。
2. 烯烃的加成反应:通过烯烃的加成反应,将烯烃与其他化合物反应,形成新的化学键。
常见的加成反应有羰基加成反应、环氧化反应等。
3. 键断裂反应:通过键断裂反应,将有机化合物分解为两个或多个小分子。
常见的键断裂反应有酯水解、烷基化反应等。
4. 金属有机化合物的取代反应:金属有机化合物是有机金属化学的重要领域,通过金属有机化合物的取代反应可以引入复杂结构的有机官能团。
常见的金属有机化合物有有机锂化合物、有机铜化合物等。
三、环化反应合成方法环化反应是有机化学中一类重要的合成方法,通过环化反应可以形成环状的有机化合物。
常见的环化反应有以下几种:1. 羰基化合物的缩合反应:通过羰基化合物的缩合反应,可以形成环状的羰基化合物。
化合物库的合成方法

化合物库的合成方法以下是 7 条关于化合物库的合成方法:1. 溶剂热合成法呀,就好像是厨师在高压锅里炖出美味佳肴一样!你想想看,把各种原料丢进去,在特定的溶剂里,高温高压下发生奇妙反应,最后就得到我们想要的化合物啦!比如说合成某种新型的纳米材料化合物库。
2. 固相合成法呢,这有点像搭积木呀,一块一块地拼起来。
我们把反应物固定在固相载体上,然后通过一系列反应逐步搭建起化合物的大厦。
不信你看那些多肽化合物库不就是这样合成出来的么!3. 乳液合成法呀,哇哦,这就如同搅拌奶油做出香甜的蛋糕糊一样。
让反应物在乳液体系中均匀分散并反应,从而形成丰富多样的化合物。
很多高分子化合物库不就是通过这种有趣的方法合成的嘛!4. 微波辅助合成法,嘿,这可神奇了!就好比用微波炉快速加热食物一样,迅速而且高效。
它能大大缩短反应时间,让化合物库的合成变得快捷无比。
一些复杂的有机化合物库在它的帮助下很快就能诞生啦!5. 电化学合成法呀,这不就像是给化学反应通上了电一样刺激嘛!利用电化学反应来合成化合物,那感觉太奇妙啦!金属配合物化合物库不就经常通过这种酷的方式来合成嘛!6. 模板合成法,哎呀呀,这就好像是按照模具来塑造东西一样精准。
有了特定的模板,就能引导反应物有序地进行反应,生成特定结构的化合物库。
比如那些具有规整结构的多孔化合物库。
7. 组合合成法呀,哇塞,这绝对是个大绝招!就像玩拼图游戏一样,把各种可能的反应物组合起来,能得到超多不同的化合物。
想想那些海量的小分子化合物库,不就是通过这种疯狂的方式搞出来的嘛!我的观点结论就是:化合物库的合成方法真是五花八门、各有奇妙,每一种都值得我们深入去探究和运用呢!。
chapter2 各类化合物的制备方法

C CH2CH2CHO CH3 O ClCH2CH2CH O
CLCH2CH2CHO + HOCH2CH2OH
Mg/Et2O
HCl(干)
ClMgCH2CH2CH
O O
用不超过4个碳原子的原料合成
O
Br O
Br
OH MgBr O Br
醛、酮的制备
1.氧化或脱氢法 2.炔烃水化 RCCR’
RCH2CH=CH2 O3 RCH2C
R α C R H
2.脱卤素
β C X
C X
R R
KOH/C2H5OH
Or 20% H2SO4,heat
R R C C
R R
+ HX
C X
+ Zn
C
C
+ ZnX2
二、还原
RC
CH
Na / 液氨 RCH=CH2(反 式) H2/Lindlar RCH=CH2 (顺式)
三、从醛酮合成烯烃的好方法
Witting
+
RCH2OH RCH2CH2OH R R' CHOH
R R' C R''
OH
苯和C3以下的有机物为原料合成
CH3 C OH CH2CH2CHO
O + CH3C Cl OMgCl
AlCl3
O CCH3
O ClMgCH2CH2CH O
OH O
H2O
C CH2CH2CH O CH3
C CH2CH2CHO CH3 O ClCH2CH2CH O
4. 5.
格氏试剂合成法 羰基化合物的还原 一章) (醛、酮
Oxymercuration-demercurataion
有机化合物的合成方法

有机化合物的合成方法引言有机化合物合成是有机化学的核心内容之一。
它涉及到将不同的化学物质通过化学反应转化为目标有机化合物的过程。
合成方法的选择对于产生高产率和高纯度的有机化合物至关重要。
常用的合成方法1. 反应物转化法反应物转化法是最常用的有机化合物合成方法之一。
它涉及将一个或多个反应物通过化学反应转化为目标有机化合物。
例如,酯化反应是一种常见的反应物转化法,通过醇和酸反应生成酯。
2. 功能团转化法功能团转化法是有机合成中另一个重要的方法。
它涉及到对已有的有机化合物中的功能团进行化学转化来得到目标有机化合物。
例如,氧化还原反应可以将醛转化为相应的羧酸。
3. 环化反应环化反应是一种合成环状有机化合物的常用方法。
它涉及将分子内的某些原子以特定的方式连接起来形成环状结构。
例如,烯醇分子通过加热可以发生脱水反应形成环戊烯。
4. 合成固相化学方法合成固相化学方法是一种特殊的合成方法,广泛应用于有机化合物的合成中。
它涉及将反应物固定在固体材料上,利用反应物与固体材料间的相互作用进行化学反应。
例如,固相合成法可以用于合成肽类化合物。
结论有机化合物的合成方法多种多样,根据具体需要选择合适的方法非常重要。
反应物转化法、功能团转化法、环化反应以及合成固相化学方法都是常见的合成方法。
通过选择合适的方法,可以高效地合成出想要的有机化合物。
参考文献:- Smith, M.B.; March, J. March´s Advanced Organic Chemistry: Reactions, Mechanisms, and Structure. 7th ed. Wiley, 2013.- Li, J.J. Name Reactions: A Collection of Detailed Mechanisms and Synthetic Applications. Springer, 2006.。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH2
CHCH2OH + HCl
C6H5CH2Br + H2O
NaOH
C6H5CH2OH + HBr
2.醛或酮的还原
(1)催化还原
醛或酮分子中的羰基,在Pt、Ni等存在下催化加氢成为羟基。
R2C
O
LiAlH 4 H
2
or NiH or Pt 2,Ni
R2CHOH
(2)Meerwein-Ponndorf-Verly还原
CH3
Pd CH3 Pd O CH3 H2H 2 2 C 2H ethyl 5OHacetate - + CH Br 3 C Na CH3CHC (298K,1atm) CH3CHC (-NaBr) O
C
CH3
环壬炔-6-酮
2. 烯烃硼氢化-质子化:
CH3 CH3CH2CH2C=CH2 (1) BH3:THF (2) CH3COOH, heat CH3 CH3CH2CH2CHCH3
R R
C
O
Zn-Hg HCl
R R
CH2
此法对芳酮较好,对酸敏感的醛或酮不能使用,这时可
使用黄鸣龙法,两种方法互为补充。
O CCH3
Zn-Hg,HCl
Δ
CH2CH3
4. 羰基间接还原成亚甲基
烷烃的反应
烷烃的反应活性较低,在光照或加热条件下,能与卤素 发生卤代反应。 氯代 烷烃的氯代反应是按游离基历程(机理)进行的
CH3 CH3 C CH2
H H 22
Ni Pd CC 2H 5OH 2H 5OH (298K,1atm) (298K,50atm)
CH3 CH3 C CH2 H H
O NaNH2 CH3CHC CH (-NH3) 环壬炔-6-酮 CH3 Pd O 2H2 excess H2 ethyl acetate Pt, pressure CH3CHCH2CH2CH3
第一节、烷烃的制备
一.偶联反应 1. Wurtz(武慈)合成法:
2. 卤代烷与二烷基铜锂的偶联 [科瑞(E.J.Corey)- 郝思(H.House)反应]
3.格氏(V.Grignard)试剂法
R'X:为饱和卤代烃时,产率不太高
4.柯尔伯法(Kolbe) H.Kolbe
(1818-1884)于1849年将高浓度的羧酸钠盐或 钾盐溶液进行电解,在阴极产生烷烃。
4. 醛酮的-H的卤化
在酸或碱的催化作用下,醛酮的-H被卤素取代的反应。
O C CH
酸或碱
O C CBr
Br2
+ HBr
酸催化的反应机理
O CH3CCH3 +
+
H+
快
OH
OH CH3C CH2 H
+
-H, 慢
CH3CCH3
+
OH CH3C=CH2 Br-Br
OH -HBr Br-CH2CCH3 + Br-
可用简式表示为
R X Zn,HX (-ZnX2) R H
其反应机理可能是:
Zn + R X
2+ .. R Zn X ..
HX
R H Zn
2+
.. 2 X ..
卤化烷基锌
•
具体实例如
2CH3CH2CHCH3 HBr Zn Br 2CH3CHCH2CH2 CH3 Br 2CH3CH2CHCH3 H HBr Zn 2CH3CHCH2CH2 CH3 H ZnBr2
第三节、炔烃的制备
RMgX
CH3CH2C CMgX CH3CH2C CNa CH3CH2CCLi R’ X
R’X
NaNH2
C2H5C CR’
RLi
R’X
*叁键无法移位时,产物是唯一的。
3. 炔化物的异构化
KOH CH3CH2C CH CH3C
LiHN(CH3)2NH2 Bu OK
t
丙酮
由于 NaI 能溶于丙酮,而反应后生成的 NaCl 或 NaBr 不溶于丙酮,使反应的平衡向生成物方向移动。
制取氟代烃的常用方法,也是通过卤素互换。
Cl NO2 NO2 + HF
硝基苯 180 ~ 195 ℃
F NO2 NO2
CCl4 + 2HF
SbCl5 110 ℃ , 300atm
F F C Cl Cl + 2HCl
R
C
C
R
LiAlH4 Na/NH3(l)
H
R C H C
H ER
7.
8. Wittig试剂和醛酮反应
R'2C O + (C6H5)3P
+
CR2
-
R'2C
CR2+(C6H5)3P
O
反应历程:醛或酮和磷叶立德发生亲核加成后再消除,
生成烯烃。
Ph3P O
+
+
CR2 CR'2
-
Ph3P O
-
+
CR2 CR'2
CHR' + KX + H2O
Br CH3CCH3 CH3
CH3CH2ONa/EtOH 55oC
CH2 CCH3 + H2O + NaBr CH3
X = F , Cl / Br / I , S Me2 , N Me3 , RCOO , ROCSO , RSCSO
+
+
3. 邻二卤代烷脱卤素
Br Br CH3CHCHCH3
H H
原因是生成腙时,同时生成了水,水的存在促进了逆反应。
R R
C O + NH2 NH2
R R
C N NH2+ H2O
黄鸣龙改进:加入高沸点溶剂,使水和过量的肼蒸出, 能在常压下进行,缩短了反应时间,提高了产率。
O CCH2CH3
NH2NH2,NaOH 二缩乙二醇
CH2CH2CH3
Clemmensen 还原法:醛或酮和锌汞齐、浓盐酸一起 加热,可将羰基还原成亚甲基。
R
CH
CH
CH 2
CH2
HBr H2O2
Br2
R
R
CH2
CH Br
CH2Br
CH2 Br
反马规则
反式加成
例2
用少于或等于4个碳的原料合成
Br HC Cl Cl CH Br CH3 CH3
(3) 芳烃的氯甲基化
芳烃和甲醛、氯化氢在无水ZnCl2或无水AlCl3等存在下,
进行反应,可以直接在芳环上导入氯甲基。
CH3 + CH3 Cl + CH4 Cl
H 过渡态
CH3
CH3 + HCl
第二节、烯烃的制备
烯 烃 的 主 要 合 成 反 应
第二节、烯烃的制备 一、消除反应
1. 醇脱水
CH3CH2OH
OH CH3CHCH3 CH3
H2SO4, 50oC
H2SO4, 170oC or AlCl3, 350oC
1 由烃制备
(1) 烃类的卤化
烯烃在高温下可以与Cl2生成烯丙式氯代烃。
CH2
CHCH3
CH3 Cl2 Δ
Cl2 500 ℃
CH2
CHCH2Cl
CH2Cl
芳烃在催化剂存在下,直接卤代。
+ Br2
Fe
Br
+ HBr
在实验室里制取烯丙式溴代烃,常用 N-溴代丁二酰亚胺 ( NBS) 作 溴化剂。
+ CH2
O + HCl
无水 ZnCl 2
CH2Cl
当苯环上有致钝基团时,不发生氯甲基化反应。
这个反应在有机合成上很重要,因为氯甲基可以转化为其他基 团。
例3
由苯或甲苯合成
CH2CN
2
由醇制备
R OH + PBr3 R Br + H3PO3
因为醇容易得到,卤代烷大多是由醇制备的。
R OH + PCl5
例5
OH
COOH
由
合成
第五节、醇的制备
羟 基 的 转 换 反 应
第五节1、醇的制备
1. 卤代烃水解
卤代烃水解生成醇,是亲核取 代反应,多数情况下必须加入 NaOH等碱性试剂。 一般情况下,醇比卤代烃容易得到,通常是用醇合成卤 代烃,所以这个方法只在特殊情况下才使用。
Na2CO3
CH2
CHCH2Cl + H2O
Zn or Mg
CH3CH=CHCH3 + ZnBr2
以上的三种合成方法都是消除反应。
4. Hofmann消除反应:
NO2 O2 N NO2 C2H5 CH 2CH2 N CH 3 OH C 2 H5
NO2 O2N NO2 CH = CH2 + CH3N ( C2H5 )2 + H2O
5. 裂解反应:
C
2H2
C C H H
具体实例如:
CH3 CH 2 3CH C CH CH CH
3 2
C2H5OH (298K,50atm)
H
H
H H22
CH3 Ni Ni CHCH CH 2 2 C 3CH CH C H OH 3 2 5 C2H5OH H H H (298K,50atm) H (298K,50atm)
Ph3P O
CR2 CR'2
Ph3P
O CR'2
+
CR2
反应时通过环状过渡状态协同完成的。
9. 交叉偶联反应
A. 烷基铜锂与烯基卤偶联
