无机化学元素周期表
化学元素周期表超清可打印
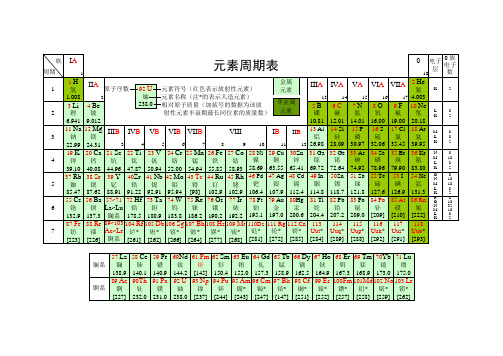
[222]
P
O
N
M
L
K
8
18
32
18
8
2
7
87Fr
钫
[223]
88Rr
镭
[226]
89~103
Ac~Lr
锕系
104Rf
钅卢*
[261]
105Db
钅杜*
[262]
106Sg
钅喜*
[266]
107Bh
钅波*
[264]
108Hs
钅黑*
[277]
109Mt
钅麦*
[268]
110Ds
钅达*
[281]
111 Rg
4.003
K
2
2
3Li
锂
6.941
4Be
铍
9.012
5B
硼
10.81
6C
碳
12.01
7N
氮
14.01
8O
氧
16.00
9F
氟
19.00
10Ne
氖
20.18
L
K
8
2
3
11Na
钠
22.99
12Mg
镁
24.31
IIIB
3
IVB
4
VB
5
VIB
6
VIIB
7
VIII
89 10
IB
11
IIB
12
13Al
铝
26.98
29Cu
铜
63.55
30Zn
锌
65.41
31Ga
镓
69.72
化学元素周期表背诵方法(拼音助记法)

化学元素周期表背诵方法(拼音助记法)化学元素周期表背诵方法氢(qīng) 氦(hài)锂(lǐ) 铍(pí) 硼(péng) 碳(tàn) 氮(dàn) 氧(yǎng) 氟(fú) 氖(nǎi)钠(nà) 镁(měi) 铝(lǚ) 硅(guī) 磷(lín) 硫(liú) 氯(lǜ) 氩(yà)钾(jiǎ) 钙(gài) 钪(kàng) 钛(tài) 钒(fán) 铬(gè) 锰(měng) 铁(tiě) 钴(gǔ) 镍(niè) 铜(tóng) 锌(xīn) 镓(jiā) 锗(zhě) 砷(shēn) 硒(xī) 溴(xi ù) 氪(kè)铷(rú) 锶(sī) 钇(yǐ) 锆(gào) 铌(ní) 钼(mù) 锝(dé) 钌(liǎo) 铑(lǎo) 钯(pá) 银(yín) 镉(gé) 铟(yīn) 锡(xī) 锑(tī) 碲(dì) 碘(diǎn) 氙(xiān) 铯(sè) 钡(bèi) 镧(lán) 铪(hā) 钽(tǎn) 钨(wū) 铼(lái) 锇(é) 铱(yī) 铂(bó) 金(jīn) 汞(gǒng) 铊(tā) 铅(qiān) 铋(bì) 钋(pō) 砹(ài) 氡(dōng) 钫(fāng) 镭(léi) 锕(ā) 钅卢(lú) 钅杜(dù) 钅喜(xǐ) 钅波(bō) 钅黑(h ēi) 钅麦(mài) 钅达(dá) 钅仑(lún)镧(lán) 铈(shì) 镨(pǔ) 钕(nǚ) 钷(pǒ) 钐(shān) 铕(yǒu) 钆(gá) 铽(t è) 镝(dí) 钬(huǒ) 铒(ěr) 铥(diū) 镱(yì) 镥(lǔ)锕(ā) 钍(tǔ) 镤(pú) 铀(yóu) 镎(ná) 钚(bù) 镅(méi) 锔(jū) 锫(péi) 锎(kāi) 锿(āi) 镄(fèi) 钔(mén) 锘(nuò) 铹(láo)元素周期表顺口溜我是氢,我最轻,火箭靠我运卫星;我是氦,我无赖,得失电子我最菜; 我是锂,密度低,遇水遇酸把泡起; 我是铍,耍赖皮,虽是金属难电离; 我是硼,黑银灰,论起电子我很穷; 我是碳,反应慢,既能成链又成环; 我是氮,我阻燃,加氢可以合成氨; 我是氧,不用想,离开我就憋得慌; 我是氟,最恶毒,抢个电子就满足; 我是氖,也不赖,通电红光放出来; 我是钠,脾气大,遇酸遇水就火大; 我是镁,最爱美,摄影烟花放光辉; 我是铝,常温里,浓硫酸里把澡洗; 我是硅,色黑灰,信息元件把我堆; 我是磷,害人精,剧毒列表有我名; 我是硫,来历久,沉淀金属最拿手; 我是氯,色黄绿,金属电子我抢去; 我是氩,活性差,霓虹紫光我来发; 我是钾,把火加,超氧化物来当家; 我是钙,身体爱,骨头牙齿我都在。
碳氮氧氟氖元素周期表

碳氮氧氟氖元素周期表
碳氮氧氟氖元素周期表是一张介绍五种重要元素在无机冶金中
特性和性质的图表,也是化学家们分析化合物组成的重要工具。
这五种元素分别是碳,氮,氧,氟和氖,它们在宇宙中存在的量占据了极大的比例。
本文将从它们的历史、概念以及在无机化学中的重要性,来详细介绍碳氮氧氟氖元素周期表。
历史
碳氮氧氟氖元素周期表可以追溯到1869年,由俄罗斯化学家谢里科夫提出。
当时他把碳、氮、氧、氟和氖作为五个新元素,进行了一番研究,由此形成了元素周期表。
在他之后,许多其他人也接着研究这些元素,推动了无机化学的发展。
概念
碳氮氧氟氖元素周期表的核心概念是构成物质的元素的组成。
它以列的形式出现,能够有效地描述每种元素的特性。
例如,碳氮氧氟氖元素周期表第一列的元素(包括碳、氮、氧和氟)的第一周期,它们的原子质量在9到20之间,具有各自的核结构和各种特性。
在无机化学中的重要性
碳氮氧氟氖元素周期表对于了解无机化合物结构和性质来说至
关重要。
比如,我们可以根据它来判断某种类型的化学物质在什么条件下会发生什么反应;还可以确定某种特定元素在某种物质中的主要构成成分。
此外,碳氮氧氟氖元素周期表也可以帮助我们推断新化合物的性质。
结论
碳氮氧氟氖元素周期表是无机冶金学中的一个重要工具,概括了五种重要元素在无机化学中的性质和特点。
这些元素的研究对于理解宇宙中最基本物质的组成,以及它们在不同情境中作用的规律,帮助我们认识了解万物之起源和运转极为重要。
无机化学上册 公式

- 1 - 第一章 原子结构和元素周期表1)轨道能级:eVnE 26.13-= 波尔半径:5.29×10-11 m2)H 原子电子能量:22e 6.13nZ V E ⨯-=多原子分子:()226.13nZ eV E σ-⨯-=第二章 化学键与分子结构1)分子键级(B.O.)=(成键电子数-反键电子数)/22)确定中心原子A 的价电子总数及价电子对数A 的价电子总数=A 的价电子数+配位原子提供的电子数±离子电荷数 (卤素原子只提供一个电子,氧族元素原子不提供电子)A 的价电子对数=A 的价电子总数/2 (基数电子按一对电子对待)第四章 化学热力学基础1)热力学第一定律:W Q +=∆U 等容过程:V Q U =∆ 体积功:nRTPV W -=-=2)Gibbs 自由能ST H G ∆-∆=∆TH S r θ∆-=∆rJRT kRT J RT G G r m r ln ln ln m +-=+∆=∆θθ0=∆m r G 时θθkRT G m ln r -=∆RS RTH k r r θθθ∆+∆-=ln)11(ln 1212T T RH k k r -∆-=θθθ第五章 化学动力学初步1) RTEa Aek -=)(速率 A RTE k a ln ln +-= ⎪⎪⎭⎫⎝⎛-=211212303.2lgT T T T R E k k a 2)过渡态理论 aa m r E E H '-=∆θ第六章 化学平衡1)混合气体分压分体积定律 RT n V p i i =总 RT n V p i i =总 ∑=i p p 总∑=iVV 总2)格拉汉姆扩散定律AB AB BA MM u u ==ρρ第七章 电离平衡1)一元弱酸(碱) 500k c a≥时[]+=Hc a k ci k =α222211ααc c =2)缓冲溶液 []盐酸c c H ak=+盐酸c c Pk PH a lg-= ;[]盐碱c c kOHb=-盐碱c c Pk POH b lg-= 有效缓冲范围:1±=a Pk PH编号 01- 2 - 第八章 氧化还原反应1)电动势 θθθϕϕ负正-=E2)电动势与吉布斯自由能 nFE G r -=∆ F=9.65×104J ·V -1·mol -13)平衡常数 []0592.00592.0lg θθθθϕϕ负正-==n nEK4)能斯特方程 正极 cC ne aA −→−+- 负极 -+−→−ne dD bB非标准状态下电动势:[][][][]ba dc B A D C nE E lg0592.0-=θ非标准状态下电极电势: [][]acA C nlg0592.0-=θϕϕ正 [][]dbD B nlg0592.0-=θϕϕ负 5)计算元素电势 nnn n n n n n n n ++++++=+ 2122111θθθθϕϕϕϕ 左右ϕϕ 能歧化,左右ϕϕ 不能歧化注:对于某一些基本公式本表未予列出。
高中化学的归纳无机化学中的常见元素和化合物总结

高中化学的归纳无机化学中的常见元素和化合物总结在高中化学学习中,无机化学是一个重要的部分。
它研究无机物质,即不含碳氢键的物质。
在无机化学中,有一些常见的元素和化合物是我们必须熟悉的。
本文将对这些常见的元素和化合物进行总结。
一、常见元素1. 氢(H):氢是宇宙中最常见的元素之一,也是化学元素周期表中的第一个元素。
氢气是无色、无臭的气体,它广泛应用于工业生产、能源储存等方面。
2. 氧(O):氧气是一种重要的气体,占地球大气中的一部分。
它是许多物质的成分之一,如水(H2O),氧化剂等。
3. 氮(N):氮气是空气中的主要成分之一,占据78%的比例。
在化学中,氮还常以氨(NH3)和硝酸(HNO3)等形式存在。
4. 碳(C):碳是有机化合物的基础,其化学性质独特而复杂。
它在地球上的许多物质中广泛存在,如燃料、矿石等。
5. 铁(Fe):铁是一种重要的金属元素,具有良好的导电性和导热性。
它广泛应用于建筑、制造业等领域。
6. 铜(Cu):铜是一种有色金属,具有良好的导电性和导热性。
它广泛应用于电子、通信等领域。
7. 锌(Zn):锌是一种重要的金属元素,它具有耐腐蚀性和导电性。
它在镀锌、防护等方面有广泛应用。
8. 氯(Cl):氯是一种具有腐蚀性的非金属元素,常以氯化钠(NaCl)等形式存在。
它在消毒、净化水等方面有重要作用。
二、常见化合物1. 水(H2O):水是无机化合物中最常见的化合物之一,它由氢和氧元素组成。
水广泛存在于地球上的海洋、河流、湖泊等自然水体中,也是生物体内重要的成分。
2. 盐(NaCl):盐是由钠和氯元素组成的无机化合物,常见的食盐就是氯化钠。
盐在食品调味、融化冰雪等方面有广泛应用。
3. 二氧化碳(CO2):二氧化碳是一种重要的气体,在大气中占据一定比例。
它参与植物的光合作用,同时也是人类活动中产生的主要温室气体。
4. 硝酸(HNO3):硝酸是一种无机酸,它是一种强氧化剂,常用于制造肥料、爆炸物等。
新高考化学知识点范围总结

新高考化学知识点范围总结高考化学的内容是非常广泛的,包括无机化学、有机化学、化学反应动力学、化学平衡、化学键和分子结构等多个方面。
为了应对高考化学考试,学生们需要掌握大量的知识,同时也需要理解化学原理和掌握一定的解题方法。
下面我们将从新高考化学知识点的范围出发,总结出需要掌握的重要知识。
一、无机化学1. 元素周期表元素周期表是化学中最基本的知识之一。
学生们需要掌握元素的周期、族、原子序数等重要信息。
特别是理解元素的周期性规律和族规律。
2. 化合物的命名和化学式化合物的命名和化学式是无机化学中需要重点掌握的内容。
学生们需要掌握化合物的命名规则,包括离子化合物、分子化合物、酸、碱等的命名方法。
3. 化学键和分子结构化学键包括离子键、共价键、金属键等多种类型,学生们需要理解不同类型的化学键的性质和形成机理。
同时,理解分子的空间结构也是很重要的。
二、有机化学1. 烃的分类和命名有机化合物主要包括烃类化合物、卤代烃、醇、醚、醛、酮、酸、酯等多种类型。
学生们需要掌握各种有机物的命名方法和性质。
2. 有机反应有机反应是有机化学的重要内容之一,包括加成反应、消除反应、取代反应、酸碱反应等多种类型。
学生们需要理解不同类型反应的机制和特点。
三、化学平衡和化学反应动力学1. 化学平衡学生们需要理解化学平衡的概念和特点,掌握平衡常数、平衡及其影响因素等内容。
2. 化学反应速率和反应动力学化学反应动力学是化学反应速率、反应机理等内容的总称。
学生们需要理解化学反应速率的影响因素、反应机理等内容。
四、环境保护化学1. 大气污染大气污染是人们关注的重要环境问题,学生们需要掌握大气污染的成因、影响和防治方法。
2. 水污染水污染也是重要的环境问题之一,学生们需要了解水污染的来源、影响和治理方法。
3. 固体废物处理固体废物处理是环境保护的重要内容,学生们需要了解固体废物的分类、处理方法等知识。
五、其他重要知识点1. 化学实验化学实验是化学学习中必不可少的一部分,学生们需要掌握化学实验的基本操作、实验原理以及安全注意事项。
常见无机化学元素周期表元素单词中英对照专业英语

1. hydrogen ['haɪdrədʒ(ə)n]n. [化学] 氢Hydrogen: 氢气| 氢| 氢原子2. helium ['hi:liəm]n. 氦(符号为He,2号元素)3. lithium ['lɪθɪəm]n. 锂(符号Li)Lithium: 锂| 锂元素| 锂盐4. beryllium [bə'rɪlɪəm]n. [化学] 铍(符号Be)beryllium: 铍| 铍青铜| 铍鋍5. boron ['bɔːrɒn]n. [化学] 硼Boron: 硼| 硼粉| 硼元素6. carbon ['kɑːb(ə)n]n. [化学] 碳;碳棒;复写纸adj. 碳的;碳处理的Carbon: 碳| 碳纤维| 碳元素7. nitrogen ['naɪtrədʒ(ə)n]n. [化学] 氮nitrogen: 氮气| 氮| 痰气8. oxygen ['ɔksidʒən]n. 氧气,氧9. fluorine ['flʊəriːn; 'flɔː-]n. [化学] 氟fluorine: 氟10. neon ['niːɒn]n. 霓虹灯;氖(10号元素,符号Ne)Neon: 霓虹| 氖| 霓虹灯11. sodium ['səʊdɪəm]n. [化学] 钠(11号元素,符号Na)Sodium: 钠| 金属钠| 六偏磷酸钠12. magnesium [mæg'niːzɪəm]n. [化学] 镁Magnesium: 镁| 镁金| 可引至腹泻13. aluminum [ə'ljuːmɪnəm]n. 铝Aluminum: 铝| 铝合金| 铝框14. silicon ['sɪlɪk(ə)n]n. [化学] 硅;硅元素Silicon: 硅| 硅胶| 硅利康15. phosphorus ['fɒsf(ə)rəs]n. 磷phosphorus: 磷| 磷光物质| 含磷的16. sulfur ['sʌlfɚ]n. 硫磺;硫磺色vt. 用硫磺处理sulfur: 硫磺| 硫| 硫磺剂17. chlorine ['klɔ:ri:n]n. 氯(17号化学元素)18. argon ['ɑːgɒn]n. [化学] 氩(18号元素)Argon: 氩气| 氩| 亚冈19. potassium [pə'tæsɪəm]n. [化学] 钾Potassium: 钾| 钾质| 金属钾20. calcium ['kælsɪəm]n. [化学] 钙Calcium: 钙| 钙质| 钙粉21. scandium ['skændɪəm]n. [化学] 钪scandium: 钪| 钪棒22. titanium [taɪ'teɪnɪəm; tɪ-]n. [化学] 钛(金属元素)Titanium: 钛| 钛合金| 钛色洗23. vanadium [və'neɪdɪəm]n. [化学] 钒V anadium: 钒| 硫酸钒| 钒矿24. chromium ['krəʊmɪəm]n. [化学] 铬(24号元素,符号Cr)25. manganese ['mæŋgəniːz]n. [化学] 锰Manganese: 锰| 锰片| 电解锰26. iron ['aɪən]n. 熨斗;烙铁;坚强adj. 铁的;残酷的;刚强的vt. 熨;用铁铸成vi. 熨衣;烫平Iron: 整理和熨烫| 铁| 熨烫27. cobalt ['kəʊbɔːlt; -ɒlt]n. [化学] 钴;钴类颜料;由钴制的深蓝色Cobalt: 钴| 钴蓝色| 钴元素28. nickel ['nɪk(ə)l]n. 镍;镍币;五分镍币vt. 镀镍于Nickel: 镍| 五美分| 镍币29. copper ['kɒpə]n. 铜;铜币;警察adj. 铜的vt. 镀铜于Copper: 铜| 铜币| 合金30. zinc [zɪŋk]n. 锌vt. 镀锌于…;涂锌于…;用锌处理Zinc: 锌| 锌色| 锌粉31. gallium ['gælɪəm]n. [化学] 镓Gallium: 镓| 金属镓| 镓盐32. germanium [dʒɜː'meɪnɪəm]n. [化学] 锗(32号元素,符号Ge)Germanium: 锗| 锗粉| 盖乐33. arsenic ['ɑːs(ə)nɪk]n. 砷;砒霜;三氧化二砷adj. 砷的;含砷的arsenic: 砷| 砒霜| 内脏中毒34. selenium [sɪ'liːnɪəm]n. [化学] 硒Selenium: 硒| 硒粉| 免疫组织化学35. bromine ['brəʊmiːn]n. [化学] 溴Bromine: 溴素| 溴| 溴盐36. krypton ['krɪptɒn]n. [化学] 氪(元素符号为Kr)krypton: 氪| 氪气| 氪星37. barium ['beərɪəm]n. [化学] 钡(一种化学元素)barium: 钡| 金属钡| 钡剂38. radium ['reɪdɪəm]n. [化学] 镭(88号元素符号Ra)Radium: 镭| 镭灰| 北投石39. palladium [pə'leɪdɪəm]n. [化学] 钯;守护神palladium: 钯金| 钯| 守护神40. platinum ['plætɪnəm]n. [化学] 铂;白金;唱片集达100万张的销售量;银灰色adj. 唱片集已售出100万张的Platinum: 白金| 铂金| 白金色41. silver ['sɪlvə]n. 银;银器;银币;银质奖章;餐具;银灰色adj. 银的;含银的;有银色光泽的;口才流利的;第二十五周年的婚姻vt. 镀银;使有银色光泽vi. 变成银色silver: 银色| 银白色| 银42. gold [ɡəuld]n. 金,黄金;金色;金币adj. 金的,金制的;金色的43. cadmium ['kædmɪəm]n. [化学] 镉(元素符号Cd)Cadmium: 镉| 影响呼吸道| 镉粒44. mercury ['mə:kjuri]n. 水银;水银柱;精神Mercury: 水星| 水银| 汞45. tin [tɪn]n. 锡;罐头,罐;马口铁adj. 锡制的vt. 涂锡于;给…包马口铁Tin: 氮化钛46. lead [liːd]n. 领导;铅;导线;石墨;榜样adj. 带头的;最重要的vt. 领导;致使;引导;指挥vi. 领导;导致;用水砣测深Lead: 领先| 带领| 引导47. antimony ['æntɪmənɪ]n. [化学] 锑(符号Sb)Antimony: 锑| 锑粒| 锑块48. bismuth ['bɪzməθ]n. [化学] 铋Bismuth: 铋| 铋粒| 铋粉49. iodine ['aɪədiːn; -aɪn; -ɪn]n. 碘;碘酒Iodine: 碘| 碘酒| 放射药理学50. xenon ['zenɒn; 'ziː-]n. [化学] 氙(稀有气体元素)xenon: 氙| 氙气| 塞诺恩51. uranium [ju'reiniəm]n. [化]铀。
化学高考备考无机化学与有机化学的重要知识总结

化学高考备考无机化学与有机化学的重要知识总结化学是高考理科中的重要学科之一,其中又分为无机化学和有机化学两个分支。
在备考过程中,对无机化学和有机化学的重要知识进行总结是非常重要的。
本文将对无机化学和有机化学的相关知识进行详细介绍和总结,以帮助考生们更好地备考。
一、无机化学无机化学是研究无机物质的性质、组成、结构和变化规律的学科,其重点在于无机物质的元素组成和化学键的特性。
考生在备考过程中需要掌握以下几个重要知识点:1. 元素周期表元素周期表是无机化学的基础,它按照元素的电子结构和化学性质的周期性进行排列。
考生需要熟悉元素周期表的结构,包括主、副、过渡元素以及其周期和族的划分。
2. 化学键化学键是构成化合物的基本单位,主要包括离子键、共价键和金属键。
考生需要理解化学键的形成过程和特点,能够根据给定的元素和化合物推断其键性。
3. 酸碱盐酸碱盐是无机化学中的重要概念,包括酸、碱和盐三种物质。
考生需要了解酸碱盐的定义、性质和常见的实验现象,能够判断物质的酸碱性和进行有关的计算。
4. 氧化还原反应氧化还原反应是无机化学中的基本反应类型,包括氧化、还原和电子转移。
考生需要掌握氧化还原反应的概念、特性和判断方法,并能够根据具体的反应方程式进行计算。
5. 配位化学配位化学是无机化学中的重要分支,研究包络合物的结构和性质。
考生需要掌握配位化学的基本概念和理论,能够分析和推断包络合物的结构和配位数。
二、有机化学有机化学是研究碳化合物及其衍生物的组成、结构和变化规律的学科,其重点在于有机物质的结构和化学反应。
考生在备考过程中需要掌握以下几个重要知识点:1. 有机物的结构与命名有机物的结构是有机化学的基础,考生需要了解有机物的基本结构、分子式和功能团,能够运用命名规则对有机物进行命名和解析。
2. 化学反应类型有机化学反应类型繁多,包括取代反应、加成反应、消除反应等。
考生需要熟悉不同反应类型的特点和机理,并能够根据反应方程式进行计算和解析。
大一无机及分析化学知识点

大一无机及分析化学知识点第一章:无机化学基础知识无机化学是研究无机化合物的组成、结构、性质和化学反应的学科。
它是化学的一个重要分支,对于理解和应用其他化学学科具有重要意义。
1.1 原子结构及元素周期表- 原子结构:原子由原子核和围绕核运动的电子组成。
原子核由质子和中子组成,电子负电荷平衡原子核的正电荷。
- 元素周期表:元素周期表是按照元素的原子序数排列的化学元素分类表。
它将元素按照性质的周期性规律分组,方便研究。
1.2 化学键和离子结构- 化学键:原子通过化学键相互连接,形成化合物。
常见的化学键有离子键、共价键和金属键。
- 离子结构:离子结构是指由正负离子通过离子键组成的化合物的结构。
正离子是失去电子的金属原子或原子团,负离子是获得电子的非金属原子或原子团。
1.3 配位化学- 配位化学是研究过渡金属离子与配体之间的键合关系及其化合物的性质的学科。
配位化合物由中心金属离子和配体组成,配体通过配位键与中心金属离子结合。
1.4 水溶液中的离子- 水溶液中的离子是指将化合物溶解在水中时形成的离子。
离子在水中可以进行水合反应,影响溶液的性质。
第二章:分析化学基础知识分析化学是研究物质组成和性质的化学分析方法的学科。
它是化学实验的基础,广泛应用于环境监测、药物分析、食品检测等领域。
2.1 定性分析和定量分析- 定性分析:定性分析是确定物质中所含的元素或化合物的成分和性质的方法。
- 定量分析:定量分析是确定物质中某种或若干种成分的含量的方法。
2.2 大气分析- 大气分析是研究大气中气体成分及其浓度的分析方法。
常用的技术包括气相色谱、质谱等。
2.3 水分析- 水分析是研究水中各种成分及其浓度的分析方法。
常用的技术包括滴定法、光谱分析等。
2.4 有机分析- 有机分析是研究有机物成分和结构的分析方法。
常用的技术包括红外光谱、核磁共振等。
第三章:重要的化学实验化学实验是学习无机及分析化学的重要途径,通过实验可以加深对化学原理的理解,培养实验操作技能。
大学无机化学大一知识点

大学无机化学大一知识点无机化学是化学科学中的一个重要分支,主要研究无机物质的结构、性质、合成和应用等方面的知识。
作为大一学生,学习无机化学的基本知识是打好化学基础的重要一步。
下面将介绍大学无机化学大一知识点的内容。
1. 原子结构和元素周期表原子是物质最基本的单位,由电子、质子和中子组成。
电子负电,质子正电,中子中性。
元素周期表是根据元素的原子序数(质子数)排列的,分为周期和族。
周期表上左边为金属元素,右边为非金属元素,中间是过渡金属元素。
根据元素的位置可以大致判断其性质。
2. 化学键与分子结构化学键是由原子之间的相互作用形成的,常见的化学键有离子键、共价键和金属键。
离子键是通过正负电荷的相互吸引形成的,如钠和氯化成氯化钠。
共价键是通过共享电子形成的,如氢气的共价键是两个氢原子共享两个电子。
分子结构描述了分子中原子的相对位置。
3. 配位化学配位化学研究配位化合物中金属离子与配体的结合。
金属离子通常可以形成配位数不同的络合物,配位数是指与金属离子配位键的配位原子或配体的个数。
配体是能与金属形成配位键的分子或离子。
4. 元素化合物及其性质元素化合物是由相同种类的原子通过化学键相互结合形成的化合物。
元素化合物的性质取决于元素的原子结构和元素之间的化学键。
例如,氯化钠是一种晶体固体,在水中可以溶解形成电解质溶液。
5. 酸碱中和反应酸碱中和反应是指酸和碱反应生成盐和水的反应。
酸是指能产生H+离子的物质,碱是指能产生OH-离子的物质。
常见的酸碱反应有酸和碱的中和反应、酸和金属的反应以及酸和碳酸盐的反应等。
6. 化学平衡化学平衡是指化学反应在一定条件下前后反应物和生成物的浓度保持一定比例的状态。
平衡常数(Kc)是反应物浓度与生成物浓度的比值的稳定值,取决于反应物浓度的温度和压力。
7. 氧化还原反应氧化还原反应是指物质间电子的转移反应,包括氧化剂接受电子的还原和还原剂提供电子的氧化。
常见的氧化还原反应有金属的腐蚀反应、非金属的燃烧反应以及电池中的反应等。
无机化学大一知识点笔记专科

无机化学大一知识点笔记专科第一章基础概念1. 元素(Element)元素是指由相同类型的原子组成的物质,例如氢(H)、氧(O)、铁(Fe)等。
元素通过其原子序数和元素符号表示,如氢的原子序数是1,元素符号为H。
2. 化合物(Compound)化合物是由不同种类的元素按照一定比例结合而成的物质,具有独特的化学性质。
例如水(H2O)、二氧化碳(CO2)等。
化合物可以通过化学式表示,如水的化学式为H2O。
3. 分子(Molecule)分子是由两个或多个原子通过共价键结合而成的化合物的最小单位。
分子可以由相同或不同种类的原子组成,如氧气(O2)由两个氧原子组成,二氧化硫(SO2)由一个硫原子和两个氧原子组成。
4. 离子(Ion)离子是失去或获得电子后带电的原子或物质。
正离子是失去了一个或多个电子的原子或物质,如氢离子(H+)、氧离子(O2-)。
负离子是获得了一个或多个电子的原子或物质,如氯离子(Cl-)、氧离子(O2-)。
5. 化学反应(Chemical Reaction)化学反应是指物质之间发生的原子或离子重新组合的过程,导致物质的性质和组成发生改变。
化学反应可以通过化学方程式表示,如氧气与氢气生成水的反应可以用方程式2H2(g) + O2(g)→ 2H2O(l)表示。
第二章周期表和元素分类1. 周期表(Periodic Table)周期表是将元素按照一定的规则排列的表格,用于系统地组织和显示元素的信息。
周期表可以根据元素的原子序数、元素符号、原子质量等进行排列。
常用的周期表包括门捷列夫周期表和IUPAC周期表。
2. 元素周期律(Periodic Law)元素周期律是指元素的化学和物理性质随着原子序数的增加而周期性变化的规律。
根据元素周期律,周期表上元素的位置可以预测其一些性质和行为。
3. 元素分类根据元素的化学性质和周期表上的位置,元素可以分为金属、非金属和类金属等几类。
金属具有良好的导电和导热性、良好的延展性和变形性,能够形成阳离子。
无机化学1~4章总结

第 1 章 原子结构元素周期表● 波粒二象性● Plank 公式:E = h ν 【光的能量(E ) 频率(ν) 普朗克常量(h )=6.626×10-34J·s 】 ● 能量量子化:物体只能按hν的整数倍(如1, 2, 3等)一份一份地吸收或释出光能 ● 光电效应:对某一特定金属而言,不是任何频率的光都能使其发射光电子。
每种金属都有一个特征的最小频率(叫临界频率),低于这一频率的光线不论其强度多大和照射时间多长,都不能导致光电效应。
光的强弱只表明光子的多少,而与每个光子的能量无关。
● 微粒的波动性德布罗依关系式(求运动粒子的波长):λ=h/p = h/mv 【λ:波长 υ:频率 v :光速 m :质量】 应用 Ni 晶体进行电子衍射实验,证实电子具有波动性宏观物体的波长极短以致无法测量,波长难以察觉,主要表现为粒子性,服从经典力学的运动规律 ● 氢原子结构的量子力学模型:波尔模型ν为波数的符号,它定义为波长的倒数,单位常用cm -1; R 为里德伯常量,实验确定为1.097 37×10 5cm -1;n 2大于n 1 ,二者都是不大的正整数 跃迁:ΔE = E 2 - E 1 = h ν波尔理论的不足之处:不能解释氢原子光谱的精细结构;不能解释氢原子光谱在磁场中的分裂;不能解释多电子原子的光谱● 海森堡的测不准原理:Δx ·Δp ≥ h /(4π)● 直角坐标( x, y, z )与球坐标 (r ,θ,φ) 的转换 r : 径向坐标,决定了球面的大小。
θ: 角坐标,由z 轴沿球面延伸至r 的弧线所表示的角度。
φ: 角坐标,由r 沿球面平行xy 面延伸至xz 面的弧线所表示的角度。
),()(),,(),,(ϕθϕθψψY r R r z y x ==波函数 = 薛定锷方程的合理解 = 原子轨道 薛定锷方程:ψπψψψ)(822222222V E hm zyx--=∂∂+∂∂+∂∂◐ 解得的ψ不是具体的数值,而是包括三个常数(n , l , m )和三个变量(r ,θ,φ)的函数式Ψn , l , m (r ,θ,φ);◐ 数学上可以解得许多个Ψn , l , m (r ,θ,φ),但其物理意义并非都合理;◐ 为得到合理解,三个常数项只能按一定规则取值,很自然地得到前三个量子数。
第五版无机化学大一知识点

第五版无机化学大一知识点无机化学是化学科学中的一个重要分支,主要研究无机物质的性质、结构和变化规律。
作为大一学生,掌握基础的无机化学知识对于后续学习和研究有着重要的作用。
下面将介绍第五版无机化学大一知识点。
一、原子结构和元素周期表原子是物质的基本单位,由质子、中子和电子组成。
质子带正电荷,中子不带电荷,电子带负电荷。
原子核由质子和中子组成,电子围绕原子核运动。
元素周期表是将元素按照一定规律进行排列,用于描述元素的性质和结构。
二、化学键和分子结构化学键是原子之间的相互作用力,常见的化学键包括共价键、离子键和金属键。
共价键是由共享电子对形成的,离子键是由带正电荷的金属离子和带负电荷的非金属离子之间的电荷吸引力形成的,金属键是由金属原子之间的金属离子形成的。
分子结构是指分子内原子的排列方式和原子之间的连接方式。
三、化学反应和化学平衡化学反应是物质发生变化的过程,包括化学反应方程式的写法、化学反应速率和反应机理的研究等。
化学平衡是指在闭合系统中,反应物和生成物的浓度达到一定比例时,反应停止,但反应物和生成物仍处于动态平衡状态。
四、酸碱和盐酸是指具有给出H+离子的物质,碱是指具有给出OH-离子的物质。
酸碱反应会生成盐和水。
盐是由阳离子和阴离子组成的晶体化合物。
五、氧化还原反应氧化还原反应是指电子的转移过程,包括氧化反应和还原反应。
氧化是指物质失去电子,还原是指物质获得电子。
氧化还原反应可以通过电子传递实现,也可以通过氧原子的转移实现。
六、配位化学配位化学研究配位化合物和配位键的形成和性质。
配位化合物是由中心金属离子和配体(通常是带有孤对电子的配位基团)形成的。
不同的配体可以形成不同的配位键,如配位键可以是双电子提供的孤对电子,也可以是单电子提供的孤对电子。
七、主要无机化合物大一学习的无机化合物主要包括氢化物、氧化物、酸盐、过渡金属配合物等。
氢化物是由氢原子和其他元素形成的化合物,氧化物是由氧元素和其他元素形成的化合物,酸盐是由阳离子、阴离子和氧元素形成的化合物,过渡金属配合物是由过渡金属离子和配体形成的化合物。
无机化学知识点

无机化学知识点无机化学是研究无机物质(不含碳的化合物)的组成、结构、性质、合成、反应以及它们在各个领域中的应用的学科。
在无机化学中,有许多重要的知识点,下面将介绍一些常见的无机化学知识点。
1. 元素周期表:元素周期表是无机化学的基础,它将化学元素按照原子序数的增加顺序排列,同时也按照元素的周期性特征进行分组。
元素周期表可以帮助我们了解元素的基本性质和趋势,例如原子半径、电离能、电负性等。
2. 键的类型:在无机化学中,化学键可以分为离子键、共价键和金属键等。
离子键是由正负电荷的离子之间的电吸引力形成的,共价键是由共用电子对连接起来的,金属键是金属离子之间的电子云形成的。
3. 价态和电子排布:元素的价态是指元素在化合物中的可能电子组态。
根据原子的外层电子数和元素周期表的规律,我们可以推测元素的价态和电子排布。
了解元素的价态和电子排布有助于我们理解元素间的键合方式以及化合物的性质。
4. 配位化合物:配位化合物是由中心金属离子和周围配体离子或分子组成的。
配位化合物中心金属离子一般处于正离子状态,周围的配体通过共用能够与金属离子形成稳定的化学键。
配位化合物的性质和结构与配体的类型、数目以及配体与中心金属离子之间的相互作用有关。
5. 晶体结构:无机化合物常常形成晶体,晶体的结构与原子之间的排列及相互作用密切相关。
无机化合物的晶体结构包括离子晶体、共价晶体和金属晶体等不同类型。
晶体结构的了解对于理解无机化合物的物理、化学性质以及合成方法都非常重要。
6. 配位数和配位几何:在配位化合物中,一个中心金属离子被周围的配体离子或分子包围时,配位数是指与中心离子直接接触的配体数目。
配位几何则是指配位体在空间中相对于中心金属离子的排列方式。
了解配位数和配位几何有助于我们理解配位化合物的性质和反应机理。
7. 氧化还原反应:氧化还原反应是无机化学中的重要反应类型,它涉及到电子的转移。
在氧化还原反应中,氧化剂接受电子而被还原,还原剂失去电子而被氧化。
化学元素周期表(最新最全)
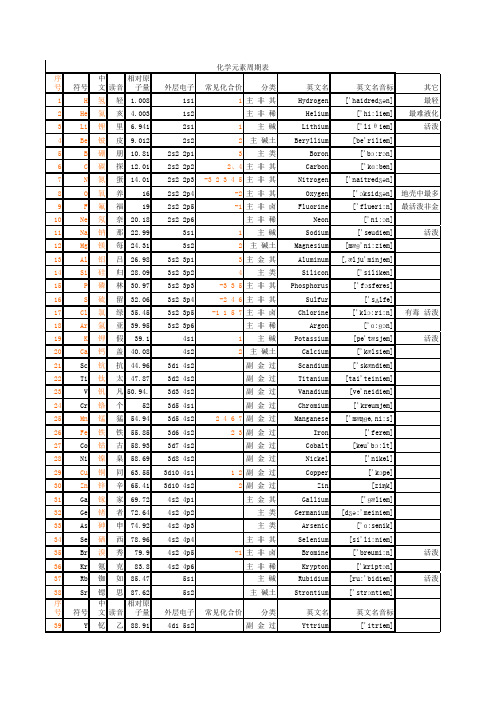
12 Mg 镁 每 24.31
13 Al 铝 吕 26.98
14 Si 硅 归 28.09
15
P 磷 林 30.97
16
S 硫 留 32.06
17 Cl 氯 绿 35.45
18 Ar 氩 亚 39.95
19
K 钾 假 39.1
20 Ca 钙 盖 40.08
21 Sc 钪 抗 44.96
22 Ti 钛 太 47.87
主类
Antimony
['æntiməni]
52 Te 碲 帝 127.6 5s2 5p4
主 类 Tellurium [te'ljuəriəm]
53
I 碘 典 126.9 5s2 5p5
主非卤
Iodine
['aiəudi:n]
54 Xe 氙 仙 131.3 5s2 5p6
主非稀
Xenon
['zenɔn]
1副 金 过
Silver
['silvə]
48 Cd 镉 隔 112.4 4d10 5s2
副金过
Cadmium
['kædmiəm]
49 In 铟 因 114.8 5s2 5p1
主金其
Indium
['indiəm]
50 Sn 锡 西 118.7 5s2 5p2
主金其
Tin
[tin]
51 Sb 锑 梯 121.8 5s2 5p3
91 Pa 镤 仆 231 5f2 6d1 7s2
92
U 铀 由 238 5f3 6d1 7s2
93 Np 镎 拿 [237] 5f4 6d1 7s2
94 Pu 钚 不 [244] 5f6 7s2
大一无机化学下知识点总结

大一无机化学下知识点总结大一无机化学课程是理工类大学本科生通常要学习的一门基础化学课程。
它是化学专业学生的基础课,也是其他学科领域的前提。
下面将对大一无机化学课程中的一些重要知识点进行总结和归纳。
1. 原子与元素周期表无机化学研究的基础是原子结构和元素周期表。
原子是最小的化学单位,由带电粒子构成,包括质子、中子和电子。
元素周期表是一种分类和组织所有已知元素的方式,它按照原子序数排列元素,并将它们分为不同的组和周期。
2. 化学键化学键是原子相互之间的结合。
常见的化学键有离子键、共价键和金属键。
离子键是由正负带电离子之间的相互吸引力形成的,如NaCl中的Na+和Cl-。
共价键是由原子之间相互共享电子形成的,如氢气中的两个氢原子共享电子。
金属键是金属元素之间由金属离子形成的。
3. 结构与几何体分子的形状对其性质和反应至关重要。
分子的结构主要受共价键和孤对电子的影响。
几何体的形状取决于中心原子周围的原子数目和孤对电子的存在。
常见的分子形状有线性、平面三角形、四面体等。
4. 配位化合物配位化合物是由一个中心金属离子和周围以配体形式存在的原子或分子构成的。
配位数指的是金属离子周围配体的数目。
配体中的原子或分子通过配位键与中心金属离子结合。
配位化合物的性质和结构对于催化、分离和生物学等领域有着重要的应用。
5. 化学反应动力学和平衡化学反应动力学研究反应速率和反应机理。
平衡化学研究在给定条件下各组分之间的相对浓度。
各种反应速率常数和平衡常数可用于衡量反应的速率和平衡位置。
6. 配合物和离子平衡在水溶液中,配合物和离子之间可以发生反应。
这些反应的平衡与络合反应和配体和金属离子的亲和力有关。
离子平衡也被广泛应用于环境科学和水处理等领域。
7. 酸碱平衡酸碱平衡是无机化学中的重要概念。
酸是能够释放质子(H+)的物质,碱是能够接受质子的物质。
酸碱中和反应是质子的转移过程。
8. 氧化还原反应氧化还原反应涉及电子的转移过程。
大一无机化学知识点

大一无机化学知识点无机化学是化学的一个重要分支领域,是研究无机物质的性质、结构和反应规律的科学。
在大一学习阶段,我们需要掌握一些基本的无机化学知识点,下面将介绍其中几个重要的知识点。
1. 元素与化合物元素是由一种类型的原子组成的物质,具有一定的物理和化学性质。
化合物是由两个或多个不同元素的原子通过化学键结合而成的物质。
2. 元素周期表元素周期表是由化学元素按照一定规律排列的表格,可以根据元素的周期性规律、性质和趋势来进行分类和研究。
3. 原子结构原子是构成物质的最基本单位,由带正电荷的原子核和围绕原子核运动的电子组成。
原子的结构主要包括质子、中子和电子。
4. 键合理论键合理论是研究原子之间是如何形成化学键以及化合物的结构和性质的理论。
常见的化学键包括离子键、共价键和金属键等。
5. 配位化合物配位化合物是由一个中心金属离子和周围的配体通过配位键结合而形成的化合物。
配位化合物具有特殊的结构和性质,广泛应用于催化、荧光和医学等领域。
6. 反应平衡化学反应平衡是指在一定条件下,反应物和生成物的浓度之间达到稳定状态的一种动态平衡。
根据化学平衡定律,平衡常数可以描述反应平衡的状态。
7. 酸碱中和反应酸碱中和反应是酸和碱反应生成盐和水的化学过程。
在中和反应中,酸的质子和碱的氢氧根离子结合形成水,同时生成相应的盐。
8. 氧化还原反应氧化还原反应是指反应物中某种物质被氧化剂接受电子,同时另一种物质被还原剂失去电子的化学反应。
氧化还原反应在生活中广泛存在,如电池工作原理、金属腐蚀等。
以上是大一无机化学的一些重要知识点,掌握这些知识对于我们理解基础化学原理和应用非常重要。
在学习过程中,要注重理论与实践的结合,通过实验来加深对无机化学知识的理解和应用。
通过不断的学习和实践,我们可以更好地掌握无机化学知识,为将来的学习和科研打下坚实的基础。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
现代元素周期表的特点
e、元素的分区
s区 ns1-2 p区 ns2np1-6 过渡元素 d区 (n-1)d1-9ns1-2 ds区 (n-1)d10ns1-2 f区 (n-2)f1-14(n-1)d0-1ns2 内过渡元素
元素性质的周期性
有效核电荷 原子半径 电离能 电子亲和能 电负性 元素的金属性和非金属性 元素的氧化值 ……
ds区
现代元素周期表的特点
a、主族元素的族数=原子最外层的电子数 特点:次外层的电子数为8或18 b、副族元素:主族元素以外的其它元素 特点:8<次外层的电子数 <18 1 2 10 ( n 1) d ns 族数=(n-1)d+ns的电子数(第Ⅷ族外) c、ⅠB、ⅡB副族元素的特点 (n-1)d10ns1~2 族数=最外层的电子数 d、第Ⅷ族的特点: (n-1)d6~8ns2
电离能涉及分级概念。基态气体原子失去最外层一个电子成为 气态+1价离子所需的最小能量叫第一电离能, 再从正离子相继逐个失 去电子所需的最小能量则叫第二、第三 … 电离能。各级电离能符 号分别用I1、I2、I3 等表示, 它们的数值关系为I1<I2<I3…. 这种关系 不难理解 , 因为从正离子离出电子比从电中性原子离出电子难得多 , 而且离子电荷越高越困难。 E (g) == E+ (g) + eI1
门捷列夫的元素周期表(1869)
门捷列夫的元素周期表
现代元素周期表
维尔纳长式周期表
阿尔弗雷德· 维尔纳(Alfred Werner, 1866-1919) 法裔瑞士籍化学家
发展了化合价理论
配位化学奠基人,1913年获诺 贝尔化学奖
现代元素周期表的特点
八主八副八与零 三短三长一不全 将同一能级的元素按原子序数从小到大排 列成一个横行,即周期 把最外层电子数相同的元素按电子层数递 增的顺序从上到下排成纵行,即族
很强, 有效核电荷增加甚小。
原子半径
镧系收缩 镧系元素的原子半径和离子半径随着原子序数 的增加而逐渐减小的现象称为镧系收缩。 镧系收缩的结果 ⅣB Zr和Hf 每对原子的原子半径和离子半径较 ⅤB Nb和Ta 接近,化学性质也十分相似,造成这 三对元素在分离上十分困难。 ⅥB Mo和W
电离能 I ( ionization energy)
Li
金 属 性 逐 渐 增 强
F
金 属 性 逐 渐 增 强 , 非 金 属 性 逐 渐 减 弱
3锂 Na
11钠 K 19钾 Rb 37铷 Cs 55铯
9氟 Cl 17氯 Br 35溴 I 53碘 At 85砹
金 属 性 逐 渐 减 弱 , 非 金 属 性 逐 渐 增 强
元素的金属性和非金属性递变小结
气态氢化物的稳定性
(稳定~强)
同一周期元素金属性和非金属变化
非金属性逐渐减弱,金属性逐渐增强
Li
Be
B
C
N
O
F
Ne
3锂 Na
11钠
4铍 Mg
12镁
5硼 Al
13铝
6碳 Si
14硅
7氮 P
15磷
8氧 S
16硫
9氟 Cl
17氯
10氖 Ar
18氩
非金属性逐渐增强,金属性逐渐减弱
同一主族元素金属性和非金属变化
金属半径(metallic radius)
(1)适用金属元素 (2)固体中测定两个最邻近原子 的核间距一半
共价半径(covalent radius)
(1)适用非金属元素 (2)测定单质分子中两个相邻原子的核 间距一半
同周期原子半径的变化趋势 (一)
总趋势:随着原子序数的增大,原子半径自左至右减小. 解 释: 电子层数不变的情况下,有效核电荷的增大导致核对外层电 子的引力增大.
电负性
1、分子中(元素间相互化合时),原子对电 子吸引能力的大小,称为该元素的电负性。
讨论:a、元素的非金属性越强,其电负性就越大,最大者为F=4.0 b、元素的金属性越强,其电负性就越小, 最小者为Cs =0.7
2、电负性的三种标度 a、鲍林电负性 b、密立根电负性 c、阿莱-罗周电负性
电负性 ( electronegativity)
原子序数及相关概念
1个质子带一个单位 正电荷 中子不带电 1个电子带一个单位 负电荷
原子序数及相关概念
质量数(A)= 质子数(Z)+中子数(N) 核电荷数=核内质子数=原子核外电子数 同位素:原子里具有相同质子数和不同中 子数的原子互称为同位素
同位素在周期表里占据同一位置。 同位素的化学性质几乎完全相同,物理性质略有差异 在天然存在的某种元素里,不论是游离态还是化合态, 各种同位素的原子个数百分比(丰度)一般为定值。
X(g) + e- == X- (g) X- (g) + e- == X 2- (g) 例如,O- (g) + e- == O2- (g) A2 = -780 kJ . mol-1
A Δr H m
◆ 电子亲和能是气态原子获得一个电子过程中能量变化的一种量度。 ◆ 与电离能相反,电子亲和能表达原子得电子难易的程度。 ◆ 元素的电子亲和能越大,原子获取电子的能力越强,即非金属性越强。
非金属性逐渐增强
H
金 属 性 逐 渐 增 强 非 金 属 性 逐 渐 增 强
Li
Na K Rb
Be
Mg Ca Sr
B
Al Ga In
C
Si Ge Sn
N
P As Sb
O
S Se Te
F
Cl Br I
Cs
Ba
Tl
Pb
Bi
Po
At
金属性逐渐增强
元素的氧化值
元素的氧化值表示化合物中各个原子所带的电荷数。 (1)在单质中元素的氧化值为零。 (2)氧在化合物中的氧化值一般为–2 ,仅在OF2中为+2; 在过氧化物(如H2O2、Na2O2等)中为–1;在超氧化物 (如KO2)中为–1/2。 (3)氢在化合物中的氧化值一般为+1。仅在与活泼金属生 成的离子型氢化物(如NaH、CaH2)中为-1。 (4)碱金属和碱土金属在化合物中的氧化值分别为+1和+2; 氟的氧化值总是-1。 (5)在任何化合物分子中各元素氧化值的代数和等于零; 在多原子离子中各元素氧化值的代数和等于该离子所带电 荷数。
◆ 电负性有不同的标度,因而会看到不同的数据表。例如 Mulliken 电负性标度,Pauling电负性标度(以热化学为基础)和 AllredRochow 电负性标度。
电负性变化的形象表示
元素的金属性与非金属性
元素的金属性:原子失去电子成为阳离子 的能力电离能 元素的非金属性:原子得到电子成为阴离 子的能力电子亲和能
总结:
短周期
第一周期
第二周期 第三周期 第四周期
—— 2 种 —— 8 种 —— 8 种
周期
(7个) 长周期
—— 18 种
—— 18 种 —— 32 种 —— 26 种
第五周期 第六周期
不完全周期 第七周期 主族
共 8个主族,包括短周期和长周期元素
族
(16个)
0族 副族
稀有气体元素
共 8个副族,只包括在长周期中
解 释: ◆ 主族元素: 电子逐个填加在最外层, 对原来最外层上的电子的屏蔽参数(σ)小, 有效 核电荷(Z*) 迅速增大。例如, 由Na(Z=11)至Cl (Z=17), 核电荷增加6, 最外层3s电子
感受到的有效核电荷则增加4.56(由2.51增加至7.07)。
◆ 过渡元素: 电子逐个填加在次外层, 增加的次外层电子对原来最外层上电子的屏蔽 较强, 有效核电荷增加较小。 ◆ 内过渡元素: 电子逐个填加在外数第三层, 增加的电子对原来最外层上电子的屏蔽
Question
原子结合电子的过程是放热还是吸热?
◆ 原子结合电子的过程中存在两种相反的静电作用力:价层原有 电子与外来那个电子之间的排斥力;原子核与外来电子之间的 吸引力。是放热还是吸热, 决定于吸引力和排斥力哪一种起支 配作用。 ◆ 电子加进电中性原子时通常是吸引力起支配作用, 发生放热过 程,第一电子亲和能通常为正值。 ◆电子加进阴离子时排斥力起支配作用, 发生吸热过程, 43; (g) ==E 2+ (g) + e● ● ●
I2
I1<I2<I3<I4
同周期总趋势: 自左至右增大
同族总趋势: 自上至下减小
电子亲和能Y ( electron affinity)
电子亲和能是指一个气态原子得到一个电子形成负
离子时放出或吸收的能量, 常以符号Y表示。像电离能一 样, 电子亲和能也有第一、第二、…之分. 元素第一电子 亲和能的正值表示放出能量, 负值表示吸收能量。
◆ 如果原子吸引电子的趋势相对较强, 元素在该化合物中显示电负 性(electronegative);如果原子吸引电子的趋势相对较弱,元素在该 化合物中则显示电正性(electropositive).
化合物 ClO2 (Cl-O化合物) HCl 电负性元素 O(3.44) Cl(3.16) 电正性元素 Cl(3.16) H(2.20)
对元素周期律的研究—— “八音律”
1865年,英国皇家农业学会化学师纽兰兹 (A.Y.Newlands,1837—1898)把当时已知的62 种元素按相对原子质量由小到大的顺序排列,每 当排列到第八种元素时就会出现性质跟第一个元 素相似的情况,犹如八度音阶一样。 没有充分估计到当时的相对原子质量测定值可能 有错误,而是机械地按相对原子质量由小到大顺 序排列 没有考虑到还有未被发现的元素,没有为这些元 素留下空位,更未能揭示元素从量变到质变这一 重要规律。
