分析化学期末试卷及答案
分析化学期末考试题A及答案

分析化学期末考试题A及答案一、选择题(每题2分,共20分)1. 以下哪种物质不是分析化学中常用的指示剂?A. 酚酞B. 甲基橙C. 硫酸铜D. 酚红答案:C2. 在酸碱滴定中,滴定终点的判断依据是:A. 滴定体积B. 溶液颜色变化C. 滴定速度D. 溶液的pH值答案:B3. 原子吸收光谱法中,待测元素的原子化方式不包括:A. 火焰原子化B. 石墨炉原子化C. 化学原子化D. 电化学原子化答案:C4. 以下哪种仪器不适用于液相色谱分析?A. 紫外检测器B. 荧光检测器C. 质谱仪D. 红外光谱仪答案:D5. 质谱分析中,分子离子峰通常指的是:A. 最大质量的离子峰B. 质量最小的离子峰C. 质量比最大的离子峰D. 质量比最小的离子峰答案:A二、填空题(每题2分,共20分)1. 在紫外-可见光谱分析中,______是分子吸收紫外光或可见光后,分子内部电子跃迁到高能级轨道的过程。
答案:电子跃迁2. 色谱分析中,______是指固定相与移动相之间的相互作用。
答案:色谱保留3. 原子吸收光谱分析中,______是指样品中待测元素的原子化效率。
答案:原子化效率4. 电位滴定法中,______是指溶液中待测离子的活度。
答案:活度5. 质谱分析中,______是指分子离子峰的质荷比。
答案:分子离子峰的质荷比三、简答题(每题10分,共30分)1. 简述高效液相色谱(HPLC)与薄层色谱(TLC)的主要区别。
答案:高效液相色谱(HPLC)与薄层色谱(TLC)的主要区别在于:(1)HPLC使用高压泵推动流动相通过柱子,而TLC使用毛细作用力使溶剂上升。
(2)HPLC的分离效率和速度通常高于TLC。
(3)HPLC可以连接多种检测器进行定量分析,而TLC通常用于定性分析。
2. 解释什么是标准溶液,并说明其在分析化学中的重要性。
答案:标准溶液是指已知准确浓度的溶液,通常用于校准仪器或作为分析过程中的参照物。
在分析化学中,标准溶液的重要性在于:(1)提供准确浓度的参照,确保分析结果的准确性。
分析化学期末考试题A及答案

分析化学期末考试题A及答案一、试题分析分析化学期末考试题A涵盖了分析化学的基本概念、基本原理、实验技术和应用等方面的内容。
试题结构合理,难易适中,旨在全面考察学生对分析化学知识体系的掌握和运用能力。
以下是对试题A的详细分析和答案:二、试题内容及答案1. 填空题(1)滴定分析法中,标准溶液的浓度单位通常用______表示。
答案:mol/L(摩尔/升)(2)在酸碱滴定中,滴定突跃范围的大小与______有关。
答案:溶液的酸碱度(3)重量分析中,沉淀的类型主要有______和______。
答案:晶形沉淀、无定形沉淀(4)紫外-可见分光光度法中,朗伯-比尔定律的数学表达式为______。
答案:A = εlc(吸光度A与摩尔吸光系数ε、溶液浓度c和光程l成正比)2. 判断题(1)在滴定分析中,滴定终点与化学计量点完全重合。
()答案:错误。
滴定终点与化学计量点不一定完全重合,二者之间存在误差。
(2)在重量分析中,沉淀的溶解度越小,沉淀越完全。
()答案:正确。
(3)电位分析法是一种基于电化学原理的分析方法。
()答案:正确。
3. 选择题(1)下列哪种分析方法属于光谱分析法?A. 滴定分析B. 重量分析C. 紫外-可见分光光度法D. 气相色谱法答案:C. 紫外-可见分光光度法(2)在下列哪种情况下,不能使用酸碱滴定法进行测定?A. 溶液中的酸碱浓度已知B. 溶液中的酸碱浓度未知,但可以通过指示剂判断滴定终点C. 溶液中的酸碱浓度未知,且没有合适的指示剂D. 溶液中的酸碱浓度已知,但浓度较低答案:C. 溶液中的酸碱浓度未知,且没有合适的指示剂4. 简答题(1)简述滴定分析法的基本原理。
答案:滴定分析法是一种定量分析方法,通过将已知浓度的标准溶液滴加到待测溶液中,根据滴加的体积和浓度计算出待测溶液中的物质含量。
其基本原理是利用化学反应的化学计量关系,使待测物质与标准溶液中的反应物完全反应,从而确定待测物质的含量。
(2)简述重量分析法的基本原理。
分析化学期末试题及参考答案
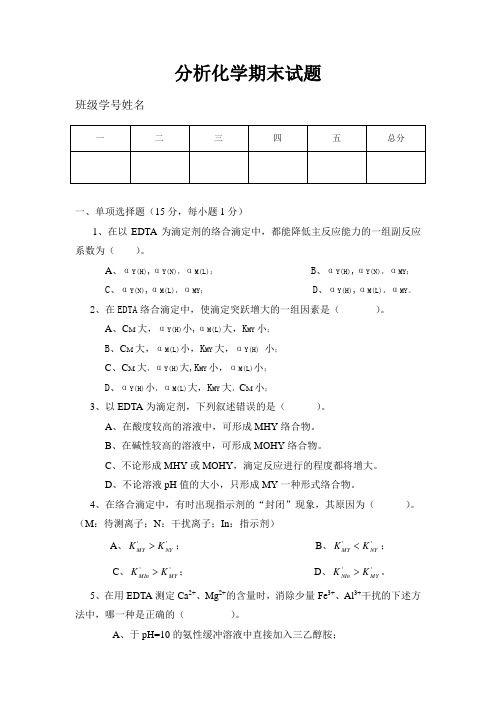
分析化学期末试题班级学号姓名一、单项选择题(15分,每小题1分)1、在以EDTA 为滴定剂的络合滴定中,都能降低主反应能力的一组副反应系数为( )。
A 、αY(H),αY(N),αM(L);B 、αY(H),αY(N),αMY ;C 、αY(N),αM(L),αMY ; D 、αY(H),αM(L),αMY 。
2、在EDTA 络合滴定中,使滴定突跃增大的一组因素是( )。
A 、C M 大,αY(H)小,αM(L)大,K MY 小; B 、C M 大,αM(L)小,K MY 大,αY(H) 小; C 、C M 大,αY(H)大,K MY 小,αM(L)小;D 、αY(H)小,αM(L)大,K MY 大,C M 小;3、以EDTA 为滴定剂,下列叙述错误的是( )。
A 、在酸度较高的溶液中,可形成MHY 络合物。
B 、在碱性较高的溶液中,可形成MOHY 络合物。
C 、不论形成MHY 或MOHY ,滴定反应进行的程度都将增大。
D 、不论溶液pH 值的大小,只形成MY 一种形式络合物。
4、在络合滴定中,有时出现指示剂的“封闭”现象,其原因为( )。
(M :待测离子;N :干扰离子;In :指示剂)A 、''NY MY K K >;B 、''NY MY K K <; C 、''MY MIn K K >; D 、''MYNIn K K >。
5、在用EDTA 测定Ca 2+、Mg 2+的含量时,消除少量Fe 3+、Al 3+干扰的下述方法中,哪一种是正确的( )。
A 、于pH=10的氨性缓冲溶液中直接加入三乙醇胺;B、于酸性溶液中加入KCN,然后调至pH=10;C、于酸性溶液中加入三乙醇胺,然后调至pH=10的氨性溶液;D、加入三乙醇胺时,不需要考虑溶液的酸碱性。
6、在1mol·L-1HCl介质中,滴定Fe2+最好的氧化-还原方法是()。
《分析化学》期末考试试卷附答案

《分析化学》期末考试试卷附答案一、填空题(每空2分,共40分)1.测定一物质中某组分的含量,测定结果为(%):59.82,60.06,59.86,60.24。
则平均偏差为;相对平均偏差为;标准偏差为;相对标准偏差为;置信区间为(18.33,05.0t)2.系统误差的减免是采用标准方法与所用方法进行比较、校正仪器及做试验和试验等方法减免,而偶然误差则是采用的办法减小。
3.有一磷酸盐混合溶液,今用标准盐酸滴定至酚酞终点时耗去酸的体积为V1;继续以甲基橙为指示剂时又耗去酸的体积为V2。
当V1=V2时,组成为;当V1<V2时,组成为。
(V1>0,V2>0)4.NH4CN质子条件为5.在含有Ca2+、Ag2+混合溶液中,在pH=12条件下,用EDTA标准溶液滴定其中的Ca2+。
加入三乙醇胺的作用是,加入NaOH的作用是。
6.某有色溶液,当液层厚度为1cm时,透过光强度为入射光强的80%。
若通过5cm的液层时,光强度将减弱%。
7.强碱滴定弱酸的滴定曲线中,滴定突跃的大小与和有关。
8.当电流等于扩散电流一半时,滴汞电极的电位称为。
不同离子在不同介质中具有特征值,是极谱分析的基础。
9.组分分子从气相到气-液界面进行质量交换所遇到的阻力,称为。
10.分子的外层电子在化学能的作用下使分子处于激发态,再以无辐射弛豫转入第一电子激发态的最低振动能级,然后跃迁回基态的各个振动能级,并产生辐射。
这种发光现象称为。
二、选择题(每题3分,共30分)1.下列有关随机误差的论述中不正确的是()A.随机误差是由一些不确定的偶然因素造成的;B.随机误差出现正误差和负误差的机会均等;C.随机误差在分析中是不可避免的;D.随机误差具有单向性2.下列各酸碱对中,属于共轭酸碱对的是()A.H2CO3——CO32-B.H3O+——OH—C.HPO42-——PO43-D.NH3+CH2COOH——NH2CH2COO—3.已知H3PO4的pK a1=2.12,pK a2=7.20, pK a3=12.36,若用NaOH滴定H3PO4,则第二个化学计量点的pH值约为()A.10.7 B.9.7 C.7.7 D.4.94.EDTA与金属离子形成螯合物时,其螯合比一般为()A.1:1 B.1:5 C.1:6 D.1:45.用异烟酸-吡唑酮作显色剂可测定水中CN-的含量。
《分析化学》期末考试试卷(A)及答案

适用专业:注意:请将所有答案填到答题纸上。
一、单项选择题(每小题1分,共25分)1.10mL移液管移取的体积应记录为()mL。
A.10 B.10.0 C.10.00 D.10.0002.0.010450有效数字的位数为()位。
A.三B.四C.五D.六3.分析结果的精密度通常用()表示。
A.绝对误差B.相对误差C.绝对偏差D.相对偏差4.分析测定中出现的下列情况,不属于系统误差的是()。
A.滴定时有液滴溅出锥形瓶B.滴定管读数时最后一位估计不准C.砝码未校正D.试剂中含有微量的干扰离子5.分析测定中可通过()减少偶然误差。
A.仪器校正B.增加平行实验的次数C.空白实验D.对照实验6.在定量分析中,要求测定结果的误差()。
A.等于零B.愈小愈好C.在允许的误差范围之内D.没有要求7.将0.6345修约成三位有效数字,正确的结果是()。
A.0.635 B.0.634C.0.64 D.0.68.下列仪器不属于量器的是()。
A.滴定管B.量筒C.烧杯D.移液管9.酚酞指示剂加入食醋溶液中呈()色。
A.红B.无C.黄D.橙10.()用符号ρ表示。
A.质量浓度B.物质的量浓度C.体积分数D.质量分数11.甲基橙指示剂的pH变色范围是()。
A.3.1~4.4B.4.4~6.2 C.3.0~4.6 D.8.0~10.0 12.相对平均偏差常保留()位有效数字。
A.两B.三C.四位D.没有什么要求13.下列物质为基准物质的是()A.浓盐酸B.氢氧化钠C.高锰酸钾D.氯化钠14.双氧水的含量测定属于()滴定法。
A.酸碱B.氧化还原C.沉淀D.配位15.碘量法常使用()作指示剂。
A.甲基橙B.铬黑TC.淀粉D.荧光黄16.EBT是()的英文缩写。
A.铬黑T B.氯化钠C.乙二胺四乙酸D.硝酸银17.标定氢氧化钠标准溶液常用的基准物质是()。
A.无水碳酸钠B.硼砂C.草酸钠D.邻苯二甲酸氢钾18.以荧光黄为指示剂测定氯化钠试样的含量,终点颜色由黄绿色转变为()。
《分析化学》期末考试试卷及答案(A)

《分析化学》期末考试试卷及答案(A)《分析化学》A考试试卷1.写出下列各体系的质⼦条件式:(1)c1(mol/L) NH4 H2PO4(2)c1(mol/L)NaAc+ c2(mol/L)H3BO32.符合朗伯-⽐尔定律的有⾊溶液,当有⾊物质的浓度增⼤时,其最⼤吸收波长,透射⽐。
3. 准确度⽤表⽰,精密度⽤表⽰。
4.⼆元弱酸H2B,已知pH=1.92时,δH2B =δHB-;pH=6.22时δHB-=δB2-, 则H2B的p K a1=,p K a2=。
5.已知EΦ(Fe3+/Fe2+)=0.68V,EΦ(Ce4+/Ce3+)=1.44V,则在1mol/L H2SO4溶液中⽤0.1000mol/L Ce4+滴定0.1000 mol/L Fe2+,当滴定分数为0.5时的电位为,化学计量点电位为,电位突跃范围是。
6.以⼆甲酚橙(XO)为指⽰剂在六亚甲基四胺缓冲溶液中⽤Zn2+滴定EDTA,终点时溶液颜⾊由_________变为__________。
7.某溶液含Fe3+10mg,⽤等体积的有机溶剂萃取⼀次后,该溶液中剩余0.1mg,则Fe3+在两相中的分配⽐= 。
8.滴定分析法中滴定⽅式有, , 和。
9.I2与Na2S2O3的反应式为。
10.以波长为横坐标,吸光度为纵坐标,测量某物质对不同波长光的吸收程度,所获得的曲线称谓;光吸收最⼤处的波长叫做,可⽤符号表⽰。
11.已知Zn(NH3)42+的各级累积形成常数logβ1—logβ4分别为2.3、4.6、7.0和9.0,则它们的第四级形成常数logK4= 。
12. 分光光度法的基础是,其相对误差⼀般为。
此法适⽤于量组分的测定。
13.在纸⾊谱分离中,是固定相。
14.晶形沉淀的条件述为①在的溶液中进⾏;②在下,加⼊沉淀剂;③在溶液中进⾏;④。
15沉淀滴定法中莫尔法、佛尔哈德法、法扬司法的指⽰剂分别是:、、。
1、试样⽤量为0.1 ~ 10 mg的分析称为:A、常量分析B、半微量分析C、微量分析D、痕量分析2、在分析⼯作中,减⼩偶然差的⽅法是:A、对结果进⾏校正B、采⽤对照实验C、增加平⾏测定次数D、采⽤空⽩实验3、下列各数中,有效数字位数为四位的是:A、[H+]=0.0003mol/LB、pH=10.42C、ω(MgO)=19.96%D、40004、在下列各酸碱组分中,属于共轭酸碱对的是:A、H+-OH-B、H3PO4-Na2HPO4C、H2S-Na2SD、NaHCO3-Na2CO35、下列⼀元弱酸或弱碱(C=0.10mol/L)中,能被直接准确滴定的是:A、HCN(K a=7.2×10-10)B、NH4CI(K bNH3=1.8×10-5)C、(CH2)6N4(K b=1.4×10-9)D、HCOOH(K a=1.8×10-4)6、⽤纯⽔将下列溶液稀释10倍,其中pH 值变化最⼤的是:A、0.1mol/L HClB、0.1mol/L HAcC、1mol/L NH3·H2OD、1mol/L HAc + 1mol/L NaAc7、⽤EDTA滴定M2+时,下列情况能够增⼤滴定突跃的是:A、固定C M使K/MY减⼩B、使K/MY固定减⼩C MC、增⼤C M和K/MYD、减⼩C M和K/MY8、当⾦属离⼦M 和N 共存时,欲以EDTA 滴定其中的M ,若c M =10c N ,TE=0.1%, ΔpM=0.2。
分析化学z期末考试题及答案

分析化学z期末考试题及答案一、选择题(每题2分,共20分)1. 分析化学中,以下哪种仪器用于测量溶液的pH值?A. 紫外分光光度计B. 原子吸收光谱仪C. pH计D. 气相色谱仪答案:C2. 滴定分析中,滴定终点的判断依据是什么?A. 溶液颜色突变B. 溶液电导率变化C. 溶液pH值变化D. 溶液温度变化答案:C3. 在原子吸收光谱法中,哪种元素的测定需要使用石墨炉?A. 钠B. 钾C. 铁D. 铜答案:C4. 高效液相色谱法中,哪种类型的色谱柱适用于非极性物质的分离?A. 离子交换柱B. 反相柱C. 凝胶渗透柱D. 正相柱答案:B5. 以下哪种方法不能用于定量分析?A. 紫外-可见分光光度法B. 原子吸收光谱法C. 红外光谱法D. 核磁共振波谱法答案:D6. 以下哪种化合物最适合用薄层色谱法进行分离?A. 大分子蛋白质B. 低分子量有机酸C. 高分子量聚合物D. 离子型化合物答案:B7. 在电位滴定中,指示终点到达的装置是什么?A. 电导仪B. pH计C. 电位计D. 光谱仪答案:C8. 气相色谱法中,用于固定相的物质是什么?A. 气体B. 液体C. 固体D. 以上都不是答案:B9. 分光光度法测定溶液中某种物质的含量时,需要使用哪种仪器?A. 紫外分光光度计B. 红外光谱仪C. 核磁共振仪D. 质谱仪答案:A10. 以下哪种方法不适用于微量分析?A. 比色法B. 重量法C. 滴定法D. 原子吸收光谱法答案:B二、填空题(每空1分,共20分)1. 分析化学中,________是用来表示溶液中某物质含量的一种方法,通常以溶质的质量与溶剂的质量或体积之比来表示。
答案:浓度2. 在酸碱滴定中,滴定曲线的拐点对应的pH值即为滴定的________。
答案:终点3. 原子吸收光谱法中,________是指被测元素的基态原子吸收特定波长的光,从而产生吸收光谱的现象。
答案:原子吸收4. 高效液相色谱法中,流动相的组成和流速对________有直接影响。
分析化学期末考试题A及答案

分析化学期末考试题A及答案一、选择题(每题2分,共20分)1. 以下哪种物质是强酸?A. 醋酸B. 碳酸C. 硫酸D. 氢氧化钠答案:C2. 酸碱滴定中,滴定终点的判断依据是?A. 溶液颜色变化B. 溶液pH值突变C. 消耗的滴定剂体积D. 溶液的电导率答案:A3. 哪种仪器用于测量溶液的pH值?A. 滴定管B. 比重计C. pH计D. 温度计答案:C4. 摩尔浓度(M)与当量浓度(N)之间的关系是什么?A. M = NB. M = 2NC. M = N/2D. M = N * 10答案:B5. 以下哪种物质不是缓冲溶液?A. 醋酸和醋酸钠B. 碳酸钠和碳酸氢钠C. 硫酸和硫酸钠D. 氨水和氯化铵答案:C6. 电位滴定中,电位突跃发生时,意味着什么?A. 滴定终点B. 滴定开始C. 滴定剂不足D. 滴定剂过量答案:A7. 哪种物质是强碱?A. 氢氧化钠B. 氢氧化钙C. 氢氧化镁D. 氢氧化铝答案:A8. 哪种物质是弱酸?A. 硫酸B. 盐酸C. 醋酸D. 硝酸答案:C9. 哪种物质是强氧化剂?A. 过氧化氢B. 硫酸C. 氯化钠D. 碳酸答案:A10. 哪种物质是还原剂?A. 铁B. 铜C. 硝酸D. 氢氧化钠答案:A二、填空题(每题2分,共20分)1. 酸碱滴定中,滴定剂的浓度为0.1M,消耗体积为20mL,则被滴定物质的摩尔数为________。
答案:0.002mol2. 摩尔浓度(M)是指每升溶液中所含溶质的________。
答案:摩尔数3. pH计测量溶液pH值时,使用的是________电极。
答案:玻璃4. 缓冲溶液的特点是能够抵抗________对溶液pH值的影响。
答案:酸碱5. 电位滴定中,电位突跃的原因是________。
答案:滴定剂与被滴定物质发生完全反应6. 摩尔浓度与当量浓度的换算关系是________。
答案:1M = 1N(对于一元酸碱)7. 强酸与强碱反应生成的盐是________。
分析化学期末考试试卷AB(带答案)

试卷一一、选择题:(每题 2 分,共40 分)(说明:将认为正确答案的字母填写在每小题后面的括号内)1. 在定量分析中,精密度和准确度之间的关系是:()A.精密度高,准确度必然高;B。
精密度是保证准确度的前提;B.准确度是保证精密度的前提。
2. 若HAc的pKa=4。
74,则Ka值为:()A. 2×10—5;B。
1.8×10-5;C. 2.0×10—5;D。
1。
82×10-5。
3。
浓度相同的下列物质水溶液pH最高的是:( )A.NaCl;B。
NaHCO3;C。
NH4Cl;D. Na2CO3 .4。
强酸滴定弱碱,以下指示剂不适用的是:()A.甲基橙;B. 甲基红;C. 酚酞;D。
溴酚蓝(pKa=4.0)。
5。
若S1,S2,S3依次为CaC2O4在纯水中、Na2C2O4稀溶液中、稀HCl溶液中的溶解度那么:()A。
S3>S2〉S1; B. S1〉S2〉S3;C。
S3〉S1〉S2;D。
S1〉S3>S2。
6 下列情况引起随机误差的是:()A.使用不纯的Na2CO3来标定HCl溶液;B.在称量分析中,杂质与被测成分共沉淀;C.滴定分析中,终点与等量点不一致;D.在获得测量值时,最后一位数字估测不准.7。
下列物质中可用直接法配制标液的是:()A. 固体NaOH;B。
固体K2Cr2O7;C。
固体Na2S2O3•5H2O;D. 浓HCl 。
8. H2PO4—的共轭碱是:()A. PO43-;B. HPO42—;C。
H2PO4—;D。
H3PO4 .9。
用重量法测定样品中SiO2含量时能引起系统误差的是:()A.称量样品时天平零点稍有变动;B. 析出硅酸沉淀时酸度控制稍有差别;C.加动物胶凝聚时的温度稍有差别;D。
硅酸的溶解损失。
10. 浓度相同的下列物质水溶液pH最高的是:()A.NaCl; B。
NaHCO3;C。
NH4Cl;D. Na2CO3。
11.原子吸收分析中,有时浓度范围合适,光源发射线强度也很高,测量噪音也小,但测得的校正曲线却向浓度轴弯曲,除了其它因素外,下列哪种情况最有可能是直接原因?( )A、使用的是贫燃火焰B、溶液流速太大C、共振线附近有非吸收线发射D、试样中有干扰12.在电热原子吸收分析中,多利用氘灯或塞曼效应进行背景扣除,扣除的背景主要是( )A、原子化器中分子对共振线的吸收B、原子化器中干扰原子对共振线的吸收C、空心阴极灯发出的非吸收线的辐射D、火焰发射干扰13.原子吸收光谱仪与原子发射光谱仪在结构上的不同之处是( )A、透镜B、单色器C、光电倍增管D、原子化器14。
分析化学(第五版)试卷套及答案

分析化学(第五版)试卷5套及答案《分析化学》期末试卷(B)一、是非题(本大题共10小题,每小题1分,共10分)1.化学分析法的测定灵敏度高,因此常用于微量分析。
()2.分析数据中,凡是“0”都不是有效数字。
()3.纯度很高的物质均可作为基准物质。
()4.用HCl溶液滴定Na2CO3基准物溶液以甲基橙作指示剂,其物质量关系为n(HCl)∶n(Na2CO3)=1∶1。
()5.酸碱滴定中,只有当溶液的pH突跃超过2个pH单位,才能指示滴定终点。
()6.标定高锰酸钾溶液时,为使反应较快进行,可以加入Mn2+。
()7.AgCl的Ksp=1.56×10-10比Ag2CrO4的Ksp=9×10-12大,所以,AgCl在水溶液中的溶解度比Ag2CrO4大。
()8.用佛尔哈德法测定Cl-时,如果生成的AgCl沉淀不分离除去或加以隔离,AgCl沉淀可转化为AgSCN沉淀。
但用佛尔哈德法测定Br-时,生成的AgBr沉淀不分离除去或不加以隔离即可直接滴定。
()9.重量分析法要求沉淀溶解度愈小愈好。
()10.吸光光度法只能测定有颜色物质的溶液。
()二、选择题(本大题共20题,每小题1.5分,共30分)1.试样预处理的目的不是为了()(A)使被测物成为溶液;(B)使被测组分生成沉淀(C)使被测物变成有利测定的状态;(D)分离干扰组分2.下列论述正确的是:()(A)准确度高,一定需要精密度好;(B)进行分析时,过失误差是不可避免的;(C)精密度高,准确度一定高;(D)精密度高,系统误差一定小;3.称取含氮试样0.2g,经消化转为NH4+后加碱蒸馏出NH3,用10mL0.05mol·L-1HCl吸收,回滴时耗去0.05mol·L-1NaOH9.5mL。
若想提高测定准确度,可采取的有效方法是()(A)增加HCl溶液体积(B)使用更稀的HCl溶液(C)使用更稀的NaOH溶液(D)增加试样量4.在酸碱滴定中被测物与滴定剂浓度各变化10倍,引起的突跃范围的变化为()。
分析化学期末考试题A及答案

分析化学期末考试题A及答案一、选择题(每题2分,共20分)1. 以下哪种物质是强酸?A. 醋酸B. 碳酸C. 硫酸D. 磷酸答案:C2. 酸碱滴定中,终点的判断依据是:A. 颜色变化B. pH值C. 体积变化D. 温度变化答案:A3. 标准溶液的配制中,需要使用的主要仪器是:A. 量筒B. 容量瓶C. 烧杯D. 滴定管答案:B4. 原子吸收光谱法中,分析元素的依据是:A. 原子的电子结构B. 原子的核结构C. 原子的振动频率D. 原子的转动频率答案:A5. 以下哪种方法属于非破坏性分析?A. 火焰光度法B. 原子吸收光谱法C. 质谱法D. 红外光谱法答案:D6. 紫外-可见光谱法中,最大吸收波长称为:A. 吸收峰B. 吸收边C. 吸收谷D. 吸收顶答案:B7. 以下哪种物质是强碱?A. 氢氧化钠B. 氢氧化铵C. 氢氧化钙D. 氢氧化镁答案:A8. 电位滴定法中,电位突跃的点称为:A. 终点B. 起始点C. 平衡点D. 等电点答案:A9. 色谱法中,用于分离混合物的物理过程是:A. 扩散B. 吸附C. 溶解D. 沉淀答案:B10. 以下哪种物质是还原剂?A. 氧气B. 氢气C. 氯气D. 溴气答案:B二、填空题(每空2分,共20分)1. 酸碱滴定中,______是滴定过程中的指示剂。
答案:酚酞2. 原子吸收光谱法中,______是分析元素的光谱线。
答案:吸收线3. 标准溶液的配制中,______是保证溶液浓度准确的关键步骤。
答案:标定4. 紫外-可见光谱法中,______是测量物质对特定波长光的吸收强度。
答案:比色法5. 色谱法中,______是色谱图上的峰高或峰面积。
答案:色谱峰6. 电位滴定法中,______是测量电极电位变化的仪器。
答案:pH计7. 非破坏性分析中,______是分析过程中不改变样品化学性质的方法。
答案:光谱分析8. 强酸和强碱在水溶液中完全离解,其离子浓度等于______。
分析化学期末试卷及参考答案

一、选择题 ( 共 9题 18分 )1. 2 分 (0918)0918反应 2A ++ 3B 4+ → 2A 4++3B 2+到达化学计量点时电位是 ---------------------------( )(A) [ ϕ(A) + ϕ(B)]/2 (B) [2 ϕ(A)+ 3 ϕ(B)]/5(C) [3 ϕ(A)+ 2 ϕ(B)]/5 (D) 6[ ϕ(A) - ϕ(B)]/0.0592. 2 分 (0920)0920用K 2Cr 2O 7滴定 Fe 2+, 在化学计量点时, 有关离子浓度的关系是-------------------( )(A) [Fe 3+] = [Cr 3+], [Fe 2+] = [Cr 2O 72-](B) 3[Fe 3+] = [Cr 3+], [Fe 2+] = 6[Cr 2O 72-](C) [Fe 3+] = 3[Cr 3+], [Fe 2+] = 6[Cr 2O 72-](D) [Fe 3+] = 3[Cr 3+], 6[Fe 2+] = [Cr 2O 72-]3. 2 分 (0901)0901对 Ox-Red 电对, 25℃ 时条件电位( ϕ') 等于 --------------------------------------( )(A) ϕ + 0059.lg n a a Ox Red(B) ϕ + 0059.lg n c c Ox Red (C) ϕ + 0059.lg n a a γγOx Ox Red Red⋅⋅ (D) ϕ +0059.lg n a a γγOx Red Red Ox ⋅⋅4. 2 分 (2217)2217以下有关系统误差的论述错误的是-----------------------------------------------------------( )(A) 系统误差有单向性 (B) 系统误差有随机性(C) 系统误差是可测误差 (D) 系统误差是由一定原因造成6. 2 分 (5118)5118若显色剂无色,而被测溶液中存在其它有色离子,在比色分析中,应采用的参比溶液是-------------------------------------------------------------------------------------------------------- --- ( )(A)蒸馏水(B)显色剂(C)加入显色剂的被测溶液(D)不加显色剂的被测溶液8. 2 分(0707)0707αM(L)=1表示---------------------------------------------------------------------------------------( )(A) M与L没有副反应(C) M与L的副反应相当严重(C) M的副反应较小(D) [M]=[L]9. 2 分(1107)1107以下说法错误的是--------------------------------------------------------------------------------( )(A) 摩尔吸光系数ε随浓度增大而增大(B) 吸光度A随浓度增大而增大(C) 透射比T随浓度增大而减小(D) 透射比T随比色皿加厚而减小二、填空题( 共7题19分)11. 2 分(2273)2273测得某溶液pH值为2.007,该值具有______位有效数字,氢离子活度应表示为______________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2008 –2009 学年第二学期期末考试 分析化学 试卷 一、选择题 ( 每题2分,共30分 ) 1.定量分析结果的标准偏差代表的是-----------------------------( C )。 A. 分析结果的准确度 B. 分析结果的精密度和准确度 C. 分析结果的精密度 D. 平均值的绝对误差 2.下列哪种情况应采用返滴定法-------------------------------------( C )。 A. 用AgNO3标准溶液测定NaCl试样含量 B. 用HCl标准溶液测定Na2CO3试样含量 C. 用EDTA标准溶液测定Al3+试样含量 D. 用Na2S2O3标准溶液测定K2Cr2O7试样含量 3.下列各项叙述中不是滴定分析对化学反应要求的是----------( D )。 A. 反应必须有确定的化学计量关系 B. 反应必须完全 C. 反应速度要快 D. 反应物的摩尔质量要大 4. 下列四个数据中为四位有效数字的-------------------------------- ( C ) (1)0.0056 (2)0.5600 (3)0.5006 (4)0.0506 A. 1, 2 B. 3, 4 C. 2, 3 D. 1, 4 5. 以下有关随机误差的论述正确的是------------------------------( C ) A. 正误差出现概率大于负误差 B. 负误差出现概率大于正误差 C. 正负误差出现的概率相等 D. 大小误差出现的概率相等 6. 在用 K2Cr2O7 法测定 Fe 时, 加入H3PO4的主要目的是 --( B ) A. 提高酸度, 使滴定反应趋于完全 B. 降低化学计量点前Fe3+/Fe2+电对的电位,使二苯胺磺酸钠在突跃范围内变色 C. 提高化学计量点前Fe3+/Fe2+ 电对的电位, 使二苯胺磺酸钠不致提前变色 D. 有利于形成 Hg2Cl2 白色丝状沉淀 7. 用Fe3+滴定Sn2+在化学计量点的电位是--------------------------( D )
[ (Fe3+/Fe2+)=0.68V, (Sn4+/Sn2+)=0.14V] A. 0.75V B. 0.68V C. 0.41V D. 0.32V 8. 测定试样中 CaO 的质量分数, 称取试样 0.9080 g,滴定耗去 EDTA 标准溶液20.50 mL, 以下结果表示正确的是---------------( C ) A. 10% B. 10.1% C. 10.08% D. 10.077% 9. 下列滴定分析操作中会产生系统误差的是-----------------------( C ) A. 指示剂选择不当 B. 试样溶解不完全 C. 所用蒸馏水质量不高 D. 称样时天平平衡点有±0.1mg的波动 10. 某溶液含Ca2+、Mg2+及少量Al3+、Fe3+,今加入三乙醇胺, 调至pH=10, 以铬黑T为指示剂, 用EDTA滴定, 此时测定的是---------( A ) A. Ca2+, Mg2+总量 B. Ca2+量 C. Mg2+量 D. Ca2+, Mg2+, Al3+, Fe3+总量
11. EDTA滴定金属离子时,若仅浓度均增大10倍,pM突跃改变---( A ) A. 1个单位 B. 2个单位 C. 10个单位 D. 不变化 12. 符合朗伯-比尔定律的一有色溶液,当有色物质的浓度增加时,最大吸收波长和吸光度分别是------------------------------------------------ ( A ) A. 不变、增加 B. 不变、减少 C. 增加、不变 D. 减少、不变 13. 人眼能感觉到的光称为可见光,其波长范围是----------------( B) A. 200~320nm B. 400~780nm C. 200~780nm D. 200~1000nm 14. 下列各条件中何者不是晶形沉淀所要求的沉淀条件 --------(A) A. 沉淀作用宜在较浓溶液中进行; B. 应在不断的搅拌下加入沉淀剂; C. 沉淀作用宜在热溶液中进行; D. 应进行沉淀的陈化。 15. 用BaSO4重量分析法测定Ba2+时,若溶液中还存在少量Ca2+、Na+、CO32-、Cl-、H+和OH-等离子,则沉淀BaSO4表面吸附杂质为 -----------------------( D ) A. H+和OH-; B. Ba2+和CO32-; C. CO32-和Ca2+; D. SO42-和Ca2+。 16. 可用于减小测定过程中偶然误差的方法是--------------------( D )。 A.对照实验 B. 空白实验 C.校正仪器 D. 增加平行测定次数 17. 可以用直接法配制的标准溶液是:-------------------------------( C )
A:Na2S2O3 B:NaOH C:K2Cr2O7 D:KMnO4 18. 直接与金属离子配位的EDTA型体为----------------------------( D ) A. H6Y2+ B. H4Y C. H2Y2- D. Y4- 19. 可以用直接法配制的标准溶液是:………………………( C )
A. Na2S2O3 B. NaNO3 C. K2Cr2O7 D. KMnO4 20.误差的分类为( C ) A. 偶然误差、方法误差 B. 系统误差、方法误差 C. 随机误差、系统误差 D. 方法误差、操作误差 21. 下列物质可以作为基准物质的是( B ) A. NaHCO3 B. K2Cr2O7 C. NaOH D. KMnO4 22. 用BaSO4重量法测定Ba2+离子时,应选用的沉淀剂是( D )。 A、Na2SO4 B、K2SO4 C、HCl D、H2SO4 23. KMnO4滴定需在( A )介质中进行 A、硫酸 B、盐酸 C、磷酸 D、硝酸 24. 用Na2C2O4标定KMnO4时,应加热至( C ) A、40~60℃ B、60~75℃ C、75~ 85 ℃ C、85~100℃ 25. 见光易分解的AgNO3应把它贮存在( A ) A. 棕色试剂瓶中 B. 白色玻璃瓶中 C. 塑料瓶中 D. 胶袋里 26. 分析用标准溶液是( D ) A. 确定了浓度的溶液 B. 用基准试剂配制的溶液 C. 用于滴定分析的溶液 D. 确定了准确浓度、用于滴定分析的溶液 二、填空题( 每空2分,共30分) 1. 系统误差影响分析结果的: 准确度 ;偶然误差影响分析结果的: 精密度 。 2. 系统误差的特点是( 1. 单向性 2. 重复性 3. 可测性)。 3.准确度的高低用(误差 )来衡量,它是测定结果与( 真实值 )之间的差异;精密度的高低用( 偏差 )来衡量,它是测定结果与(平均值 )之间的差异。 4.减免系统误差的方法主要有(对照试验 )、( 空白试验 )、(校准仪器 )、( 方法校正)等。减小随机误差的有效方法是( 进行多次平行测定 )。 5. 滴定分析法包括(酸碱滴定)、(配位滴定)、(氧化还原滴定)和(沉淀滴定)四大类。 6. 引起Na2S2O3标准溶液浓度改变的主要原因有(二氧化碳)、(氧气)和(微生物 )。 1. 对一个w(Cr)=1.30%的标样,测定结果为1.26%,1.30%,1.28%。则测定结果的绝对误差为 -0.02% ,相对误差为 -1.5% 。
2. 已知EDTA的pKa1 pKa6分别为0.9 , 1.6 , 2.0 , 2.67 , 6.16 , 10.26。在pH < 1.0的酸性溶液中,EDTA的主要存在形式是 _ H6Y2+_;在pH 2.7 6.2 的溶液中,主要存在形式是 _H2Y2-_。pH>10.5主要存在形式是_ Y4-_。 3. 若每1000g水中含有50 g Pb2+, 则可将Pb2+的质量体积浓度表示为__50_g/L。 4. 已知NH3的pKb=4.74,则NH4+的Ka值为 5.5×10-10 。 5. 已知PAR指示剂的H2In和HIn-形式显黄色,In2-形式及其金属离子络合物均
为红色,PAR的pKa2 = 12.4。据此判断,PAR在pH < 12时,呈现 _黄色__颜色;变色点的pH = _12.4_;它在pH _< 12_范围,能用作金属指示剂。 6. 常量分析中,实验用的仪器是分析天平和50 mL滴定管,某生将称样和滴定的数据记为0.25 g和24.1 mL,正确的记录应为 0.2500g和 24.10mL 。,
7. 某(Na2CO3溶液32CONac = c mol/L,其物料平衡式为______________________________________________; 电荷平衡式为_____________________________________________________。 质子条件式为______________________________________________。
8. NaH2PO4溶液的PBE是 、 NH4Ac溶液的PBE是 。 9. 判断下列情况对测定结果的影响 (填偏高, 偏低, 无影响)。 (1) K2Cr2O7法测铁, SnCl2加入不足 _______偏低_________________ (2) 草酸标定 KMnO4时, 酸度过低 _______偏低_________________ 10、在重量法中,如果称量形式是Mg2P2O7,而被测组分是MgSO4·7H2O。换算因数为 。
三、计算题 ( 共 4题 36分 )
1. 测得某试样中钒的质量分数w(V)/%为:1.20, 1.27, 1.22, 1.15, 1.30。计算置信
度95%时平均值的置信区间。 f 4 5 6 t0.05 2.78 2.57 2.45
解:x=1.23%, s=0.059%
=x±nst4,05.01.23(%)07.023.15059.078.2
2. 计算pH=3.0和pH=4.0时,ZnY的条件稳定常数K'ZnY,判断能否准确滴定。已知:lgK ZnY =16.50,pH=2.0时lgαY(H)=13.79;pH=5.0时lgαY(H)=6.45。(7分)
