药物临床试验英文缩写总汇编
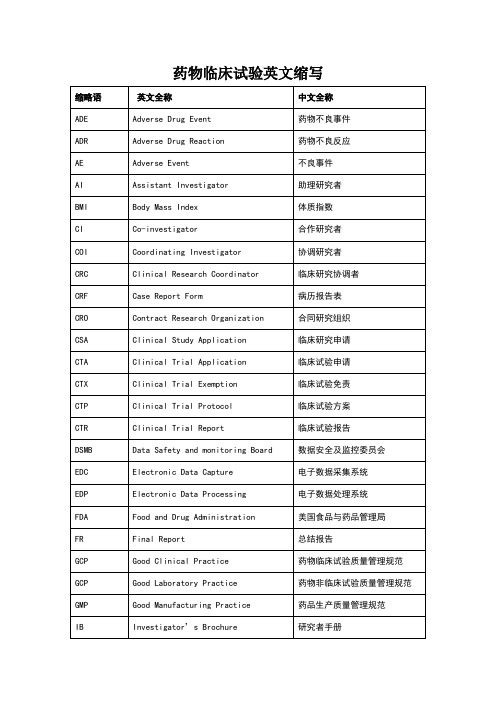
药物临床试验英文缩写

Investigator
研究者
Investigator’s brochure, IB
研究者手册
Last observation carry forward, LOCF
最接近一次观察的结转
LC-MS
上市前许可(申请)
PSI
Statisticians in the Pharmaceutical Industry
制药业统计学家协会
QA
Quality Assurance
质量保证
QC
Quality Control
质量控制
RA
Regulatory Authorities
监督管理部门
SA
Site Assessment
New Drug Entity
新化学实体
NIH
National Institutes of Health
国家卫生研究所(美国)
PI
Principal Investigator
主要研究者
PL
Product License
产品许可证
PMA
Pre-market Approval (Application)
合同研究组织
Contract/ agreement
协议/合同
Control group
对照组
Coordinating committee
协调委员会
Crea
肌酐
CRF(case report form)
病例报告表
Crossover design
交叉设计
Cross-over Study
交叉研究
Css
稳浓度
美国食品与药品管理局
药物临床试验英文词汇及缩写

药物临床试验英文缩写药物临床试验英文缩写实验室检查英文缩写Accuracy 准确度Active control, AC 阳性对照,活性对照Adverse drug reaction, ADR 药物不良反应Adverse event, AE 不良事件Adverse medical events 不良医学事件Adverse reaction 药物不良反应Alb 白蛋白ALD(Approximate Lethal Dose)近似致死剂量ALP 碱性磷酸酶Alpha spending function 消耗函数ALT 丙氨酸氨基转换酶Analysis sets 统计分析的数据集Approval 批准Assistant investigator 助理研究者AST 天门冬酸氨基转换酶ATR 衰减全反射法AUCss 稳态血药浓度-时间曲线下面积Audit 稽查Audit or inspection 稽查/视察Audit report 稽查报告Auditor 稽查员Bias 偏性,偏倚Bioequivalence 生物等效应Blank control 空白对照Blind codes 编制盲底Blind review 盲态审核Blind review 盲态检查Blinding method 盲法Blinding/ masking 盲法,设盲Block 分段Block 层Block size 每段的长度BUN 尿素氮Carryover effect 延滞效应Case history 病历Case report form 病例报告表Case report form/ case record form, CRF 病例报告表,病例记录表Categorical variable 分类变量Cav 平均浓度CD 圆二色谱CL 清除率Clinical equivalence 临床等效应Clinical study 临床研究Clinical study report 临床试验的总结报告Clinical trial 临床试验Clinical trial application, CTA 临床试验申请Clinical trial exemption, CTX 临床试验免责Clinical trial protocol, CTP 临床试验方案Clinical trial/ study report 临床试验报告Cmax 峰浓度Co-investigator 合作研究者Comparison 对照Compliance 依从性Composite variable 复合变量Computer-assisted trial design, CATD 计算机辅助试验设计Confidence interval 可信区间Confidence level 置信水平Consistency test 一致性检验Contract research organization, CRO 合同研究组织Contract/ agreement 协议/合同Control group 对照组Coordinating committee 协调委员会Crea 肌酐CRF(case report form)病例报告表Crossover design 交叉设计Cross-over study 交叉研究Css 稳浓度Cure 痊愈Data management 数据管理Database 建立数据库Descriptive statistical analysis 描述性统计分析DF 波动系统Dichotomies 二分类Diviation 偏差Documentation 记录/文件Dose-reaction relation 剂量-反应关系Double blinding 双盲Double dummy 双模拟Double dummy technique 双盲双模拟技术Double-blinding 双盲Drop out 脱落DSC 差示扫描热量计Effectiveness 疗效Electronic data capture, EDC 电子数据采集系统Electronic data processing, EDP 电子数据处理系统Emergency envelope 应急信件End point 终点Endpoint criteria/ measurement 终点指标Equivalence 等效性Essential documentation 必须文件Ethics committee 伦理委员会Excellent 显效Exclusion criteria 排除标准Factorial design 析因设计Failure 无效,失败Final point 终点Fixed-dose procedure 固定剂量法Forced titration 强制滴定Full analysis set 全分析集GC-FTIR 气相色谱-傅利叶红外联用GC-MS 气相色谱-质谱联用Generic drug 通用名药Global assessment variable 全局评价变量GLU 血糖Good clinical practice, GCP 药物临床试验质量管理规范Good manufacture practice, GMP 药品生产质量管理规范Good non-clinical laboratory practice, GLP 药物非临床研究质量管理规范Group sequential design 成组序贯设计Health economic evaluation, HEV 健康经济学评价Hypothesis test 假设检验Hypothesis testing 假设检验International Conference of Harmonization, ICH 人用药品注册技术要求国际技术协调会,国际协调会议Improvement 好转Inclusion criteria 入选标准Independent ethics committee, IEC 独立伦理委员会Information consent form, ICF 知情同意书Information gathering 信息收集Informed consent, IC 知情同意Initial meeting 启动会议Inspection 视察/检查Institution inspection 机构检查Institution review board, IBR 机构审查委员会Intention to treat 意向治疗(——临床领域)Intention-to –treat, ITT 意向性分析(-统计学)Interactive voice response system, IVRS 互动式语音应答系统Interim analysis 期中分析Investigator 研究者Investigator's brochure, IB 研究者手册IR 红外吸收光谱Ka 吸收速率常Last observation carry forward, LOCF 最接近一次观察的结转LC-MS 液相色谱-质谱联用LD50 板数致死剂量Logic check 逻辑检查LOQ (Limit of Quantitation)定量限LOCF, Last observation carry forward 最近一次观察的结转Lost of follow up 失访Marketing approval/ authorization 上市许可证Matched pair 匹配配对Missing value 缺失值Mixed effect model 混合效应模式Monitor 监查员Monitoring 监查Monitoring report 监查报告MRT 平均滞留时间MS 质谱MS-MS 质谱-质谱联用MTD(Maximum Tolerated Dose)最大耐受剂量Multicenter trial 多中心试验Multi-center trial 多中心试验New chemical entity, NCE 新化学实体New drug application, NDA 新药申请NMR 核磁共振谱Non-clinical study 非临床研究Non-inferiority 非劣效性Non-parametric statistics 非参数统计方法Obedience 依从性ODR 旋光光谱Open-blinding 非盲Open-label 非盲Optional titration 随意滴定Original medical record 原始医疗记录Outcome 结果Outcome assessment 结果指标评价Outcome measurement 结果指标Outlier 离群值Parallel group design 平行组设计Parameter estimation 参数估计Parametric statistics 参数统计方法Patient file 病人档案Patient history 病历Per protocol,PP 符合方案集Placebo 安慰剂Placebo control 安慰剂对照Polytomies 多分类Power 检验效能Precision 精密度Preclinical study 临床前研究Primary endpoint 主要终点Primary variable 主要变量Principal investigator 主要研究者Principle investigator,PI 主要研究者Product license,PL 产品许可证Protocol 试验方案Protocol 试验方案Protocol amendment 方案补正Quality assurance unit,QAU 质量保证部门Quality assurance,QA 质量保证Quality control,QC 质量控制Query list,query form 应用疑问表Randomization 随机化Randomization 随机Range check 范围检查Rating scale 量表Regulatory authorities,RA 监督管理部门Replication 可重复RSD 日内和日间相对标准差Run in 准备期Safety evaluation 安全性评价Safety set 安全性评价的数据集Sample size 样本含量Sample size 样本量,样本大小Scale of ordered categorical ratings 有序分类指标Secondary variable 次要变量Sequence 试验次序Serious adverse event,SAE 严重不良事件Serious adverse reaction,SAR 严重不良反应Seriousness 严重性Severity 严重程度Significant level 检验水准Simple randomization 简单随机Single blinding 单盲Single-blinding 单盲Site audit 试验机构稽查SOP 试验室的标准操作规程Source data verification,SDV 原始数据核准Source data,SD 原始数据Source document,SD 原始文件Specificity 特异性Sponsor 申办者Sponsor-investigator 申办研究者Standard curve 标准曲线Standard operating procedure,SOP 标准操作规程Statistic 统计量Statistical analysis plan 统计分析计划Statistical analysis plan 统计参数计划书Statistical analysis plan,SAP 统计分析计划Statistical model 统计模型Statistical tables 统计分析表Stratified 分层Study audit 研究稽查Subgroup 亚组Sub-investigator 助理研究者Subject 受试者Subject diary 受试者日记Subject enrollment 受试者入选Subject enrollment log 受试者入选表Subject identification code,SIC 受试者识别代码Subject recruitment 受试者招募Subject screening log 受试者筛选表Superiority 检验Survival analysis 生存分析SXRD 单晶X-射线衍射System audit 系统稽查T1/2 消除半衰期Target variable 目标变量T-BIL 总胆红素T-CHO 总胆固醇TG 热重分析TLC、HPLC 制备色谱Tmax 峰时间TP 总蛋白Transformation 变量变换Treatment group 试验组Trial error 试验误差Trial master file 试验总档案Trial objective 试验目的Trial site 试验场所Triple blinding 三盲Two one-side test 双单侧检验Unblinding 揭盲Unblinding 破盲Unexpected adverse event,UAE 预料外不良事件UV-VIS 紫外-可见吸收光谱Variability 变异Variable 变量Visual analogy scale 直观类比打分法Visual check 人工检查Vulnerable subject 弱势受试者Wash-out 清洗期Washout period 洗脱期Well-being 福利,健康1.临床试验(Clinical Trial):指任何在人体(病人或健康志愿者身上)进行药品的系统性研究,以证实或揭示研究药品的作用、不良反应及/或试验用药品的吸收、分布、代谢和排泄,目的是确定研究药品的疗效与安全性。
完整word版,临床试验常见英文缩写

临床试验常见英文缩写ADR(Adverse drug reaction)不良反应AE(Adverse event)不良事件SAE(Serious Adverse Event)严重不良事件CRF(Case report form/case record form)病例报告表CRO(Contract research organization)合同研究组织EC(Ethics Committee)伦理委员会GCP(Good clinical practice)药品临床试验管理规范EDC(Electronic data capture)电子数据采集IB(Investigator's Brochure)研究者手册ND (Not Done) 未做NA (Not Applicable) 不适用UK (Unknown) 未知PI(Principal investigator )主要研究者Sub-I(Sub-investigator) 助理研究者QA(Quality assurance) 质量保证QC(Quality control) 质量控制SDV(Source data verification)原始资料核对SD(Source data)原始数据SD(Source document ) 原始文件SFDA 国家食品药品监督管理局SOP(Standard operating procedure) 标准操作规程IRB 机构审查委员会ICF(Informed Consent Form) 知情同意书TMF(trial master file)研究管理文件夹临床试验常见英文单词A•Active control ,AC 阳性对照,活性对照阳性对照,活性对照•Adverse drug reaction ,ADR 药物不良反应药物不良反应•Adverse event ,AE 不良事件•Approval 批准•Assistant investigator 助理研究者•Audit 稽查•Audit report 稽查报告•Auditor 稽查员B•Bias 偏性,偏倚•Blank control 空白对照•Blinding/masking 盲法,设盲•Block 层C•Case history 病历•Case report form/case record form ,CRF 病例报告表,病例记录表•Clinical study 临床研究•Clinical trial 临床试验•Clinical trial application ,CTA 临床试验申请•Clinical trial exemption ,CTX 临床试验免责•Clinical trial protocol ,CTP 临床试验方案•Clinical trial/study report 临床试验报告•COA(药品检测报告)•Co-investigator 合作研究者•Comparison 对照•Compliance 依从性•Computer-assisted trial design ,CATD 计算机辅助试验设计•Contract research organization ,CRO 合同研究组织•Contract/agreement 协议/合同•Coordinating committee 协调委员会•Coordinating investigator 协调研究者•Cross-over study 交叉研究•Cure 痊愈•CTRB 临床试验文件夹D•Documentation 记录/文件•Dose-reaction relation 剂量—反应关系•Double blinding 双盲•Double dummy technique 双盲双模拟技术E•Electronic data capture ,EDC 电子数据采集系统•Electronic data processing ,EDP 电子数据处理系统•Endpoint criteria/measurement 终点指标•Essential documentation 必需文件•Excellent 显效•Exclusion criteria 排除标准F•Failure 无效,失败•Final report 总结报告•Final point 终点•Forced titration 强制滴定G&H•Global 全球•Generic drug 通用名药•Good clinical practice ,GCP 药物临床试验质量管理规定•Good manufacture practice ,GMP 药品生产质量管理规范•Good non-clinical laboratory practice ,GLP 药物非临床研究质量管理规范•Health economic evaluation ,HEV 健康经济学评价•Hypothesis testing 假设检验I•Improvement 好转•Inclusion criteria 入选标准•Independent ethics committee ,IEE 独立伦理委员会•Information gathering 信息收集•Informed consent form ,ICF 知情同意书•Informed consent ,IC 知情同意•Initial meeting 启动会议•Inspection 视察/检查•Institution inspection 机构检查•Institutional review board ,IBR 机构审查委员会•Intention to treat 意向治疗•Interactive voice response system ,IVRS 互动式语音应答系统•International Conference on Harmonization ,ICH 国际协调会议•Investigational new drug ,IND 新药临床研究•Investigational product 试验药物•Investigator 研究者•Investigator’s brochure ,IB 研究者手册L•Local 局部M&N•Marketing approval/authorization 上市许可证•Matched pair 匹配配对•Monitor 监查员•Monitoring 监查•Monitoring report 监查报告•Multi-center trial 多中心试验•New chemical entity ,NCE 新化学实体•New drug application ,NDA 新药申请•Non-clinical study 非临床研究O•Obedience 依从性•Optional titration 随意滴定•Original medical record 原始医疗记录•Outcome 结果•Outcome assessment 结果指标评价•Outcome measurement 结果指标P•Patient file 病人指标•Patient history 病历•Placebo 安慰剂•Placebo control 安慰剂对照•Preclinical study 临床前研究•Principle investigator ,PI 主要研究者•Product license ,PL 产品许可证•Protocol 试验方案•Protocol amendment 方案补正Q&R•Quality assurance ,QA 质量保证•Quality assurance unit ,QAU 质量保证部门•Quality control ,QC 质量控制•Randomization 随机•Regulatory authorities ,RA 监督管理部门•Replication 可重复•Run in 准备期S•Sample size 样本量,样本大小•Serious adverse event ,SAE 严重不良事件•Serious adverse reaction ,SAR 严重不良反应•Seriousness 严重性•Severity 严重程度•Simple randomization 简单随机•Single blinding 单盲•Site audit 试验机构稽查•Source data ,SD 原始数据•Source data verification ,SDV 原始数据核准•Source document ,SD 原始文件•Sponsor 申办者•Sponsor-investigator 申办研究者•Standard operating procedure ,SOP 标准操作规程•Statistical analysis plan ,SAP 统计分析计划•Study audit 研究稽查•Subgroup 亚组•Sub-investigator 助理研究者•Subject 受试者•Subject diary 受试者日记•Subject enrollment 受试者入选•Subject enrollment log 受试者入选表•Subject identification code ,SIC 受试者识别代码•Subject recruitment 受试者招募•Subject screening log 受试者筛选表•System audit 系统稽查T&U•Trial error 试验误差•Trial master file 试验总档案•Trial objective 试验目的•Trial site 试验场所•Triple blinding 三盲•Unblinding 破盲•Unexpected adverse event ,UAE 预料外不良事件V&W•Variability 变异•Visual analogy scale 直观类比打分法•Vulnerable subject 弱势受试者•Wash-out 清洗期•Well-being 福利,健康EDC 系统常见英文缩写•1.SCR (screening) 筛选•2.DOV (date of visit) 访视第一天•3.ELIG ( ELIGIBILITY ) 入排合格•4.DEM ( DEMOGRAPHY )人口统计学•5.MEDSX (medical history) 既往史•MHX1 : CANCER RELATED CURRENT MEDICAL CONDITIONS 该肿瘤手术史及肿瘤相关症状•MHX2 : NON-CANCER RELATED MEDICAL CONDITIONS•与该肿瘤无关的病史•6.VS /VITALS ( VITAL SIGNS ) 生命体征•7.ECOG/PS 体能评分note:后面具体讲解•8. ECG : 12-LEAD ECG 心电图•9. ECHO ( ECHOCARDIOGRAM ) 超声心动图•10. HAEMA ( LOCAL LABORATORY –HAEMATOLOGY )血常规•11. CHEM ( LOCAL LABORATORY –CLINICAL CHEMISTRY )血生化•12. URIN ( urine ) 尿常规•13. C1 ( Cycle1 ) 第一周期•14. WD : End of Therapy/DISCONTINUATION 结束治疗(停止用药)•15. FU ( Follow-up ) 随访•16.CMED( CONCOMITANT MEDICATIONS ) 伴随药物•17. AE ( NON-SERIOUS ADVERSE EVENTS ) 不良事件•18. SAE ( SERIOUS ADVERSE EVENTS ) 严重不良事件•19. EOS( End of Study ) 结束研究:肿瘤以病人死亡事件为准•20. UNS ( Unscheduled Visit ) 不预期访问•21.ND (Not Done) 未做•22. NA (Not Applicable) 不适用• (Unknown) 未知临床试验常见语句描述一. 临床试验过程描述1)一般描述:1. Subject was diagnosed with XX in September, 2010, and had XX surgery in December, 2010.患者于2010 年9 月确诊XX 疾病,于2010 年12 月行XX 术。
药物临床试验英文缩写

应急信件
End point
终点
Endpoint Criteria
终点指标
Endpoint criteria/ measurement
终点指标
Equivalence
等效性
Essential Documentation
必需文件
Ethics committee
伦理委员会
气相色谱-傅利叶红外联用
GC-MS
气相色谱-质谱联用
Generic drug
通用名药
Global assessment variable
全局评价变量
GLU
血糖
Good clinical practice, GCP
药物临床试验质量管理规范
Good manufacture practice, GMP
药品生产质量管理规范
药物临床试验英文缩写
药物临床试验英文缩写
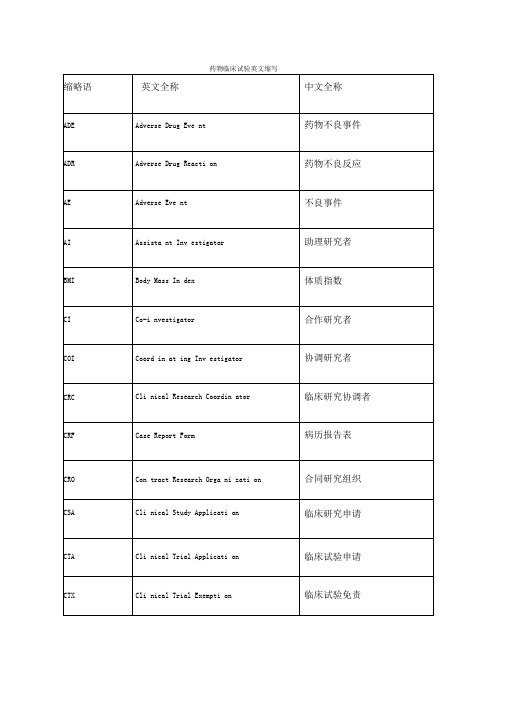
缩略语
英文全称
中文全称
ADE
Adverse Drug Event
药物不良事件
ADR
Adverse Drug Reaction
药物不良反应
AE
Adverse Event
不良事件
AI
Assistant Investigator
助理研究者
BMI
Body Mass Index
信息收集
Informed consent IC
知情同意
Initial meeting
启动会议
Inspection
检察/视察
Institution inspection
机构检查
Institution review board, IBR
药物临床试验英文缩写
Good Manu facturi ng Practice
药品生产质量管理规范
IB
Investigator's Brochure
研究者手册
IC
In formed Consent
知情同意
ICF
In formed Consent Form
知情同意书
缩略语
英文全称
中文全称
ICH
Intern ati onalConferenceon
Harm oni zati on
国际协调会议
IDM
In depe ndent Data Mon itori ng
独立数据监察
IDMC
In depe ndentDataMon itori ng
Committee
独立数据监察委员会
IEC
In depe ndent Ethics Committee
独立伦理委员会
受试和参比试剂
UAE
Un expected Adverse Eve nt
预料外不良事件
WHO
World Health Orga ni zati on
世界卫生组织
缩略语
英文全称
中文全称
WHO-ICDRA
WHO Intern ati onal Conference of
WHO国际药品管理当局会
Drug Regulatory Authorities
中文全称
NEC
New Drug En tity
新化学实体
NIH
National Institutes of Health
国家卫生研究所(美国)
PI
Prin cipal Inv estigator
药物临床试验英文缩写

IC
Informed Consent
知情同意
ICF
Informed Consent Form
知情同意书
ICH
International Conference on Harmonization
国际协调会议
IDM
Independent Data Monitoring
独立数据监察
IDMC
Independent Data Monitoring Committee
Cure
痊愈
Data management
数据管理
Database
建立数据库
Descriptive statistical analysis
描述性统计分析
DF
波动系统
Dichotomies
二分类
Diviation
偏差
Documentation
记录/文件
Dose-reaction relation
剂量-反应关系
合同研究组织
Contract/ agreement
协议/合同
Control group
对照组
Coordinating committee
协调委员会
Crea
肌酐
CRF(case report form)
病例报告表
Crossover design
交叉设计
Cross-over Study
交叉研究
Css
稳浓度
试验药物
Investigator
研究者
Investigator’s brochure, IB
研究者手册
Last observation carry forward, LOCF
临床试验常用英文缩写及注释参考

临床试验常用英文缩写及注释参考1. IRB:Institutional Review Board,研究机构审评委员会。
负责审核和批准医学研究,确保受试者的权益得到保障。
2. CRA:Clinical Research Associate,临床研究助理。
负责临床试验的执行和监督,协助研究者完成各项任务。
3. SAE:Serious Adverse Event,严重不良事件。
临床试验期间发生的任何导致死亡、危及生命、重要器官功能或功能衰竭等严重后果的事件。
4. SPC:Summary Safety Profile,汇总安全性摘要。
临床试验结束后,对试验期间发生的不良事件进行汇总和分析,以评估试验的安全性。
5. ECG:Electrocardiogram,心电图。
用于监测心血管系统状况,评估药物对心脏的影响。
6. TDM:Therapeutic Drug Monitoring,治疗药物监测。
用于评估药物在患者体内的浓度,以指导临床用药。
7. IRN:Interim Analysis,中期分析。
在临床试验中期对数据进行分析,评估试验的效果和可行性。
8. RCT:Randomized Controlled Trial,随机对照试验。
一种常见的临床试验设计方法,将受试者随机分为试验组和对照组,比较试验药物和安慰剂或常规治疗的效果。
9. MTD:Maximum Tolerated Dose,最大耐受剂量。
在临床试验中,找到能够使大多数受试者耐受的最大药物剂量。
10. DLT:Dose-Limiting Toxicity,剂量限制毒性。
在临床试验中,观察到任何可能导致严重不适或威胁生命的副作用,被认为是继续增加剂量的限制条件。
11. PP population:入选患者群体。
在临床试验中,指符合入选标准并完成试验的患者群体。
12. OMP:Observational Medical Outcomes Project,观察性医学项目。
临床实验常用缩写英文

临床实验常用缩写英文临床实验是医学领域中进行药物研发和治疗方法评估的重要环节。
为了方便专业人士之间的交流和信息传递,临床实验中常使用一些缩写的英文术语。
本文将介绍一些常用的临床实验缩写英文及其对应的含义。
1. ADME:吸收(absorption)、分布(distribution)、代谢(metabolism)、排泄(excretion)。
该缩写用于描述在药物体内的吸收、分布、代谢和排泄等过程。
2. ADR:不良药物反应(Adverse Drug Reaction)。
用于描述患者在接受药物治疗过程中出现的不良反应或副作用。
3. AE:不良事件(Adverse Event)。
与ADR类似,用于描述患者在治疗过程中出现的任何不良事件或反应。
4. BLA:生物类似药(Biologics License Application)。
是指生物医药产品的许可申请,通常用于申请生物类似药的上市许可。
5. CRO:合同研究组织(Contract Research Organization)。
专门从事临床试验的服务机构,负责执行和管理临床试验项目。
6. CT:临床试验(Clinical Trial)。
用于描述进行人类临床试验的过程和方法。
7. DDI:药物相互作用(Drug-Drug Interaction)。
用于描述两种或多种药物在体内相互影响的情况。
8. EOD:每日一次(Every Other Day)。
用于描述用药频率,表示每隔一天一次。
9. GCP:良好临床实践(Good Clinical Practice)。
是临床研究的国际质量标准,确保临床试验的安全性和质量。
10. IND:新药批准申请(Investigational New Drug Application)。
用于描述新药研发过程中提交给监管机构的申请文件。
11. NDA:新药申请(New Drug Application)。
是用于申请新药上市许可的文件。
药物临床试验英文缩写

DSMB
Data Safety and monitoring Board
数据安全及监控委员会
EDC
Electronic Data Capture
电子数据采集系统
EDP
Electronic Data Processing
电子数据处理系统
FDA
Food and Drug Administration
Emergency envelope
应急信件
End point
终点
Endpoint Criteria
终点指标
Endpoint criteria/ measurement
终点指标
Equivalence
等效性
Essential Documentation
必需文件
Ethics committee
伦理委员会
药物临床试验英文缩写
英文全称
中文全称
Accuracy
准确度
Active control, AC
阳性对照活性对照
Adverse drug reaction, ADR
药物不良反应
Adverse event, AE
不良事件
Adverse medical events
不良医学事件
Adverse reaction
研究者手册
IC
Informed Consent
知情同意
ICF
Informed Consent Form
知情同意书
ICH
International Conference on Harmonization
国际协调会议
IDM
Independent Data Monitoring
药物临床试验英文缩写汇编

药物临床试验英文缩写药物临床试验英文缩写研究者(Investigator),实施临床试验并对临床试验的质量及受试者安全和权益的负责者。
研究者必须经过资格审查,具有临床试验的专业特长、资格和能力。
协调研究者(CoordinatingInvestigator),在多中心临床试验中负责协调参加各中心研究者工作的一名研究者。
申办者(Sponsor),发起一项临床试验,并对该试验的启动、管理、财务和监查负责的公司、机构或组织。
监查员(Monitor),由申办者任命并对申办者负责的具备相关知识的人员,其任务是监查和报告试验的进行情况和核实数据。
稽查(Audit),指由不直接涉及试验的人员所进行的一种系统性检查,以评价试验的实施、数据的记录和分析是否与试验方案、标准操作规程以及药物临床试验相关法规要求相符。
视察(Inspection),药品监督管理部门对一项临床试验的有关文件、设施、记录和其它方面进行官方审阅,视察可以在试验单位、申办者所在地或合同研究组织所在地进行。
病例报告表(CaseReportForm,CRF),指按试验方案所规定设计的一种文件,用以记录每一名受试者在试验过程中的数据。
试验用药品(InvestigationalProduct),用于临床试验中的试验药物、对照药品或安慰剂。
不良事件(AdverseEvent),病人或临床试验受试者接受一种药品后出现的不良医学事件,但并不一定与治疗有因果关系。
严重不良事件(SeriousAdverseEvent),临床试验过程中发生需住院治疗、延长住院时间、伤残、影响工作能力、危及生命或死亡、导致先天畸形等事件。
标准操作规程(StandardOperatingProcedure,SOP),为有效地实施和完成某一临床试验中每项工作所拟定的标准和详细的书面规程。
设盲(Blinding/Masking),临床试验中使一方或多方不知道受试者治疗分配的程序。
单盲指受试者不知,双盲指受试者、研究者、监查员或数据分析者均不知治疗分配。
药物临床试验英文缩写汇编

药物临床试验英文缩写药物临床试验英文缩写研究者(Investigator),实施临床试验并对临床试验的质量及受试者安全和权益的负责者。
研究者必须经过资格审查,具有临床试验的专业特长、资格和能力。
协调研究者(CoordinatingInvestigator),在多中心临床试验中负责协调参加各中心研究者工作的一名研究者。
申办者(Sponsor),发起一项临床试验,并对该试验的启动、管理、财务和监查负责的公司、机构或组织。
监查员(Monitor),由申办者任命并对申办者负责的具备相关知识的人员,其任务是监查和报告试验的进行情况和核实数据。
稽查(Audit),指由不直接涉及试验的人员所进行的一种系统性检查,以评价试验的实施、数据的记录和分析是否与试验方案、标准操作规程以及药物临床试验相关法规要求相符。
视察(Inspection),药品监督管理部门对一项临床试验的有关文件、设施、记录和其它方面进行官方审阅,视察可以在试验单位、申办者所在地或合同研究组织所在地进行。
病例报告表(CaseReportForm,CRF),指按试验方案所规定设计的一种文件,用以记录每一名受试者在试验过程中的数据。
试验用药品(InvestigationalProduct),用于临床试验中的试验药物、对照药品或安慰剂。
不良事件(AdverseEvent),病人或临床试验受试者接受一种药品后出现的不良医学事件,但并不一定与治疗有因果关系。
严重不良事件(SeriousAdverseEvent),临床试验过程中发生需住院治疗、延长住院时间、伤残、影响工作能力、危及生命或死亡、导致先天畸形等事件。
标准操作规程(StandardOperatingProcedure,SOP),为有效地实施和完成某一临床试验中每项工作所拟定的标准和详细的书面规程。
设盲(Blinding/Masking),临床试验中使一方或多方不知道受试者治疗分配的程序。
单盲指受试者不知,双盲指受试者、研究者、监查员或数据分析者均不知治疗分配。
药物临床试验英文词汇及缩写

药物临床试验英文词汇及缩写药物临床试验英文缩写缩略语英文全称中文全称ADE Adverse Drug Event 药物不良事件ADR Adverse Drug Reaction 药物不良反应AE Adverse Event 不良事件AI Assistant Investigator 助理研究者BMI Body Mass Index 体质指数CI Co-investigator 合作研究者COI CoordinatingInvestigator 协调研究者CRC Clinical ResearchCoordinator 临床研究协调者CRF Case Report Form 病历报告表称CRO Contract ResearchOrganization 合同研究组织CSA Clinical StudyApplication 临床研究申请CTA Clinical TrialApplication 临床试验申请CTX Clinical TrialExemption 临床试验免责CTP Clinical Trial Protocol 临床试验方案CTR Clinical Trial Report 临床试验报告DSMB Data Safety andmonitoring Board 数据安全及监控委员会EDC Electronic DataCapture 电子数据采集系统EDP Electronic Data 电子数称Processing 据处理系统FDA Food and DrugAdministration 美国食品与药品管理局FR Final Report 总结报告GCP Good Clinical Practice 药物临床试验质量管理规范GCP Good LaboratoryPractice 药物非临床试验质量管理规范GMP Good ManufacturingPractice 药品生产质量管理规称范IB Investigator’s Brochure 研究者手册IC Informed Consent 知情同意ICF Informed ConsentForm 知情同意书ICH InternationalConference onHarmonization 国际协调会议IDM Independent DataMonitoring 独立数据监察IDMC Independent DataMonitoring Committee 独立数据监察委员会IEC Independent EthicsCommittee 独立伦理委员会IND Investigational NewDrug 新药临床研究称IRB Institutional ReviewBoard 机构审查委员会IVD In Vitro Diagnostic 体外诊断IVRS Interactive VoiceResponse System 互动语音应答系统MA MarketingApproval/Authorization 上市许可证MCA Medicines ControlAgency 英国药品监督局MHW Ministry of Health andWelfare 日本卫生福利部NDA New Drug Application 新药申请NEC New Drug Entity 新化学实体称NIH National Institutes ofHealth 国家卫生研究所(美国)PI Principal Investigator 主要研究者PL Product License 产品许可证PMA Pre-market Approval(Application) 上市前许可(申请)PSI Statisticians in thePharmaceuticalIndustry 制药业统计学家协会QA Quality Assurance 质量保证QC Quality Control 质量控制RA Regulatory Authorities 监督管称理部门SA Site Assessment 现场评估SAE Serious Adverse Event 严重不良事件SAP Statistical Analysis Plan 统计分析计划SAR Serious AdverseReaction 严重不良反应SD Source Data/Document 原始数据/文件SD Subject Diary 受试者日记SFDA State Food and DrugAdministration 国家食品药品监督管理局SDV Source DataVerification 原始数据核准称SEL Subject Enrollment Log 受试者入选表SI Sub-investigator 助理研究者SI Sponsor-Investigator 申办研究者SIC Subject IdentificationCode 受试者识别代码SOP Standard OperatingProcedure 标准操作规程SPL Study Personnel List 研究人员名单SSL Subject Screening Log 受试者筛选表T&R Test and ReferenceProduct 受试和参比试剂UAE Unexpected AdverseEvent 预料外不良事称件WHO World HealthOrganization 世界卫生组织WHO-ICDRA WHO InternationalConference ofDrug RegulatoryAuthorities WHO 国际药品管理当局会议药物临床试验英文缩写英文全称中文全称Accuracy 准确度Active control, AC 阳性对照活性对照Adverse drug reaction, 药物不良反应ADRAdverse event, AE 不良事件Adverse medical events 不良医学事件Adverse reaction 药物不良反应Alb 白蛋白ALD(Approximate近似致死剂量Lethal Dose)ALP 碱性磷酸酶消耗函数Alpha spendingfunctionALT 丙氨酸氨基转换酶Analysis sets 统计分析的数据集Approval 批准Assistant investigator 助理研究者AST 天门冬酸氨基转换酶ATR 衰减全反射法AUCss 稳态血药浓度-时间曲线下面积Audit 稽查Audit or inspection 稽查/视察Audit report 稽查报告Auditor 稽查员Bias 偏性偏倚Bioequivalence 生物等效应Blank control 空白对照Blind codes 编制盲底Blind review 盲态审核Blind review 盲态检查Blinding method 盲法Blinding/masking 盲法/设盲Block 层Block size 每段的长度Carryover effect 延滞效应Case history 病历Case report form/ case record form CRF病例报告表病例记录表Categorical variable 分类变量Cav 平均浓度CD 圆二色谱CL 清除率Clinical equivalence 临床等效应Clinical study 临床研究Clinical study report 临床试验的总结报告Clinical trial 临床试验临床试验申请Clinical trialapplication CTA临床试验免责Clinical trial exemptionCTXClinical trial protocol临床试验方案CTP临床试验报告Clinical trial/ studyreportCmax 峰浓度Co-investigator 合作研究者Comparison 对照Compliance 依从性Composite variable 复合变量计算机辅助试验设计Computer-assisted trialdesign CATDConfidence interval 可信区间Confidence level 置信水平Consistency test 一致性检验Contract research 合同研究组织organization CROContract/ agreement 协议/合同Control group 对照组协调委员会CoordinatingcommitteeCrea 肌酐CRF(case report form) 病例报告表Crossover design 交叉设计Cross-over Study 交叉研究Css 稳浓度Cure 痊愈Data management 数据管理Database 建立数据库描述性统计分析Descriptive statisticalanalysisDF 波动系统Dichotomies 二分类Diviation 偏差Documentation 记录/文件Dose-reaction relation 剂量-反应关系Double dummy 双模拟Double dummy双盲双模拟技术techniqueDrop out 脱落DSC 差示扫描热量计Effectiveness 疗效Electronic data capture电子数据采集系统EDC电子数据处理系统Electronic dataprocessing EDPEmergency envelope 应急信件End point 终点Endpoint Criteria 终点指标终点指标Endpoint criteria/measurementEquivalence 等效性必需文件EssentialDocumentationEthics committee 伦理委员会Excellent 显效Exclusion criteria 排除标准Factorial design 析因设计Failure 无效失败Final point 终点Fixed-dose procedure 固定剂量法Forced titration 强制滴定Full analysis set 全分析集GC-FTIR 气相色谱-傅利叶红外联用GC-MS 气相色谱-质谱联用Generic drug 通用名药Global assessmentvariable全局评价变量GLU 血糖Good clinical practice, GCP 药物临床试验质量管理规范Good manufacture practice, GMP药品生产质量管理规范Good non-clinical laboratory practice, GLP药物非临床研究质量管理规范Group sequentialdesign成组序贯设计Health economicevaluation, HEV健康经济学评价Hypothesis test 假设检验Hypothesis testing 假设检验Improvement 好转Inclusion Criteria 入选表准Inclusion criteria 入选标准Independent ethicscommittee IEC独立伦理委员会Information consentform ICF知情同意书Information Gathering 信息收集Informed consent IC 知情同意Initial meeting 启动会议Inspection 检察/视察Institution inspection 机构检查Institution reviewboard, IBR机构审查委员会Intention-to –treat ITT 意向性分析(-统计学)Interactive voice 互动式语音应答系统response systemIVRSInterim analysis 期中分析International Conference of Harmonization ICH 人用药品注册技术要求国际技术协调会国际协调会议Investigational Product 试验药物Investigator 研究者Investigator’sbrochure, IB研究者手册Last observation carryforward, LOCF最接近一次观察的结转LC-MS 液相色谱-质谱联用LD50 板数致死剂量LOCF, Lastobservation carryforward最近一次观察的结转Logic check 逻辑检查LOQ (Limit ofQuantization)定量限Lost of follow up 失访Marketing approval/上市许可证authorizationMatched pair 匹配配对Missing value 缺失值Mixed effect model 混合效应模式Monitor 监察员Monitoring 监查Monitoring Plan 监察计划Monitoring Report 监察报告MRT 平均滞留时间MS 质谱MS-MS 质谱-质谱联用MTD(Maximum最大耐受剂量Tolerated Dose)Multi-center Trial 多中心试验新化学实体New chemical entityNCENew drug application新药申请NDANMR 核磁共振谱Non-clinical Study 非临床研究Non-inferiority 非劣效性Non-parametric非参数统计方法statisticsObedience 依从性ODR 旋光光谱Open-label 非盲Optional titration 随意滴定原始医疗记录Original medicalrecordOutcome 结果Outcome Assessment 结果评价Outcome assessment 结果指标评价Outcome measurement 结果指标Outlier 离群值Parallel group design 平行组设计Parameter estimation 参数估计Parametric statistics 参数统计方法Patient file 病人档案Patient history 病历Per protocol PP 符合方案集Placebo 安慰剂Placebo control 安慰剂对照Polytomies 多分类Power 检验效能Precision 精密度Preclinical study 临床前研究Primary endpoint 主要终点Primary variable 主要变量Principle investigator主要研究者PIProduct license PL 产品许可证Protocol 试验方案Protocol Amendments 修正案Quality assurance QA 质量保证质量保证部门Quality assurance unitQAUQuality control QC 质量控制Query list query应用疑问表formRandomization 随机Range check 范围检查Rating scale 量表Reference Product 参比制剂监督管理部门Regulatory authoritiesRAReplication 可重复RSD 日内和日间相对标准差Run in 准备期Safety evaluation 安全性评价Safety set 安全性评价的数据集Sample size 样本量样本大小有序分类指标Scale of orderedcategorical ratingsSecondary variable 次要变量Sequence 试验次序严重不良事件Serious adverse eventSAE严重不良反应Serious adversereaction SARSeriousness 严重性Severity 严重程度Severity 严重程度Significant level 检验水准Simple Randomization 简单随机Single blinding 单盲Site audit 试验机构稽查SOP 试验室的标准操作规程Source data SD 原始数据Source data原始数据核准verification SDVSource document SD 原始文件Specificity 特异性Sponsor 申办者Sponsor-investigator 申办研究者Standard curve 标准曲线标准操作规程Standard operatingprocedure SOPStatistic 统计量Statistical analysis plan 统计分析计划Statistical model 统计模型Statistical tables 统计分析表Stratified 分层Study Audit 研究稽查Study audit 研究稽查Study Site 研究中心Subgroup 亚组Sub-investigator 助理研究者Subject 受试者Subject 受试者Subject diary 受试者日记Subject Enrollment 受试者入选Subject enrollment log 受试者入选表受试者识别代码Subject identificationcode SIC受试者识别代码表Subject IdentificationCode ListSubject Recruitment 受试者招募Subject screening log 受试者筛选表Superiority 检验Survival analysis 生存分析SXRD 单晶X-射线衍射System audit 系统稽查System Audit 系统稽查T1/2 消除半衰期Target variable 目标变量T-BIL 总胆红素T-CHO 总胆固醇Test Product 受试制剂TG 热重分析TLC、HPLC 制备色谱Tmax 峰时间TP 总蛋白Transformation 变量变换Treatment group 试验组Trial error 试验误差Trial Initial Meeting 试验启动会议Trial Master File 试验总档案Trial objective 试验目的Trial site 试验场所Triple blinding 三盲Two one-side test 双单侧检验Un-blinding 揭盲Unexpected adverse预料外不良事件event UAEUV-VIS 紫外-可见吸收光谱Variability 变异Variable 变量Visual analogy scale 直观类比打分法Visual check 人工检查Vulnerable subject 弱势受试者Wash-out 洗脱Washout period 洗脱期实验室检查英文缩写英文全称中文全称血常规白细胞计数WBC white blood cellcountGR% granulocyte 中性粒细胞百分比LY% lymphocyte 淋巴细胞百分比MID% 中值细胞百分比EOS% eosimophil 嗜酸性粒细胞百分比AL% allergylymphocyte变异淋巴细胞百分比ST% 中性杆状粒细胞百分比RBC red blood cell 红细胞计数HGB hemoglobin 血红蛋白HCT hematocrit 红细胞比积红细胞比积MCV mean corpusularvolume平均红细胞体积MCH mean corpusular hemoglobin 平均红细胞血红蛋白含量MCHC mean corpusular hemoglobin concerntration 平均红细胞血红蛋白浓度RDW red blood cellvolume distributionwidth红细胞分布宽度变异PLT/BPC plateletcount/blood plateletcount血小板计数MPV mean platelet 平均血小板体积volumePCT plateletocrit 血小板比积血小板分布宽度PDW plateletdistribution width尿便常规PH acidity 酸碱度NIT nitrite 亚硝酸盐GLU glucose 尿糖SG specific gravity 比重PRO protein 尿蛋白BLD blood 隐血BIL bilirubin 尿胆红素URO urobilinogen 尿胆原WBC white blood cell 白细胞艾迪氏计数addish计数addishcount每高倍视野/HP high powerobjective/LP low power每低倍视野objectiveOB occult blood test 大便隐血试验体液常规CSF cerebrospinal 脑积夜Pandy pandy 庞氏试验生化检验TB total bilirubin 总胆红素DB direct bilirubin 直接胆红素TP total protein 总蛋白ALB albumin 白蛋白GLOB globulin 球蛋白UREA urea 尿素CREA creatinine 肌肝UA uric acid 尿酸GLU glucose 血糖ALT alanine丙氨酸氨基转移酶amiotransferase门冬氨酸氨基转移酶AST aspartateaminotransferaseGGT γ-glutamyl谷氨酰转肽酶transpeptadaseCK creatine kinase 肌酸肌酶CK-MB creatine 肌酸肌酶同工酶kinase-MBLDH lactate乳酸脱氢酶dehydrogenaseα-羟丁酸脱氢酶α-HBD α-hydroxybutyricdehydrogenaseAMY serum amylase 血淀粉酶TG triglyceride 肝油三脂CHOL cholesterol 胆固醇高密度脂蛋白HDL-c high-densitylipoprotein cholesterol低密度脂蛋白LDL-c low-densitylipoprotein cholesterol极低密度脂蛋白VLDL very low-densitylipoproteinCa serum calcium 钙Mg serum magnesium 镁IP inorganic phosphate 无机磷ALP alkaline碱性磷酸酶phosphataseTBA total biliary acid 总胆汁酸ASO antistreptolysin 抗链球菌溶血素O a-AG a-acida-酸性糖蛋白glycoprotein反应蛋白CRP C-reactive proteinCRF rheumatoid factor 类风湿因子MTP mili-total protein 微量蛋白IgG immunoglobin G 免疫球蛋白GIgA immunoglobin A 免疫球蛋白A IgM immunoglobin M 免疫球蛋白MC3 complement C3 补体C3C4 complement C4 补体C4cTNT troponin T 肌钙蛋白T MYOG myoglobin 肌红蛋白电解质Na sodium 钠K kalium 钾Cl chloride 氯Ga calcium 钙Mg magnesium 镁乙肝标志物HBV hepatitis B virus 乙肝病毒HBsAg hepatitis B乙肝表面抗原surface antigen乙肝表面抗体HBsAb antibody tohepatitis surfaceantigen乙肝核心抗原HBcAg hepatitis B coreantigen乙肝核心抗体HBcAb antibody tohepatitis B core antigen乙肝e抗原HBeAg hepatitis Be-antigen乙肝e抗体HBeAb antibody tohepatitis B e-antigen酶联免疫吸附试验ELISA enzymelinked immunosorbentassyHAV hepatitis A virus 甲肝病毒HCV hepatitis C virus 丙肝病毒输血免疫全套HBV hepatitis B virus 乙型肝炎病毒HCV hepatitis C virus 丙型肝炎病毒TP treponema梅毒螺旋体pallidum人类免疫缺陷病毒HIV humanimmunodeficiencyvirusAccuracy 准确度Active control, AC 阳性对照,活性对照Adverse drug reaction, ADR 药物不良反应Adverse event, AE 不良事件Adverse medical events 不良医学事件Adverse reaction 药物不良反应Alb 白蛋白ALD(Approximate Lethal Dose)近似致死剂量ALP 碱性磷酸酶Alpha spending function 消耗函数ALT 丙氨酸氨基转换酶Analysis sets 统计分析的数据集Approval 批准Assistant investigator 助理研究者AST 天门冬酸氨基转换酶ATR 衰减全反射法AUCss 稳态血药浓度-时间曲线下面积Audit 稽查Audit or inspection 稽查/视察Audit report 稽查报告Auditor 稽查员Bias 偏性,偏倚Bioequivalence 生物等效应Blank control 空白对照Blind codes 编制盲底Blind review 盲态审核Blind review 盲态检查Blinding method 盲法Blinding/ masking 盲法,设盲Block 分段Block 层Block size 每段的长度BUN 尿素氮Carryover effect 延滞效应Case history 病历Case report form 病例报告表Case report form/ case record form, CRF 病例报告表,病例记录表Categorical variable 分类变量Cav 平均浓度CD 圆二色谱CL 清除率Clinical equivalence 临床等效应Clinical study 临床研究Clinical study report 临床试验的总结报告Clinical trial 临床试验Clinical trial application, CTA 临床试验申请Clinical trial exemption, CTX 临床试验免责Clinical trial protocol, CTP 临床试验方案Clinical trial/ study report 临床试验报告Cmax 峰浓度Co-investigator 合作研究者Comparison 对照Compliance 依从性Composite variable 复合变量Computer-assisted trial design, CATD 计算机辅助试验设计Confidence interval 可信区间Confidence level 置信水平Consistency test 一致性检验Contract research organization, CRO 合同研究组织Contract/ agreement 协议/合同Control group 对照组Coordinating committee 协调委员会Crea 肌酐CRF(case report form)病例报告表Crossover design 交叉设计Cross-over study 交叉研究Css 稳浓度Cure 痊愈Data management 数据管理Database 建立数据库Descriptive statistical analysis 描述性统计分析DF 波动系统Dichotomies 二分类Diviation 偏差Documentation 记录/文件Dose-reaction relation 剂量-反应关系Double blinding 双盲Double dummy 双模拟Double dummy technique 双盲双模拟技术Double-blinding 双盲Drop out 脱落DSC 差示扫描热量计Effectiveness 疗效Electronic data capture, EDC 电子数据采集系统Electronic data processing, EDP 电子数据处理系统Emergency envelope 应急信件End point 终点Endpoint criteria/ measurement 终点指标Equivalence 等效性Essential documentation 必须文件Ethics committee 伦理委员会Excellent 显效Exclusion criteria 排除标准Factorial design 析因设计Failure 无效,失败Final point 终点Fixed-dose procedure 固定剂量法Forced titration 强制滴定Full analysis set 全分析集GC-FTIR 气相色谱-傅利叶红外联用GC-MS 气相色谱-质谱联用Generic drug 通用名药Global assessment variable 全局评价变量GLU 血糖Good clinical practice, GCP 药物临床试验质量管理规范Good manufacture practice, GMP 药品生产质量管理规范Good non-clinical laboratory practice, GLP 药物非临床研究质量管理规范Group sequential design 成组序贯设计Health economic evaluation, HEV 健康经济学评价Hypothesis test 假设检验Hypothesis testing 假设检验International Conference of Harmonization, ICH 人用药品注册技术要求国际技术协调会,国际协调会议Improvement 好转Inclusion criteria 入选标准Independent ethics committee, IEC 独立伦理委员会Information consent form, ICF 知情同意书Information gathering 信息收集Informed consent, IC 知情同意Initial meeting 启动会议Inspection 视察/检查Institution inspection 机构检查Institution review board, IBR 机构审查委员会Intention to treat 意向治疗(——临床领域)Intention-to –treat, ITT 意向性分析(-统计学)Interactive voice response system, IVRS 互动式语音应答系统Interim analysis 期中分析Investigator 研究者Investigator's brochure, IB 研究者手册IR 红外吸收光谱Ka 吸收速率常Last observation carry forward, LOCF 最接近一次观察的结转LC-MS 液相色谱-质谱联用LD50 板数致死剂量Logic check 逻辑检查LOQ (Limit of Quantitation)定量限LOCF, Last observation carry forward 最近一次观察的结转Lost of follow up 失访Marketing approval/ authorization 上市许可证Matched pair 匹配配对Missing value 缺失值Mixed effect model 混合效应模式Monitor 监查员Monitoring 监查Monitoring report 监查报告MRT 平均滞留时间MS 质谱MS-MS 质谱-质谱联用MTD(Maximum Tolerated Dose)最大耐受剂量Multicenter trial 多中心试验Multi-center trial 多中心试验New chemical entity, NCE 新化学实体New drug application, NDA 新药申请NMR 核磁共振谱Non-clinical study 非临床研究Non-inferiority 非劣效性Non-parametric statistics 非参数统计方法Obedience 依从性ODR 旋光光谱Open-blinding 非盲Open-label 非盲Optional titration 随意滴定Original medical record 原始医疗记录Outcome 结果Outcome assessment 结果指标评价Outcome measurement 结果指标Outlier 离群值Parallel group design 平行组设计Parameter estimation 参数估计Parametric statistics 参数统计方法Patient file 病人档案Patient history 病历Per protocol,PP 符合方案集Placebo 安慰剂Placebo control 安慰剂对照Polytomies 多分类Power 检验效能Precision 精密度Preclinical study 临床前研究Primary endpoint 主要终点Primary variable 主要变量Principal investigator 主要研究者Principle investigator,PI 主要研究者Product license,PL 产品许可证Protocol 试验方案Protocol 试验方案Protocol amendment 方案补正Quality assurance unit,QAU 质量保证部门Quality assurance,QA 质量保证Quality control,QC 质量控制Query list,query form 应用疑问表Randomization 随机化Randomization 随机Range check 范围检查Rating scale 量表Regulatory authorities,RA 监督管理部门Replication 可重复RSD 日内和日间相对标准差Run in 准备期Safety evaluation 安全性评价Safety set 安全性评价的数据集Sample size 样本含量Sample size 样本量,样本大小Scale of ordered categorical ratings 有序分类指标Secondary variable 次要变量Sequence 试验次序Serious adverse event,SAE 严重不良事件Serious adverse reaction,SAR 严重不良反应Seriousness 严重性Severity 严重程度Significant level 检验水准Simple randomization 简单随机Single blinding 单盲Single-blinding 单盲Site audit 试验机构稽查SOP 试验室的标准操作规程Source data verification,SDV 原始数据核准Source data,SD 原始数据Source document,SD 原始文件Specificity 特异性Sponsor 申办者Sponsor-investigator 申办研究者Standard curve 标准曲线Standard operating procedure,SOP 标准操作规程。
药物临床试验英文缩写
Improvement
好转
Inclusion Criteria
入选表准
Inclusion criteria
入选标准
Independent ethics committee IEC
独立伦理委员会
Information consent form ICF
知情同意书
Information Gathering
Co-investigator
合作研究者
COI
Coordinating Investigator
协调研究者
CRC
Clinical Research Coordinator
临床研究协调者
CRF
Case Report Form
病历报告表
CRO
Contract Research Organization
合同研究组织
美国食品与药品管理局
FR
Final Report
总结报告
GCP
Good Clinical Practice
药物临床试验质量管理规范
GCP
Good Laboratory Practice
药物非临床试验质量管理规范
GMP
Good Manufacturing Practice
药品生产质量管理规范
IB
Investigator’s Brochure
合同研究组织
Contract/ agreement
协议/合同
Control group
对照组
Coordinating committee
协调委员会
Crea
肌酐
CRF(case report form)
病例报告表
完整word版,临床试验常见英文缩写

临床试验常见英文缩写ADR(Adverse drug reaction)不良反应AE(Adverse event)不良事件SAE(Serious Adverse Event)严重不良事件CRF(Case report form/case record form)病例报告表CRO(Contract research organization)合同研究组织EC(Ethics Committee)伦理委员会GCP(Good clinical practice)药品临床试验管理规范EDC(Electronic data capture)电子数据采集IB(Investigator's Brochure)研究者手册ND (Not Done) 未做NA (Not Applicable) 不适用UK (Unknown) 未知PI(Principal investigator )主要研究者Sub-I(Sub-investigator) 助理研究者QA(Quality assurance) 质量保证QC(Quality control) 质量控制SDV(Source data verification)原始资料核对SD(Source data)原始数据SD(Source document ) 原始文件SFDA 国家食品药品监督管理局SOP(Standard operating procedure) 标准操作规程IRB 机构审查委员会ICF(Informed Consent Form) 知情同意书TMF(trial master file)研究管理文件夹临床试验常见英文单词A•Active control ,AC 阳性对照,活性对照阳性对照,活性对照•Adverse drug reaction ,ADR 药物不良反应药物不良反应•Adverse event ,AE 不良事件•Approval 批准•Assistant investigator 助理研究者•Audit 稽查•Audit report 稽查报告•Auditor 稽查员B•Bias 偏性,偏倚•Blank control 空白对照•Blinding/masking 盲法,设盲•Block 层C•Case history 病历•Case report form/case record form ,CRF 病例报告表,病例记录表•Clinical study 临床研究•Clinical trial 临床试验•Clinical trial application ,CTA 临床试验申请•Clinical trial exemption ,CTX 临床试验免责•Clinical trial protocol ,CTP 临床试验方案•Clinical trial/study report 临床试验报告•COA(药品检测报告)•Co-investigator 合作研究者•Comparison 对照•Compliance 依从性•Computer-assisted trial design ,CATD 计算机辅助试验设计•Contract research organization ,CRO 合同研究组织•Contract/agreement 协议/合同•Coordinating committee 协调委员会•Coordinating investigator 协调研究者•Cross-over study 交叉研究•Cure 痊愈•CTRB 临床试验文件夹D•Documentation 记录/文件•Dose-reaction relation 剂量—反应关系•Double blinding 双盲•Double dummy technique 双盲双模拟技术E•Electronic data capture ,EDC 电子数据采集系统•Electronic data processing ,EDP 电子数据处理系统•Endpoint criteria/measurement 终点指标•Essential documentation 必需文件•Excellent 显效•Exclusion criteria 排除标准F•Failure 无效,失败•Final report 总结报告•Final point 终点•Forced titration 强制滴定G&H•Global 全球•Generic drug 通用名药•Good clinical practice ,GCP 药物临床试验质量管理规定•Good manufacture practice ,GMP 药品生产质量管理规范•Good non-clinical laboratory practice ,GLP 药物非临床研究质量管理规范•Health economic evaluation ,HEV 健康经济学评价•Hypothesis testing 假设检验I•Improvement 好转•Inclusion criteria 入选标准•Independent ethics committee ,IEE 独立伦理委员会•Information gathering 信息收集•Informed consent form ,ICF 知情同意书•Informed consent ,IC 知情同意•Initial meeting 启动会议•Inspection 视察/检查•Institution inspection 机构检查•Institutional review board ,IBR 机构审查委员会•Intention to treat 意向治疗•Interactive voice response system ,IVRS 互动式语音应答系统•International Conference on Harmonization ,ICH 国际协调会议•Investigational new drug ,IND 新药临床研究•Investigational product 试验药物•Investigator 研究者•Investigator’s brochure ,IB 研究者手册L•Local 局部M&N•Marketing approval/authorization 上市许可证•Matched pair 匹配配对•Monitor 监查员•Monitoring 监查•Monitoring report 监查报告•Multi-center trial 多中心试验•New chemical entity ,NCE 新化学实体•New drug application ,NDA 新药申请•Non-clinical study 非临床研究O•Obedience 依从性•Optional titration 随意滴定•Original medical record 原始医疗记录•Outcome 结果•Outcome assessment 结果指标评价•Outcome measurement 结果指标P•Patient file 病人指标•Patient history 病历•Placebo 安慰剂•Placebo control 安慰剂对照•Preclinical study 临床前研究•Principle investigator ,PI 主要研究者•Product license ,PL 产品许可证•Protocol 试验方案•Protocol amendment 方案补正Q&R•Quality assurance ,QA 质量保证•Quality assurance unit ,QAU 质量保证部门•Quality control ,QC 质量控制•Randomization 随机•Regulatory authorities ,RA 监督管理部门•Replication 可重复•Run in 准备期S•Sample size 样本量,样本大小•Serious adverse event ,SAE 严重不良事件•Serious adverse reaction ,SAR 严重不良反应•Seriousness 严重性•Severity 严重程度•Simple randomization 简单随机•Single blinding 单盲•Site audit 试验机构稽查•Source data ,SD 原始数据•Source data verification ,SDV 原始数据核准•Source document ,SD 原始文件•Sponsor 申办者•Sponsor-investigator 申办研究者•Standard operating procedure ,SOP 标准操作规程•Statistical analysis plan ,SAP 统计分析计划•Study audit 研究稽查•Subgroup 亚组•Sub-investigator 助理研究者•Subject 受试者•Subject diary 受试者日记•Subject enrollment 受试者入选•Subject enrollment log 受试者入选表•Subject identification code ,SIC 受试者识别代码•Subject recruitment 受试者招募•Subject screening log 受试者筛选表•System audit 系统稽查T&U•Trial error 试验误差•Trial master file 试验总档案•Trial objective 试验目的•Trial site 试验场所•Triple blinding 三盲•Unblinding 破盲•Unexpected adverse event ,UAE 预料外不良事件V&W•Variability 变异•Visual analogy scale 直观类比打分法•Vulnerable subject 弱势受试者•Wash-out 清洗期•Well-being 福利,健康EDC 系统常见英文缩写•1.SCR (screening) 筛选•2.DOV (date of visit) 访视第一天•3.ELIG ( ELIGIBILITY ) 入排合格•4.DEM ( DEMOGRAPHY )人口统计学•5.MEDSX (medical history) 既往史•MHX1 : CANCER RELATED CURRENT MEDICAL CONDITIONS 该肿瘤手术史及肿瘤相关症状•MHX2 : NON-CANCER RELATED MEDICAL CONDITIONS•与该肿瘤无关的病史•6.VS /VITALS ( VITAL SIGNS ) 生命体征•7.ECOG/PS 体能评分note:后面具体讲解•8. ECG : 12-LEAD ECG 心电图•9. ECHO ( ECHOCARDIOGRAM ) 超声心动图•10. HAEMA ( LOCAL LABORATORY –HAEMATOLOGY )血常规•11. CHEM ( LOCAL LABORATORY –CLINICAL CHEMISTRY )血生化•12. URIN ( urine ) 尿常规•13. C1 ( Cycle1 ) 第一周期•14. WD : End of Therapy/DISCONTINUATION 结束治疗(停止用药)•15. FU ( Follow-up ) 随访•16.CMED( CONCOMITANT MEDICATIONS ) 伴随药物•17. AE ( NON-SERIOUS ADVERSE EVENTS ) 不良事件•18. SAE ( SERIOUS ADVERSE EVENTS ) 严重不良事件•19. EOS( End of Study ) 结束研究:肿瘤以病人死亡事件为准•20. UNS ( Unscheduled Visit ) 不预期访问•21.ND (Not Done) 未做•22. NA (Not Applicable) 不适用• (Unknown) 未知临床试验常见语句描述一. 临床试验过程描述1)一般描述:1. Subject was diagnosed with XX in September, 2010, and had XX surgery in December, 2010.患者于2010 年9 月确诊XX 疾病,于2010 年12 月行XX 术。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
药物临床试验英文缩写
药物临床试验英文缩写
研究者(Investigator),实施临床试验并对临床试验的质量及受试者安全和权益的负责者。
研究者必须经过资格审查,具有临床试验的专业特长、资格和能力。
协调研究者(CoordinatingInvestigator),在多中心临床试验中负责协调参加各中心研究者工作的一名研究者。
申办者(Sponsor),发起一项临床试验,并对该试验的启动、管理、财务和监查负责的公司、机构或组织。
监查员(Monitor),由申办者任命并对申办者负责的具备相关知识的人员,其任务是监查和报告试验的进行情况和核实数据。
稽查(Audit),指由不直接涉及试验的人员所进行的一种系统性检查,以评价试验的实施、数据的记录和分析是否与试验方案、标准操作规程以及药物临床试验相关法规要求相符。
视察(Inspection),药品监督管理部门对一项临床试验的有关文件、设施、记录和其它方面进行官方审阅,视察可以在试验单位、申办者所在地或合同研究组织所在地进行。
病例报告表(CaseReportForm,CRF),指按试验方案所规定设计的一种文件,用以记录每一名受试者在试验过程中的数据。
试验用药品(InvestigationalProduct),用于临床试验中的试验药物、对照药品或安慰剂。
不良事件(AdverseEvent),病人或临床试验受试者接受一种药品后出现的不良医学事件,但并不一定与治疗有因果关系。
严重不良事件(SeriousAdverseEvent),临床试验过程中发生需住院治疗、延长住院时间、伤残、影响工作能力、危及生命或死亡、导致先天畸形等事件。
标准操作规程(StandardOperatingProcedure,SOP),为有效地实施和完成某一临床试验中每项工作所拟定的标准和详细的书面规程。
设盲(Blinding/Masking),临床试验中使一方或多方不知道受试者治疗分配的程序。
单盲指受试者不知,双盲指受试者、研究者、监查员或数据分析者均不知治疗分配。
合同研究组织(ContractResearchOrganization,CRO),一种学术性或商业性的科学机构。
申办者可委托其执行临床试验中的某些工作和任务,此种委托必须作出书面规定。
实验室检查英文缩写。
