新版药品不良反应事件报告表
药品不良反应事件报告表(附表1)
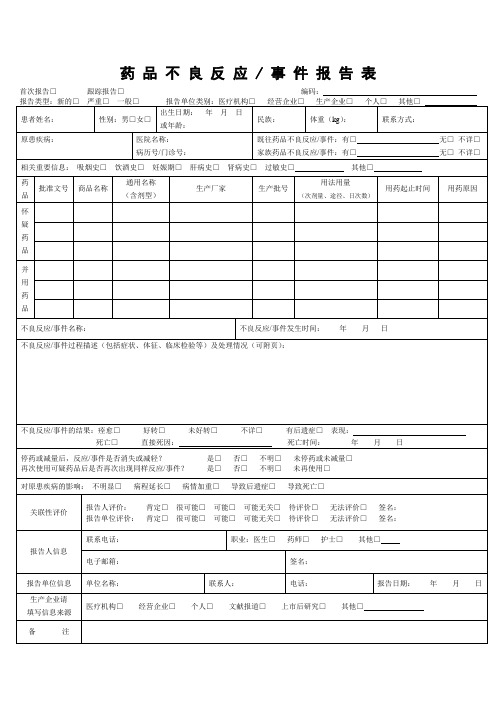
药品不良反应 / 事件报告表首次报告□跟踪报告□编码:
填写说明:
严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:
1) 导致死亡;
2)危及生命;
3)致癌、致畸、致出生缺陷;
4)导致显著的或者永久的人体伤残或者器官功能的损伤;
5)导致住院或者住院时间延长;
6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
报告时限
新的、严重的药品不良反应应于发现或者获知之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应30日内报告。
有随访信息的,应当及时报告。
其他说明
怀疑药品:是指患者使用的怀疑与不良反应发生有关的药品。
并用药品:指发生此药品不良反应时患者除怀疑药品外的其他用药情况,包括患者自行购买的药品或中草药等。
用法用量:包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次。
报告的处理
所有的报告将会录入数据库,专业人员会分析药品和不良反应/事件之间的关系。
根据药品风险的普遍性或者严重程度,决定是否需要采取相关措施,如在药品说明书中加入警示信息,更新药品如何安全使用的信息等。
在极少数情况下,当认为药品的风险大于效益时,药品也会撤市。
药品不良反应事件报告表

药品不良反应/事件报告表跟踪报告口 严重口 一般口报告单位类别:医疗机构口 编码: 经营企业口生产企—其他口附表1首次报告口 报告类型:新的口填写说明一、严重药品不良反应是指因使用药品引起以下损害情形之一的反应:1)导致死亡;2)危及生命;3)致癌、致畸、致出生缺陷;4)导致显著的或者永久的人体伤残或者器官功能的损伤;5)导致住院或者住院时间延长;6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
二、新的药品不良反应是指药品说明书中未载明的不良反应。
药品不良反应在说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
三、报告时限新的、严重的药品不良反应应于发现或者获知之日起15 日内报告,其中死亡病例须立即报告,其他药品不良反应30 日内报告。
有随访信息的,应当及时报告。
四、关联性评价指标肯定:用药及反应发生时间顺序合理;反应符合该药已知的不良反应类型;停药或减量后,反应停止或减轻;再次使用可疑药品,反应再现;已排除并用药、原患疾病等其它因素影响。
很可能:用药及反应发生时间顺序合理;反应符合该药已知的不良反应类型;停药或减量后,反应停止或减轻;已排除并用药、原患疾病等其它因素影响。
可能:用药及反应发生时间关系密切;反应表现与已知该药ADR 不相吻合;无法排除并用药、原患疾病等其它因素影响。
可能无关:用药及反应发生时间相关性不密切;反应表现与已知该药ADR 不相吻合;无法排除并用药、原患疾病等其它因素影响。
待评价:需要补充材料才能评价。
无法评价:评价的必需资料无法获得。
五、其他说明怀疑药品:是指患者使用的怀疑与不良反应发生有关的药品。
并用药品:指发生此药品不良反应时患者除怀疑药品外的其他用药情况,包括患者自行购买的药品或中草药等。
用法用量:包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次。
六、报告的处理所有的报告将会录入数据库,专业人员会分析药品和不良反应/事件之间的关系。
药品不良反应事件报告表

药品不良反应/事件报告表新的严重的一般单位类型:医疗卫生机构单位名称: 部门: 电话: 报告日期:患者姓名: *** 性别: 出生日期: 民族: 体重(kg): 联系方式: ************家族药品不良反应: 有无不详既往药品不良反应情况: 有无不详不良反应/事件名称:食欲不振、恶心、呕吐不良反应发生时间: ****年**月*日医院名称: 病历号/门诊号:不良反应过程描述(包括症状、体征、临床检验等)及处理情况:患者第一天服用该药时稍有不适但能耐受,并无其他反应,等第三天早上食欲不振、恶心呕吐等症状更加明显且不能耐受,体征:血压130/85mmHg,心率:75次/分都正常,嘱托患者停药,随后两天访视一切良好,建议患者服用其他降糖口服药。
怀疑药品商品名称通用名称(含剂型,上市五年内品种用*注明)用药原因用法用量用药起止时间生产厂家批号*** 盐酸二甲双胍***剂型: *** 2型糖尿病用量:次日3次/日用法: 250mg/次从****年*月**日到****年*月**日**************** **********并用药品商品名称通用名称(含剂型,上市五年用药原因用法用量用药起止时间生产厂家批号内品种用*注明)剂型:用量:用法:从到不良反应的结果: 治愈好转有后遗症死亡原患疾病:对原患疾病的影响: 不明显病程延长病情加重导致后遗症导致死亡国内有无类似不良反应(包括文献报道): 有无不详国外有无类似不良反应(包括文献报道): 有无不详关联性评价报告人: 肯定很可能可能可能无关待评价无法评价签名:报告单位: 肯定很可能可能可能无关待评价无法评价签名:不良反应分析1. 用药与不良反应的出现有无合理的时间关系?是否2. 反应是否符合该药已知的不良反应类型?是否不明3. 停药或减量后,反应是否消失或减轻?是否不明未停药或未减量是否不明未再使用是否不明报告人职业: 执业药师报告人职务/职称: 职员报告人签名:。
新版药品不良反应事件报告表.doc
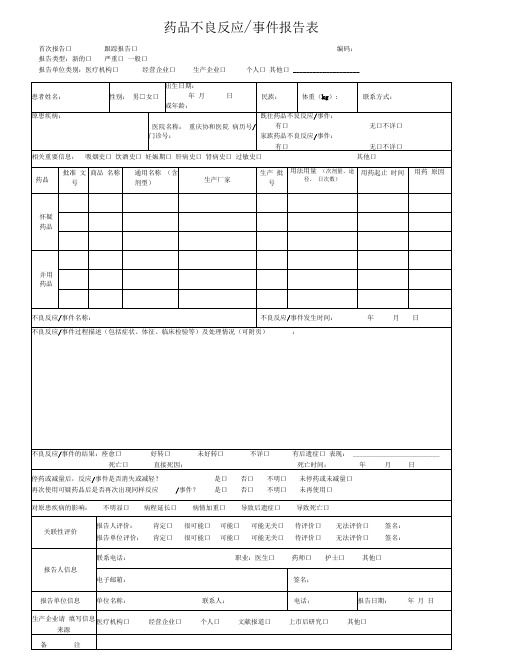
药品不良反应/事件报告表首次报告口跟踪报告口编码:报告类型:新的口严重口一般口报告单位类别:医疗机构口经营企业口生产企业口个人口其他口____________________严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:1)导致死亡;2)危及生命;3)致癌、致畸、致出生缺陷;4)导致显著的或者永久的人体伤残或者器官功能的损伤;5)导致住院或者住院时间延长;6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
报告时限新的、严重的药品不良反应应于发现或者获知之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应30日内报告。
有随访信息的,应当及时报告。
其他说明怀疑药品:是指患者使用的怀疑与不良反应发生有关的药品。
并用药品:指发生此药品不良反应时患者除怀疑药品外的其他用药情况,包括患者自行购买的药品或中草药等。
用法用量:包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次。
报告的处理所有的报告将会录入数据库,专业人员会分析药品和不良反应/事件之间的关系。
根据药品风险的普遍性或者严重程度,决定是否需要采取相关措施,如在药品说明书中加入警示信息,更新药品如何安全使用的信息等。
在极少数情况下,当认为药品的风险大于效益时,药品也会撤市。
不良反应/爭件过程1S述苗写要求套用格式何时岀现何不艮反应■何时停药.采取何措施■何时不良良应治愈或好转°以时间为线索,记录不艮反应的发生、发展及处理过程J为关联性评价提供充分的信息.做到三个时间“三个项目"两个尽可能J要求三个时间不良反应发生的时间采取措施干预不艮反应的时间不良反应终结的时间三个项目事件初始歿生时的相关症状.体征和相关检查动态变化的相关症伏、体征和相关检查采取的干预措施后的症状、俸征和相关检杳两个尽可能不艮反应」爭件的表现埴写时要尽可能明确*具体有关的辅助检查结果要尽可能明确埴写赠送以下资料考试知识点技巧大全考试中途应饮葡萄糖水大脑是记忆的场所,脑中有数亿个神经细胞在不停地进行着繁重的活动,大脑细胞活动需要大量能量。
药品不良反应报告事件表

药品不良反应/ 事件报告表新的□严重□一般□单位名称:XX市XX区人民医院1填写说明:1、新的□严重□一般□(1)新的药品不良反应是指说明书中未载明的不良反应(15日内上报)。
(2)严重的药品不良反应是指因服用药品引起以下损害情形之一的反应:⑴引起死亡(立即报);⑵致癌、致畸、致出生缺陷(15日内上报)⑶对生命有危险并能够导致人体永久的或显著的伤残(15日内上报);⑷对器官功能产生永久损伤(15日内上报);⑸导致住院或住院时间XX(15日内上报)。
(3)、一般药品不良反应:新的、严重的药品不良反应以外的所有不良反应。
2、不良反应/事件名称:不良反应/事件名称应填写不良反应中最主要、最明显的症状。
3、不良反应/事件发生时间(1)填写不良反应/事件的确切时间。
(2)当一个新生儿被发现有出生缺陷,不良反应/事件的发生时间就是孩子的出生日期。
(3)当一个胎儿因为先天缺陷而发生早产或流产时,不良反应/事件的发生时间就是怀孕终止日期。
4、不良反应/事件过程描述及处理情况不良反应/事件的开始时间和变化过程要用具体时间,如X年X月X日,不要用“入院后第X天”,“用药后第XXX”。
不良反应/事件的表现填写时要尽可能明确、具体,如为过敏型皮疹,要填写皮疹的类型、性质、部位、面积大小等;如为心率失常,要填写何种心率失常;如为上消化道出血,有呕血者需估计呕血量的多少等;严重病例应注意生命体征指标(体温、血压、脉搏、呼吸)的记录。
与可疑不良反应/事件有关的辅助检查结果要尽可能明确填写,如怀疑某药引起血小板减少症,应填写病人用药前的血小板记数情况及用药后的变化情况。
如怀疑某药引起药物性肝损害,应填写用药前后的肝功变化,同时要填写肝炎病毒学检验结果,所有检查要注明检查日期。
填写与不良反应/事件发生有关的患者病史:①高血压、糖尿病、肝/肾功能障碍等;②过敏史、怀孕史、吸烟史、饮酒史、药物滥用史等填写本次临床上发现的不良反应/事件的处理情况,主要针对不良反应/事件而采取的医疗措施,也包括为作关联性评价而采取的试验和试验结果,如补做皮肤试验的情况5、如何正确填报不良反应报告不良反应过程描述(包括症状、体征、临床检验等)及处理情况?(1)套用格式:何时出现何不良反应,何时停药、采取何措施,何时不良反应治愈或好转。
药品不良反应事件报告表

附表1
药品不良反应 / 事件报告表
首次报告□跟踪报告□编码:
报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□
13
严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:
1) 导致死亡;
2)危及生命;
3)致癌、致畸、致出生缺陷;
4)导致显著的或者永久的人体伤残或者器官功能的损伤;
5)导致住院或者住院时间延长;
6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
报告时限
新的、严重的药品不良反应应于发现或者获知之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应30日内报告。
有随访信息的,应当及时报告。
其他说明
怀疑药品:是指患者使用的怀疑与不良反应发生有关的药品。
并用药品:指发生此药品不良反应时患者除怀疑药品外的其他用药情况,包括患者自行购买的药品或中草药等。
用法用量:包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次。
报告的处理
所有的报告将会录入数据库,专业人员会分析药品和不良反应/事件之间的关系。
根据药品风险的普遍性或者严重程度,决定是否需要采取相关措施,如在药品说明书中加入警示信息,更新药品如何安全使用的信息等。
在极少数情况下,当认为药品的风险大于效益时,药品也会撤市。
14。
药品不良反应事件报告表

药品不良反应 / 事件报告表
患者姓名性别:男
□女□
出生日期:年月
日
或年龄
民族联系方式:
体重
(kg)
病历号/门
诊号
家族药品不良反
应/事件:有□无□不详□既往药品不良反应/事件情况:有□无□ 不详□
既往病史:(如高血压、糖尿病、肝肾疾病等)相关重要情况:怀孕□ 吸烟□ 饮酒□ 药物滥用□ 放射治疗□ 其他□
不良反应/事件名称:不良反应/事件发生时间:年月日
不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况(可附页):不良反应/事件的结果:治愈□ 好转□ 未好转□ 不详□ 有后遗症□ 表现:
死亡□ 直接死因:死亡时间:年月日
1.停药或减量后,反应/事件是否消失或减轻?是□否□不明□未停药或未减量□
2.再次使用可疑药品后是否再次出现同样反应/事件?是□否□不明□未再使用□
商品名称通用名称(含剂型,监
测期内品种用*注明)
生产
厂家
批号
用法用
量
用药起止时间
用药原
因
怀疑药品
关联性评价报告人:肯定□很可能□可能□可能无关□待评价□无法评价□签名:
报告单位:肯定□很可能□可能□可能无关□待评价□无法
除非得到允许,报告表中的个人信息将予以保密。
药品不良反应事件报告表

药品不良反应/事件报告表跟踪报告口 严重口 一般口报告单位类别:医疗机构口 编码: 经营企业口生产企—其他口附表1首次报告口 报告类型:新的口填写说明一、严重药品不良反应是指因使用药品引起以下损害情形之一的反应:1)导致死亡;2)危及生命;3)致癌、致畸、致出生缺陷;4)导致显著的或者永久的人体伤残或者器官功能的损伤;5)导致住院或者住院时间延长;6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
二、新的药品不良反应是指药品说明书中未载明的不良反应。
药品不良反应在说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
三、报告时限新的、严重的药品不良反应应于发现或者获知之日起15 日内报告,其中死亡病例须立即报告,其他药品不良反应30 日内报告。
有随访信息的,应当及时报告。
四、关联性评价指标肯定:用药及反应发生时间顺序合理;反应符合该药已知的不良反应类型;停药或减量后,反应停止或减轻;再次使用可疑药品,反应再现;已排除并用药、原患疾病等其它因素影响。
很可能:用药及反应发生时间顺序合理;反应符合该药已知的不良反应类型;停药或减量后,反应停止或减轻;已排除并用药、原患疾病等其它因素影响。
可能:用药及反应发生时间关系密切;反应表现与已知该药ADR 不相吻合;无法排除并用药、原患疾病等其它因素影响。
可能无关:用药及反应发生时间相关性不密切;反应表现与已知该药ADR 不相吻合;无法排除并用药、原患疾病等其它因素影响。
待评价:需要补充材料才能评价。
无法评价:评价的必需资料无法获得。
五、其他说明怀疑药品:是指患者使用的怀疑与不良反应发生有关的药品。
并用药品:指发生此药品不良反应时患者除怀疑药品外的其他用药情况,包括患者自行购买的药品或中草药等。
用法用量:包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次。
六、报告的处理所有的报告将会录入数据库,专业人员会分析药品和不良反应/事件之间的关系。
药品不良反应事件报告表

单位名称: 患者姓名: 不良反应/事件名称: 部门: 性别: 无 不详 电话: 出生日期: 民族: 报告日期: 体重: 无 年 月 日 既往药品不良反应/事件情况:有 不良反应/事件发生时间:
家族药品不良反应/事件:有
不
不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况:
事件报告表
报告日期: kg 联系方式: 无 不详 月 日 病历号/单位:
不良反应/事件情况:有
年
剂量
用药起止时间 用法
用药原因
直接死因:
死亡时间:
表现 1有 2无 3不详
导致死亡
类似不良反应
签名: 签名: 5无法评价 5无法评价 签名: 签名:
3不明 4未停药或未减量 4未再使用 3不明
1是 1是 1是 1是
2否 2否 2否 2否 1是 3不明 3不明 3不明 2否
5. 反应是否可用并用药的作用、患者病情的进展、其他治疗的影响来解释?
严重药品不良反应/事件是指下列情形之一者: 1、引起死亡 2、致畸、致癌、致出生缺陷 3、对生命有危险并能够导致人体永久的或显著的伤残 4、对器官功能产生永久损伤 5、导致住院或住院时间延长 报告人职业: 1、医生 2、医师 3、护士 4、其他 报告人:
批准文号 商品名称
通用名称(含剂型)
生产厂家
批号
怀疑药品
并用药品
不良反应/事件的结果:治愈 原患疾病: 对原患疾病的影响: 1不明显 国内有无类似不良反应好转ຫໍສະໝຸດ 有后遗症表现:死亡:
2病程延长3病情加重4导致后遗症 1有 2无 3不详 国外有无类似不良反应
报告人: 1肯定 关联性评价 报告单位: 1肯定
药品不良反应事件报告表模版

药品不良反应报告表部分项目填报注意事项一、药品不良反应事件名称及描述1、如果患者出现皮疹伴瘙痒,不要把二者同时列为一个不良反应,应当分类描述为“皮疹;瘙痒”,对于皮疹的发生部位、大约形态进行描述;2、如果患者发生多种过敏反应,就不用分类描述,直接描述为“过敏反应”或是“过敏样反应”;不属于过敏反应的其他症状,应当分类描述;3、如果患者出现过敏性休克,就必须描述患者的临床表现(包含呼吸道阻塞、微循环障碍、中枢神经系统症状及皮肤过敏症状)及体征;例如头晕、面色苍白、呼吸困难、胸闷、腹痛、出汗、脉搏增快及血压下降等;此时相应的体征进行描述,如体温、心率、血压、呼吸频率等;还包含不良反应发生前后的症状和体征的动态变化。
4、如果患者出现血象异常,要将不良反应发生前后相应指标、实验室检查进行描述;例如患者白细胞降低,此时就需要提供患者入院时(或服药前)白细胞指数,服药后发生不良反应是监测的白细胞指数以及采取措施停药后患者白细胞有所恢复的指数。
5、如果患者出现消化道反应,例如腹泻、呕吐等,请具体描述一哈相关的症状;例如腹泻,一日几次、什么性状;呕血,一日几次、颜色等性状;呕吐,一日几次、内容物是什么。
二、药品不良反应发生后采取的措施及转归1、药品不良反应发生以后,主要采取的治疗措施要进行描述。
例如立即停药,给与抗过敏治疗(过敏反应)、给与升白细胞治疗(白细胞下降)、给与物理降温(高热)等对症治疗。
具体的治疗措施,例如给与地塞米松10mg肌肉注射,要尽量详细描述对症治疗的药物及剂量。
2、药品不良反应的转归,要尽量描述采取对症治疗之后患者的转归。
有的医疗机构在患者刚刚发生不良反应,采取措施尚未缓解的时候就立即上报,这种是不规范的。
国家规定药品不良反应报告的上报时限。
大家应当按照规定时限完整的对药品不良反应进行上报。
附表药品不良反应 / 事件报告表首次报告□跟踪报告□编码:报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□。
药品不良反应事件报告表
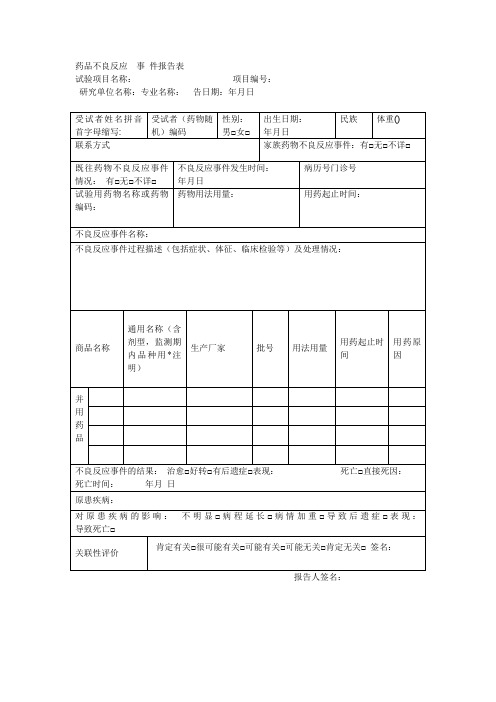
药物用法用量:
用药起止时间:
不良反应事件名称:
不良反应事件过程描述(包括症状、体征、临床检验等)及处理情况:
商品名称
通用名称(含剂型,监测期内品种用*注明)
生产厂家
批号
用法用量
用药起止时间
用药原因
并
用
药
品
不良反应事件的结果:治愈□Βιβλιοθήκη 转□有后遗症□表现:死亡□直接死因:
死亡时间:年月日
药品不良反应事件报告表
试验项目名称:项目编号:
研究单位名称:专业名称:告日期:年月日
受试者姓名拼音首字母缩写:
受试者(药物随机)编码
性别:
男□女□
出生日期:
年月日
民族
体重()
联系方式
家族药物不良反 应事件:有□无□不详□
既往药物不良反应事件情况:有□无□不详□
不良反应事件发生时间:
年月日
病历号门诊号
原患疾病:
对原患疾病的影响:不明显□病程延长□病情加重□导致后遗症□表现: 导致死亡□
关联性评价
肯定有关□很可能有关□可能有关□可能无关□肯定无关□签名:
报告人签名:
药品不良反应事件报告表
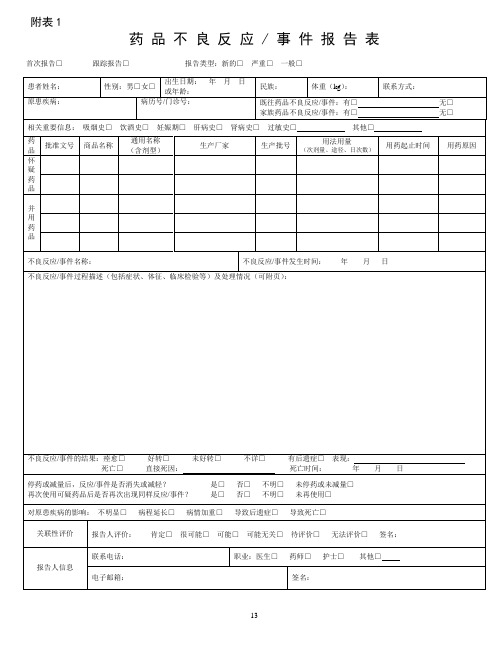
附表1
药品不良反应 / 事件报告表首次报告□跟踪报告□报告类型:新的□严重□一般□
13
严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:
1) 导致死亡;
2)危及生命;
3)致癌、致畸、致出生缺陷;
4)导致显著的或者永久的人体伤残或者器官功能的损伤;
5)导致住院或者住院时间延长;
6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
报告时限
新的、严重的药品不良反应应于发现或者获知之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应30日内报告。
有随访信息的,应当及时报告。
其他说明
怀疑药品:是指患者使用的怀疑与不良反应发生有关的药品。
并用药品:指发生此药品不良反应时患者除怀疑药品外的其他用药情况,包括患者自行购买的药品或中草药等。
用法用量:包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次。
报告的处理
所有的报告将会录入数据库,专业人员会分析药品和不良反应/事件之间的关系。
根据药品风险的普遍性或者严重程度,决定是否需要采取相关措施,如在药品说明书中加入警示信息,更新药品如何安全使用的信息等。
在极少数情况下,当认为药品的风险大于效益时,药品也会撤市。
14。
药品不良反应报告表.doc

谢谢你看完全篇文本,希望所编写的内容对你有所帮助!你有好的想法和见解可以编辑文档添加上去。
国际非专利名
批号
剂型
年销售量
年产量
怀疑引起不良
反应的药品
你喜欢:“失败永远比成功更有吸引力。”也许是你失败太多拿来自嘲自勉,也许你尝到了失败之后的成功更加甘甜。但无论因为哪种情形,在决定命运的时候,希望你是成功者,那么希望你能早日振作起来,让智慧的火花早日闪烁起来。你喜欢“世界上最宽阔的东西是海洋,比海洋更宽阔的是天空,
1、树立综合的、开放的课程观综合的课程观要求我们走出以往的学科教学模式尤其是说教式德育模式,尊重学生的生活,根据其实际需要组织教学活动,引导他们在生活中饶有兴趣地学习、探究、体验,在学习中愉快地生活、成长,获取对社会的整体认识,形成自己的价值观和道德观。
不是因为你相信“学习是苦根上长出来的甜果”,所以你总能坚持着努力学习?经过两年的不懈努力,你已成为全校闻名的好学生。新的学习生活已经在你面前展开,愿你驾驶着装满知识的巨轮,树起理想的风帆,擎着奋斗的指南针,抵达成功的彼岸。
药品不良反应报告表
企业名称:电话:报告日期:年月日
患者姓名:
性别:男□女□
出生日期:年月日
民族:
体重:
家庭药品不良反应:有□无□不详□
病历号:
(门诊号)
工作单位
或住址
电话:
既往药品不良反应情况:
有□无□不详细□
原患病症:
不良反应:
名称:
不良反应发生时间:年月日
不良反应的表现:
(包括临床检国内、外发生的不良反应情况(包括报刊杂志报道情况)
国内:
国外:
其他:
报告人职务、职称:报告人签名:
药品不良反应事件报告表

严重报告□ 境外报告□ 首次报告□ 跟踪报告□
病例编号*
报告来源* 患者信息
姓名*
医疗机构□
经营企业□ 个人□
文献□ 研究□ 项目□ 其他□ 监管机构□
性别*
出生日期*
年龄
国籍
民族/种族 身高(cm) 体重(kg)
联系电话
医疗机构/经营企业名称: 病历号/门诊号:
既往药品不良反应及药物过敏史 有□
开始日期
结束日期
治疗疾病Biblioteka 1初始报告人姓名* 职业*医生□药师□ 护士□ 其他医务人员□ 消费者□ 其他人员□
所在单位: 联系电话:
电子邮箱:
事件发生国家/地区*:首次获知时间*: 企业病例编码*:
最近一次获知时间*(仅适用于跟踪报告):
上市许可持有人名称*:联系人*: 电话*: 地址*:
备注
其他需说明的情况:
号 期至 途径 剂量 频次
用药 时间
治疗 疾病
*
是否存 在以下 情况(可 多选)注 1
对药 品采 取的 措施注 2
1
2
注 1:
1-假药 2-用药过量 3-父源暴露 4-使用了超出有效期的药品 5-检测并合格的批号 6-检测并不合格的批号 7-用药错误
8-误用 9-滥用
10-职业暴露 11-超说明书使用
无□
相关重要信息:
吸烟
有□ 无 □
不详□
饮酒
有□ 无 □
不详□
其他过敏史 有□ 无
不详□
其他(如肝病史,肾病史, 家族史)
有□ 无 □
不详□
相关疾病信息 (可重复)
序号
疾病名称
开始日期
药品不良反应、事件报告表
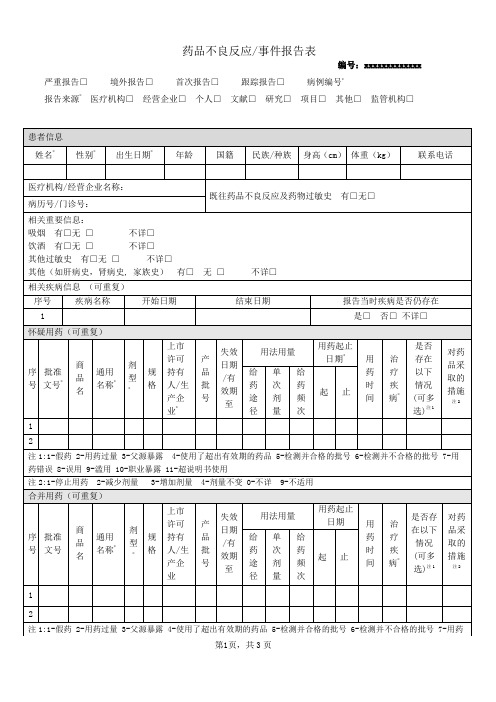
严重报告□境外报告□首次报告□跟踪报告□病例编号*
报告来源*医疗机构□经营企业□个人□文献□研究□项目□其他□监管机构□
填表说明:
1.“*”为必填项。
2.病例编号:首次报告时系统会自动赋予每份报告唯一识别码。
3.报告来源:填写持有人获得不良反应的来源。
“研究”指不良反应报告来源于上市后研究;“项目”指不良反应报告来源于面向患者或医生的市场项目等。
若报告来源为文献,则需附上全文。
4.年龄:如患者的出生日期不详,也可填写不良反应发生时的年龄。
年龄以“岁”为单位,对于1岁以下婴儿,填写月龄;对于新生儿,填写日龄。
5.相关疾病信息:应填写完整的现病史以及怀疑对此次不良反应发生有影响的既往病史。
需要注明疾病开始时间和报告时疾病是否仍存在,如已结束需填写结束时间。
6.报告表是药品安全性监测工作的重要档案资料,需要长期保存,内容应真实、完整、准确,不主观臆造、弄虚作假,严格按照原始数据填写,尽可能详细地填写报告表中所要求的项目。
药品不良反应事件报告表-制表单位国家食品药品监督管理局

附表 1 制表单位�国家食品药品监督管理局药品不良反应/ 事件报告表新的√□ 严重□一般□单位名称�医疗卫生机构□ 生产企业经营企业□ 个人□编码□□□□□□□□□□□□□□□□□□□部门�电话�报告日期2014联系方式年6 月10 日患者姓名:杨红性别�男□女√出生日期1968 年4 月18 日民族汉体重62(kg)家族药品不良反应/事件�有□无√□不详□既往药品不良反应/事件情况�有□ 无□√不详□不良反应/事件不良反应/事件发生时间�年病历号/门诊号�企业填写医院名称�名称�月日不良反应/事件过程描述�包括症状、体征、临床检验等�及处理情况�通用名称�含剂型�监商品名称* 生产厂家批号用法用量用药起止时间用药原因测期内品种用注明�怀疑药品并用药品不良反应/事件的结果�治愈□原患疾病�好转□有后遗症□ 表现�病情加重□死亡□ 直接死因�死亡时间�年月日对原患疾病的影响�不明显□病程延长□导致后遗症□表现�导致死亡□国内有无类似不良反应�包括文献报道��有□无□不详□国外有无类似不良反应�包括文献报道��有□ 无□ 不详□报告人�肯定□很可能□很可能□很可能□很可能□可能□可能无关□可能无关□可能无关□可能无关□待评价□待评价□待评价□待评价□无法评价□无法评价□无法评价□无法评价□签名�签名�报告单位�肯定□可能□关联性评价省级药品不良反应监测机构�国家药品不良反应监测中心�肯定□可能□签名�肯定□可能□签名�报告人职业�医疗机构��医生□药师□护士□其他□报告人职务职称�企业��报告人签名�◇不良反应/事件分析1. 用药与不良反应/事件的出现有无合理的时间关系�2. 反应是否符合该药已知的不良反应类型� 有□ 无□是□ 否□不明□3. 停药或减量后�反应/事件是否消失或减轻�4. 再次使用可疑药品后是否再次出现同样反应/事件�是□否□ 不明□ 未停药或未减量□ 是□ 否□ 不明□未再使用□5. 反应/事件是否可用并用药的作用、患者病情的进展、其他治疗的影响来解释�是□ 否□ 不明□◇严重药品不良反应/事件是指有下列情形之一者� ① 引起死亡□ □ □ □ □② 致畸、致癌或出生缺陷③ 对生命有危险并能够导致人体永久的或显著的伤残 ④ 对器官功能产生永久损伤 ⑤ 导致住院或住院时间延长◇编码规则�省(自治区、直辖市) 市�地区� 县�区� 单位 年代 流水号 □□□□□□□□□□□□□□□□□□□注�省�自治区、直辖市�、市�地区�、县�区�编码按中华人民共和国行政区划代码填写。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
药品不良反应/事件报告表
首次报告□跟踪报告□编码:报告类型:新的□严重□一般□
报告单位类别:医疗机构□经营企业□生产企业□个人□其他□
严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:
1) 导致死亡;
2)危及生命;
3)致癌、致畸、致出生缺陷;
4)导致显著的或者永久的人体伤残或者器官功能的损伤;
5)导致住院或者住院时间延长;
6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
报告时限
新的、严重的药品不良反应应于发现或者获知之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应30日内报告。
有随访信息的,应当及时报告。
其他说明
怀疑药品:是指患者使用的怀疑与不良反应发生有关的药品。
并用药品:指发生此药品不良反应时患者除怀疑药品外的其他用药情况,包括患者自行购买的药品或中草药等。
用法用量:包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次。
报告的处理
所有的报告将会录入数据库,专业人员会分析药品和不良反应/事件之间的关系。
根据药品风险的普遍性或者严重程度,决定是否需要采取相关措施,如在药品说明书中加入警示信息,更新药品如何安全使用的信息等。
在极少数情况下,当认为药品的风险大于效益时,药品也会撤市。
