胰蛋白酶分离工艺
磁性亲合分离法纯化胰蛋白酶

胰蛋 白酶 ( rp i, C3 2 .)是一种 蛋 白水解 Ty s E . 1 n 4 4 酶(rt s) Po ae,具有 蛋 白水解 酶的通性 。胰 蛋 白酶的专 e
一
能共价键 结合亲和 配基 ,还 因具有磁性 ,在 外加磁场 的作用 下,进行快速 运动或分 离, 因而 引起众 多研究 人员 的广泛 关注L 。 2 本文采用 简单、 易行 的方法,制备 出具活性 基团的 高磁性 壳聚 糖微粒 、共价 偶联抑肽 酶 ,应用于胰 蛋 白 酶的亲和纯化 , 纯化倍 数为 1 2 活 性回收率为4 . ., 7 1 2%, 实验结果表 明,高磁性壳聚糖微 粒可用作亲和 吸附剂 。
胰蛋白酶的制备

一、猪胰蛋白酶制备(一)猪胰蛋白酶原的提取∙猪胰脏1.0Kg(新鲜的或杀后立即冷藏的),除去脂肪和结缔组织后,绞碎。
∙加入2倍体积预冷的乙酸酸化水(pH2.5)于10~15℃搅拌提取24小时,四层纱布过滤得乳白色滤液,用2.5M H2SO4调pH至2.5~3.0,放置3~4小时后用折迭滤纸过滤得黄色透明滤液(约1.5升)。
∙加入固体硫酸铵(予先研细),使溶液达0.75饱和度(每升滤液加492克)放置过夜后抽滤(挤压干),得猪胰蛋白酶原粗制品。
(二)胰蛋白酶原激活∙向胰蛋白酶原粗制品滤饼分次加入10倍体积(按饼重计)冷的蒸馏水,使滤饼溶解,得胰蛋白酶原溶液。
将研细的固体无水氯化钙慢慢加入酶原溶液中(滤饼中硫酸铵的含量按饼重的四分之一计),使Ca2+与SO42-结合后,边加边搅拌均匀,边加边搅拌,使溶液中最终仍含有0.1M CaCl2。
2.用5M NaOH调pH至8.0,加入极少量猪胰蛋白酶(约2-5mg)轻轻搅拌,于室温下活化8~10小时,(2~3小时取样一次,并用0.001M HCl稀释),测定酶活性增加的情况。
3.活化完成(比活约3500~4000BAEE单位)后,用2.5M H2SO4调pH至2.5~3.0,抽滤除去CaSO4沉淀。
(三)胰蛋白酶的分离1.将已激活的胰蛋白酶溶液按242克/升加入细粉状固体硫酸铵,使溶液达到0.4饱和度,放置数小时后,抽滤,弃去滤饼。
2.滤液按250克/升加入研细的硫酸铵,使溶液饱度达到0.75,放置数小时,抽滤,弃去滤液。
(四)胰蛋白酶的结晶1.将上述胰蛋白酶滤饼(粗胰蛋白酶)溶解后进行结晶:按每克滤饼溶于1.0ml pH9.0的0.4M硼酸缓冲液的量计加入缓冲液,小心搅拌溶解。
2.用2M NaOH调pH至8.0,注意要小心调节,偏酸不易结晶,偏碱易失活,存放于冰箱。
3.放置数小时后,应出现大量絮状物,溶液逐渐变稠呈胶态,再加入总体积的1/4~1 /5的pH8.0的0.2M硼酸缓冲液,使胶态分散,必要时加入少许胰蛋白酶晶体。
胰蛋白酶的配制、过滤除菌与分装

20ml0.25%胰蛋白酶的配制、过滤除菌与分装(1ml)
准备样品:Try干粉,PBS缓冲液,离心管两个、冻存管20个、盒子一个、枪头1盒、灭菌器、注射器。
准备工作:将离心管、冻存管装载盒子中高温高压灭菌。
配制:
1.称取胰蛋白酶:按胰蛋白酶液浓度为0.25%,用电子天平准确称取粉剂50mg溶入离心管PBS(PH到7.2左右)液中。
搅拌混匀,置于4℃内过夜。
2.用注射滤器抽滤消毒:配好的胰酶溶液要在超净台内用注射滤器(0.22微米微孔滤膜)抽滤除菌。
3.分装:将除菌之后的胰蛋白酶用移液枪分装到冻存管中,每个冻存管1ml,于-20℃保存以备使用。
实验三 亲和层析法纯化胰蛋白酶

实验三亲和层析法纯化胰蛋白酶(二)姓名:mangogola利用亲和层析(affinity of chromatography)技术纯化胰蛋白酶是一个综合性实验。
本次的实验内容是:以上次分离的鸡卵粘蛋白为配基,偶联到琼脂糖凝胶(sepharose-4B)上,制成鸡卵粘蛋白的亲和吸附剂,然后通过亲和层析方法对粗胰蛋白酶进行纯化。
亲和层析是由吸附层析发展起来的,主要是根据生物分子与特定的固相化配基之间的亲和力而使生物分子得到分离的。
本实验采用的是猪胰蛋白酶的天然抑制剂——鸡卵粘蛋白作为配基的。
在pH7.6-8.0范围内,猪或牛的胰蛋白酶能牢固的吸附在鸡卵粘蛋白亲和吸附剂上,在pH2.5-3.0的条件下,又能从鸡卵粘蛋白亲和吸附剂上洗脱下来。
本实验选用的载体是琼脂糖凝胶(sepharose-4B),使用溴化氰活化载体。
一.实验过程1.溴化氰活化载体将琼脂糖凝胶先用0.5mol/LNaCl溶液洗,再用蒸馏水洗,抽干后称取20g放入250ml 烧杯中。
(以下操作在通风橱中进行。
)加入1.5mol/LNa2CO3150ml,将此烧杯放置在一冰浴中,在电磁搅拌器缓缓搅拌下10min内加入溴化氰——乙腈溶液6ml(含2g溴化氰),而后继续反应10min。
停止反应,将凝胶迅速转移至玻璃烧结漏斗内抽滤,用200ml预冷的蒸馏水淋洗,再用20ml0.2 mol/L,pH9.5的Na2CO3缓冲液洗,抽干后立即偶联。
2.鸡卵粘蛋白的偶联将活化好的凝胶取10g装入小三角瓶中,按1:1的比例加入0.2mol/L,pH9.5的Na2CO3缓冲液和鸡卵粘蛋白溶液,4℃搅拌偶联24h左右。
(注意不要晃动三角瓶,以免凝胶沾在容器壁上,影响偶联量。
)3.上样前凝胶处理偶联结束后,将琼脂糖凝胶转移至玻璃烧结漏斗内,抽去Na2CO3母液并收集记录体积及A280nm。
然后用约100ml0.5mol/LNaCl溶液洗去未被偶联的蛋白(最后一次滤液A280nm 小于0.02即可),收集滤液记录体积及A280nm。
实验六 用反胶束萃取技术提取胰蛋白酶

实验六用反胶束萃取技术提取胰蛋白酶Ⅰ反胶束萃取法提取胰蛋白酶一、实验目的和要求1、加深对反胶束萃取基本原理的理解。
2、了解反胶束萃取的工艺过程及影响因素。
3、了解胰蛋白酶酶话的测定方法和原理。
4、研究pH对萃取率和反胶束率的影响规律,求出适宜的萃取pH值。
二、实验原理反胶束萃取技术是近年来发展的具有开发前景的新型分离技术。
他是由表面活性剂分散在有机溶剂(连续相)中,自发形成纳米级的聚集体,称反胶束(或称反胶团)。
在反胶束溶液中,组成反胶束的表面活性剂定向排列,其非极性尾向外伸入非极性有机溶剂的有机主体中,而极性头向内排列,形成一个极性核,核内充满水溶液,具有溶解蛋白质之类大分子物质的能力。
当含有反胶束的有机溶剂与蛋白质水溶液接触时,蛋白质在静电引力、疏水作用或亲和力等推动作用力下溶入极性核,从而被萃取,然后再控制适当的条件使蛋白质从负载有机相中重新反萃取到水相,达到纯化的目的。
影响反胶束萃取的因素很多,主要有水相溶液的pH、离子强度、表面活性剂和有机溶剂的种类、浓度和温度等。
胰蛋白酶(trypsin)广泛存在于动物的胰中,是由胰腺腺泡细胞合成的肽链内切酶,分Ⅰ型和Ⅱ型两种,其相应前体分别胰蛋白酶原Ⅰ(CTN)和胰蛋白酶原Ⅱ(ATN)。
正常胰液中胰蛋白酶原占总蛋白质含量的19%,CTN 是AT N 的2倍.胰蛋白酶为白色或类白色结晶性粉末,等电点pI = 10.8。
胰蛋白酶是生物化学尤其是蛋白质组学研究的重要试剂。
它具有分解肽链的作用,能消化溶解变性蛋白质,对未变性的蛋白质无作用,因此能使浓痰液、血凝块等消化变稀,易于引流排除,加速创面净化,促进肉芽组织新生,而不损伤正常组织或损伤极微(因血清内有胰蛋白酶抑制物)。
可帮助创伤或手术后伤口愈合,治疗烧伤,具有多种药用价值。
此外,还有抗炎作用。
临床上可用于脓胸、血胸、外科炎症、溃疡、瘘管等所产生的局部水肿、血肿、脓肿等。
喷雾吸入,用于治疗呼吸道疾病。
胰蛋白酶存放于密闭,阴凉处保存。
胰蛋白酶的提取

胰蛋白酶的提取原理和方法步骤2010-03-29 14:21:31 来源:易生物实验浏览次数:404 网友评论0 条在动物胰脏中除了存在胰蛋白酶外,还有另外两种与胰蛋白酶性质相似的蛋白水解酶:胰凝乳蛋白酶和弹性蛋白酶。
在胰蛋白酶提取过程中,三者彼此很难分开。
需采用合适的方法进一步分离纯化。
关键词:胰蛋白酶trypsin[原理]在动物胰脏中除了存在胰蛋白酶外,还有另外两种与胰蛋白酶性质相似的蛋白水解酶:胰凝乳蛋白酶和弹性蛋白酶。
在胰蛋白酶提取过程中,三者彼此很难分开。
需采用合适的方法进一步分离纯化。
从动物胰脏中提取胰蛋白酶,一般是用稀酸将胰腺细胞中含有的胰蛋白酶原提取出来,然后根据等电点沉淀的原理将提取液的pH值调至酸性(pH3.0左右),使大量的酸性蛋白沉淀出来。
经硫酸铵分级盐析将胰蛋白酶原、胰凝乳蛋白酶原和弹性蛋白酶原沉淀。
沉淀物经水溶解并调至pH8.0,用极少量的胰蛋白酶将胰蛋白酶原激活,同时溶液中的胰凝乳蛋白酶原和弹性蛋白酶原也被激活,三种酶原相互作用过程如下:也可采用从胰脏中提取出胰蛋白酶原,利用合适的提取溶液的pH值促使胰蛋白酶原部分自溶,并通过溶液中Ca2+的环境,使胰蛋白酶原被开始自溶的少量具有活性的胰蛋白酶所激活,转变为具有活性的胰蛋白酶(胰凝乳蛋白酶原及弹性蛋白酶原亦同时被胰蛋白酶激活成有活性的酶)。
激活后的酶溶液再进一步分离纯化。
[试剂和器材]1、试剂(1)pH2.5~3.0乙酸化的水溶液(2)10%(体积分数)乙酸(3)2mol/L硫酸(4)固体硫酸铵(5)无水CaCl2(6)结晶胰蛋白酶(7)25%乙醇溶液(含0.015mol/LHCl 、0.05mol/LCaCl2)(8)95%(体积分数)乙醇(9)5mol/LNaOH(10)丙酮2、器材(1)胰脏(2)组织捣碎机(3)离心机(4)磁力搅拌器(5)透析袋、20目筛网、纱布、水浴锅(6)烧杯、量筒、刻度吸管、试管、玻璃漏斗(7)布氏漏斗、抽滤瓶、温度计、滴管、玻璃搅棒、纱布、pH试纸等[方法和步骤]方法一1、胰蛋白酶原的提取取新鲜胰脏约150g,剥去结缔组织和脂肪,取净重100g,切成碎块,在组织捣碎机中捣碎,并加入2倍体积预冷的pH2.5~3.0 乙酸化水溶液,制成匀浆。
胰蛋白酶的纯化实验报告

一、实验目的1. 学习和掌握胰蛋白酶的纯化方法。
2. 了解胰蛋白酶的理化性质和生物学功能。
3. 培养实验操作技能和数据分析能力。
二、实验原理胰蛋白酶是一种广泛存在于胰腺中的丝氨酸蛋白酶,具有水解蛋白质的能力。
本实验采用硫酸铵盐析法对胰蛋白酶进行纯化,该方法具有操作简便、成本低廉、纯度较高等优点。
三、实验材料1. 胰蛋白酶粗品:由动物胰腺提取。
2. 硫酸铵:分析纯。
3. 氯化钠:分析纯。
4. 磷酸盐缓冲液(pH 7.0):0.1 mol/L。
5. 其他试剂:三氯乙酸、硫酸、氢氧化钠等。
四、实验方法1. 胰蛋白酶粗品预处理:将胰蛋白酶粗品溶解于磷酸盐缓冲液(pH 7.0),搅拌使其充分溶解。
2. 盐析:向胰蛋白酶溶液中加入硫酸铵,使其饱和,充分搅拌,室温静置过夜。
3. 沉淀收集:用布氏漏斗抽滤,收集沉淀,并用磷酸盐缓冲液(pH 7.0)洗涤沉淀。
4. 脱盐:将沉淀溶于适量的水,加入适量的三氯乙酸,使蛋白质变性,去除杂质。
5. 纯化:将变性后的蛋白质溶液透析,去除三氯乙酸和硫酸铵。
6. 蛋白质复性:将透析后的蛋白质溶液加入适量的磷酸盐缓冲液(pH7.0),使蛋白质复性。
7. 检测:采用SDS-PAGE方法检测纯化后的胰蛋白酶。
五、实验结果与分析1. 盐析:在胰蛋白酶溶液中加入硫酸铵后,溶液出现白色沉淀,说明胰蛋白酶已经盐析。
2. 沉淀收集:通过抽滤,收集到白色沉淀,表明胰蛋白酶已经沉淀。
3. 脱盐:加入三氯乙酸后,沉淀溶解,表明蛋白质已经变性。
4. 纯化:透析后的蛋白质溶液中,SDS-PAGE电泳结果显示,只有一个明显的条带,说明胰蛋白酶已经纯化。
5. 蛋白质复性:复性后的胰蛋白酶溶液中,SDS-PAGE电泳结果显示,蛋白条带清晰,说明蛋白质已经复性。
六、实验结论本实验采用硫酸铵盐析法对胰蛋白酶进行纯化,成功地将胰蛋白酶从粗品中分离出来,并通过SDS-PAGE电泳检测,证明纯化后的胰蛋白酶具有较高的纯度。
用胰蛋白酶酶解蛋白的基本方法
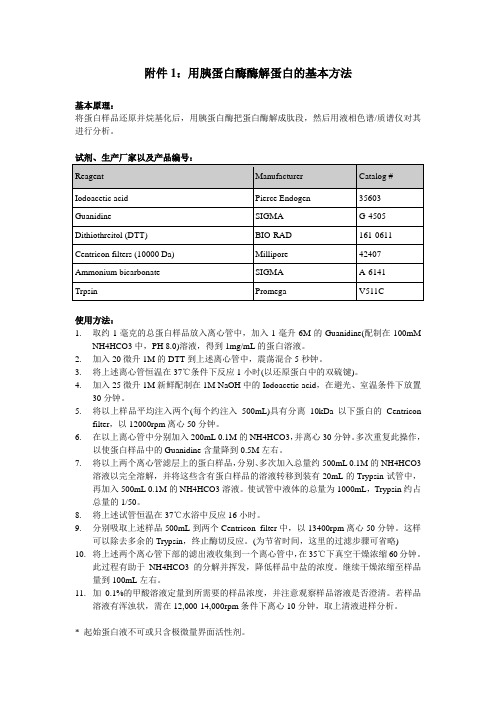
附件1:用胰蛋白酶酶解蛋白的基本方法基本原理:将蛋白样品还原并烷基化后,用胰蛋白酶把蛋白酶解成肽段,然后用液相色谱/质谱仪对其进行分析。
试剂、生产厂家以及产品编号:使用方法:1.取约1毫克的总蛋白样品放入离心管中,加入1毫升6M的Guanidine(配制在100mMNH4HCO3中,PH 8.0)溶液,得到1mg/mL的蛋白溶液。
2.加入20微升1M的DTT到上述离心管中,震荡混合5秒钟。
3.将上述离心管恒温在37℃条件下反应1小时(以还原蛋白中的双硫键)。
4.加入25微升1M新鲜配制在1M NaOH中的Iodoacetic acid,在避光、室温条件下放置30分钟。
5.将以上样品平均注入两个(每个约注入500mL)具有分离10kDa以下蛋白的Centriconfilter,以12000rpm离心50分钟。
6.在以上离心管中分别加入200mL 0.1M的NH4HCO3,并离心30分钟。
多次重复此操作,以使蛋白样品中的Guanidine含量降到0.5M左右。
7.将以上两个离心管滤层上的蛋白样品,分别、多次加入总量约500mL 0.1M的NH4HCO3溶液以完全溶解,并将这些含有蛋白样品的溶液转移到装有20mL的Trypsin试管中,再加入500mL 0.1M的NH4HCO3溶液。
使试管中液体的总量为1000mL,Trypsin约占总量的1/50。
8.将上述试管恒温在37℃水浴中反应16小时。
9.分别吸取上述样品500mL到两个Centricon filter中,以13400rpm离心50分钟。
这样可以除去多余的Trypsin,终止酶切反应。
(为节省时间,这里的过滤步骤可省略)10.将上述两个离心管下部的滤出液收集到一个离心管中,在35℃下真空干燥浓缩60分钟。
此过程有助于NH4HCO3的分解并挥发,降低样品中盐的浓度。
继续干燥浓缩至样品量到100mL左右。
11.加0.1%的甲酸溶液定量到所需要的样品浓度,并注意观察样品溶液是否澄清。
测序级胰蛋白酶生产工艺

测序级胰蛋白酶生产工艺引言测序级胰蛋白酶是一种重要的酶制剂,广泛应用于生物医药领域的基因测序、蛋白质鉴定和结构研究等方面。
本文将详细介绍测序级胰蛋白酶的生产工艺,包括菌种培养、酶的提取与纯化、活性检测和产品包装等环节。
菌种培养测序级胰蛋白酶的生产通常采用大肠杆菌作为宿主菌。
首先,选择高产酶的菌株进行培养,常用的菌株有E. coli BL21(DE3)等。
接种菌株后,通过连续扩大培养来增加菌量。
培养基的配方需要根据不同菌株的需求进行调整,一般包括碳源、氮源、矿物质和生长因子等。
培养过程中,需要控制好温度、pH值和氧气供应等条件。
一般来说,温度维持在37摄氏度,pH值在6.8-7.2之间,氧气供应通过搅拌或气体通气来实现。
同时,还需要添加适量的抗生素来抑制杂菌的生长。
酶的提取与纯化菌体培养达到一定程度后,可以开始进行酶的提取与纯化。
首先,将培养物离心,分离出菌体。
然后,通过破碎菌体的方式将胰蛋白酶释放出来。
常用的方法有超声波破碎、高压破碎和酶解等。
接下来,需要对提取的酶液进行纯化。
纯化的目的是去除杂质并提高酶的纯度。
常用的纯化方法包括离子交换层析、凝胶过滤层析和亲和层析等。
通过这些方法,可以逐步去除蛋白质混合物中的杂质,得到纯度较高的胰蛋白酶。
活性检测在酶的纯化过程中,需要对酶的活性进行检测。
常用的活性检测方法有酶联免疫吸附试验(ELISA)、荧光法和比色法等。
这些方法可以通过测量酶的底物转化速率或与底物结合的能力来评估酶的活性。
活性检测的结果可以用于调整工艺参数,优化生产过程。
同时,也可以作为产品质量的重要指标,保证测序级胰蛋白酶的活性符合要求。
产品包装经过提取、纯化和活性检测后,测序级胰蛋白酶可以进行最后的产品包装。
包装的目的是保护酶制剂,延长其保存期,并方便使用者使用。
常见的包装形式有冻干粉剂和液体制剂。
冻干粉剂可以通过冷冻干燥将酶溶液转化为固态粉末,便于储存和运输。
液体制剂则直接将酶溶液灌装在适当的容器中,方便用户取用。
盐析法制备胰蛋白酶

盐析法制备胰蛋白酶引言胰蛋白酶是一种重要的消化酶,广泛应用于医药、食品、制革等领域。
其制备方法多种多样,其中一种常见的制备方法是盐析法,通过调节盐浓度来进行蛋白质的分离纯化。
本文将详细介绍盐析法制备胰蛋白酶的步骤和注意事项。
胰蛋白酶的背景知识胰蛋白酶是由胰腺分泌的一种消化酶,主要负责将蛋白质分解为氨基酸,参与人体的消化过程。
胰蛋白酶具有高度的催化活性和特异性,因此在药物研究、食品加工和生物工程等领域具有广泛的应用。
盐析法的原理盐析法是一种常用的蛋白质分离纯化方法,利用谷氨酸、麦芽糊精等盐类对蛋白质的溶解度的影响进行分离。
在盐析法中,通过改变盐溶液的浓度,使蛋白质发生四级结构变化,从而在溶液中形成沉淀从而分离纯化。
盐析法制备胰蛋白酶的步骤1.准备样品:首先,从胰腺组织中提取胰蛋白酶,获得纯度较高的蛋白样品。
2.加入盐溶液:向蛋白样品中加入适量的盐溶液,如谷氨酸溶液或麦芽糊精溶液。
通过调节盐溶液的浓度,可以控制蛋白质的溶解度和沉淀速度。
3.搅拌:在加入盐溶液后,使用搅拌器均匀搅拌样品,使蛋白质与盐溶液充分混合。
4.等待沉淀:将样品静置一段时间,待蛋白质沉淀到底部形成沉淀。
5.离心分离:使用离心机对样品进行离心分离,使蛋白质沉淀完全分离。
6.纯化沉淀:将离心分离得到的沉淀进行重悬,使用适量的缓冲液对其进行纯化。
7.检测纯化产物:使用电泳等方法对纯化产物进行检测,确定其纯度和活性。
8.保存和储存:将纯化产物保存在适当的温度和湿度条件下,以保持其活性和稳定性。
注意事项在进行胰蛋白酶的盐析法制备时,需要注意以下几点:1.盐溶液的选择:根据实验需求选择合适的盐溶液。
常用的盐溶液包括谷氨酸溶液、麦芽糊精溶液等。
2.盐溶液的浓度:盐溶液的浓度会影响蛋白质的溶解度和沉淀速度,需要根据实验进行调节。
3.搅拌的时间和速度:搅拌的时间和速度要适当,确保蛋白质与盐溶液充分混合,但避免过度剧烈的搅拌损伤蛋白质的结构。
4.离心的条件:离心的条件要选择合适,以确保蛋白质沉淀完全分离。
胰蛋白酶 酶解流程

胰蛋白酶酶解流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classicarticles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!胰蛋白酶酶解流程1. 样品准备将样品溶解于Tris-HCl缓冲液中,pH 8.0。
胰蛋白酶的分离纯化及动力学研究

北京理工大学珠海学院2009届胰蛋白酶的分离纯化及动力学研究摘要通过沉淀离心法提取胰蛋白酶的专一性抑制剂-鸡卵类粘蛋白(CHOM),作为亲和配基,利用亲和层析法进行分离纯化胰蛋白酶,接着以抑制剂对酶反应速度的影响了解酶促反应,掌握其规律,来最大限度地实现酶促反应的高效率,寻找最有利的反应条件以及了解酶在代谢中的作用,最后SDS-PAGE进行酶纯度检验以及其相对分子量的测定。
关键词:胰蛋白酶鸡卵粘蛋白亲和层析法米氏常数酶促反应动力聚丙烯酰胺凝胶电泳Trypsin of isolation and purification and dynamic researchABSTRACTThrough the precipitation centrifugation extraction specificity of trypsin inhibitor - chicken egg kind mucin (CHOM), as affinity ligands, using the method of affinity chromatography separation and purification, and then to by trypsin inhibitor enzyme reaction speed is known about the effects of enzymatic reaction, grasp their rule, come maximally realize enzymatic reaction efficient, find the most favorable reaction conditions and understand the role in metabolic enzymes, finally sds-page for enzyme and its relative molecular weight inspection purity of determination.目录摘要 (Ⅰ)ABSTRACT (Ⅱ)目录 (Ⅲ)1 引言 (1)2 材料与方法 (1)2.1原料与试剂 (1)2.2仪器设备 (1)2.3实验方法 (2)2.3.1CHOM的分离 (2)2.3.2CHOM的定量 (2)2.3.3胰蛋白酶的分离 (2)2.3.4酶活力的测定 (2)2.3.5纯化效果及纯化蛋白质相对分子量的测定 (2)3 结果与讨论 (3)3.1CHOM的分离和定量 (3)3.2胰蛋白酶的纯化 (4)3.3酶活力的测定 (5)3.4纯化效果及纯化蛋白质分子量的测定 (6)4总结 (7)参考文献 (8)附录 (9)1 引言胰蛋白酶是取自猪胰脏的一种蛋白质水解酶,属于丝氨酸蛋白酶家族的消化酶。
测序级胰蛋白酶生产工艺

测序级胰蛋白酶生产工艺测序级胰蛋白酶是一种重要的酶制剂,广泛应用于生物医药、食品工业、环境保护等领域。
本文将从生产工艺的角度介绍测序级胰蛋白酶的制备过程。
一、胰蛋白酶的来源与提取胰蛋白酶主要来源于动物胰腺组织,常用的动物包括猪、牛等。
提取胰蛋白酶的方法通常包括以下几个步骤:1. 动物胰腺的收集:选择健康的动物,将其胰腺收集起来。
在收集过程中,要保证胰腺组织的新鲜度,避免组织受到损伤。
2. 组织的粉碎:将收集到的胰腺组织进行粉碎,可以采用机械研磨或者酶解的方法。
粉碎的目的是使胰蛋白酶能够更好地释放出来。
3. 蛋白质的溶解:将粉碎后的胰腺组织加入适量的缓冲液,进行蛋白质的溶解。
常用的缓冲液包括磷酸盐缓冲液、氯化钠溶液等。
4. 蛋白质的分离:通过离心等方法,将溶解后的蛋白质与残渣分离开来。
分离后的蛋白质溶液即为胰蛋白酶的提取液。
二、测序级胰蛋白酶的纯化与精制提取液中的胰蛋白酶通常还存在着其他的蛋白质、杂质等物质,需要进行纯化和精制。
常用的纯化方法包括以下几种:1. 盐析法:利用胰蛋白酶与其他蛋白质在盐浓度不同的条件下溶解性的差异,通过逐渐增加盐浓度来分离纯化胰蛋白酶。
2. 层析法:利用胰蛋白酶与其他蛋白质在固定相上的相互作用差异,通过选择性地吸附、洗脱等步骤,使胰蛋白酶得以纯化。
3. 电泳法:利用胰蛋白酶与其他蛋白质在电场中的迁移速度差异,通过电泳分离来纯化胰蛋白酶。
纯化后的胰蛋白酶还需要进行精制,以获得测序级的制剂。
精制的过程中通常包括以下几个步骤:1. 去除胰蛋白酶中的核酸:利用核酸酶将胰蛋白酶中的核酸降解,从而减少核酸对测序的影响。
2. 去除胰蛋白酶中的蛋白酶抑制剂:胰蛋白酶抑制剂会降低胰蛋白酶的活性,因此需要通过抗蛋白酶抑制剂的方法将其去除。
3. 调节pH值和温度:胰蛋白酶的活性受到pH值和温度的影响,因此需要将其调节到适宜的范围内。
三、测序级胰蛋白酶的质量控制生产测序级胰蛋白酶的过程中需要进行严格的质量控制,以确保最终产品的质量符合要求。
胰蛋白酶的分离纯化PPT课件

.
5
胰蛋白酶分离纯化路线
胰蛋白酶纯化
采用离子交换层析 原理:蛋白质在其等电点以下时带正电荷,可以被阳离子交换树脂所 吸附;而蛋白质在等电点以上,带负电荷,可以被阴离子交换树脂所 吸附。 因为胰蛋白酶等电点为10.1且在酸性条件下稳定,所以功能基团考虑 使用阳离子 此外,遵循大分子物质分离一般采用弱性,因此使用弱酸性阳离子, 骨架材料选择凝胶,因为其孔度大,亲水性好。 离子交换剂的离子形式考虑用盐型。
• 牛胰蛋白酶原有229个氨基酸组成,含6对二硫键,其氨基酸排列顺序和晶体结构
已被阐明。在肠激酶活自身催化下,酶原的N末端赖氨酸与异亮氨酸残基之间的肽 键被水解,释放出来缬-天-天-天-天-赖6肽,生成有活性的胰蛋白酶。牛的胰蛋 白酶氨基酸残基223个,分子量23800。
• 猪胰蛋白酶的化学结构与牛胰蛋白酶十分相似,在氨基酸残基排列顺序中,只有
41个氨基酸残基不同,但分子构型有很大区别。沉降系数S20W为2.77S pI=10.8, 热稳定性较牛胰蛋白酶稳定,Ca2+对酶的保护作用不及牛羊的明显,无螯合Ca2+ 的中心部位。有6对二硫键,断裂1~2个键,均不至于破坏酶分子的完整结构而保 护了酶的活性。酶的活力分别相当于牛的72%及羊的61%。
• 羊胰蛋白酶与牛、猪的相似,但其活力略高于牛和猪的。
.
3
胰蛋白酶的功效
为蛋白质水解酶,能选择地水解蛋白质中由赖 氨酸或精氨酸的羧基所构成的肽链,能消化溶解变 性蛋质,对未变性的蛋白质无作用,因此,能使脓、 痰液、血凝块等分解、变稀,易于引流排除,加速 创面净化,促进肉芽组织新生,此外还有抗炎症作 用。
临床上用于脓胸、血胸、外科炎症、溃疡、创 伤性损伤、瘘管等所产生的局部水肿、血肿及脓肿 等。喷雾吸入,用于呼吸道疾病。也可用于治疗毒 蛇咬伤。还常用于动物细胞培养前对组织的处理。
1-亲和分离纯化胰酶课件

6-2、测定酶活力试剂与配制
6-2-1、试剂
(1)、Nα-苯甲酰-DL-精氨酸对硝基苯胺盐酸盐 (BAPNA)
(2)、三乙醇胺
(3)、氯 化 钙
(4)、硫 (5)、盐 酸 酸
6-2-2、 试剂的配制
(1)、底物(B)的配制 [ mg/ml ] : (2)、缓冲溶液(S)[TEA-2]: (3)、0.5 mol/L H2SO4溶液的配制: (4)、样品溶液的配制: 直接按照测定步骤,分别吸取自动部分收集器收集的各管样 品原液。
(1)、表1:酶活力的测定方法与结果表
试剂 / 管 号 缓 冲 液(ml)
0
1
2
3
4
5
6
2.0 1.8 1.8 1.8 1.8 1.8 1.8
样 品 溶 液 (ml)
1.4 1.2 1
A 405 nm
0.8 0.6 0.4 0.2 0 -0.2 0 2 4 6 8 管 号
胰蛋白酶分离效果图 1.2 1 0.8 0.6 0.4 0.2 0 -0.2 0 2 4 6 8
管 号
吸光度[280nm]
1 0.8 0.6 0.4 0.2 0 10 -0.2
蛋白质洗脱峰
胰蛋白酶活力峰
亲和层析
分离纯化胰蛋白酶
一
实验原理
我们都知道酶和它的底物或竞争性抑制剂,特异性抗原和抗体, 激素及其受体等具有专一性很强的亲和能力。亲和层析是利用生物分 子间所特有的专一亲和力而设计的一种层析技术。 亲和层析就是在一种载体上,用化学偶联的方法,接上特定的配 基作为固相支持物,然后装柱,并在适当的条件下当样品通过柱子时, 其中与配基具有特异性亲和力的组分被吸附在柱上,然后通过改变洗 脱条件,使得该组分被洗脱分离开来。 亲和层析是具有快速、高效等特点,对于那些分离流程长、难度 大、浓度低、杂质多、采用常规方法难以进行分离的生物分子来说, 亲和层析显示出其独特的优越性。 通过亲和层析,被分离物质的纯度有时一次即可高达数百倍,活 性回收率纯度也非常之高。亲和层析先决条件是,不同的分离对象需 要选择接有专一性配基的固相化亲和载体,有关载体的活化、接臂、 偶联,详见相关一书。
猪胰蛋白酶的分离纯化与鉴定

猪胰蛋白酶的分离纯化与鉴定一、实验目的1、掌握等电点沉淀、盐析及离子交换层析原理及操作。
2、熟悉胰蛋白酶分离纯化的一般过程。
3、掌握胰蛋白酶活力测定方法及SDS-聚丙烯酰胺凝胶电泳技术。
二、实验原理胰蛋白酶是以无活性的酶原形式存在于动物胰脏中,在Ca2+的存在下,被肠激酶或有活性的胰蛋白酶自身激活,从肽链N端赖氨酸和异亮氨酸残基之间的肽键断开,失去一段六肽,分子构象发生一定改变后转变为有活性的胰蛋白酶。
猪胰蛋白酶的分子量约为23400,其等电点约为pH10.8,最适pH7.6~8.0,胰蛋白酶在pH3条件下较稳定,在pH5以上易自溶,Ca2+离子对胰蛋白酶有稳定作用,在低温条件下贮存数周内酶的活性不发生明显的改变。
本实验以猪胰脏为材料,首先用酸性水溶液抽提组织,在Ca2+离子存在条件下,以少量胰蛋白酶结晶激活所得的酶原,再以硫酸铵盐析获得粗胰蛋白酶。
经过透析除盐,以羧甲基纤维素柱阳离子交换层析进行纯化,即可获得较纯的胰蛋白酶。
胰蛋白酶能催化蛋白质的水解,对于由碱性氨基酸(精氨酸、赖氨酸)的羧基与其他氨基酸的氨基所形成的键具有高度的专一性。
此外还能催化由碱性氨基酸和羧基形成的酰胺键或酯键,其高度专一性仍表现为对碱性氨基酸一端的选择。
胰蛋白酶对这些键的敏感性次序为:酯键> 酰胺键> 肽键。
因此可利用含有这些键的酰胺或酯类化合物作为底物来测定胰蛋白酶的活力。
本实验以酪蛋白为底物的方法来测定胰蛋白酶活力,其主要用于测定胰蛋白酶粗制品的活力。
胰蛋白酶催化水解底物酪蛋白生成不被三氯乙酸沉淀的小分子肽以及氨基酸。
在一定浓度范围内酶的水解滤液在波长280nm处光吸收的增值与胰蛋白酶的活力单位成正比。
测定中以标准酪氨酸溶液的光吸收值做对照,根据酶活力蛋白的定义,确定样品中胰蛋白酶的活性。
活力单位的定义:在一定条件下每分钟酶水解滤液光吸收的增值与1μmol酪氨酸在280nm处光吸收值相同时的酶量为一个蛋白酶活力单位(U)。
胰蛋白酶 糜蛋白酶 制备方法

胰蛋白酶糜蛋白酶制备方法胰蛋白酶和糜蛋白酶是两种常用的酶制剂,用于消化蛋白质。
它们在医疗、生物工程和食品工业等领域都有广泛的应用。
本文将介绍胰蛋白酶和糜蛋白酶的制备方法。
胰蛋白酶的制备方法:胰蛋白酶是一种消化酶,主要由胰腺分泌。
在制备胰蛋白酶时,主要包括以下几个步骤:1. 提取胰蛋白酶:首先需要从动物的胰腺中提取胰蛋白酶。
一般使用动物胰腺作为原料,如猪胰腺、牛胰腺等。
提取胰蛋白酶的方法通常是将动物胰腺切碎,加入缓冲液中,通过机械或化学方法破坏细胞膜,释放胰蛋白酶。
2. 纯化胰蛋白酶:提取的胰蛋白酶中可能还存在其他酶或杂质,需要进行纯化。
常用的纯化方法包括离心、过滤、吸附和层析等。
通过这些纯化方法,可以去除杂质,得到较纯的胰蛋白酶。
3. 浓缩胰蛋白酶:纯化后的胰蛋白酶可能是稀释的,需要进行浓缩。
常用的浓缩方法有蒸发法、超滤法和冷冻干燥法等。
通过这些方法,可以使胰蛋白酶的浓度提高,方便后续的应用。
4. 活性检测:制备好的胰蛋白酶需要进行活性检测,以确保其具有一定的消化能力。
常用的活性检测方法包括酶活测定、底物降解等。
糜蛋白酶的制备方法:糜蛋白酶是一种能够降解胶原蛋白的酶,主要用于医疗和化妆品等领域。
糜蛋白酶的制备方法主要包括以下几个步骤:1. 选择菌株:从自然环境中选择具有糜蛋白酶产生能力的细菌或真菌菌株。
常见的菌株有放线菌、枯草杆菌等。
2. 培养菌株:将选定的菌株接种于合适的培养基中,并进行培养。
培养条件包括温度、pH值、培养时间和培养方法等。
通过培养,菌株能够产生和分泌糜蛋白酶。
3. 收集糜蛋白酶:培养一定时间后,菌体和培养基中会含有糜蛋白酶。
收集的方法可以采用离心、过滤等方式,将糜蛋白酶从培养基中分离出来。
4. 纯化糜蛋白酶:收集到的糜蛋白酶中可能还有其他酶或杂质,需要进行纯化。
纯化方法可以采用离心、吸附、层析等技术,去除杂质,得到纯净的糜蛋白酶。
5. 活性检测:制备好的糜蛋白酶需要进行活性检测,以确定其降解胶原蛋白的能力。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1、集落刺激因子(G-CSF )组成结构:是一种含有二硫键的单链糖蛋白,由175个氨基酸残基组成的单链非糖基化多肽链理化性质:①性状:无色澄明液体②分子量:20000,等电点为5.8~6.6③溶解度:④稳定性:生理作用与临床适应症:作用于造血祖细胞,促进其增殖和分化,其重要作用是刺激粒、单核巨噬细胞成熟,促进成熟细胞向外周血释放,并能促进巨噬细胞及噬酸性细胞的多种功能 ,主要用于预防和治疗肿瘤放疗或化疗后引起的白细胞减少症, 分离纯化工艺:G-CSF 为无菌冻干粉剂,由含有10mM 醋酸钠pH 为4的蛋白溶液经0.2um 过滤后分装冻干。
由含有高效表达人G-CSF 的原核表达系统(E.coli )经发酵、分离和高度纯化后经冻干制成。
纯化液聚乙二醇浓缩洗脱液柱层析透析液透析缓冲液溶解沉淀沉淀蛋白质盐析洗脱液纤维素柱层析透析液透析缓冲液溶解沉淀饱和度至加入硫酸铵透析液透析滤液超滤浓缩正常成人尿液150ephadexG -%8020000 S DEAE 2、超氧化物歧化酶(SOD ):组成结构:理化性质:①性状:淡蓝色冻干粉结晶体②分子量:32000左右③溶解度:④稳定性:耐热性强,90℃ 环境120分钟酶活几乎没有损失,100℃环境60分钟酶活保持90%以上;稳定性高,在pH4.0—11.0范围内酶活稳定。
生理作用与临床适应症:是一种能够催化超氧化物通过歧化反应转化为氧气和过氧化氢的酶,是一种重要的抗氧化剂,保护暴露于氧气中的细胞分离纯化工艺:血液预处理,洗涤红细胞和溶血;去除大部分杂蛋白得SOD 粗品;再经柱层析分离得到精品。
猪血经血液预处理、洗涤红细胞、溶血、乙醇一氯仿混合液除去血红蛋白,然后用坟柳043HZO 萃取、丙酮沉淀、55一65℃热变性得到粗酶液。
粗酶液上阴离子DEAE 一Cellulose52交换层析柱、分子筛SephadexG-75柱,最终获得了纯化的铜锌超氧化物歧化酶。
冻干粉末冻干纯化液凝胶层析洗脱液柱柱层析上清液离心透析液磷酸钾缓冲液透析粗提液,后冰浴℃热处理重蒸水溶解沉淀离心加入预冷过的丙酮上清液离心上层液萃取加入上清液离心仿加入预冷过的乙醇,氯溶血液细胞溶胀沉淀离心清洗红细胞去血浆离心匀浆液草酸钾组织匀浆新鲜猪血7552min 1565-5542l a %5.2--SphadexG Cellulose DEAE HPO K C N 3、胰蛋白酶: 组成结构:理化性质:①性状:白色或米黄色结晶性粉末②分子量:24000左右pI10.5③溶解度:溶于水,不溶于乙醇、甘油、氯仿和乙醚④稳定性:最适pH 值7.8~8.5左右pH>9.0不可逆失活 生理作用与临床适应症:本品为蛋白质水解酶,能选择地水解蛋白质中由赖氨酸或精氨酸的羧基所构成的肽链,能消化溶解变性蛋质,对未变性的蛋白质无作用,因此,能使脓、痰液、血凝块等分解、变稀,易于引流排除,加速创面净化,促进肉芽组织新生,此外还有抗炎症作用。
临床上用于脓胸、血胸、外科炎症、溃疡、创伤性损伤、瘘管等所产生的局部水肿、血肿及脓肿等。
喷雾吸入,用于呼吸道疾病。
也可用于治疗毒蛇咬伤。
还常用于动物细胞培养前对组织的处理。
分离纯化工艺:鸡卵类粘蛋白是一种专一性很强的胰蛋白酶的抑制剂,对猪和牛的胰蛋白酶有很强的抑制作用(而对胰凝乳蛋白酶无抑制作用)。
在pH7.6~8.0的范围内,猪或牛胰蛋白酶能牢固地吸附在鸡卵类粘蛋白上,在 pH2.5~3.0的范围内,能从鸡卵类粘蛋白上被洗脱下来。
因此,采用鸡卵类粘蛋白作为配基制成亲和吸附剂,可以从胰蛋白酶粗品直接获得高纯度的胰蛋白酶。
反应的基本原理如下:纯化液浓缩透析液脱盐透析洗脱液离子交换层析洗脱液凝胶层析浓缩液聚乙二醇浓缩透析液透析洗脱液离子交换层析液F SepharoseF Q Sephacryl F SepharoseF Q ---300鳀鱼粗酶 4、蚓激酶:组成结构:理化性质:①性状:微黄色粉末②分子量:③溶解度:④稳定性:在碱性环境中则相对稳定生理作用与临床适应症:是一种多分子重组口服制剂,与血栓(纤维蛋白)有特殊的亲和力,能够跟踪溶栓,有效溶解微栓,改善微循环,加强心、脑血管侧支循环,开放性修复血管受损内皮细胞,增加血管弹性,改善血管供氧功能,降低血液粘度,降低血小板聚集率,抑制血栓再次形成。
修复血栓发生后周边坏死脑细胞,挽救半暗区。
目前已广泛用于临床,并越来越多地用在心、脑血管、内分泌,呼吸系统等疾病的预防和治疗中心。
分离纯化工艺:(一)鲜蚓清洗 在筐中或地面上将蚯蚓上部泥土层层除去,把蚯蚓铺成薄层,光照10~18小时,让蚯蚓排出污物,用自来水在槽中冲洗二遍,洗去泥和粘浮物,用塑料桶装盛,贮存于冷库中备用; (二)磨浆 用胶体磨将蚯蚓磨成浆液,蚯蚓与按(V /V )1∶3~5的比例加入低浓度乙醇的pH5.0~5.3的柠檬酸钠制成匀浆; (三)除渣 用沉降离心机将料液中的粗渣去除,制得上清液; (四)盐析 上清液中按30%饱和浓度加入硫酸铵,搅拌完全溶解后静置1小时; (五)离心 用立式高速离心机经高速离心将料液中细渣去除,制得清液; (六)超滤 取上清液用50,000dt 膜超滤,得超滤液; (七)柱层析分离 将超滤液用泵送到下料桶,混合上样,上样完毕,用洗涤液,洗至流出液呈淡黄色,pH7.0~8.0,略呈碱性,再用洗脱液洗脱,洗脱液变混浊,颜色由黄变红,流出液电导率比洗脱液电导率略高时开始收集,洗脱至料液变清,颜色呈淡橙色,电导率达到洗脱液电导率(不小于9000μs /cm )为止; (八)超滤 将收集液倒入贮罐内,开泵,调转速21×12rpm ,调节压力不大于0.1Mpa ,浓缩至1/15,收集料液澄清,澄清完再上柱加去离子水脱盐,至浓缩液呈中性(pH =7.0)最后浓缩至1/(16~20);(九)过滤、除菌 用澄清型、除菌型液净滤板过滤3遍,至滤液澄清,在30万级用0.22um 微孔滤膜进行灭菌过滤; (十)喷干 在干燥塔中,使出口温度控制在80~86℃干燥料液,收集酶粉。
酶粉喷干滤液灭菌过滤滤液超滤脱盐膜分离洗脱液柱层析超滤液膜超滤膜分离上清液去除细渣离心盐析液加硫酸铵盐析上清液去除粗渣离心匀浆乙醇溶解碎片捣碎洗净蚯蚓污物洗净光照,让蚯蚓排出预处理新鲜蚯蚓000dt ,50纯化液疏水色谱层析洗脱液离子交换层析洗脱液凝胶层析上清液离心粗酶液浓缩滤液脱盐超滤上清液℃离心匀浆液匀浆碎片捣碎洗净蚯蚓污物洗净光照,让蚯蚓排出预处理新鲜蚯蚓75k 104 SephadexG D5、细胞色素C :组成结构:其肽链仅有104个氨基酸,其中赖氨酸含量较高,故为碱性蛋白。
理化性质:①性状:红色冻干粉②分子量:11000-13000③溶解度:易溶于水,在酸性溶液中溶解度更大④等电点10.2-10.8,含铁量0.37-0.43%细胞色素C 对热,酸和碱都比较稳定,但三氯乙酸和乙酸可使之变性,引起部分失活。
生理作用与临床适应症:细胞色素C 与细胞凋亡有关,从线粒体中泄露出的细胞色素C 有诱导细胞凋亡的作用。
本品用于组织缺氧的急救和辅助用药,如一氧化碳中毒、催眠药中毒、新生儿窒息、严重休克缺氧、麻醉及肺部疾病引起的呼吸困难、高山缺氧、脑缺氧、心脏疾病引起的缺氧等。
分离纯化工艺:C HPO N C N C C C CTA SO NH C 精品细胞色素除去氯离子透析洗脱液洗脱树脂吸附细胞色素弱酸性阳离子交换色谱离子交换层析粗品细胞色素除去硫酸根离子透析沉淀红色细胞色素三氯乙酸沉淀盐析滤液加固体硫酸铵盐析洗脱液洗脱沸石吸附细胞色素人造沸石吸附滤液氨水中和提取液酸提取牛心肉末预处理牛心脏4a2-l a %2042)4(%256、肝素钠:组成结构:粘多糖硫酸酯类抗凝血药理化性质:①性状:白色或灰棕色无定性粉末,无臭,无味,有吸湿性②分子量: 12000③溶解度:易溶于水,不溶于乙醇,乙醚,丙酮和苯等有机溶剂④稳定性: 生理作用与临床适应症:治疗各种疾病并发的播散性血管内凝血早期。
2.预防动、静脉血栓和肺栓塞。
3.治疗动、静脉血栓和肺栓塞,缺血性脑卒中,不稳定型心绞痛(减轻症状、预防心肌梗塞),急性心肌梗塞(防止早期再梗塞和梗塞区延展,降低病死率)。
4.人工心肺、腹膜透析或血液透析时作为抗凝血药物。
5.作为溶血栓疗法的维持治疗。
6.用于输血时预防血液凝固及血库保存鲜血等体外抗凝剂分离纯化工艺:一、原料处理:将新鲜的猪肠(或冷冻猪肠自然解冻之后)用清水仔细清洗去除内外污物和外部皮肤脂肪后,绞碎成糜状,并在充分搅拌下,加入等量的水混合后,再加入少许溶度为0.1%的防腐剂混合均匀。
二、酶解提取:先将上述原料在充分搅拌下,用少量稀碱液精细地调节至PH 值为8-9(可用相应的精密PH 试纸进行测定,下同)再加入事先已经绞碎的新鲜胰浆作为酶解剂(所加入的猪胰浆按照原料液实际重量的1%-1.5%为宜),搅匀后,缓慢升温至40度左右,继续搅拌,并保持料液PH=7.5-8,保持液温于37-40度下,酶解3-4小时,然后升温至47-50度,维持PH 值=8.0-8.5,再酌情补加少许猪胰浆后,继续酶解4-5小时,在上述酶解过程中,如果酶解料液的PH 纸复查有所下降之际,就应该及时用少许稀碱液(5%-8%NaOH 溶液)仔细调整。
盐酸调整其PH=5.5-6,然后升温至80度。
在充分搅拌下,加入料液总重量5%左右的精盐(含NaCL ≥95%,钙镁钙盐<0.5%),使之混溶均匀后,再升温90度,保温30分钟,停止搅拌,趁热过滤除去杂质,待滤液冷却至37度时,用稀碱液调整其PH=10.5,精细过滤,滤液回调其PH=9.0-9.5范围内进行离子交换吸附处理。
三、离子交换吸附;先将上述酶解提取液冷却至室温,仔细捞除浮于液面的油脂薄片层,控制升温至45度,停止加热,在搅拌下加入事先预处理好的D-254型树脂已有效的吸附料液中的肝素钠成分,新树脂的用量一般为料液的2.55-3%,用过后的再生树脂应酌情加大其用量,搅拌、吸附处理3个小时后静置过滤,滤液可作为生产治疗冠心病的新药冠心舒的原料。
将上述已经吸附有肝素成分的D-254树脂先用清水充分漂洗,干净后,再用大约一倍的1.2mol/L 氯化钠溶液对洗涤好的D-254树脂进行肝素钠操作:第一次洗脱液为树脂体积的1.5倍左右,大约洗脱4小时,第二次洗脱为树脂体积的0.5倍左右 ,洗脱时间为1小时。
滤干树脂,将洗脱液予以合并。
将上述所得的洗脱液调节到PH=10-11,搅拌30分钟后,静置6小时,然后仔细的析出上层清液,下部沉淀物尽量的抽滤至干。
合并清液和滤液,精细调节PH=6.0-6.5,加入1.5倍量的95%乙醇沉淀过夜,翌日,仔细地烘吸出上层清液,收集下部沉淀物,抽滤至干(母液可套用于调PH 值前的洗脱液中)。
