元素原子离子半径表
离子半径表

元素原子半径排序表

元素原子半径排序表元素原子半径是描述原子大小的物理量,通常以埃(Å)为单位。
原子半径受到原子核的正电荷和外层电子云的电荷分布的影响,因此不同元素的原子半径大小存在差异。
以下是一个较为详细的元素原子半径排序表,按照原子序数进行排序。
| 原子序数 | 元素符号 | 元素名称 | 原子半径(Å) ||--------|---------|--------|-------------|| 1 | H | 氢 | 0.37 || 2 | He | 氦 | 0.32 || 3 | Li | 锂 | 1.34 || 4 | Be | 铍 | 0.90 || 5 | B | 硼 | 0.82 || 6 | C | 碳 | 0.77 || 7 | N | 氮 | 0.75 || 8 | O | 氧 | 0.73 || 9 | F | 氟 | 0.71 || 10 | Ne | 氖 | 0.69 || 11 | Na | 钠 | 1.54 || 12 | Mg | 镁 | 1.36 || 13 | Al | 铝 | 1.18 || 14 | Si | 硅 | 1.11 || 15 | P | 磷 | 1.06 || 16 | S | 硫 | 1.02 || 17 | Cl | 氯 | 0.99 || 18 | Ar | 氩 | 0.98 || 19 | K | 钾 | 2.03 || 20 | Ca | 钙 | 1.74 || ... | ... | ... | ... || 118 | Og | 锇 | 0.78 |上述表格中的原子半径是根据实验测量结果整理得出的,并且仅作为参考值。
需要注意的是,原子半径具有一定的模糊性,因为原子的电子云并没有一个明确的边界,而且还受到其他因素的影响。
从上述表格可以看出,原子半径随着原子序数的增加而逐渐增大。
然而,并非所有元素的原子半径都按照这个规律变化。
有时候,由于特殊的电子构型或其他原因,某些元素的原子半径可能会偏离这个趋势。
元素原子离子半径表.pptx
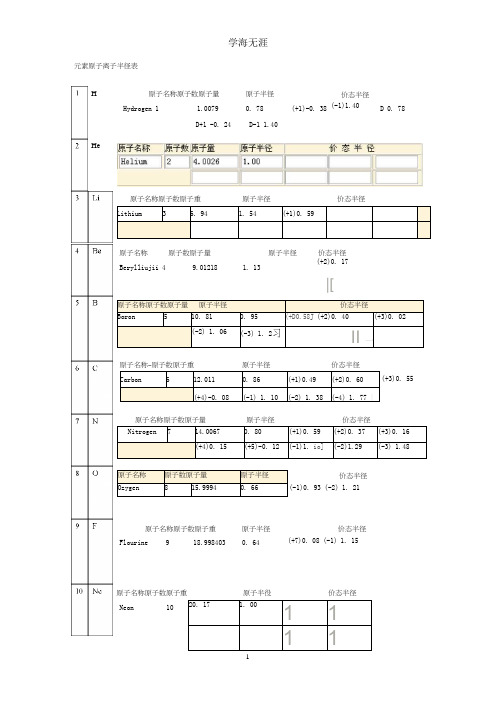
Nickel
28
58. 71
原子半径 1. 24
价态半径 (+1)0. 68 (+2)0.69
(+3)0. 60
(+4)0. 56
Cu
原子名称原子数原子重
Copper
29
63. 546
Zn 原于名称 原于数
Zinc
30
原子童 65. 38
原子名称 Galliiun
原子数原子童
31
69.735
原子半径 1. 28
(+5)-0. 12 (-1)1. io] (-2)1.29 (-3) 1.48
原子名称 Ozygen
原子数原子量
8
15.9994
原子半径 0. 66
价态半径 (-1)0. 93 (-2) 1. 21
原子名称原子数原子重
Flourine 9
18.998403
原子半径 0. 64
价态半径 (+7)0. 08 (-1) 1. 15
原子半径 1. 64
价态半径 (+1) 1.36 (+2) 1. 09 (+3)0. 73
2
学海无涯
Ti 原子名标 限于觐
Tit:ifiiuin
22
■47. 90
原干半径 1.45
(+2)0. 86
价态半径 (+3)0. 67
(+4)0. 53
V
原子名称原子数原于童
原子半径
价态半径
V:di_LdiujTL
P
睨于名杯
Phosphoro 15
30.97376 (+4)0.40
隔于半彳仝 1. 30
元素周期律——原子、离子半径比较

元素周期律——原子、离子半径比较原子半径比较同周期从左到右依次减小,同主族从上到下依次增大(稀有气体除外)1、为什么原子半径同周期从左到右依次减小?同周期元素的原子,电子层数一样,随核电荷数的增大,原子核对核外电子的吸引增强,原子半径逐渐减小。
(核外电子数增加了,吸得越紧了)2、为什么原子半径同主族从上到下依次增大?同一主族元素,从上到下,原子核的质子逐渐增多,核外电子数也逐渐增多,核外排布的电子层也逐渐增多,电子层的多少影响原子的半径大小,电子层的增多,意味着原子直径的增大,所以同一主族元素,原子半径从上到下逐渐增大。
离子半径比较(1)同一元素的微粒,电子数越多,半径越大。
如:钠原子>钠离子,氯原子<氯离子(2)同一周期内元素的微粒,阴离子半径大于阳离子半径。
如:氧离子>锂离子(电子层影响)(3)同类离子与原子半径比较相同。
如:钠离子>镁离子>铝离子,氟离子<氯离子<溴离子(4)具有相同电子层结构的离子(单核),核电荷数越小,半径越大。
如:氧离子>氟离子>钠离子>镁离子>铝离子;硫离子>氯离子>钾离子>钙离子(5)同一元素高价阳离子半径小于低价阳离子半径,又小于金属的原子半径。
(越负越勇)如:铜离子<亚铜离子<铜原子负二价硫>硫原子>四价硫>六价硫比较微粒(原子、离子)半径大小的依据——“三看规则”一看电子层数:在电子层数不同时,电子层数越多,半径越大;二看核电荷数:在电子层数相同时,核电荷数越大,半径越小;三看电子数:在电子层数和核电荷数都相同时,电子数越多,半径越大.(同种元素,非金属)1.根据表1信息,判断以下叙述正确的是___C__.表1 部分短周期元素的原子半径及主要化合价A.R6+比R2-半径大B.单质与稀盐酸反应的速率为L<Q C.M与T形成的化合物具有两性D.M3+比T2-的半径小2、已知短周期元素的离子aAm+、bBn+、cCm-、dDn-(m<n)都具有相同的电子层结构,则下列叙述正确的是( D )A原子半径:A>B>C>DB原子序数:b>a>d>cC离子半径:D>C>B>AD a-d = n+m解:已知aAm+、bBn +、cCm-、dDn-(m<n)都具有相同的电子层结构,则有:a-m=b-n=c+m=d+n,则有A、B在周期表中C、D的下一周期,并且原子序数:b>a>c>d.A、原子半径:A>B>D>C,故A错误;B、原子序数:b>a>c>d,故B错误;C、离子具有相同的电子层结构,则核电荷数(原子序数)越多,半径越小,所以离子半径:D>C>A>B,故C错误;D、离子具有相同的电子层结构,则有:a-m=d+n,所以a-d=n+m,故D正确.故选D.。
各类元素离子半径最全版
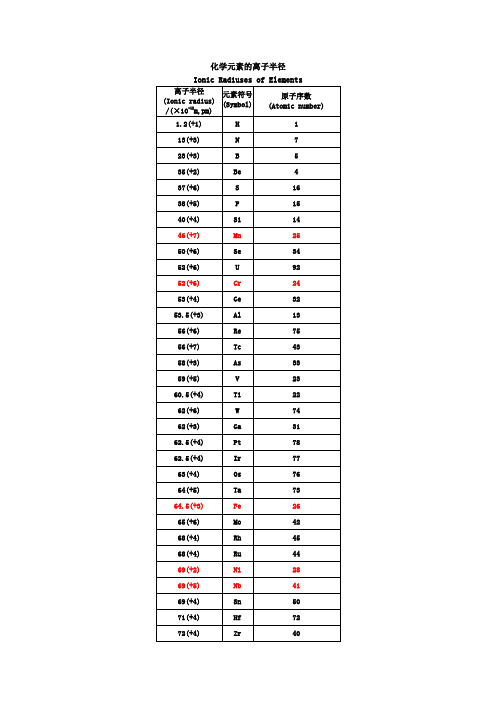
97
96.4(+3)
Sm
62
97(+3)
Cm
96
97(+4)
Te
52
97(+2)
Cd
48
97.2(+4)
Th
90
97.9(+3)
Pm
61
98.2(+3)
Am
95
99(+2)
Ca
20
99.5(+3)
Nd
60
101.3(+3)
Pr
59
102(+2)
Hg
80
102(+1)
Na
11
103(+3)
Bi
83
+2
45
5
硼
B
+3
27
6
碳
C
+4
16
7
氮
N
−34
146
+3
16
+5
13
8
氧
O
−2
140
9
氟
F
−1
133
+7
8
11
钠
Na
+1
102
12
镁
Mg
+2
72
13
铝
Al
+3
53.5
14
硅
Si
+4
40
15
磷
P
+3
44
+5
38
16
硫
S
−2
184
元素周期表中各原子半径

元素周期表中各原子半径
元素周期表是对元素按照其原子序数排列的表格,其中包含了丰富的信息,如
原子量、原子半径等。
原子半径是一个重要的物理性质,它指的是原子核到最外层电子轨道外沿的距离,决定了原子的大小和化学性质。
不同元素的原子半径存在一定的规律性,下面将对部分元素的原子半径进行简要介绍。
1.氢(H)氢是元素周期表中第一位的元素,其原子半径较小,大约为
0.53埃。
2.氦(He)氦是稀有气体元素,原子结构稳定,原子半径约为0.31埃。
3.锂(Li)锂是周期表中第三组元素,原子结构较松散,原子半径大
约为1.23埃。
4.氧(O)氧是非金属元素,原子半径较小,大约为0.73埃。
5.氟(F)氟是有毒气体,原子半径较小,大约为0.64埃。
6.氯(Cl)氯是卤素元素,原子半径约为0.99埃。
7.钠(Na)钠是周期表中第三组元素,原子结构较宽松,原子半径大
约为1.54埃。
8.铁(Fe)铁是过渡金属元素,原子半径约为1.24埃。
以上是部分元素的原子半径数据,随着元素的变化,其原子半径也会发生相应
变化。
通过了解元素的原子半径,可以更深入地了解元素的性质和化学反应规律。
在化学研究和工程应用中,原子半径信息具有重要的指导意义。
