物质组成性质专题
新教材2024高考化学二轮专题复习专题1物质的组成分类性质及应用考点1物质的分类及变化教师用书
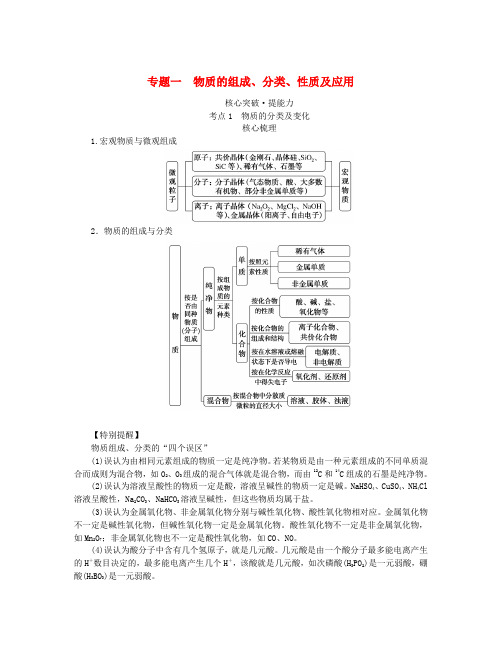
专题一物质的组成、分类、性质及应用核心突破·提能力考点1 物质的分类及变化核心梳理1.宏观物质与微观组成2.物质的组成与分类【特别提醒】物质组成、分类的“四个误区”(1)误认为由相同元素组成的物质一定是纯净物。
若某物质是由一种元素组成的不同单质混合而成则为混合物,如O2、O3组成的混合气体就是混合物,而由12C和14C组成的石墨是纯净物。
(2)误认为溶液呈酸性的物质一定是酸,溶液呈碱性的物质一定是碱。
NaHSO4、CuSO4、NH4Cl 溶液呈酸性,Na2CO3、NaHCO3溶液呈碱性,但这些物质均属于盐。
(3)误认为金属氧化物、非金属氧化物分别与碱性氧化物、酸性氧化物相对应。
金属氧化物不一定是碱性氧化物,但碱性氧化物一定是金属氧化物。
酸性氧化物不一定是非金属氧化物,如Mn2O7;非金属氧化物也不一定是酸性氧化物,如CO、NO。
(4)误认为酸分子中含有几个氢原子,就是几元酸。
几元酸是由一个酸分子最多能电离产生的H+数目决定的,最多能电离产生几个H+,该酸就是几元酸,如次磷酸(H3PO2)是一元弱酸,硼酸(H3BO3)是一元弱酸。
3.常见易混的物理变化与化学变化(1)物理变化——金属导电、溶解、潮解、萃取、分液、蒸馏、分馏、挥发、升华、吸附、盐析、渗析、焰色试验,物质三态变化等。
(2)化学变化——风化、同素异形体间的相互转化、脱水、变性、干馏、显色反应、颜色反应、钝化、油脂的硬化、煤的气化和液化等。
典题精研考向物质的分类及转化例1中国科学技术大学的钱逸泰教授等以四氯化碳和金属钠为原料,在700℃时制得纳米级金刚石粉末,发生的反应是4Na+CCl4C+4NaCl,这一成果被誉为“稻草变黄金”。
对此反应的理解有误的是( )A.反应过程中元素种类没有改变B.四氯化碳和氯化钠都属于盐C.金刚石属于共价晶体D.该反应为置换反应练1化学促进了科技进步和社会发展,下列叙述中没有涉及化学变化的是( )A.《神农本草经》中记载的“石胆能化铁为铜”B.利用“侯氏联合制碱法”制备纯碱C.科学家成功将CO2转化为淀粉或葡萄糖D.北京冬奥会场馆使用CO2跨临界直冷制冰核心突破·提能力[例1] 解析:化学反应前后遵循元素守恒,反应前后元素种类不变,A正确;四氯化碳不符合盐的定义,不是盐,B错误;金刚石属于共价晶体,C正确;CCl4和金属钠为原料,在700℃时制造出纳米级金刚石粉末的过程是钠单质置换出碳单质的过程,属于置换反应,D正确。
物质的组成及性质

物质的组成及性质随着人类科技的发展和认知的提升,对于物质的组成及性质的研究也越来越深入。
本文将从化学角度探讨物质的组成和性质,并以有机物和无机物为例进行阐述。
一、物质的组成物质是指占据空间并具有质量的实物。
从微观角度来看,物质是由不同种类的原子或分子组成的。
原子是构成物质的基本粒子,在化学上以符号表示,如氧原子的符号为O,氮原子的符号为N。
原子可以组成分子,分子是由两个或更多原子通过化学键连接而成的。
不同种类的原子和分子以一定的比例组合在一起,构成了不同性质的物质。
例如,水分子由一个氧原子和两个氢原子组成,化学式为H2O。
而氧气分子由两个氧原子结合而成,化学式为O2。
二、物质的性质物质的性质可以分为物理性质和化学性质。
1.物理性质物理性质是反映物质在不发生化学变化的情况下的特性。
它包括外观、颜色、形状、密度、熔点、沸点等。
物理性质可以通过观察和实验进行测量和描述,但不改变物质的化学组成。
举个例子,水的物理性质包括无色、透明、具有一定的密度和熔点等。
当温度低于0摄氏度时,水会凝固成冰,而当温度超过100摄氏度时,水会沸腾成水蒸气。
2.化学性质化学性质是指物质在与其他物质发生反应时所表现出的性质。
它涉及物质的组成和结构的变化,包括化学反应的速率、反应产物、氧化性、还原性等。
以燃烧为例,燃烧是一种常见的化学反应,当物质与氧气发生燃烧反应时,会产生火焰、热和光。
例如,木材燃烧时会释放出可燃气体和灰烬。
三、有机物和无机物根据化学组成和性质的不同,物质可以分为有机物和无机物。
1.有机物有机物是指含有碳元素,并通常与氢、氧、氮等元素组成的化合物。
它们是生物体的基本组分,包括蛋白质、碳水化合物、脂肪等。
有机物通常是复杂的,具有多样性和特殊的化学性质。
以葡萄糖为例,葡萄糖是一种有机物,化学式为C6H12O6。
它是一种简单糖类,是生物体内重要的能量来源。
2.无机物无机物是指除了有机物以外的物质,主要由无机化合物和无机元素组成。
专题一 物质的组成、性质与分类

专题一物质的组成、性质与分类题组一1. [2023全国甲卷,6分]化学与生活密切相关,下列说法正确的是( B )A. 苯甲酸钠可作为食品防腐剂是由于其具有酸性B. 豆浆能产生丁达尔效应是由于胶体粒子对光线的散射C. SO2可用于丝织品漂白是由于其能氧化丝织品中有色成分D. 维生素C可用作水果罐头的抗氧化剂是由于其难以被氧化[解析]苯甲酸钠为强碱弱酸盐,其水溶液显碱性,A错误;豆浆是一种胶体,能产生丁达尔效应是由于胶体粒子对光线的散射,B正确;SO2可用于丝织品漂白是由于其能与丝织品中有色成分反应生成无色物质,C错误;维生素C具有还原性,故可用作水果罐头的抗氧化剂,D错误。
2. [2023山东,2分]下列之物具有典型的齐鲁文化特色,据其主要化学成分不能与其他三种归为一类的是( C )A. 泰山墨玉B. 龙山黑陶C. 齐国刀币D. 淄博琉璃[解析]墨玉、黑陶、琉璃的主要成分属于无机非金属材料,齐国刀币的主要成分为青铜,属于金属材料,故本题选C。
3. [2023湖北,3分]2023年5月10日,天舟六号货运飞船成功发射,标志着我国航天事业进入到高质量发展新阶段。
下列不能作为火箭推进剂的是( A ) A. 液氮-液氢 B. 液氧-液氢 C. 液态NO2−肼 D. 液氧-煤油[解析]火箭推进剂通常包括燃料、氧化剂,两者混合遇高温、明火能燃烧,液体燃料主要有液氢、肼、偏二甲肼、煤油等,液体氧化剂主要有液氧、二氧化氮、过氧化氢等,液氢具有强还原性,但液氮较稳定,二者混合遇高温、明火不能燃烧,A正确。
4. [2022海南,2分]化学与日常生活息息相关。
下列说法错误的是( B )A. 使用含氟牙膏能预防龋齿B. 小苏打的主要成分是Na2CO3C. 可用食醋除去水垢中的碳酸钙D. 使用食品添加剂不应降低食品本身营养价值[解析]含氟牙膏中的F−可与牙齿中矿物质羟基磷灰石发生沉淀的转化:Ca5(PO4)3OH+F−⇌Ca5(PO4)3F+OH−,生成的氟磷灰石比羟基磷灰石更能抵抗酸的侵蚀,A项正确;小苏打的主要成分为NaHCO3,B项错误;食醋的主要成分醋酸可与碳酸钙发生反应CaCO3+2CH3COOH Ca(CH3COO)2+H2O+CO2↑,C项正确;食品添加剂是为改善食品品质和色、香、味,以及为防腐、保鲜和加工工艺的需要而加入食品的人工合成的或天然的物质,不应降低食品本身营养价值,D项正确。
化学物质的组成与性质

化学物质的组成与性质化学物质是构成我们周围世界的基本单位,它们由不同的化学元素组成,并具有各自独特的性质。
本文将介绍化学物质的组成以及不同组成对其性质的影响。
一、化学物质的组成化学物质的组成是指它所包含的化学元素及其相对比例。
化学元素是构成所有物质的基本单位,已知的化学元素有118种。
1. 单质单质由同一种化学元素组成,例如氧气(O2)、氢气(H2)等都是由单一元素组成的。
2. 化合物化合物由不同种化学元素以一定的相对比例组成。
例如水(H2O)由氢元素和氧元素按2:1的比例组成,二氧化碳(CO2)由碳元素和氧元素按1:2的比例组成。
3. 混合物混合物是由两种或两种以上的化学物质混合而成,其中每一种化学物质保持其独立的性质。
混合物可以是均匀混合或非均匀混合。
二、化学物质的性质化学物质的性质是指其在化学反应中所表现出的特征和行为。
化学物质的性质可以分为物理性质和化学性质。
1. 物理性质物理性质是指在不改变化学组成的条件下,可以通过观察或测量得到的一些特征。
例如颜色、形状、密度、溶解度等。
物理性质可以根据外界条件的改变而发生变化,如温度、压力等。
2. 化学性质化学性质是指物质在化学变化中表现出的性质,包括物质的化学反应性、稳定性、可燃性等。
化学性质取决于化学元素的组成和原子之间的化学键。
不同组成对化学物质的性质具有重要影响。
例如,在有机化学中,碳是主要的化学元素,不同的碳原子连接方式将直接决定化合物的性质。
另外,化学物质的性质还受到了外部条件的影响,如温度、压力、pH值等。
三、化学物质的应用和重要性化学物质的组成和性质决定了其在日常生活和工业中的广泛应用。
例如,氧气作为呼吸气体支持生命,氢气可以用作燃料和化工原料。
化学物质在医药领域也有重要应用,例如化学药品的开发和生产都依赖于对化学物质组成和性质的深入研究。
此外,对化学物质组成和性质的了解还对环境保护和安全管理具有重要意义。
通过研究和监测化学物质的组成及其可能的危害性,可以制定相应的安全措施和环境保护措施,以减少对人类和环境的潜在危害。
物质的基本组成与性质变化

物质的基本组成与性质变化物质是构成一切物体和物体之间相互转化的基本实体。
它们以不同的方式组合和分解,形成多种物质的性质变化和转化。
一、物质的基本组成一切物质都由原子构成。
原子是最小的化学物质单位,由质子、中子和电子组成。
质子带正电荷,中子无电荷,电子带负电荷。
原子通过中子和质子的核心组成原子核,电子则绕原子核运动。
不同元素的原子具有不同数量的质子和中子,因此具有不同的物理和化学性质。
原子通过化学键形成分子。
化学键是原子之间的相互作用力,它们链接在一起形成更复杂的化学物质。
原子之间的化学键包括共价键、离子键和金属键。
共价键是通过共享电子对形成的,离子键是通过质子和电子的转移形成的,金属键是通过金属原子间电子互相流动形成的。
分子之间的相互作用力形成物质的宏观性质。
这些性质包括物质的固态、液态和气态,以及熔点、沸点、密度、溶解度等。
不同物质的分子相互之间的强度和形式不同,导致相应的物质性质也不同。
例如,离子键比较强,导致离子化合物在常温下多为固态;共价键较弱,导致共价化合物可以是固态、液态或气态。
二、物质的性质变化物质的性质变化是物质组分和组成之间的变化过程。
根据物质的性质变化类型,可以分为物理性质变化和化学性质变化。
物理性质变化是物质组分和组成发生改变,但不会改变原子的结构和性质。
常见的物理性质变化包括熔化、冻结、沸腾、升华、溶解等。
这些变化通常涉及物质的相态变化,即从一个相态转变为另一个相态,例如固体转变为液体、气体转变为液体等。
这些变化发生时,物质的分子之间的相对位置和相互作用力发生变化,但分子本身不发生任何改变。
化学性质变化是物质组分和组成发生改变,导致物质的性质发生显著变化。
常见的化学性质变化包括燃烧、酸碱中和、氧化还原、水解等。
这些变化是由于物质的化学反应导致的,即原子之间的结构和组成发生改变。
在化学反应中,原子之间的键被断裂,重新组合形成新的键,导致物质性质发生全面的改变。
性质变化可以根据反应条件的不同而产生不同的效果。
物质的组成、性质和分类

2021年高考化学二轮精品讲练析物质的组成、性质和分类一、物质的组成1.元素——宏观概念,说明物质的宏观组成。
元素是质子数一样的一类原子的统称。
质子数一样的微粒不一定是同一种元素,因为微粒的含义要比原子广泛。
2.分子、原子、离子、“基〞、“根〞、“碳正离子〞——微观概念,说明物质的微观构成。
★原子(1)原子是化学变化中的最小粒子。
确切地说,在化学反响中,原子核不变,只有核外电子发生变化。
(2)原子是组成某些物质(如金刚石、晶体硅等)和分子的根本粒子。
(3)原子是由更小的粒子构成的。
(4)原子的概念是古希腊哲学家德谟克利特从哲学的角度首先提出来的。
1803年英国化学家道尔顿提出了原子说。
目前人类对原子构造的认识正在不断地深入。
注意:化学反响的本质就是原子的重新排列和组合。
原子与元素的联系与区别★离子离子是指带电荷的原子或原子团。
①离子的种类:②离子的生成途径:③存在离子的物质:离子化合物:NaCl、CaC2、C17H35COONa;电解质溶液中:盐酸、稀硫酸等;金属晶体中:钠、铁、铜等。
注意:在金属晶体中只有阳离子,而没有阴离子。
分子、原子、离子均是组成物质的根本粒子,是参加化学反响的根本单元,是化学研究的微观对象。
★分子:分子是能够独立存在并保持物质化学性质的一种粒子。
完整理解分子的概念,应包括以下几个方面。
①分子是一种粒子,它同原子、离子一样是构成物质的根本粒子。
如:水、氧气、干冰、蔗糖等就是由分子组成的物质。
②分子有质量,其数量级约为10—26kg。
③分子间有间隔,并不断运动着。
④同种分子的性质一样,不同种分子的性质不同。
⑤每个分子一般是由一种或几种元素的假设干原子按一定方式通过化学键结合而成的。
⑥按组成分子的原子个数,可把分子分成⑦分子间存在相互作用,此作用称作分子间作用力(又称范德华力),它是一种较弱的作用力。
★“基〞、“根〞、“碳正离子〞“基〞是指分子中除去一个原子或原子团以后剩下的原子团(也可能是单个原子),它是电中性的,通常不能稳定存在,如—NO2硝基、—CH3甲基、—SO3H磺酸基等(注意磺酸基不能写成—HSO3)。
专题一 物质的组成、性质和分类
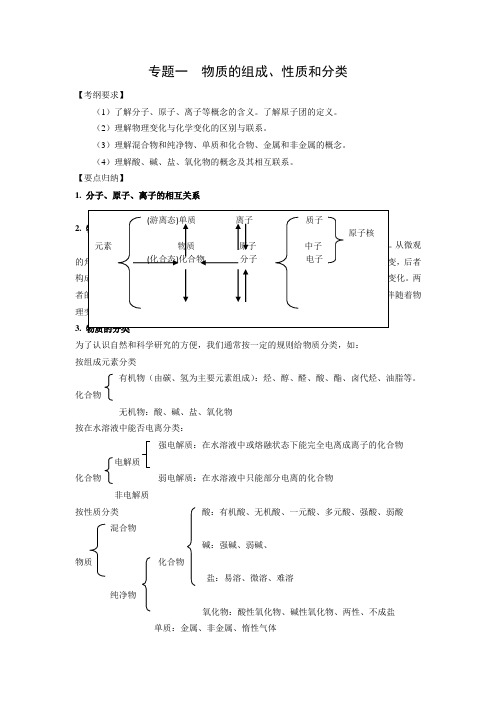
专题一物质的组成、性质和分类【考纲要求】(1)了解分子、原子、离子等概念的含义。
了解原子团的定义。
(2)理解物理变化与化学变化的区别与联系。
(3)理解混合物和纯净物、单质和化合物、金属和非金属的概念。
(4)理解酸、碱、盐、氧化物的概念及其相互联系。
【要点归纳】1. 分子、原子、离子的相互关系2.从微观后者两3.为了认识自然和科学研究的方便,我们通常按一定的规则给物质分类,如:按组成元素分类有机物(由碳、氢为主要元素组成):烃、醇、醛、酸、酯、卤代烃、油脂等。
化合物无机物:酸、碱、盐、氧化物按在水溶液中能否电离分类:强电解质:在水溶液中或熔融状态下能完全电离成离子的化合物电解质化合物弱电解质:在水溶液中只能部分电离的化合物非电解质按性质分类酸:有机酸、无机酸、一元酸、多元酸、强酸、弱酸混合物碱:强碱、弱碱、物质化合物盐:易溶、微溶、难溶纯净物氧化物:酸性氧化物、碱性氧化物、两性、不成盐单质:金属、非金属、惰性气体【试题精选】1.Cl和Cl-的共同点是()A.有相同的核电荷数B.都有毒C.都有氧化性D.最外层电子数相同2.(河南安阳2010高三上学期统一考试(化学))关于金属元素在自然界存在的全科的叙述中,正确的是A.金属元素仅存在于矿物中B.金属元素存在于矿物和动物体内,单植物体内不含C.大多数金属元素以游离态存在,少数金属元素以化合态存在D.金属元素不仅存在矿物中,动物和植物体内页存在少量金属元素3.(山东济宁一中2010高三第二次反馈练习)2007年10月24日,“嫦娥一号”开始了它的探月历程,它的一项重要任务是探测月球表面土壤里的一种非常有用的资源——可控核聚变的原料3He,3He是一种安全高效而又清洁无污染的物质,据统计,月球上的3He可以满足人类1万年以上的供电需求,月球土壤的3He含量可达500万吨。
关于3He的叙述正确的是()A.3He和4He两种核素互为同素异形体B.3He和4He两种核素互为同位素C.核聚变时,原子核发生了变化,发生了化学反应D.在3He中存在:质子数=中子数=核外电子数2.(东北师大附中2010高三第二次摸底)最近意大利罗马大学的FulvioCacace等人获得了分子。
物质的组成与性质

物质的组成与性质一、简介物质是构成世界的基本要素,它们的组成与性质对于我们理解自然界起着重要的作用。
本文将探讨物质的组成和性质,并分析它们之间的关系。
二、物质的组成1. 原子及元素物质由原子构成,原子是物质的最小单位。
元素是只包含一种原子的物质。
例如,氧元素由氧原子组成,铁元素由铁原子组成。
2. 化合物化合物由两种或两种以上不同元素的原子化合而成。
其中最常见的是水,由氧原子和氢原子组成。
化合物的性质往往与构成它的元素有着显著的差异。
3. 混合物混合物由两种或两种以上的纯物质混合而成,它们的组成和性质可以根据不同的比例进行变化。
例如,空气是由氮气、氧气、二氧化碳等气体组成的混合物。
三、物质的性质1. 物理性质物质的物理性质是指在不改变物质组成的情况下可以观察到的性质。
例如,颜色、形状、密度、熔点和沸点等都是物质的物理性质。
这些性质可以通过观察和实验来确定。
2. 化学性质物质的化学性质指的是在物质参与化学反应时可以观察到的性质。
例如,金属与酸反应会产生氢气,这是金属的化学性质。
化学性质需要通过化学实验来进行判断。
3. 密度与比重物质的密度是指单位体积内所含质量的大小。
比重是物质密度与某一给定物质密度的比值。
密度和比重可以用来描述物质的重量特征,对于实际应用具有一定的重要性。
四、组成与性质的关系物质的组成决定了其性质。
不同元素和不同比例的元素组合会导致不同的物质性质。
例如,氧气和氯气分别是氧原子和氯原子的纯物质,它们具有截然不同的性质。
当它们反应时,会产生氯化铁,这是由氧原子和氯原子组成的化合物,其性质也和原始元素有所不同。
五、小结物质的组成与性质是密不可分的。
我们通过对物质的组成和性质的研究,可以更好地理解自然界中的各种现象,并且为人类的生产和应用提供指导。
通过分析物质的组成与性质的关系,人们可以利用这些知识来开发新的材料和技术,推动社会的进步与发展。
六、致谢在撰写本文过程中,笔者参考了多篇相关文献和资料,特此致谢。
物质的组成、分类、性质和基本化学用语专题总结

物质的组成、分类、性质和基本化学用语专题总结考纲要求1.理解物理变化与化学变化的区别与联系。
2.理解混合物和纯净物、单质和化合物、金属和非金属的概念。
3.理解酸、碱、盐、氧化物的概念及其相互联系。
4.了解胶体是一种常见的分散系。
了解胶体与溶液的简单鉴别方法和胶体的重要应用。
5.正确规范使用基本化学用语,如:常见元素符号、原子结构示意图、化学式(分子式)、电子式、结构式和结构简式等。
知识点一、物质的组成:1. 物质的组成关系2. 分子、原子、离子的比较3,离子与基团4. 同素异形体与同位素、同系物、同分异构体的区别:要点1.在宏观上,物质由元素组成,已发现组成物质的元素有110多种;在微观上,物质由微粒构成,构成物质的微粒有原子、离子、分子等。
2.分子与原子的区别:分子是保持物质化学性质的最小粒子,在化学反应中可分。
原子是化学变化中的最小粒子,在化学变化中不可分。
3.元素与核素、同位素的区别:元素是指具有相同核电荷数(或质子数)的一类原子的总称。
元素只有种类之分,无数量概念。
核素是具有一定数目的质子和一定数目的中子的一种原子 .同位素是指具有相同质子数和不同中子数的同种元素的不同原子。
元素种类仅由质子数决定,而同位素是由质子数和中子数共同决定。
4.同素异形体——同种元素形成结构不同的单质,如:O 2和O 3、金刚石和石墨、白磷和红磷。
5.物质的构成微粒: a 由分子构成的物质:①非金属单质:如H 2、X 2、O 2、O 3、N 2、P 4、S 、C 60、稀有气体等 ②非金属氢化物:如HX 、H 2O 、NH 3、H 2S 等 ③酸酐:如SO 2、CO 2、SO 3、P 2O 5、N 2O 5 等④酸类:如HClO 4、HClO 、H 2SO 4、H 3PO 4、H 2SiO 3等 ⑤有机物:如烃类、烃的衍生物、糖类、氨基酸等 ⑥其它:如NO 、N 2O 4、AlCl 3等离子基团定义 带电的原子或原子团 化学中对原子团和基的总称 区别 带有正电荷或负电荷不带电,为缺电子物质,呈电中性联系 两者通过得失电子可以互相转化实例-OH-2NO-Cl CH 3+-OH -NO 2 -Cl -CH 3b 由原子直接构成的物质:稀有气体、金刚石、晶体硅、二氧化硅、碳化硅、石墨等;c 由阴阳离子构成的物质:绝大多数盐、强碱、低价金属氧化物。
专题一 物质的性质、组成和化学用语

仁一北
高三化学备课
C
)
二轮复习
专题一 物质的组成、性质和化学用语
3. 化学家将研究气体与固体(或液体)在界面上所发生的物理、化学现象 的科学称为表面化学。对下列现象的研究不属于表面化学范畴的是 ( A ) A.氯化银在水中的溶解平衡 B.氢氧燃料电池中电极上的反应 C.铁在潮湿的空气中生锈 D.氮气与氢气在铁触媒作用下化合 4. 下列变化中属于物理变化的是 ( D ) A.剩饭变馊 B.自行车生锈 C.牛奶变酸 D.电灯发光 5. 下列变化不能说明发生了化学变化的是 A.变化时有电子的得失或共用电子对的形成 B.变化时释放出能量 C.变化过程中有旧化学键的断裂和新化学键的形成 D.变化前后原子的种类和数目没有改变,分子种类增加了
(2)物理变化:金属导电、盐析、活性炭吸附、渗析。
1. (2012·重庆理综,6)化学工业是国民经济的支柱产业。下列生产过 程中不涉及化学变化的是 ( D ) A.氮肥厂用氢气和氮气合成氨 B.钢铁厂用热还原法冶炼铁 C.硫酸厂用接触法生产硫酸 D.炼油厂用分馏法生产汽油
2. 下列诗句或谚语都与化学现象有关,下列说法不正确的是 ( A.“水乳交融,火上浇油”前者包含物理变化,而后者包含化学变化 B.“落汤螃蟹着红袍”肯定发生了化学变化 C.“滴水石穿,绳锯木断”不包含化学变化 D.“野火烧不尽,春风吹又生”包含了多种化学变化
仁一北
高三化学备课
二轮复习
专题一 物质的组成、性质和化学用语
题组一 概念的判断与理解 1.正误判断,正确的划“√”,错误的划“×” (1)金属氧化物均为碱性氧化物 (× ) (2)HClO是弱酸,所以NaClO是弱电解质 (× ) (3)HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均为离子化合物 × ( ) (4)石油是混合物,其分馏产品汽油为纯净物 (× ) (5)BaSO4的水溶液不易导电,故BaSO4是弱电解质 (× ) (6)SO2、SiO2、CO均为酸性氧化物 ( ×) (7)烧碱、冰醋酸、四氯化碳均为电解质 ( ×) (8)福尔马林、水玻璃、氨水均为混合物 (√) (9)黑火药由硫黄、硝石、木炭三种物质按一定比例混合而成 (√) (10)KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 (× )
化学高考专题复习物质的组成性质和分类

物质的组成、性质和分类物质的组成、性质和分类1.元素:具有相同核电荷数(即质子数)的一类原子的总称。
元素没有数量意义,只论种类,不论个数。
原子:是化学变化最小的微粒。
少数非金属单质如:金刚石、石墨等直接由原子构成。
金属单质也可以认为由原子构成,但实际是由金属阳离子和自由电子构成的。
分子:是构成物质的一种微粒,它是保持物质化学性质的一种微粒。
某些非金属单质(如:氢气、氧气、S8、Br2、I2和Ar等),氢化物(如氨气、水等),酸酐(如SO2、SO3、P2O5等),酸(如硫酸等),和有机物等由分子构成的。
离子:离子是带电荷的原子或原子团。
绝大多数盐、强碱和某些低价态金属氧化物是由离子构成的。
2.元素有两种存在的形式,在单质中的元素称为游离态元素,在化合物中的元素称为化合态元素。
3.混合物:由不同种物质混合而成,没有固定的组成和性质。
纯净物:由同种物质组成,具有固定的组成和性质。
4.单质:同种元素组成的纯净物(元素的游离态)化合物:不同种元素组成的纯净物(元素的化合态)5.氧化物:由氧元素和另一种元素组成的化合物酸:电离时所生成的阳离子全部是氢离子的化合物碱:电离时所生成的阴离子全部是氢氧根离子的化合物盐:由金属离子和酸根离子组成的化合物6.物质的变化物理变化:物质发生变化时,只是形状或状态发生改变,而没有新物质生成,这种变化叫做物理变化。
发生物理变化时,物质的分子(或原子组合)保持不变。
化学变化:物质发生变化时,生成了新的物质,这种变化叫做化学变化。
发生化学变化时,物质组成中的原子(或离子)重新组合,生成了新的物质。
化学变化场伴随着物理变化,有放热、吸热、改变颜色、生成气体和沉淀等现象。
7.物质的性质物理性质:是指物质在物理变化中表现出来的性质。
如:颜色、聚集状态、气味、熔沸点、密度和硬度等。
化学性质:是指物质在发生化学变化中表现出来的性质。
如可燃性、氧化性、还原性、酸碱性和热稳定性等。
8.物质的分类:金属:钠、铁混合物酸性氧化物CO2、SO2单质非金属:氯气、硫物质成盐氧化物碱性氧化物Na2O、CuO稀有气体:氖、氩纯净物氧化物两性氧化物Al2O3、ZnO不成盐氧化物:NO、CO、NO2无氧酸:HCl、H2S化合物酸含氧酸:H2SO4、H3PO4可溶性碱:NaOH、KOH、Ba(OH)2、Ca(OH)2碱不溶性碱:Mg(OH)2、Cu(OH)2正盐:Na2CO3、K2S酸式盐:NaHCO3、NaHSO4、CaHPO4盐碱式盐:Cu2(OH)2CO3、Mg(OH)Cl复盐:KAl(SO4)2·12H2O络盐:Na3AlF6注意:判断氧化物所属类别时,一定要注意①酸性氧化物不一定是非金属氧化物,如Mn2O7;非金属氧化物也不一定是酸性氧化物,如CO、NO;②碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物,如Mn2O7是酸性氧化物;Al2O3是两性氧化物。
物质的组成和性质

物质的组成和性质物质是构成世界的基本单位,它具有不同的组成和性质。
在本文中,我们将探讨物质的组成和性质的相关概念,以及它们在化学和物理学中的应用。
一、物质的组成物质的组成可以从微观和宏观两个层面进行描述。
微观上,物质由原子或分子组成,不同的物质由不同种类的原子或分子组合而成。
宏观上,物质可以分为纯物质和混合物。
1. 纯物质纯物质是由同一种物质组成的,具有固定的化学组成和特定的性质。
例子包括金属元素铁、氧气和水等。
纯物质又可以分为元素和化合物。
(1)元素元素是由具有相同原子序数的原子组成的物质,无法通过化学方法进一步分解。
元素可以用元素符号表示,例如氧气(O)、氢气(H₂)等。
(2)化合物化合物是由两种或两种以上不同原子组成的物质,具有特定化学组成和一定的化学性质。
化合物可以通过化学反应分解为其组成元素。
例如,水(H₂O)是由氢原子和氧原子组成的化合物。
2. 混合物混合物是由不同种类的物质混合而成的物质,其成分可以通过物理方法进行分离。
混合物的组成和性质可以随着混合物中各组分比例的改变而改变。
常见的混合物包括空气、海水和沙子等。
二、物质的性质物质的性质可以分为物理性质和化学性质。
1. 物理性质物理性质描述了物质在没有发生化学反应的情况下,通过观察、测量和实验等方法可以确定的特征。
常见的物理性质包括颜色、密度、熔点、沸点和导电性等。
物理性质可以用来区分不同的物质和判断物质的变化。
2. 化学性质化学性质描述了物质在发生化学反应时的行为和性质变化。
化学性质是由物质的化学组成所决定的,例如燃烧性、氧化性和酸碱性等。
通过观察物质在不同化学反应中的变化,可以确定物质的化学性质。
三、物质的应用物质的组成和性质在化学和物理学中有着广泛的应用。
1. 化学应用在化学领域,研究物质的组成和性质可以帮助我们了解化学反应的机理和过程。
通过研究物质的化学性质,可以合成新的物质,开发新的药物和材料,推动科学技术的发展。
2. 物理应用物质的物理性质在物理学中的应用十分广泛。
高中化学知识点总结物质的组成性质和分类

高中化学知识点总结物质的组成性质和分类高中化学知识点总结:物质的组成、性质和分类化学作为一门自然科学,研究物质的组成、性质和变化规律。
在高中化学的学习过程中,我们积累了许多关于物质的基本概念和知识点。
本文将对物质的组成、性质和分类进行总结,希望对化学的学习者有所帮助。
一、物质的组成物质是由不同种类的原子或分子组成的。
原子是构成物质的基本粒子,它由质子、中子和电子组成。
元素是由具有相同原子序数的原子组成的,可以用元素符号表示,如氢(H)、氧(O)等。
化合物是由不同元素的原子按照一定的比例和方式结合而成。
物质的组成还可以根据物质的形态进行分类。
常见的物态有固态、液态和气态。
固态物质具有固定的形状和体积,原子或分子之间的相互作用力较强;液态物质具有固定的体积但可流动,原子或分子之间的相互作用力相对较弱;气态物质具有可压缩性和可流动性,原子或分子之间的相互作用力较弱。
二、物质的性质物质的性质可以分为物理性质和化学性质。
物理性质是物质自身固有的性质,可以通过观察和测量进行判断,而不改变物质的组成。
常见的物理性质有颜色、硬度、密度、熔点和沸点等。
化学性质是物质参与化学反应时表现出来的性质,会导致物质的组成发生变化。
化学性质包括可燃性、氧化性、还原性和酸碱性等。
物质的性质还可以根据其可溶性进行分类。
溶解是指固体、液体或气体溶质与溶剂之间的混合过程。
可溶性是指物质在一定条件下能否溶解于某种溶剂中。
常见的可溶性规律包括“相似相溶原则”和“亲水性和疏水性原则”。
三、物质的分类根据物质的组成和化学性质,可以将物质分为元素和化合物。
元素是由相同原子组成的物质,可以根据其在元素周期表中的位置进行分类,如金属元素、非金属元素和半金属元素等。
化合物是由不同元素的原子组成的物质,可以根据其化学式和结构进行分类,如无机化合物和有机化合物。
根据物质的物理性质和可溶性,可以将物质分为溶液、悬浮液和胶体。
溶液是由溶质溶解于溶剂中而形成的均匀透明的混合物,如盐水、糖水等。
物质的组成与性质

物质的组成与性质物质是构成我们周围世界的基本单位。
它们以不同的形式和性质存在,通过它们的组成和结构,我们能够了解它们的性质和行为。
在本文中,我们将讨论物质的组成、分类和性质。
一、物质的组成物质由原子和分子组成。
原子是最基本的单位,它们与其他原子结合形成分子。
原子由质子、中子和电子组成。
质子和中子位于原子核中,而电子则围绕核心旋转。
原子的种类由其核中所含有的质子数决定,这被称为原子序数。
例如,氢原子的原子序数为1,氧原子的原子序数为8。
分子是由两个或多个原子结合而成的,它们可以是相同类型的原子,如氧气(O2)和氮气(N2),也可以是不同类型的原子,如水(H2O)和二氧化碳(CO2)。
分子通过共用或交换电子来结合在一起。
二、物质的分类物质可以根据其组成和性质进行分类。
最常见的分类方法是将物质分为纯物质和混合物。
纯物质是由同一种类型的粒子组成的物质。
它们可以是单一的原子或分子,例如金属元素铁(Fe)和氧气(O2)。
纯物质还可以是化合物,由不同类型的原子组成,如水(H2O)和盐(NaCl)。
混合物由两种或更多种类型的物质混合而成,它们保留了各自成分的性质。
混合物可以是均匀的或不均匀的。
均匀混合物也被称为溶液,其中溶剂和溶质彼此完全混合。
例如,盐水是水作为溶剂,溶解了盐作为溶质的溶液。
三、物质的性质物质的性质可以分为物理性质和化学性质。
物理性质是可以通过观察和测量来确定的性质。
它们包括颜色、形状、密度、熔点和沸点等。
物理性质可以用来识别物质并区分它们之间的差异。
化学性质指的是物质在与其他物质发生反应时所表现出来的性质。
它们包括物质的可燃性、反应性、氧化性等。
化学性质可以描述物质与其他物质之间的相互作用和变化。
物质的性质还可以分为基本性质和特定性质。
基本性质是与物质的组成和结构无关的性质,而特定性质则是由物质的组成和结构决定的。
总结起来,物质以原子和分子的形式存在,根据其组成和性质被分类为纯物质和混合物。
物质的性质可以分为物理性质和化学性质,它们描述了物质的外观和行为。
物质的组成与性质

物质的组成与性质一、引言物质是构成宇宙万物的基本要素,它们以不同的形式存在于我们周围的世界中。
本文将探讨物质的组成及其性质,并分析其在化学和物理领域的重要性。
二、物质的组成物质由原子或分子组成,进一步可细分为元素和化合物。
元素是由同类原子组成的物质,而化合物是由不同元素以确定比例结合而成的物质。
1. 元素元素是物质的最基本单位,无法通过化学方法再分解为其他物质。
目前,元素周期表中已确认了118种元素,其中92种为天然元素,其余为人工合成元素。
2. 化合物化合物是由不同元素以固定比例结合而成的物质。
化合物的性质与其组成元素及其结合方式有关。
例如,水(H2O)是由氢和氧元素结合而成的化合物,具有特定的物理和化学性质。
三、物质的性质物质的性质可分为物理性质和化学性质两类。
1. 物理性质物理性质是物质固有的,不改变其物质组成的特征。
物质的物理性质包括颜色、形状、硬度、密度、电导率等。
通过观察和测量这些性质,我们能够了解物质的基本特征。
2. 化学性质化学性质是物质与其他物质发生化学反应并产生新物质的特征。
物质的化学性质包括与其他物质的反应性,如与酸碱反应、氧化还原反应等。
化学性质的变化常常伴随着能量的变化,如放热或吸热反应。
四、物质的重要性物质的组成与性质对于化学和物理学领域具有重要意义。
1. 化学领域在化学领域,了解物质的组成和性质可以揭示物质间的相互作用和反应机制。
通过研究物质的化学性质,我们可以开发新的化学物质,应用于医药、材料科学等领域。
2. 物理领域物质的物理性质对于物理学有着重要的意义。
通过研究物质的物理性质,我们可以揭示物质的运动规律、热力学性质等。
这对于探索宇宙的基本规律以及开发新的物理技术有着重要的影响。
五、结论物质的组成与性质是科学研究中的重要内容,它们对于化学和物理学等学科的发展具有重要作用。
通过深入了解物质的组成与性质,我们能够更好地探索和应用它们,推动科学技术的进步和创新。
总结起来,物质的组成与性质是研究物质本质的关键要素。
物质的组成与性质

物质的组成与性质在我们生活的这个世界里,物质无处不在。
从我们呼吸的空气,到脚下坚实的土地;从日常饮用的水,到构成生物体的复杂有机物,无一不是由各种物质组成。
那么,物质究竟是由什么构成的?它们又具有怎样的性质呢?首先,让我们来探讨一下物质的组成。
从微观角度来看,物质是由原子、分子和离子等粒子构成的。
原子是化学变化中的最小粒子,它由原子核和核外电子组成。
原子核包含质子和中子,质子带正电荷,中子不带电。
而核外电子则围绕着原子核高速运动,并且带负电荷。
不同的原子,其质子数不同,这就决定了元素的种类。
例如,氢原子的质子数为 1,氧原子的质子数为 8。
分子是保持物质化学性质的最小粒子。
有些物质是由分子构成的,比如水(H₂O)就是由水分子组成的,一个水分子由两个氢原子和一个氧原子通过共价键结合而成。
氧气(O₂)也是由氧分子构成的。
离子则是原子或分子失去或得到电子形成的带电粒子。
比如氯化钠(NaCl),就是由钠离子(Na⁺)和氯离子(Cl⁻)通过离子键结合而成。
物质的组成决定了其性质。
物质的物理性质包括颜色、状态、气味、熔点、沸点、密度、硬度等。
例如,金是金黄色的、具有较高的密度和良好的延展性;氧气是无色无味的气体,在一定条件下会变成液态和固态。
物质的化学性质则主要体现在其化学反应的能力上。
比如,氢气具有可燃性,能够在氧气中燃烧生成水;铁容易在潮湿的空气中生锈,这是铁与氧气和水发生化学反应的结果。
不同的物质具有不同的性质,这使得它们在生活和生产中有着各种各样的用途。
金属具有良好的导电性、导热性和延展性,因此被广泛用于制造电线、炊具和各种机械零件。
例如铜,因为其良好的导电性常用于制作电线;铝具有较轻的质量和良好的耐腐蚀性,常用于制造飞机外壳和饮料罐。
非金属元素也各有其重要的用途。
比如,碳可以形成金刚石和石墨等不同的同素异形体。
金刚石硬度极高,常用于制造切割工具;石墨则具有良好的导电性和润滑性,可以用于制作电极和润滑剂。
物质的组成和性质

物质的组成和性质物质是构成宇宙的基本单位,它们由不同的元素组成,拥有独特的性质。
本文将从物质的组成和性质两个方面进行探讨。
一、物质的组成物质的组成是指物质由哪些元素构成。
元素是由相同类型的原子组成的基本物质单位。
目前已知的元素有118种,它们按照化学性质的相似性被分类到不同的元素周期表族别中。
1. 元素的组成元素由原子构成,原子是最小的化学单位,由原子核和绕核电子组成。
原子核由质子和中子组成,质子带正电荷,中子是电荷中性的。
原子核的质量主要集中在中子和质子上,绕核电子质量很小可以忽略。
2. 合成物质的组成大部分物质都是复杂的合成物质,由两种或多种不同元素的原子通过化学反应结合而成。
例如,水(H2O)由氢原子和氧原子组成,氧气(O2)由两个氧原子构成。
3. 混合物的组成混合物是由两种或多种物质混合而成,每种物质保留其原有的性质。
混合物可以是均匀的或非均匀的。
例如,蜂蜜和水混合后形成的溶液就是一种均匀混合物,而沙子和水混合后形成的悬浮液是一种非均匀混合物。
二、物质的性质物质的性质是指物质在特定条件下所表现出来的特点。
物质的性质可以分为物理性质和化学性质两类。
1. 物理性质物理性质是指在不改变物质组成的情况下可以通过观察和测量来获得的性质。
物理性质包括颜色、形状、密度、熔点、沸点等。
例如,水的熔点是0°C,沸点是100°C,这是水的物理性质。
2. 化学性质化学性质是指物质与其他物质发生化学反应时所表现出来的性质。
化学性质可以通过观察物质与其他物质之间的反应来判断。
例如,铁可以与氧气反应产生铁锈,这是铁的化学性质。
物质的性质还可以分为可量性质和不可量性质。
可量性质可以通过数值测量得到,而不可量性质只能通过观察和描述来获得。
总结:物质的组成和性质是物质科学研究的基础。
物质由元素、化合物或混合物组成,每种物质都有其独特的性质。
物质的性质分为物理性质和化学性质,可以通过观察、测量以及化学反应来获得。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题一物质的组成、性质和分类化学用语【学法导航】(1)一般采用“概念对比法”或“反例否定法”等。
化学基本概念的有关知识比较零碎,容易混淆,我们在记忆时一定要记牢,特别是一些概念、定义中的关键字更是要记忆准确,这是解决这类题的关键。
(2)此类题有不少是选择题,可采用筛选法、排除法、估算法等各种方法使解题的速度和准确性大大提高.(3)解题思路要点认真阅读试题,弄清题目问的是什么?给出的条件是什么?列出解题的关键字词,是解答此类题的关键。
不少考生由于不能深入地进行观察思考,对题设的条件以点盖面、以偏盖全,忽视了题中的隐含条件,仅仅依靠熟题效应,简单地给出答案,结果造成错误。
【典例精析】1. 下列过程中,不涉及化学变化的是()A.甘油加水作护肤剂B.用明矾做净水剂C.烹鱼时加入少量的料酒和食醋可减少腥味,增加香味D.烧菜用过的铁锅,经放置常出现红棕色斑迹【考点分析】本题考查的是物理变化和化学变化之间的差异。
2. 材料与化学密切相关,表中对应系错误的是【考点分析】本题考查考生对物质组成成分的认识。
3. 我国稀土资源丰富。
下列有关稀土元素14462Sm与15062Sm的说法正确的是A. 14462Sm与15062Sm互为同位素 B.14462Sm与15062Sm的质量数相同C. 14462Sm与15062Sm是同一种核素 D.14462Sm与15062Sm的核外电子数和中子数均为62【考点分析】考查同位素、核素的概念及质量数质子数、中子数之间的关系。
属于原子结构部分的。
4. 下列说法都正确的是.①江河入海口三角洲的形成通常与胶体的性质有关②四川灾区重建使用了大量钢材,钢材是合金③“钡餐”中使用的硫酸钡是弱点解质④太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置⑤常用的自来水消毒剂有氯气和二氧化氯,两者都含有极性键⑥水陆两用公共汽车中,用于密封的橡胶材料是高分子化合物A. ①②③④B. ①②④⑥C. ①②⑤⑥D. ③④⑤⑥【考点分析】考查生活材料的组成、特性等。
5.下列各项中表达正确的是A.F-的结构示意图:B.CO2的分子模型示意图:C.NaCl的电子式:D.N2的结构简式:6. 以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是A.:He B.C.1s2D.7. 下列现象或事实可用同一原理解释的是()A.浓硫酸和浓盐酸长期暴露在空气中浓度降低B.氯水和活性炭使红墨水褪色C.漂白粉和水玻璃长期暴露在空气中变质D.乙炔和乙烯使溴的四氯化碳溶液褪色【考点分析】本题考查对物质性质的掌握和化学实验现象及物质变化的本质理解。
8. 对于下列反应的反应类型的判断,不正确的是()A.CO2+H2O=H2CO3 化合反应B.Cu(OH)2ΔCuO+H2O 分解反应C.Fe2O3+3CO高温2Fe+3CO2 置换反应D.NaCl+AgNO3=AgCl↓+NaNO3复分解反应【考点分析】本题考查四种基本反应类型9. 下列叙述中正确的是()A.酸酐一定是酸性氧化物B.碱性氧化物一定是金属氧化物C.金属氧化物一定是碱性氧化物D.非金属氧化物一定是酸性氧化物【考点分析】本题是在物质分类本质理解透彻基础上再加实例验证的分析、对比、判断试题。
10. 下列各组物质按酸、碱、盐分类次序排列正确的是()A.硫酸、纯碱、石膏B.氢氟酸、熟石灰、明矾C.原硅酸、石英、小苏打D.高锰酸、烧碱、尿素11. 下列化学式既能表示物质的组成,又能表示物质的一个分子的是()A.NaOH B.SiO2C.Fe D.C3H812. 某合作学习小组讨论辨析以下说法:①粗盐和酸雨都是混合物;②沼气和水蒸气都是可再生能源;③冰和干冰既是纯净物又是化合物;④不锈钢和目前流通的硬币都是合金;⑤盐酸和食醋既是化合物又是酸;⑥纯碱和熟石灰都是碱;⑦豆浆和雾都是胶体。
上述说法正确的是()A.①②③④B.①②⑤⑥C.③⑤⑥⑦D.①③④⑦【考点分析】本题考查对一些概念的理解13. 由两种原子组成的纯净物()A. 一定是化合物B. 可能是化合物或单质C. 一定是单质D. 一定是同素异形体【考点分析】本题主要考查学生对物质的组成、同素异形体、同分异构体、混合物和纯净物、单质和化合物等概念的理解14. 下列变化或过程属于物理变化的是()A.激光法蒸发石墨得C60 B.渗析法净化氢氧化铁胶体C.鸡蛋白遇浓硝酸显黄色D.用铂丝蘸取NaCl固体进行焰色反应【考点分析】本题考查了物理变化和化学变化的概念辨析。
15. 物质分类的依据通常有组成和性质,下列物质分类中,只考虑组成的是()A. Na2SO4是钠盐、硫酸盐、正盐B. HNO3是一元酸、强酸、挥发性酸C. Mg(OH)2是二元碱、难溶性碱、中强碱D. Al2O3是两性氧化物、金属氧化物、最高价氧化物【考点分析】本题考查物质的分类的划分标准和依据。
16.主族元素A有1个价电子,主族元素B的最高价与最低价的绝对值相等,它们形成化合物的化学式是()A. AB4B. BA4C. A2BD. B2A3【考点分析】本题考查根据原子结构推测构成化合物的分子式。
17. 用特殊方法把固体物质加工到纳米级(1nm~100nm)的超细粉末粒子,然后制得纳米材料。
下列分散系中的分散质的粒子的大小和这种纳米粒子大小具有相同的数量级的是A.溶液B.悬浊液C.胶体D.乳浊液【考点分析】胶体与其他分散系的本质区别18. 用下列方法来制备溶胶:①0.5mol/L BaCl2溶液和等体积的2mol/L H2SO4相混合并振荡;②把1mL饱和三氯化铁逐滴加入20mL沸水中,边加边振荡;③把1mol/L水玻璃加入10mL 1mol/L盐酸中,用力振荡。
可行的是()A.只有①②B.只有①③C.只有②③D.①②③【考点分析】胶体的制备【专题突破】1.下列变化不属于化学变化的是()A. 在稀盐酸中滴入石蕊试液溶液变红B. 红糖水中加入活性炭溶液变为无色C. SO2通入品红中溶液变为无色D. 少量胆矾粉末加入到浓硫酸中固体变白色2. 20世纪20年代起,就有人预言可能存在由4个氧原子构成的氧分子,但一直没有得到证实。
最近,意大利一所大学的科学家使用普通氧分子和带正电的氧离子制造出了这种新型氧分子,并用质谱仪探测到了它存在的证据。
若该氧分子具有空间对称结构,你认为该氧分子是()A. 氧元素的一种同位素B. 臭氧的同素异形体C. 一种新的氧化物D. 可能是非极性键构成的非极性分子3. 下列物质按纯净物、混合物、强弱电解质和非电解质顺序排列的是()A. 单甘油酯、混甘油酯、苛性钾、氢硫酸、三氧化硫B. 胆矾、漂白粉、硫酸钠、次氯酸、氯气C. 明矾、水煤气、盐酸、醋酸、铜D. 冰醋酸、福尔马林、硫酸钡、氢硫酸、乙醇4. 对化学反应的认识错误的是()A.会引起化学键的变化B.会产生新的物质C.必然引起物质状态的变化D.必然伴随着能量的变化5. 下列类型的反应,一定发生电子转移的是()A.化合反应B.分解反应C.置换反应D.复分解反应6. 近年来逐步实施垃圾分类放置的方法,其中塑料袋、废纸、旧橡胶制品等属于 ()A.无机物B.有机物C.盐类D.非金属单质7. 下列叙述中正确的是()A.钢铁在海水中比在河水中更易腐蚀,主要原因是海水中的含氧量高于河水B .焰色反应是物理变化C .用切割机切割金属时,个别金属的原子核恰好被分成更小的微粒D .某些不合格大理石装潢材料中含有严重超过规定标准、对人体有害的放射性同位素氡Rn 22286,其质子数为1368.下列各项中表达不正确...的是 ( ) A. -F 的结构示意图: B.NaCl 的电子式:Na ClC.CO 2分子的结构式:O =C =OD.碳-12原子:126C 9.下列说法正确的是 ( )A .明矾净水过程中不涉及化学变化B .由同种元素组成的物质一定是纯净物C .风化、石油分馏和碘的升华都是物理变化D .在化学反应中,反应前后原子种类、数目和质量一定不变10. 下列表达式正确的是 ( )A. 羟基的电子式:[:O :H]-B.NaCO 3的水解方程式为:-23CO +H 2O -3HCO +-OHC.甲酸甲酯的结构简式:HCOOC 2H 5D.用Cu 做阳极电解饱和食盐水的阳极反应式为:2-Cl -2e-=Cl 2↑11. 化学用语是学习化学的工具和基础。
下列有关化学语的使用正确的是 ( )A .用食醋除去水壶内的水垢:CaCO 3+2H + = Ca 2++CO 2↑+H 2OB .纯碱溶液呈碱性的原因是:CO 32—+2H 2O H 2CO 3+2OH —C. 钢铁发生吸氧腐蚀的正极反应式:O 2+ 4e - +2H 2O =4OH —D .表示氢气燃烧热的热化学方程式为:2H 2(g )+O 2(g )= 2H 2O (1);△H = -571.6 KJ·mol -112. 把A 、B 、C 、D 四种物质放在密闭容器中,在一定条件下充分反应,反应前及反应一段时间后各物质的质量见下表:下列说法不正确的是( ) A .此反应一定不是可逆反应 B .物质C 一定是化合物C .此反应不一定是氧化还原反应D .若A 、C 的摩尔质量之比为97:108,则A 、C 变化的物质的量之比为1:213. 已知自然界氧的同位素有16O 、17O 、18O ,氢的同位素有H 、D ,从水分子的原子组成来看,自然界的水分子一共有 ( )A .3种B .6种C .9种D .12种14 正确掌握化学用语和化学基本概念是学好化学的基础,下列有关表述中正确的一组是 ( )A .过氧乙酸(CH 3COOOH)与羟基乙酸(HOCH 2COOH)所含官能团相同;两者互为同分异构体B .16O 与18O 互为同位素;H 216O 、D 216O 、H 218O 、D 218O 互为同素异形体C .P 4、CH 4、4NH 粒子的空间构型均为正四面体型;CO 2、C 2H 2均为直线型分子D .Ca 2+的结构示意图为,NH 4Cl 的电子式为【学后小结】15. 金属钛对体液无毒且有惰性,能与肌肉和骨骼生长在一起,因而有“生物金属”之称。
下列有关Ti 4822和Ti 5022的说法中正确的是 ( )A.Ti 4822和Ti 5022原子中均含有22个中子 B. Ti 4822和Ti 5022核外均有4个电子层 C. 分别由Ti 4822和Ti 5022组成的金属钛单质互称为同分异构体 D. Ti 4822与Ti 5022为同一核素16. 下列说法正确的是 ( )A. 发生化学反应时失去电子越多的金属原子,还原能力越强B. 金属阳离子被还原后,一定得到该元素的单质C. 核外电子总数相同的原子,一定是同种元素的原子D. 能与酸反应的氧化物,一定是碱性氧化物17. Y 元素的最高正价与最低负价的绝对值之差是4;Y 元素可与M 元素形成离子化合物,并在水中电离出电子层结构相同的阴、阳离子,则该化合物是 ( )A .2K SB .2N a SC .2N a OD .K C l18. 下列各组物质的类别归属正确的是 ( )A. 同位素:B. 分子晶体:I 2、SO 3、固态氩C. 非电解质:Cl 2、BaSO 4、C 2H 5OHD. 化合物:重水、双氧水、矿泉水19. 下列说法正确的是 ( )A .硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物B .洒精、硫酸钡和水分别属于电解质、强电解质和弱电解质C .Mg 、Al 、Cu 可以分别用置换法、直接加热法和电解法冶炼得到D .天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源20. 下列各组物质中,第一种是含氧酸,第二种是混合物,第三种是碱的是 ( )A .爆鸣气、硫酸铜、硫酸B .水、空气、纯碱C .氧化铁、胆矾、熟石灰D .硝酸、石灰石、烧碱21. 符合右图中阴影部分的物质是()A .Na 2CO 3B .Cu 2(OH)2CO 3C .NaClD .NaHCO 322. “神舟七号”,标志我国已具有深太空探测能力。
