第四节离子的开裂规律及开
常见有机化合物的裂解方式和规律

CH2 HC
CH3
CH2
H H m/z=92
CH2CH2CH2CH3 m/z=134
C4H9 m/z=77
HC CH m/z=51
三.醇类
• ①分子离子峰很小,随C链↑而↓, 甚至消失(C>5时),(易脱 水)。
• ②易发生α裂解,31+14n
• ③脱水重排,M-18峰
• ④直链伯醇含羟基碎片(31,45, 59),烷基离子(29,43,57) 及链烯离子 (27,41,55)三种 系统的离子,质谱峰多
• (正离子稳定性顺序R3C+> R2C+H> C+H2> C+H3)
3.烯烃 H3C
CH3 CH C CH2 CH3
CH2 CH3 m/z=55 CH3
% OF BASE PEAK
H3C
100 90 80 70 60 50 40 30 20 10 0
CH C 41
55 27
H3C
CH3
CH3
CH C CH2
一、烃
二、芳烃
第四节
常见有机化合物的 裂解方式和规律
三、醇 四、醛、酮
五、酸和酯类
一、烃的质谱图
1.直链烷烃
43
29 15
57
71 85 99 113 142
m/z
16 15
methane M=16
m/z
43
29 15
57
71 85 99 113 142
正癸烷
m/z
❖分子离子:C1(100%), C10(6%), C16(小), C45(0) ❖有m/z :29,43,57,71,……CnH2n+1 系列峰(σ—断裂) ❖有m/z :27,41,55,69,……CnH2n-1 系列峰
人教版高中化学选修3---第四节-----离子晶体讲解及习题

1.了解离子晶体的结构特点。
2.能根据离子晶体的结构特点解释其物理性质。
3.了解晶格能的定义及应用。
细读教材记主干1.什么是离子键?其成键微粒有哪些?提示:带相反电荷离子之间的相互作用叫作离子键,其成键微粒是阴、阳离子。
2.由离子键构成的化合物叫离子化合物;离子化合物一定含离子键,可能含共价键,含离子键的化合物一定是离子化合物。
3.离子晶体是由阴、阳离子通过离子键结合而成的晶体。
决定离子晶体结构的重要因素有:几何因素(正负离子的半径比),电荷因素(正负离子的电荷比),键性因素(离子键的纯粹程度)。
4.离子晶体硬度较大,难以压缩,具有较高的熔点和沸点,固体不导电,溶于水或在熔融状态下可以导电。
[新知探究]1.概念由阳离子和阴离子通过离子键结合而成的晶体。
(1)构成粒子:阳离子和阴离子。
(2)作用力:离子键。
2.决定晶体结构的因素3.熔、沸点熔、沸点较高,难挥发硬度硬度较大,难以压缩溶解性一般在水中易溶,在非极性溶剂中难溶1.离子晶体中的“不一定”(1)离子晶体中不一定都含有金属元素,如NH4NO3晶体。
(2)离子晶体的熔点不一定低于原子晶体,如MgO的熔点(2 800 ℃)高于SiO2的熔点(1 600 ℃)。
(3)离子晶体中除含离子键外不一定不含其他化学键,如CH3COONH4中除含离子键外,还含有共价键、配位键。
(4)由金属元素和非金属元素组成的晶体不一定是离子晶体,如AlCl3是分子晶体。
(5)含有阳离子的晶体不一定是离子晶体,也可能是金属晶体。
(6)离子晶体中不一定不含分子,如CuSO4·5H2O晶体。
[对点演练]1.(2016·邢台高二检测)CaC 2晶体的晶胞结构与NaCl 晶体的相似(如图所示),但CaC 2晶体中由于哑铃形C 2-2的存在,使晶胞沿一个方向拉长。
下列关于CaC 2晶体的说法中正确的是( )A .1个Ca 2+周围距离最近且等距离的C 2-2数目为6 B .该晶体中的阴离子与F 2是等电子体C .6.4 g CaC 2晶体中含阴离子0.1 molD .与每个Ca 2+距离相等且最近的Ca 2+共有12个解析:选C 依据晶胞示意图可以看出,晶胞的一个平面的长与宽不相等,再由图中体心可知1个Ca 2+周围距离最近的C 2-2有4个,而不是6个,故A 错误;C 2-2含电子数为2×6+2=14,F 2的电子数为18,二者电子数不同,不是等电子体,故B 错误;6.4 g CaC 2为0.1mol ,CaC 2晶体中含阴离子为C 2-2,则含阴离子0.1 mol ,故C 正确;晶胞的一个平面的长与宽不相等,与每个Ca 2+距离相等且最近的Ca 2+应为4个,故D 错误。
离子晶体
6 2
4
这几个Na+在空间
构成的几何构型 为 正八面体 。
3
6
1
2
5
4
每个Cl- 周围 与之最接近且 距离相等的Na+ 共有 6 个。
1每个Na+周围最近且等距的Cl-有 6 个
它们围成的几何空间构型为 正八面体 2每个Cl-周围最近且等距的Na+有 6 个 它们围成的几何空间构型为 正八面体
3每个Na+周围最近且等距的Na+有 12 个 4每个Cl-周围最近且等距的Cl-有 12 个
离子键的强弱在一定程度上可 以用离子晶体的晶格能来衡量。
晶格能:定义是气态离子形成l摩离子晶 体释放的能量,通常取正值。
4、离子晶体的晶格能
仔细阅读课本 P80 表3—8,离子晶体的晶格能与哪些 因素有关?
(1)、影响晶格能大小因素
小结:离子晶体中 阴阳离子半径越小,所带电荷,越多 离子键越强,晶格能越大,简言之:晶格能的大
NaCl:95/181=0.525 CsCl:169/181=0.933
(2)电荷因素
由正负离子的电荷比影响 离子晶体的配位数学.科.网的因素, 称为电荷因素。
CaF2的晶胞
例和:F-C的aF个2的数晶之体比中_1_:,_2_C,a电2+ 荷数之比_2_:_1__,Ca2+配位 数是__8___,F-的配位数是
第四节 离子晶体
一、离子晶体
1、定义: 由阳离子和阴离子通过离子键结合 而成的晶体。
2、构成粒子: 阴、阳离子
3、相互作用力: 离子键
4、常见的离子晶体:强碱、 活泼金属氧化物、 大部分的盐类。
二、晶胞结构特点 1、几种常见的晶体类型
质谱解谱教程 (1)

第四章:质谱法第一节: 概述1.1 发展历史1.1886年,E. Goldstein在低压放电实验中观察到正电荷粒子.2. 1898年,W. Wen发现正电荷粒子束在磁场中发生偏转.3.现代质谱学之父: J. J. Thomson(获1906年诺贝尔物理奖).4.1922年, F.W.Aston[英]因发明了质谱仪等成就获诺贝尔化学奖. 1942年, 第一台商品质谱仪.5.50年代起,有机质谱研究(有机物离子裂解机理, 运用质谱推断有机分子结构)6.各种离子源质谱, 联机技术的研究及其在生物大分子研究中的应用(CI, FD, FAB, ESI-MS等)1.2 特点:1.灵敏度高(几微克甚至更少的样品, 检出极限可达10-14克)2.是唯一可以确定分子式的方法.3.分析速度快(几秒)4.可同色谱联用.第二节: 基本原理2.1基本原理质谱是唯一可以确定分子式的方法。
而分子式对推测结构是至关重要的。
质谱法的灵敏度远远超过其它方法,测试样品的用量在不断降低,而且其分析速度快,还可同具有分离功能的色谱联用。
具有一定压力的气态有机分子,在离子源中通过一定能量(70ev)的电子轰击或离子分子反应等离子化方式,使样品分子失去一个电子产生正离子, 继而还可裂解为一系列的碎片离子,然后根据这些离子的质荷比(m/z e)的不同,用磁场或磁场与电场等电磁方法将这些正离子进行分离和鉴定。
由此可见质谱最简单形式的三项基本功能是:(1)气化挥发度范围很广的化合物;(2)使气态分子变为离子(除了在气化过程中不产生中性分子而直接产生离子的化合物);(3)根据质荷比(m/z e)将它们分开,并进行检测、记录。
由于多电荷离子产生的比例比单电荷离子要小得多,通常取z等于1,e为常数(1个电子的电荷),因而就表征了离子的质量。
这样,质谱就成为了产生并称量离子的装置。
由于各化合物所形成的离子的质量以及各种离子的相对强度都是各化合物所特有的,故可从质谱图形中确定分子量及其结构。
第四节--离子晶体

2,若晶体类型相同,则有:
⑴离子晶体中,结构相似 时,离子半径越小,离子电 荷越高,晶格能越大,离子 键就越强,熔点就越高。
⑵原子晶体中,结构相似时, 原子半径越小,共价键键长越 短,键能越大,熔点越高。
⑶分子晶体中(不含氢键时), 分子组成和结构相似时,相对分 子质量越大,范德华力就越强, 熔点就越高。
(1)NaCl晶体中
每个Na+周围最近且等距离的Cl-有 6个,每 个Cl-周围最近且等距离的Na+有 6 个;在每 个Na+周围最近且等距离的Na+有 1 个,在每 2 Na+和 个Cl-周围最近等距离的Cl-有12 个。 Cl-的配位数分别为 6 、 6 。一个NaCl晶
胞中含 4 个Na+和 4 个Cl-。
(1)每个晶胞含铯离子、 氯离子的个数?
(2)CsCl晶体 每个Cs+周围最近且等距离的 Cl-有 8 个,每个Cl-周围最近且 等距离的Cs+有 8 个,在每个Cs+ 周围最近且等距离的Cs+有 6 个, 在每个Cl-周围最近等距离的Cl6 有 个,一个CsCl晶胞中 含 1 个Cs+和 1 个Cl-。 Cs+ 和Cl-的配位数分别为 8 、 8 。
CaF2晶胞
2+ ①Ca 的配
位数:8 ②F 的配位 4 数:
③一个CaF2晶 胞中含: 4 个 2+ Ca 和 8个F
(3)CaF2晶体
2+ 每个Ca 周围最近且等距离的F
有 8 个,每个F-周围最近且等距 2+ 离的Ca 有 4 个 ; 2+ 在每个Ca 周围最近且等距离的 Ca2+有 12 个,在每个F-周围最近 等距离的F 有 6 个。一个CaF2晶 胞中含 4 个Ca2+和 8 个F-; Ca2+ 和F 的配位数分别为 8 、 4 。
新人教化学选修3第3章第4节离子晶体
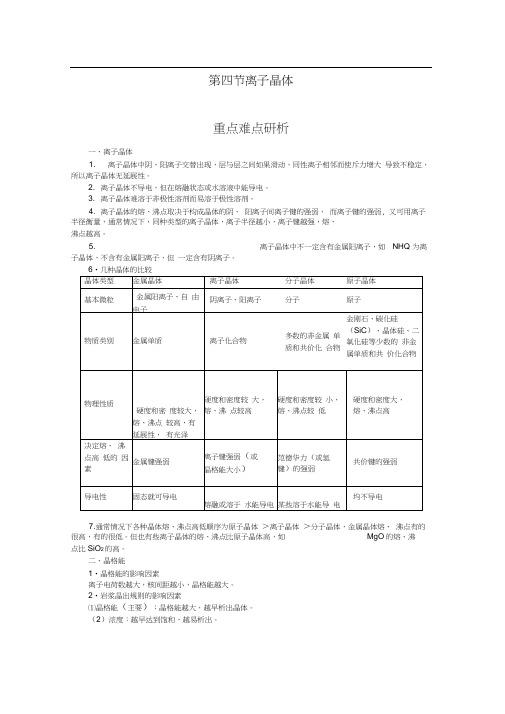
第四节离子晶体重点难点研析一、离子晶体1. 离子晶体中阴、阳离子交替出现,层与层之间如果滑动,同性离子相邻而使斥力增大导致不稳定,所以离子晶体无延展性。
2. 离子晶体不导电,但在熔融状态或水溶液中能导电。
3. 离子晶体难溶于非极性溶剂而易溶于极性溶剂。
4. 离子晶体的熔、沸点取决于构成晶体的阴、阳离子间离子键的强弱,而离子键的强弱, 又可用离子半径衡量,通常情况下,同种类型的离子晶体,离子半径越小,离子键越强,熔、沸点越高。
5. 离子晶体中不一定含有金属阳离子,如NHQ 为离子晶体,不含有金属阳离子,但一定含有阴离子。
6•几种晶体的比较7.通常情况下各种晶体熔、沸点高低顺序为原子晶体>离子晶体>分子晶体,金属晶体熔、沸点有的很高,有的很低。
但也有些离子晶体的熔、沸点比原子晶体高,如MgO的熔、沸点比SiO2的高。
二、晶格能1•晶格能的影响因素离子电荷数越大,核间距越小,晶格能越大。
2•岩浆晶出规则的影响因素⑴晶格能(主要):晶格能越大,越早析出晶体。
(2)浓度:越早达到饱和,越易析出。
典型实例剖析10例1在医院施行外科手术时,常用HgCl 2的稀溶液作为手术刀的消毒剂。
已知HgCl 2有如下性质:①HgCl 2晶体熔点较低;②HgCl 2在熔融状态下不能导电;③ HgCl 2在水溶液中 可发生微弱的电离。
下列关于HgCl 2的叙述正确的是( )A . HgCl 2属于共价化合物B . HgCl 2属于离子化合物C . HgCl 2属于非电解质D . HgCl 2属于强电解质解析 分子晶体一般熔、沸点较低,熔化后不能导电,符合共价化合物的特点,溶于水 后可微弱电离则说明是弱电解质。
答弓 A此类习题主要考查不同类型晶体的物理性质的特点。
正确解答这类习题,要全面比较并 记忆四种类型晶体的物理性质各个方面的异同点。
晅例2 离子晶体熔点的高低决定于阴、阴离子之间的距离、晶格能的大小, 识判断KCl 、NaCl 、CaO 、BaO 四种晶体熔点的高低顺序是 ()A . KCI>NaCI>BaO>CaOB . NaCI>KCI>CaO>BaOC . CaO>BaO>KCl>NaClD . CaO>BaO>NaCl>KCl解析 对于离子晶体来说,离子所带电荷数越多,阴、阳离子核间距离越小,晶格能越 大,离子键越强,熔点越高。
第四节离子反应

C.碳酸钙溶于醋酸中: CaCO3 + 2H+ ===Ca2+ + H2O + CO2↑
D.碳酸氢钙溶液跟稀硝酸反应:
解析:稀氨水是弱碱溶液,应该保留一水合氨的化学式,即 NH3·H2O+H+===NH+4 +H2O,故 A 错;稀硝酸是氧化性酸,能 氧化亚铁离子和硫化氢,自身被还原为一氧化氮,即 FeS+4H+ +NO-3 ===Fe3++S↓+NO↑+2H2O,故 B 错;醋酸是弱酸,应 该 保 留 醋 酸 的 分 子 式 , 即 CaCO3 + 2CH3COOH===Ca2 + + 2CH3COO-+CO2↑+H2O,故 C 错;硝酸是强酸,与碳酸氢钙能 发生复分解反应,HCO-3 +H+===CO2↑+H2O,故 D 正确。
解析:HCl不是氧化性酸,只能将铁屑氧化为Fe2+,故 A错;钠优先与水置换,不能与硫酸铜置换,故B错;HCO 不能改写,故C错;溶解度较大的沉淀可以转化为溶解度较 小的沉淀,故D正确。
答案:D
【例3】 (2013·哈尔滨模拟)下列各项中离子方程式的 书写与反应物的用量无关的是( )
A.FeBr2溶液与Cl2
(5)在电解质、强电解质、弱电解质中,不能根据其溶解 性来判断是电解质或非电解质,是强电解质或弱电解质,如 BaSO4就难溶于水,但它是强电解质,因溶解部分已经完全 电离。
(6)非电解质不导电,不导电的物质不一定是非电解质 (如金刚石、固体KNO3)。
针对训练
1.下列物质溶于水时电离方程式不正确的是( ) A.NaHCO3===Na++H++CO B.NaHSO4===Na++H++SO C.MgCl2===Mg2++2Cl- D.Ba(OH)2===Ba2++2OH- 2.(2013·烟台月考)下列说法不正确的是( ) ①将BaSO4放入水中不能导电,所以BaSO4是非电解质 ②氨溶于水得到的氨水能导电,所以氨水是电解质 ③固态共价化合物不导电,熔融态的共价化合物可以导电
仪器分析-EI源断裂机理-1

主讲教师:杜振霞
EI源离子开裂规律
一般有机化合物的电离能为7-13电子伏特,质谱中常用 的电离电压为70电子伏特,因此分子离子还可以进一步断裂, 使结构裂解,产生各种“碎片”离子,不同结构类型的化合物 分子在质谱中有不同裂解规律,质谱谱图的解析就是通过裂解 生成的碎片,按照裂解规律进行组装,推断分子的结构。
A +.BCD A +. BCD
α NH2CH2CH2OH
α
A+
+
.
BCD
A. + +BCD
.
H2N=CH2 + CH2OH
主要
.
CH2=OH + CH2NH2 次要
EI源离子开裂规律
4.最大烷基优先丢失规律
在多个竞争的反应中,失去的烷基游离基愈大,反应愈有利,因 而对应的产物离子丰度愈大。
O
α
α
CH2 R -e
CH2 R
-R
CH2
CH2
m/z 91
基峰
从热力学角度出发, 在分子离子断裂过程 中,能够生成稳定碎 片离子的过程总是优 先进行,观测到的碎 片离子丰度也高。
EI源离子开裂规律
3. Stevenson规则
奇电子离子裂解过程中,自由基留在电离电位(IP)较高的碎片 上,而正电荷留在IP较低的碎片上。
异裂-双电子转移
+.
R YR'
双箭头表示两个电子都留在 其中一个碎片上
半异裂
R1 S R2
σ
R1 S + R2
EI源离子开裂规律
二、影响离子开裂的因素 1.化学键的相对强度
化学键的相对强度可由键能大小反映出来,键能小的共价键优先断裂, 碳-卤键最易断。
第四节---离子的开裂规律及开
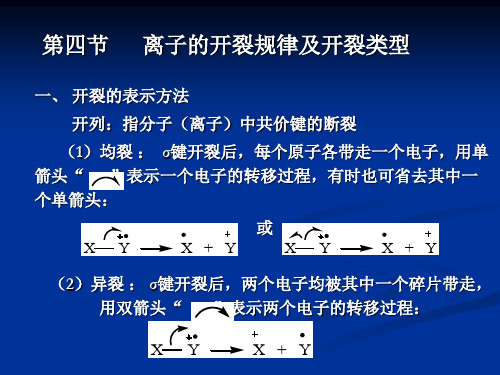
-C3H7
H -C3H6
CH2 CH2
m/z91
m/z134
m/z92
又如丁烯,也容易发生-开裂, 生成的烯丙基正离子的电荷被-键电
子分散, 故该离子的稳定性相对较大,因此 m/z 41的离子峰就成为强峰。
m/z 41
(2)含有杂原子的化合物,也容易生成相对稳定的 碎片离子
三、影响离子开裂的因素
由于不同方式开裂的难易程度不同,造成了碎片 离子峰的相对丰度也有区别。一般把容易进行的开裂 称为优势开裂,由优势开裂生成的碎片离子相对丰度 较大。
1、化学键的相对强度 化学键的相对强度可由键能大小反映出来,键能
小的共价键优先断裂。 ⑴ 单键与双键共存时,键能小的单键优先断裂。 ⑵ 单键键能由弱到强的顺序为:
CH3(CH2)6
+
X
+ CH2
+
NH2
+ CH CH3
2、 i-裂解(诱导裂解):指电负性很大的杂原子可将 双电子转移到杂原子上,正电荷留在烷基上。
+.
R Y R'
i-裂解
R+ + . YR
Y= X,OR,SR,NR2
3、 键断裂:当化合物不含O、N等杂原子、也没有 键时,只能发生 断裂(如Si、P、S等)。
CH2
C
CH2
CH3 CH2
ห้องสมุดไป่ตู้+.
OH
CH3 C CH2 + CH2 CH2 m/e 58
⑵逆Diels-Alder反应(RDA):当分子中存在含
一个π键的六元环时,可发生RDA反应。该重排正好是 Diels-Alder反应的逆反应,故因此而得名。实际是两次 裂解过程。其结果产生一个带正电荷的共轭二烯游离基及 一个烯烃中性分子。
第四节 离子反应(第2课时)一轮复习教学案 含答案

第四节离子反应(第2课时)姓名学号【学习目标】1、熟练掌握常见离子的检验方法.2、小组合作探究应用离子反应进行含量测定、物质制备与纯化等.3、以极度的热情投入课堂,体验学习的快乐。
【预习导学】一、离子的检验:请写出下列离子的检验方法:【小结】离子检验类简答题的答题要点有:________________________________________【练习】对未知的无机盐溶液所含离子作鉴定。
根据下列实验事实做出的判断不一定正确的是( )①加入BaCl2溶液有白色沉淀生成,再加入稀盐酸,沉淀不溶解,则原溶液中含SO42-②向溶液中加硝酸酸化,再加入少许AgNO3溶液,有白色沉淀生成,则原溶液中含Cl-③向溶液中加入盐酸,有无色气体逸出,此气体能使澄清石灰水变浑浊,则溶液中含有CO32④加入NaOH溶液,微热时有气体放出,该气体能使湿润的红色石蕊试纸变蓝,则溶液中有NH4+ A.①②B.①③C.②③D.③④二、含量测定(一)中和滴定1、在定量分析中,用已知浓度的酸或碱测定未知浓度的碱或酸的方法叫做中和滴定,其实质酸碱中和。
若为一元强酸与一元强碱中和,则原理用公式表达为:________________。
2、在中和滴定中,由于石蕊颜色变化范围太宽且不够灵敏,一般不用作酸碱中和滴定的指示剂,酚酞用于酸滴碱时颜色变化由____色刚好变_____色,碱滴酸时颜色由____ 色变______色。
用指示剂判断的滴定终点对应溶液的pH (填“是”或“否”)一定等于7,3、滴定管的使用a、滴定管具有精确刻度,可以准确控制流出液体体积,滴定管有________和________之分。
b、使用前,应先_____________________________,然后洗涤,先用_________洗涤滴定管,再用________润洗2~3次,注入待盛溶液,使液面高于0刻度以上2-3cm处,并使尖嘴部分充满液体,调整液面于______________________________,读数要读至__________。
质 谱(第四节)

第四节 质谱中的主要离子
质谱图
分子离子确定分子量。 碎片离子提供结构信息,即试样分子中 的结构单元及其连接顺序。
(3)无杂原子、无双键时,正电荷
标记在季碳原子上。
(4)不能确定正电荷位置时可如下表示:
10
二、 同位素峰与同位素峰强度
(1)同位素峰 质谱中的分子离子(M+· )和碎片离子(A+)都是由天然丰度最大的轻同位 素组成的。比分子离子(M+· )或碎片离子(A+)峰高1~3质量数处可观察到一 些小峰,它们来自重同位素的贡献,称为同位素峰。 以最简单的含一个碳的甲烷(CH4)为例: 在甲烷的质谱图中可以观察到m/z16的分子 离子峰和 m/z17、m/z18即M+1和M+2由重同 位素贡献的同位素峰,M、M+1、M+2峰构成 同位素簇。同理,碎片离子也存在同位素簇。 (2)同位素峰的强度 由于各种元素同位素的天然丰度不同,它们同位素峰的强度也不相同. 同位素峰的强度不仅与重同位素天然丰度有关,还与分子所含元素的数目 有关。 ①只含C、H、O、N化合物:只含C、H、0、N元素的化合物中,它们的重同位素 的丰度都较小,同位素峰很弱。 37 对只含C、H、O、N化合物同位素峰 的相1
9:6:1 27:27:9:1
1
2 3
1:1
1:2:1 1:3:3:1
14
其它元素的存在及其原子数目
① 氟的存在可以从分子离子失去20,50 u (分别对应失去HF,CF2)而证实 ② 碘的存在可以从 M-127 得到证实 ③ 若存在 m/z 31,45,59 …的离子,说明有醇、醚 形式的氧存在。从分子量与已知元素组成质量的 较大差额也可估计氧原子的存在个数。
质谱-MS.

71
正
H3C CH2 CH2 CH2 CH2 CH3
己
71 57 43 29
15
烷 71 H3C CH2 CH2 CH2 CH2
CH3
57 H3C CH2 CH2 CH2
CH2 CH3
43 H3C CH2 CH2
CH2 CH2 CH3
29 H3C CH2
CH2 CH2 CH2 CH3
15 CH3
CH2 CH2 CH2 CH2 CH3
用高分辨质谱计则可测得小数后3-4位数字,质谱计 分辨率越高,测定越正确,误差越小。
一般高分辨质谱计测定小分子的分子离子质量数的误 差不大于士0.006。能符合这准确数值的可能分子式数目 大为减少,若再配合其它信息,即可从这少数可能化合物 中判断最合理的分子式。
三、质谱表示方法 以质荷比m/z为横座标,以对基
1.条形图(常用) 2. 表格法
峰(最强离子峰,规定相对强度 为100%)相对强度为纵座标所构 成的谱图,称之为质谱图。
丰度:离子的峰高
相对丰度=峰高/最强峰高 ×100%
最强峰为基峰
峰强度与碎片离子的稳定性成正比
正戊烷的电子轰击电离质谱
离子质荷比 (m/z)
15 26 27 28 29 30 39 40
所以化合物c的可能分子式为c13br或cobr由图中的碎片离子可判断其分子式为13br本章总结本章总结本章总结本章总结441质谱法基本原理质谱法基本原理一质谱计及其原理一质谱计及其原理二分辨率二分辨率三质谱表示方法三质谱表示方法442质谱中的离子类型质谱中的离子类型一分子离子及其识别方法一分子离子及其识别方法二同位素离子及分子式的确定二同位素离子及分子式的确定三碎片离子及相应峰三碎片离子及相应峰443质谱中离子断裂类型及断裂规律质谱中离子断裂类型及断裂规律一化学键断裂电子转移方向一化学键断裂电子转移方向二单纯开裂二单纯开裂三麦氏重排三麦氏重排445质谱解析质谱解析一解析步骤一解析步骤二质谱解析实例二质谱解析实例444各类有机化合物的各类有机化合物的msms和开裂规律和开裂规律一烃类一烃类三醚类三醚类五羧酸酯五羧酸酯七有机卤化物七有机卤化物各种图谱解析的主要着眼点uv1共轭体系发色团2从b带精细结构苯环的存在ir判断各种官能团3芳环取代4炔烯类型nmr1积分曲线h个数2化学位移各类质子3从偶合裂分各基团的相互关系4判断活泼h加d2oms1从m
有机质谱断裂规律课件-PPT

b.酮、醚化合物经过α-断裂后得到的偶电子离子(EE + )也进 一步发生i- 断裂。
C6H13
O CH2
C5H11
-
α C5H11
C6H13
O
CH2
i C6H13 + CH2 O
阳离子 中性分子
O
C2H5 C
CH3
α - C2H5
O
C
CH3
i CH3 + CO
阳离子 中性分子
有机质谱断裂规律
(优选)有机质谱断裂规律
沙漠行舟 别有天地
有机质谱图与分子结构的关联
(一)基础知识
1.1 原子中电子的排布 1.2 奇电子离子与偶电子离子 1.3 氮规则 1.4 环加双键值 1.5 同位素峰 1.6 分子离子的识别 1.7 单分子反应
(二) 离子的丰度
2.1 质荷比与离子丰度 2.2 影响碎片离子丰度的基本因素
(CH2)3CH3 α2
CH3 +
HO
CH(CH2)3CH3
OH
m/z 87(M-CH3)
H
CH3 C α3 (CH2)3CH3 α3
CH3(CH2)3
+ CH3 CH
OH
OH
z 45(M-C4H9)
(3)i-断裂—电荷中心诱导的键的断裂 i断裂反应的推动力是由于电荷中心吸引一对电子,造成单
对的离子称为偶电子离子(EE),并标以“+”。 5 α 断裂与 i 断裂的竞争
含一个氯原子时[M]/[M+2]=3/1,含一个溴原子时[M]/[M+2]=1/1,它们的分子离子峰通常能观察到,芳香族卤化物的分子离子峰较强。
② C=Y型(游离基中心定域于不饱和杂原子)
《主题三第四节离子反应和离子方程式》教学设计教学反思-2023-2024学年中职化学高教版加工制造类

《离子反应和离子方程式》教学设计方案(第一课时)一、教学目标1. 知识与技能:理解离子反应的概念,掌握离子方程式的书写方法。
2. 过程与方法:通过实验探究,培养观察、分析和解决问题的能力。
3. 情感态度与价值观:树立化学源于生活又服务于生活的理念,激发学习化学的兴趣。
二、教学重难点1. 教学重点:离子反应及其现象。
2. 教学难点:离子方程式的正确书写。
三、教学准备1. 实验器材:烧杯、试管、玻璃棒、酚酞溶液、氢氧化钠溶液、硫酸钠溶液、氯化钡溶液等。
2. 多媒体课件:离子反应和离子方程式的相关图片和视频。
3. 练习题:用于学生练习离子方程式的书写。
四、教学过程:(一)课前预习1. 了解离子反应的概念和离子反应方程式的含义。
2. 知道离子方程式的书写规则,并尝试书写一些简单的离子方程式。
(二)新课导入1. 通过一些典型的离子反应实例,让学生了解离子反应在实际生活和化工生产中的应用。
2. 介绍离子方程式的意义和作用,让学生明白学习离子方程式的重要性。
(三)新课教学1. 离子反应的实质:通过实验,让学生观察到一些化学反应的现象,并引导学生分析这些反应中离子的变化,从而引出离子反应的实质。
2. 离子方程式的书写规则:通过一些例题的讲解和练习,让学生掌握离子方程式的书写规则和方法。
3. 离子方程式的应用:通过一些实际问题的分析和解决,让学生了解离子方程式在化工生产中的应用。
(四)课堂互动1. 组织学生分组讨论,让学生相互交流和讨论离子方程式的相关问题,加深对知识点的理解和掌握。
2. 鼓励学生提出疑问,对于学生提出的问题,教师进行解答和指导。
(五)课堂小结1. 总结本节课的主要内容,包括离子反应和离子方程式的概念、书写规则和应用等。
2. 强调重点和难点,帮助学生回顾和巩固所学知识。
(六)课后作业1. 布置一些与本节课内容相关的练习题和思考题,让学生进行练习和思考。
2. 要求学生完成一些与离子方程式相关的作业,巩固所学知识。
