青黛中靛玉红提取方法的研究
大青叶中靛玉红的超临界萃取工艺及含量测定医学论文(精)

大青叶中靛玉红的超临界萃取工艺及含量测定医学论文本文由中国论文范文收集整理。
【关键词】大青叶SFE technology of indirubin from Daqingye and content determination of indirubin【Abstract】 AIM: To use HPLC for the content determination of indirubin in supercritical fluid extraction (SFE) material from Daqingye and to optimize the process of SFE. METHODS: Content of indirubin was used as index to evaluate the technologies based on orthogonal design, in which 4 factors considered were extraction temperature and pressure, separation temperature and pressure. A HPLC system was used to determine the content of indirubin. RESULTS: Optimal program was as follows: extraction temperature 50℃ and pressure 40 MPa, separation temperature 40℃ and pressure 8 MPa. The average recovery of indirubin was 102.8% and RSD was 1.48%. CONCLUSION: The extraction temperature, extraction pressure and separation pressure all have significant effects on the extraction rate of indirubin. The HPLC method is simple, precise and suitablefor the content determination of indirubin in SFE material of Daqingye.【Keywords】 Daqingye; SFECO2; indirubin; chromatography, high pressure liquid【摘要】目的:建立用HPLC测定大青叶的超临界萃取物中靛玉红含量的方法,对萃取工艺进行优选. 方法:采用超临界萃取法进行L9(34)正交实验. 以靛玉红含量考察萃取温度、萃取压力、分离温度及分离压力四个因素的影响. 采用HPLC法测定萃取物中靛玉红含量. 结果:最佳萃取工艺为萃取温度50℃,萃取压力40 MPa,分离温度40℃及分离压力8 MPa. 靛玉红平均回收率为102.8%,RSD为1.48%. 结论:萃取温度、萃取压力及分离压力对大青叶中靛玉红的萃取都有显著影响. HPLC法操作简便,结果准确,可作为超临界萃取大青叶中靛玉红的质量控制方法.【关键词】大青叶;CO2超临界萃取;靛玉红;色谱法,高压液相0引言靛玉红主要来源于植物马蓝(Baphicacanthus cusia)、蓼蓝(Polygonum tinctorium)及菘蓝(Isatis indigotica)的中药材如大青叶、板蓝根、青黛等,靛玉红是其主要有效成分. 靛玉红有治疗慢性髓性白血病作用,是一种应用前景广阔的抗肿瘤成分[1].靛玉红在中药材中含量很低,为减少药物使用量,提高生物利用度,我们用超临界流体萃取(SFE)法对大青叶中的靛玉红进行分离提纯,同时建立萃取物中靛玉红含量的HPLC测定方法,优化靛玉红SFE工艺.1材料和方法1.1材料Golden System高效液相色谱仪(美国Beckman公司),配125型高压双泵,168型二极管阵列检测器;色谱柱: Synersi FusionRP柱(4.6 mm×250 mm, 4 μm,美国Phenomenex公司);FY2215006超临界萃取仪(南通市飞宇石油科技开发有限公司);R200D电子分析天平(德国Satorius公司);旋转蒸发仪(EYELA ASPIRATOR A3S RIKAKIKAT CO.LTD). 大青叶购自西安药材市场,按照中国药典(2005年版)有关大青叶项下鉴定本品为合格药材;靛玉红对照品购自中国药品生物制品检定所,批号717200204;甲醇为HPLC级(美国FISHER公司),水为超纯水,其余试剂均为AR级.1.2方法1.2.1SFE正交实验设计采用L9(34)设计,选择萃取温度、萃取压力、分离温度及分离压力四个因素,每个因素取3水平. 分别为萃取温度40, 50及60℃;萃取压力20, 30及40 MPa;分离温度30, 40及50℃;分离压力8, 10及12 MPa.1.2.2供试品溶液的制备打开超临界萃取仪,按1.2.1的设计设置萃取仪温度参数,预热完毕后将精密称取的大青叶50 g放入萃取缸Ⅱ,按1.2.1的设计将压力值调整到需要的参数,同时向副泵系统下的夹带剂缸中加入氯仿100 mL,开动副泵,开始萃取. 每半小时收集一次分离液,至2 h内连续收集不到液体时停止该次实验. 将收集到的分离液在旋转蒸发仪上蒸干,用甲醇定容于10 mL容量瓶中,作为供试品溶液.转贴于中国论文范文关键词:测定,含量,工艺,分离,压力,of,医学论文,大青叶中靛玉红的超临界萃取工艺及含量测定内容摘要:本文由中国论文范文收集整理。
靛玉红的提取分离和药理研究进展
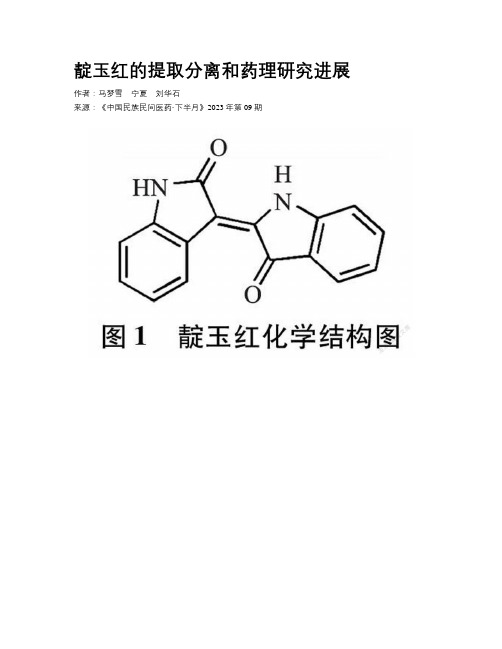
靛玉红的提取分离和药理研究进展作者:马梦雪宁夏刘华石来源:《中国民族民间医药·下半月》2023年第09期【摘要】靛玉红是一种双吲哚类化合物,天然的靛玉红主要存在于青黛、板蓝根、大青叶中。
文章主要围绕靛玉红的提取分离及近几年研究的药理作用这两方面进行综述。
提取分离主要包括超声提取法、回流提取法、水煎煮法、减压提取法、柱色谱等方法;药理作用主要包括抗癌、抗炎、抗病毒以及心脏保护作用,治疗血小板减少等,以期为后续相关研究和产品开发提供参考。
【关键词】靛玉红;提取分离;药理作用【中图分类号】R28【文献标志码】 A【文章编号】1007-8517(2023)18-0064-06DOI:10.3969/j.issn.1007-8517.2023.18.zgmzmjyyzz202318013Progress in Extraction Isolation and Pharmacology of IndirubinMA MengxueNING Xia*LIU HuashiHeilongjiang Academy of Traditional Chinese Medicine, Harbin 150036, ChinaAbstract:Indirubin is a kind of biindole compound. Indirubin mainly exists in indigo, isatidis root and indigo leaf. This paper reviews the preparation methods of Indirubin and its pharmacological effects in recent years.The preparation methods mainly include ultrasonic extraction, reflux extraction, water decocting, decompression extraction, column chromatography and other methods.The pharmacological effects mainly include anti-cancer, anti-inflammatory, antiviral,cardioprotective effects, treatment of thrombocytopenia, etc. Further research should be conducted on its pharmacological effects.Keywords:Indirubin;The Preparation Methods;Pharmacological Effects靛玉红(Indirubin)又名玉红片、炮弹树碱B,在结构上称为2-(2-氧代-1H-吲哚-3-亚基)-1H-吲哚-3-酮,是一种新型双吲哚类化合物,具有一定弱碱性,其分子式为C16H10N2O2,相对分子质量262.2628。
靛玉红提取分离及定量测定的研究

4 6
云 南 中 医 中 药 杂 志
20 年第 2 卷第4 08 9 期
靛 玉红 提 取 分 离 及 定 量 测定 的研 究
谢 芳
( 天津 中医药大学,天津 3 9 ) O 13
摘 要: 目的 : 探讨从青黛 中提 取及分 离纯化靛 玉红的 最 佳方法, 确定靛 玉红的 高效液相 色谱 ( L 定量分析 方法。 HP C)
目活度 Ⅱ级 ( 海 五 四 化学 试 剂 厂 ) 9 乙醇 , 馏 水 , 上 ,5 蒸 超
纯水 。
论: 乙酸 乙酯提取效果好 , 用 干柱氧化铝分 离色带 明显 。用 高
效液相 色谱 法测定青黛 中的靛玉红简便 可行 。
关键词 : 青黛; 靛玉红 ; 高效液相 中图分类号 : 2 4 2 R 8 . 文献标识码 : A
文 章 编 号 :O 7 39 2 0 )4 0 4 - 0 10 —2 4 (0 8 0 - 0 6 2
12 实验材料 .
2 方 法 与 结 果
青黛( 由安舜大药房购买 , 福建省 靛染厂 ) 。
2 1 靛 玉 红 的 提 取 .
2 1 1 盐酸处理 ..
方法 : 称取 5 g青黛 粉 , 入 1 的盐酸 0 加 8
照溶 液。用微量毛 细管 吸取 上述 3 溶 液各 5 L, 种 分别 点于 同一硅胶 G薄层板上 , 以甲醇一浓 氨(0: ) 2 1 为展开剂 , 开 , 展 取出, 晾干 , 喷以碘化铋 钾试 液。供 试 品色谱 中 , 与对 照药 在 材色谱 相应的位置 上显 相 同的橘红 色斑点 , 阴性对 照溶液 而
粉 1 . g 54 。
制 白血病细胞 的 D NA合成 , 机理可能为靛玉红 与人体 内一种 致活酶 C K产生相互作用 , D 阻止癌细胞分裂 。该化合物 具有 临床疗效可靠 , 毒副作用小的特点 , 近年来对该化合物进 行 了
靛玉红的合成

靛玉红的合成姓名:*** 学号:*** 班级:***1. 靛玉红功效简介靛玉红是从中药青黛中分离出来的抗白血病的有效成分,为一双吲哚类抗肿瘤药物。
对多种移植性动物肿瘤有抑制作用,能破坏白血病细胞;在靛玉红的作用下,变性坏死的细胞多呈肿胀、溶解性坏死。
实验研究发现,靛玉红还能增强动物的单核巨噬细胞系统的吞噬能力。
靛玉红对蛋白合成无直接影响,其对DNA 合成的抑制是由于对DNA 聚合酶的抑制,影响DNA 的聚合。
靛玉红主要用于慢性粒细胞白血病,总有效率为87.3%,其降白细胞的作用与马利兰相似,缩小肝脏的疗效较马利兰好,但血像及骨髓象的缓解作用则较马利兰差,与马利兰无交叉耐药性。
可用于异常骨髓增生症及嗜酸性粒细胞增多症。
2. 靛玉红的理化性质及结构靛玉红又称,2-(2-氧代-1H-吲哚-3-亚基)-1H-吲哚-3-酮,暗红色针状结晶。
溶于乙酸乙酯、丙酮、氯仿、乙醚,不溶于水,微溶于乙醇。
其结构如下:NHNHOO3. 靛玉红的合成设计根据靛玉红的结构按α,β-不饱和醛酮进行切断,分成两个单体1和2。
NHNHOON HOO NHO+(2)(1)合成单体1。
合成思路如下:NHOCONH 2COOHONH 2第一步切断按酰胺键切断,第二步考虑C 上的酰基化反应。
反应合成时应考虑以下几个问题:(1)苯环上的氨基为第一类定位基,且活性很强,不易控制一取代,且上对位比上邻位更容易,应考虑占位;(2)氨基活性很强,酰基化时不稳定,要保护起来。
合成步骤如下:NH 2NHCOCH 3NHCOCH 3SO 3HCH COOH浓H SO HOOCCOOHNHCOCH 3SO 3HCOOHONH 2COOHONHOCO3+合成单体2。
合成思路如下:NHON HOHONH 2ClCH 2COOH+合成步骤如下:N HOH ONH 2ClCH 2COOH +1,NaOH 2,HCl1,NaOH2,H O+HC O利用合成的1和2,反应即可得到目标产物靛玉红分子。
多波长HPLC法同时测定青黛药材中靛蓝和靛玉红的含量

Si m ul t a ne o us de t e r mi na t i o n o f i ndi go a nd i n di r ub i n
i n i n d i g o n a t u r a l i s b y HP LC wi t h mu l t i p l e UV wa v e l e n g t h d e t e c t i o n
c o n t e n t s o f i n d i g o a n d i n d i r u b i n i n i n d i g o n a t u r a l i s a n d t o c h a r a c t e r i z e t h e q u a l i t y o f i n d i g o n a t u r a l i s .Me t h o d s :T h e s a mp l e s w e r e
黛药材 中靛 蓝和靛玉红含量。结果 : 在2 0 m i n内青 黛 中靛蓝 和靛 玉红 2种有效 成分 被完 全分 离。靛蓝 在 5 . 1 9~8 3 . 0 4
H I l 范围内线性关 系 良好 ( r =0 . 9 9 9 9 ) , 平均 回收率 为 1 0 0 . 4 6 %, R S D为 2 . 1 8 %; 靛 玉红在 0 . 3 6 4— 5 . 8 2 5 x I g / m l 范围内 线性关 系 良好 ( r : 0 . 9 9 9 9 ) , 平均 回收率为 1 0 1 . 5 7 %, R S D为 2 . 2 2 % 。结 论 : 本 方法 合理 、 便捷 、 快 速 简便 、 准确 、 重复 性 好, 能同时测定青黛 中靛蓝和靛玉红含量 , 符合现行《 中国药典》 简便 、 快速 、 准确 的要求 。 关键词 青 黛药材 , 高效液相色谱法 , 靛蓝 , 靛 玉红 , 质量特征 文献标识 码 : A 文章编号 : 1 0 0 6 . 5 6 8 7 ( 2 0 1 7 ) 0 2 - 0 0 1 4 - 0 5 中图分类号 : R 9 2 7 . 2
生物催化生产抗肿瘤药靛玉红新工艺

生物催化生产抗肿瘤药靛玉红新工艺
靛玉红(indirubin)是中国医学科学家在七十年代中期发现的具有新型结构的抗肿瘤新药,它是传统中成药当归芒荟丸中青黛的抗肿瘤有效成分。
由于该化合物对慢粒白血病具有明显的抑制作用 ,且具有临床疗效可靠,毒副作用小,对骨髓无明显抑制作用等特点。
我公司在多年研究工作的基础上开发出微生物催化法生产靛玉红的新工艺,将是靛玉红生产方式的一次革命性创新,由于其生产方式简化,不受季节限制,转化率高,成本低,组分单一,提取工艺简单,产品纯度高,不久会替代靛玉红从植物提取与合成的传统工艺。
目前,国内靛玉红原料药生产商:北京协和药厂,四川广大制药有限公司,重庆市中药研究院制药厂等。
[药理作用]本品是从发酵液中提取分离出来的抗白血病的有效成分,为一双吲哚类抗肿瘤药物。
本品对多种移植性动物肿瘤有抑制作用,能破坏白血病细胞;在本品的作用下,变性坏死的细胞多呈肿胀、溶解性坏死。
实验研究发现,本品还能增强动物的单核巨噬细胞系统的吞噬能力。
本品对蛋白合成无直接影响,其对
[临床应用]
(1)主要用于慢性粒细胞白血病,总有效率为87.3%,其降白细胞的作用与马利兰相似,缩小肝脏的疗效较马利兰好,但血像及骨髓象的缓解作用则较马利兰差,与马利兰无交叉耐药性。
(2)可用于异常骨髓增生症及嗜酸性粒细胞增多症。
青黛中靛玉红的提取及其抗氧化活性

青黛中靛玉红的提取及其抗氧化活性陈莉华;王晓静;廖薇;肖斌;谭林艳;龙进国【摘要】利用超声波辅助乙酸乙酯提取青黛中靛玉红,考察提取物对羟基自由基的清除作用及对油脂氧化的抑制效果,并与柠檬酸和Vc作比较.用乙酸乙酯为提取剂,料液比为1∶10(g/mL),在40 W超声功率、13 kHz超声频率及250 W加热功率的条件下超声50 min,提取率达到0.12%.提取物对羟基自由基有一定的清除作用,并呈现一定的量效关系,能增加植物油的抗氧化能力,相同条件下对油脂的抗氧化效果强于Vc、柠檬酸.【期刊名称】《吉首大学学报(自然科学版)》【年(卷),期】2013(034)001【总页数】5页(P72-76)【关键词】超声波;乙酸乙酯;青黛;靛玉红;抗氧化活性【作者】陈莉华;王晓静;廖薇;肖斌;谭林艳;龙进国【作者单位】吉首大学化学化工学院,湖南吉首 416000;吉首大学植物资源保护与利用湖南省高校重点实验室,湖南吉首 416000;吉首大学化学化工学院,湖南吉首416000;吉首大学化学化工学院,湖南吉首 416000;吉首大学化学化工学院,湖南吉首 416000;吉首大学化学化工学院,湖南吉首 416000;吉首大学化学化工学院,湖南吉首 416000【正文语种】中文【中图分类】R284.1青黛是一种常用传统中药,为十字花科菘蓝Isatis indigotica For-tune、蓼科蓼蓝Polygonumtinctorium Ait.、爵床科马蓝Bap-hicacanthuscusia Bremek.和豆科假蓝靛Indigoferatinctoria L.的叶或茎叶经加工制得的干燥粉末或团块,收载于《中国药典》2005版一部[1],具有清热解毒、凉血消肿、散结止痛、消斑化瘀之功效,主要用于温毒发斑、血热吐吜、胸痛咳血、口疮、痄腮、喉痹、小儿惊痫等症[2].青黛的主要活性成分是靛蓝(indigo)与靛玉红(indirubin)[3].前人的研究主要集中在青黛中靛玉红的清热凉血、抗菌消炎[4-5]、抑制肿瘤细胞[6-7]等生物活性方面.迄今为止,关于青黛中靛玉红抗氧化作用的研究尚未见报道.笔者利用超声波辅助乙酸乙酯提取青黛中靛玉红,研究提取物对羟基自由基亚的清除作用及对油脂氧化的抑制作用,以期为青黛的进一步开发提供实验依据.1.1 仪器、试剂与材料仪器:723可见分光光度计(日本岛津);KQ250-E型超声波清洗器(郑州长城科工贸有限公司);K-201B-Ⅱ旋转蒸发器(郑州长城科工贸有限公司);SHB-Ⅲ循环水式多用真空泵(郑州长城科工贸有限公司);Gzx-9070MBE数显鼓风干燥箱(上海博迅实业有限公司医疗设备厂);电子天平;恒温槽.试剂:盐酸、石油醚、乙酸乙酯、无水乙醇、95%乙醇、氢氧化钠、硫酸亚铁、过氧化氢、水杨酸、亚硝酸钠、柠檬酸、对氨基苯磺酸、盐酸萘乙二胺、三羟基甲基氨基甲烷、邻苯三酚、氯仿三氯甲烷、冰醋酸、碘化钾、淀粉等,均为分析纯. 材料:植物油(购买于吉首市超市)、青黛(购于吉首市中草药店).1.2 试验方法1.2.1 青黛中靛玉红的提取及分离 (1)青黛超声预处理.准确称取青黛成药10.0 g,置于250 mL的烧杯中,取24%盐酸溶液50 mL,分5次加入并不断搅拌至没有气泡产生,将烧杯封口,置于80℃的超声发生器中超声50 min后取出烧杯静置10 min,减压抽滤,然后用90℃左右热水50 mL,分5次洗涤滤渣并置于80℃的烘箱中干燥后保存.(2)石油醚回流脱脂.将上一步得到的干燥的滤渣用10倍量的石油醚于80℃超声回流50 min,静置10 min冷却至室温,减压抽滤,用10 mL石油醚分2次洗涤滤渣,于80℃烘箱中干燥后保存.(3)乙酸乙酯回流提取.将上一步得到的干燥的滤渣用10倍量的乙酸乙酯在80℃超声回流50 min,静置10 min,冷却至室温,减压抽滤,取20 mL乙酸乙酯分4次洗涤滤渣,弃去滤渣,滤液保存于一棕色试剂瓶中.初提取液用旋转蒸发仪减压浓缩,温度为75℃,浓缩液置于步骤(3)的棕色试剂瓶中,于旋转蒸发仪进一步减压浓缩至蒸干,温度为75℃,蒸干的残渣加入95%乙醇50 mL和1%NaOH 100 mL,搅拌均匀,静置24 h,减压抽滤,滤液于旋转蒸发仪减压回收乙醇,温度为70℃;滤渣于80℃烘箱干燥渣后保存,滤渣即为靛玉红粉末.1.2.2 提取物中靛玉红含量的测定以靛玉红为标准品,用紫外分光光度计在540 nm处测定吸光度,绘制靛玉红浓度-吸光值标准曲线.将提取得到的靛玉红粉末置于烧杯中并放在80℃水浴超声50 min,同时取20mL乙酸乙酯分4次加入其中,溶解时烧杯封口,冷却至室温,转入100 mL的容量瓶中,用乙醇稀释至刻度定容,摇匀,放置1 0 min,用乙醇为试剂空白,用紫外分光光度计在540 nm处测定此溶液的吸光值,由回归方程计算靛玉红含量.1.2.3 靛玉红对羟基自由基的清除参照Fenton反应[8]建立羟基自由基生成模型,在15 mL比色管中依次加入2 mmol/L FeSO4溶液3 mL,2 mmol/LH2O2溶液3 mL,摇匀后,加入6 mmol/L水杨酸溶液3 mL,立即摇匀,于37℃水浴中恒温15 min后取出,然后分别加入浓度为72.65 mg/L的提取液0.5,1.0,1.5,2.0,2.5,3.0,3.5 mL,最后加入蒸馏水补充体积至15 mL.继续在37℃水浴恒温15 min,在波长5 10 nm处以空白液为参比测定其吸光度Ax及本底吸光度Ax0.以蒸馏水代替提取液,按以上方法实验,在37℃下恒温15 min后测其吸光度A0.以同浓度抗坏血酸、柠檬酸做对比,比较3种物质的清除羟基自由基能力.每组测定重复3次,按下式据算羟基自由基的清除率:其中:A0为空白对照液吸光值;Ax为待测样品液吸光度;Ax0为本底吸光度.1.2.4 靛玉红对油脂氧化的抑制作用采用国际上通用的烘箱强化贮存法[9]使之发生氧化酸败变质,并利用碘量法[10]测定过氧化值.通过烘箱强化贮存法使油脂发生氧化,加入靛玉红考察其对油脂氧化作用的抑制:称取20 g油脂,加入2 mL纯化液,搅拌均匀后,放入烘箱中强化保存,间隔1 h交换在烘箱中的位置并取1 mL待测样品,参照标准曲线方法分别测定585 nm 处的吸光度.然后计算油脂过氧化值(POV)及原花青素对油脂的保护率η,以抗坏血酸、柠檬酸做对比,比较3种物质的抗氧化能力.油脂过氧化值(POV)和保护率η的计算公式分别为其中:W表示油脂质量(kg);POV初为未对油脂进行强化氧化时的过氧化值,mmol/kg;POV末1为添加靛玉红的油脂强化氧化后的过氧化值,mmol/kg;POV 末2为未添加靛玉红的油脂强化氧化后的过氧化值,mmol/ kg.2.1 青黛靛玉红含量测定及提取率在实验确定的最佳条件下青黛中靛玉红提取率为0.12%.在540 nm处吸光值与靛玉红的浓度有良好的线性关系,回归方程为A=0.012c+0.008 2,R2=0.998 1.亚硝酸盐测定的回归方程A=0.396 9c+0.040 3,R2=0.996 9,亚硝酸盐在0.0~0.2 mg/L之间有良好的线性关系.碘量M(μmol)与吸光度A在0.0~0.96 μmol间有良好的线性关系,回归方程为M=4.015 3A+0.003 9,R2=0.998 6.2.2 青黛靛玉红对羟基自由基(·OH)的清除2.2.1 靛玉红浓度对羟基自由基(·OH)清除效果的影响按照实验方法,对一系列不同浓度的靛玉红提取液、抗坏血酸溶液及柠檬酸溶液进行实验,考察各自对羟基自由基的清除效果,并进行比较,结果如图1所示.图1结果表明,在浓度2.4~17 mg/L范围内,随着靛玉红提取液质量浓度的增大,靛玉红对羟自由基清除效果逐渐增大,在实验浓度为1 6.95 mg/L时,清除率为15.4%,但清除效果不及抗坏血酸、柠檬酸.总体而言,对羟自由基清除率的排序从大到小为柠檬酸,抗坏血酸,靛玉红提取液;在浓度2.4~17 mg/L范围内三者清除率均与浓度剂量呈正相关.2.2.2 温度对靛玉红清除羟基自由基效果的影响以浓度均为9.68 mg/L的靛玉红提取物、抗坏血酸及柠檬酸,考察不同温度对清除羟基自由基效果的影响,结果如图2所示.图2结果表明,同一浓度不同温度下的清除率有很大的不同.温度较低时,对羟基自由基的清除率较小;随着温度升高,对羟基自由基的清除率逐渐增大,但当温度升高到一定程度后,其清除率有下降的趋势.在37℃时抗坏血酸及柠檬酸的对羟基自由基清除率最大;但靛玉红提取液在42℃时对羟基自由基清除率最大(13.71%).原因可能是靛玉红的耐高温性较强,在较高温度下才发生自身氧化,因此在较高温度下仍可以清除羟基自由基.2.3靛玉红对油脂的抗氧化性研究2.3.1 靛玉红浓度对油脂的抗氧化性效果的影响按照实验方法,40℃条件下,将植物油在烘箱强制保温一定时间,对一系列不同浓度的靛玉红提取液、抗坏血酸溶液及柠檬酸溶液进行实验,考察其对植物油的保护效果,结果如图3所示.图3结果表明,在浓度2.4~17 mg/L范围内,靛玉红对植物油的保护率较柠檬酸、抗坏血酸的大,其对油脂的抗氧化作用十分的明显.随着靛玉红质量浓度的增大,保护率逐渐增大,在实验浓度为1 6.95 mg/L时,清除率为55.77%,由此可得出靛玉红对植物油氧化的抑制效果很好.总体而言,对植物油氧化的抑制作用排序从大到小为青黛靛玉红提取液,抗坏血酸,柠檬酸;在浓度2.4~17 mg/L范围内三者对油脂的保护率均与浓度剂量呈正相关.2.3.2温度对靛玉红抗氧化性效果的影响以浓度均为9.68 mg/L的靛玉红提取物、抗坏血酸及柠檬酸,考察不同温度对植物油的保护效果,结果如图4所示.图4结果表明,同一浓度不同温度靛玉红对植物油的保护率影响很明显.同时表明,温度较低时,靛玉红对植物油的保护率较小;随着温度升高,靛玉红对植物油的保护率迅速增大,但当温度升高到一定程度后,其保护率几乎不变.而对于抗坏血酸及柠檬酸,在42℃时均对植物油保护率最大;随后二者有下降的趋势.原因可能是靛玉红的耐高温性较强,在较高温度下才发生自身氧化,因此在较高温度下仍可以保护植物油.以乙酸乙酯为提取剂,料液比为1∶10(g/mL),40 W的超声功率超声50 min的条件下,青黛中靛玉红提取率为0.12%.靛玉红提取液对·OH有一定的清除作用,且清除效果与其浓度有剂量效应关系,能很好抑制油脂的氧化作用,在浓度2.4~17 mg/L范围内,它对植物油的保护率在15.77%~55.77%,大于Vc及柠檬酸.青黛中的靛玉红具有良好的抗氧化能力,作为一种新的天然、保健的绿色食品抗氧化剂,具有良好的开发前景.【相关文献】[1]中华人民共和国国家药典委员会.中国药典[S].一部.北京:化学工业出版社,2005:138. [2]赫微微,温红珠,李佳,等.靛玉红对溃疡性结肠炎小鼠CD4CD25Treg细胞Foxp3表达的影响[J].上海中医药杂志,2011,12:82-84.[3]谢友良,何百寅,李远彬,等.青黛药材中的靛蓝和靛玉红含量的同时测定[J].中药新药与临床药理,2011,22(4): 452-455.[4]李东,武彦舒,王灿,等.青黛镇痛、抗炎药效学研究[J].中国实验方剂学杂志,2011,17(13):137-140.[5]农志新,兰日程.普济消毒饮合青黛治疗流行性腮腺炎疗效观察[J].广西中医学院学报,2010,13(2):15-17.[6]吴琦玮,葛忠良,高月,等.靛玉红对肿瘤细胞抑制作用的研究及相关机制探讨[J].天津中医药,2008,25(1):55-58.[7]刘雅波,陶文沂.18种青黛7-氮杂靛玉红对6种肿瘤细胞增殖的影响[J].天然产物研究与开发,2010,22:899-906.[8]陈莉华,左林艳,唐玉坚.微波辅助乙醇提取姜辣素及其对油脂的抗氧化性研究[J].食品科学,2011,32(04):69-73.[9]张俊生,陈莉华,张文龙.湘西节节草总黄酮的超声波提取及抗氧化研究[J].食品科学,2011,32(16):71-75.[10]邓斌,王存嫦,徐安武.微波辅助提取花生壳黄酮类化合物及其抗氧化性研究[J].中国油脂,2009,34(3):54-57.。
高效液相色谱法测定青黛中靛玉红的含量

中华 血 液 学 杂 志 ,0 42 ( ) 3 1 2 0 ,5 6 :8 .
-_-_
I
Cj
I -j = -
效 液相 色谱 法测 定 青黛 中 靛玉 红 的含 量
程力惠 , 李晓蒙
( 东药 学院 , 广 广东 广州 50 2 ) 1 2 4
摘要 : 目的 建立测定青黛中靛玉红的含量方法。方法 采用高效液相色谱法, shro . 46m 20in 为色 以 pes bC (. m× 0 l) ir n
谱柱 , 甲醇_. m LL乙酸铵 (5 5 为流动相 , o 1 o/ 6 :3 ) 检测 波长为 2 0B , 8 i 流速 为 1m/ n 柱温 3 ℃。结果 青黛中靛 玉红 n lmi, 5 的含量在 5 9 5 . g m 范围 内线性 良好 ( = .9 ) . 8~ 9 8 , l / r 0 995 。平均回收率 9 .7 ,S . 1 。结论 该方法测定 简便 9 8 % R D 13 % 快速 、 可靠, 可作 为青黛 中靛玉红含 量的质 量控制 。
表 2 马齿 苋 提 取 物 对 细 胞 周 期 和 凋 亡 率 的 影 响 ( ) 妇
东科 技 出版 社 ,9 5 3 . 19 :7
刘春安 , 彭
明. 癌 中药 大辞 典 [ . 汉: 抗 M1 武 湖北 科学技 术出版
社 ,9 4 17 19 :2 .
段小梅. 因家族对细胞 凋亡 的调 控[ ] 中国医学文摘肿 瘤学 , 基 J.
维普资讯
时 珍 国 医 国药 20 0 7年 第 1 第 5期 8卷
L HZ E E IIEA DM T RAM DC E E R H20 O .8N . I IH NM DCN N A E I E IAR S A C 7V L 1 O 5 S 0
青黛实验报告

一、实验模块生物化学实验二、实验标题青黛提取与鉴定三、实验日期2021年X月X日四、实验操作者XXX五、实验目的1. 学习青黛的提取方法。
2. 掌握青黛的鉴定方法。
3. 了解青黛的药理作用。
六、实验原理青黛为天然植物靛蓝和靛玉红的复合物,具有清热解毒、凉血止血、消肿止痛等功效。
本实验通过提取青黛中的有效成分,对其进行鉴定,并了解其药理作用。
七、实验步骤1. 青黛的提取(1)称取一定量的青黛粉末,置于烧杯中。
(2)加入适量的蒸馏水,搅拌均匀。
(3)煮沸10分钟,过滤,收集滤液。
(4)将滤液浓缩至一定体积,加入适量的乙醇,静置过夜。
(5)取上清液,过滤,收集滤液。
2. 青黛的鉴定(1)取少量青黛提取液,加入适量的碘化钾溶液,观察颜色变化。
(2)取少量青黛提取液,加入适量的淀粉溶液,观察颜色变化。
(3)取少量青黛提取液,加入适量的氯化钡溶液,观察颜色变化。
3. 青黛的药理作用实验(1)取一定量的青黛提取液,加入适量的生理盐水,制成药液。
(2)将小鼠随机分为两组,每组10只。
(3)实验组:灌胃给药,剂量为0.5g/kg。
(4)对照组:灌胃给药,剂量为等量的生理盐水。
(5)观察并记录小鼠的体温、活动能力等指标。
八、实验环境实验在生物化学实验室进行,实验场所通风良好,温度适宜。
九、实验过程1. 青黛的提取按照实验步骤1进行,成功提取青黛。
2. 青黛的鉴定按照实验步骤2进行,观察到青黛提取液与碘化钾、淀粉、氯化钡溶液反应后,均呈现蓝色,证明提取的青黛中含有靛蓝和靛玉红。
3. 青黛的药理作用实验按照实验步骤3进行,实验组小鼠体温、活动能力等指标与对照组无明显差异。
十、实验结论1. 成功提取青黛,提取液呈蓝色。
2. 青黛提取液与碘化钾、淀粉、氯化钡溶液反应后,均呈现蓝色,证明提取的青黛中含有靛蓝和靛玉红。
3. 青黛提取液对小鼠体温、活动能力等指标无明显影响。
十一、后记或附录1. 实验数据:实验组:体温:37.2±0.3℃,活动能力:正常。
青黛中靛玉红的提取及其抗氧化活性

1 实 验 部 分
1 . 1仪 器 、 试 剂 与 材 料
仪器 : 7 2 3 可 见分 光光 度计 ( 日本 岛津 ) ; KQ2 5 0一E型超 声 波 清洗 器 ( 郑 州 长 城 科 工 贸有 限 公 司 ) ; K一
2 0 1 B— U旋转 蒸发 器 ( 郑州 长城 科工 贸有 限公 司 ) ; S HB— i l I 循 环 水 式 多用 真 空 泵 ( 郑 州 长 城科 工 贸 有 限 公 司) ; Gz x一 9 0 7 0 MB E数 显鼓 风干 燥箱 ( 上 海博 迅实 业有 限公 司 医疗设 备 厂 ) ; 电子 天平 ; 恒 温槽 .
划项 目; 吉 首 大 学 大 学 生 创 新 基 金 资助 项 目( 2 0 1 1 Z X J J 0 5 )
作者 简 介 : 陈莉华 ( 1 9 6 1 一 ) , 女, 湖南吉首人 , 吉 首 大 学 化 学 化 工 学 院教 授 , 博士 , 主要 从 事 纳 米 粒 子 的 生 物 应 用 研 究 .
第 1 期
陈莉 华 , 等: 青 黛 中靛 玉 红 的 提 取 及 其 抗 氧 化 活 性
1 . 2试 验 方 法
1 . 2 . 1青 黛 中靛 玉红 的提取 及 分离 ( 1 )青 黛 超声 预 处 理. 准确 称 取 青黛 成 药 1 0 . 0 g , 置于 2 5 0 mL的烧 杯中, 取2 4 盐 酸溶 液 5 0 mL, 分 5次 加入并 不 断搅 拌至 没有气 泡 产生 , 将 烧杯 封 口, 置于 8 0℃的超 声 发 生 器 中超 声 5 0 ai r n后 取 出烧杯 静置 1 0 mi n , 减 压抽 滤 , 然 后用 9 0℃左 右热 水 5 O mL, 分 5次洗 涤 滤渣 并
银屑病外用制剂青黛油的制备及有效成分靛玉红含量测定

0 . 1 3 3 、0 . 1 3 6 和0 . 1 3 9 K o 。线 性 范 围 1 . O ~1 0 . 0 g / mL ( r 2 —0 . 9 9 9 4 ) ,平 均 回 收率 为 9 8 . 2 % ,R S D为 1 . 4 。结 论 用 高效 液 相 色 谱 法 测 定 青 黛 油 中 靛 玉 红 含 量 的 方 法 简 便 可 行 ,可 用 于 青 黛 油 的质 量 控 制 。 【 关 键 词 】 银 屑 病 ;青 黛 油 ;靛 玉 红 ; HP L C;含 量 测 定 【 中 图分 类 号 】 R 2 8 5 . 5 【 文献标识码】A 【 文章 编 号】 1 0 0 2 — 2 6 0 0 ( 2 0 1 7 ) 0 3 — 0 0 8 1 0 3
l 1 O 7 1 7 - 2 o o 2 2 o 4 ) 。2 ) 试 剂 : 甲 醇 , N, N一 二 甲基
1 . 2 . 2 . 2 青黛 油 供 试 品溶 液 制备 :分别 精 密 称取
制备 好 的青黛 油 各 5 mI ,置 于 2 5 mL量 瓶 中 ,加 入氯 仿一N,N一 二 甲 基 甲 酰胺 ( 2:1 )约 2 O mL, 震荡 、混 匀 ;分别 置于 超声 波清洗 器 ( 频率 4 5 Hz , 功率 2 5 0 w)中处理 3 0 mi n后放 置室 温环 境 ,待冷 却后 加入 N,N - Z. 甲基 甲酰 胺 试 剂 至 刻度 ,振 荡 、 混匀 后用 0 . 4 5 m 有机 滤膜 滤过 。取续 滤液 于液 相 自动 进样 瓶 中 ,备 用 。 1 . 2 . 2 . 3 靛 玉 红 对 照 品 溶 液 制 备 :精 密 称 取 定 靛
O DS — C 1 8柱 ;流 动 相 : 甲 醇 一1 O N,N一 二 甲基 甲
大青叶中靛玉红的提取分离工艺研究

大青叶中靛玉红的提取分离工艺研究
1 大青叶中靛玉红的提取分离工艺研究
大青叶(Himalayan blue poppy)是一种重要的药用植物,其中包含大量有益的化学成分,其中以靛玉红(Indigotin)最为珍贵。
因此,提取和分离大青叶中的靛玉红成分(Indigotin)是一项研究
重点。
根据技术原理,大青叶中靛玉红的提取与分离工艺可分为三大类:
一、化学工艺:
主要采用氯仿、硫酸、溴、氨水等,对大青叶中的靛玉红进行提取与分离。
具体操作方法为:将大青叶中的靛玉红放入容器,加入以上化学试剂,通过煮沸、搅拌、蒸馏等手段分离靛玉红。
该工艺易于操作,但因化学试剂的残留容易污染环境,并且成本较高。
二、物理工艺:
采用超声破碎、低温分离、稀释分离等技术,对大青叶中的靛玉红进行提取分离。
超声破碎是对原料的颗粒破碎,使其表面积增大,增强提取效率。
低温分离采用蒸馏技术,通过蒸汽热能,使溶于油的靛玉红溶解,并将油滴逐步分离出来。
稀释分离则是采用逆渗性膜稀释分离技术,将大青叶中的靛玉红以乳化液的形式提取出来,并分离出乳液中的有效成分。
三、抽提工艺:
采用抽提工艺,利用溶剂(如乙醇)对大青叶中的靛玉红进行抽提,通过连续抽提法,或分别抽提法,最后在蒸发器中将其蒸发即可。
将溶剂从抽提出的靛玉红中蒸发掉,得到纯的靛玉红。
总的来说,大青叶中靛玉红的提取分离工艺,可根据不同的需要,采用化学工艺、物理工艺和抽提工艺,而它们的共同特点是安全、高效、可控。
大青叶中靛玉红的提取分离工艺研究

大青叶中靛玉红的提取分离工艺研究一、引言大青叶是一种常见的中药材,具有清热解毒、消肿止痛等功效。
其中,靛玉红是一种具有药用价值的成分,具有抗炎、抗氧化等生物活性。
因此,对大青叶中靛玉红的提取分离工艺进行研究,有助于深入挖掘大青叶的药用价值,为其开发利用提供科学依据。
二、提取工艺研究1. 溶剂选择靛玉红是一种水溶性成分,因此水是一种常用的提取溶剂。
此外,还可以选择乙醇、丙酮等有机溶剂进行提取。
通过比较不同溶剂的提取效果,最终选择适合的溶剂。
2. 提取条件提取条件包括提取时间、提取温度、提取液比等因素。
在实验中,可以通过单因素试验和正交试验等方法,确定最佳的提取条件。
3. 提取效果评价提取效果评价主要包括靛玉红的含量和提取率。
其中,含量可以通过紫外分光光度法、高效液相色谱法等方法进行测定;提取率则是通过计算提取物中靛玉红的质量与原料中靛玉红的质量之比得出。
三、分离工艺研究1. 色谱分离色谱分离是一种常用的分离方法,可以通过选择不同的色谱柱和流动相,实现对靛玉红的分离。
常用的色谱柱包括反相色谱柱、离子交换柱等。
2. 薄层色谱分离薄层色谱分离是一种简单易行的分离方法,可以通过选择不同的薄层板和展开剂,实现对靛玉红的分离。
常用的薄层板包括硅胶薄层板、纤维素薄层板等。
3. 液液萃取分离液液萃取分离是一种基于溶剂选择性的分离方法,可以通过选择适当的萃取剂和萃取条件,实现对靛玉红的分离。
常用的萃取剂包括乙酸乙酯、正丁醇等。
四、总结大青叶中靛玉红的提取分离工艺研究是一项复杂的工作,需要综合考虑多种因素。
通过选择合适的提取溶剂、提取条件和分离方法,可以实现对靛玉红的高效提取和纯化,为其进一步的开发利用提供保障。
大青叶中靛玉红提取方法的研究

大青叶中靛玉红提取方法的研究
蒋小文;吴启南;沈金辉
【期刊名称】《时珍国医国药》
【年(卷),期】2006(17)4
【摘要】目的优选大青叶中靛玉红的提取方法。
方法以靛玉红含量为指标,采用单因素考察法考察生药粒径、提取时间对索氏提取结果的影响,另采用正交实验,考察生药粒径、提取剂用量、提取时间、提取次数等4个因素对超声结果的影响。
结果超声法优于传统索氏提取法,最佳超声提取条件为过40目的生药加入60倍量甲醇超声提取3次,每次提取30 m in。
结论超声提取法提取靛玉红提取效率高、操作简便、省时,有独特的优越性。
【总页数】2页(P583-584)
【关键词】大青叶;靛玉红;超声提取;索氏提取;正交实验
【作者】蒋小文;吴启南;沈金辉
【作者单位】南京中医药大学
【正文语种】中文
【中图分类】R284.2
【相关文献】
1.大青叶中靛玉红的提取分离工艺研究 [J], 谢国祥;张立国;邱明丰;贾伟
2.复方大青叶合剂中的靛玉红、绿原酸含量测定方法的研究 [J], 韩梅海;成爱华
3.复方大青叶针剂中的靛玉红、氯原酸含量测定方法的研究 [J], 朱守友;韦友国;姜
开京
4.大青叶中靛玉红提取工艺的研究 [J], 和翀翼;刘文;吴晨晨;王爽;武瑞
因版权原因,仅展示原文概要,查看原文内容请购买。
青黛脂溶性提取物固体分散体制备及溶解性研究

【摘要】目的考察共研磨技术对难溶性药物的增溶能力。
方法分别利用共研磨技术和共沉淀法制备青黛脂溶性提取物的固体分散体,并以靛玉红为指标,采用hplc测定其表观溶解度。
结果共研磨技术和共沉淀法有效提高了靛玉红的表观溶解度,不同载体研究表明共研物中亲水载体的羟基对改善难溶性药物的溶解度有着重要的影响。
结论共研磨技术能有效地提高难溶药物的溶解度。
【关键词】共研磨技术超细粉碎难溶性药物靛玉红共研磨技术(cogrinding method)是近年来发展起来的、将超细粉碎技术与包合技术或固体分散技术结合起来的一种新技术[1]。
它既可以避免传统固体分散技术中的溶剂或温度对药物稳定性的影响[2],又可以避免超细粉碎技术中因粒子团聚而引起的药物溶出下降[3]。
它通过降低药物的结晶性,改善可湿性以及增加表面积等促进药物的溶出,是改善药物溶解度和溶出速率的有效途径[4]。
青黛(natural indigo)是一种良好的传统中药材,具有清热解毒、凉血定惊作用。
用于瘟病、发斑、胸痛咳血、口疮、喉痹、小儿惊痫[5]。
其脂溶性提取物成分(lipophilic extract from indigo lei)含有靛玉红、色胺酮等化合物,在抗肿瘤、抑菌、抗炎和抑制细菌内毒素等方面起重要作用[6,7]。
但是这些成分在水中的溶解度较小,难以吸收,生物利用度差[8]。
其中靛玉红(iindirubin)是青黛中的主要成分,不溶于水,通常用作评价青黛制剂质量的指标性成分。
本实验分别用固体分散技术和共研磨技术,制备青黛固体制剂,并选用靛玉红为质控指标,以hplc法初步研究该固体分散体的溶解特性。
1 材料与仪器lc-1500高效液相色谱仪(日本jλsco公司);行星式磨机(美国fritsch公司);旋转蒸发仪(日本būchi公司);恒温真空干燥箱(上海一恒科学仪器设备厂)。
青黛(镇江存仁堂药业,批号020801);靛玉红标准品(中国药品生物制品检定所,批号717-200204);聚维酮(pvp,规格k30,上海国药集团化学试剂有限公司);聚乙二醇(peg,规格4000,上海国药集团化学试剂有限公司);羟丙甲纤维素(hpmc,规格e6-lv,型号2910,黏度6cp ;规格e-4m,型号2910 ,黏度4000cp上海卡乐康公司赠送);乙醇(色谱纯江苏汉邦科技);聚乙烯醇(pva,规格17-88,美国cook公司);所有试剂均采用分析纯。
RP-HPLC法测定青黛中靛玉红的含量

RP-HPLC法测定青黛中靛玉红的含量
林夕霆
【期刊名称】《海峡药学》
【年(卷),期】2004(16)6
【摘要】目的建立测定青黛中靛玉红的含量方法.方法采用反相液相色谱法,以Hgperil ODS C18柱(46mm×250mm;5mm)为色谱柱,0.1%磷酸-甲醇(30:70);为流动相,检测波长为292nm,流速0.6ml·min-1,柱温为30℃.结果青黛中靛玉红的含量在9.65μg~96.5μg·mL-1范围内线性良好(r=0.9995).平均回收率100.3%,RSD 1.3%.结论本方法测定简便快速、可靠,可作为青黛中靛玉红含量的质量控制.
【总页数】2页(P64-65)
【作者】林夕霆
【作者单位】莆田市湄洲湾北岸医药公司,湄洲湾,351146
【正文语种】中文
【中图分类】R927.2
【相关文献】
1.HPLC法测定青黛中靛玉红的含量 [J], 戴平;韦汉燕;桂劲松;谢恒
2.一阶导数光谱法测定青黛中靛蓝和靛玉红含量的研究 [J], 朱品业;罗晓华
3.HPLC法测定青黛中靛玉红的含量 [J], 邹爱东;张群;赵晓春;潘卫三
4.高效液相色谱法测定复方青黛丸中靛玉红含量 [J], 高文平;李拜;袁云刚
5.高效液相色谱法测定青黛中靛玉红的含量 [J], 程力惠;李晓蒙
因版权原因,仅展示原文概要,查看原文内容请购买。
靛玉红的合成

靛玉红的合成姓名:*** 学号:*** 班级:***1. 靛玉红功效简介靛玉红是从中药青黛中分离出来的抗白血病的有效成分,为一双吲哚类抗肿瘤药物。
对多种移植性动物肿瘤有抑制作用,能破坏白血病细胞;在靛玉红的作用下,变性坏死的细胞多呈肿胀、溶解性坏死。
实验研究发现,靛玉红还能增强动物的单核巨噬细胞系统的吞噬能力。
靛玉红对蛋白合成无直接影响,其对DNA 合成的抑制是由于对DNA 聚合酶的抑制,影响DNA 的聚合。
靛玉红主要用于慢性粒细胞白血病,总有效率为87.3%,其降白细胞的作用与马利兰相似,缩小肝脏的疗效较马利兰好,但血像及骨髓象的缓解作用则较马利兰差,与马利兰无交叉耐药性。
可用于异常骨髓增生症及嗜酸性粒细胞增多症。
2. 靛玉红的理化性质及结构靛玉红又称,2-(2-氧代-1H-吲哚-3-亚基)-1H-吲哚-3-酮,暗红色针状结晶。
溶于乙酸乙酯、丙酮、氯仿、乙醚,不溶于水,微溶于乙醇。
其结构如下:NHNHOO3. 靛玉红的合成设计根据靛玉红的结构按α,β-不饱和醛酮进行切断,分成两个单体1和2。
NHNHOON HOO NHO+(2)(1)合成单体1。
合成思路如下:NHOCONH 2COOHONH 2第一步切断按酰胺键切断,第二步考虑C 上的酰基化反应。
反应合成时应考虑以下几个问题:(1)苯环上的氨基为第一类定位基,且活性很强,不易控制一取代,且上对位比上邻位更容易,应考虑占位;(2)氨基活性很强,酰基化时不稳定,要保护起来。
合成步骤如下:NH 2NHCOCH 3NHCOCH 3SO 3HCH COOH浓H SO HOOCCOOHNHCOCH 3SO 3HCOOHONH 2COOHONHOCO3+合成单体2。
合成思路如下:NHON HOHONH 2ClCH 2COOH+合成步骤如下:N HOH ONH 2ClCH 2COOH +1,NaOH 2,HCl1,NaOH2,H O+HC O利用合成的1和2,反应即可得到目标产物靛玉红分子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
= = I,.’-/ $+5*1+6’C ’C C542 /1 64+F /F !"#$%" %&’%()$%* ,#-.%+#+#&$./" +/"%#, !&’%()012#" $%&+$)2%# +,. 3)* +#, 45()&/6 $%&+$)2%/6,D)’3) ’C G1/34CC4. 5/ ?4 .1H ?6*4 G/D.41 /1 ?/6*CJ I,.’-/ $+5*1+6’C ’C + T’,. /F !)’,4C4 24.’3’,4 3/22/,6H *C4.J I,.’1*?’, D+C .’C3/A414. 5/ ?4 5)4 +,5’3+,341 4FF435’A4 3/2G/,4,5 ’, 1434,5 H4+1C, D)’3) ’,)’?’54. CH,5)4C’7’,- 5)4 W$L /F 64*T42’+5’/, G1/34CC /F ’,.’1*?’, F1/2 I,.’-/
$+5*1+6’C D+C .’C3*CC4. ’, 5)’C +15’364 ,’, D)’3) 5)4 ’,( .’1*?’, /F 5)4 )’-)41 G*1’5H D+C +55+’,4. ?H 5)4 C’2G64 4EG41’24,5+6 245)/.J ! = :BB.-.%&9 .*’ -#.6#*% !" ! = LGG+1+5*C= M)’2+.7* "0&! ,&!(9:LBX0 C/( 6*5’/, 51+,CF41 G*2G, M0W(9:LX0 YX(X’C .45435/1, M&!(9:LX0 3/,51/6641, !B>(9:LMX0 542G41+5*14 3/,51/6641,&3M/6*5’/, D/1TC5+5’/,J !" # = N4+-4,5 = I,.’-/ $+5*1+6’C ( Z’+,H/* ’, F*@’+, G1/A’,34 ) ,’,.’1*?’, 14F414,34 C*?C5+,34( C5+,.+1.’7+( 5’/, .4G+1524,5 /F 24.’3’,4 +,. ?’/6/-’3+6 G1/.*35 ’, !)’,+ , S9S(;::;:< ,F/1 [*+,5’5+5’A4 +CC+H) ,245)+,/6
青黛中靛玉红提取方法的研究
程力惠 ( 广东药学院, 广东广州 89:;;< )
= = 摘要= 目的: 探讨从青黛提取较高纯度靛玉红单体的方法。方法: 用乙酸乙酯从青黛中提取靛玉红, 然后比较 提取液在硅胶柱 和 氧 化 铝 柱 的 行 为。结 果: 选 用 硅 胶 柱 分 离 青 黛 中 的 靛 玉 红, 经 "0&! 测 定, 靛玉红纯度达 OPJ QR 。结论: 利用较简单的实验路线, 从青黛中得到较高纯度的靛玉红单体。 关键词= 青黛; 靛玉红; "0&!
〔 9〕
( 3)1/2+5/-1+G)’3 G*14 ) ,+22/,’*2 +345+54,3)6/1/( ( +,+6H5’3+6 1+54 ) ,+34( F/12,G451/64*2 45)41,+345/,4 5’3 45)41( 3)42’3+6 1+54) J # = 1#%")’ .*’ -#9&8% #" ! = #E51+35’,- ’,.’1*?’, = Q:- /F I,.’-/ $+5*1+6’C D414 ’2241C4. ’, +345’3 45)41 +5 1//2 542G41+5*14 F/1 C’E 5’24CJ B)4 4E51+35 D+C G*5 5/-45)41 +,. 3/,.4,C4. 5/ ?4 Q:26J #" # = !/2G+14 C4G+1+5’,- 5)4 ’,.’1*?’, F1/2 I,.’-/ $+5*1+6’C ?H +6*2’,’*2 3)1/2+5/-1+G)’3 3/6*2, D’5) 5)+5 ?H M’6’3/, -46 3)1/2+5/-1+G)’3 3/6*2,J #" #" ! = M4G+1+5’,- 5)4 ’,.’1*?’, F1/2 I,.’-/ $+5*1+6’C ?H +6*2’,’*2 3)1/2+5/-1+G)’3 3/6*2,: B)4 3/6*2, ( 5)4 3/6*2, ’C ;:32 6/,-,’5C .’+24541 ’C Q32 )D+C G+3T4. D’5) Q:26 /F +345’3 45)41 4E51+35 F1/2 I,.’-/ $+5*1+6’C 2’E4. D’5) C*FF’3’4,5 [*+,5’5’4C /F +6*2’,’*2J B)4 3/6*2, D+C 46*54. ?H G451/64*2 45)41: +345/,4 ( ;:\ 9 ) J #+3) 3/6/*1 ?+,. /F 3/6*2, D+C ,/5 +GG+14,5 D)4, ?4’,- 46*54.J B)4 C4G+1+5’/, 4FF435 +2/,- 5)4 3/6/*1 ?+,. D+C ,/5 -//.J
L*5)/1 14*24:!"#$%, &’()*’,F42+64,G/C5-1+.*+54 4.*3+5’/,+6 ?+3T-1/*,.,’C 4,-+-4. ’, C5*.H +,. .4A46/G24,5 /F ,+5*1+66H /33*11’,- .1*-CJ 万方数据 3/22*,’3+5’/, 2/.4: 9Q99O8Q8S:: ( B46) , 9)3P;;U 9VQJ 3/2 ( #(2+’6) 。
= = :49%-./%= >?@435’A4:B/ .’C3*CC )/D 5/ 4E51+35 5)4 ’,.’1*?’, /F 5)4 )’-)41 G*1’5H F1/2 I,.’-/ $+5*1+6’CJ K45)/.C:LF( 541 4E51+35’,- 5)4 ’,.’1*?’, F1/2 I,.’-/ $+5*1+6’C ?H +345’3 45)41,3/2G+14 5)4 C4G+1+5’/, 4FF435 /F 5)4 4E51+35 ’, M’ -46 3/6( *2, D’5) 5)+5 ’, +6*2’,+ 3/6*2,J N4C*65C:B)4 ’,.’1*?’, ’, I,.’-/ $+5*1+6’C ?H M’ -46 3/6*2, 3)1/2+5/-1+G)H ’C 3)/C4,J B)4 G*1’5H /F ’,.’1*?’, ’C OPJ QR +F541 M’ -46 3/6*2, 3)1/2+5/-1+G)HJ !/,36*C’/,:B)4 ’,.’1*?’, /F 5)4 )’-)41 G*1’5H D+C +55+’,4. ?H 5)4 C’2G64 4EG41’24,5+6 245)/.J ;#( <)-’9= I,.’-/ $+5*1+6’C;I,.’1*?’,;"0&! =>?@ @?@ 7&54#-:NOQ9J S9= A)/&5#*% 3A:L= :-/%0/8# *&54#-; 9::9(<<8< ( ;::S ) :9(::8:(:Q
]0-&)%4 0/ D+()#5# U#,(7()%4 U%’#&(%45! ! 第 ;: 卷第 B 期 9::Q 年 B 月
・ GB・
!" !" ! ! "#$%&%’()* ’+# (),(&-.() /&01 2),(*0 3%’-&%4(5 .6 "(4(70) *#4 7+&01%’0*&%$+(7 704-1) : 8+# 704-1) ( ’+# 704-1) (5 9:71 40)*,(’5 ,(%1#’#& (5 ;71 )<%5 $%7=#, <(’+ ;:14 0/ %7#’(7 #’+#& #>’&%7’ /&01 2),(*0 3%’-&%4(5 1(>#, <(’+ 5-//(7(#)’ ?-%)’(’(#5 0/ "(4(70) *#4@ 8+# 704-1) <%5 #4-’#, .6 $#’&04#-1 #’+#&: %7#’0)# ( 9: A B ) @ C%7+ 7040-& .%), 0/ 704-1) <%5 %$$%&#)’ <+#) .#()* #4-’#,@ 8+# 5#$%&%’(0) #//#7’ %10)* ’+# 7040-& .%), <%5 .#’’#&@ D01$%&()* ’+# 5#$%&%’(0) 0/ %7#’(7 #’+#& #>’&%7’ .6 "(4(70) *#4 7+&01%’0*&%$+(7 704-1) <(’+ %4-1()(-1 0)# ,5(4(70) *#4 7+&01%’0*&%$+(7 704-1) (5 7+05#)@ !" !" # ! "#$%&%’()* %), $-&(/6()* ’+# (),(&-.() /&01 2),(*0 3%’-&%4(5 .6 5(4(70) *#4 7+&01%’0*&%$+(7 704E -1) :8+# 704-1)( ’+# 704-1) (5 9:71 40)*,(’5 ,(%1E #’#& (5 ;71)<%5 ,&(46 $%7=#, <(’+ ;:14 0/ ’+# #>’&%7’ 0/ %7#’(7 #’+#& /&01 2),(*0 3%’-&%4(5 1(>#, <(’+ 5-//(E 7(#)’ ?-%)’(’(#5 0/ 5(4(70) *#4( ;:: 1#5+) @ 8+# 704-1) <%5 #4-’#, <(’+ $#’&04#-1 #’+#&:%7#’0)# ( 9: A B ) ’(44 ’+# $-&$4# .%), <%5 701()* 0-’@ 8+#) ’+# #4-’(0) <%5 7+%)*#, ’0 .# $#’&04#-1 #’+#&:%7#’0)#( B: A B )%), ’+# $-&$4# .%), <%5 7044#7’#,@ 8+# $-&$4# 7044#7’#, 504-’(0) %), (),(&-.() &#/#&E #)7# 5-.5’%)7# <#&# %$$4(#, 5#$%&%’#46 0) ’+# "(E*#4 $4%’#@ 8+# ,#F#40$()* &#%*#)’ (5 $#’&04#-1 #’+#& :%7#E ’0)#( GA B ) @ H0’+ ’+# $-&$4# 7044#7’#, 504-’(0) %), ’+# (),(&-.() &#/#&#)7# 5-.5’%)7# <(44 ,#F#40$ ’+# $-&$4# 5$0’5 <+(7+ +%F# ’+# 5%1# I / F%4-#@ J-&$4# 504-’(0) %&# 7044#7’#, () 51%44 70)# /4%5= , 5’%),()* /0& 0F#&)(*+’ -)’(4 ’+# $-&$4# /()# )##,4# 7&65E ’%45 <#&# %$$$#%&#,@ !" # ! K55%6 0/ (),(&-.() !" #" $ ! 8+# $&#$%&%’(0) 0/ ’#5’ 504-’(0) : <#(*+ L@ L91* 0/ (),(&-.() 5%1$4# $(5#46@ M(5504F# (’ () 7+40&0/0&1 %), 1#’#&#, F04-1# ’0 G:14 F04-1#’&(7 /4%5=@ 8+# ’#5’ 504-’(0) <#&# 70)/#7’#, ’0 .# N@ NL !* O 14@ !" #" ! ! 8+# $&#$%&%’(0) 0/ &#/#&#)7# 5-.5’%)7# : <#(*+ G@ PQ1* 0/ (),(&-.() 5%1$4# $(5#46@ 8+# &#/E #&#)7# 5-.5’%)7# 504-’(0) <#&# 70)/#7’#, ’0 .# BB@ PL !* O 14 %770&,()* ’0 %.0F# 1#’+0,@ !" #" # ! D0),(’(0) 0/ ’+# 7+&01%’0*&%$+(7 704-1) : 7+&01%’0*&%$+(7 704-1) (5 DBN ( L@ R11 S 9::11 ) , 10.(4# $+%5# (5 1#’+%)04E:@ B104 O T 0/ %110)(-1 %7#E ’%’#,/40<万方数据 &%’# (5 B14 O 1(),,#’#7’(0) <%F# (5 9N:)1,
