第一课时-物质的量、摩尔质量、阿伏加德罗常数
化学必修1物质的量(最新课件ppt)

N = n ×2 × NA = 0.5 mol×2× 6.02 ×1023mol-1 = 6.02 × 1023
答:O2的氧原子数为 6.02 × 1023个。
牛刀小试
1.判断下列说法是否正确 。
1mol小麦约含有6.02×1023个麦粒 。(×)
=3.01×1023
二、求0.3 mol H2O的质量?其中所含O 原子个数?
解: m(H2O)= n(H2O)× M(H2O) = 0.3mol × 18g·mol-1 = 5.4g
N(O) = n(O)× NA = 0.3mol× 6.02 ×1023mol-1 = 1.806 ×1023
第一课时: 物质的量的单位——摩尔
第一章 第二节化学计量在实验中的应用
1. 能理解物质的量的定义。 2.认识阿伏加德罗常数。 3.掌握物质的量、微粒数、摩尔质量之间的
换算。
学习重难点
物质的量、微粒数、摩尔质量的理解与换算
通过科学实验测得,一个碳原子12C的质量 是1.9927×10-26kg。
一、物质的量
有多少个C原子数呢?
问题探讨1
已知一个C12的质量为1.992710-23g,试计 算12gC12中含有的C原子数是多少?
12 g
N=
≈ 6.021023
1.992710-23 g
阿伏伽德罗常数,
符号NA,单位mol-1
即:1mol=12gC12 ≈ 6.021023 个粒子数。
所以,把1mol任何粒子的集合体都含 有约6.02×1023 个粒子。
0.5molH2 含有3.01×1023 个氢原子。( × )
高一化学一物质的量、阿伏伽德罗常数辅导讲义

高一化学一物质的量、阿伏伽德罗常数辅导讲义授课主题化学计量在实验中的应用教学目的1、认识摩尔是物质的量的差不多单位,了解物质的量与微观粒子之间的关系,了解摩尔质量的概念,明白得阿伏加德罗常数的涵义。
2、了解物质的量、摩尔质量、物质的质量之间的关系,能用于进行简单的化学运算。
教学重难点物质的量及单位;摩尔质量的概念和有关摩尔质量的运算教学内容一、本节知识点讲解知识点一物质的量1.物质的量的概念表示含有一定数目粒子的集合体,符号为n,物质的量是一个整体,不能说成“物质量”或“物质的质量”。
2.物质的量的单位——摩尔①物质的量作为一个物理量,同其他物理量一样,也有其单位。
物质的量的单位是摩尔,简称摩,符号是mol。
②“摩尔”的标准:假如在一定量的粒子集合体中所含的粒子数与0.012 kg 12C中所含的碳原子数相同,该粒子的物质的量确实是1 mol。
③1 mol 任何粒子所含有的粒子数都相等。
科学实验说明,在0.012 kg 12C中所含有的碳原子数约为6.02×1023。
因此,我们常常表述为1 mol O 中约含有6.02×1023个O;1 mol H2O中约含有6.02×1023个H2O;1 mol NO3-中约含有6.02×1023个NO3-等。
即1 mol 粒子集体都约含6.02×1023个粒子。
⑴使用物质的量时,表述要确切,指代须明确。
一样用数量+单位+粒子(一样用适当的符号或化学式)来表示具体微粒的物质的量。
如1 mol H表示1mol 氢原子,1 mol H2表示1 mol 氢分子(或氢气),1 mol H+ 表示1 mol 氢离子,然而假如说“1 mol 氢”则错误。
⑵摩尔作为物质的量的单位,能够计量所有的微观粒子(包括原子、分子、离子、质子、中子、电子、原子团等),但不能表示宏观物质,例如,不能说“1 mol 小米”、“1 mol 乒乓球”等。
物质的量及其阿伏伽德罗常数
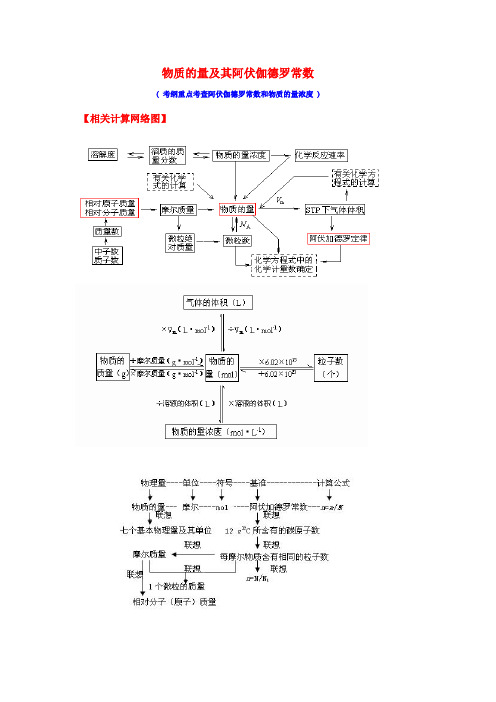
物质的量及其阿伏伽德罗常数( 考纲重点考查阿伏伽德罗常数和物质的量浓度 )【相关计算网络图】【知识点梳理】一、物质的量:1﹑物质的量(n):表示物质含指定粒子多少的物理量注:专有名词,表示微观粒子单位:摩尔(mol),简称为摩规定0.012kg12C中所含碳原子数为1mol阿伏加德罗常数N A =6.02×1023mol-1计算公式:n=N/ N A2﹑摩尔质量(M):单位物质的量的物质所具有的质量单位:g/mol 或 g﹒mol-1计算公式:M=m/n二、阿伏伽德罗常数(一)阿伏加德罗定律(1)在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子(2)注意:①使用范围:气体;②使用条件:同温、同压、同体积;③特例:气体摩尔体积(3)推论:用n表示物质的量,V表示体积,P表示压强,M表示摩尔质量(式量),ρ表示密度。
(注意语言表达)①同温同压:V1/V2 = n1/n2 = N1/N2②同温同体积:P1/P2 = n1/n2 = N1/N2③同温同压:ρ1/ρ2 = M1/M2④同温同压同质量:V1/V2 = M1/M2⑤同温同压同体积:m1/m2 = M1/M2(二)阿伏伽德罗常数的考查方式1,考查物质的状态考查气体摩尔体积时,常用在标准状况下非气态的物质来迷惑考生,如H2O、SO3、CCl4、苯、辛烷等,要清醒地看到气体摩尔体积适用的对象是气体,对非气态物质不适用。
因此,要掌握常见物质的状态,在常见有机物中C≤4的烃、CH3Cl、甲醛为气态,其它一般为非气体。
2,考查气体摩尔体积应用条件气体摩尔体积适用于0℃、1.01×105Pa,而在许多考题中常给出非标准状况如:常温常压;在25℃、1.01×105Pa时等,要注意气体摩尔体积适用的条件。
另外,要明确物质的质量或物质的量与状态无关,因此,这时的判断不涉及22.4L/mol。
“如常温常压下,1 mol 氦气含有的核外电子数为2N A”这句话是正确的。
物质的量与阿伏伽德罗常数..

• 6. (2014· 四川高考· 5)设NA为阿伏伽德罗 常数的值。下列说正确的是 • A.高温下,0.2molFe与足量水蒸气反应, 生成的H2分子数目为0.3NA • B.室温下,1LpH=13的NaOH溶液中,由 水电离的OH-离子数目为0.1NA • C.氢氧燃料电池正极消耗22.4L(标准状 况)气体时,电路中通过的电子数目为NA • D.5NH4NO3=2HNO3+4N2↑+9H2O反应 中,生成28g N2时,转移的电子数目为 3.75NA
题型二、阿伏伽德罗定律及其推论
• 1.在两个密闭容器中,分别充有质量相同的甲、 乙两种气体,若它们的温度和密度均相同,试根 据甲、乙的摩尔质量(M)关系,判断下列说法 正确的是 • A.若M(甲)>M(乙),则气体体积:甲<乙 • B.若M(甲)<M(乙), • 则气体的压强:甲>乙 • C.若M(甲)>M(乙), • 则气体的摩尔体积:甲<乙 • D.若M(甲)<M(乙),则的分子数:甲<乙
• 3)1L1mol.L-的氨水中NH4+数目为1 NA。 • 4)0.1mol的FeCl3配成1L溶液,所得溶液含 有0.1 NAFe3+。 • 5)50g质量分数为46%的乙醇水溶液中, 含氢原子数目为3NA。 • 6)1mol乙烷中含有共价键的数目为6NA。 • 7)某密闭容器中盛有0.1molN2和0.3molH2, 在一定条件下充分反应,转移的电子数目 为0.6NA。
2.在下列条件下,两种气体的分子数一 定相等 的是 A .同密度,同压强的N2和C2H4 B .同温度,同体积的O2和N2 C. 同体积,同密度的C2H6和NO D .同压强,同体积的CO2和C3H8
• 8.(2012广东理综)设nA 为阿伏伽德罗常 数的数值 ,下列说法正确的是 • A .常温下 ,4gCH4 含有nA 个C-H共价键 • B .1 mol Fe 与过量的稀HNO3 反应,转移 2 nA 个电子 • C .1 L 0.1 mol · L- NaHCO3液含有 0.1nA 个HCO3 • D. 常温常压下,22.4L的NO2 和CO2合气 体含有2 nA 个O 原子
高考化学复习专题一:化学计量在实验中的应用总结归纳

精心整理专题一:化学计量在实验中的应用知识点一:物质的量、摩尔质量以及阿伏伽德罗常数(考点,易错点)1.物质的量(n)是表示含有一定数目粒子的集体的物理量。
(注意任何粒子)2.摩尔(mol): 把含有6.02 ×1023个粒子的任何粒子集体计量为1摩尔。
(注意任何粒子)3.阿伏加德罗常数:把6.02 X1023mol-1叫作阿伏加德罗常数。
(注意单位)4.物质的量=物质所含微粒数目/阿伏加德罗常数 n =N/N A5.摩尔质量(M)(1) 定义:单位物质的量的物质所具有的质量叫摩尔质量.(2)单位:g/mol 或 g.mol-1(3)6.物质的量=物质的质量/摩尔质量 ( n = m/M )例1:列说法中正确的是()A.H2的摩尔质量是2 gB.1 mol氧的质量是C.氧气的摩尔质量是32 g·mol-1D.2 g H2含6.02×10变式练习1.标准状况下有①0.112 L水②0.5N A个HCl氦气⑥6.02×10232.含0.4 mol Al2(SO4)3的溶液中,含、“<”或“=”)3.(1)1 mol_______________________个氢原子。
(2)水所含氢原子数相同。
4. 5 K下呈现超导性。
据报道,该晶体的化学式为Na0.35CoO2·12.2 g该晶体中含氧原子数__________,氢原5.用N A()。
A2N AB.28 g2N AC.常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6N AD.常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数为2N A知识点二:气体摩尔体积与阿伏伽德罗定律(考点,重点,易错点)1.气体摩尔体积(Vm)(1)定义:单位物质的量的气体所占的体积叫做气体摩尔体积.(2)单位:L/mol2.物质的量=气体的体积/气体摩尔体积n=V/Vm3.标准状况下, Vm = 22.4 L/mol4. 阿伏加德罗定律:同温同压下,相同的任何气体,含有数目的分子(或气体的物质的量相同)。
2020高三化学第一轮复习第一章:物质的量

必考部分第一章化学中常用的物理量——物质的量第1讲物质的量气体摩尔体积考纲要求:1.了解物质的量(n)及其单位摩尔(mol)的含义。
2.了解摩尔质量(M)、气体摩尔体积(Vm)、物质的量浓度(C)、阿伏伽德罗常数(N A)的含义。
3.能根据微粒(原子、分子、离子等)物质的量、数目、气体体积(标准状况下)之间的相互关系进行相关运算。
考点一物质的量、摩尔质量核心知识1.物质的量、摩尔、阿伏伽德罗常数(1)物质的量:①定义:表示含有一定数目微观粒子的集合体的物理量。
②符号:n,单位:mol(摩尔)补充:七个基本物理量:1971年第十四届国际计量大会确定,它们分别是:长度(m)、时间(s)、质量(kg)、热力学温度(K)、电流(A)、发光强(cd)、物质的量(mol)。
注意事项:1.“物质的量”是一个基本物理量,而不是摩尔,它是一个整体,不能增添或删减,也不能说物质的质量或物质量。
2.“物质的量”仅用于表示微观的粒子,即分子、原子、离子、质子、中子、电子不能表示宏观粒子。
3.“物质的量”是构建微观粒子和宏观物质的桥梁。
4.“摩尔”是物质的量的单位。
正如“米”是长度的单位一样。
5.使用摩尔是必须指明微粒的名称或符号或化学式等具体组合。
如:1mol氢(×) 1molH(√) 1mol氢原子(√)1mol水(√) 1molHO(√) 1mol水分子(√)2(2)摩尔(ρ):①摩尔是物质的量的单位,简称:摩。
符号:mol②数值规定:国际上规定,1mol粒子集合体所含有的粒子数与0.012kgC12中所含的碳原子数相同,约为6.02×1023。
(3)阿伏伽德罗常数:①概念:1mol任何粒子的粒子数。
符号为N,单位为mol-1A②精确值:0.012kg12C中所含的碳原子数。
③近似值:N A≈6.02×1023mol-1④关系式:物质的量与微观粒子的换算关系:n=N/N A注意事项:1.阿伏伽德罗常数在数值上约为:6.02×1023。
化学计量在试验中的应用章节复习

第二节化学计量在实验中的应用第一课时物质的量摩尔质量知识体系:一、物质的量1.物质的量是一个物理量,它表示含有一定数目粒子的集合体,符号是n。
2.物质的量的单位是摩尔,简称摩,符号为mol。
说明:mol和个都是可以用来表示微观粒子数目多少的单位,它们之间的关系,好比是质量单位吨与克。
mol表示的单位很大,那么它与个之间的进率是多少呢?3.阿伏加德罗常数1mol粒子集体所含的粒子数与0.012kg12C中所含的碳原子数目相同,约为6.02×1023。
把1mol 任何粒子的粒子数叫做阿伏伽德罗常数,符号为N A,通常用6.02×1023mol-1表示。
注意:使用摩尔作单位时,应该尽量用元素符号指明粒子种类,否则,概念模糊,意义不清。
例:1 mol H 表示1mol氢原子,而说1 mol 氢则不能确定到底是氢原子还是氢分子。
4.物质的量(n)、阿佛加德罗常数(N A)与粒子数之间(N)的关系:n= ,此公式可变形为N= 。
(1)求0.5molO2中含有的O2的分子数目和氧原子的物质的量和数目各是多少?(2)3.01×1024个硫酸分子的物质的量为。
三.摩尔质量1.单位物质的量的物质所具有的质量叫摩尔质量。
用符号 M表示。
2.物质的摩尔质量与相对分子质量的关系?3.物质的量(n)、物质的质量(m)与物质的摩尔质量(M)之间的关系:n= ,此公式可变形为m= 或。
例:1.1.5molH2SO4的质量是多少?2.24.5gH2SO4物质的量是多少?3.0.01mol某物质的质量为1.08g,此物质的摩尔质量是多少?()小结:÷M(摩尔质量)×N A(阿伏加德罗常数)1、m(质量)n(物质的量)N(微粒数)×M(摩尔质量)÷N A(阿伏加德罗常数)2、粒子的数目比等于其物质的量之比。
3、在摩尔质量相等的情况下,质量与物质的量成正比。
随堂练习:1.下列关于阿伏加德罗常数的说法正确的是()A.阿伏加德罗常数是12g碳中所含的碳原子数B.阿伏加德罗常数就是6.02×1023C.阿伏加德罗常数是指1mol的任何物质的个数D.阿伏加德罗常数的近似值为:6.02×1023mol-12.下列关于摩尔的说法中,正确的是()A.摩尔是表示物质质量的单位B.摩尔是物质的数量单位C.摩尔既是物质的数量单位又是物质的质量单位D.用摩尔表示物质的量时,要用化学式指明粒子种类,而不用该粒子的中文名称3.下列说法正确的是()A.Na的物质的量为23g/molB.每摩尔Na的质量是23g,即Na的摩尔质量为23gC.23gNa的量是1molD.Na的摩尔质量是23g/mol4.0.012kg14C含有的碳原子数()A.等于N A B.小于N A C.大于N A D.无法判断5.下列叙述正确的是()A.6.02×1023个碳-12原子就是阿伏加德罗常数B.1mol氧含6.02×1023个O2分子C.1 mol C2H2中含4mol原子D.0.5molCl2含0.5molCl6.0.5molNa2SO4中含有Na+的数目约为()个A、3.01×1023B、6.02×1023C、0.5D、17.瓦斯中甲烷和氧气的质量比为1:4时极易爆炸,此时甲烷与氧气的体积比是()A、1:4B、1:2C、1:1D、2:18.相同质量的SO2和SO3它们之间的关系是()A.所含质子数之比为4:5 B.氧原子的物质的量之比为3:2 C.氧元素的质量比为5:6 D.硫元素的质量比为5:69.如果2g甲烷含有x个分子,那么22gCO2中所含分子数是()A.x B.4x C.0.5x D.3x 10.1克O2和1克 O3中()A.所含分子数相同B.所含电子数相同C.1克O2所含原子数相同D.1克 O3所含分子数较多11.0.5molNa2SO4含有 mol Na+, mol SO42-,约含个O。
物质的量及其阿伏伽德罗常数

物质的量及其阿伏伽德罗常数考点过关一、物质的量:1﹑物质的量(n):表示物质含指定粒子多少的物理量注:只能用于微观粒子单位:摩尔(mol),简称为摩规定0.012 kg12C中所含碳原子数为1mol阿伏加德罗常数:任意1 mol 粒子所含的微粒数N A =6.02×1023mol-1粒子数、物质的量、阿伏伽德罗常数之间计算公式:n=N/ N A2﹑摩尔质量(M):单位物质的量的物质所具有的质量单位:g/mol 或Kg﹒mol-1计算公式:M=m/n二、阿伏伽德罗常数(一)阿伏加德罗定律(1)在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子(2)注意:①使用范围:气体;②使用条件:同温、同压、同体积;③特例:气体摩尔体积(3)阿伏加德罗推论:用n表示物质的量,V表示体积,P表示压强,M表示摩尔质量(式量),ρ表示密度。
(注意语言表达)(理想气体方程:PV=nRT)①T、P相同:V1/V2 = n1/n2 = N1/N2②T、V相同:P1/P2 = n1/n2 = N1/N2③T、P相同:ρ1/ρ2 = M1/M2m m P R T P R TM M ρρ=⇒=④T、P、m相同:V1/V2 = M2/M1 (mPV RTM=)⑤T、V、m相同:P1/P2 = M2/M1三﹑气体摩尔体积1﹑物质体积大小取决于:物质的量、微粒的大小、微粒的距离气体体积大小的决定因素:物质的量、微粒的距离固体、液体体积大小的决定因素:物质的量、微粒的大小2﹑气体摩尔体积(V m):单位物质的量的气体所占的体积单位:L/mol 或L·mol-1标况下V m=22.4 L·mol-1, 常温常压下V m=24.8L·mol-1计算公式:V m=V/n3﹑等温等压下,物质的量相等的气体它们的体积相等4﹑混合气体的平均摩尔质量:M=m(总)/n(总)四﹑物质的量浓度1.概念:以单位体积溶液里所含溶质的物质的量来表示溶液浓度的物理量。
高中化学必修一 第一章第二节 物质的量(第一课时)教学设计

物质的量(第一课时)教学设计一、教学内容分析(一)课程标准要求本节课的内容标准,认识摩尔是物质的量的单位,能用于进行简单的化学计算,体会定量研究的方法对研究和学习化学的重要作用。
学习要求上看,要求认识物质的量是描述微观粒子集体的一个物理量,摩尔是物质的量的单位,了解阿伏伽德罗常数的含义。
(二)教材内容本节课选自新课标人教版教材高中化学必修一第一章《从实验学化学》第二节《化学计量在实验中的应用》的第一课时。
物质的量是化学中的常用物理量,由它可导出摩尔质量、气体摩尔体积、物质的量浓度等物理量,本节课内容属于工具性概念,这些物理量不但贯穿于整个高中化学阶段,今后几乎每节课都会用到,在化学计算中处于核心地位,而且被广泛应用于工农业生产和科学研究中。
因此,物质的量概念的教学历来被认为是教学的重点和难点,具有非常重要的作用。
(三)教学内容与学习水平根据课程标准要求和教材内容确定本节的教学内容及学习水平如下:二、学情分析本节课的学习对象是高一新生,学生的水平参差不齐,对高中自主学习方法的应用、抽象思维能力的形成有很大欠缺。
在本节课的概念学习中,引导学生由已知到未知逐步深入,自主学习,使不同的学生都能享受到学习的快乐、探索新知的喜悦,建构自己对知识的理解。
三、教学目标1、知识与技能⑴了解物质的量的含义及其单位摩尔。
⑵了解阿伏伽德罗常数的含义。
⑶初步学会物质的量与微观粒子数间的相互转化。
2、过程与方法通过教学的问题性、创设情景、增强学生主动求知的精神,培养学生演绎推理,归纳推理的能力。
在思考,讨论和交流中提高独立思考的能力及养成与人合作的团队精神。
3、情感态度与价值观通过概念的引入、推导及应用,培养学生相信科学、尊重科学、依靠科学的思想。
四、教学重、难点重点: ⑴物质的量的单位及其概念。
⑵物质的量与微粒个数间的相互转化。
难点:物质的量概念的理解五、教学方法讲练结合法、讨论法、类比迁移法六、教学过程七、板书设计一、物质的量1、概念:表示含有一定数目粒子的集合体。
鲁科版化学必修一物质的量、摩尔质量

【思考】
1molC-12的质量0.012kg, 那么1mol其他物质的质量又是多 少呢?
物质的量(第二课时)
----物质的量与摩尔质量
1mol物质的质量到底有多大?
粒子符号
物质的相 1摩尔物质的 对原(分) 粒子数(个) 子质量
1摩尔物质质量(g)
C Fe H2SO4 H2O Na+
OH-
12 56 98 18 23 17
_______ 1:1
两种物质的微粒数之比 == 物质的量之比
(与物质的状态无关)
本课总结
物质的量
1、表示一定数目微粒的集体的物理量 2、专有名词,不能随意拆开 3、对象为微观粒子及其特定组合 1、是基本物理量“物质的量”的单位 2、量度对象是具体微观粒子及其特定组合 3、使用时用化学式指明粒子的种类 1、准确值:12g12C所含原子数 近似值: 6.02 1023 n1 N1 2、 n= N = NA n2 N2
[习题一]
在0.5molO2中含有的氧分子数目是多少?
解:O2的分子数为 N = n × NA
=0.5 mol× 6.02 ×1023mol-1
= 3.01 × 1023
答:O2的分子数为3.01 × 1023个.
[习题二]
在0.5molO2中含有的氧原子数目是多少? 解:O2的氧原子数为 N = n ×2 × NA =0.5 mol×2× 6.02 ×1023mol-1
NA的基准值为:12克12C所含的原子数目(定义时用) 近似值为:6.02 1023mol-1(计算时用)
判断下列说法是否正确
1mol苹果 不对,不能指宏观 物质
不对,不能指 1mol花粉颗粒 宏观物质
第三节 第1课时 物质的量 摩尔质量

第三节物质的量第1课时物质的量摩尔质量导学案1、了解物质的量的单位——摩尔。
2、通过对比、类比、归纳等多种思维活动,了解物质的量、摩尔质量的含义,体会从物质的量层次定量研究化学问题的意义。
3、能基于物质的量认识物质组成及其化学变化,利用物质的量和摩尔质量之间的关系进行简单计算,知道从定量的角度认识宏观物质和微观粒子的相互关系是研究化学问题的科学方法之一。
1、物质的量的概念;建构以物质的量为中心的转化关系,感受宏观与微观相结合的思想。
2、物质的质量与物质的量之间转化关系的建构。
一、物质的量的单位——摩尔1.物质的量(1)物质的量是表示含有一定数目粒子的集合体的物理量,用符号n表示。
(2)物质的量的单位——摩尔①符号:mol②标准:1mol粒子集合体所含的粒子数为6.02×1023。
③计量对象:原子、分子、离子、原子团、电子、质子、中子等所有微观粒子。
(3)书写方法及含义表述微观粒子的物质的量时,必须指明微观粒子的种类:如1 mol H指1 mol氢原子,1 mol H2指1 mol 氢分子。
2.阿伏加德罗常数①定义:1mol任何粒子的粒子数叫做阿伏伽德罗常数。
②符号:N A③数值即单位:约为6.02×1023mol-1。
3.物质的量、阿伏加德罗常数与粒子数之间的关系(1)关系式:n=NN A。
(2)结论:微粒之间的物质的量之比等于微粒的粒子数之比。
二、摩尔质量1.摩尔质量①概念:单位物质的量的物质所具有的质量。
②符号、单位:符号:M ;单位:g/mol (或g ·mol -1)③数值:以g/mol 为单位时,数值与该粒子的相对分子质量或相对原子质量相等。
2.物质的量、质量和摩尔质量之间的关系:n =mM。
3.以物质的量(n )为桥梁联系宏观物质质量(m )与微观微粒数(N )之间的关系:m M =n =NN A 。
总结:(1)摩尔质量概念的理解 ①等值性:摩尔质量以g·mol-1作单位时,在数值上与其相对分子质量或相对原子质量相等。
高一化学,物质的量的单位-摩尔,阿伏伽德罗常数

物质的量的单位—摩尔1.物质的量的定义:表示含有一定数目粒子的集合体,符号为n,单位为mol。
(1)衡量标准:1 mol粒子集合体所含的粒子数与0.012 kg 12C中所含的碳原子数相同,约为6.02×1023。
称为阿伏加德罗常数,用N A表示,通常表示为6.02×1023 mol-1。
(2)计量对象:原子、分子、离子、原子团、电子、质子、中子等所有微观粒子(填“微观”或“宏观”)。
(3)计算关系:n=NN A(N为微粒数)。
注意:a.阿伏加德罗常数N A是一个物理量,有单位(mol-1)。
近似量为6.02×1023 mol-1。
b.物质的量是国际单位制(SI)七个基本物理量之一,摩尔是对应的国际单位制七个基本单位之一。
七个基本物理量—“时光物质温电长”-摩尔(mol) 质量-千克(kg)热力学温度-开尔文(K) 电流-安培(A) 长度-米(m)2.摩尔质量的概念:单位物质的量的物质所具有的质量,符号为M,常用的单位为g·mol-1。
(1)以g·mol-1为单位时,其数值与该粒子的相对分子质量或相对原子质量相等。
注意:摩尔质量有单位(g·mol-1),相对原子质量或相对分子质量无单位。
(2)关系:n=mM(m为物质的质量)。
(3)摩尔质量与物质的质量的区别:a.概念不同:摩尔质量是指单位物质的量的物质所具有的质量,而质量是指物体所含物质多少的物理量。
b.单位不同:摩尔质量的单位是g·mol-1,而物质的质量的单位是g或kg。
3.物质的量、物质的质量、粒子数目之间的计算:通过计算,准确理解“阿伏加德罗常数”把微观物理量和宏观物理量联系起来的“桥梁”作用。
4.高中化学计算主要是以物质的量为中心的计算,学习时要养成把“其他物理量转化为物质的量”这一思维模式。
如已知物质的质量求其粒子数,首先根据摩尔质量求出其物质的量,然后根据阿伏加德罗常数转化为粒子数。
2022年高三一轮复习化学教案第1章化学计量在实验中的应用

2022年高三一轮复习化学教案第1章化学计量在实验中的应用第一课时物质的量与阿伏伽德罗常的应用复习目标:1、把握物质的量、摩尔质量、阿伏伽德罗常等概念。
2、把握以物质的量为中心,相互之间的转化关系。
3、能够把握考查N A题型的解答方法及技巧。
基础知识:一、物质的量(1)物质的量是七个差不多物理量之一,其意义是表示含有一定量数目的粒子的集体。
符号为:n ,单位为:摩尔(mol)。
〖说明〗物质的量是用来描述微观粒子,如分子、原子、离子、电子、质子、中子等。
在描述的时候应该标明微观粒子的特定组合。
如1molH,或1mol氢原子。
(2)物质的量的基准(N A):以0.012kg12C所含的碳原子数即阿伏加德罗常数作为物质的量的基准。
阿伏加德罗常数能够表示为N A,其近似值为6.02×1023 mol-1二、摩尔质量(M)摩尔质量是单位物质的量的物质所具有的质量,单位是g/mol 。
假如g/mol作为单位,其数字上等于相对原子(分子)质量或式量。
三、物质的量为中心的转化关系【解题指导】阿佛加德罗常数考点命题陷阱归类分析阿佛加德罗常数(用N A表示)涉及的知识面广,灵活性强,是高考的热点之一,要紧以选择题的形式(选择正确的或错误的)进行考查。
分析近几年的高考试题,此类题型常以选择题形式显现,容易引起学生错误的有以下几点:1、温度和压强:22.4L/mol是在标准状况(0 ℃,1.01×105Pa)下的气体摩尔体积。
命题者有意在题目中设置非标准状况下的气体体积,让考生与22.4L/mol进行转换,从而误入陷阱。
2、物质状态:22.4L/mol使用的对象是气体(包括混合气体)。
命题者常把一些容易忽视的液态或固态物质作为气体来命题,让考生落入陷阱。
如SO3:常温下是固态;水:常温下是液态。
戊烷,辛烷常温下是液态等。
3、物质变化:一些物质间的变化具有一定的隐藏性,有时需要借助方程式分析才能挖掘出隐含的变化情形。
1.2.1《物质的量 摩尔质量》教学设计(含解析)-人教版高中化学必修一

【板书】5.n=N/NA
【讲解】摩尔是一个巨大数量粒子的集合体,可以是整数,也可以是小数,如可以有0.5 mol O2、0.01 mol H2SO4等。但分子、原子等具体的粒子,只能是整数,而不能是0.5个或0.01个。
下面,请大家做以下练习:
【思考1】1. 0.5 mol水中含有个水分子。
【交流】3.01×1023
【思考2】2 mol水中含有个水分子,个氢原子。
【交流】1.204×10242.408×1024
【思考3】1 mol H2SO4溶于水,水中存在的溶质粒子是什么?它们的物质的量各是多少?
【交流】氢离子、2 mol;硫酸根离子、1 mol。
【思考】怎样表示n、m、M三者之间的关系?
【交流并板书】2.m=nMn=m/M。
【讲解】Mg的摩尔质量为24g/mol,水的摩尔质量为18g/mol,KCl的摩尔质量为74.5g/mol,CO 的摩尔质量为60g/mol。
【典例1】下列表示错误的是()
A.1 mol H2B.1 mol Fe
C.1 mol NH D.1 mol小米
【答案】D
【解析】物质的量不适用于表示宏观物质。
【典例2】比较1 mol氧气和1 mol一氧化碳,下列说法正确的是()
A.质量相同B.分子总数相同
C.原子总数不同D.氧原子总数相同
【答案】B
【解析】氧气和一氧化碳的物质的量相同时:它们含有的分子总数相同;二者都是双原子分子,它们含有的原子总数也相同,但含有的氧原子总数不相同;二者的摩尔质量不同,它们的质量不相同。
【典例3】下列说法中错误的是()
物质的量 阿伏伽德罗常数

物质的量阿伏伽德罗定律都是双原子分子和氨的化学式的主要依据是( )①阿伏加德罗定律;②质量守恒定律;③原子或分子数只能为整数;④化合价规则A. ①③B. ①②③C. ①②④D. ①②③④10.将空气与CO2按5:1体积比混合,跟足量的赤热的焦炭充分反应,若反应前后温度相同,则在所得气体中,CO的体积百分含量为(假设空气中氮、氧体积比为4:1,其它成分可忽略不计) ( )A. 29%B. 43%C. 50%D. 100%11.在一密闭容器中盛有H2、O2、Cl2组成的混合气体,通过电火花引爆后,三种气体恰好完全反应。
经充分反应后,测得所得溶液的质量分数为33.4%,则原混合气中三种气体的体积比是________。
12.已知A、B两种气体在一定条件下可发生反应:2A+B==C+3D+4E。
现将相对分子质量为M的A气体m g和足量B气体充入一密闭容器中恰好完全反应后,有少量液滴生成;在相同温度下测得反应前后压强分别为6.06×105Pa 和1.01×105Pa,又测得反应共放出Q kJ热量。
试根据上述实验数据写出该反应的热化学方程式。
________________________________________________________________13.化合物A 是一种不稳定的物质,它的分子组成可用O x F y表示。
10mLA气体能分解生成15mLO2和10mLF2(同温同压)。
⑴A的化学式是___________,推断理由是____________________________________________________________________________________。
⑵已知A分子中x个氧原子呈…O—O—O…链状排列,则A分子的电子式是______________,A分子的结构式是______________。
14.A、B两种金属元素的相对原子质量之比是8:9。
物质的量

物质的量知识点和题型分析一、物质的量、摩尔质量、阿伏伽德罗常数定义1、下列说法正确的是A.摩尔是国际七个基本物理量之一B、12g碳所含的原子数就是阿伏加德罗常数,阿伏加德罗常数没有单位C.“物质的量”指物质的质量D.摩尔是表示物质的量的单位,每摩尔物质含有阿伏加德罗常数个微粒2.下列说法正确的是A.1 molH2的质量是1 gB.1 mol HCl的质量是36.5 g·mol-1C.Cl2摩尔质量等于它的相对分子质量D.硫酸根离子摩尔质量是96 g·mol-13.下列说法错误的是A.1 mol 氢B.1 mol OC.1 mol 二氧化碳D.1 mol水二、物质的量的计算粒子的物质的量===物质的物质的量*角标(部分=整体*角标)填空题(1)、等物质的量的SO2与SO3分子数之比,氧原子数之比,质量之比,原子数目之比;等质量的SO2与SO3的物质的量之比,分子数之比,氧原子的物质的量之比,氧原子数之比,硫原子的物质的量之比,硫原子的质量之比,原子数目之比。
(2)、已知40.5 g某金属氯化物MCl2含0.6 mol Cl-,该氯化物的摩尔质量,该金属M相对原子质量。
(3)、将4gNaOH固体溶于克水中,才能使每49个水分子中溶有1个Na+。
选择题1、在一定质量的碳酸钠中,碳原子和氧原子的物质的量之比是A.1:1B.1:3C.3:1D.2:32、下列物质中,与0.3moLH2O含相同氢原子数的物质是A.0.3moLHNO3B.3.612×1023个HNO3分子C.0.1moLH3PO4D.0.2moLCH43、比较1molN2和1molCO的下列物理量:①分子的物质的量②原子的物质的量③质量④电子数⑤质子数,其中相同的是A.①②③B. ①②③⑤C.①②③④⑤D. ①④⑤4、相同质量的下列气体中,所含原子数最多的是A.CH4B.N2C.COD.O25、2.16g X2O5中含有0.1mol 氧原子,则X的相对原子质量为A.21.6B.28C.14D.31三、阿伏伽德罗常数1、铅笔芯的主要成分是石墨和黏土,这些物质按照不同的比例加以混和、压制,就可以制成铅笔芯。
人教版高中化学必修1第一章《物质的量 摩尔质量》教案

第一章从实验学化学第二节化学计量在实验中的应用第1课时物质的量摩尔质量三维目标1. 理解影响固体、液体、气体体积的大小主要因素。
2. 理解气体摩尔体积的概念,初步学会运用气体摩尔体积等概念进行简单计算。
3. 掌握阿伏加德罗定律及其推论。
教学重点物质的量及其单位摩尔。
教学难点物质的量及其单位摩尔。
教学过程【课程引入】大家都知道曹冲称象的故事,那么,曹冲称象的主要思想是什么呢?将巨大的不可直接称重的大象“分解”成一块块可以称重的石头。
这个故事给我们的启示就是化整为零。
日常生活中,买大米时我们一般论斤买而论“粒”就不方便,一斤就是许多“粒”的集体;买矿泉水我们可以论瓶买,但买多的也可以论箱买,一箱就是24瓶的集体等等。
一滴水中就大约含有1.7万亿亿个水分子,如果一个个去数,即使分秒不停,一个人穷其一生也无法完成这个工作。
那我们怎样才能既科学又方便地知道一定量水中含有多少个水分子呢?所以,这里需要一个“桥梁”,需要一个物理量把宏观质量和微观粒子数联系起来,这个物理量就是“物质的量”。
第14届国际计量大会通过以“物质的量”作为化学计量的基本单位量,至此,物质的量和长度、质量、时间等成为国际单位制中的7个基本单位。
【板书】一、 物质的量是一个物理量,表示含有一定数目粒子的集合体。
了解物质的量要注意以下几个问题: 1. 是七个国际基本物理量之一。
2. 是一个专有名词,由固定字数组成,不能分割、不能增减。
3. 符号为“n ”。
4. 微粒是指:分子、原子、离子、电子、质子、原子团、中子等。
5. 粒子必须十分明确,且用化学式表示。
【讲述】每种物理量都有相应的单位。
速率的单位是“米/秒”,“物质的质量”的单位是“千克”等。
“物质的量”作为一种物理量也应有相应的单位,它的单位是什么? 科学上用“摩尔”作为“物质的量”的单位。
1摩尔是多少?在国际上摩尔这个单位是以0.012 kg 12C 中所含的原子数目为标准的,即1 mol 粒子集体所含的粒子数与0.012 kg 12C 中所含的原子数相同,约为6.02 × 1023个。
摩尔质量与阿伏伽德罗常数的公式

物质的量=粒子数/阿伏伽德罗常数:n=N/NA物质的量=物质的质量/摩尔质量:n=m/M物质的量=气体的体积/气体摩尔体积:n=V/Vₘ所以,N/NA=m/M=V/Vₘ=n。
物质的量——n,物质的质量——m。
摩尔质量——M,粒子数(微粒的个数)——N。
阿伏伽德罗常数——NA,气体的体积——V。
气体摩尔体积——Vₘ——L/mol——22.4L/mol。
扩展资料:一、阿伏加德罗常数NA原以0.012kgC-1所含的碳原子数作基准,其原近似值为6.0221367×10²³mol⁻¹。
1mol的任何物质所含有的该物质的微粒数叫阿伏伽德罗常数,精确值为NA=6.02214076×10²³,单位为1/mol。
1、1mol任何微粒的粒子数为阿伏伽德罗常数,其不因温度压强等条件的改变而改变。
2、应用阿伏伽德罗定律及理论时要满足:物质在所给温度及压强下为气体。
2018年11月16日,国际计量大会通过决议,1摩尔被定义为“精确包含6.02214076×10^23个原子或分子等基本单元的系统的物质的量”。
与此同时修改了阿伏伽德罗常数为6.02214076×10^23。
二、与粒子数的关系n=N/NA,满足上述关系的粒子是构成物质的基本粒子(如分子、原子、离子、质子、中子、电子)或它们的特定组合.如:1molCaCl₂与阿伏加德罗常数相等的粒子是CaCl₂粒子,其中Ca²⁺为1mol、Cl⁻为2mol,阴阳离子之和为3mol或原子数为3mol.在使用摩尔表示物质的量时,应该用化学式指明粒子的种类,而不使用该粒子的中文名称。
例如说“1mol氧”,是指1mol氧原子,还是指1mol氧分子,含义就不明确。
又如说“1mol碳原子”,是指1molC-12,还是指1molC-13,含义也不明确。
粒子集体中可以是原子、分子,也可以是离子、质子、中子、电子等。
物质的量四个基本公式

物质的量四个基本公式一、摩尔质量=物质的量÷阿伏加德罗常数,即: m=c÷阿伏加德罗常数(c=6.96×10-23)。
阿伏加德罗常数值是一个与物质的组成和状态有关的重要物理量,它不是个固定的值,是随着物质的组成和状态而变化的。
摩尔质量的单位是“摩”(符号是mol)。
从分子的角度来看,摩尔质量就是某种物质的所有分子集合在一起的一个数目。
根据阿伏加德罗定律:在标准状况下,气体摩尔体积与气体摩尔质量成反比。
在化学反应前后分子数目保持不变时,气体摩尔体积与反应物的总体积成正比,这也可以叫作等压方程式。
二、阿伏加德罗常数,也叫阿伏伽德罗常数,其数值等于6.636×10-23克·摩尔-----此常数值的测定对研究物质的性质和用途具有很重要的意义。
三、相对分子质量=M ×M/M×Kg=m×m/m×M×6.67×10-23(即, 1摩尔物质的质量等于该物质的相对分子质量乘以阿伏加德罗常数)摩尔质量=物质的量÷阿伏加德罗常数,即: m=c÷阿伏加德罗常数(c=6.96×10-23)。
阿伏加德罗常数值是一个与物质的组成和状态有关的重要物理量,它不是个固定的值,是随着物质的组成和状态而变化的。
如果我们已知气体摩尔体积、气体摩尔质量及阿伏加德罗常数,可根据标准状况下气体的体积和质量计算出标准状况下该气体的摩尔质量。
即: V=mV/m=MV/M。
气体摩尔体积是气体分子间距的一种度量。
若在标准状况下,某气体分子间距为10-9m,则其摩尔体积约为1000mL。
四、气体摩尔体积=(4pi)(p/n)v=(4pi)(p/n)ln(1/p)。
是在标准状况下(0 ℃, T)气体的体积,单位是升(L),它的物理意义是该温度下气体的体积,也就是在该温度下的压强为一个标准大气压时的气体体积。
v的数值等于每摩尔气体所占的体积,是一个无量纲量,它不随气体的状态和温度而改变。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.15g 这些 OH- 和___________ (质量)Na+含有的离子数相同。
5、将4g NaOH溶于多少克水中,才能使每100个H2O分子 溶有一个Na+? 解:n(Na+)= n(NaOH)=
m(NaOH) M(NaOH)
= 4g÷40g/mol = 0.1 mol n(H2O)= 100× n(Na+)= 100 × 0.1mol = 10mol m(H2O)= n(H2O)× M(H2O)
如果把 6.02×1023 粒米给全球60亿人吃, 每人每天吃一斤,要吃14万年,所以物质的量只 用来表示原子、分子、离子等微观粒子。
物质的量与粒子数的关系
n(物质的量) 1mol H
2mol H
……
N(粒子总数)
NA个H 2× NA个H n× NA个H
……
n mol H
N=n×NA
物质的量 (单位:mol)
两个变式(1单位:个)
n =
N NA
n
一个推论: N1 n1 —— = ——
阿伏加德罗常数
N2
n2
(单位:mol-1)
练 习:
1.下列说法中正确的是 D A、阿佛加德罗常数为6.02×1023 B、“1mol氧”约含有6.02×1023个氧原子 C、摩尔是表示物质的质量的单位 D、12克12C含有的碳原子数就是阿佛加德罗常数
阿伏加德罗常数:12克12C中含有的碳原子数,符号为NA 。
意 大 利 物 理 学 家 是 一 近似值: 6.02×1023mol-1 个 衡 量 标 准 定义摩尔时用阿伏加德罗常数来表达,在具 体计算则常用6.02×1023mol-1 是 一 个 数 值
感受阿伏加德罗常数
如果把6.02×1023个直径为2.5cm的硬币排 成一行,可以来回于地球与太阳之间240.8亿次
国际单位制(SI)的7个基本单位
物理量
长度 质量
单位名称
米 千克 秒 安培 开尔文 摩尔 坎德拉
单位符号
m Kg
时间
电流 热力学温度 物质的量 发光强度
S
A
K
mol
cd
0.012kg C-12
微观构成
[思考] 已知:一个碳原子的质量约为 1.993 × 10-23kg 求: 0.012kg 碳-12 中所含的碳原子数? 解: 碳原子数=
12C的质量
一个碳原子的质量
0.012kg 1.993 × 10-23kg
=阿伏加德罗常数
≈
≈6.02×1023
B、阿伏加德罗常数 规定: 每摩尔物质含有阿伏加德罗常数个微粒。
关于物质的量的关系式
N = n= m NA M mol
与 微 粒 总 数 的 关 系 与 质 量 的 关 系
g g/mol
辨析
单位 相对原子质量 相对分子质量 数值
1
1mol物质的质量 摩尔质量
g
相 同
g / mol
练习
1、24.5克硫酸的物质的量是 0.25 mol; 2、1.5mol 硫酸的质量是 147 克,其中含有 量是 mol O ,其质
D 8、 1gH2O中含有a个H2O,则阿伏加德罗常数可表示为( ) mol-1 A. 1/9a 108 g· -1 mol 10、若3.2gXO2中含有0.1mol的氧原子,则X的相对原子质量为 32 B. 9a C. 2a D. 18a
9、0.01mol某物质的质量为1.08g,此物质的摩尔质量为
“物质的量”理解注意事项:
1、“物质的量”是一个基本物理量,四个字是一个整体, 不能拆开理解,也不能理解为“物质的质量”或“物质的数量”。 2、“物质的量”的国际基本单位是“摩尔”,如同长度 的单位是米,质量的单位是千克一样。
3、“物质的量”的单位除mol为,还有Kmol和mmol。 1Kmol=1000mol;1mol=1000mmol。 4、“物质的量”这个物理量只适用于微观粒子,所指粒 子必须十分明确(原子、分子、离子、原子团、电子、质子、中 子等),且粒子的种类要用化学式表示。如:1molH表示1mol 的氢原子而不是1mol 的氢元素。
2、1 mol C中约含有 6.02 × 1023 个碳原子
1.806 × × 1023个硫酸分子 1023 3、0.3 mol H2SO4含有0.3× 6.02
4、 1.204 × 1024个H2O2分子的物质的量为 2 mol 。
2 1 5、1 mol Na2CO3中约含有___molNa+、___molCO321.806 ×× 1023 1024 离子,共含有离子的个数为______________个。 3×6.02
6
96
克;
3、71克Na2SO4中含Na+ 1 mol, NA 个.
0.85g 4、 3.01×1022个OH- 的物质的量为0.05mol,质量为_______, 含有质子的物质的量为___________ , 0.45mol 含有电子的物质的量为___________ , 0.5mol 0.05mol 这些 OH- 与___________ (物质的量)NH3的质量相同,
S
A
K
mol
cd
了解国际基本单位
米(长度):
国际单位制的长度单位“米”(meter,metre)起源于法国。1790年 5月由法国科学家组成的特别委员会,建议以通过巴黎的地球子 午线全长的四千万分之一作为长度单位──米,1791年获法国国 会批准。
千克(质量)
最初的定义和长度单位有关;1791年规定:1立方分米的纯水在 4℃时的质量 ,并用铂铱合金制成原器,保存在巴黎,后称国际 千克原器。
物质的量:表示的一定数目的粒子的集合体,那么 “一定数目”是多少呢?
摩尔的标准:
国际上规定,以0.012kg 12C中所含的原子数目为标 准
粒子集体中所含有的粒子数与0.012kg 12C中所含的碳 原子数目相同,则它的物质的量为1mol
阿伏加德罗常数——1mol物质所含有的微粒数目 0.012kg 12C中所含的原子数目、即1mol 12C的数目 约为6.02×1023 的是多少呢?
一、物质的量及其单位 A、物质的量(n) 物质的量是一个物理量,它表示含有一定数目粒子的集 合体,符号为n。 是国际单位制七个基本物理量之一,表示物质所含粒子 数目的多少。 其单位为摩尔,简称摩,符号为mol
有关摩尔的趣闻 有三个人,一个是动物学家,一个是土木工程师,一个是化学 家,怎样迅速将其中的化学家鉴别出来呢? 科普作家阿西莫夫想出了一个方法,问他们“mole”是什么?
1mol几种物质的质量 1mol 物质的质量(g)在数值上等于其相对原子(分子)质量
C、摩尔质量(M)
概念:单位物质的量的物质所具有的质量。摩尔质量的符 号是M,常用的单位是g/mol(g· -1)。 mol
1 mol(阿伏加德罗常数)的任何粒子或物质,当质量以克 为单位时,在数值上都与该粒子的相对原子质量或相对分子质 量相等。 质量(g) 定义式: 摩尔质量(g/mol)= 物质的量(mol)
6.练习:判断下列说法是否正确? (×) (1)1molH2O中含有NA个氢原子。
(×) (2)1molH2O中含有1molH2和1molO。
(×) (3)1molH2O中含有阿佛加德罗常数个原子。 (√) (4)1molH2O中约含有6.02×1023个水分子。 (5)1molH2O中含的氧原子数与1molCO2中含的氧原子数 (×) 中相同。
质量
0.012 kg=12 g
16 g
试计算1mol下列物质的质量为多少? H2O、H2、Mg、CO32已知水分子的质量约为2.99×10-23g,氢分子的质量约为 0.33×10-23g,镁原子的质量约为3.99×10-23g,碳酸根离子的质量 约为9.97×10-23g m(H2O)=18g m(H2)=2g m(Mg)=24g m(CO32-)= 60g 有何规律?
练习: 判断下列表示方法是否正确? (1)1mol氧 (2)1mol氯化钠
(3)1molH2SO4 (4)1mol甲烷
(5)1molNO3-
(6)1mol苹果
答案:(3)(5)
国际单位制(SI)的7个基本单位
物理量
长度 质量
单位名称
米 千克 秒 安培 开尔文 摩尔 坎德拉
单位符号
m Kg
时间
电流 热力学温度 物质的量 发光强度
第一章 从实验学化学
第二节 化学计量在实验中的应用
黎 江
NaCl
Fe
CO2
你知道吗?
15万亿亿个
一滴水中所含的水分子数,让10亿人去数,每人 每分钟数100个,日夜不停的数,需要3万年才能数完。
个体数量大时,人们习惯以集体为单位统计个体数量微 观粒子的数量很大,我们将以集体为单位对其进行计算 摩尔 (单位) 物质的量 (物理量)
7、下面有关摩尔的说法不正确的是 B D A、摩尔是国际单位制的一种基本单位 B、摩尔是表示物质微粒数量的单位 C、摩尔是以阿伏加德罗常数为衡量标准的物质的量 的单位 D、摩尔是表示物质质量的单位。
一个C原子 微观粒子: m: 1.99×10-23
一个O原子 2.66×10-23
扩大6.02×1023倍 1 mol C 原子 1 mol O 原子
= 10mol × 18g/mol = 180g
6、Cl2 HCl O2 H2 CO2各5g,按其所含分子数目由多到少 的顺序排列是: H2 O2 HCl CO2 Cl2
7、下列各物质中,含氧原子个数最多的是( A ) A. 1molKClO3 C. 32gO2 B. 0.5molH2SO4 D. 3.01×1023个CO2
